физические и человеческие факторы воздействия
В процессе эксплуатации аккумуляторные батареи подвергаются воздействию различных факторов: механических, температурных, химических и электрохимических. В результате их воздействия возникают неисправности, которые или снижают электрические характеристики аккумуляторов, или преждевременно выводят их из строя. В большинстве случаев неисправности являются результатом небрежного или неправильного ухода и обслуживания аккумуляторных батарей при их эксплуатации. При этом признаки неисправности аккумуляторных батарей обширны и разные, поэтому определить настоящую причину выхода из строя порой очень сложно.
Одной из главных причин естественного выхода из строя – полная выработка ресурса аккумулятора. Причиной этому является физика электрохимического процесса заряда и разряда. Накапливая и отдавая накопленную энергию, пластины с нанесенной на них активной массой расширяются и сжимаются, что приводит к разрушению их структуры. Активная масса начинает опадать от электродов и скапливаться на дне корпуса, что впоследствии может привести к замыканию пластин еще до того, как они полностью оголятся и перестанут накапливать энергию.
Для продления срока службы аккумуляторов производители подвешивают пластины, оставляя пространство до дна корпуса, чтобы осыпающийся шлам не замыкал электроды, а также используют специальные конверты-сепараторы, которые представляют собой пористую структуру, легко пропускающие электролит, но при этом предотвращающие замыкание.
Кроме того, тут присутствует и естественный процесс коррозии положительного электрода, который растет с «возрастом» батареи. Это – плотный слой двуокиси свинца на поверхности решетки, который не работает как активный материал. Коррозия протекает на поверхности электрода, медленно проникает внутрь, оказывает растягивающее воздействие и ухудшает проводимость решетки электрода. Более того, она воздействует и на положительный вывод аккумулятора: деформированный и увеличенный положительный электрод придает усилие соединительному мосту, а тот, в свою очередь, выдавливает положительный выводной борн аккумулятора.
К сожалению, коррозия идет постоянно (и при работе, и при хранении), ее нельзя предотвратить, она необратима. Скорость коррозии можно только минимизировать за счет правильной эксплуатации аккумуляторов.
Скорость коррозии можно только минимизировать за счет правильной эксплуатации аккумуляторов.
Если рассматривать человеческий фактор, то основная причина – это неконтролируемый глубокий разряд. Влияние глубокого разряда на состояние пластин очень велико, а отследить его наступление достаточно сложно.
Почему глубина разряда так важна? При разряде ионы серной кислоты из электролита входят в электроды – они расширяются: твердый кристалл неорганического вещества, будто губка, расширяется в пространстве, при этом, чем больше вошло серной кислоты в электроды, тем больше их структурное расширение, а значит, тем больше растрескивание и потеря физического контакта у частичек электрода. Именно поэтому заводы- производители указывают в разрядных таблицах на каждый тип аккумуляторной батареи допустимый ток нагрузки, временные интервалы нагрузки для этого тока и конечное напряжение разряда, а при циклическом режиме эксплуатации – количество циклов заряда/разряда при допустимой глубине разряда.
Второй весьма важной причиной выхода из строя аккумулятора из-за человеческого фактора является несвоевременное или полное игнорирование интервалов заливки дистиллированной воды в обслуживаемые заливные аккумуляторы. Это часто бывает, если периодически не отслеживать уровень электролита в элементах. Для этого производители в заливных аккумуляторах используют прозрачный корпус (обычно из пластика SAN – стирол-акрило-нитрил) с метками максимального и минимального уровня электролита.
При низком уровне электролита сначала высыхает верхняя часть пластин, она попросту выходит из контакта с электролитом, перестаёт отдавать ёмкость и, конечно же, сульфатируется остатком серной кислоты на поверхности пластин. Далее, в процессе заряда, дистиллированная вода постепенно выпаривается, а уровень электролита снижается, пока электролит не превратится в высококонцентрированную серную кислоту, и тут уже коррозия и глубокие разряды «добьют» аккумулятор.
Третья весьма популярная причина, влияющая на преждевременный выход из строя аккумулятора – это перезаряд. Обычно он возникает в двух случаях: первый – когда аккумулятор осознанно ставят после заряда еще раз на заряд; второй – если аккумулятор старый, внутреннее сопротивление у него уменьшилось, и автоматическая зарядное устройство будет отключаться позже, чем планировалось.
Если в эксплуатации обслуживаемый аккумулятор, то это грозит более частыми операциями по заливу дистиллированной воды и более скорому выходу аккумулятора из строя из-за повышения коррозии электродов у горячего аккумулятора. А если это необслуживаемый (герметизированный) аккумулятор, то избыточная энергия от зарядного устройства пойдет на электролиз дистиллированной воды, которая впоследствии за счет избыточного давления газовыделения выпарится через односторонний клапан обратного давления в аккумуляторе. Но так как невозможно залить в необслуживаемый аккумулятор воду, то мгновенно выявляются все признаки выхода из строя, названные во второй причине: осушение пластин – глубокие разряды – осыпание пластин – полный выход аккумулятора из строя.
Более того перезаряд сопровождается обильным тепловыделением. И если не контролировать этот процесс, то неизбежен эффект «терморазгона», когда выпускные клапаны уже не в состоянии «вытравить» избыточное давление и оно воздействует механически на корпус, деформируя его или даже разрушая.
И последняя причина – это сульфатация. Хотя сульфатация электродов, на самом деле, естественный процесс (она образуется каждый раз при разряде электродов), но нюанс в том, что если аккумулятор разрядился только что, то сульфат свинца существует в виде геля и способен при малых энергозатратах вернуться в исходное состояние – свинец и оксид свинца. А вот если аккумулятор в разряженном состоянии некоторое время будет храниться (от месяца до 3-х месяцев), то гелеобразный сульфат свинца превратится в кристаллический, у него вырастет внутреннее сопротивление, и обычное зарядное устройство уже не сможет зарядить такой аккумулятор полноценно. Поэтому нельзя длительно держать аккумулятор в разряженном состоянии.
От чего умирают аккумуляторы.
Такой вопрос часто возникает как у начинающих, так и бывалых автомобилистов. Причин того, что аккумулятор теряет свои свойства, может быть достаточно много. Но главная из них – это физика электрохимического процесса разрядки и зарядки. На пластины аккумуляторов нанесена специальная паста. Получая или отдавая ток, эти пластины имеют свойство расширяться и сжиматься соответственно. Чем больше используется аккумулятор, тем больше таких циклов происходит. За все время работы стандартная аккумуляторная батарея может выдержать до несколько тысяч подобных циклов.
Временные решения существуют. Изначально делались емкости-отстойники на дне аккумуляторов, именно в них собирался шлам. Немного позже конструкторы разработали более эффективный способ – конверты-сепараторы, которые предназначены для разделения положительных и отрицательных пластин. Кроме того, такие сепараторы дали возможность располагать пластины близко друг к другу, что повлияло на размеры аккумулятора.
Следует помнить, что хотя пластины защищены конвертами-сепараторами,
Кроме того, АКБ бояться глубокой разрядки и перезарядки. В случае перезарядки происходит интенсивное окисления пластин, что приводит к их разрушению и осыпанию. Перезарядка АКБ может случиться в двух случаях. Первый – когда электросистема автомобиля не исправна. Второй, более распространенный, автовладелец забывает о том, что поставил аккумуляторную батарею на зарядку. После того, как АКБ зарядиться на 100%, он начинает активно бурлить и разлагать электролит.
В случае перезарядки происходит интенсивное окисления пластин, что приводит к их разрушению и осыпанию. Перезарядка АКБ может случиться в двух случаях. Первый – когда электросистема автомобиля не исправна. Второй, более распространенный, автовладелец забывает о том, что поставил аккумуляторную батарею на зарядку. После того, как АКБ зарядиться на 100%, он начинает активно бурлить и разлагать электролит.
Более современные кальциевые, калиевые и другие гибридные аккумуляторы не бояться перезаряда, так как перестают принимать ток уже на 95-97% общего заряда.
Глубокий разряд влечет за собой оплывание пасты с отрицательных решеток. Чаще всего это происходит, когда в автомобиле неисправен генератор, окислились контакты или ремень генератора не достаточно натянут. Если автомобиль стал плохо заводиться, следует на это обратить особое внимание. Ведь новая АКБ удовольствие не из дешевых.
 Но если Вы ее даже и зарядите, то другой проблемы не избежать. Во время глубокого разряда электролит в АКБ превращается в воду, а она имеет свойство замерзать. Поэтому следует быть внимательным в сильные морозы, возможно, стоит забрать аккумулятор в теплое помещение. Иначе может получиться не малый взрыв.
Но если Вы ее даже и зарядите, то другой проблемы не избежать. Во время глубокого разряда электролит в АКБ превращается в воду, а она имеет свойство замерзать. Поэтому следует быть внимательным в сильные морозы, возможно, стоит забрать аккумулятор в теплое помещение. Иначе может получиться не малый взрыв.Глубокий разряд, а также постоянный недозаряд – основная причина сульфатации пластин аккумулятора. Процесс сульфатации не обратим, аккумулятор теряет свою ёмкость и по этой причине выходит из строя.
Почему замерзают аккумуляторы? | АКБ-сервис
Почему замерзают аккумуляторы?
Никто из автолюбителей не застрахован от того, что одним морозным утром он обнаружит тот факт, что в аккумуляторе замерз электролит. Визуально это можно определить по вздувшимся стенкам АКБ, а также по отказу работы абсолютно всех электро систем автомобиля. Так почему же замерзает аккумулятор, эксплуатирующийся сравнительно недолгое время, а подчас даже и совсем новый? Давайте разберемся с физико-химическими процессами, которые протекают внутри аккумулятора.
Визуально это можно определить по вздувшимся стенкам АКБ, а также по отказу работы абсолютно всех электро систем автомобиля. Так почему же замерзает аккумулятор, эксплуатирующийся сравнительно недолгое время, а подчас даже и совсем новый? Давайте разберемся с физико-химическими процессами, которые протекают внутри аккумулятора.
При разряде аккумулятора в процессе электролитической диссоциации серная кислота воздействует на свинец в пластинах и в результате этого активно образуются углекислый газ, сульфат аммония и вода. Замерзанию как раз таки подвержена вода в аккумуляторе и чем ниже будет плотность электролита, тем выше температура замерзания. Следовательно, делаем вывод, что если ваш аккумулятор замерз, то он был разряжен, либо электролит имел малую плотность по другим причинам.
Иногда такие простые, казалось бы, причины, как ослабление или окисление контактов соединения с электропроводкой, приводят к снижению эффективности зарядки от генератора из-за падения напряжения на клеммах аккумулятора, при этом сам аккумулятор абсолютно исправен, но систематически недозаряжается. Прибавьте к этому низкую температуры за бортом автомобиля и получите результат – аккумулятор не принимает заряд.
Прибавьте к этому низкую температуры за бортом автомобиля и получите результат – аккумулятор не принимает заряд.
Этому явлению есть довольно простое объяснение. При низких температурах в аккумуляторах повышается вязкость электролита, скорость протекания электрохимических реакций замедляется, и в итоге снижается способность аккумулятора быстро заряжаться.
В таких случаях автомобилисты вынуждены эксплуатировать свои аккумуляторы в состоянии неполного заряда и, естественно, с более низкой ёмкостью. При каждом последующем пуске аккумулятор, как правило, недопустимо глубоко разряжается, а зарядиться быстро до требуемой ёмкости и напряжения уже не может.
Конечно, электролит замерзнуть не может, а вот когда весь ресурс аккумулятора исчерпан и вся серная кислота израсходована на процессы разрядки, то в электролите остается практически одна вода, температура которой составляет 0 С.
Еще очень часто распространено такое явление, как утечка тока в цепи — обычно это может быть магнитола, сигнализация или другое не штатное оборудование, подключенное не правильно. Даже видеорегистратор если хотите. Он буквально за сутки разрядит АКБ и тот даже при малых морозах – замерзнет! Драгоценные амперы могут также расходоваться из-за попадания влаги, или перетертой проводки- иногда причину бывает сложно найти. Или же внезапная неисправность в генераторе – вышедший из строя регулятор напряжения или диодный мост, также могут быть причиной быстрой разрядки аккумулятора, и следовательно замерзания электролита в мороз.
Даже видеорегистратор если хотите. Он буквально за сутки разрядит АКБ и тот даже при малых морозах – замерзнет! Драгоценные амперы могут также расходоваться из-за попадания влаги, или перетертой проводки- иногда причину бывает сложно найти. Или же внезапная неисправность в генераторе – вышедший из строя регулятор напряжения или диодный мост, также могут быть причиной быстрой разрядки аккумулятора, и следовательно замерзания электролита в мороз.
Ниже приведены температуры замерзания электролита в аккумуляторе при разряде:
Вода при замерзании увеличивается в объеме и выдавливает активную массу из ячеек решетки, в результате мы имеем снижение по токотдаче и сроку службы. Такой аккумулятор теряет свой ресурс и, как правило, преждевременно выходит из строя. Именно поэтому величина тока холодной прокрутки и запас ёмкости в аккумуляторе в холодное время года имеет такое большое значение для беспроблемной эксплуатации.
Что делать с замерзшим АКБ? Как правильно разморозить и зарядить замерзший аккумулятор?
Первым делом нужно убедиться в дальнейшей пригодности батареи путем осмотра корпуса на предмет трещин и разломов (очень часто лед внутри разрывает тонкие пластиковые стенки корпуса). После осмотра аккумуляторную батарею следует снять с автомобиля и поставить в теплое помещение.
Самое главное не заряжать аккумулятор пока в нем находиться лед, чтобы избежать замыкания.
Батарея должна оттаять полностью и температура электролита должна приблизиться к комнатной. После размораживания мы еще раз осматриваем нет ли течей по корпусу (вздувшиеся стенки должны принять исходный вид). Если на корпусе аккумулятора вы наблюдаете какую-то жидкость, то следует определить ее происхождения с помощью лакмусового индикатора. Если бумага приобретет красный цвет, то вы имеете дело с кислотой, которая является основной составляющей электролита и может вытечь через трещины в корпусе АКБ. Интуитивно вы должны осознавать тот факт, что кислотой можно обжечься.
Иногда случается так, что мелкие трещины на корпусе аккумулятора оставляют без внимания, принимая слегка влажные стенки за водный конденсат. В итоге после того как АКБ будет разморожен, заряжен и готов к эксплуатации, он будет медленно, но уверено течь. Есть конечно вариант запайки корпуса аккумулятора ( для этого сливаем все содержимое и берем паяльник в руки ), но вероятность положительного исхода этой операции примерно один к десяти. Потому что запаять получиться только трещину, которая размещена с боку ( не снизу или на углу) и которая распространяется лишь на одну банку.
Далее приступаем к зарядке, помня о том, что ток заряда определяем как десять процентов от номинальной емкости аккумулятора в ампер/часах. В таком случае процесс зарядки длиться около десяти часов. Но, это «кустарный метод». В идеале зарядка батареи производиться разным током, изначально нужно пробить сульфатацию на пластинах АКБ импульсным высоким током, потом постоянным пониженным дать основную зарядку и доводить батарею на прерывающемся низком току для полного восстановления пластин. Главное – мы должны зарядить батарею полностью (желательно автоматическим зарядным устройством), после этого обязательно проверяем прозрачность и плотность электролита. Мутный электролит свидетельствует о том, что пластины осыпались. Если все в порядке, то можно спокойно ставить АКБ и ездить дальше.
Главное – мы должны зарядить батарею полностью (желательно автоматическим зарядным устройством), после этого обязательно проверяем прозрачность и плотность электролита. Мутный электролит свидетельствует о том, что пластины осыпались. Если все в порядке, то можно спокойно ставить АКБ и ездить дальше.
Как не допустить того чтобы в аккумуляторе замер электролит?
Основная задача, которая стоит перед водителем, по уходу за АКБ – это не допускать его разряда или перезаряда.
Это же касается и вопроса замерзания батареи. В большинстве случаев замерзает разряженный аккумулятор. Так же важно постоянно следить за плотностью электролита, проверку плотности производим в каждой отдельной банке. Нужно учитывать, что зимой на аккумулятор идет дополнительная нагрузка (постоянно работающая печка, утрудненный запуск двигателя в морозы, световой день меньше – включены фары и т.д.), потому чаще проверяйте уровень зарядки, выдаваемый генератором, и при необходимости вовремя заряжайте батарею. При низких температурах саморазряд аккумулятора повышается, потому не ленитесь заносить снятую АКБ в теплое помещение на ночь или как минимум отключайте массу.
При низких температурах саморазряд аккумулятора повышается, потому не ленитесь заносить снятую АКБ в теплое помещение на ночь или как минимум отключайте массу.
Краткий вывод: замерзание батареи – это еще не ее конец. С аккумулятором нужно быть особо внимательным в зимнюю пору. Заряженная батарея с нормальной плотностью электролита – не замерзает!
Всё об аккумуляторах
Электри́ческий аккумулятор — химический источник тока, источник ЭДС многоразового действия, основная специфика которого заключается в обратимости внутренних химических процессов, что обеспечивает его многократное циклическое использование (через заряд-разряд) для накопления энергии и автономного электропитания различных электротехнических устройств и оборудования, а также для обеспечения резервных источников энергии в медицине, производстве, транспорте и в других сферах.
Все цифровые устройства, такие как плееры, смартфоны, диктофоны и другие носимые гаджеты, а также электромобили — все более совершенствуются в своих возможностях. Ограничения накладываются главным образом конечным количеством запасаемой в аккумуляторах энергии.
Ограничения накладываются главным образом конечным количеством запасаемой в аккумуляторах энергии.
Смартфон, например, работает после очередной подзарядки максимум 2 дня. Вот если бы аккумуляторы улучшить, сделать их более емкими, то работу на одной зарядке можно было бы многократно продлить.
Однако смартфоны, к сожалению, развиваются в последние 10 лет значительно быстрее нежели совершенствуются технологии создания аккумуляторов. Но надежда на улучшение ситуации есть, ведь наука на месте не стоит, и в последние годы ученые начинают предлагать очень интересные новые решения. Их можно назвать технологиями аккумуляторов будущего. Давайте обратим внимание на некоторые из них.
1. Зарядить электромобиль за 5 минут, а телефон — за 30 секунд
В 2022 году израильская компания StoreDot планирует начать выпуск аккумуляторов для электрокаров и гаджетов на основе революционной технологии литиевых аккумуляторов. Технология позволит электрокарам восстанавливать запас хода на 500 километров всего за 5 минут!
Графит, обычно применяемый в литиевых аккумуляторах, хотят заменить на особую смесь металлоидов, включающую кремний и некоторые запатентованные материалы, лишь недавно синтезированные в лаборатории компании. Процесс формирования смеси менее токсичен, а количество кобальта в батареях будет сокращено вдвое. Кстати, батареи станут при этом еще и безопаснее.
Процесс формирования смеси менее токсичен, а количество кобальта в батареях будет сокращено вдвое. Кстати, батареи станут при этом еще и безопаснее.
Даже само название компании «StoreDot» содержит в себе намек на крошечные биоорганические пептидные молекулы, известные как «нанодоты», которые повышают плотность хранения заряда и обеспечивают аккумуляторам на базе новой технологии быстрое поглощение и накопление энергии.
Между тем, ученым еще предстоит преодолеть некоторые технические трудности, связанные с необходимостью пропускания очень большого тока в процессе зарядки. Для этого необходима более совершенная система охлаждения кабелей и разъемов как в системе автомобиля, так и непосредственно на зарядной станции.
Физик Виктор Кривченко о перспективных видах аккумуляторов, фундаментальных проблемах в производстве литий-серных источников тока и преимуществах постлитийионных аккумуляторов:
2. Как подзарядить телефон от окружающего шума
Как подзарядить телефон от окружающего шума
Британские ученые разработали телефон, способный получать заряд просто из шума, постоянно стоящего вокруг. В основе технологии — пьезоэлектрический эффект. Пьезоэлектрические наногенераторы сами давно в известном смысле наделали много шума.
И вот теперь уже созданы специализированные генераторы такого рода, работающие на фоновом шуме, и генерирующие из него электрический ток для заряда небольших батарей. По сути телефон заряжается от шума, который во все времена просто действовал людям на нервы, а теперь он сможет приносить ощутимую пользу.
Исследователи создали особую смесь, в которую добавили оксид цинка, и просто покрыли поверхность гаджета данной смесью. Так получилась поверхность, полностью покрытая пьезоэлектрическими наностержнями — генерирующая энергию поверхность аппарата. Эти наностержни очень чувствительны к звуковым волнам и изгибаются от воздействия даже очень слабого звукового давления.
Наногенераторы преобразуют данные колебания в электрический ток, энергии которого достаточно для зарядки аккумулятора. Кроме преобразования звуковых волн шума, наногенераторы работают и от голоса, звучащего во время разговора, так что просто разговаривая по телефону пользователь уже частично восстанавливает заряд своего аккумулятора.
Кроме преобразования звуковых волн шума, наногенераторы работают и от голоса, звучащего во время разговора, так что просто разговаривая по телефону пользователь уже частично восстанавливает заряд своего аккумулятора.
3. Увеличить емкость аккумуляторов чистым кремнием, добытым из песка
В университете Риверсайд группа исследователей, в поисках альтернативного подхода к созданию литий-ионных аккумуляторов, решили заменить традиционный графит на обычный песок. Изначально учеными была отмечена проблема скорой деградации наноразмерного кремния, который к тому же очень сложно получать в промышленных количествах. После этого ученые решили попробовать применить обычный доступный песок.
Песок легко поддается очистке, к тому же его легко наносить в виде порошка. Очищенный песок намочили солью и магнием, затем подвергли нагреванию для удаления кислорода. Так получился чистый кремний пористой структуры, который позволил увеличить емкость элемента втрое, а также повысить эффективность его использования и увеличить срок службы! Производство получается недорогим и экологически безвредным.
4. Зарядить смартфон на ходу
Даже самую обычную одежду можно использовать в качестве генератора электроэнергии, чуть-чуть доработав ее, считают исследователи из Университета Суррей в Манор Парк (Англия). Они предлагают использовать так называемые трибоэлектричские наногенераторы, способные преобразовывать энергию движения поверхности одежды в электрический заряд. Генерируемое таким образом электричество можно накапливать, а затем передавать в обычный литиевый аккумулятор, либо напрямую питать им портативное устройство (плеер, телефон и т.д.).
Принципиально технология трибоэлектрических наногенераторов не имеет практических ограничений, ее можно внедрить даже в стены домов, в тротуарную плитку, в стволы и ветви деревьев, в автомобильные шины и т. д. – всюду, где есть колебания или трение. Такая система позволила бы использовать энергию от движения всего чего угодно — для зарядки аккумуляторов ночных фонарей, гаджетов, сегвеев и тому подобных устройств.
5. Передать энергию к аккумулятору в форме ультразвука
Идея передачи электрической энергии «по воздуху» не нова. Но почему бы не попробовать использовать для этой цели ультразвук? Астробиолог Мередит Перри предлагает встраивать именно ультразвуковые передатчики в элементы интерьера. Ультразвук определенного диапазона не слышен людям и животным, поэтому звуковые волны можно вполне безопасно направить прямо на гаджет, обеспечив таким образом беспроводную зарядку.
Пластина в 5,5 мм толщиной служит в такой системе передатчиком, который автоматически включается только тогда, когда в зоне его действия находится заряжаемый гаджет. Ультразвуковая волна энергии направляется в форме сфокусированного луча и принимается плоским приемником, закрепленным на заряжаемом устройстве. В отличие от Wi-Fi, система uBeam на ультразвуке не может преодолевать стены, зато энергия направляется очень концентрированно.
Аккумуляторы безграничного жизненного цикла
Проблема аккумуляторов любого типа — ограниченное количество жизненных циклов, то есть их можно заряжать и разряжать не бесконечное количество раз. Хорошо бы создать такой аккумулятор, который можно было бы никогда не менять на новый, а просто перезаряжать когда это необходимо, причем делать это сколько угодно раз. В Калифорнийском университете Ирвин создали почти такой идеальный аккумулятор!
Хорошо бы создать такой аккумулятор, который можно было бы никогда не менять на новый, а просто перезаряжать когда это необходимо, причем делать это сколько угодно раз. В Калифорнийском университете Ирвин создали почти такой идеальный аккумулятор!
Исследователи разработали батарею на основе нанопроводов из золота, способную выдержать до 200000 циклов заряда-разряда без снижения емкости. Проводки тысячекратно тоньше волоса дают возможность создавать огромные площади поверхностей с достаточно высокой проводимостью. Нанопровода покрыты особой оболочкой из гелиевого электролита и диоксида марганца, что позволило получить в результате предельную стойкость к деградации. Это решение считается одним из весьма перспективных на сегодняшний день.
7. Графен открывает новые горизонты
Компания Grabat создала аккумуляторы на базе особой формы углерода — графене. На сегодняшний день именно графеновые батареи являются лучшими из уже доступных на рынке.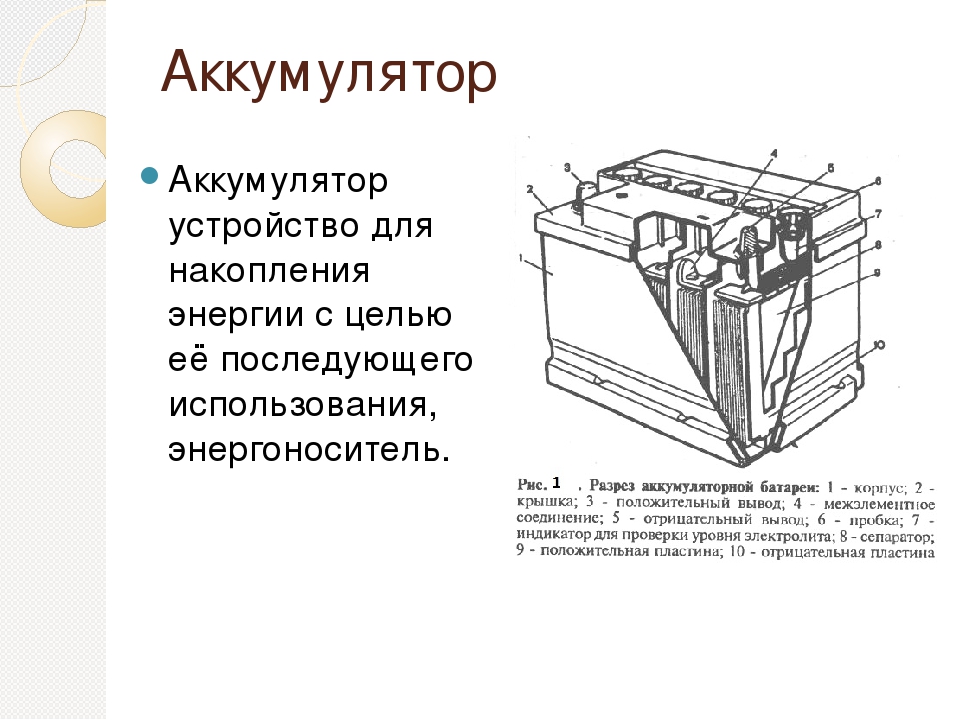 Они позволяют, например, проехать электрокару 750 километров на одной зарядке.
Они позволяют, например, проехать электрокару 750 километров на одной зарядке.
Принципиально такие батареи способны заряжаться за несколько минут и отдавать заряд в 30 раз интенсивнее чем литий-ионные предшественники. Уже сейчас такие аккумуляторы устанавливают в беспилотные летательные аппараты, кроме того они завоевывают популярность в электротранспорте и в качестве накопителей для домашних электростанций.
8. Пенные аккумуляторы обещают быть дешевыми
Инженеры компании Prieto делают ставку на твердотельные аккумуляторы, создаваемые при помощи печати и на основе медной пены с электрополимеризованным сепаратором. Фирма планирует таким образом создавать самые безопасные, дешевые, быстро заряжаемые и долго живущие аккумуляторы, плотность заряда в которых в 5 раз превзойдет современные литиевые аккумуляторы.
9. Натрий — конкурент литию
Натрий является одним из самых доступных на планете химических элементов. Именно из натрия группа ученых из Японии планирует производить аккумуляторы нового типа. Здесь не нужен редкий литий, а емкость обещает быть в 7 раз выше чем у него!
Именно из натрия группа ученых из Японии планирует производить аккумуляторы нового типа. Здесь не нужен редкий литий, а емкость обещает быть в 7 раз выше чем у него!
Начиная с 80-х годов 19 века натрий активно исследуется как основа источников энергии, и вот теперь с использованием соли и современных технологий стало технически возможным сделать натрий-ионный аккумулятор достаточно дешевым. Однако ожидается что до начала широкой практической реализации пройдет еще несколько лет.
10. Водород для зарядки гаджетов
Недавно в продаже появились совершенно необычные умные зарядные устройства для мобильной техники на водородном топливе. Данный продукт носит название Upp. Водород безопасен для окружающей среды, и в процессе зарядки с его помощью образуется лишь водяной пар. Одной водородной ячейки хватит на 5 полных зарядок среднего смартфона. На данный момент устройство не особенно востребовано в силу дороговизны, но идея представляется многим очень интересной и перспективной.
Ранее ЭлектроВести писали, что инженеры Williams Advanced Engineering разработали аккумулятор, который одновременно легче, вместительнее и мощнее литий-ионных батарей. Технологию планируют применять в авто- и мотоспорте и в электрической авиации.
По материалам: electrik.info.
Создан аккумулятор будущего: долгоиграющий, взрывобезопасный и без лития
, Текст: Эльяс Касми
Американские исследователи заменили литий в батареях на особый материал на основе магния, и получили более надежные и долговечные аккумуляторы. В будущем их разработка может лечь в основу всех перезаряжаемых батарей.Хаос на страже электрического заряда
Ученые Иллинойского университета в Чикаго разработали новую технологию производства аккумуляторных батарей для мобильных устройств, в основе которой лежит принцип использования неупорядоченных частиц оксида магния и непосредственно магниевого анода. Эту идею до них никто не развивал, поскольку неупорядоченные (или беспорядочные, движущиеся хаотично) частицы теоретически и практически могут стать препятствием при производстве и эксплуатации элементов питания.
Эту идею до них никто не развивал, поскольку неупорядоченные (или беспорядочные, движущиеся хаотично) частицы теоретически и практически могут стать препятствием при производстве и эксплуатации элементов питания.
Несмотря на то, ранее технология нигде и никем не применялась, американские ученые уже добились определенных успехов в выбранном направлении. К главным преимуществам магниевых АКБ авторы технологии отнесли их повышенную безопасность в сравнении с литиевыми батареями, а также способность гораздо дольше держать заряд.
По словам исследователей, если литий-ионные аккумуляторы уже достаточно давно достигли пика своего развития, то магниевые лишь только начинают свой путь, имея в запасе внушительный потенциал.
Суть и потенциал технологии
В аккумуляторе, созданном учеными Иллинойского университета, используется созданный ими на основе оксида магния и хрома (MgCr2O4) неупорядоченный материал толщиной порядка 5 нанометров. Его характеризует в первую очередь низкая температура реакции при высокой скорости этой самой реакции. На практике это даст возможность не опасаться перегрева аккумулятора в мобильном устройстве в жаркий летний день или в процессе подзарядки. Литий-ионные батареи, отметим, очень чувствительны к изменению температуры и могут воспламениться и даже взорваться прямо в руках у владельца смартфона.
На практике это даст возможность не опасаться перегрева аккумулятора в мобильном устройстве в жаркий летний день или в процессе подзарядки. Литий-ионные батареи, отметим, очень чувствительны к изменению температуры и могут воспламениться и даже взорваться прямо в руках у владельца смартфона.
Преследуя цель убедиться в своей правоте, ученые провели сравнительный эксперимент, в ходе которого сопоставили 5-нанометрвоый неупорядоченный материал с 7-нанометровым упорядоченным оксидом магния и хрома. Оба материала подвергались различным испытаниям и тестам, включая рентгеновскую абсорбционную спектроскопию и современные электрохимические методы тестирования.
Тестирование первой в мире батареи на неупорядоченных частицах оксида магния в лабораторных условиях
Специалисты исследовали структурные и химические изменения в материалах в процессе их тестирования и увидели, что они ведут себя совершенно по-разному. Неупорядоченные частицы оксида магния могут перетекать от анода к катоду, тогда как упорядоченные – нет. На основе полученных результатов ученые сделали вывод о пригодности их новой технологии для создания нового вида аккумуляторных батарей. По состоянию на декабрь 2018 г. технология требовала доработки и не могла быть использована в серийном производстве.
На основе полученных результатов ученые сделали вывод о пригодности их новой технологии для создания нового вида аккумуляторных батарей. По состоянию на декабрь 2018 г. технология требовала доработки и не могла быть использована в серийном производстве.
Магний лучше лития, никеля и кадмия?
О применении магния в перезаряжаемых элементах питания специалисты стали задумываться еще в начале века, даже когда литиевые батареи еще не получили столь широкого распространения. В 2003 г. израильские ученые из университета в Рамат-Гане даже разработали прототип нового магниевого аккумулятора, который практически не уступал по своим энергетическим свойствам популярным тогда никель-кадмиевым АКБ. Он тоже выдавал напряжение до 1,2 В, но при этом характеризовался меньшей степенью деградации спустя несколько сотен циклов зарядки и разрядки и в целом был намного более экологичным. В серию аккумуляторы, выполненные по израильской технологии, не пошли.
Конкурирующие разработки
Существуют и другие технологии, способные заменить собой литиевые АКБ и положить конец их далеко не самым экологичным производству и утилизации. К примеру, еще одна группа американских ученых, на этот раз из Калифорнийского технологического университета, создала аккумулятор на основе фторидов – химических соединений фтора с другими элементами таблицы Менделеева. Подобные АКБ в теории характеризуются способностью держать заряд до восьми раз дольше в сравнении с литий-ионными и литий-полимерными. Опять же, они намного безопаснее оных ввиду неподверженности влиянию повышенной температуры окружающей среды или нагреву во время подзарядки.
К примеру, еще одна группа американских ученых, на этот раз из Калифорнийского технологического университета, создала аккумулятор на основе фторидов – химических соединений фтора с другими элементами таблицы Менделеева. Подобные АКБ в теории характеризуются способностью держать заряд до восьми раз дольше в сравнении с литий-ионными и литий-полимерными. Опять же, они намного безопаснее оных ввиду неподверженности влиянию повышенной температуры окружающей среды или нагреву во время подзарядки.
Как перевести четверть клиентов на самообслуживание? Опыт банка «Открытие»
ИТ в банкахВ целом, многие страны сейчас ищут замену не самым дешевым в производстве литий-ионным АКБ. К примеру, Китай отдал предпочтение аккумуляторам на твердых электролитах – такие батареи надежнее, безопаснее и производительнее литиевых. Их также характеризует сравнительно малый вес, что позволит уменьшить массу мобильных устройств. Твердотельные аккумуляторы имеют большой потенциал в автомобилестроении – при идентичной емкости они компактнее литиевых, что позволит увеличить запас хода гибридных и электрических транспортных средств без прироста их массы.
Автомобильный аккумулятор (АКБ). Общее устройство аккумулятора
Неотъемлемой частью каждого автомобиля является аккумуляторная батарея, которая предназначена для питания электрических цепей управления и сервиса бортовой сети, когда двигатель автомобиля не работает. Но самое главное,- приводить в действие стартер, во время заводки авто. Аккумуляторная батарея включается в буфер с автомобильным генератором и во время движения, или просто работы двигателя, является нагрузкой для генератора. Но как только вся совокупная электрическая нагрузка превысит мощность выдаваемую генератором, в действие «вступает» аккумулятор и поддерживает напряжение бортовой сети на уровне 12 вольт.
Обычно для автомобилей применяются кислотно-свинцовые аккумуляторы, которые имеют напряжение 12 вольт и различаются только по емкости заряда. Автомобильный аккумулятор должен обладать несколькими важными параметрами.
- Иметь малое внутренне падение напряжения
- Иметь небольшой саморазряд во время эксплуатации
- Иметь способность выдавать большие токи
- Иметь небольшие габариты и минимальное обслуживание.
Всем этим параметрам и соответствует кислотно-свинцовый аккумулятор, об устройстве которого поговорим ниже.
Устройство аккумулятора автомобиля
Аккумулятор, с номинальным напряжением в 12 вольт состоит из (обычно 6) независимых друг от друга аккумуляторов (банок) меньшего напряжения (2 вольта), собранных в одном корпусе и соединенных последовательно между собой.
- Банка аккумулятора представляет собой набор разно полюсных пластин, которые изолированы друг от друга кислотоупорными сепараторами.
- Корпус аккумулятора изготавливается из кислотоупорных пластмасс или эбонита. В корпусе имеется отсеки для установки банок аккумулятора.
- Полюсная пластина изготавливается из свинца и имеет вид решетки, в ячейки решетки впрессовывается специальный состав (активное вещество) пористой структуры, для увеличения площади соприкосновения с электролитом.
 Активное вещество изготавливается из свинцового порошка, с добавлением серной кислоты. В отрицательные пластины добавляется еще сернокислый барий. Во время формирования аккумулятора пластины заряжаются, и активное вещество в плюсовых пластинах превращается в диоксид свинца, а в отрицательных – в губчатый свинец.
Активное вещество изготавливается из свинцового порошка, с добавлением серной кислоты. В отрицательные пластины добавляется еще сернокислый барий. Во время формирования аккумулятора пластины заряжаются, и активное вещество в плюсовых пластинах превращается в диоксид свинца, а в отрицательных – в губчатый свинец. - Электролит заливается в банки аккумулятора и служит для движения заряженных частиц от полюса к полюсу. Изготавливается из серной кислоты и очищенной воды (дистиллированной).
Принцип работы аккумуляторной батареи
Физика процесса работы аккумулятора очень проста, при подключении нагрузки, в аккумуляторе начинается движение заряженных частиц, что приводит к появлению тока. В условиях заряда от генератора или зарядного устройства, напряжение заряда превышает номинальное значение напряжения аккумулятора, и движение частиц происходит в обратном направлении.
|
РЕКОМЕНДУЕМ ТАКЖЕ ПРОЧИТАТЬ:
|
Виды и типы аккумуляторных батарей — подробно!
- Категория: Поддержка по аккумуляторным батареям
- Опубликовано 25.
 06.2015 19:00
06.2015 19:00 - Автор: Abramova Olesya
Аккумуляторная батарея – это источник постоянного тока, который предназначен для накопления и хранения энергии. Подавляющее число типов аккумуляторных батарей основано на циклическом преобразовании химической энергии в электрическую, это позволяет многократно заряжать и разряжать батарею.
Еще в 1800 году Алессандро Вольта произвел поразительное открытие, когда опустил в банку, наполненную кислотой, две металлические пластины – медную и цинковую, после чего доказал, что по соединяющей их проволоке протекает электрический ток. Спустя более чем 200 лет, современные аккумуляторные батареи продолжают производить на основе открытия Вольта.
|
Рисунок 1. Вольтов столб из шести элементов. |
Рисунок 2. Алессандро Джузеппе Антонио Анастасио Вольта |
Со времени изобретения первого аккумулятора прошло не больше 140 лет и сейчас сложно представить современный мир без резервных источников питания на основе батарей. Аккумуляторы применяются всюду, начиная с самых безобидных бытовых устройств: пульты управления, переносные радиоприемники, фонари, ноутбуки, телефоны, и заканчивая системами безопасности финансовых учреждений, резервными источниками питания для центров хранения и передачи данных, космической отраслью, атомной энергетикой, связью и т. д.
Аккумуляторы применяются всюду, начиная с самых безобидных бытовых устройств: пульты управления, переносные радиоприемники, фонари, ноутбуки, телефоны, и заканчивая системами безопасности финансовых учреждений, резервными источниками питания для центров хранения и передачи данных, космической отраслью, атомной энергетикой, связью и т. д.
Развивающийся мир нуждается в электрической энергии столь сильно, сколько человеку нужен кислород для жизни. Поэтому конструкторы и инженеры ежедневно ведут работу по оптимизации имеющихся типов аккумуляторов и периодически разрабатывают новые виды и подвиды.
Основные виды аккумуляторов приведены в таблице №1.
|
Тип |
Применение |
Обозначение |
Рабочая температура, ºC |
Напряжение элемента, В |
Удельная энергия, Вт∙ч/кг |
|
Литий-ионный (Литий-полимерный, литий-марганцевый, литий-железно-сульфидный, литий-железно-фосфатный, литий-железо-иттрий-фосфатный, литий-титанатный, литий-хлорный, литий-серный) |
Транспорт, телекоммуникации, системы солнечной энергии, автономное и резервное электроснабжение, Hi-Tech, мобильные источники питания, электроинструмент, электромобили и т. |
Li-Ion (Li-Co, Li-pol, Li-Mn, LiFeP, LFP, Li-Ti, Li-Cl, Li-S) |
-20 … +40 |
3,2-4,2 |
280 |
|
никель-солевой |
Автомобильный транспорт, Ж\Д транспорт, Телекоммуникации, Энергетика, в том числе альтернативная, Системы накопления энергии |
Na/NiCl |
-50 … +70 |
2,58 |
140 |
|
никель-кадмиевый |
Электрокары, речные и морские суда, авиация |
Ni-Cd |
–50 … +40 |
1,2-1,35 |
40 – 80 |
|
железо-никелевый |
Резервное электропитание, тяговые для электротранспорта, цепи управления |
Ni-Fe |
–40 … +46 |
1,2 |
100 |
|
никель-водородный |
Космос |
Ni-h3 |
|
1,5 |
75 |
|
никель-металл-гидридный |
электромобили, дефибрилляторы, ракетно-космическая техника, системы автономного энергоснабжения, радиоаппаратура, осветительная техника. |
Ni-MH |
–60 … +55 |
1,2-1,25 |
60 – 72 |
|
никель-цинковый |
Фотоаппараты |
Ni-Zn |
–30 … +40 |
1,65 |
60 |
|
свинцово-кислотный |
Системы резервного питания, бытовая техника, ИБП, альтернативные источники питания, транспорт, промышленность и т.д. |
Pb |
–40 … +40 |
2, 11-2,17 |
30 – 60 |
|
серебряно-цинковый |
Военная сфера |
Ag-Zn |
–40 … +50 |
1,85 |
<150 |
|
серебряно-кадмиевый |
Космос, связь, военные технологии |
Ag-Cd |
–30 … +50 |
1,6 |
45 – 90 |
|
цинк-бромный |
|
Zn-Br |
|
1,82 |
70 – 145 |
|
цинк-хлорный |
|
Zn-Cl |
–20 … +30 |
1,98-2,2 |
160 – 250 |
Таблица №1. Классификация аккумуляторных батарей.
Классификация аккумуляторных батарей.
Исходя из приведенных данных в таблице №1, можно прийти к выводу, что существует достаточно много видов аккумуляторов, отличных по своим характеристикам, которые оптимизированы для применения в разнообразных условиях и с различной интенсивностью. Применяя для производства новые технологии и компоненты, ученым удается достигать нужных характеристик для конкретной области применения, к примеру, для космических спутников, космических станций и другого космического оборудования были разработаны никель-водородные аккумуляторы. Конечно, в таблице приведены далеко не все типы, а лишь основные, которые получили распространение.
Современные системы резервного и автономного электропитания для промышленного и бытового сегмента основаны на разновидностях свинцово-кислотных, никель-кадмиевых (реже применяются железо-никелевый тип) и литий-ионных аккумуляторах, поскольку эти химические источники питания безопасны и имеют приемлемые технические характеристики и стоимость.
Свинцово-кислотные аккумуляторные батареи
Этот тип является самым востребованным в современном мире по причине универсальных особенностей и невысокой стоимости. Благодаря наличию большого количества разновидностей, свинцово-кислотные аккумуляторы применяется в областях систем резервного питания, системах автономного электроснабжения, солнечных электростанций, ИБП, различных видах транспорта, связи, системах безопасности, различных видах портативных устройств, игрушках и т. д.
Принцип действия свинцово-кислотных батарей
Основа работы химических источников питания основана на взаимодействии металлов и жидкости – обратимой реакции, которая возникает при замыкании контактов положительных и отрицательных пластин. Свинцово-кислотные аккумуляторы, как понятно из названия, состоят из свинца и кислоты, где положительно заряженными пластинами является свинец, а отрицательно заряженными – оксид свинца. Если подключить к двум пластинам лампочку, цепь замкнется и возникнет электрический ток (движение электронов), а внутри элемента возникнет химическая реакция. В частности, происходит коррозия пластин батареи, свинец покрывается сульфатом свинца. Таким образом, в процессе разряда аккумулятора на всех пластинах будет образовываться налет из сульфата свинца. Когда аккумулятор полностью разряжен, его пластины покрыты одинаковым металлом – сульфатом свинца и имеют практически одинаковый заряд относительно жидкости, соответственно, напряжение батареи будет очень низким.
В частности, происходит коррозия пластин батареи, свинец покрывается сульфатом свинца. Таким образом, в процессе разряда аккумулятора на всех пластинах будет образовываться налет из сульфата свинца. Когда аккумулятор полностью разряжен, его пластины покрыты одинаковым металлом – сульфатом свинца и имеют практически одинаковый заряд относительно жидкости, соответственно, напряжение батареи будет очень низким.
Если к батарее подключить зарядное устройство к соответствующим клеммам и включить его, ток будет протекать в кислоте в обратном направлении. Ток будет вызывать химическую реакцию, молекулы кислоты – расщепляться и за счет этой реакции будет происходить удаление сульфата свинца с положительных и отрицательных пластилин батареи. В финальной стадии зарядного процесса пластины будут иметь первозданный вид: свинец и оксид свинца, что позволит им снова получить разный заряд, т. е. батарея будет полностью заряжена.
Однако на практике все выглядит немного иначе и пластины электродов очищаются не полностью, поэтому аккумуляторы имеют определенный ресурс, по достижении которого емкость снижается до 80-70% от изначальной.
Рисунок №3. Электрохимическая схема свинцово-кислотного аккумулятора (VRLA).
Типы свинцово-кислотных батарей
-
Lead–Acid, обслуживаемые – 6, 12В батареи. Классические стартерные аккумуляторы для двигателей внутреннего сгорания и не только. Нуждаются в регулярном обслуживании и вентиляции. Подвержены высокому саморазряду.
-
Valve Regulated Lead–Acid (VRLA), необслуживаемые – 2, 4, 6 и 12В батареи. Недорогие аккумуляторы в герметизированном корпусе, которые можно использовать в жилых помещениях, не требуют дополнительной вентиляции и обслуживания. Рекомендованы для использования в буферном режиме.
-
Absorbent Glass Mat Valve Regulated Lead–Acid (AGM VRLA), необслуживаемые – 4, 6 и 12В батареи. Современные аккумуляторы свинцово-кислотного типа с абсорбированным электролитом (не жидкий) и стекловолоконными разделительными сепараторами, которые значительно лучше сохраняют свинцовые пластины, не давая им разрушаться.
 Такое решение позволило значительно снизить время заряда AGM батарей, поскольку зарядный ток может достигать 20-25, реже 30% от номинальной емкости.
Такое решение позволило значительно снизить время заряда AGM батарей, поскольку зарядный ток может достигать 20-25, реже 30% от номинальной емкости.Аккумуляторы AGM VRLA имеют множество модификаций с оптимизированными характеристиками для циклического и буферного режимов работы: Deep – для частых глубоких разрядов, фронт-терминальные – для удобного расположения в телекоммуникационных стойках, Standard – общего назначения, High Rate – обеспечивают лучшую разрядную характеристику до 30% и подходят для мощных источников бесперебойного питания, Modular – позволяют создавать мощные батарейные кабинеты и т. д.
Рисунок №4. AGM VRLA аккумуляторы EverExceed.
-
GEL Valve Regulated Lead–Acid (GEL VRLA), необслуживаниемые – 2, 4, 6 и 12В батареи. Одна из последних модификаций свинцово-кислотного типа аккумуляторов. Технология основана на применение гелеобразного электролита, который обеспечивает максимальный контакт с отрицательными и положительными пластинами элементов и сохраняет однообразную консистенцию по всему объему.
 Данный тип аккумуляторов требует «правильного» зарядного устройства, которое обеспечит требуемый уровень тока и напряжения, лишь в этом случае можно получить все преимущества по сравнению с AGM VRLA типом.
Данный тип аккумуляторов требует «правильного» зарядного устройства, которое обеспечит требуемый уровень тока и напряжения, лишь в этом случае можно получить все преимущества по сравнению с AGM VRLA типом.Химические источники питания GEL VRLA, как и AGM, имеют множество подвидов, которые наилучшим образом подходят для определенных режимов работы. Самыми распространенными являются серии Solar – используются для систем солнечной энергии, Marine – для морского и речного транспорта, Deep Cycle – для частых глубоких разрядов, фронт-терминальные – собраны в специальных корпусах для телекоммуникационных систем, GOLF – для гольф-каров, а также для поломоечных машин, Micro – небольшие аккумуляторы для частого использования в мобильных приложениях, Modular – специальное решение по созданию мощных аккумуляторных банков для накопления энергии и т. д.
Рисунок №5. GEL VRLA аккумулятор EverExceed.
-
OPzV, необслуживаемые – 2В батареи.
 Специальные свинцово-кислотные элементы типа OPZV произведены с применением трубчатых пластин анода и сернокислотным гелеобразным электролитом. Анод и катод элементов содержат дополнительный металл – кальций, благодаря которому повышается стойкость электродов к коррозии и увеличивается срок службы. Отрицательные пластины – намазные, эта технология обеспечивает лучший контакт с электролитом.
Специальные свинцово-кислотные элементы типа OPZV произведены с применением трубчатых пластин анода и сернокислотным гелеобразным электролитом. Анод и катод элементов содержат дополнительный металл – кальций, благодаря которому повышается стойкость электродов к коррозии и увеличивается срок службы. Отрицательные пластины – намазные, эта технология обеспечивает лучший контакт с электролитом.Аккумуляторы OPzV устойчивы к глубоким разрядам и обладают длительным сроком службы до 22 лет. Как правило, для изготовления подобных элементов питания применяются только лучшие материалы, чтобы обеспечить высокую эффективность работы в циклическом режиме.
Применение OPzV аккумуляторов востребовано в телекоммуникационных установках, системах аварийного освещения, источниках бесперебойного питания, системах навигации, бытовых и промышленных системах накопления энергии и солнечной электрогенерации.
Рисунок №6. Строение OPzV аккумулятора EverExceed.
-
OPzS, малообслуживаемые – 2, 6, 12В батареи. Стационарные заливные свинцово-кислотные аккумуляторы OPzS производятся с трубчатыми пластинами анода с добавлением сурьмы. Катод также содержит небольшое количество сурьмы и представляет собой намазной решетчатый тип. Анод и катод разделены микропористыми сепараторами, которые предотвращают короткое замыкание. Корпус аккумуляторов выполнен из специального ударопрочного, устойчивого к химическому воздействию и огню прозрачного пластика, а вентилируемые клапаны относятся к пожаробезопасному типу и обеспечивают защиту от возможного попадания пламени и искр.
Прозрачные стенки позволяют удобно контролировать уровень электролита при помощи отметок минимального и максимального значения. Специальная структура клапанов дает возможность без их снятия доливать дистиллированную воду и промерять плотность электролита. В зависимости от нагрузки, долив воды осуществляется раз в один – два года.

Аккумуляторные батареи типа OPzS обладают самыми высокими характеристиками среди всех других видов свинцово-кислотных батарей. Срок службы может достигать 20 – 25 лет и обеспечивать ресурс до 1800 циклов глубокого 80% разряда.
Применение подобных батарей необходимо в системах с требованиями среднего и глубокого разряда, в т.ч. где наблюдаются пусковые токи средней величины.
Рисунок №7. OPzS аккумулятор Victron Energy.
Характеристики свинцово-кислотных аккумуляторов
Анализируя приведенные в таблице №2 данные, можно прийти к выводу, что свинцово-кислотные аккумуляторы обладают широким выбором моделей, которые подходят для различных режимов работы и условий эксплуатации.
|
Тип |
LA |
VRLA |
AGM VRLA |
GEL VRLA |
OPzV |
OPzS |
|
Емкость, Ампер/час |
10 – 300 |
1 – 300 |
1 – 3000 |
1 – 3000 |
50 – 3500 |
50 – 3500 |
|
Напряжение, Вольт |
6, 12 |
4, 6, 12 |
2, 4, 6, 12 |
2, 6, 12 |
2 |
2 |
|
Оптимальная глубина разряда, % |
|
30 |
<40 |
<50 |
<60 |
<60 |
|
Допустимая глубина разряда, % |
|
<75 |
<80 |
<90 |
<90 |
<100 |
|
Циклический ресурс, D.O.D.=50% |
|
<250-300 |
<1000 |
<1400 |
<3200 |
<3300 |
|
Оптимальная температура, °С |
0 … +45 |
+15 … +25 |
+10 … +25 |
+10 … +25 |
0 … +30 |
0 … +30 |
|
Диапазон рабочих температур, °С |
–50 … +70 |
–35 … +60 |
–40 … +70 |
–40 … +70 |
–40 … +70 |
–40 … +70 |
|
Срок службы, лет при +20°С |
<7 |
<7 |
5 – 15 |
8 – 15 |
15 – 20 |
17 – 25 |
|
Саморазряд, % |
3 – 5 |
2 – 3 |
1 – 2 |
1 – 2 |
1 – 2 |
1 – 2 |
|
Макс. ток заряда, % от емкости |
10 – 20 |
20 – 25 |
20 – 30 |
15 – 20 |
15 – 20 |
10 – 15 |
|
Минимальное время заряда, ч |
8 – 12 |
6 – 10 |
6 – 10 |
8 – 12 |
10 – 14 |
10 – 15 |
|
Требования к обслуживанию |
3 – 6 мес. |
нет |
нет |
нет |
нет |
1 – 2 года |
|
Средняя стоимость, $, 12В/100Ач. |
70 – 150 |
200 – 250 |
250 – 380 |
350 – 500 |
1000 – 1400 |
1500 – 3500 |
Таблица №2. Сравнительные характеристики по видам свинцово-кислотных батарей.
Для анализа использовались усредненные данные более чем 10-ти производителей батарей, продукция которых представлена на рынке Украины в течение длительного времени и успешно применяется во многих областях (EverExceed, B.B. Battery, CSB, Leoch, Ventura, Challenger, C&D Techologies, Victron Energy, SunLight, Troian и другие).
Литий-ионные (литиевые) аккумуляторные батареи
История прохождения происхождения уходит в 1912 год, когда Гилберт Ньютон Льюис работал над вычислением активностей ионов сильных электролитов и проводил исследования электродных потенциалов целого ряда элементов, включая литий. С 1973 года работы были возобновлены и в результате появились первые элементы питания на основе лития, которые обеспечивали только один цикл разряда. Попытки создать литиевый аккумулятор затруднялись активностью свойств лития, которые при неправильных режимах разряда или заряда вызывали бурную реакцию с выделением высокой температуры и даже пламени. Компания Sony выпустила первые мобильные телефоны с подобными аккумуляторами, но была вынуждена отозвать продукцию обратно после нескольких неприятных инцидентов. Разработки не прекращались и в 1992 году появились первые «безопасные» аккумуляторы на основе ионов лития.
Аккумуляторы литий-ионного типа обладают высокой плотностью энергии и благодаря этому при компактном размере и легком весе обеспечивают в 2-4 раза большую емкость по сравнению со свинцово-кислотными аккумуляторами. Несомненно, большим достоинством литий-ионных батарей является высокая скорость полной 100% перезарядки в течение 1-2 часов.
Li-ion батареи получили широкое применение в современной электронной технике, автомобилестроении, системах накопления энергии, солнечной генерации электроэнергии. Крайне востребованы в высокотехнологичных устройствах мультимедиа и связи: телефонах, планшетных компьютерах, ноутбуках, радиостанциях и т. д. Современный мир сложно представить без источников питания литий-ионного типа.
Принцип действия литиевых (литий-ионных) батарей
Принцип работы заключается в использовании ионов лития, которые связаны молекулами дополнительных металлов. Обычно, в дополнение к литию применяются литийкобальтоксид и графит. При разряде литий-ионного аккумулятора происходит переход ионов от отрицательного электрода (катода) к положительному (аноду) и наоборот при заряде. Схема аккумулятора предполагает наличие разделительного сепаратора между двумя частями элемента, это необходимо для предотвращения самопроизвольного перемещения ионов лития. Когда цепь аккумулятора замкнута и происходит процесс заряда или разряда, ионы преодолевают разделительный сепаратор стремясь к противоположно заряженному электроду.
Рисунок №8. Электрохимическая схема литий-ионного аккумулятора.
Благодаря своей высокой эффективности, литий-ионные аккумуляторы получили бурное развитие и множество подвидов, например, литий-железо-фосфатные аккумуляторы (LiFePO4). Ниже приведена графическая схема работы этого подтипа.
Рисунок №9. Электрохимическая схема процесса разряда и разряда LiFePO4 батареи.
Типы литий-ионных аккумуляторов
Современные литий-ионные аккумуляторы имеют множество подтипов, основная разница которых заключается в составе катода (отрицательно заряженного электрода). Также может изменяться состав анода для полной замены графита или использования графита с добавлением других материалов.
Различные виды литий-ионных аккумуляторов обозначаются по их химическому разложению. Для рядового пользователя это может быть несколько сложно, поэтому каждый тип будет описан максимально подробно, включая его полное название, химическое определение, аббревиатуру и краткое обозначение. Для удобства описания будет использоваться сокращенное название.
-
Литий кобальт оксид (LiCoO2) – Обладает высокой удельной энергией, что делает литий-кобальтовый аккумулятор востребованным в компактных высокотехнологичных устройствах. Катод батареи состоит из оксида кобальта, тогда как анод – из графита. Катод имеет слоистую структуру и во время разряда ионы лития перемещаются от анода к катоду. Недостатком этого типа является относительно короткий срок службы, невысокая термическая стабильность и лимитированная мощность элемента.
Литий-кобальтовые батареи не могут разряжаться и заряжаться током, превосходящим номинальную емкость, поэтому аккумулятор с емкостью 2,4Ач может работать с током 2,4А. Если для заряда будет применяться большая сила тока, то это вызовет перегрев. Оптимальный зарядный ток составляет 0,8C, в данном случае 1,92А. Каждый литий-кобальтовый аккумулятор комплектуется схемой защиты, которая ограничивает заряд и скорость разряда и лимитирует ток на уровне 1C.
На графике (Рис. 10) отражены основные свойства литий-кобальтовых аккумуляторов с точки зрения удельной энергии или мощности, удельная мощность или способность обеспечивать высокий ток, безопасности или шансы воспламенения при высокой нагрузке, рабочая температура окружающей среды, срок службы и циклический ресурс, стоимость.
Рисунок №10. Диаграмма основных свойств LiCoO2 аккумуляторов.
-
Литий Оксид Марганца (LiMn2O4, LMO) – первая информация об использовании лития с марганцевыми шпинелями была опубликована в научных докладах 1983 года. Компания Moli Energy в 1996 году выпустила первые партии аккумуляторов на основе литий-оксид-марганца в качестве материала катода. Такая архитектура формирует трехмерные структуры шпинели, что улучшает поток ионов к электроду, тем самым снижая внутреннее сопротивление и повышая возможные токи заряда. Также преимущество шпинели в термической стабильности и повышенной безопасности, однако циклический ресурс и срок службы ограничен.
Низкое сопротивление обеспечивает возможность быстрого заряда и разряда литий-марганцевого аккумулятора с высоким током до 30А и кратковременно до 50А. Применяется для мощных электроинструментов, медицинского оборудования, а также гибридных и электрических транспортных средств.
Потенциал литий-марганцевых аккумуляторов примерно на 30% ниже по сравнению с литий-кобальтовыми батареями, однако эта технология обладает примерно на 50% лучшими свойствами, чем аккумуляторы на основе никелевых химических компонентов.
-
Литий Оксид Марганца (LiMn2O4, LMO) – первая информация об использовании лития с марганцевыми шпинелями была опубликована в научных докладах 1983 года. Компания Moli Energy в 1996 году выпустила первые партии аккумуляторов на основе литий-оксид-марганца в качестве материала катода. Такая архитектура формирует трехмерные структуры шпинели, что улучшает поток ионов к электроду, тем самым снижая внутреннее сопротивление и повышая возможные токи заряда. Также преимущество шпинели в термической стабильности и повышенной безопасности, однако циклический ресурс и срок службы ограничен.
Низкое сопротивление обеспечивает возможность быстрого заряда и разряда литий-марганцевого аккумулятора с высоким током до 30А и кратковременно до 50А. Применяется для мощных электроинструментов, медицинского оборудования, а также гибридных и электрических транспортных средств.
Потенциал литий-марганцевых аккумуляторов примерно на 30% ниже по сравнению с литий-кобальтовыми батареями, однако эта технология обладает примерно на 50% лучшими свойствами, чем аккумуляторы на основе никелевых химических компонентов.
Гибкость конструкции позволяет инженерам оптимизировать свойства батареи и достичь длительного срока службы, высокой емкости (удельная энергия), возможности обеспечивать максимальный ток (удельная мощность). Например, с длительным сроком эксплуатации типоразмер элемента 18650 имеет емкость 1,1Ач, тогда как элементы, оптимизированные на повышенную емкость, – 1,5Ач, но при этом они имеют меньший срок службы.
На графике (Рис. 12) отраженны не самые впечатляющие характеристики литий-марганцевых аккумуляторов, однако современные разработки позволили существенно повысить эксплуатационных характеристики и сделать этот тип конкурентным и широко применяемым.
Рисунок №11. Диаграмма основных свойств LiMn2O4 аккумуляторов.
Современные аккумуляторы литий-марганцевого типа могут производиться с добавлениями других элементов – литий-никель-марганец-кобальт оксид (NMC), подобная технология существенно продлевает срок службы и повышает показатели удельной энергии. Этот состав привносит лучшие свойства из каждой системы, так называемые LMO (NMC) применяются для большинства электромобилей, таких как Nissan, Chevrolet, BMW и т. д.
-
Литий-Никель-Марганец-Кобальт оксид (LiNiMnCoO2 или NMC) – ведущие производители литий-ионных батарей сосредоточились на сочетании никеля-марганца-кобальта в качестве материалов катода (NMC). Похожий на литий-марганцевый тип, эти аккумуляторы могут быть адаптированы для достижения показателей высокой удельной энергии или высокой удельной мощности, однако, не одновременно. К примеру, элемент NMC типа 18650 в состоянии умеренной нагрузки имеет емкость 2,8Ач и может обеспечить максимальный ток 4-5А; NMC элемент, оптимизированный к параметрам повышенной мощности, имеет всего 2Втч, но может обеспечить непрерывный ток разряда до 20А. Особенность NMC заключается в сочетании никеля и марганца, в качестве примера можно привести поваренную соль, в которой основные ингредиенты натрий и хлорид, которые в отдельности являются токсичными веществами.
Никель известен своей высокой удельной энергией, но низкой стабильностью. Марганец имеет преимущество формирования структуры шпинели и обеспечивает низкое внутреннее сопротивление, но при этом обладает низкой удельной энергией. Комбинируя эти два металла, можно получать оптимальные характеристика NMC аккумулятора для разных режимов эксплуатации.
NMC аккумуляторы прекрасно подходят для электроинструмента, электровелосипедов и других силовых агрегатов. Сочетание материалов катода: треть никеля, марганца и кобальта обеспечивают уникальные свойства, а также снижают стоимость продукта в связи с уменьшением содержания кобальта. Другие подтипы, как NCM, CMN, CNM, MNC и MCN имеют отличное соотношение тройки металлов от 1/3-1/3-1/3. Обычно, точное соотношение держится производителем в секрете.
Рисунок №12. Диаграмма основных свойств LiNiMnCoO2 аккумуляторов.
-
Литий-Железо-Фосфатные (LiFePO4) – в 1996 в университете штата Техас (и другими участниками) был применен фосфат в качестве катодного материала для литиевых аккумуляторов. Литий-фосфат предлагает хорошие электрохимические характеристики с низким сопротивлением. Это стало возможным с нано-фосфатом материала катода. Основными преимуществами являются высокий протекающий ток и длительный срок службы к тому же, хорошая термическая стабильность и повышенная безопасность.
Литий-железо-фосфатные аккумуляторы терпимее к полному разряду и менее подвержены «старению», чем другие литий-ионные системы. Также LFP более устойчивы к перезаряду, но как и в других аккумуляторах литий-ионного типа, перезаряд может вызвать повреждение. LiFePO4 обеспечивает очень стабильное напряжение разряда – 3,2В, это же позволяет использовать всего 4 элемента для создания батареи стандарта 12В, что в свою очередь позволяет эффективно заменять свинцово-кислотные батареи. Литий-железо-фосфатные аккумуляторы не содержат кобальт, это существенно снижает стоимость продукта и делает его более экологически чистым. В процессе разряда обеспечивает высокий ток, а также может быть заряжен номинальным током всего за один час до полной емкости. Эксплуатация при низких температурах окружающей среды снижает производительность, а температура свыше 35ºС – несколько сокращается срок службы, но показатели намного лучше, чем у свинцово-кислотных, никель-кадмиевых или никель-металлогидридных аккумуляторов. Литий-фосфат имеет больший саморазряд, чем другие литий-ионные аккумуляторы, которые могут вызвать потребность балансировки батарейных кабинетов.
Рисунок №13. Диаграмма основных свойств LiFePO4 аккумуляторов.
-
Литий-Никель-Кобальт-Оксид Алюминия (LiNiCoAlO2) – литий-никель-кобальто-оксид алюминиевые батареи (NCA) появились в 1999 году. Этот тип обеспечивает высокую удельную энергию и достаточную удельную мощность, а также длительный срок службы. Однако существуют риски воспламенения, в следствие чего был добавлен алюминий, который обеспечивает более высокую стабильность электрохимических процессов, протекающих в аккумуляторе при высоких токах разряда и заряда.
Рисунок №14. Диаграмма основных свойств LiNiCoAlO2 аккумуляторов.
-
Литий-титанат (Li4Ti5O12) – аккумуляторы с анодами из литий-титаната были известны с 1980-х годов. Катод состоит из графита и имеет сходство с архитектурой типичной литий-металлической батареи. Литий-титанат имеет напряжение элемента 2,4В, может быть быстро заряжен и обеспечивает высокий разрядный ток 10C, который в 10 раз превышает номинальную емкость батареи.
Литий-титанатные аккумуляторы отличаются повышенным циклическим ресурсом по сравнению с другими Li-ion видами батарей. Обладают высокой безопасностью, а также способны работать при низких температурах (до –30ºC) без ощутимого снижения рабочих характеристик.
Недостаток заключается в достаточно высокой стоимости, а также в небольшом показателе удельной энергии, порядка 60-80Втч/кг, что вполне сопоставимо с никель-кадмиевыми аккумуляторами. Области применения: электрические силовые агрегаты и источники бесперебойного питания.
Рисунок №15. Диаграмма основных свойств Li4Ti5O12 аккумуляторов.
-
Литий-полимерные аккумуляторы (Li-pol, Li-polymer, LiPo, LIP, Li-poly) – литий полимерные аккумуляторы отличаются от литий-ионных тем, что в них используется специальный полимерный электролит. Возникший ажиотаж к этому виду батарей с 2000-х годов длится до сегодняшнего времени. Основан он не безосновательно, т. к. при помощи специальных полимеров удалось создать батарею без жидкого или гелеобразного электролита, это дает возможность создавать батареи практически любой формы. Но основная проблема заключается в том, что твердый полимерный электролит обеспечивает плохую проводимость при комнатной температуре, а лучшие свойства демонтирует в разогретом состоянии до 60°С. Все попытки ученых обнаружить решение этой задачи оказали тщетны.
В современных литий-полимерных батареях применяется небольшое количество гелевого электролита для лучшей проводимости при нормальной температуре. А принцип работы построен на одном из описанных выше типов. Самым распространенным является литий-кобальтовый тип с полимерным гелеобразным электролитом, который применяется в большинстве случаев.
Основная разница между литий-ионными аккумуляторами и литий-полимерными заключается в том, что микропористый полимерный электролит заменяется традиционным разделительным сепаратором. Литий-полимер имеет немного больший показатель удельной энергии и дает возможность создавать тонкие элементы, но стоимость на 10-30% выше, чем литий-ионных. Существенная разница есть и в структуре корпуса. Если для литий-полимерных применяется тонкая фольга, которая дается возможность создавать настолько тонкие элементы питания, что они похожи на кредитные карты, то литий-ионные собираются в жестком металлическом корпусе для плотной фиксации электродов.
Рисунок №17. Внешний вид Li-polymer аккумулятора для мобильного телефона.
Характеристики литий-ионных аккумуляторов
В таблице отсутствует максимальная емкость элементов, т. к. технология литий-ионных аккумуляторов не позволяет производить мощные отдельные элементы. Когда необходима высокая емкость или постоянный ток, батареи соединятся параллельно и последовательно при помощи перемычек. Состояние обязательно должна контролировать система батарейного мониторинга. Современные батарейные кабинеты для ИБП и солнечных электростанций на основе литиевых элементов могут достигать напряжения 500-700В постоянного тока с емкостью около 400А/ч, а также емкости 2000 – 3000Ач с напряжением 48 или 96В.
|
Параметр \ Тип |
LiCoO2 |
LiMn2O4 |
LiNiMnCoO2 |
LiFePO4 |
LiNiCoAlO2 |
Li4Ti5O12 |
|
Напряжение элемента, Вольт; |
3.6 |
3.7 |
3.6-3.7 |
3.2 |
3.6 |
2.4 |
|
Оптимальная глубина разряда, %; |
85-90 |
85-90 |
85-90 |
85-90 |
85-90 |
85-90 |
|
Допустимая глубина разряда, %; |
100 |
100 |
100 |
100 |
100 |
100 |
|
Циклический ресурс, D.O.D.=80%; |
700 – 1000 |
1000 – 2000 |
1000 – 2000 |
1000 – 2000 |
1000 – 2000 |
5000 – 8000 |
|
Оптимальная температура, °С; |
+20…+30 |
+20…+30 |
+20…+30 |
+20…+30 |
+20…+30 |
+20…+30 |
|
Диапазон рабочих температур, °С; |
–10 …+60 |
–10 …+45 |
–10 …+55 |
–10 …+60 |
–10 …+55 |
–10 …+45 |
|
Срок службы, лет при +20°С; |
5 – 7 |
10 |
10 |
20 – 25 |
20 – 25 |
18 – 25 |
|
Саморазряд в мес., % |
1 – 2 |
1 – 2 |
1 – 2 |
1 – 2 |
1 – 2 |
1 – 2 |
|
Макс. ток разряда |
1C |
10C/30C 5с |
2C |
25 – 30C |
1C |
10C/30С 5с |
|
Макс. ток заряда |
0,7-1C |
0,7-1C |
0,7-1C |
1C |
0,7C |
1C |
|
Минимальное время заряда, ч |
2 – 3 |
2 – 2.5 |
2 – 3 |
2 – 3 |
2 – 3 |
2 – 3 |
|
Требования к обслуживанию |
нет |
нет |
нет |
нет |
нет |
нет |
|
Уровень стоимости |
высокий |
средний |
средний |
низкий |
средний |
высокий |
Никель-кадмиевые аккумуляторные батареи
Изобретателем является шведский ученый Вальдемар Юнгнер, который запатентовал технологию производства никель кадмиевого типа в 1899 году. D 1990 году возник патентный спор с Эдисоном, который Юнгнер проиграл в силу того, что не владел таким средствами, как его оппонент. Компания «Ackumulator Aktiebolaget Jungner», основанная Вальдемаром, оказалась на грани банкротства, однако, сменив название на «Svenska Ackumulator Aktiebolaget Jungner», предприятие все же продолжило свое развитие. В настоящее время предприятие, основанное разработчиком, носит название «SAFT AB» и производит одни из самых надежных никель-кадмиевых аккумуляторов в мире.
Никель-кадмиевые аккумуляторы относятся к очень долговечному и надежному типу. Существуют обслуживаемые и необслуживаемые модели с емкостью от 5 до 1500Ач. Обычно поставляются в виде сухо-заряженных банок без электролита с номинальным напряжением 1,2В. Несмотря на схожесть конструкции со свинцово-кислотными, никель- кадмиевые батареи имеют ряд существенных преимуществ в виде стабильной работы при температуре от –40°С, возможности выдерживать высокие пусковые токи, а также оптимизированы моделями для быстрого разряда. Ni-Cd батареи устойчивы к глубокому разряду, перезаряду и не требуют моментального заряда как свинцово-кислотный тип. Конструктивно производятся в ударопрочном пластике и хорошо переносят механические повреждения, не боятся вибрации и т.п.
Принцип действия никель-кадмиевых батарей
Щелочные аккумуляторы, электроды которых состоят из гидрата окиси никеля с добавлениями графита, окиси бария и порошкового кадмия. В качестве электролита, как правило, выступает раствор с 20%-ным содержанием калия и добавлением моногидрата лития. Пластины разделены изолирующими сепараторами во избежании замыкания, одна отрицательно заряженная пластина расположена между двумя положительно заряженными.
В процессе разряда никель-кадмиевой батареи происходит взаимодействие между анодом с гидратом окиси никеля и ионами электролита, образуя гидрат закиси никеля. В это же время катод из кадмия образует гидрат окиси кадмия, тем самым создавая разность потенциалов до 1,45В обеспечивая напряжение внутри аккумулятора и во внешней замкнутой цепи.
Процесс заряда никель-кадмиевых аккумуляторов сопровождается окислением активной массы анодов и переходом гидрата закиси никеля в гидрат окиси никеля. Одновременно катод восстанавливается с образованием кадмия.
Достоинством принципа действия никель-кадмиевой батареи является то, что все составляющие, которые образуются в процессе циклов разряда и заряда, почти не растворяются в электролите, а также не вступают в какие-либо побочные реакции.
Рисунок №16. Строение Ni-Cd аккумулятора.
Типы никель-кадмиевых аккумуляторов
В настоящее время батареи Ni-Cd используют чаще всего в промышленности, где требуется обеспечивать питанием разнообразные приложения. Некоторые производители предлагают несколько подвидов никель-кадмиевых аккумуляторов, которые обеспечивают наилучшую работу в определенных режимах:
-
время разряда 1,5 – 5 часов и более – обслуживаемые батареи;
-
время разряда 1,5 – 5 часов и более – необслуживаемые батареи;
-
время разряда 30 – 150 минут – обслуживаемые батареи;
-
время разряда 20 – 45 минут – обслуживаемые батареи;
-
время разряда 3 – 25 минут – обслуживаемые батареи.
Характеристики никель-кадмиевых аккумуляторов
|
Параметр \ Тип |
Никель-кадмиевые / Ni-Cd |
|
Емкость, Ампер/час; |
1 – 1500 |
|
Напряжение элемента, Вольт; |
1,2 |
|
Оптимальная глубина разряда, %; |
60 – 80 |
|
Допустимая глубина разряда, %; |
100 |
|
Циклический ресурс, D.O.D.=80%; |
2300 |
|
Оптимальная температура, °С; |
0 … +20 |
|
Диапазон рабочих температур, °С; |
-50 … +70 |
|
Срок службы, лет при +20°С; |
25 |
|
Саморазряд в мес., % |
4 |
|
Макс. ток разряда |
10 C5 |
|
Макс. ток заряда |
0.4 C5 |
|
Минимальное время заряда, ч |
5 |
|
Требования к обслуживанию |
Малообслуживаемые или необслуживанемые |
|
Уровень стоимости |
средняя (300 – 400$ 100Ач) |
Высокие технические характеристики делают этот тип аккумуляторных батарей очень привлекательным для решения производственных задач, когда требуется высоконадежный источник резервного питания с длительным сроком службы.
Никелево-железные аккумуляторные батареи
Впервые были созданы Вальдемаром Юнгнером в 1899 году, когда он пытался найти более дешевый аналог кадмию в составе никель-кадмиевых батарей. После долгих испытаний Юнгнер отказался от применения железа, т. к. заряд осуществлялся слишком медленно. Несколькими годами позднее, Томас Эдисон создал никель-железный аккумулятор, который осуществлял питание электромобилей «Baker Electric» и «Detroit Electric».
Дешевизна производства позволили никель-железным аккумуляторам стать востребованными в электротранспорте в качестве тяговых батарей, также применяются для электрификации пассажирских вагонов, питания цепей управления. В последние годы о никель-железных аккумуляторах заговорили с новой силой, т. к. они не содержат токсичных элементов вроде свинца, кадмия, кобальта и т. д. В настоящее время некоторые производители продвигают их для систем возобновляемой энергетики.
Принцип действия никелево-железных батарей
Аккумуляция электроэнергии происходит при помощи никель оксида-гидроксида, применяемого в качестве положительных пластин, железа – в качестве отрицательных пластин и жидкого электролита в виде едкого калия. Никелевые стабильные трубки или «карманы» содержат активное вещество
Никелево-железный тип очень надежный, т.к. выдерживает глубокие разряды, частые перезаряды, а также может находится в недозаряженном состоянии, что очень пагубно для свинцово-кислотных батарей.
Характеристики никелево-железных аккумуляторов
|
Параметр \ Тип |
Никель-кадмиевые / Ni-Cd |
|
Емкость, Ампер/час; |
10 – 1000 |
|
Напряжение элемента, Вольт; |
1,2 |
|
Оптимальная глубина разряда, %; |
50 – 80 |
|
Допустимая глубина разряда, %; |
100 |
|
Циклический ресурс, D.O.D.=80%; |
1800 – 2300 |
|
Оптимальная температура, °С; |
+15 … +25 |
|
Диапазон рабочих температур, °С; |
-40 … +60 |
|
Срок службы, лет при +20°С; |
20 |
|
Саморазряд в мес., % |
15 |
|
Макс. ток разряда |
0.25C 5 |
|
Макс. ток заряда |
0.25C 5 |
|
Минимальное время заряда, ч |
12 – 16 |
|
Требования к обслуживанию |
Малообслуживаемые |
|
Уровень стоимости |
средняя, низкая |
Использованные материалы
Исследования компании Boston Consulting Group
Техническая документация ТМ Bosch, Panasonic, EverExceed, Victron Energy, Varta, Leclanché, Envia, Kokam, Samsung, Valence и других.
Как работает аккумулятор – Любопытно
Представьте себе мир без батарей. Все портативные устройства, от которых мы так зависим, были бы настолько ограничены! Мы сможем доставить наши ноутбуки и телефоны так, чтобы их кабели были доступны только для того, чтобы сделать это новое работающее приложение, которое вы только что загрузили на свой телефон, практически бесполезным.
К счастью, батарейки у нас есть. Еще в 150 г. до н.э. в Месопотамии парфянская культура использовала устройство, известное как багдадская батарея, сделанное из медных и железных электродов с уксусом или лимонной кислотой.Археологи считают, что на самом деле это не батареи, а в основном они использовались для религиозных церемоний.
Изобретение батареи в том виде, в котором мы ее знаем, приписывают итальянскому ученому Алессандро Вольта, который собрал первую батарею, чтобы доказать свою точку зрения другому итальянскому ученому Луиджи Гальвани. В 1780 году Гальвани показал, что лапы лягушек, подвешенных на железных или латунных крючках, подергиваются при прикосновении к зонду из другого металла. Он считал, что это было вызвано электричеством из тканей лягушек, и называл это «животным электричеством».
Луиджи Гальвани обнаружил, что лапы лягушек, подвешенных на латунных крючках, дергались, когда их ткнули зондом из другого металла. Он думал, что эта реакция была вызвана «животным электричеством» внутри лягушки. Источник изображения: Луиджи Гальвани / Wikimedia Commons.Вольта, первоначально впечатленный открытиями Гальвани, пришел к выводу, что электрический ток исходит от двух разных типов металла (крючки, на которых висели лягушки, и другой металл зонда) и просто передается через них, а не через них. из тканей лягушек.Он экспериментировал со стопками слоев серебра и цинка, перемежаемых слоями ткани или бумаги, пропитанной соленой водой, и обнаружил, что электрический ток действительно протекает через провод, приложенный к обоим концам стопки.
Батарея Алессандро Вольта: куча цинковых и серебряных листов, перемеженных тканью или бумагой, пропитанной соленой водой. Представьте, что вы используете это для питания вашего телефона. Источник изображения: Луиджи Кьеза / Wikimedia Commons.Volta также обнаружил, что, используя различные металлы в свае, можно увеличить количество напряжения.Он описал свои открытия в письме Джозефу Бэнксу, тогдашнему президенту Лондонского королевского общества, в 1800 году. Это было довольно большое дело (Наполеон был весьма впечатлен!), И его изобретение принесло ему устойчивое признание в честь «вольта». ‘(мера электрического потенциала), названная в его честь.
Я сам, шутя в сторону, поражен тем, как мои старые и новые открытия … чистого и простого электричества, вызванного контактом металлов, могли вызвать такое волнение.Алессандро Вольта
Так что же именно происходило с этими слоями цинка и серебра и с дрожащими лягушачьими лапами?
Химия батареи
Батарея – это устройство, которое накапливает химическую энергию и преобразует ее в электричество.Это известно как электрохимия, а система, лежащая в основе батареи, называется электрохимическим элементом. Батарея может состоять из одного или нескольких (как в оригинальной кучке Вольты) электрохимических ячеек. Каждая электрохимическая ячейка состоит из двух электродов, разделенных электролитом.
Итак, откуда электрохимический элемент получает электричество? Чтобы ответить на этот вопрос, нам нужно знать, что такое электричество. Проще говоря, электричество – это тип энергии, производимый потоком электронов.В электрохимической ячейке электроны образуются в результате химической реакции, которая происходит на одном электроде (подробнее об электродах ниже!), А затем они перетекают на другой электрод, где расходуются. Чтобы понять это правильно, нам нужно внимательнее изучить компоненты клетки и то, как они устроены вместе.
Электроды
Чтобы создать поток электронов, вам нужно где-то, чтобы электроны текли с из , а где-то электроны текли с по .Это электроды ячейки. Электроны текут от одного электрода, называемого анодом (или отрицательным электродом), к другому электроду, называемому катодом (положительный электрод). Как правило, это разные типы металлов или другие химические соединения.
В котле Вольта анодом служил цинк, от которого электроны текли по проволоке (при соединении) с серебром, которое было катодом батареи. Он сложил много этих ячеек вместе, чтобы получилась общая куча, и поднял напряжение.
Но откуда анод вообще берет все эти электроны? И почему они так счастливы, что их отправили в веселый путь к катоду? Все сводится к химии, происходящей внутри клетки.
Нам нужно понять пару химических реакций. На аноде электрод вступает в реакцию с электролитом, в результате чего образуются электроны. Эти электроны накапливаются на аноде. Между тем, на катоде одновременно происходит другая химическая реакция, которая позволяет этому электроду принимать электроны.
Технический химический термин, обозначающий реакцию, которая включает обмен электронами, – это реакция окисления-восстановления, обычно называемая окислительно-восстановительной реакцией. Вся реакция может быть разделена на две половинные реакции, и в случае электрохимической ячейки одна полуреакция происходит на аноде, а другая – на катоде. Уменьшение – это усиление электронов, и это то, что происходит на катоде; мы говорим, что катод восстанавливается во время реакции. Окисление – это потеря электронов, поэтому мы говорим, что анод окисляется.
Каждая из этих реакций имеет определенный стандартный потенциал. Думайте об этой характеристике как о способности / эффективности реакции либо производить, либо поглощать электроны – ее силу в электронном перетягивании каната.
- Стандартные потенциалы для полуреакций
Ниже приведен список половинных реакций, которые включают высвобождение электронов из чистого элемента или химического соединения. Рядом с реакцией указано число (E 0 ), которое сравнивает силу электрохимического потенциала реакции с силой готовности водорода расстаться со своим электроном (если вы посмотрите вниз по списку, вы увидите, что водородная полуреакция имеет нулевое значение E 0 ).E 0 измеряется в вольтах.
Причина, по которой этот список настолько интересен, заключается в том, что если вы выберете две реакции из списка и объедините их в электрохимическую ячейку, значения E 0 скажут вам, в каком направлении будет протекать общая реакция: реакция с более отрицательной реакцией. Значение E 0 отдает свои электроны другой реакции, и это определяет анод и катод вашей ячейки. Разница между двумя значениями E 0 говорит вам об электрохимическом потенциале вашей ячейки, который в основном представляет собой напряжение ячейки.
Итак, если вы возьмете литий и фторид и сумеете объединить их, чтобы сделать элемент батареи, у вас будет самое высокое напряжение, теоретически достижимое для электрохимического элемента. Этот список также объясняет, почему в котле Вольта цинк был анодом, а серебро – катодом: полуреакция цинка имеет более низкое (более отрицательное) значение E 0 (-0,7618), чем полуреакция серебра (0,7996). .
Источник: UC Davis ChemWiki
Любые два проводящих материала, которые вступают в реакцию с разными стандартными потенциалами, могут образовывать электрохимическую ячейку, потому что более сильный из них сможет забирать электроны у более слабого.Но идеальным выбором для анода был бы материал, который вызывает реакцию со значительно более низким (более отрицательным) стандартным потенциалом, чем материал, который вы выбираете для своего катода. В итоге мы получаем электроны, притягивающиеся к катоду от анода (и анод не очень сильно пытается бороться), и, когда у нас есть легкий путь, чтобы добраться туда – проводящий провод, мы можем использовать их энергию для обеспечения электрического питание нашего фонарика, телефона или чего-то еще.
Разница в стандартном потенциале между электродами как бы равна силе, с которой электроны перемещаются между двумя электродами.Это известно как общий электрохимический потенциал ячейки, и он определяет напряжение ячейки. Чем больше разница, тем больше электрохимический потенциал и выше напряжение.
Чтобы увеличить напряжение аккумулятора, у нас есть два варианта. Мы могли бы выбрать для наших электродов другие материалы, которые придадут ячейке больший электрохимический потенциал. Или мы можем сложить несколько ячеек вместе. Когда элементы объединяются определенным образом (последовательно), это оказывает аддитивное влияние на напряжение батареи.По сути, силу, с которой электроны движутся через батарею, можно рассматривать как общую силу, когда они движутся от анода первого элемента на всем пути, сколько бы ячеек ни содержала батарея, к катоду последнего элемента.
Когда элементы объединяются другим способом (параллельно), это увеличивает возможный ток батареи, который можно рассматривать как общее количество электронов, протекающих через элементы, но не ее напряжение.
Электролит
Но электроды – это всего лишь часть батареи.Помните обрывки бумаги Вольты, пропитанные соленой водой? Соленая вода была электролитом, еще одной важной частью картины. Электролит может быть жидкостью, гелем или твердым веществом, но он должен обеспечивать движение заряженных ионов.
Электронов имеют отрицательный заряд, и поскольку мы посылаем поток отрицательных электронов по нашей цепи, нам нужен способ уравновесить это движение заряда. Электролит обеспечивает среду, через которую могут протекать положительные ионы, уравновешивающие заряд.
Поскольку химическая реакция на аноде производит электроны, для поддержания баланса нейтрального заряда на электроде также производится соответствующее количество положительно заряженных ионов. Они не проходят по внешнему проводу (только для электронов!), А попадают в электролит.
В то же время катод должен также уравновешивать отрицательный заряд электронов, которые он принимает, поэтому реакция, которая здесь происходит, должна втягивать положительно заряженные ионы из электролита (альтернативно, он также может высвобождать отрицательно заряженные ионы из электрода в электролит. электролит).
Итак, в то время как внешний провод обеспечивает путь для потока отрицательно заряженных электронов, электролит обеспечивает путь для переноса положительно заряженных ионов, чтобы уравновесить отрицательный поток. Этот поток положительно заряженных ионов так же важен, как и электроны, обеспечивающие электрический ток во внешней цепи, которую мы используем для питания наших устройств. Роль балансировки заряда, которую они выполняют, необходима для поддержания протекания всей реакции.
Так вот, если бы все ионы, высвобожденные в электролит, могли полностью свободно перемещаться через электролит, они в конечном итоге покрыли бы поверхности электродов и забили бы всю систему.Таким образом, в клетке обычно есть какой-то барьер, чтобы этого не произошло.
При использовании аккумулятора возникает ситуация, когда происходит непрерывный поток электронов (через внешнюю цепь) и положительно заряженных ионов (через электролит). Если этот непрерывный поток остановлен – если цепь разомкнута, например, когда ваш фонарик выключен – поток электронов остановлен. Заряды будут накапливаться / накапливаться, и химические реакции, приводящие в движение аккумулятор, прекратятся.
По мере того, как батарея используется и реакции на обоих электродах протекают, возникают новые химические продукты.Эти продукты реакции могут создавать своего рода сопротивление, которое может помешать продолжению реакции с такой же эффективностью. Когда это сопротивление становится слишком большим, реакция замедляется. Электронное перетягивание каната между катодом и анодом также теряет свою силу, и электроны перестают течь. Аккумулятор медленно разряжается.
Зарядка аккумулятора
Некоторые обычные батареи предназначены только для одноразового использования (так называемые первичные или одноразовые батареи).Электроны перемещаются от анода к катоду в одну сторону. Либо их электроды истощаются по мере того, как они выделяют свои положительные или отрицательные ионы в электролит, либо накопление продуктов реакции на электродах препятствует продолжению реакции, и это делается и вытирается пыль. Батарея оказывается в мусорном ведре (или, надеюсь, на переработку, но это уже другая тема Nova).
Но. Изящная вещь в этом потоке ионов и электронов, который имеет место в некоторых типах батарей с соответствующими материалами электродов, заключается в том, что он также может двигаться в обратном направлении, возвращая нашу батарею в исходную точку и давая ей совершенно новую жизнь. .Подобно тому, как батареи изменили способ использования различных электрических устройств, аккумуляторные батареи еще больше изменили полезность этих устройств и их продолжительность жизни.
Когда мы подключаем почти разряженную батарею к внешнему источнику электричества и отправляем энергию обратно в батарею, происходит обратная химическая реакция, которая произошла во время разряда. Это отправляет положительные ионы, выпущенные из анода, в электролит, обратно к аноду, а электроны, которые катод принимает, также обратно к аноду.Возврат как положительных ионов, так и электронов обратно в анод подготавливает систему, так что она снова готова к работе: ваша батарея заряжена.
Однако процесс не идеален. Замена отрицательных и положительных ионов электролита обратно на соответствующий электрод при перезарядке батареи не такая аккуратная и не такая хорошо структурированная, как электрод вначале. Каждый цикл зарядки еще больше ухудшает состояние электродов, а это означает, что батарея со временем теряет производительность, поэтому даже аккумуляторные батареи не могут работать вечно.
В течение нескольких циклов зарядки и разрядки форма кристаллов аккумулятора становится менее упорядоченной. Это усугубляется, когда аккумулятор разряжается / заряжается с высокой скоростью – например, если вы едете на электромобиле с большой скоростью, а не с постоянной скоростью. Высокоскоростное переключение приводит к тому, что кристаллическая структура становится более неупорядоченной, что приводит к менее эффективной батарее.
Эффект памяти и саморазряд
Практически, но не полностью обратимые реакции разряда и перезарядки также способствуют так называемому «эффекту памяти».Когда вы перезаряжаете некоторые типы аккумуляторных батарей, не разрядив их сначала, они «запоминают», где находились в предыдущих циклах разрядки, и не перезаряжаются должным образом.
В некоторых элементах это вызвано тем, как металл и электролит реагируют с образованием соли (и тем, как эта соль затем снова растворяется и металл заменяется на электродах при перезарядке). Мы хотим, чтобы наши клетки имели красивые, однородные, маленькие кристаллы соли, покрывающие идеальную металлическую поверхность, но это не то, что мы получаем в реальном мире! Некоторые кристаллы образуются очень сложно, а некоторые металлы откладываются во время перезарядки, поэтому некоторые типы батарей имеют больший эффект памяти, чем другие.Дефекты в основном зависят от первоначального состояния заряда батареи, температуры, напряжения заряда и тока зарядки. Со временем недостатки в одном цикле зарядки могут вызвать то же самое в следующем цикле зарядки и так далее, и наша батарея накапливает некоторые плохие воспоминания. Эффект памяти силен для некоторых типов элементов, таких как батареи на никелевой основе. Другие типы, такие как литий-ионные, не страдают этой проблемой.
Другой аспект аккумуляторных батарей заключается в том, что химический состав, делающий их перезаряжаемыми, также означает, что они имеют более высокую тенденцию к саморазряду.Это когда внутренние реакции происходят внутри аккумуляторного элемента, даже когда электроды не подключены через внешнюю цепь. Это приводит к тому, что клетка со временем теряет часть своей химической энергии. Высокая скорость саморазряда серьезно ограничивает срок службы аккумуляторов – и приводит к их разрядке во время хранения.
Литий-ионные аккумуляторы в наших мобильных телефонах имеют довольно хорошую скорость саморазряда около 2–3 процентов в месяц, и наши свинцово-кислотные автомобильные аккумуляторы также довольно разумны – они, как правило, теряют 4–6 процентов. месяц.Никелевые батареи теряют около 10–15 процентов своего заряда в месяц, что не очень хорошо, если вы планируете хранить фонарик в течение всего сезона, когда он вам не нужен! Неперезаряжаемая щелочная батарея теряет около 2–3% своего заряда в год.
Напряжение, сила тока, мощность, емкость… в чем разница?
Все эти слова в основном описывают мощность батареи, не так ли? Ну вроде как.Но все они немного разные.
Напряжение = сила, при которой реакция, приводящая в действие аккумулятор, проталкивает электроны через элемент. Это также известно как электрический потенциал и зависит от разницы потенциалов между реакциями, которые происходят на каждом из электродов, то есть от того, насколько сильно катод будет тянуть электроны (через цепь) от анода. Чем выше напряжение, тем больше работы может совершить то же количество электронов.
Ток = количество электронов, которые проходят через любую точку цепи в данный момент времени.Чем выше ток, тем больше работы он может выполнять при том же напряжении. Внутри ячейки ток можно также рассматривать как количество ионов, проходящих через электролит, умноженное на заряд этих ионов.
Мощность = напряжение x ток. Чем выше мощность, тем быстрее батарея может работать – это соотношение показывает, как напряжение и ток важны для определения того, для чего подходит батарея.
Емкость = мощность батареи как функция времени, которая используется для описания продолжительности времени, в течение которого батарея может обеспечивать питание устройства.Аккумулятор большой емкости сможет проработать более длительный период, прежде чем разрядится / разрядится. У некоторых батарей есть небольшая печальная особенность – если вы слишком быстро попытаетесь извлечь из них слишком много энергии, химические реакции не успеют поспеть, и емкость станет меньше! Итак, мы всегда должны быть осторожны, когда говорим о емкости батареи, и помнить, для чего она будет использоваться.
Еще один популярный термин – «плотность энергии». Это количество энергии, которое устройство может удерживать на единицу объема, другими словами, сколько энергии вы получите за свои деньги с точки зрения мощности по сравнению сразмер. С батареей, как правило, чем выше плотность энергии, тем лучше, поскольку это означает, что батарея может быть меньше и компактнее, что всегда является плюсом, когда вам нужно, чтобы она питала то, что вы хотите держать в кармане. Для электромобилей это даже плюс – аккумулятор должен как-то влезать в машину!
Для некоторых приложений, таких как хранение электроэнергии на возобновляемых электростанциях, таких как ветряная или солнечная ферма, высокая плотность энергии не является большой проблемой, поскольку в них, скорее всего, будет достаточно места для хранения батарей.Основная цель такого использования – просто хранить как можно больше электроэнергии, как можно безопаснее и дешевле.
Почему так много типов?
Ряд материалов (раньше это были просто металлы) могут использоваться в качестве электродов в батарее. За прошедшие годы было опробовано много-много различных комбинаций, но лишь немногие из них действительно прошли дистанцию.Но зачем вообще использовать разные комбинации металлов? Если у вас есть пара металлов, которые хорошо работают вместе в качестве электродов, зачем возиться с другими?
Различные материалы имеют разные электрохимические свойства, поэтому они дают разные результаты, когда вы соединяете их в аккумуляторном элементе. Например, некоторые комбинации будут производить высокое напряжение очень быстро, но затем быстро падают, не в состоянии поддерживать это напряжение в течение длительного времени. Это хорошо, если вам нужно произвести, скажем, внезапную вспышку света, такую как вспышка фотоаппарата.
Другие комбинации будут производить только тонкую струйку тока, но они будут поддерживать эту струю на века. Например, нам не нужен большой ток для питания детектора дыма, но мы хотим, чтобы наши детекторы дыма работали долгое время.
Еще одна причина для использования различных комбинаций металлов заключается в том, что часто два или более аккумуляторных элемента необходимо уложить в стопку для получения необходимого напряжения, и оказывается, что некоторые комбинации электродов складываются вместе намного лучше, чем другие комбинации.Например, литий-железо-фосфатные батареи (тип литий-ионных аккумуляторов), используемые в электромобилях, складываются вместе для создания систем высокого напряжения (100 или даже более вольт), но вы никогда не сделаете этого с теми батареями NiCad Walkman, которые имеют горячий!
Наши различные потребности с течением времени привели к разработке огромного количества типов батарей. Чтобы узнать больше о них и о том, что ждет аккумулятор в будущем, ознакомьтесь с другими нашими темами о Nova.
Эта тема является частью нашей серии из четырех статей об аккумуляторах.Для дальнейшего чтения ознакомьтесь с типами аккумуляторов, литий-ионных аккумуляторов и аккумуляторов будущего.| пример | анод (-) | электролит | катод (+) | напряжение |
|---|---|---|---|---|
| свинцово-кислотный | свинец (Pb) | серная кислота (H 2 SO 4 ) | оксид свинца (PbO 2 ) | 2.11 В |
| Никад | гидроксид никеля (Ni (OH) 2 ) | гидроксид калия (КОН) | гидроксид кадмия (Cd (OH) 2 ) | 1,35 В |
| ниф | гидроксид никеля (Ni (OH) 2 ) | гидроксид калия (КОН) | железо (Fe) | 1,2 В |
| низ | гидроксид никеля (Ni (OH) 2 ) | гидроксид калия (КОН) | цинк (Zn) | 1.65 В |
| Металлогидрид никеля | гидроксид никеля (Ni (OH) 2 ) | гидроксид калия (КОН) | интерметаллиды соединения | 1,2 В |
| литий-ионный | углеродистый (C) | солей лития в органическом растворителе † | оксид лития-кобальта (LiCoO 2 ) | 3,6 В |
20.1: Батареи и простые схемы
Батарея – это электрический компонент, который обеспечивает постоянную разность электрических потенциалов (фиксированное напряжение) на своих выводах. Луиджи Гальвани был первым, кто осознал, что определенная комбинация металлов, находящихся в контакте друг с другом, может привести к разнице электрических потенциалов (или, скорее, они могут заставить подергиваться ноги мертвой лягушки, что, как мы теперь понимаем, связано с разностью потенциалов из-за металлов). Фактически Гальвани создал первую «электрохимическую ячейку».Затем Алессандро Вольта объединил несколько из этих ячеек вместе, чтобы сформировать «гальваническую батарею», которую мы теперь назвали бы батареей (батарея, технически, представляет собой комбинацию нескольких ячеек, батарею ячеек, хотя часто используется термин аккумулятор, даже если задействован только один электрический элемент).
Электрохимическая ячейка
Электрический элемент может быть сконструирован из металлов, которые имеют различное сродство к растворению в кислоте. Простая ячейка, аналогичная той, что изначально была сделана Volta, может быть изготовлена с использованием цинка и углерода в качестве «электродов» (Volta использовала серебро вместо углерода) и раствора разбавленной серной кислоты (жидкость называется «электролитом»). как показано на рисунке \ (\ PageIndex {1} \).{2 +} \)). Это оставляет избыток электронов на цинковом электроде, что приводит к отрицательному электрическому заряду. Точно так же положительно заряженные ионы цинка притягивают электроны от углеродного электрода в раствор, оставляя углеродный электрод положительно заряженным. Равновесие достигается очень быстро, поскольку в какой-то момент отрицательный заряд цинкового электрода будет электрически притягивать положительные ионы цинка, предотвращая дальнейшее растворение ионов цинка в растворе. Точно так же, когда углеродный электрод накапливает положительный заряд, этот заряд в конечном итоге предотвратит «прыжок» электронов в раствор.В этот момент между двумя электродами (клеммами) батареи будет фиксированная разность электрических потенциалов.
Если два электрода соединены вместе через резистор, электроны покинут цинковый электрод, пересекут резистор и окажутся на положительном углеродном электроде. Это оставит место для большего количества электронов на цинковом электроде, поэтому больше ионов цинка будет растворяться в растворе. Таким образом, образуется цепь, в которой электрон движется вверх по цинковому электроду, через резистор и обратно вниз по углеродному электроду.В то же время все больше и больше ионов цинка растворяются в электролите, пока цинковый электрод не растворится полностью. На практике ионы цинка проходят через раствор и пластину на углеродный электрод (электроны не совсем «прыгают» в электролит, скорее, это ионы цинка, которые перемещаются в электролите). Поскольку заряд на электродах постоянно пополняется, разность потенциалов между электродами остается постоянной даже при протекании тока.
Электрический элемент перестанет работать, как только цинковый электрод полностью растворится (это то, что происходит, когда ваша батарея разряжена).Обратите внимание, что существует также максимальный ток, который может подавать элемент, который зависит от скорости, с которой цинк может растворяться в электролите и наноситься на углеродный электрод. Если электроды ячейки соединены с резистором с очень низким сопротивлением, результирующий ток будет слишком большим для поддержания разности потенциалов. Большинство электрических элементов работают аналогичным образом, хотя химические реакции могут быть намного сложнее. Иногда химическая реакция обратима; можно использовать другую батарею, чтобы подать отрицательное напряжение на угольный электрод, чтобы обратить реакцию вспять и нанести цинк обратно на цинковый электрод, таким образом «перезарядив батарею» (и преобразовав электрическую энергию обратно в накопленную химическую потенциальную энергию).
Идеальный аккумулятор в цепи
В дальнейшем мы будем использовать термин «батарея» в широком смысле для обозначения устройства (такого как электрический элемент или совокупность элементов), которое может обеспечивать фиксированную разность потенциалов между двумя выводами (или электродами). На рисунке \ (\ PageIndex {2} \) показана принципиальная схема батареи, состоящая из двух (или четырех) вертикальных полос, причем большая полоса указывает на положительный полюс батареи.
Рисунок \ (\ PageIndex {2} \): символы принципиальной схемы, которые можно использовать для батареи.На рисунке \ (\ PageIndex {3} \) показаны символы принципиальной схемы, используемые для резистора (в Северной Америке и Европе используются разные символы).
Рисунок \ (\ PageIndex {3} \): символы принципиальной схемы резистора с использованием североамериканских соглашений (слева) и европейских соглашений (справа).На рисунке \ (\ PageIndex {4} \) показана принципиальная схема очень простой схемы, состоящей из одной батареи \ (9 \ text {V} \), подключенной к резистору \ (2 \ Omega \). При рисовании принципиальной схемы (или создании реальной схемы) каждый соединяет различные компоненты вместе (например,грамм. батареи и резисторы) с отрезками провода с нулевым сопротивлением , даже если на практике провода всегда имеют некоторое сопротивление. Однако, поскольку провода соединены последовательно с резисторами (или другими компонентами, имеющими сопротивление), всегда можно включить сопротивление проводов, добавив его к сопротивлению других компонентов. Например, на рисунке \ (\ PageIndex {4} \), если общее сопротивление проводов равно \ (1 \ Omega \), мы могли бы просто смоделировать схему, как если бы сопротивление резистора было \ (3 \ Omega \) вместо \ (2 \ Omega \).На практике это обычно учитывается при составлении принципиальной схемы (т.е. любые резисторы включают сопротивление подключенных к нему проводов).
Рисунок \ (\ PageIndex {4} \): Простая схема, показывающая батарею \ (9 \ text {V} \) и резистор \ (2 Ом \). Для облегчения анализа цепей мы предлагаем нарисовать «стрелку батареи» над батареями, которая идет от отрицательной клеммы к положительной.Схема на рисунке \ (\ PageIndex {4} \) проста для анализа. В этом случае, какой бы заряд не выходил из одной клеммы батареи, она должна пройти через резистор, а затем войти в другую клемму батареи.Мы всегда используем обычный ток для анализа цепи. Таким образом, мы моделируем схему так, как будто положительные заряды выходят из положительной клеммы батареи, проходят через резистор, а затем входят в отрицательную клемму батареи.
Мы рекомендуем вам всегда рисовать «стрелку батареи» для каждой батареи на принципиальной схеме, чтобы указать направление, в котором увеличивается электрический потенциал, и в каком направлении обычный ток будет выходить из батареи, если простой резистор будет подключен к батарее.В сложных схемах ток не обязательно может течь в том же направлении, что и стрелка батареи, а стрелка батареи упрощает анализ этих цепей. Мы также указываем ток, протекающий в любом проводе схемы, путем рисования стрелки в направлении тока на этом проводе (обозначенном \ (I \) на рисунке \ (\ PageIndex {4} \)).
Полезно подумать о значении электрического потенциала вдоль различных частей цепи, как показано на рисунке \ (\ PageIndex {5} \) для той же цепи, что и на рисунке \ (\ PageIndex {4} \).2R \)), и заряды не «теряют» никакой потенциальной энергии (а значит, и потенциал не может измениться). Единственное место, где заряды могут рассеивать энергию, – это внутри резистора. После того, как заряды пересекли резистор, электрический потенциал в проводе снова остается постоянным, пока они не достигнут другого вывода батареи. Таким образом, в этой простой схеме разность электрических потенциалов на резисторе такая же, как и разность потенциалов на выводах батареи. Это показано цветными областями на рисунке \ (\ PageIndex {5} \).Если мы выберем \ (0 \ text {V} \) для определения на отрицательном выводе батареи, то потенциал будет \ (9 \ text {V} \) всюду в красной области (справа от резистора. ) и \ (0 \ text {V} \) везде в серой области (слева от резистора).
Мы можем применить закон Ома (макроскопическая версия) к резистору и определить ток в цепи, поскольку мы знаем разность потенциалов на резисторе: \ [\ begin {align} \ Delta V & = RI \\ \, следовательно, I & = \ frac {\ Delta V} {R} = \ frac {(9 \ text {V})} {(2 \ Omega)} = 4.5 \ text {A} \ end {align} \]
Полезно думать о схемах с точки зрения энергии. Заряды движутся по цепи, и их потенциальная энергия изменяется, когда они проходят через компоненты, в то время как она остается постоянной, когда они движутся по проводу. Если положительный заряд входит в отрицательную клемму батареи и выходит из положительной клеммы, ее потенциальная энергия увеличивается. Если этот заряд затем попадает в резистор, его потенциальная энергия будет уменьшаться по мере прохождения через резистор, поскольку заряд будет «использовать» свою потенциальную энергию для нагрева резистора.Батареи обеспечивают энергию для «проталкивания» зарядов через резисторы в цепи путем преобразования химической потенциальной энергии в электрическую потенциальную энергию зарядов.
Также полезно провести аналогию с гидродинамикой; аккумулятор можно представить как насос, который непрерывно проталкивает вязкую несжимаемую жидкость через трубу с узким сечением, как показано на рисунке \ (\ PageIndex {6} \). Широкое сечение трубы аналогично проводам без сопротивления, а узкое сечение аналогично резистору.Разница давлений, создаваемая насосом, аналогична напряжению, создаваемому батареей, а скорость потока жидкости аналогична электрическому току. Давление в трубе не падает в широком сечении, если нет сопротивления. Полное падение давления жидкости происходит в узком сечении, так же как напряжение падает только на резисторе.
Рисунок \ (\ PageIndex {4} \), где насос играет роль батареи, а узкая трубка – резистора.Пример \ (\ PageIndex {1} \)
Два резистора типа \ (2 \ Omega \) и \ (4 \ Omega \) соответственно подключены последовательно к батарее \ (12 \ text {V} \).Каков ток через каждый из резисторов и какое напряжение на каждом резисторе?
Решение :
Начнем с создания принципиальной схемы, как на рисунке \ (\ PageIndex {7} \), на которой показаны резисторы, ток, \ (I \), батарея и стрелка батареи. Обратите внимание, что, поскольку это замкнутая цепь только с одним путем, ток через батарею \ (I \) совпадает с током через два резистора.
Рисунок \ (\ PageIndex {7} \): два резистора, соединенных последовательно с батареей.Если мы выберем потенциал на отрицательной стороне батареи равным \ (0 \ text {V} \), то точки \ (a \) и \ (e \) на диаграмме будут иметь потенциал \ (0 \ text {V} \), так как потенциал не может измениться в проводе без сопротивления. Аналогично, точки в \ (b \) и \ (c \) находятся под потенциалом \ (12 \ text {V} \) (относительно точек \ (a \) и \ (e \)). В точке \ (d \), между двумя резисторами, потенциал будет между \ (0 \ text {V} \) и \ (12 \ text {V} \), поскольку потенциал будет «падать» по мере того, как ток проходит через резистор \ (2 \ Omega \).
Самый простой способ определить ток через эту простую схему – объединить два резистора в один эффективный резистор с сопротивлением: \ [\ begin {align} R_ {eff} = (2 \ Omega) + (4 \ Omega) = 6 \ Omega \ end {align} \], чтобы схему можно было упростить до схемы, показанной на рисунке \ (\ PageIndex {8} \):
Рисунки \ (\ PageIndex {7} \) объединены последовательно для упрощения схемы.Разность потенциалов на эффективном резисторе такая же, как и на батарее (между точками \ (e \) и \ (c \)), так что закон Ома может быть применен к эффективному резистору для определения тока, который проходит через него. : \ [\ begin {align} \ Delta V & = R_ {eff} I \\ \, следовательно, I & = \ frac {\ Delta V} {R_ {eff}} = \ frac {(12 \ text {V})} {(6 \ Omega)} = 2 \ text {A} \ end {align} \] Это тот же ток, который проходит через каждый отдельный резистор, поскольку он такой же, как ток, проходящий через батарею.Возвращаясь к полной схеме (рисунок \ (\ PageIndex {7} \)), теперь мы можем использовать закон Ома для вычисления падения напряжения на каждом резисторе, так как мы знаем ток через каждый резистор. Напряжение на резисторе \ (2 \ Omega \) определяется следующим образом: \ [\ begin {align} \ Delta V_ {2 \ Omega} = RI = (2 \ Omega) (2 \ text {A}) = 4 \ текст {V} \ end {align} \], а напряжение на резисторе \ (4 \ Omega \) задается следующим образом: \ [\ begin {align} \ Delta V_ {4 \ Omega} = RI = (4 \ Omega ) (2 \ text {A}) = 8 \ text {V} \ end {align} \] Обратите внимание, что сумма этих двух напряжений равна увеличению напряжения на батарее за счет сохранения энергии.Рассмотрите электрический потенциал в различных точках на рисунке \ (\ PageIndex {7} \), когда вы двигаетесь по часовой стрелке по петле, начиная с точки \ (a \). Если электрический потенциал определяется как \ (0 \ text {V} \) на отрицательном конце батареи (точки \ (a \) и \ (e \)), потенциал в точке \ (d \) ( между резисторами) – это потенциал в точке \ (e \) плюс разность потенциалов на резисторе \ (4 \ Omega \): \ [\ begin {align} V_d = V_e + \ Delta V_ {4 \ Omega} = (0 \ text {V}) + (\ Delta V_ {4 \ Omega}) = 8 \ text {V} \ end {align} \] Если мы затем добавим разность потенциалов на резисторе \ (2 \ Omega \) к потенциал в точке \ (d \), мы обнаруживаем, что потенциал в точке \ (c \) равен \ (V_c = V_d + \ Delta V_ {2 \ Omega} = 12 \ text {V} \), как и ожидалось, поскольку это соответствует потенциалу на плюсовой клемме аккумуляторной батареи.
Обсуждение:
В этом примере мы показали, как можно смоделировать схему, объединив резисторы вместе в эффективные резисторы, чтобы упростить схему. Мы также показали, как разность потенциалов между различными компонентами в цепи должна составлять в сумме ноль (падение напряжения на резисторах должно суммироваться с увеличением напряжения на батарее).
Упражнение \ (\ PageIndex {1} \)
Какое напряжение на комбинации батареи \ (3 \ text {V} \), соединенной последовательно с батареей \ (6 \ text {V} \), где отрицательный вывод \ (6 \ text { V} \) батарея обращена к положительному полюсу батареи \ (3 \ text {V} \)?
- \ (9 \ text {V} \).
- \ (6 \ text {V} \).
- \ (3 \ text {V} \).
- \ (0 \ text {V} \).
- Ответ
Настоящая батарея в цепи
До сих пор мы моделировали батареи как «идеальные» устройства, обеспечивающие фиксированную разность потенциалов. На самом деле при этом не учитывается тот факт, что материалы, из которых изготовлена батарея, сами обладают сопротивлением. Например, если электроны хотят покинуть цинковый стержень в электрическом элементе, показанном на рисунке \ (\ PageIndex {1} \), они потеряют некоторую энергию при прохождении через цинк.Таким образом, при моделировании реальной батареи в цепи важно учитывать ее «внутреннее сопротивление» в виде резистора, включенного последовательно с разностью потенциалов. Это проиллюстрировано на рисунке \ (\ PageIndex {9} \), на котором показаны два вывода реальной батареи, идеальной батареи (с фиксированной разностью потенциалов \ (\ Delta V_ {ideal} \)) и ее внутреннего сопротивление, \ (r \) (которое можно нарисовать с любой стороны батареи).
Рисунок \ (\ PageIndex {9} \): Модель реальной батареи, показывающая идеальную батарею последовательно с резистором для моделирования внутреннего сопротивления батареи.Важно отметить, что разность потенциалов на выводах реальной батареи равна разности потенциалов на идеальной батарее только при отсутствии тока, протекающего через батарею . Если есть ток \ (I \), протекающий через внутреннее сопротивление, электрический потенциал уменьшится на величину \ (Ir \) на внутреннем сопротивлении, и напряжение на реальных выводах будет \ (\ Delta V_ {идеал} -Ир \).
Пример \ (\ PageIndex {2} \)
Когда к реальной батарее не подключено сопротивление, измеренная разность потенциалов на ее выводах составляет \ (6 \ text {V} \).Когда к батарее подключен резистор \ (R = 2 \ Omega \), через резистор измеряется ток \ (2 \ text {A} \). Какое внутреннее сопротивление \ (r \) батареи и какое напряжение на ее выводах, когда подключен резистор \ (R = 2 \ Omega \)?
Решение :
Настоящая батарея может быть смоделирована как идеальная батарея с разностью потенциалов \ (\ Delta V_ {ideal} \), соединенная последовательно с внутренним сопротивлением \ (r \). Хотя нам неизвестно значение внутреннего сопротивления, нам говорят, что разность потенциалов на выводах реальной батареи составляет \ (6 \ text {V} \) , когда через нее не течет ток .Поскольку через внутреннее сопротивление не протекает ток, напряжение на внутреннем сопротивлении не падает, а напряжение на выводах реальной батареи (например, рисунок \ (\ PageIndex {9} \)) должно быть равным напряжению на клеммы идеальной батареи, так что \ (\ Delta V_ {ideal} = 6 \ text {V} \).
Имея эту информацию, мы можем составить принципиальную схему для случая, когда резистор \ (2 \ Omega \) подключен к клеммам реальной батареи, как на рисунке \ (\ PageIndex {10} \).
Рисунок \ (\ PageIndex {10} \): Схема, показывающая настоящую батарею (с внутренним сопротивлением \ (r \)) последовательно с резистором.Клеммы реальной батареи расположены в точках \ (a \) и \ (c \) диаграммы, а клеммы идеальной батареи соответствуют точкам \ (a \) и \ (b \). Когда через внутренний резистор \ (r \) не течет ток, на этом резисторе нет падения напряжения, и потенциал в точке \ (b \) будет равен потенциалу в точке \ (c \), как мы утверждали выше.
Схема на рисунке \ (\ PageIndex {10} \) теперь идентична схеме, проанализированной в примере 20 .1.1 , и с ним можно поступить так же. Мы можем последовательно соединить резистор \ (2 \ Omega \) с внутренним сопротивлением \ (r \), чтобы получить эффективный резистор \ (R_ {eff} = r + R \). Падение напряжения на эффективном резисторе будет таким же, как разность потенциалов на идеальной батарее, и мы можем использовать закон Ома, чтобы найти внутреннее сопротивление, \ (r \): \ [\ begin {align} \ Delta V_ {ideal} & = R_ {eff} I = (r + R) I \\ \ поэтому r & = \ frac {\ Delta V_ {ideal}} {I} -R = \ frac {(6 \ text {V} )} {(2 \ text {A})} – (2 \ Omega) = 1 \ Omega \ end {align} \] Теперь, когда мы знаем внутреннее сопротивление, мы можем определить падение напряжения на внутреннем резисторе, используя Закон: \ [\ begin {align} \ Delta V_r = rI = (1 \ Omega) (2 \ text {A}) = 2 \ text {V} \ end {align} \] Падение напряжения на реальных клеммах батарея (между точками \ (a \) и \ (c \)), таким образом, задается следующим образом: \ [\ begin {align} \ Delta V_ {real} = \ Delta V_ {ideal} – \ Delta V_r = (6 \ text {V}) – (2 \ text {V}) = 4 \ text {V} \ end {align} \] Опять же, вы можете убедиться, что падение напряжения на двух резисторах будет суммироваться с общим падением напряжения на клеммы идеального аккумулятора.
Обсуждение:
Моделирование реальных батарей не так уж отличается от моделирования идеальных батарей, поскольку в схему нужно только включить внутреннее сопротивление. Ключевое отличие от настоящей батареи заключается в том, что напряжение на ее реальных клеммах зависит от того, что подключено к батарее. В приведенном выше примере батарея имеет напряжение \ (6 \ text {V} \) на ее (реальных) выводах, когда ничего не подключено, но напряжение падает до \ (4 \ text {V} \), когда \ Подключен резистор (2 \ Omega \).
Упражнение \ (\ PageIndex {2} \)
Предположим, вы хотите измерить идеальное напряжение реальной батареи, подключив измерительное устройство (вольтметр) к ее клеммам. Чтобы получить наиболее точные показания, следует ли выбирать вольтметр с высоким сопротивлением или вольтметр с низким сопротивлением?
- Высокое сопротивление.
- Низкое сопротивление.
- Не имеет значения, имеет ли вольтметр высокое или низкое сопротивление.
- Ответ
Аккумуляторы
| Известный углеродно-цинковый элемент или элемент Лехланша был изобретен в 1866 году и был наиболее распространенным маленьким аккумулятором на протяжении большей части 20-го века, пока его не вытеснили щелочные элементы.Окисление на цинковом электроде (аноде) происходит просто и аналогично окислению в других ячейках, таких как ячейка Даниэля. В других реакциях участвуют MnO 2 , который содержится рядом с углеродным центральным стержнем, и NH 4 Cl и ZnCl 2 , которые составляют основную массу пасты между катодом и анодом. |
Химические реакции в этой ячейке могут быть приблизительно
2NH 4 + (водный) + 2MnO 2 (s) + 2e – -> Mn 2 O 3 (s) + H 2 O (l) + 2NH 3 (водн.) |
Часть сложности этой реакции связана с тем фактом, что восстановление иона аммония дает два газообразных продукта.
2NH 4 + (водн.) + 2e – -> 2NH 3 (г) + H 2 (г)
, который необходимо абсорбировать, чтобы предотвратить повышение давления газа.Это достигается двумя дополнительными реакциями в пастообразном электролите. Хлорид цинка реагирует с аммиаком с образованием твердого хлорида цинка и аммония, а диоксид марганца реагирует с водородом с образованием твердого триоксида диманганца плюс вода (Hewitt).
ZnCl 2 (водн.) + 2NH 3 (г) -> Zn (NH 3 ) 2 Cl 2 (т)
2MnO 2 (т) + H 2 (г) -> Mn 2 O 3 (т) + H 2 O (л)
Напряжение этой ячейки изначально около 1.5 вольт, но уменьшается по мере забора энергии из элемента. Он также имеет короткий срок хранения и быстро портится в холодную погоду. Окисление цинковой стенки в конечном итоге приводит к вытеканию содержимого, поэтому такие батареи не следует оставлять в электрическом оборудовании на длительное время. Хотя эти батареи имеют долгую историю использования, их применение сокращается, поскольку некоторые из их проблем решаются в щелочных батареях.
Что такое аккумулятор? – learn.sparkfun.com
Добавлено в избранное Любимый 22Введение
Батареи представляют собой совокупность одной или нескольких ячеек, химические реакции которых создают поток электронов в цепи. Все батареи состоят из трех основных компонентов: анода (сторона «-»), катода (сторона «+») и какого-то электролита (вещество, которое химически реагирует с анодом и катодом).
Когда анод и катод батареи подключены к цепи, между анодом и электролитом происходит химическая реакция.Эта реакция заставляет электроны проходить через цепь и возвращаться к катоду, где происходит другая химическая реакция. Когда материал катода или анода расходуется или больше не может быть использован в реакции, батарея не может производить электричество. В этот момент ваша батарея «разряжена».
Батареи, которые необходимо выбросить после использования, известны как первичные батареи . Батареи, которые можно перезаряжать, называются вторичными батареями .
Литий-полимерные батареи, например, заряжаемые
Без батарей ваш квадрокоптер пришлось бы привязать к стене, вам пришлось бы вручную заводить машину, а ваш контроллер Xbox должен был бы быть постоянно подключен к розетке (как в старые добрые времена).Батареи позволяют хранить потенциальную электрическую энергию в переносном контейнере.
Батареи бывают разных форм, размеров и химического состава.
Изобретение современной батареи часто приписывают Алессандро Вольта. На самом деле все началось с удивительной аварии, связанной с рассечением лягушки.
Что вы узнаете
В этом руководстве будут подробно рассмотрены следующие темы:
- Как были изобретены батарейки
- Из каких частей состоит аккумулятор
- Как работает аккумулятор
- Общие термины, используемые для описания батарей
- Различные способы использования батарей в схемах
Рекомендуемая литература
Есть несколько концепций, с которыми вы, возможно, захотите ознакомиться перед тем, как начать читать это руководство:
Хотите изучить различные батареи?
Мы вас прикрыли!
Щелочная батарея 9 В
В наличии PRT-10218Это ваши стандартные щелочные батарейки на 9 вольт от Rayovac.Даже не думайте пытаться перезарядить их. Используйте их с…
1История
Термин Батарея
Исторически, слово «батарея» использовалось для описания «серии подобных объектов, сгруппированных вместе для выполнения определенной функции», как в артиллерийской батарее. В 1749 году Бенджамин Франклин впервые использовал этот термин для описания серии конденсаторов, которые он соединил вместе для своих экспериментов с электричеством.Позже этот термин будет использоваться для любых электрохимических ячеек, связанных вместе с целью обеспечения электроэнергии.
Батарея «конденсаторов» Лейденской банки, соединенная вместе(Изображение любезно предоставлено Альвинруном из Wikimedia Commons)
Изобретение батареи
В один роковой день 1780 года итальянский физик, врач, биолог и философ Луиджи Гальвани рассекал лягушку, прикрепленную к медному крючку. Когда он коснулся лягушачьей лапы железным отростком, нога дернулась.Гальвани предположил, что энергия исходит от самой ноги, но его коллега-ученый Алессандро Вольта считал иначе.
Вольта выдвинул гипотезу, что импульсы лягушачьей лапки на самом деле были вызваны различными металлами, пропитанными жидкостью. Он повторил эксперимент, используя ткань, пропитанную рассолом, вместо трупа лягушки, что привело к аналогичному напряжению. Вольта опубликовал свои открытия в 1791 году, а позже создал первую батарею, гальваническую батарею, в 1800 году.
Гальваническая свая состояла из пакета цинковых и медных пластин, разделенных тканью, пропитанной рассолом
СтопкаVolta страдала от двух основных проблем: из-за ее веса электролит вытек из ткани, а особые химические свойства компонентов привели к очень короткому сроку службы (около часа).Следующие двести лет уйдут на совершенствование конструкции Вольты и решение этих проблем.
Исправления в гальванической куче
Уильям Круикшанк из Шотландии решил проблему утечки, положив гальваническую батарею на бок, чтобы сформировать «желобную батарею».
Лотковая батарея решила проблему утечки гальванической сваи
Вторая проблема, короткий срок службы, была вызвана разложением цинка из-за примесей и скоплением пузырьков водорода на меди.В 1835 году Уильям Стерджен обнаружил, что обработка цинка ртутью предотвратит разложение.
Британский химик Джон Фредерик Дэниелл использовал второй электролит, который вступал в реакцию с водородом, предотвращая накопление на медном катоде. Батарея Даниэля с двумя электролитами, известная как «ячейка Даниэля», станет очень популярным решением для обеспечения энергией зарождающихся телеграфных сетей.
Коллекция клеток Даниэля из 1836 г.
Первая аккумуляторная батарея
В 1859 году французский физик Гастон Планте создал батарею из двух прокатанных листов свинца, погруженных в серную кислоту.Путем реверсирования электрического тока через батарею химический состав возвращается в исходное состояние, создавая таким образом первую перезаряжаемую батарею.
Позже, в 1881 году, Камилла Альфонс Фор улучшила конструкцию Планте, превратив листы свинца в пластины. Эта новая конструкция упростила производство аккумуляторов, а свинцово-кислотные аккумуляторы получили широкое распространение в автомобилях.
-> Дизайн обычного «автомобильного аккумулятора» существует уже более 100 лет
(Изображение любезно предоставлено Эмилианом Робертом Виколом из Wikimedia Commons) <-
Сухая камера
Вплоть до конца 1800-х годов электролит в батареях был в жидком состоянии.Это сделало транспортировку аккумуляторов очень осторожным делом, и большинство аккумуляторов никогда не предназначались для перемещения после подключения к цепи.
В 1866 году Жорж Лекланше создал батарею с цинковым анодом, катодом из диоксида марганца и раствором хлорида аммония в качестве электролита. Хотя электролит в элементе Лекланше был все еще жидким, химический состав батареи оказался важным шагом для изобретения сухого элемента.
Карл Гасснер придумал, как создать электролитную пасту из хлорида аммония и гипса.Он запатентовал новую батарею с «сухими элементами» в 1886 году в Германии.
Эти новые сухие элементы, обычно называемые «угольно-цинковыми батареями», производились массово и пользовались огромной популярностью до конца 1950-х годов. Хотя углерод не используется в химической реакции, он играет важную роль в качестве электрического проводника в углеродно-цинковой батарее.
-> 3V угольно-цинковая батарея 1960-х годов
(Изображение любезно предоставлено PhFabre из Wikimedia Commons) <-
В 1950-х годах Льюис Урри, Пол Марсал и Карл Кордеш из компании Union Carbide (позже известной как «Eveready», а затем «Energizer») заменили электролит хлористого аммония щелочным веществом на основе химического состава батареи, сформулированного Вальдемаром. Юнгнер в 1899 году.Щелочные батареи с сухими элементами могут содержать больше энергии, чем угольно-цинковые батареи того же размера, и имеют более длительный срок хранения.
Щелочные батареи приобрели популярность в 1960-х годах, обогнали угольно-цинковые батареи и с тех пор стали стандартными первичными элементами для потребительского использования.
-> Щелочные батареи бывают разных форм и размеров
(Изображение любезно предоставлено Aney ~ Commonswiki из Wikimedia Commons) <-
Аккумуляторы 20-го века
В 1970-х годах компания COMSAT разработала никель-водородную батарею для использования в спутниках связи.Эти батареи хранят водород в газообразной форме под давлением. Многие искусственные спутники, такие как Международная космическая станция, по-прежнему используют никель-водородные батареи.
Исследования нескольких компаний с конца 1960-х годов привели к созданию никель-металлгидридной (NiMH) батареи. NiMH батареи были выпущены на потребительский рынок в 1989 году и стали более дешевой альтернативой никель-водородным аккумуляторным элементам меньшего размера.
Компания Asahi Chemical из Японии построила первую литий-ионную батарею в 1985 году, а Sony создала первую коммерческую литий-ионную батарею в 1991 году.В конце 1990-х годов был создан мягкий гибкий корпус для литий-ионных аккумуляторов, в результате чего появилась «литий-полимерная» или «LiPo» батарея.
Химические реакции в литий-полимерной батарее практически такие же, как и в литий-ионной батарее
Очевидно, что было изобретено, произведено и устарело гораздо больше химикатов батарей. Если вы хотите узнать больше о современных и популярных технологиях аккумуляторов, ознакомьтесь с нашим руководством по технологиям аккумуляторов.
Компоненты
Батареисостоят из трех основных компонентов: анода , катода и электролита . Сепаратор часто используется для предотвращения соприкосновения анода и катода, если электролита недостаточно. Для хранения этих компонентов аккумуляторы обычно имеют какой-то кожух .
Хорошо, большинство аккумуляторов на самом деле не разделены на три равные части, но идею вы поняли.Лучшее поперечное сечение щелочной ячейки можно найти в Википедии.И анод, и катод относятся к типу электродов . Электроды – это проводники, через которые электричество входит или выходит из компонента в цепи.
Анод
Электроны выходят из анода в устройстве, подключенном к цепи. Это означает, что обычный «ток» течет в анод.
На аккумуляторах анод обозначен как отрицательная (-) клемма
В батарее химическая реакция между анодом и электролитом вызывает накопление электронов на аноде.Эти электроны хотят двигаться к катоду, но не могут пройти через электролит или сепаратор.
Катод
Электроны текут в катод в устройстве, подключенном к цепи. Это означает, что обычный «ток» течет из катода.
На батареях катод помечен как положительный (+) вывод
В батареях в химической реакции внутри катода или вокруг него используются электроны, образующиеся на аноде.Электроны могут попасть на катод только через цепь, внешнюю по отношению к батарее.
Электролит
Электролит – это вещество, часто жидкость или гель, которое способно переносить ионы между химическими реакциями, происходящими на аноде и катоде. Электролит также препятствует потоку электронов между анодом и катодом, так что электроны легче проходят через внешнюю цепь, чем через электролит.
-> Щелочные батареи могут протекать из своего электролита, гидроксида калия, если подвергаются воздействию высоких температур или обратного напряжения
(Изображение любезно предоставлено Вильямом Дэвисом из Wikimedia Commons) <-
Электролит имеет решающее значение в работе аккумулятора.Поскольку электроны не могут проходить через него, они вынуждены проходить через электрические проводники в виде цепи, соединяющей анод с катодом.
Сепаратор
Сепараторы представляют собой пористые материалы, которые предотвращают соприкосновение анода и катода, что может вызвать короткое замыкание в батарее. Сепараторы могут быть изготовлены из различных материалов, включая хлопок, нейлон, полиэстер, картон и синтетические полимерные пленки. Сепараторы не вступают в химическую реакцию ни с анодом, ни с катодом, ни с электролитом.
В гальванической куче использовалась ткань или картон (разделитель), пропитанные рассолом (электролитом), чтобы электроды разнесены.
Ионы в электролите могут быть положительно заряженными, отрицательно заряженными и иметь различные размеры. Могут быть изготовлены специальные сепараторы, которые пропускают одни ионы, но не пропускают другие.
Кожух
Большинству батарей требуется способ удерживать химические компоненты. Кожухи, также известные как «кожухи» или «оболочки», представляют собой просто механические конструкции, предназначенные для удержания внутренних компонентов батареи.
Свинцово-кислотный аккумулятор в пластиковом корпусе
Корпуса батареймогут быть изготовлены практически из чего угодно: из пластика, стали, чехлов из мягкого полимерного ламината и так далее. В некоторых батареях используется токопроводящий стальной кожух, который электрически соединен с одним из электродов. В случае обычного щелочного элемента AA стальной корпус соединен с катодом.
Эксплуатация
Батареи обычно требуют нескольких химических реакций для работы.По крайней мере, одна реакция происходит внутри или вокруг анода, и одна или несколько реакций происходят внутри или вокруг катода. Во всех случаях реакция на аноде производит дополнительные электроны в процессе, называемом окислением , а реакция на катоде использует дополнительные электроны во время процесса, известного как восстановление .
Когда переключатель замкнут, цепь замыкается, и электроны могут течь от анода к катоду. Эти электроны активируют химические реакции на аноде и катоде.
По сути, мы разделяем определенный вид химической реакции, реакцию окисления-восстановления или окислительно-восстановительную реакцию, на две отдельные части. При переносе электронов между химическими веществами происходят окислительно-восстановительные реакции. Мы можем использовать движение электронов в этой реакции, чтобы они выходили за пределы батареи и питали нашу цепь.
Анодное окисление
Эта первая часть окислительно-восстановительной реакции, окисление, происходит между анодом и электролитом и производит электроны (обозначенные как e – ).
В некоторых реакциях окисления образуются ионы, например, в литий-ионной батарее. В других химических реакциях расходуются ионы, как в обычных щелочных батареях. В любом случае ионы могут свободно проходить через электролит, а электроны – нет.
Катодное восстановление
Другая половина окислительно-восстановительной реакции, восстановление, происходит в катоде или рядом с ним. Электроны, образующиеся в результате реакции окисления, расходуются во время восстановления.
В некоторых случаях, например, в литий-ионных батареях, положительно заряженные ионы лития, образующиеся во время реакции окисления, расходуются во время восстановления.В других случаях, например, в щелочных батареях, во время восстановления образуются отрицательно заряженные ионы.
Электронный поток
В большинстве батарей некоторые или все химические реакции могут происходить, даже если батарея не подключена к цепи. Эти реакции могут повлиять на срок годности батареи.
По большей части, реакции будут происходить с полной силой только тогда, когда между анодом и катодом замыкается электрически проводящая цепь. Чем меньше сопротивление между анодом и катодом, тем больше электронов может течь и тем быстрее протекают химические реакции.
Короткое замыкание в аккумуляторе (в данном случае даже случайное) может быть опасным. Известно, что литий-ионные батареи перегреваются и даже задымляются или загораются при коротком замыкании.
Мы можем пропускать эти движущиеся электроны через различные электрические компоненты, известные как «нагрузка», для выполнения чего-то полезного. В анимационном ролике в начале этого раздела мы зажигаем виртуальную лампочку движущимися электронами.
Батарея разряжена
Химические вещества в батарее в конечном итоге достигают состояния равновесия. В этом состоянии химические вещества больше не будут реагировать, и в результате аккумулятор больше не будет генерировать электрический ток. На данный момент аккумулятор считается «мертвым».
Первичные элементы необходимо утилизировать, когда батарея разряжена. Вторичные элементы можно перезаряжать, и это достигается путем подачи через батарею обратного электрического тока.Перезарядка происходит, когда химические вещества выполняют еще одну серию реакций, чтобы вернуть их в исходное состояние.
Терминология
Люди часто используют общий набор терминов, говоря о напряжении батареи, емкости, возможности источника тока и так далее.
Ячейка
Элемент – это один анод и катод, разделенные электролитом, используемым для выработки напряжения и тока. Батарея может состоять из одной или нескольких ячеек.Например, одна батарея AA – это одна ячейка. Автомобильные аккумуляторы содержат шесть ячеек по 2,1 В.
Обычная 9-вольтовая батарея содержит шесть щелочных элементов по 1,5 В, установленных друг над другом
Первичный
Первичные клетки содержат химический состав, который нельзя обратить вспять. В результате аккумулятор необходимо выбрасывать после того, как он разрядился.
Среднее
Вторичные элементы можно перезаряжать, и их химический состав возвращается в исходное состояние.Эти элементы, также известные как «перезаряжаемые батареи», можно использовать много раз.
Номинальное напряжение
Номинальное напряжение аккумулятора – это напряжение, указанное производителем.
Например, щелочные батареи типа AA указаны как имеющие напряжение 1,5 В. В этой статье Mad Scientist Hut показано, что их испытанные щелочные батареи начинаются с напряжения около 1,55 В, а затем медленно теряют напряжение по мере разряда. В этом примере номинальное напряжение «1,5 В» относится к максимальному или пусковому напряжению батареи.
Этот аккумулятор Storm для квадрокоптеров показывает кривую разряда для их LiPo-элементов, начиная с 4,2 В и снижаясь до 2,8 В по мере разряда. Номинальное напряжение, указанное для большинства литий-ионных и LiPo-элементов, составляет 3,7 В. В этом случае номинальное напряжение «3,7 В» относится к среднему напряжению аккумулятора в течение его цикла разряда.
Вместимость
Емкость аккумулятора – это величина электрического заряда, который он может доставить при определенном напряжении. Большинство батарей рассчитаны на ампер-часы (Ач) или миллиампер-часы (мАч).
Этот LiPo аккумулятор рассчитан на 1000 мАч, что означает, что он может обеспечить 1 ампер в течение 1 часа, прежде чем он будет считаться разряженным.
Большинство графиков разряда батареи показывают зависимость напряжения батареи от емкости, например, эти тесты батареи AA, проведенные PowerStream. Чтобы выяснить, достаточно ли емкости аккумулятора для питания вашей схемы, найдите самое низкое допустимое напряжение и найдите соответствующий номинал мАч или Ач.
C-скорость
Многие батареи, особенно мощные литий-ионные, обозначают ток разряда как “C-Rate”, чтобы более четко определить характеристики батареи.C-Rate – это скорость разряда относительно максимальной емкости аккумулятора.
1С – это сила тока, необходимая для разрядки аккумулятора за 1 час. Например, аккумулятор емкостью 400 мАч, обеспечивающий ток 1С, будет обеспечивать 400 мА. 5C для той же батареи будет 2 A.
Большинство батарей теряют емкость при более высоком потреблении тока. Например, этот график информации о продукте от Chargery показывает, что их LiPo-элемент имеет меньше мАч при более высоких показателях C-Rates.
ПРИМЕЧАНИЕ: Общий совет гласит, что вы должны заряжать LiPo батареи при 1С или меньше.
MIT предлагает фантастическое руководство по спецификациям и терминологии аккумуляторов, которое идет намного дальше этого обзора.
Использование
Однокамерный
Некоторые схемы могут питаться от одного элемента, но убедитесь, что батарея может обеспечивать достаточное напряжение и ток.
Этот экран для фотонной батареи питается от одного элемента LiPoЕсли напряжение слишком высокое или слишком низкое для вашей схемы, вам, вероятно, понадобится преобразователь постоянного тока в постоянный.
серии
Чтобы увеличить напряжение между выводами батареи, вы можете расположить элементы последовательно. Последовательность означает штабелирование ячеек встык, соединение анода одного с катодом следующего.
Последовательно соединяя батареи, вы увеличиваете общее напряжение. Сложите напряжение всех ячеек, чтобы определить рабочее напряжение. Емкость остается прежней.
В этом примере четыре ячейки 1,5 В соединены последовательно.Напряжение на нагрузке составляет 6 В, а общий набор аккумуляторов имеет емкость 2000 мАч.
В большинстве бытовых электронных устройств, в которых используются щелочные батареи, батареи устанавливаются последовательно. Например, этот держатель батареек 2x AA может поднять номинальное напряжение до 3 В для проекта.
ПРИМЕЧАНИЕ: Если вы заряжаете литий-ионные или литий-полимерные батареи последовательно, вам необходимо обязательно использовать специальные схемы, известные как «балансировщик», чтобы гарантировать равномерное напряжение между элементами.Некоторые зарядные устройства, такие как это, имеют балансиры для безопасной зарядки.Параллельный
Если напряжение одного элемента соответствует нагрузке, вы можете добавить батареи параллельно, чтобы увеличить емкость. Обратите внимание, что это также означает увеличение доступного тока (C-Rate).
Будьте осторожны при параллельном подключении аккумуляторов! Все элементы должны иметь одинаковое номинальное напряжение и одинаковый уровень заряда. В случае разницы в напряжении может произойти короткое замыкание, что приведет к перегреву и, возможно, возгоранию.
В этом примере четыре ячейки 1,5 В подключены параллельно. Напряжение на нагрузке остается на уровне 1,5 В, но общая емкость увеличивается до 8000 мАч.
Серияи параллельный
Если вы хотите увеличить напряжение и емкость, вы можете комбинировать последовательные и параллельные батареи. Еще раз убедитесь, что уровень напряжения одинаков для батарей, включенных параллельно, так как может произойти короткое замыкание.
В этом примере полное напряжение на нагрузке составляет 3 В, а общая емкость аккумуляторов составляет 4000 мАч.
В больших аккумуляторных блоках, особенно литий-ионных, вы часто видите конфигурацию, указанную с использованием «S» и «P» для последовательного и параллельного подключения. Конфигурация для схемы выше – 2S2P. В качестве практического примера современные электромобили используют массивные массивы батарей, соединенных последовательно и параллельно.
Ресурсы и дальнейшее развитие
К настоящему времени вы должны понимать, как были изобретены батареи и как они работают. Батареи – это один из способов обеспечения вашего проекта электроэнергией, и они могут быть невероятно полезны, если вам нужен портативный источник питания.
Если вы хотите больше узнать о батареях, вот еще несколько уроков:
Хотите увидеть аккумуляторы в действии? Взгляните на эти проекты, в которых используются разные батареи в разных конфигурациях:
Simon Splosion Wireless
Это учебное пособие, демонстрирующее один из многих методов “взлома” Саймона Сэйса. Мы выделим технику, чтобы взять ваш Simon Says Wireless.
Электрический ток | Безграничная физика
Аккумулятор
Аккумулятор – это устройство, преобразующее химическую энергию непосредственно в электрическую.
Цели обучения
Опишите функции и определите основные компоненты батареи
Основные выводы
Ключевые моменты
- Аккумулятор накапливает электрический потенциал в результате химической реакции. Когда он подключен к цепи, этот электрический потенциал преобразуется в кинетическую энергию по мере прохождения электронов по цепи.
- Напряжение или разность потенциалов между двумя точками определяется как изменение потенциальной энергии заряда q, перемещенного из точки 1 в точку 2, деленное на заряд.
- Напряжение батареи является синонимом ее электродвижущей силы или ЭДС. Эта сила отвечает за прохождение заряда через цепь, известную как электрический ток.
Ключевые термины
- аккумулятор : Устройство, вырабатывающее электричество в результате химической реакции между двумя веществами.
- ток : временная скорость протекания электрического заряда.
- напряжение : величина электростатического потенциала между двумя точками в пространстве.
Символ батареи на принципиальной схеме : Это символ батареи на принципиальной схеме. Он возник как схематический рисунок батареи самого раннего типа – гальванической батареи. Обратите внимание на положительный катод и отрицательный анод. Эта ориентация важна при рисовании принципиальных схем, чтобы изобразить правильный поток электронов.
Аккумулятор – это устройство, преобразующее химическую энергию непосредственно в электрическую. Он состоит из ряда гальванических элементов, последовательно соединенных проводящим электролитом, содержащим анионы и катионы.Одна полуячейка включает электролит и анод или отрицательный электрод; другая полуячейка включает электролит и катод или положительный электрод. В окислительно-восстановительной реакции, которая приводит в действие аккумулятор, катионы восстанавливаются (добавляются электроны) на катоде, а анионы окисляются (электроны удаляются) на аноде. Электроды не касаются друг друга, но электрически связаны электролитом. В некоторых элементах используются два полуэлемента с разными электролитами. Разделитель между полуэлементами позволяет ионам течь, но предотвращает смешивание электролитов.
Каждая полуячейка имеет электродвижущую силу (или ЭДС), определяемую ее способностью передавать электрический ток изнутри во внешнюю часть ячейки. Чистая ЭДС ячейки – это разница между ЭДС ее полуячеек или разность восстановительных потенциалов полуреакций.
Электрическая движущая сила на выводах элемента известна как напряжение на выводах (разность) и измеряется в вольтах. Когда батарея подключена к цепи, электроны от анода проходят через цепь к катоду по прямой цепи.Напряжение батареи является синонимом ее электродвижущей силы или ЭДС. Эта сила отвечает за прохождение заряда через цепь, известную как электрический ток.
Батарея накапливает электрический потенциал химической реакции. Когда он подключен к цепи, этот электрический потенциал преобразуется в кинетическую энергию по мере прохождения электронов по цепи. Электрический потенциал определяется как потенциальная энергия на единицу заряда ( q ). Напряжение или разность потенциалов между двумя точками определяется как изменение потенциальной энергии заряда q , перемещенного из точки 1 в точку 2, деленное на заряд.В перегруппированном виде это математическое соотношение можно описать как:
[латекс] \ Delta \ text {PE} = \ text {q} \ Delta \ text {V} [/ latex]
Напряжение – это не то же самое, что энергия. Напряжение – это энергия на единицу заряда. Таким образом, аккумулятор мотоцикла и автомобильный аккумулятор могут иметь одинаковое напряжение (точнее, одинаковую разность потенциалов между клеммами аккумулятора), но при этом один хранит гораздо больше энергии, чем другой. Автомобильный аккумулятор может заряжать больше, чем аккумулятор мотоцикла, хотя оба аккумулятора – 12 В.
Идеальные и настоящие батареи : Краткое введение в идеальные и настоящие батареи для студентов, изучающих электрические схемы.
Измерения тока и напряжения в цепях
Электрический ток прямо пропорционален приложенному напряжению и обратно пропорционален сопротивлению в цепи.
Цели обучения
Опишите взаимосвязь между электрическим током, напряжением и сопротивлением в цепи
Основные выводы
Ключевые моменты
- Простая схема состоит из источника напряжения и резистора. Закон
- Ома дает соотношение между током I , напряжением В и сопротивлением R в простой схеме: I = В / R .
- Единицей измерения скорости электрического заряда в системе СИ является ампер, который равен заряду, протекающему через некоторую поверхность со скоростью один кулон в секунду.
Ключевые термины
- электрический ток : движение заряда по цепи
- Ом : в Международной системе единиц производная единица электрического сопротивления; электрическое сопротивление устройства, на котором разность потенциалов в один вольт вызывает ток в один ампер; символ: Ω
- ампер – единица электрического тока; стандартная базовая единица в Международной системе единиц.Аббревиатура: amp. Символ: A.
Чтобы понять, как измерять ток и напряжение в цепи, вы также должны иметь общее представление о том, как работает схема и как связаны ее электрические измерения.
Что такое напряжение? : Это видео помогает с концептуальным пониманием напряжения.
Электрическая цепь – это тип сети с замкнутым контуром, который обеспечивает обратный путь для тока. Простая схема состоит из источника напряжения и резистора и схематически может быть представлена как на рис.
Простая схема : Простая электрическая цепь, состоящая из источника напряжения и резистора
Согласно закону Ома, электрический ток I , или движение заряда, который протекает через большинство веществ, прямо пропорционален приложенному к нему напряжению В . Электрическое свойство, препятствующее току (примерно такое же, как трение и сопротивление воздуха), называется сопротивлением R . Столкновения движущихся зарядов с атомами и молекулами вещества передают энергию веществу и ограничивают ток.Сопротивление обратно пропорционально току. Следовательно, закон Ома можно записать следующим образом:
[латекс] \ text {I} = \ text {V} / \ text {R} [/ latex]
, где I – ток через проводник в амперах, В, – разность потенциалов, измеренная на проводнике в вольтах, а R – сопротивление проводника в омах (Ом). Более конкретно, закон Ома гласит, что R в этом отношении является постоянным, не зависящим от тока.Используя это уравнение, мы можем рассчитать ток, напряжение или сопротивление в данной цепи.
Например, если у нас есть батарея на 1,5 В, которая была подключена по замкнутой цепи к лампочке с сопротивлением 5 Ом, какой ток течет по цепи? Чтобы решить эту проблему, мы просто подставим указанные значения в закон Ома: I = 1,5 В / 5 Ом; I = 0,3 ампера. Зная ток и сопротивление, мы можем изменить уравнение закона Ома и решить для напряжения В :
[латекс] \ text {V} = \ text {IR} [/ latex]
A Микроскопическое изображение: скорость дрейфа
Скорость дрейфа – это средняя скорость, которую достигает частица под действием электрического поля.
Цели обучения
Свяжите скорость дрейфа со скоростью свободных зарядов в проводниках
Основные выводы
Ключевые моменты
- В проводниках есть электрическое поле, которое заставляет электроны дрейфовать в направлении, противоположном полю. Скорость дрейфа – это средняя скорость этих свободных зарядов.
- Выражение для связи между током и скоростью дрейфа можно получить, рассмотрев количество свободных зарядов в отрезке провода.
- I = qnAv связывает скорость дрейфа с током, где I – ток через провод с площадью поперечного сечения A , изготовленный из материала с плотностью свободного заряда n . Каждый из носителей тока имеет заряд q и движется со скоростью дрейфа величиной v .
Ключевые термины
- скорость дрейфа : средняя скорость свободных зарядов в проводнике.
Скорость дрейфа
Известно, что электрические сигналы движутся очень быстро.Телефонные разговоры по проводам проходят на большие расстояния без заметных задержек. Свет загорается при нажатии переключателя. Большинство электрических сигналов, переносимых токами, передаются со скоростью порядка 10 8 м / с, что составляет значительную часть скорости света. Интересно, что отдельные заряды, составляющие ток, в среднем движутся намного медленнее, обычно дрейфуя со скоростью порядка 10 –4 м / с.
Высокая скорость электрических сигналов является результатом того факта, что сила между зарядами быстро действует на расстоянии.Таким образом, когда свободный заряд вводится в провод, входящий заряд выталкивает другие заряды впереди себя, которые, в свою очередь, подталкивают заряды дальше по линии. Возникающая в результате электрическая ударная волна движется по системе почти со скоростью света. Если быть точным, этот быстро движущийся сигнал или ударная волна представляет собой быстро распространяющееся изменение электрического поля.
Электроны, движущиеся через проводник : Когда заряженные частицы выталкиваются в этот объем проводника, такое же количество быстро вынуждено покинуть его.Отталкивание между одноименными зарядами затрудняет увеличение количества зарядов в объеме. Таким образом, как только один заряд входит, другой почти сразу уходит, быстро передавая сигнал вперед.
Скорость дрейфа
Хорошие проводники имеют большое количество бесплатных зарядов. В металлах свободными зарядами являются свободные электроны. Расстояние, на которое может перемещаться отдельный электрон между столкновениями с атомами или другими электронами, довольно мало. Таким образом, пути электронов кажутся почти случайными, как движение атомов в газе.Однако в проводнике есть электрическое поле, которое заставляет электроны дрейфовать в указанном направлении (противоположном полю, поскольку они отрицательны). Скорость дрейфа v d – это средняя скорость свободных зарядов после приложения поля. Скорость дрейфа довольно мала, так как свободных зарядов очень много. Имея оценку плотности свободных электронов в проводнике (количество электронов в единице объема), можно вычислить скорость дрейфа для заданного тока.Чем больше плотность, тем ниже скорость, необходимая для данного тока.
Скорость дрейфа : Свободные электроны, движущиеся в проводнике, совершают множество столкновений с другими электронами и атомами. Показан путь одного электрона. Средняя скорость свободных зарядов называется дрейфовой скоростью и направлена в направлении, противоположном электрическому полю электронов. Столкновения обычно передают энергию проводнику, требуя постоянного подвода энергии для поддержания постоянного тока.
Можно получить выражение для связи между током и скоростью дрейфа, учитывая количество свободных зарядов в отрезке провода. Количество бесплатных зарядов на единицу объема обозначается символом n и зависит от материала. Ax – это объем сегмента, поэтому количество бесплатных зарядов в нем составляет nAx . Заряд ΔQ в этом сегменте, таким образом, равен qnAx , где q – это количество заряда на каждом носителе.(Напомним, что для электронов q составляет 1,60 × 10−19C.) Ток – это заряд, перемещаемый за единицу времени. Таким образом, если все первоначальные заряды покидают этот сегмент за время t, ток равен:
[латекс] \ text {I} = \ Delta \ text {Q} / \ Delta \ text {t} = \ text {qnAx} / \ Delta \ text {t} [/ latex]
Примечательно, что x / Δt – это величина скорости дрейфа v d , поскольку заряды перемещаются на среднее расстояние x за время t. Перестановка членов дает: I = qnAv d , где I – ток через провод с площадью поперечного сечения A, , изготовленный из материала с плотностью свободного заряда n .Каждый из носителей тока имеет заряды q и движется со скоростью дрейфа величиной v d .
Плотность тока – это электрический ток на единицу площади поперечного сечения. Он имеет единицы ампер на квадратный метр.
MIT Школа инженерии | »Как работает аккумулятор?
Как работает аккумулятор?
Ваши часы, ноутбук и лазерная указка питаются от одного и того же: химии…
Мэри БейтсСуществует много разных типов батарей, но все они работают на основе одной и той же концепции.«Батарея – это устройство, способное накапливать электрическую энергию в форме химической энергии и преобразовывать эту энергию в электричество», – говорит Антуан Алланор, научный сотрудник отдела материаловедения и инженерии Массачусетского технологического института. «Вы не можете улавливать и хранить электричество, но вы можете хранить электрическую энергию в химических веществах внутри батареи».
Батарея состоит из трех основных компонентов: две клеммы, изготовленные из разных химикатов (обычно металлов), анод и катод; и электролит, разделяющий эти выводы.Электролит – это химическая среда, которая обеспечивает прохождение электрического заряда между катодом и анодом. Когда устройство подключено к батарее – лампочке или электрической цепи – на электродах происходят химические реакции, которые создают поток электрической энергии к устройству.
Более конкретно: во время разряда электричества химическое вещество на аноде высвобождает электроны к отрицательному полюсу и ионы в электролите в результате так называемой реакции окисления.Между тем, на положительном выводе катод принимает электроны, замыкая цепь для потока электронов. Электролит предназначен для того, чтобы привести различные химические вещества анода и катода в контакт друг с другом таким образом, чтобы химический потенциал мог уравновешиваться от одного вывода к другому, преобразовывая накопленную химическую энергию в полезную электрическую энергию. «Эти две реакции происходят одновременно», – говорит Алланор. «Ионы переносят ток через электролит, в то время как электроны текут во внешней цепи, и это то, что генерирует электрический ток.”
Если батарея одноразовая, она будет вырабатывать электричество до тех пор, пока не закончатся реагенты (одинаковый химический потенциал на обоих электродах). Эти батареи работают только в одном направлении, преобразуя химическую энергию в электрическую. Но в других типах аккумуляторов реакция может быть обратной. Перезаряжаемые батареи (например, в вашем мобильном телефоне или в вашем автомобиле) спроектированы таким образом, что электрическая энергия от внешнего источника (зарядное устройство, которое вы подключаете к стене или динамо-машина в вашем автомобиле) может подаваться на химическую систему и наоборот.


 д.
д.
