Что такое ржавчина и как ее удалить с поверхности металла?
По статистике, потери от ржавчины (коррозии) составляют до 12% от всего производимого металла. Условия эксплуатации металлических изделий и конструкций постоянно ужесточаются, в том числе и из-за загрязнения атмосферы. Так, выбросы оксидов серы или азота приводят к образованию микрокапель серной или азотной кислот, при этом скорость образования ржавчины увеличивается в несколько раз.
Ржавчина – химические основы процесса
Железо – химически активный металл, который в присутствии воды и кислорода легко окисляется, образуя несколько соединений – оксидов, гидроксидов и их гидратов. Как ни странно, но точной формулы ржавчины не существует: в зависимости от условий окружающей среды продукт окисления железа имеет переменный состав: nFe(OH)3*mFe(OH)2*ph3O. Поражение ржавчиной происходит по всей поверхности металла, но наиболее уязвимыми местами являются сварные швы, внутренние углы конструкций, отверстия для резьбовых соединений. По своей структуре ржавчина очень рыхлая, сцепление с металлом практически отсутствует. Из-за высокой пористости слой ржавчины легко задерживает атмосферную влагу, создавая благоприятные условия для дальнейшего разрушения металла.

Опасность процесса в том, что визуально оценить степень поражения металлической конструкции не представляется возможным: под красно-бурым слоем ржавчины металл может быть полностью разрушен. Если своевременно не принять меры, результат может оказаться плачевным, вплоть до полного разрушения изделия. Одно дело, если это – ржавый гвоздь в стене дачного домика, и совсем другое – если ржавчина поразила опору ЛЭП или корпус морского судна.

Способы удаления ржавчины
Народная мудрость гласит, что любую проблему проще предотвратить, чем потом прикладывать героические усилия для устранения ее последствий. Ржавчина – не исключение. За последние 20-30 лет химики и физики предложили немало способов предотвращения коррозии – от защитных покрытий до сложных инженерных сооружений – станций электрохимической защиты.
Если ржавчина все-таки появилась – это не повод опускать руки: есть немало эффективных способов ее удаления, и чем раньше предприняты активные меры, тем большим будет эффект от их применения. Итак, обо всем по порядку.
Механическое удаление ржавчины
Продукты коррозии обладают малой адгезией и поэтому легко удаляются с поверхности металла при механическом воздействии – например, при обработке металлической щеткой. Снять ржавый налет с крупных изделий можно с помощью шлифовального станка, соблюдая при этом простое правило: начинать нужно с крупного зерна, а для финишной обработки использовать самое мелкое. Участки металла, с которых удалена ржавчина, оказываются совершенно беззащитными перед атмосферным воздействием. Если их не обработать антикоррозионными составами, предотвращающими контакт с водой и кислородом, процесс ржавления только ускорится.

Химические способы удаления ржавчины
Зная природу и химический состав ржавчины, логично предположить, что удалить ее можно с помощью кислот. Из школьного курса химии известно, что оксиды и гидроксиды металлов легко взаимодействуют с кислотами, при этом образуются соли железа и соответствующей кислоты, и вода.
Например, при действии соляной кислоты происходят следующие реакции:
- 2Fe (OH)3 + 6HCL → 2FeCl3 + 6h3O
- Fe (OH)2 + 2HCL → FeCl2 +2h3O
Образующийся хлорид железа – водорастворимая соль, которую необходимо удалить с поверхности обрабатываемого изделия простым ополаскиванием в воде, а затем насухо вытереть поверхность. Не надо ждать, пока ржавчина начнет образовываться снова, очищенные участки следует обработать защитными составами.
При обработке кислотами существует опасность растворения металла, поскольку железо в электрохимическом ряду напряжений стоит до водорода, оно активно реагирует со многими разбавленными кислотами:
- Fe + 2HCl → FeCl2 + h3↑
По этой причине прежде, чем заняться химическими экспериментами в домашних условиях, необходимо почитать соответствующую литературу. Устранить побочный эффект поможет ингибитор коррозии – уротропин, при добавлении всего 1-2 г на литр раствора соляной кислоты реакция с железом не протекает.

Преобразователи ржавчины
Жидкие составы на основе ортофосфорной кислоты являются отличным способом предотвратить дальнейшее образование ржавчины на поверхности стальных и железных изделий. При таком способе обработки предварительно удаляются лишь те участки ржавчины, которые слабо держатся на основе. Образующийся в процессе реакции ортофосфат железа создает прочную защитную пленку, через которую не проникает влага и кислород, благодаря чему предотвращается дальнейшая коррозия металла. Для ускорения процесса высыхания на литр 25%-ого раствора ортофосфорной кислоты можно добавить 30-40 мл изобутилового спирта или 15 граммов винной кислоты.

Современное оборудование для удаления ржавчины
Механические способы очистки поверхности от ржавчины с помощью подручных средств применимы далеко не всегда, если изделие имеет сложную форму, то обработать все участки не представляется возможным. Химические способы тоже имеют свои недостатки, при несоблюдении элементарных правил техники безопасности можно получить химический ожог или отравление. Определенную проблему представляет и утилизация отработанных растворов.
Оптимальным способом удаления ржавчины, особенно с поверхности изделий сложной геометрической формы, является мягкий бластинг. Суть метода состоит в следующем, на металлическое изделие направляется струя сжатого воздуха, содержащая особые абразивные гранулы. Меняя давление, можно регулировать глубину слоя, снимаемого с поверхности – таким образом удаляется только слой ржавчины или окалины, а металл остается нетронутым. Гранулы ARMEX, используемые в аппарате для мягкого бластинга Nordblast NB 28-2, состоят из мельчайших частиц соды и мела. Попадая под большим давлением на поверхность, они легко удаляют не только ржавчину, но и лакокрасочные материалы.

Отличительной особенностью метода является абсолютная экологическая безопасность: применяемые компоненты химически инертны. Многочисленные исследования доказали, что на поверхности металла практически не образуются царапины и иные микроскопические дефекты, которые последствии могут стать центрами повторного образования ржавчины. Щелочная природа гранул способствует образованию пассивной пленки на изделиях из железа или стали, предохраняя основной объем металла от коррозионного разрушения.
Наилучшие результаты применения аппарата мягкого бластинга Nordblast NB 28-2 получены при обработке деталей машин или яхт. Процесс чистки от ржавчины зависит от степени коррозии, обычно на полную обработку автомобиля уходит 1 день, яхты – 2 дня.
Чем раньше обнаружена проблема, тем проще бороться с ржавчиной. Какой способ наиболее предпочтителен – каждый решает самостоятельно, но не стоит пользоваться дедовскими методами, если есть оборудование, удаляющее ржавчину со 100%-ой эффективностью!
blastingservice.ru
Ржавчина
Ржавчина – продукт взаимодействия внешней окислительной атмосферы с железом. Процесс ее образования называется ржавлением ( коррозия ). Термин «ржавчина» присущ только продуктам коррозии железа и его сплавов. Любые другие металлы могут корродировать, но не ржаветь!
Ржавчина – это гидратированная окись железа (гидроксид железа). Химическая формула ржавчины – Fe2O3•H2О (иногда пишут просто Fe2O3). На поверхности образуется в виде шероховатого налета, который имеет рыхлую структуру. Цвет ржавчины – от оранжевого до красно-коричневого.

Железо при рН среды > 5,5 образует труднорастворимый гидрат закиси железа, имеющий белый цвет:
Fe2+mH2O + 2OH– = mH2O + Fe(OH)2↓
При взаимодействии гидрата закиси железа с растворенным кислородом в воде, образуются еще более труднорастворимое соединение – гидрат окиси железа (бурый цвет):
2Fe(OH)2 + 1/2 O2 + H2О = 2Fe(OH)3↓
Вторичные продукты коррозии (Fe(OH)2 и Fe(OH)3) могут и дальше превращаться, с образованием гидратированных окислов FeO•Fe2O3•nH2О – ржавчины. FeO – нестабильное соединение, поэтому в формуле ржавчины его часто просто не записывают.
Реакции образования ржавчины:
2e + 2H+ – H2;
4e +O2 + 4H+ – 2H2O;
2e + Fe(OH)2 + 2H+ – Fe + 2H2O;
2e + Fe2+ – Fe;
2e + Fe(OH)3– + 3H+ – Fe + 3H2O;
e + Fe(OH)3 + H+ – Fe(OH)2 + h3O;
e + Fe(OH)3 + 3H+ – Fe2+ + 3H2O;
Fe(OH)3- + H+ – Fe(OH)2 + H2O;
e + Fe(OH)3 – Fe(OH)3-
Fe3+ + 3H2O – Fe(OH)3 + 3H+;
Fe2+ + 2H2O – Fe(OH)2 + 2H+;
e + Fe3+ – Fe2+;
Fe2+ + H2O – FeOH + H+;
FeOH+ + H2O > Fe(OH)2 + H+;
Fe(OH)2 + H2O – Fe(OH)3- + H+;
Fe3+ + H2O – FeOH2+ + H+;
FeOH2+ + H2O – Fe(OH)3 + H+;
FeOH2+ + H+ – Fe2+ + H2O;
e + FeOH2+ + 2H+ – Fe2+ +2H2O;
e + Fe(OH)3 + H+ – Fe(OH)2 + H2O;
e + Fe(OH)3 + 2H+ – FeOH+ + 2H2O;
e + Fe(OH)3 + 3H+ – Fe2+ + 3H2O.
Ржавчина может существовать в двух формах: магнитной (γ- Fe2O3) и немагнитной (α-Fe2O3). Гидратированная окись железа в α форме (гематит) -более стабильное соединение. Раствор, насыщенный ржавчиной, почти нейтральный. γ- Fe2O3 обычно между гидратированными оксидами Fe2O3 и FeO образует черный промежуточный слой. Поэтому можно сказать, что ржавчина состоит из трех слоев оксидов железа разной степени окисления.
Процесс ржавления металла начинается только при наличии в воздухе влаги. При попадании на поверхность изделия из железа капли воды, спустя некоторое время, можно заметить изменение ее цвета. Капля становится мутной и постепенно окрашивается в бурый цвет. Это свидетельствует о появлении, в месте контакта воды с поверхностью, продуктов коррозии железа.
Если ржавчина уже образовалась – остановить процесс коррозии крайне трудно и не всегда удается. Лучше его предупреждать и заранее защищать металл!
www.okorrozii.com
Ржавчина – это… Что такое Ржавчина?
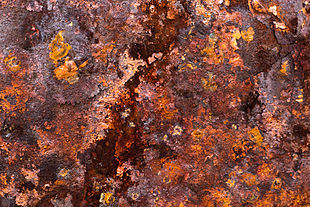 Цвета ржавчины
Цвета ржавчиныРжа́вчина является общим термином для определения оксидов железа. В разговорной речи этот термин применяется к красным окислам, образующимся в результате реакции железа с кислородом в присутствии воды или влажного воздуха. Есть и другие формы ржавчины, например, продукт, образующийся в результате реакции железа с хлором при отсутствии кислорода. Такое вещество образуется, в частности, в арматуре, используемой в подводных бетонных столбах, и называют его зелёной ржавчиной. Несколько видов коррозии различимы визуально или с помощью спектроскопии, они формируются при разных внешних условиях.[1] Ржавчина состоит из гидратированного оксида железа(III) Fe2O3·nH2O и метагидроксида железа (FeO(OH), Fe(OH)3). При наличии кислорода и воды и достаточном времени любая масса железа в конечном итоге преобразуется полностью в ржавчину и разрушается. Поверхность ржавчины не создаёт защиту для нижележащего железа, в отличие от образования патины на медной поверхности.
Ржавчиной как правило называют продукт коррозии только железа и его сплавов, таких как сталь. Многие другие металлы тоже подвергаются коррозии, но именно оксиды обычно не называют ржавчиной.
Химические реакции
 Толстый слой ржавчины на звеньях цепи возле моста Золотые Ворота в Сан-Франциско. Цепь постоянно подвергается воздействию сырости и солёных брызг, вызывающих разрушение поверхности, растрескивание и шелушение металла.
Толстый слой ржавчины на звеньях цепи возле моста Золотые Ворота в Сан-Франциско. Цепь постоянно подвергается воздействию сырости и солёных брызг, вызывающих разрушение поверхности, растрескивание и шелушение металла.Причины ржавления
Если железо, содержащее какие-либо добавки и примеси (например, чугун), находится в контакте с водой, кислородом или другим сильным окислителем и/или кислотой, то оно начинает ржаветь. Если при этом присутствует соль, например, имеется контакт с солёной водой, коррозия происходит быстрее в результате электрохимических реакций. Чистое железо относительно устойчиво к воздействию чистой воды и сухого кислорода. Как и у других металлов, например, у алюминия, плотно приставшее оксидное покрытие на железе (слой пассивации) защищает основную массу железа от дальнейшего окисления. Превращение же пассивирующего слоя оксида железа в ржавчину является результатом комбинированного действия двух агентов, как правило, кислорода и воды. Другими разрушающими факторами являются диоксид серы и углекислый газ в воде. В этих агрессивных условиях образуются различные виды гидроксида железа. В отличие от оксидов железа, гидроксиды не защищают основную массу металла. Поскольку гидроксид формируется и отслаивается от поверхности, воздействию подвергается следующий слой железа, и процесс коррозии продолжается до тех пор, пока всё железо не будет уничтожено, или в системе закончится весь кислород, вода, диоксид углерода или диоксид серы.[2]
Происходящие реакции
 Покрытый ржавчиной и грязью болт. Заметна точечная коррозия и постепенная деформации поверхности, вызванная сильным окислением.
Покрытый ржавчиной и грязью болт. Заметна точечная коррозия и постепенная деформации поверхности, вызванная сильным окислением.Ржавление железа — это электрохимический процесс, который начинается с переноса электронов от железа к кислороду.[3] Скорость коррозии зависит от количества имеющейся воды, и ускоряется электролитами, о чём свидетельствуют последствия применения дорожной соли на коррозию автомобилей. Ключевой реакцией является восстановления кислорода:
- O2 + 4 e– + 2 H2O → 4 OH–
Поскольку при этом образуются ионы гидроксидов, этот процесс сильно зависит от присутствия кислоты. Действительно, коррозия большинства металлов кислородом ускоряется при понижении pH. Обеспечение электронов для вышеприведённой реакции происходит при окисления железа, которое может быть описано следующим образом:
- Fe → Fe2+ + 2 e−
Следующая окислительно-восстановительная реакция происходит в присутствии воды и имеет решающее значение для формирования ржавчины:
- 4 Fe2+ + O2 → 4 Fe3+ + 2 O2−
Кроме того, следующие многоступенчатые кислотно-щелочные реакции влияют на ход формирования ржавчины:
- Fe2+ + 2 H2O ⇌ Fe(OH)2 + 2 H+
- Fe3+ + 3 H2O ⇌ Fe(OH)3 + 3 H+
что приводит к следующим реакциям поддержания баланса дегидратации:
- Fe(OH)2⇌ FeO + H2O
- Fe(OH)3⇌ FeO(OH) + H2O
- 2 FeO(OH) ⇌ Fe2O3 + H2O
Из приведённых выше уравнений видно, что формирование продуктов коррозии обусловлено наличием воды и кислорода. С ограничением растворённого кислорода на передний план выдвигаются железо(II)-содержащие материалы, в том числе FeO и чёрный магнит (Fe3O4). Высокая концентрация кислорода благоприятна для материалов с трёхвалентным железом, с номинальной формулой Fe(OH)3-xOx/2. Характер коррозии меняется со временем, отражая медленные скорости реакций твёрдых тел.
Кроме того, эти сложные процессы зависят от присутствия других ионов, таких как Ca2+, которые служат в качестве электролита, и таким образом, ускоряют образование ржавчины, или в сочетании с гидроксидами и оксидами железа образуют различные осадки вида Ca-Fe-O-OH.
Более того, цвет ржавчины можно использовать для проверки наличия ионов Fe2+, которые меняет цвет ржавчины с жёлтого на синий.
Предотвращение ржавления
 Отслаивающаяся краска обнажает участки ржавой поверхности листового металла.
Отслаивающаяся краска обнажает участки ржавой поверхности листового металла.Ржавчина является проницаемой для воздуха и воды, поэтому внутрилежащее железо продолжает разъедаться. Предотвращение ржавчины, следовательно, требует покрытия, которое исключает образование ржавчины. На поверхности нержавеющей стали формируется пассивирующий слой оксида хрома(III). Подобное проявление пассивации происходит с магнием, титаном, цинком, оксидом цинка, алюминием, полианилином и другими электропроводящими полимерами.
Гальванизация
Хорошим подходом к предотвращению ржавчины является метод гальванизации, который обычно заключается в нанесении на защищаемый объект слоя цинка либо методом горячего цинкования, либо методом гальванотехники. Цинк традиционно используется, потому что он достаточно дёшев, обладает хорошей адгезией к стали и обеспечивает катодную защиту на стальную поверхность в случае повреждения цинкового слоя. В более агрессивных средах (таких, как солёная вода), предпочтительнее является кадмий. Гальванизация часто не попадает на швы, отверстия и стыки, через которые наносилось покрытие. В этих случаях покрытие обеспечивает катодную защиту металла, где оно выступает в роли гальванического анода, на который прежде всего и воздействует коррозия. В более современные покрытия добавляют алюминий, новый материал называется цинк-алюм. Алюминий в покрытии мигрирует, покрывая царапины и, таким образом, обеспечивая более длительную защиту. Этот метод основан на применении оксидов алюминия и цинка, защищающих царапины на поверхности, в отличие от процесса оксидизации, как в случае применения гальванического анода. В некоторых случаях при очень агрессивных средах или длительных сроках эксплуатации применяются одновременно и гальванизация цинком, и другие защитные покрытия, чтобы обеспечить надёжную защиту от коррозии.
Катодная защита
Катодная защита является методом, используемым для предотвращения коррозии в скрытых под землёй или под водой структурах путём подачи электрического заряда, который подавляет электрохимические реакции. Если её правильно применять, коррозия может быть остановлена полностью. В своей простейшей форме это достигается путём соединения защищаемого объекта с протекторным анодом, в результате чего на поверхности железа или стали происходит только катодный процесс. Протекторный анод должен быть сделан из металла с более отрицательным электродным потенциалом, чем железо или сталь, обычно это цинк, алюминий или магний.
Лакокрасочные и другие защитные покрытия
От ржавчины можно предохранять с помощью лакокрасочных и других защитных покрытий, которые изолируют железо из окружающей среды. История красок для нанесения на ржавчину насчитывает 50 лет, когда в Англии была изобретена краска Hammerite. Большие поверхности, поделённые на секции, как например, корпуса судов и современных автомобилей, часто покрывают продуктами на основе воска. Такие средства обработки содержат также ингибиторы от коррозии. Покрытие стальной арматуры бетоном (железобетон) обеспечивает некоторую защиту стали в среде с высоким рН. Однако коррозия стали в бетоне всё ещё является проблемой.
Покрытие слоем металла
Ржавчина может полностью разрушить железо. Обратите внимание на гальванизацию незаржавевших участков.- Оцинковка (оцинкованное железо/сталь): железо или сталь покрываются слоем цинка. Может использоваться метод горячего цинкования или метод цинкового дутья.
- Лужение: мягкая листовая сталь покрывается слоем олова.
- Хромирование: тонкий слой хрома наносится электролитическим способом на сталь, обеспечивая как защиту от коррозии, так и яркий, полированный внешний вид. Часто используется в блестящих компонентах велосипедов, мотоциклов и автомобилей.
Воронение
Воронение — это метод, который может обеспечить ограниченную устойчивость к коррозии для мелких предметов из стали, таких как огнестрельное оружие и др. Метод состоит в получении на поверхности углеродистой или низколегированной стали или чугуна слоя окислов железа толщиной 1-10 мкм. Для придания блеска, а также для улучшения защитных свойств окисной плёнки, её пропитывают минеральным или растительным маслом.
Снижение влажности
Ржавчины можно избежать, снижая влажность окружающей железо атмосферы. Этого можно добиться, например, с помощью силикагеля.
Ингибиторы
Ингибиторы коррозии, как, например, газообразные или летучие ингибиторы, можно использовать для предотвращения коррозии в закрытых системах.
Экономический эффект
Ржавчина вызывает деградацию инструментов и конструкций, изготовленных из материалов на основе железа. Поскольку ржавчина имеет гораздо больший объём, чем исходное железо, её нарост ведёт к быстому разрушению конструкции, усиливая коррозию на прилегающих к нему участках — явление, называемое «поеданием ржавчиной». Это явление стало причиной разрушения моста через реку Мианус (штат Коннектикут, США) в 1983 году, когда подшипники подъёмного механизма полностью проржавели изнутри. В результате этот механизм зацепил за угол одной из дорожных плит и сдвинул её с опор. Ржавчина была также главным фактором разрушения Серебряного моста в Западной Вирджинии в 1967 году, когда стальной висячий мост рухнул меньше, чем за минуту. Погибли 46 водителей и пассажиров, находившихся в то время на мосту.
 Мост Кинзу после разрушения.
Мост Кинзу после разрушения.Мост Кинзу в штате Пенсильвания была снесён торнадо в 2003 году в значительной степени потому, что центральные базовые болты, соединяющие конструкцию с землёй, проржавели, предоставив мосту возможность держаться просто под действием силы тяжести.
Кроме того, коррозия покрытых бетоном стали и железа может вызвать раскалывание бетона, что создает серьёзные конструкторские проблемы. Это один из наиболее распространённых отказов железобетонных мостов.
См. также
Примечания
- ↑ Interview, David Des Marais.(недоступная ссылка — история)
- ↑ Holleman, A. F.; Wiberg, E. “Inorganic Chemistry” Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ↑ Hubert Gräfen, Elmar-Manfred Horn, Hartmut Schlecker, Helmut Schindler “Corrosion” Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH: Weinheim, 2002. DOI: 10.1002/14356007.b01_08
Ссылки
dic.academic.ru
Ржавчина на металле: вред, виды коррозии
Мы – продавцы металлопроката – как никто сталкивается с этим наваждением – ржавиной. И мы точно знаем вред от коррозии. В этой статье мы скажем несколько слов об этой проблеме, ее проявлениях, ее масштабах.

Ущерб, ущерб…
Все видели эти оранжево-бурые или желтоватые пятна ржавчины на металлических деталях. Экономический ущерб от коррозии металлов огромен. В США и Германии подсчитанный ущерб от коррозии и затраты на борьбу с ней составляют примерно 3 % ВВП. При этом потери металла, в том числе из-за выхода из строя конструкций, изделий, оборудования, составляют до 20 % от общего объема производства стали в год. По России точные данные о потерях от коррозии не подсчитаны.
Доподлинно известно, что именно проржавевшие металлоконструкции стали причиной обрушения нескольких мостов в Соединенных Штатах, в том числе с многочисленными человеческими жертвами. Крайне неприятен и экологический вред: утечка газа, нефти при разрушении трубопроводов приводит к загрязнению окружающей среды.
Виды коррозии и ее причины
Перед тем как говорить о ржавчине на железе, кратко рассмотрим другие ее типы.
Коррозии подвержены не только металлы, но и неметаллические изделия. В этом случае коррозию еще называют «старением». Старению подвержены пластмассы, резины и другие вещества. Для бетона и железобетона существует термин “усталость”. Происходит их разрушение или ухудшение эксплуатационных характеристик из-за химического и физического воздействия окружающей среды. Корродируют и металлические сплавы – медь, алюминий, цинк: в процессе их коррозии на поверхности изделий образуется оксидная пленка, плотно прилегающая к поверхности, что значительно замедляет дальнейшее разрушение металла (а патина на меди еще и придает ей особый шарм). Драгоценные металлы являются таковыми не только из-за своей красоты, ценимой ювелирами, но и за счет стойкости к коррозии. Золото и серебро до сих пор используется для покрытия особо чувствительных электронных контактов а платина применяется в космической отрасли.
Корродировать металл может в некоторых участках поверхности (местная коррозия), охватить всю поверхность (равномерная коррозия), или же разрушать металл по границам зерен (межкристаллитная коррозия). Коррозия заметно ускоряется с повышением температуры.

Типы ржавчины
В большей степени коррозии подвержено железо. С точки зрения химии ржавчина – это окислительный процесс (как и горение). Элементы возникающие при окислении в кислородной среде называются Оксиды. Можно выделить 4 основных типа.
1. Желтая ржавчина – химическая формула FeO(OH)h3O (оксид железа двухвалетный). Возникает во влажной, недонасыщенной кислородом среде. Часто встречается под водой. В природе существует в виде минерала вюстита, при этом являясь монооксидом (те содержит 1 атом кислорода).
2. Коричневая ржавчина – Fe2O3 (двойной оксид железа): растет без воды и встречается редко.
3. Черная ржавчина – Fe3O4 (оксид железа четырех валентый). Образуется при малом содержании кислорода и без воды поэтому стабильна и распространяется очень медленно. Этот оксид является ферромагнетиком (при определенных условиях обладает намагниченностью в отсутствие внешнего магнитного поля), поэтому потенциально применим для создания сверх-проводников.
4. Красная ржавчина – химическая формула Fe2O3•h3O (оксид железа трехвалентный). Возникает под воздействием кислорода и воды, самый частый тип, процесс протекает равномерно и затрагивает всю поверхность. В отличии от всех вышеперечисленных не столь опасных для железа видов окисления этот в своей толще образует гидроксид железа, который, начиная отслаиваться, открывает для разрушения все новые слои металла. Реакция может продолжатся до полного разрушения конструкции. Применяется при выплавке чугуна и как краситель в пищевой промышленности. Встречается в природе в естественном виде под названием гематид.
Несколько видов ржавления могут протекать одновременно, не особо мешая друг другу.
Химическая и электрохимическая коррозия
Железо ржавеет, если в нем есть добавки и примеси (например, углерод) и при этом контактирует с водой и кислородом. Если же в воде растворена соль (хлорида натрия и калия), реакция становится электрохимической и процесс ржавления ускоряется. Массовое применение этих солей как в бытовой химии так и для борьбы с льдом и снегом делают электрохимическую коррозию очень распространенным и опасным явлением: потери в США от использования солей в зимний период составляют 2,5 млрд. долларов. При одновременном воздействии воды и кислорода образуется гидроксид железа, который, в отличие от оксида, отслаивается от металла и никак его не защищает. Реакция продолжается либо до полного разрушения железа, либо пока в системе не закончится вода или кислород.

Электрохимическую коррозию могут вызывать блуждающие токи, возникающие при утечке из электрической цепи части тока в водные растворы или в почву и оттуда — в конструкции из металла. В тех местах, где блуждающие токи выходят из металлоконструкций обратно в воду или в почву, происходит разрушение металлов. Особенно часто блуждающие токи возникают в местах движения наземного электротранспорта (например, трамваев и ж/д локомотивов на электрической тяге). Всего за год блуждающие токи силой в 1А способны растворить железа — 9,1 кг, цинка — 10,7 кг, свинца — 33,4 кг.
Во второй части статьи мы расскажем, как вы можете защитить свои металлоконструкции от этой напасти или победить ее, если она уже атакует.
www.1metallobaza.ru
РЖАВЧИНА – это… Что такое РЖАВЧИНА?
РЖАВЧИНА — РЖАВЧИНА, ржавчины, мн. нет, жен. 1. Краснобурый налет на поверхности железа, образующийся вследствие медленного окисления его в воздухе. Ржавчина ест железо. На машинных частях ржавчина недопустима. 2. Места на болотах, покрытые бурой водой. 3.… … Толковый словарь Ушакова
ржавчина — коррозия; пятно, ржа, слой, налет, пленка, тля Словарь русских синонимов. ржавчина ржа (устар. и прост.) Словарь синонимов русского языка. Практический справочник. М.: Русский язык. З. Е. Александрова. 2011 … Словарь синонимов
РЖАВЧИНА — (её удаление). Металлические изделия смачивают керосином (мелкие изделия погружают в него), оставляют в таком виде на несколько часов, затем вытирают тряпкой. При чистке машинных частей к керосину добавляют 10% (по весу) парафина; применяют также … Краткая энциклопедия домашнего хозяйства
Ржавчина — – продукты коррозии железа и его сплавов, образующиеся при электрохимической коррозии и состоящие преимущественно из окислов. [ГОСТ 5272 68] Ржавчина – продукты коррозии стали, стальной арматуры, образующиеся при электрохимической… … Энциклопедия терминов, определений и пояснений строительных материалов
РЖАВЧИНА — см. Ржавчина поражает листья и стебли. На нижней стороне листьев и на стеблях появляются сперва бурые, потом темно коричневые образования (пустулы) … Энциклопедия семян. Овощные культуры
РЖАВЧИНА — слой частично гидратированных оксидов железа, образующийся на поверхности железа и некоторых его сплавов в результате коррозии, вызванной действием кислорода и влаги. См. также Коррозия … Большой Энциклопедический словарь
Ржавчина — Ржавчина, красно бурый налет на железе, образующийся в результате окисления и ведущий к разрушению металла. В Иез 24:6,11 и след. Р. (евр. хэла; в Синод. пер. накипь ) является символом нечистоты, греха Иерусалима. Греч. слово иос (Иак 5:3)… … Библейская энциклопедия Брокгауза
РЖАВЧИНА — РЖАВЧИНА, ы, жен. 1. Красно бурый налёт на железе, образующийся вследствие окисления и ведущий к разрушению металла, а также след на чём н. от такого налёта. В душе появилась какая то р. (перен.: что то разъедающее, мучащее). 2. Бурая плёнка на… … Толковый словарь Ожегова
РЖАВЧИНА — «РЖАВЧИНА», Россия, Петербург 5 канал ГТРК, 1991. Детектив. В основе сценария фильма документальные материалы из архивов КГБ. Исследуется процесс возникновения организованной преступности, мафии. Картина повествует о событиях 1938 1987 годов. В… … Энциклопедия кино
Ржавчина — Ржавчина: видимые продукты коррозии, состоящие, в случае черных металлов, главным образом, из гидратированных оксидов железа… Источник: ГОСТ 9.402 2004. Единая система защиты от коррозии и старения. Покрытия лакокрасочные. Подготовка… … Официальная терминология
dic.academic.ru
Что такое коррозия и ржавчина на автомобиле. Особенности, причины и как бороться
ЧТО ТАКОЕ КОРРОЗИЯ И РЖАВЧИНА НА АВТОМОБИЛЕ. ОСОБЕННОСТИ, ПРИЧИНЫ И КАК БОРОТЬСЯ
Добрый день, сегодня мы узнаем, что называется автомобильной коррозией и ржавчиной, что способствует развитию этого опасного явления относительно деталей из металла, а также, какие бывают разновидности процесса. Расскажем про то, чем отличается коррозия от ржавчины, какие существуют способы борьбы с этой проблемой и почему так важно знать каждому автовладельцу профилактические меры ухода за металлическими деталями кузова своей машины. В заключении поговорим о том, насколько эффективно в борьбе с коррозионным налетом, средство под названием преобразователь ржавчины и можно ли проблемное место без обработки сразу покрывать краской или необходимо перед этим грунтовать и шпаклевать.

Перед тем, как переходить к определению коррозии и ржавчины, необходимо понимать, в каком месте они появляются. А появляются эти проблемы в подавляющем большинстве на кузове, как несущем элементе транспортного средства и его деталях (крылья, капот, крышка багажника, крыша и прочее). Что же такое автомобильный кузов? Кузовом называется несущая конструкция автомобиля изготовленная из тонкого листового металла, причем разных сплавов и с большим количеством сварных соединительных швов. Кроме того, стоит помнить, что кузов машины используется, как “минус” для бортовой сети, таким образом, он постоянно проводит через себя ток. Поэтому этот элемент просто обязан коррозировать и ржаветь. В материале мы попробуем разобраться, что происходит с кузовом и его деталями в процессе эксплуатации автомобиля, а также, как бороться с коррозионным налетом и ржавчиной.

 ЧТО ТАКОЕ АКТИВНАЯ И ПАССИВНАЯ БЕЗОПАСНОСТЬ КУЗОВА
ЧТО ТАКОЕ АКТИВНАЯ И ПАССИВНАЯ БЕЗОПАСНОСТЬ КУЗОВА

Любой ржавчине всегда предшествует коррозия. Коррозия стали или железа является процессом окисления металла под воздействием кислорода в сочетании с водой. После соединения воды с металлом образуется гидратированный оксид железа, который напоминает рыхлый порошок, вот он и называется ржавчиной. Таким образом, коррозия – это начальная стадия ржавчины и если она своевременно обнаружена, то легко поддается устранению. Сам по себе процесс разрушения кузова – это яркий пример электрохимической коррозии. Однако вода и воздух всего лишь небольшая часть проблемы. Кроме простых химических воздействий, главную роль в процессе играют гальванические вещества, которые проявляются между электрохимически неоднородными парами поверхности.
Таким образом, появление ржавчины или оксида железа появляется в последствии окисления металла после контакта с водой и воздухом. Главной причиной ржавчины является именно вода, которая проникает в поры металла, затем высыхает и на поверхности образуется рыхлый порошок. Если во время не начать бороться с проблемой и не выявить все очаги ржавчины сразу, то такая процедура будет просто бесконечной. Справочно заметим, что ржаветь способно только железо и его сплавы. Цвет ржавчины, как правило, носит оранжевый или красно-коричневый оттенки.

1. Причины появления ржавчины
Теперь мы знаем, что ржаветь способно только железо, которое под воздействием процесса окисления после соединения с водой и воздухом образует на своей поверхности порошок рыхлого вида. Однако, как установили специалисты по обслуживанию автомобилей, коррозия металла довольно часто также образовывается при выделении кузовом машины электронов, которые через электролит (вода с солями) попадают на катод (металлические элементы кузова), который, как магнит притягивает частицы. Результатом процесса, как и в ранее рассмотренном явлении является появление оксида железа – источника любой ржавчины.

Как видим природа возникновения коррозии имеет электрохимическую основу, поэтому разные стыки (особенно возле лобового стекла) и сколы краски до “голого” металла на элементах кузова являются потенциальными местами для поражения ржавчиной. Как только на поврежденных местах появляется вода, а еще хуже с солью, то процесс ржавления довольно быстро начнет выполнять свою работу по превращению металла в оранжевый порошок.

Когда мы понимаем, как устроен процесс коррозии металла, то это дает нам возможность и инструменты для борьбы с ней. В связи с тем, что кузов любой современной машины изготовлен из металла, а точнее железа, то анод и катод, о которых мы сказали ранее, в нашей жизни найдутся всегда. Однако электролит, то есть вода с примесями, который появляется в процессе может быть нами нивелирован до минимума. Справочно заметим, что порой не так страшна чистая вода, как те примеси, которые идут вместе с ней. Как правило, примеси сильно насыщенны разными солями химических реагентов, которые применяются коммунальными службами в зимнее время года, вот они то и ускоряют процесс ржавления металла.
{banner_yandexblokrtb1}
2. Методы борьбы с коррозией. Профилактика коррозионного налета
На сегодняшний день существует определенный методы, которые обеспечивают защиту металлических деталей от коррозии. Данные барьеры заключаются в том, чтобы не допустить физического контакта металла с внешней средой. К таким способам защиты специалисты по обслуживанию и ремонту автомобилей относят специальные лаки, а также краски, которые оберегают поверхностный слой элемента от воздействия атмосферы.

Данный метод защиты называется протекторный. Его принцип действия заключается в том, что специальные средства окисляют ржавый металл, к примеру цинк, который находится в прямом контакте со сталью. В результате протекающей электрохимической реакции, цинк берет на себя коррозию, а железо тем временем находится под защитой. Защитное покрытие такого типа довольно эффективное, даже при наличии механических дефектов на поверхности. Причем, чем толще слой того же цинка, тем дольше работает защита. Ярким примером долгоживущих кузовов с цинковым покрытием и хорошей стойкостью к коррозии можно отнести несущие элементы всем известных машин 90-х: Audi 80 (“Бочка“) и Audi 100 (“Сигара“), которые даже сегодня находятся в прекрасном состоянии, особенно их металл.

Итак, какие же существуют методы борьбы с коррозией и ржавчиной? На сегодняшний день таких методов существует 3: пассивный, активный и электрохимический.
– Пассивный метод: используется в случае необходимости покрытия металла кузова специальным изолирующим покрытием. Таким образом, данный метод обязывает автовладельца загрунтовать, а затем покрасить нужный участок. Метод является наиболее эффективным в случае предупреждения появления или начальной стадии образования коррозии. После обработки участка, необходимо на систематической основе следить за целостностью нанесенного защитного покрытия и проверять его на появление мелких сколов или трещин, которые могут образовываться в процессе эксплуатации автомобиля.

Кроме того, после обработки участка или всего кузова машины, необходимо проводить определенные профилактические мероприятия связанные с чистотой кузова, например регулярно посещать автомойку и периодически обрабатывать поверхность машины воском. Благодаря воску, вода не задерживается на деталях кузова, она просто скатывается большими каплями на землю.

Активный метод: борьбы с коррозией основывается на использовании разного рода защитных покрытий на металлические элементы кузова. Для этого процесса применяются специальные герметики, мастики и антикоррозионные средства. Автохимические средства для такого процесса применяются на основе специальных формул. Как правило, препараты такого вида используются для защиты участков, которые наиболее подвержены коррозионному процессу, например такими местами у автомобиля являются днище, арки и пороги. Дополнительная защита такого рода будет эффективно оберегать участки кузова только в том случае, если нанесение препаратов производилось на сухую и чистую поверхность, в противном случае под покрытием может оставаться вода, которая будет создавать коррозионный налет.

– Электрохимический метод: борьбы с коррозией автовладельцами используется значительно реже, чем остальные, так как стоимость проведения такой процедуры очень высокая. Кроме высокой стоимости, в автомобиле нужно постоянно перевозить специальное электронное устройство, которое уберегает кузов от образования коррозионного налета. Суть электрохимического метода заключается в том, что благодаря изменению электродного потенциала, процессы коррозии в машине могут проходить только в определенных участках на кузове. Таким образом, автовладелец, в какой степени начинает управлять коррозией, так как катодом уже являются не элементы кузова транспортного средства, а специальный электрод, который принимает на себя весь удар ржавчины.
3. Способы и средства для удаления ржавчины
В том случае, если коррозионный налет вовремя не удалось обнаружить и устранить, в следствие чего образовалась ржавчина на том или ином элементе кузова автомобиля, то не нужно волноваться, еще не все потеряно, ее просто нужно удалить. Чтобы это осуществить, необходимо использовать слабый раствор щелочной кислоты на примере ортофосфорной, которой обрабатывается проблемный участок, а затем он при помощи механических воздействий удаляется. Для механического удаления, как правило, применяются металлические щетки и наждачная бумага. При покупке щелочной или ортофосфорной кислоты, нужно очень внимательно изучить инструкцию, а затем при работе ее четко соблюдать, так как данный препарат по своим свойствам является агрессивным веществом. Принцип действия препарата основан на разъедании ржавчины изнутри. Щелочная кислота является очень эффективным препаратом по борьбе с ржавчиной.

Кроме того, не будем забывать, что сегодня в автомагазинах можно найти специальные преобразователи или модификаторы ржавчины. Данные средства в процессе химической реакции не разъедают, а наоборот преобразуют оксид в таннат железа, который выступает в роли стабильного вещества. Дорогие и более качественные преобразователи в своем составе могут содержать дополнительные вещества, такие как полимеры, которые выступают в качестве грунтовки. Однако преобразователи и модификаторы обладают определенными минусами. Заключаются они в том, что если оксид металла не сможет обработаться в полном объеме и останется на обрабатываемом участке, то дальнейший процесс коррозии продолжится, причем в ускоренном темпе.

Что же такое преобразователь ржавчины? Это специальное средство предназначенное для химического преобразования ржавчины на поверхности металлического элемента кузова, который предотвращает дальнейшую наружную коррозию слоя фосфатов и хроматов цинка с железом. Также такое вещество рекомендуется применять в профилактических целях для обработки еще не тронутого коррозией металла перед нанесением грунтовки. Кроме того, преобразователи применяются для увеличения сцепления поверхности металла с лакокрасочным покрытием.

Преобразователи ржавчины всегда есть в наличии в магазинах, причем существует большое множество видов этого полезного средства. Что касается цены, то она совсем не высока и в среднем колеблется от 2 до 5 долларов США в эквиваленте. Использовать такие препараты довольно просто, первоначально необходимо зашкурить проблемный участок до чистого металла, а затем при помощи губки или пульверизатора нанести преобразователь на поверхность. После нанесения вещества, примерно 12-24 часа дают средству, на то чтобы оно впиталось в металл. После высыхания и впитывания, обработанный участок будет выглядеть зеленым цветом. Это говорит о том, что наш модификатор преобразовал ржавчину.

После того, как участок обработан и имеет зеленоватый оттенок, можно переходить шпаклевке, грунтовке и дальнейшей покраске. На распространенный вопрос многих автолюбителей: “Можно ли не шпаклевать и не грунтовать обработанный участок после нанесения преобразователя?”, ответ специалистов по обслуживанию и ремонту транспортных средств однозначен, чтобы элемент кузова был надежно защищен, шпаклевать, а также грунтовать поверхность металла нужно в обязательном порядке. По завершению всех работ на поврежденном участке, рекомендуется провести антикоррозионную обработку всего автомобиля.
Видео обзор: “Что такое коррозия и ржавчина на автомобиле. Особенности, причины и как бороться”
В заключении отметим, что все методы и способы защиты от коррозии с ржавчиной, которые мы перечислили в нашей статье отлично взаимодополняют друг друга. Однако случается такое, что порой из-за незначительной ошибки в процессе обработки по истечению определенного времени, снова появляется ржавчина с буро-рыжим оттенком. В таком случае, не стоит волноваться, просто нужно действовать крайне быстро, так как запускать этот процесс не в коем случае нельзя, в связи с тем, что устранить проблему будет потом очень сложно и может потребоваться даже замена того или иного элемента кузова, если он не играет несущей функции, как кузов.
БОЛЬШОЕ СПАСИБО ЗА ВНИМАНИЕ. ОСТАВЛЯЙТЕ СВОИ КОММЕНТАРИИ, ДЕЛИТЕСЬ С ДРУЗЬЯМИ.
ЖДЕМ ВАШИХ ОТЗЫВОВ И ПРЕДЛОЖЕНИЙ.
bazliter.ru
Что такое ржавчина и как с ней бороться: оксиды железа
Как показывает практика, ржавчина (коррозия) поражает почти 12% производимого в мире железа. В связи с тем, что окружающая среда становится все более агрессивной, в том числе из-за ее загрязнения, металлы эксплуатируются все в более сложных условиях. Оксиды серы или азота, выделяемые из атмосферы, образуют микрокапли азотной или серной кислоты, что приводит к существенному возрастанию скорости появления ржавчины.
Химические основы процесса коррозии железа
Железо является химически активным металлом. Оно в присутствии кислорода и воды подвергается окислению, при этом образуя разнообразные соединения: оксиды, гидроксиды, гидраты оксидов. Химки констатируют, что определенной формулы ржавчины нет. Что такое ржавчина? Это коррозия, которая образуется вследствие окисления железа. Она обладает переменным составом, который зависит от окружающей среды.

Ржавчина поражает железо по его всей поверхности. Однако самыми уязвимыми являются внутренние и внешние узлы изделий, сварочные швы, резьбовые соединения. Структуры ржавого железа отличаются значительной степенью рыхлости. У ржавчины отсутствует какое-либо сцепление с металлом. Вследствие того, что поверхность высокопористой коррозии свободно удерживает в себе атмосферную влагу, создаются оптимальные условия для дальнейшего разрушения железа.
Обычно цвет ржавчины – красно-бурый, коричневый, который не позволяет оценить состояние железа под слоем коррозии. Под ржавчиной металл может быть окончательно разрушен. Если не принимать меры для предотвращения ее распространения, то результаты воздействия коррозии на железо могут оказаться катастрофическими, привести к полному разрушению конструкций. Это особенно опасно, если ржавчина разъела опоры ЛЭП или дно морского судна. Что такое ржавчина для автомобиля, и какой вред она несет, известно каждому автомобилисту.

Причины появления ржавчины
Ржавчина начинает появляться тогда, когда металл контактирует с кислородом, водой, окислителями либо кислотами. Одним из условий того, что металл подвергается ржавчине, является наличие в нем примесей либо добавок. Если имеет место контакт железа с внешними раздражителями в присутствии соли (соленая вода), то коррозия разрушает его значительно быстрее в виду начала электрохимических реакций.
Если железо является чистым, без примесей, то оно к воздействиям кислорода и воды значительно устойчивее. Так же, как и у них металлов, таких как алюминий, на его поверхности образуется плотное оксидное покрытие (слой пассивации), который обеспечивает защиту основной массы железа от более глубокого окисления. Однако и этот слой может быть разрушен, если начинается взаимодействие железа с кислородом и водой совместно.

Иными факторами, которые активно разрушают железо, являются углекислый газ в воде и серный диоксид. При их воздействии очень активно образуются разнообразные типы гидроксида железа. Они, в отличие от оксидов железа, не могут защитить металл. Гидроксид, формируясь, начинает отслаиваться от поверхности железа, после чего негативному воздействию подвергается нижний слой, который также отслаивается. И этот процесс длится до того времени, пока весь металл не будет уничтожен, либо в окружающей среде не останется кислорода, диоксида углерода, серы и воды.
Если железо, подвергаясь сгоранию на воздухе, контактирует с кислородом, то имеет место образование оксида железа ii.
При сгорании в чистом кислороде — оксид IV.
Оксид железа iii образуется тогда, когда через металл, находящийся в расплавленном состоянии, проходит воздух или кислород.
Состав ржавчины
Ржавчина, которая образуется в обычных условиях, является как правило смесью 3 оксидов железа. Они образуются не в один момент и имеют разные физико-механические свойства. Железные оксиды с самого нижнего слоя по направлению к поверхности представляют собой сочетание следующих составляющих:
- Вюстит (оксид железа) – мягкая структура, зависящая от условий, в которых находится металл. Если температура хранение высокая, то этот слой наибольший.
- магнетит (магнитный железняк) – окись-закись железа, обладающая более высокой пористостью, чем вюстидный слой, и меньшей твердостью. Это структура имеет выраженные магнитные свойства.
- Гематит (красный железняк) – обычно это структура красно-серого цвета, твердое абразивное вещество. Гематит обладает более высокой плотностью, разъедает металл и увеличивает коэффициент трения при соприкосновении с поверхностями.

Перед тем, как заняться работами по ликвидации ржавчины, необходимо узнать состав металла, особенно на его поверхности, а также установить условия, которые способствовали ее появлению. Располагая такой информацией, достаточно просто найти оптимальный вариант для удаления оксида железа и выбрать наиболее эффективные средства для борьбы с ржавчиной.
Классификация способов борьбы с коррозией
С учетом основных составляющих коррозии, способы, как вывести ржавчину, делятся на следующие:
- Механический – ликвидация оксидного слоя осуществляется посредством жестких металлических щеток, наждачной бумаги и т. п.
- Тепловой – осуществляется посредством воздействия на коррозию высоких температур, обычно в сочетании с водяным и (или) воздушным потоками.
- химический – удаление оксидов железа осуществляется вследствие воздействия на них специальными средствами, растворяющими ржавчину, при нанесении их на поверхность металла.
Необходимо учитывать, что эффективность вышеуказанных методов различна. Так, если процесс образования коррозии установлен своевременно, и это небольшое пятно, то поверхность железа можно эффективно обработать стальной щеткой, наждачный крупнозернистой бумагой, угловой шлифовальной машиной с соответствующей насадкой.
Однако если установлено, что ржавчина захватила большие поверхности, то тогда оптимальными методами будут химические.
Если площади ржавого металла очень большие, их невозможно транспортировать, то тогда оптимальным считается тепловая обработка, но она связана с высокой трудоемкостью.
Обычно обработка металла для удаления ржавчины осуществляется комбинированными способами, при которых различные методы применяют в определенной последовательности.
Механические способы
Выбор определенного способа механической обработки зависит от вида поверхности железа. Так для мотков стальной проволоки применяют ее перематывание с одного носителя на другой. В этом случае при перегибах ржавчина отделяется от поверхности металла.

При удалении коррозии механическим способом обычно используют жесткие щетки из стальной щетины или наждачную бумагу (крупнозернистую).
К недостаткам механических способов избавления от ржавчины относится тот факт, что на поверхности железа остаются следы, образованные очистительным инструментом. Поэтому рекомендуется поверхность очищенного железа подвергать полировке для придания ей прежнего внешнего вида.
Тепловая очистка
Для удаления ржавчины тепловыми методами необходимы специальные установки (промышленные парогенераторы либо строительные фены). Способ очистки от оксидов железа основан на том, что контакт ржавчины с основным металлом не прочен. Воздействие повышенной температуры и горячей влаги при большом скоростном воздушном потоке такое, что ржавчина удаляется практически полностью.
Наиболее эффективен этот метод тогда, когда на обрабатываемую поверхность подается и горячий пар. Паровоздушная смесь в струе, которая подается на металлическую поверхность под давлением, приводит к размягчению ржавчины, дроблению на отдельные фрагменты, которые удаляются с поверхности железа воздушным потоком.
Эти методы особенно эффективны, когда необходимо удалить ржавчину со стальных дверей, вентиляционных конструкций, металлических структур, демонтировать которые невозможно либо затруднительно.
Химическая очистка
В настоящее время методы химической очистки металлических поверхностей от ржавчины очень разнообразны. Однако у всех в основе лежит один процесс – удаление коррозии посредством химического воздействия на нее растворами кислот.
К наиболее эффективным способам избавления от окислов железа относят воздействие на ржавчину соляной кислотой, особенно когда ее концентрация в растворе составляет не менее 15%. Если концентрация меньше, то растворение ржавчины существенно замедляется.
Кислотные составы, сделанные на основе серной кислоты, применять не следует, так как в результате воздействия на поверхности железа образуется слой гидридов, которые повышают хрупкость металла.

Если необходимо осуществить химическую очистку металла в домашних условиях, то возможно применение неагрессивных веществ, таких как лимон, уксус и т.п. Принцип воздействия на коррозию такой же. Эти вещества достаточно хорошо растворяют ржавчину, которая потом легко удаляется ветошью. Что такое ржавчина и как ее удалить, вероятно, знает большинство домохозяек.
Применение иного оборудования для удаления коррозии металла
Механические методы борьбы со ржавчиной возможно использовать далеко не всегда, особенно если металлические изделия имеют сложные формы.
Химические методы имеют также определенные недостатки. Если не соблюдать технику безопасности, то можно получить химический ожог либо отравление. Есть сложности с утилизацией отработанных растворов.

Вследствие этого наиболее оптимальным является применение способа так называемого мягкого бластинга. Его принцип состоит в том, что на поверхность металла, поврежденного ржавчиной, направляется струя сжатого воздуха, которая содержит в себе абразивные составляющие.
Изменяя давление в струе, можно регулировать глубину слоя, который снимается. Это приводит к тому, что удаляется только ржавчина, тогда как сам металл остается сохранным. Гранулы, которые действуют на коррозию, состоят из мелкодисперсной соды и мела, можно применять и очень мелкий песок.
fb.ru


