Ученые нашли способ удешевить производство магния
Коллектив ученых кафедры цветных металлов и золота Национального исследовательского технологического университета «МИСиС» нашел способ удешевить процесс получения технического магния, широко применяемого в авиации и оборонной промышленности. Усовершенствовав процесс, ученые смогли повысить выход магния на 15% и уменьшить расход электроэнергии на 5%. В результате, производительность заводов, выпускающих магний, может вырасти до 10%.
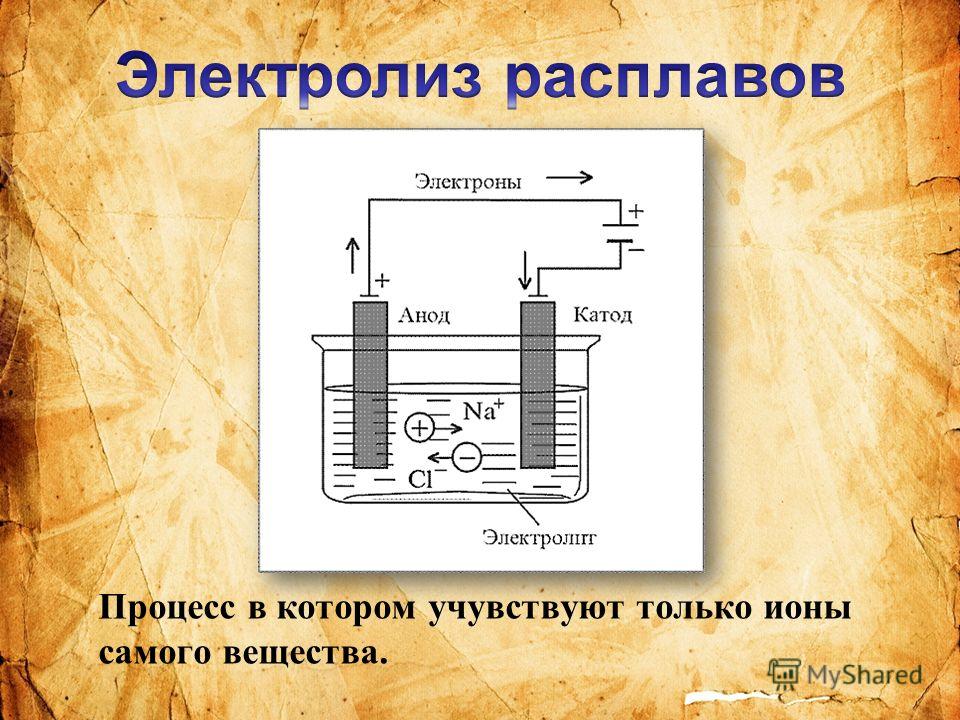
Технический магний — конструкционный материал, широко используемый в сплавах для авиационной, космической, оборонной промышленности. Традиционно, чистый магний получают путем электролиза его из соединения — MgCl2 в хлоридной среде, где он разлагается электролитически. На катоде (электрод с отрицательным зарядом) выделяется жидкий магний, а на аноде (электрод с положительным зарядом) газообразный хлор.
Однако есть проблема — в традиционных условиях электролиза выход по току не превышает 80%.
«В традиционных условиях электролиза соединения магний-хлор на катод выделяется жидкий магний, а на анод — газообразный хлор. Из-за того, что капельки магния перемешиваются газом, они легко соединяются обратно. Мы нашли способ предотвратить этот процесс, понизив температуру электролита, и заставили выделяться магний в твердом виде» — рассказывает Андрей Лысенко, к.т.н., руководитель исследования, доцент кафедры цветных металлов и золота НИТУ «МИСиС».
Однако оставалось понять, как отделить затвердевший магний от катода, ведь просто соскребать его — сложно и неэффективно.
Стоит отметить, что электролиз — не единственный способ разделения соединения MgCl2. Например, иногда применяется вакуумная дистилляция, однако это куда более дорогостоящий метод. Получается, что разработка ученых НИТУ «МИСиС» — наиболее эффективный и дешевый способ получения технического магния из всех, существующих сегодня.
В ближайшем будущем ученые планируют заняться вопросом автоматизации всего цикла — от расплавления хлорида магния в электролите до вычерпывания расплава готового магния.
Законы электролиза Фарадея • Джеймс Трефил, энциклопедия «Двести законов мироздания»
При электролизе масса превращенного вещества прямо пропорциональна количеству электричества, прошедшего через электролитическую ячейку.
При прохождении через электролит одного и того же количества электричества масса превращенного вещества зависит от массы и заряда ионов вещества.
Два закона электролиза — это всего лишь небольшая часть вклада Майкла Фарадея в науку. Электролиз — это совокупность процессов, происходящих при пропускании электрического тока через электролит — плавленое ионное вещество (например, плавленая соль) или раствор, в котором присутствуют ионы. Электрический ток проходит через электролит от одного электрода к другому. Положительно заряженные ионы при этом движутся к отрицательному электроду, катоду
, а отрицательно заряженные — к положительному электроду, аноду. Химические реакции происходят на электродах. Фарадей провел фундаментальные исследования электролитов и создал законы, в которых говорится, что химические превращения связаны с потоком электронов (то есть электрическим током): чем больше электронов, тем больше химических превращений.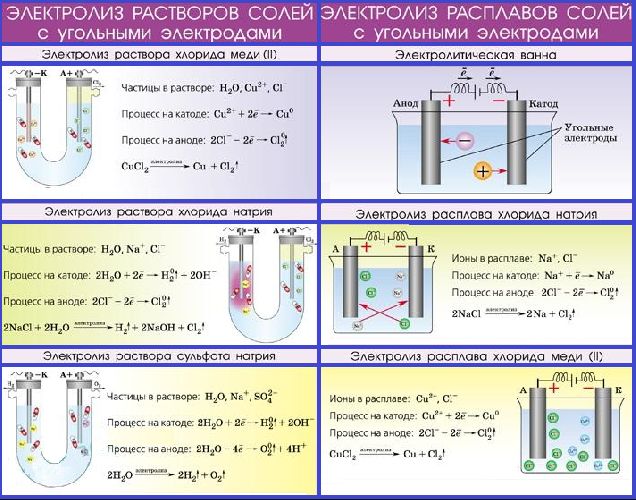
Электролиз — это важный промышленный процесс, используемый как при получении определенных металлов, так и при конечной обработке поверхностей методом нанесения гальванического покрытия. Примером электролиза в действии может быть электролитическое рафинирование меди после ее выделения из руды. Выступающие в качестве катода тонкие листы чистой меди опускают в электролит, содержащий раствор сульфата меди и серную кислоту, а слитки неочищенной меди подвешивают в этом же растворе, и они действуют как анод. При пропускании электрического тока анод начинает растворяться, и ионы меди, вместе с некоторым количеством ионов железа и цинка, поступают в электролит. Остальные спутники меди, содержавшиеся в слитках (включая значительное количество серебра, золота и платины), выпадают в осадок и накапливаются на дне электролитической ванны. Ионы меди через электролит направляются к катоду и осаждаются на нем. Цинк и железо остаются в растворе.
В промышленных масштабах в подобных ваннах за месяц можно очистить всего несколько тонн меди, но при этом получается продукт 99,96-процентной чистоты. Более того, благодаря извлечению из осадка благородных металлов окупается весь процесс очистки. Кроме меди, электролитическим методом в промышленных масштабах очищаются также магний, натрий и алюминий.
Более того, благодаря извлечению из осадка благородных металлов окупается весь процесс очистки. Кроме меди, электролитическим методом в промышленных масштабах очищаются также магний, натрий и алюминий.
В описанном выше процессе рафинирования меди атом меди переходит в электролит в виде иона, теряя два электрона. Следовательно, на аноде он принимает два электрона, и ион снова превращается в нейтральный атом меди (можно представить себе, что эти два электрона бегут по проводу, как электрический ток). Согласно первому закону Фарадея, для того чтобы очистить в два раза больше меди, необходимо в два раза больше электронов.
Больше чем просто источник энергии
Водород используется в различных промышленных процессах, начиная от производства синтетического топлива и нефтехимии до изготовления полупроводников и электромобилей на водородных топливных элементах. Чтобы уменьшить вредное воздействие на окружающую среду в связи с производством 70 млн тонн водорода в год, некоторые страны обращаются к ядерной энергетике.
«Например, перевод всего лишь 4% текущего производства водорода на электроэнергию, вырабатываемую АЭС, позволил бы уменьшить выбросы углекислого газа на 60 млн тонн в год, — объясняет Хамис. — А если бы весь водород производился с использованием ядерной энергии, то можно было бы говорить о сокращении выбросов углекислого газа на более чем 500 млн тонн в год».
Ядерные энергетические реакторы могут быть соединены с установкой по производству водорода в единую систему когенерации для экономически эффективного производства одновременно электроэнергии и водорода. При производстве водорода когенерационная система оснащается компонентами либо для электролиза, либо для термохимических процессов. Электролиз — это процесс выделения водорода и кислорода из молекул воды с помощью постоянного электрического тока. Электролиз воды проходит при относительно низких температурах от 80°C до 120°C, в то время как электролиз водяного пара проводится при гораздо более высоких температурах и поэтому является более эффективным. Электролиз пара может идеально подходить для интеграции с усовершенствованными высокотемпературными АЭС, поскольку для этого процесса требуется подвод теплоносителя с температурой от 700°C до 950°C.
Электролиз пара может идеально подходить для интеграции с усовершенствованными высокотемпературными АЭС, поскольку для этого процесса требуется подвод теплоносителя с температурой от 700°C до 950°C.
Термохимические процессы позволяют производить водород с помощью химических реакций с определенными соединениями при высоких температурах для расщепления молекул воды. Усовершенствованные ядерные реакторы, способные работать при очень высоких температурах, также могут использоваться в целях производства тепла для этих процессов.
«Производство водорода с использованием серно-йодного цикла, в частности, имеет большой потенциал в плане расширения масштабов применения для обеспечения устойчивой и долгосрочной эксплуатации, — рассказывает Хамис. — Разработка этого метода с использованием конструкций японского реактора HTTR и китайских конструкций HTR‑PM 600 и HTR‑10 является весьма многообещающей, в рамках других исследовательских инициатив также продолжает наблюдаться отличный прогресс».
В настоящее время несколько стран внедряют производство водорода с использованием АЭС или изучают такую возможность в целях содействия декарбонизации своего энергетического, промышленного и транспортного секторов. Это позволяет также увеличить отдачу от АЭС, что может способствовать повышению ее рентабельности.
МАГАТЭ оказывает поддержку странам, заинтересованным в производстве водорода, посредством различных инициатив, в том числе проектов координированных исследований и технических совещаний. Оно разработало также Программу экономической оценки водорода (HEEP) — инструмент для проведения экономической оценки крупномасштабного производства водорода с помощью ядерной энергии. В начале 2020 года МАГАТЭ запустило также электронный учебный курс, посвященный производству водорода с помощью ядерной когенерации.
«Производство водорода с использованием АЭС имеет большой потенциал в плане содействия усилиям по декарбонизации, но сначала необходимо решить ряд вопросов, таких как определение экономической целесообразности включения производства водорода в более широкую энергетическую стратегию, — говорит Хамис.
Ученые ТПУ разрабатывают электролизер для водородной энергетики
ТОМСК, 10 дек –
РИА Томск. Исследователи лаборатории импульсно-пучковых, электроразрядных и
плазменных технологий Томского политехнического университета (ТПУ)
разрабатывают промышленную установку (электролизер) для получения водорода на
АЭС; запуск ее в серийное производство позволит вывести
экологически чистую водородную энергетику на новый уровень.
Ранее сообщалось, что водородная энергетика – одно из ведущих направлений по разработке экологически чистых способов получения энергии. Рамочная конвенция ООН, подписанная Россией в 2015 году, предполагает кратное сокращение выбросов углерода при производстве электроэнергии в ближайшее десятилетие. Основными “поставщиками” углекислоты в атмосферу являются объекты традиционной энергетики (ГРЭС и ТЭЦ).
По данным открытых источников, будучи самым распространенным элементом на Земле и в космосе, водород, тем не менее, остается почти невостребованным. Если в 2018 году в мире было добыто 4,4 миллиарда тонн нефти и 3,86 триллиона кубометров природного газа (метана), то объем производства водорода не превышает 70 миллионов тонн, то есть объем его выработки в 6285 раз меньше, чем нефти, и в 5514 раз меньше, чем газа.
© пресс-служба Томского политехнического университета Водород, который сегодня используется в экономике, принято разделять на “серый” – из угля, нефти и газа, “голубой” – на теплоэлектростанциях или АЭС с технологией CCS – и “зеленый” – выделенный из воды (ВИЭ). Согласно недавним
исследованиям Wood Mackenzie, сегодня 99% водорода являются “серым” и
“голубым”, его выработка создает огромный углеродный след,
сопоставимый с половиной суммарных выбросов CO2 всей экономикой России, и
только 1% водорода считается экологичным “зеленым”.
Согласно недавним
исследованиям Wood Mackenzie, сегодня 99% водорода являются “серым” и
“голубым”, его выработка создает огромный углеродный след,
сопоставимый с половиной суммарных выбросов CO2 всей экономикой России, и
только 1% водорода считается экологичным “зеленым”.Для масштабного перехода к получению энергии от сжигания водорода необходимо разработать технологии его производства, сопоставимые по объемам выпуска с традиционными источниками углеводородов. Однако самый дешевый способ его производства – паровой риформинг (каталитическая конверсия углеводородов – метана, пропан-бутана, бензина, керосина, дизтоплива, угля – в присутствии водяного пара) в ходе реакции создает огромные объемы СО2.
Альтернатива пиролизу
Альтернативным методом получения водорода в промышленных масштабах (а именно такие нужны для запуска водородных электростанций) является электролиз.
Электролиз – это процесс
разложения воды под действием постоянного электрического тока на кислород и
водород. Химическая реакция идет по схеме: 2Н2O + энергия —> 2h3+O2. Его преимущества: доступное сырье – деминерализованная вода и электроэнергия; отсутствие
загрязняющих выбросов; процесс автоматизирован; на выходе получается достаточно
чистый (99,99%) продукт. Главный недостаток – получение водорода дороже, чем
при риформинге, в 1,5–3 раза.
Химическая реакция идет по схеме: 2Н2O + энергия —> 2h3+O2. Его преимущества: доступное сырье – деминерализованная вода и электроэнергия; отсутствие
загрязняющих выбросов; процесс автоматизирован; на выходе получается достаточно
чистый (99,99%) продукт. Главный недостаток – получение водорода дороже, чем
при риформинге, в 1,5–3 раза.
В такой системе координат в выигрыше оказываются производители электроэнергии высокой мощности, которые могут “вложить” ее в производство высоколиквидного “зеленого” топлива. В России это главным образом атомщики, рассказал РИА Томск главный специалист лаборатории импульсно-пучковых, электроразрядных и плазменных технологий ТПУ Виктор Дмитриенко.
© пресс-служба Томского политехнического университета “На атомных станциях себестоимость электроэнергии очень низкая. И мощности, как правило, избыточные. Потому мы сейчас предполагаем, что сможем заключить контракт с Росатомом, который хочет использовать свою дешевую электроэнергию для производства водорода. Это позволит корпорации стать крупнейшим производителем
этого экологичного топлива в России”, – сказал Дмитриенко.
Это позволит корпорации стать крупнейшим производителем
этого экологичного топлива в России”, – сказал Дмитриенко.Промышленные установки для получения водорода методом электролиза известны более 60 лет, поясняет ученый. В основном это электролизеры фильтр-прессного типа, которые на выходе позволяют получать водород и кислород.
Широкое распространение они получили в традиционной углеводородной энергетике – их устанавливают на ГРЭС и ТЭЦ, где водород используют для охлаждения турбинных подшипников, неизбежно раскаляющихся от трения. Еще один способ их использования – электролиз цветных металлов из измельченной руды. К примеру, золота. Но для выработки водорода как товарного продукта они не подходят.
“Наша цель –
разработать электролизер, который бы обладал улучшенными характеристиками по
сравнению с существующими. Соответственно, электролизер фильтр-прессного типа
нам не подходит. Мы взяли за основу конструкцию мембранного типа, в которой
катодное и анодное пространство разделены ионообменной мембраной”, – рассказывает Дмитриенко.
Мембрана особого назначения
Казалось бы, электролиз – доступный и давно известный способ получения водорода из воды. Однако, если применять “школьную” конструкцию электролизера, вместо СО2 неизбежно будет вырабатываться не менее опасный побочный продукт – хлор (CI2), который появляется на аноде.
© предоставлено пресс-службой ТПУ “Представьте, в Красноярске завод “Красцветмет” находится в городской черте. Если применять там электролиз для осаждения цветмета из руды без применения мембраны, будут вырабатываться огромные объемы хлора. Это значит, нужно строить дорогую систему очистки, утилизации, вентиляции. И все равно в жилых районах это будет бомба замедленного действия. Лучше вовсе избежать появления опасных соединений”, – утверждает ученый.Большинство
имеющихся на рынке мембранных электролизеров разделяют катодную и анодную
камеры, в которых происходит электролитическая диссоциация (химическая реакция,
вызванная электрическим напряжением в жидком растворе), прокладкой из асбеста. Мембрана,
которую используют томские политехники, сложнее.
Мембрана,
которую используют томские политехники, сложнее.
“На нашей установке, в ходе электролиза, мы будем получать три продукта – водород, чистый медицинский кислород и 40%-ный раствор щелочи (КОН или NaОH). Все три составляющих – это товарные продукты. Но главная наша задача – разработать экономически выгодный электролизер для производства водорода в промышленных масштабах”, – подчеркивает Дмитриенко.
От бумаги до железа
В настоящий момент исследователи ведут переговоры с Росатомом для включения своих исследований в программу водородной энергетики, запущенную в госкорпорации.
“У нас есть
опыт работы с мембранными электролизерами. Мы уже выполняли работы по заказу
“Трансгаза”, там наш мембранный электролизер работал над изменением
рН-среды. Есть опыт разработки и изготовления различных электролизеров с катионо-
и анионообменными мембранами для
осаждения золота из продуктивных растворов”, – рассказывает Дмитриенко.
Промышленный мембранный электролизер для осаждения золота. Разработка ТПУ
За свою историю сотрудники лаборатории импульсно-пучковых, электроразрядных и плазменных технологий ТПУ изготовили порядка 20 установок для электролиза. Для нужд “Алданзолото ГРК” политехники изготовили электролизер с анионообменными мембранами, для Дальневосточного федерального университета – опытно-промышленную установку осаждения металлов с катионо- и анионообменными мембранами, а для ООО “Гелиос” – pH-корректор с биполярными мембранами.
Опытной установки для производства водорода, “заточенной” под потребности Росатома, “в железе” пока нет, признает Дмитриенко.
© с сайта ТПУ “Предварительная конструкция у нас уже проработана. Все необходимые чертежи подготовлены. При наличии финансирования собрать опытную установку мы сможем быстро. Финансирование мы планируем получить от Росатома, если попадем в их водородную программу”, – отмечает ученый.
Не в одиночку
Ранее также сообщалось, что в ноябре 2020 года ТПУ вошел в состав консорциума по развитию водородных технологий, который получил название “Технологическая водородная долина”. Помимо ТПУ в консорциум вошли Институт катализа СО РАН, Институт проблем химической физики РАН, Институт нефтехимического синтеза РАН, Самарский государственный технический университет и Сахалинский государственный университет.
Участники консорциума будут вести совместные разработки технологий по всей “водородной цепочке”: от получения до использования водорода. Консорциум планирует тесное сотрудничество с крупнейшими компаниями РФ, заинтересованными в развитии водородной энергетики.
Электролиз воды → Реакция • Диаграмма • Напряжение • Уравнение • Формула
электролиз это разложение химической молекулы под действием внешнего электрического напряжения. Электролиз может сопровождаться электролитической диссоциацией, переносом ионов к электродам или вторичными ионными превращениями на электродах.
Не фильтруйте воду. Очисти ее! Мы представляем революционную технологию УФ-светодиодной лампы для обеззараживания воды от Acuva. Мы первый эксклюзивный дистрибьютор в Европе!
Электролиз водыэлектролиз вода это процесс разложения молекулы воды под действием электрического тока на водород и кислород.
Процесс электролиза происходит в системах, содержащих вещества, способные к ионизацияраспадается на ионы и происходит с принудительной миграцией ионов в Электрод погружены в вещества, когда к ним приложено электрическое напряжение.
Отрицательно заряженный электрод называется катод, а положительно заряженный электрод – анод.
Смотрите также: Обратный осмос
Каждый электрод притягивает ионы с противоположным зарядом:
– положительно заряженный движется к катоду катионы
– отрицательно заряженные направляются на анод анионы
Ионы передают свой заряд электродам и могут вступать с ними в химическую реакцию.
В этой реакции они возникают электрически нейтральные химические соединения Lub корнеплоды.
Ионы, которые блуждают в веществе, могут вступать в химические реакции с другими ионами. Образованные таким образом вещества осаждаются на электродах или высвобождаются в виде газ.
Смотрите также: Фильтр для воды
Катодные и анодные реакции электролиза водыкатодная реакция (восстановление)
2h3O + 2eˉ → h3 + 2OHˉ
анодная реакция (окисление)
2h3O → O2 + 4H + + 4eˉ
Уравнение электролиза воды
Сводное уравнение электролиза воды:
2h3O → 2h3 + O2
Реакция электролиза воды
Электролиз воды, реакция, протекающая на электродах, дает продукты этого процесса в виде газообразных элементов:
– кислород – на аноде
-водород – на катоде
Смотрите также: Рукомойник
Схема электролиза воды
Схема электролиза воды реакции представлены ниже:
Опыт электролиза воды
Электролиз воды можно проводить с:
– источник постоянного тока, то есть аккумулятор или выпрямитель, преобразующий переменный ток в постоянный
-электроды
-вольтметр
-амперметр
-резистор для регулирования разности потенциалов между электродами
Электроды представляют собой металлические проводники, которые погружены в раствор электролита и подают или проводят электрический ток.
Эффективность процесса электролиза воды позволяет получать чистый водород и кислород в промышленных масштабах простым и относительно дешевым способом.
Электролиз применяют:-при производстве некоторых металлов: алюминия, лития, натрия, калия
-при производстве простых веществ и химических соединений
– проводить окислительные и восстановительные процессы
-в процессе гальваники – для покрытия металла тонким слоем другого металла
В результате электролиза в приборах, называемых ионизаторы сформированный ионизированная щелочная вода, обладающие лечебными свойствами.
Считается, что щелочная вода помогает бороться с диабетом, аллергией и даже раком, поддерживая иммунную систему. Щелочной pH снижает закисление организма и нейтрализует действие свободных радикалов.
Во время электролиза воды напряжение тока заставляет молекулы воды распадаться на водород и кислород.
Электролиз дистиллированной воды не происходит. Процесс электролиза касается веществ, растворенных в воде, поэтому электролиз воды с растворенной в ней солью происходит в ионизаторе, и молекулы разлагаются под действием постоянного тока.
Формула электролиза воды
Формула электролиза воды: h3O = H + + OHˉ.
В ионизаторе катод притягивает положительные ионы водорода к основному сосуду, а анод собирает отрицательные ионы в съемном сосуде.
Положительные ионы образуют ионизированную щелочную воду, в которой есть такие элементы, как кальций, магний и калий.
С другой стороны, отрицательные ионы создают кислую воду.
Смотрите также: Пьющий
4.6 / 5 ( 27 голосов )
Получение водорода электролизом воды / Инструменты, цифровые технологии, связь, измерения / Элек.
 ру
руПолучение чистого водорода путем электролиза воды — самая очевидная и эффективная технология, и один из наиболее перспективных способов получения альтернативного топлива. Водород добывают из любого водного раствора, а при сгорании он превращается обратно в воду.
По сравнению с прочими методами получения водорода, электролиз воды отличается целым рядом преимуществ. Во-первых, в ход идет доступное сырье — деминерализованная вода и электроэнергия. Во-вторых, во время производства отсутствуют загрязняющие выбросы. В-третьих, процесс целиком автоматизирован. Наконец, на выходе получается достаточно чистый (99,99%) продукт. Из всех методов электролиза наиболее перспективным считают высокотемпературный электролиз (себестоимость водорода от 2,35 до 4,8 $/кг). Его следует иметь на технологическом вооружении, поскольку при определенных экономических условиях он может быть использован в крупнопромышленном масштабе.
Электролизом воды называется физико-химический процесс, при котором под действием постоянного электрического тока дистиллированная вода разлагается на кислород и водород. В результате разделения на части молекул воды, водорода по объему получается вдвое больше, чем кислорода. Эффективность электролиза такова, что из 500 мл воды получается около кубометра обоих газов с затратами около 4 квт/ч электрической энергии.
В результате разделения на части молекул воды, водорода по объему получается вдвое больше, чем кислорода. Эффективность электролиза такова, что из 500 мл воды получается около кубометра обоих газов с затратами около 4 квт/ч электрической энергии.
Технологический ток для протекания процесса электролиза воды для получения водорода и кислорода получается, как правило, при помощи промышленного выпрямителя с необходимыми рабочими параметрами, Обычно это напряжение до 90В и силой тока до 1500 А. Подходящим агрегатом является Пульсар СМАРТ.
На электронном дисплее выпрямителя Пульсар СМАРТ или в специальном ПО для компьютера можно контролировать все стадии процесса производства, что позволяет оператору следить за параметрами, и круглосуточно журналировать протекание технологического процесса. Полностью автоматическая работа, включающая непрерывный мониторинг всех параметров для безаварийного функционирования без надзора оператора. Все параметры, касающиеся напряжения и силы тока постоянно измеряются и контролируются микропроцессором выпрямителя.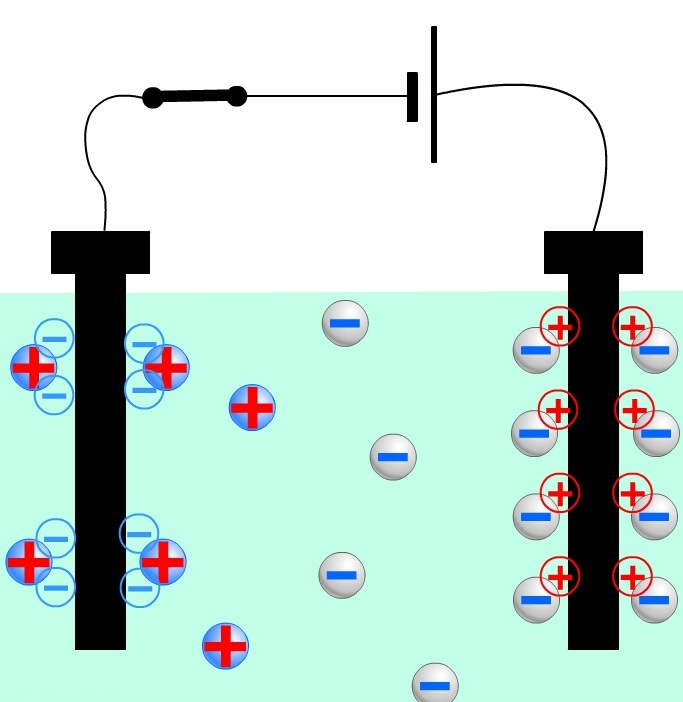 Более того, все контролируемые параметры фиксируются устройством, которое в случае сбоя или отклонения может автоматически остановить процесс и сигнализирует об этом при помощи световой колонны.
Более того, все контролируемые параметры фиксируются устройством, которое в случае сбоя или отклонения может автоматически остановить процесс и сигнализирует об этом при помощи световой колонны.
Выпрямители тока серии Пульсар СМАРТ разработаны в соответствии с самыми высокими требованиями промышленной эффективности и международными стандартами. При этом технологическое программное обеспечение допускает гибкую адаптацию к требованиям Заказчика, и постоянно совершенствуется.
Электролиз процессы – Справочник химика 21
Практическое применение электролиза. Процесс электролиза широко применяется в различных областях народного хозяйства. Практически нет ни одной отрасли техники, где бы электролиз не применялся в той или иной мере. [c.205]В процессе электрохимического гальванического покрытия электробатареи или другие источники тока поставляют электроны, необходимые для перевода ионов металлов в атомы, которые образуют слой металла на поверхности предмета. Гальванопокрытие производят для защиты поверхности от механических повреждений или для придания ей красивого вида. Покрытия дешевых украшений тонким слоем золота делает их более привлекательными. Хромовое покрытие бамперов автомобилей защищает их и улучшает внешний вид. Ячейка, используемая для проведения таких химических изменений, состоит из двух электродов (анода и катода), раствора ионов и источника электричества. Гальванопокрытие – одна из форм электролиза, процесса, использованного вами в гл. II, разд. Г.4. [c.532]
Электролиз — процесс несамопроизвольный, поэтому для его проведения требуется расход энергии — закон Фарадея [c.189]
Уравнение (IV.38) лежит в основе метода Гитторфа, в котором числа переноса определяют по изменению концентрации раствора в приэлектродном отсеке. Это уравнение является приближенным, так как не учитывает перенос растворителя (воды) через пористую мембрану, разделяющую отсеки / и II. Более того, изменение количества растворителя в отсеке I в процессе электролиза зависит от конструкции измерительной ячейки, поскольку оио обусловлено не только переносом растворителя в сольватных оболочках ионов, но и другими причинами нарушением гидростатического равновесия из-за обогащения или обеднения отсека / продуктами электролиза, процессом электроосмоса и др. Вследствие этого уравне- [c.70]
Практические применения электролиза. Процессы электролиза получили широкое и разностороннее применение в промышленности. [c.447]
Потенциал разложения и перенапряжение. В принципе процессы электролиза обратны процессам работы соответствующих гальванических элементов, и при обратимом проведении термодинамическая характеристика их должна совпадать. Однако при практическом проведении электролиза процесс сопровождается большей частью теми или иными побочными явлениями, делающими его не вполне обратимым. [c.449]
Иониты после использования их емкости могут быть легко регенерированы посредством обработки кислотой и щелочью. Поскольку последние легко получаются из природной воды путем электролиза, процесс опреснения, в принципе, не требует расхода химических веществ, — затрачивается лишь электроэнергия. Промышленные иониты обладают высокой механической и химической стойкостью и выдерживают практически сотни регенерационных циклов. [c.190]
В зависимости от состава раствора, подвергающегося электролизу, процесс электролитического выделения кислорода может протекать различными путями. При электролизе растворов щелочей наиболее вероятным источником анодного кислорода являются ионы гидроксила. Суммарную реакцию образования кислорода за счет разряда этих ионов на аноде можно представить как [c.419]
Электролиз. Процессы электрорафинирования и электроэкстракции обычно проводят в электролизерах ящичного типа, устанавливаемых вплотную друг к другу. В каждом электролизере имеется большое число чередующихся анодов и катодов, включенных по току параллельно. На рис. 6.3 показана схема электролизера для рафинирования меди. [c.253]
Чтобы создавать новые рациональные технологические схемы и сознательно совершенствовать технологию электрохимических производств, необходимо глубоко разбираться в существе и механизме наблюдаемых при электролизе процессов, знать законы и особенности, сопровождающие превращение электрической энергии в химическую и обратно. Этой цели служат электрохимическая термодинамика и кинетика электродных реакций. [c.15]
Электролиз — процесс химического разложения электролита под влиянием электрического тока, состоящий из восстановления на катоде и окисления на аноде. [c.210]
Электролиз. Процессы, проходящие на катоде и аноде. Электролиз веществ в расплаве и в водном растворе. Электро,ииз воды. Уравнения электрохимических реакций. Практическое значение электролиза. [c.77]
Электролиз — процесс, обратный процессу в гальваническом элементе с металлическим электродом. Минимальное напряжение для электролиза раствора соли определяется по таблице электродных потенциалов. Для осуществления процесса электролиза на электроды следует подать напряжение, несколько большее, чем э. д. с. гальванического элемента. При разряде катионов на катоде в первую очередь будут разряжаться те ионы, у которых. .. (наименьшее, наибольшее) положительное и. .. отрицательное значение потенциала. В растворе находятся катионы (С=1 г-ион/л) натрия, калия, алюминия, золота, серебра, меди, железа, кадмия. На электролизер подано напряжение 3 в. Какова теоретически последовательность осаждения металлов (См. табл. 3.4) [c.126]
Электролиз — процесс раздельного окисления и восстановления на электродах, осуществляемый за счет протекания тока от внешнего источника э.д.с. Если в гальваническом элементе энергия химической реакции преобразуется в электрический ток, то в электролизере идет обратный процесс — преобразование электрической энергии в химическую. При электролизе, как и в гальваническом элементе, на аноде происходит окисление, а на катоде — восстановление. Однако при этом анодом служит положительный электрод, а катодом — отрицательный. [c.297]
Условия электролиза. Процесс электрохимического синтеза хлорной кислоты на аноде описывается следующим суммарным уравнением [c.160]
Электролиз. Процесс электролиза с получением НгЗгОв проводят в каскадно расположенных электролизерах. Использование каскада, включающего 24—26 электролизеров, позволяет обеспечить высокий выход по току при получении растворов пероксодисерной кислоты высокой концентрации. По мере увеличения концентрации НгЗгОв в каскаде выход по току снижается в первых электролизерах каскада выход по току высокий, в последних меньше, при этом суммарный выход по току составляет в среднем 75—80%. [c.175]
Условия электролиза. Процесс электрохимического синтеза пероксобората протекает при высоком положительном потенциале, поэтому в качестве анода используют платину либо титан, покрытый платиной. [c.197]
Условия электролиза. Процесс образования тетраэтилсвинца происходит на анодно поляризованном свинце. В процессе используют очищенный свинец, содержащий не менее 99,8% РЬ. Катодом служит Ст. 3. [c.222]
По существу электрохимия имеет дело с химическими реакциями, в которых происходит перенос электронов, а также с электрическим током, используемым или получаемым в подобных реакциях. Грубо говоря, всю электрохимию можно подразделить на две большие области, по смыслу как бы противоположные друг другу, несмотря на то что каждая из них подчиняется одним и тем же общим законам. Первая из этих областей связана с электролизом — процессом, в ходе которого электрический ток, вызываемый внешним электрическим потенциалом, обусловливает химическое превращение. Вторая область связана с электрохимическими элементами (называемыми также гальваническими элементами)— устройствами, в которых химическое превращение используется- для получения электрического тока. Изучение электролиза и электрохимических элементов неотделимо от переноса электрических зарядов в химических системах, и этому вопросу мы уделим много внимания. Перед тем как приступить к изучению данной главы, рекомендуется освежить в памяти методы составления уравнений окислительно-восстановительных реакций и полуреакций (см. гл. 14), поскольку мы будем иметь дело именно с такими реакциями. Характер подобных процессов и их связь с фундаментальными свойствами реагентов постоянно рассматриваются в данной главе. [c.283]
Электролиз. Процесс электролиза сводится к следующим стадиям подготовки электролизера -л пуску, питанию электролизера глиноземом, формированию и обслуживанию непрерывно самообжигающихся анодов или замены обожженных анодов, регулированию напряжения, корректировки электролита и извлечению алюминия из ванны. [c.280]
Вследствие протекания таких препятствующих, электролизу процессов напряжение разложения электролита, при котором на электродах начинается выделение конечных электролитических продуктов, должно быть больше теоретически рассчитанного значения. Повышение напряжения, необходимого для развития процесса электролиза, называется перенапряжением. Как правило, перенапряжение обусловлено суммарным влиянием двух или нескольких указанных выше причин. [c.229]
Электролиз — процессы, протекающие на электродах при пропускании электрического тока через растворы или расплавы электролитов. [c.13]
В настоящее время электроды из различных типов углеродных материалов находят широкое применение в хлорном электролизе, процессах электрохимической энергетики, ряде электрохимических методов очистки сточных вод, а также в электроаналитических исследованиях. [c.248]
Гидрометаллургия. Процессы восстановления металлов из водных растворов их солей относятся к области гидрометаллургии они осуществляются при обычных температурах, причем восстановителями могут служить или сравнительно более активные металлы, или электроны катода при электролизе. Процессы катодного восстановления металлов как из растворов, так и из расплавов называют электрометаллургическими. [c.275]
Электролиз водного раствора сульфата натрия с нерастворимыми платиновыми электродами. Сульфат натрия в водном растворе диссоциирует на ионы 2Na и S0 . При электролизе процесс на катоде может быть выражен следующим образом [c.291]
Миграция ионов. Метод основан на различии в подвижности ионов при электролизе. Процесс осуществляется при противотоке [c.453]
Катодный стержень бериллия наращивают до 500 мм длины, после чего катод сменяют и продолжают электролиз. Процесс ведут непрерывно до полного износа графитового тигля (он разрушается анодно выделяющимся кислородом). [c.634]
Если подвергнуть электролизу растворы ЫзаЗО.,, раствор кислый) или молекулы воды (если раствор щелочной или нейтральный), более энергично присоединяющие электроны, чем К+- или Ыа+-ионы. Следовательно, происходящие при электролизе процессы можно выразить схемой [c.423]
Однако при электролизе сохраняется ток обмена, обратный пропускаемому через ячейку току (см. стр. 607), поэтому необходимо учитывать и обратный электролизу процесс в тех случаях, когда обратный ток имеет заметную величину, и пользоваться не уравнением (XXIV, 14), а уравнением [c.626]
Алюминий получают из руды (боксита) путем электролиза. Процесс этот требует больших затрат электричества. Гидроэлектростанции на р. Снейк дают гораздо больше электричества, чем необходимо для Ривервуда и его ок-ресностей. Руководство электрической компании предложило EKS большое количество электроэнергии в очень короткие сроки. [c.526]
При электролизе процессы разряда ионов называют первичными, всл другие процессы у электродов, ведущие к образованию конечных продуктов, — вторичными. Например, при электролизе раствора Н250первичными процессами являются разряд ионов водорода и гидроксила на катоде Н + +е = Н на аноде ОН — е = ОН. Вторичные процессы на катоде Н + И = На на аноде 20Н = Н20 + 0 О О = Ог. [c.204]
Условия электролиза. Процесс анодного окисления манганата калия до перманганата лимитлруется диффузией ионов Мп04 из объема раствора к электродной поверхности. Поэтому рабочая плотность тока зависит от эффективности перемешивания раствора. В промышленных электролизерах плотность тока составляет 0,08—0,09 кА/м . [c.181]
Условия электролиза. Процесс гидродимеризации акрило-яитрила существенно зависит от материала катода, как можно видеть из данных, полученных в сравнимых условиях (электролит фосфат калия+гидроксид тетраэтиламмония) [c.212]
Условия электролиза. Процесс электрофторирования протекает в относительно узком интервале экспериментальных уело-. ВИЙ. Как уже отмечалось, единственным материалом анода является никель, причем достаточную устойчивость имеет никель чистоты не менее 99,9%. Наличие примесей существенно снижает коррозионную стойкость металла. В качестве атода можно использовать Ст. 3 или медь, но учитывая их низшую- коррозионную стойкость при эксплуатации, предпочитают никелевые катоды. [c.227]
Ю. А. Чернихов с сотрудниками 1140, 1141] предлагает определять индий методом внутреннего электролиза. Процесс заключается в том, что в раствор, содержащий индий, погружают два электрода, соединенных между собой медной проволокой платиновый катод и цинковый анод. Между электродами создается некоторая разность потенциалов, заставляющая ионы индия направляться к катоду, на котором они разряжаются и оседают количественно плотным слоем. Катод взвешивают до и после осаждения на нем индия. Процесс ведется при 70° С и pH = = 3,5- 3,8 в присутствии виннокислого буфера. Состав раствора следующий 0,1-н. раствор соляной или серной кислоты, 10%-ный раствор кислого виннокислого натрия и 10 г хлористого аммония. [c.422]
Общая схема протекающих при электролизе процессов для соединения ВдС СН—СНХа выражается следующим образом [591 [c.248]
Влияние условий электролиза. Процесс электролиза обычно проводится с платиновыми или графитовыми анодами. Гидроксили-рование толуола и крезола протекает при плотностях тока на аноде от 0,01 до 0,10 А/см [98, 99]. [c.359]
Термоэлектричество | физика | Британника
Термоэлектричество , также называемое эффектом Пельтье-Зеебека , прямое преобразование тепла в электричество или электричества в тепло с помощью двух взаимосвязанных механизмов, эффекта Зеебека и эффекта Пельтье.
Подробнее по этой теме
электричество: термоэлектричество
Когда два металла находятся в электрическом контакте, электроны выходят из одного, в котором электроны менее связаны, в другой….
Когда два металла находятся в электрическом контакте, электроны выходят из одного, в котором электроны менее связаны, в другой. Связывание измеряется расположением так называемого уровня Ферми электронов в металле; чем выше уровень, тем ниже привязка. Уровень Ферми представляет собой разграничение энергии в зоне проводимости металла между уровнями энергии, занятыми электронами, и уровнями, которые не заняты. Энергия электрона на уровне Ферми составляет – Вт относительно свободного электрона вне металла.Поток электронов между двумя контактирующими проводниками продолжается до тех пор, пока изменение электростатического потенциала не приведет к одинаковому значению уровней Ферми двух металлов ( W, , 1, и W, , 2, ). Этот электростатический потенциал называется контактным потенциалом ϕ 12 и определяется как e ϕ 12 = W 1 – W 2 , где e составляет 1,6 × 10 −19 кулон.
Если замкнутая цепь сделана из двух разных металлов, в цепи не будет чистой электродвижущей силы, потому что два контактных потенциала противостоят друг другу и ток не будет течь.Будет ток, если температура одного из переходов будет повышена по сравнению с температурой второго. В цепи генерируется чистая электродвижущая сила, так как маловероятно, что два металла будут иметь уровни Ферми с одинаковой температурной зависимостью. Для поддержания разницы температур тепло должно поступать в горячий спай и уходить из холодного спая; это согласуется с тем фактом, что ток можно использовать для выполнения механической работы. Генерация тепловой электродвижущей силы на стыке называется эффектом Зеебека (в честь немецкого физика эстонского происхождения Томаса Иоганна Зеебека).Электродвижущая сила приблизительно линейна с разницей температур между двумя соединениями разнородных металлов, которые называются термопарами. Для термопары, изготовленной из железа и константана (сплав 60 процентов меди и 40 процентов никеля), электродвижущая сила составляет около пяти милливольт, когда холодный спай находится при 0 ° C, а горячий спай – при 100 ° C. Одно из основных приложений эффекта Зеебека – измерение температуры. Химические свойства среды, температура которой измеряется, и требуемая чувствительность определяют выбор компонентов термопары.
Поглощение или выделение тепла в соединении, в котором есть электрический ток, называется эффектом Пельтье (в честь французского физика Жана-Шарля Пельтье). Эффекты Зеебека и Пельтье также возникают на стыке металла и полупроводника и на стыке двух полупроводников. Развитие полупроводниковых термопар (например, состоящих из теллурида висмута типа n и типа p ) сделало использование эффекта Пельтье практичным для охлаждения.Комплекты таких термопар соединены последовательно электрически и параллельно термически. Когда электрический ток течет, между двумя переходами возникает разница температур, которая зависит от тока. Если температура более горячего спая поддерживается низкой за счет отвода тепла, второй спай может быть на десятки градусов холоднее и действовать как холодильник. Холодильники Пельтье используются для охлаждения небольших тел; они компактны, не имеют движущихся механических частей и могут регулироваться для поддержания точной и стабильной температуры.Они используются во многих приложениях, например, для поддержания постоянной температуры образца, когда он находится на столике микроскопа.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас Эта статья была недавно отредактирована и обновлена помощником редактора Уильямом Л. Хошем.Узнайте больше в этих связанных статьях Britannica:
20.8: Промышленные процессы электролиза – Chemistry LibreTexts
Цели обучения
- Определить электрорафинирование и электросинтез
- Объясните основы промышленного электролиза соленой воды для получения газообразного хлора.
Реакции электролиза – это фундамент современной промышленности. Существуют различные элементы, химические соединения и органические соединения, которые производятся только электролизом, включая алюминий, хлор и NaOH. Электролиз – это процесс, при котором электрический ток вызывает в противном случае несамопроизвольную реакцию.
Электрорафинирование
Процесс электролитического рафинирования позволяет рафинировать металлы или соединения высокой чистоты по низкой цене. Чистый металл может покрыть ничего не стоящий предмет.Давайте рассмотрим процесс электролитического рафинирования меди: на аноде есть нечистый кусок меди, содержащий другие металлы, такие как Ag, Au, Pt, Sn, Bi, Sb, As, Fe, Ni, Co и Zn. Медь в этой нечистой руде окисляется с образованием Cu 2 + на аноде и перемещается через водный раствор серной кислоты и сульфата меди (II) на катод. Когда он достигает катода, Cu 2 + восстанавливается до Cu. Весь этот процесс происходит при достаточно низком напряжении (около.От 15 до 0,30 В), поэтому Ag, Au и Pt не окисляются на аноде, так как их стандартные потенциалы окислительного электрода составляют -800, -1,36 и -1,20 соответственно; эти неокисленные примеси превращаются в смесь, называемую анодным шламом, шлам на дне резервуара. Этот осадок может быть восстановлен и использован в различных процессах. В отличие от Ag, Au и Pt, примеси Sb, Bi и Sn в руде действительно окисляются на аноде, но они осаждаются, поскольку образуют гидроксиды и оксиды. Наконец, окисляются Fe, Ni, Co и Zn, но они растворяются в воде.Таким образом, единственное твердое вещество, которое у нас осталось, – это пластина из чистой твердой меди на катоде с уровнем чистоты около 99,999%. Изображение ниже дает представление о судьбе основных компонентов загрязненной железной руды.
Электросинтез
Электросинтез – это метод получения веществ посредством реакций электролиза. Это полезно, когда необходимо тщательно контролировать условия реакции. Одним из примеров электросинтеза является MnO 2 , диоксид марганца.-} \\
& \ textrm {Катод:}
&& \ ce {2Ch3 = CHCN + 2h3O + 2e- \ rightarrow NC (Ch3) CN + 2OH -} \\
& \ textrm {Всего:}
&& \ underset {\ textrm {акрилонитрил}} {\ ce {2Ch3 = CHCN}} + H_2O \ rightarrow \ dfrac {1} {2} O_2 + \ underset {\ textrm {adiponitrile}} {\ ce {NC (Ch3) 4CN}} \ end {align} \)
Важность адипонитрила заключается в том, что он легко превращается в другие полезные соединения.
Хлор-щелочной процесс
Этот процесс представляет собой электролиз хлорида натрия (NaCl) на промышленном уровне.Мы начнем с обсуждения уравнения хлорщелочного процесса, а затем обсудим три различных типа процесса: мембранный элемент, ртутный элемент и мембранный элемент. Мы начнем объяснение хлорщелочного процесса с определения реакций, протекающих при электролизе NaCl. Поскольку NaCl находится в водном растворе, мы также должны учитывать электролиз воды как на аноде, так и на катоде. Следовательно, есть два возможных уравнения восстановления и две возможные реакции окисления.0_ {O_2 / H_2O} = -1.23 \: V \ label {4}}
\ end {align} \)
Как мы видим, из-за гораздо более высокого потенциала отрицательного электрода восстановление ионов натрия гораздо менее вероятно, чем восстановление воды, поэтому мы можем предположить, что при электролизе NaCl происходит восстановление по формуле \ (\ ref {2} \). Следовательно, мы должны попытаться определить, что собой представляет реакция окисления.
Допустим, у нас есть уравнение \ (\ ref {2} \) в качестве восстановления и уравнение \ (\ ref {3} \) в качестве окисления.0_ {O_2 / H_20} \ label {6b}} \\
& && && \ mathrm {\ hspace {22px} = -0,83 \: V – (1,23 \: V) = -2,06}
\ end {align} \ )
На первый взгляд может показаться, что уравнение \ (\ ref {6b} \) возникнет из-за меньшего (менее отрицательного) потенциала электрода. Однако O 2 на самом деле имеет довольно большое перенапряжение, поэтому вместо этого более вероятно образование Cl 2 , что делает уравнение \ (\ ref {5a} \) наиболее вероятным результатом электролиза NaCl.
Хлорно-щелочной процесс в мембранной ячейке
В зависимости от используемого метода может быть несколько различных продуктов, производимых с помощью хлорно-щелочного процесса.Ценность этих продуктов – вот что делает хлорщелочной процесс таким важным. Название происходит от двух основных продуктов процесса, хлора и щелочи, гидроксида натрия (NaOH). Таким образом, одним из основных применений хлорщелочного процесса является производство NaOH. Как описано ранее, уравнение хлорщелочного процесса, то есть электролиза NaCl, выглядит следующим образом:
\ (\ begin {align}
& \ textrm {Сокращение:}
&& \ mathrm {2 H_2O _ {\ large {(l)}} + 2e ^ – \ rightarrow H_ {2 \ large {(g)}} + 2OH ^ -_ {\ large {(aq)}}}
&& \ mathrm {E_ {H_2O / H_2O} = -0.-}} \\
& && && \ hspace {12px} \ mathrm {= -0,83 \: V- (-1,36 \: V) = -2,19 \: V}
\ end {align} \)
** Хлорно-щелочной процесс часто происходит в аппарате, называемом мембранной ячейкой, что показано на рисунке \ (\ PageIndex {1} \).
Рисунок \ (\ PageIndex {1} \): Базовая мембранная ячейка, используемая при электролизе рассола. На аноде ( A ) хлорид (Cl – ) окисляется до хлора. Ионоселективная мембрана ( B ) позволяет противоиону Na + свободно проходить через нее, но предотвращает диффузию анионов, таких как гидроксид (OH –) и хлорид.На катоде ( C ) вода восстанавливается до гидроксида и газообразного водорода. Чистый процесс представляет собой электролиз водного раствора NaCl на промышленно полезные продукты – гидроксид натрия (NaOH) и газообразный хлор. из Википедии (Jkwchui)Обратите внимание на следующие аспекты ячейки диаграммы:
Анод
- Хлорид натрия помещается в анодное отделение в водной форме.
- Фактический физический анод изготовлен из графита или титана.
- В анодном отсеке образуется газ Cl 2 , поскольку Cl – окисляется.
Катод
- На катодной стороне при восстановлении воды образуются газы OH – (водный) и H 2 .
- Вы можете спросить, почему на катодной стороне находятся ионы натрия и хлорида, если мы помещаем хлорид натрия в анодный отсек? Чтобы ответить на этот вопрос, мы можем рассмотреть разницу в уровнях раствора между анодом и катодом.Это вызывает постепенный поток NaCl на катод и предотвращает обратный поток NaOH на анод. При контакте Cl 2 и NaOH, Cl 2 превращается в ионы ClO –, ClO 3 –, Cl –. Разница уровней воды предотвращает этот контакт, а также способствует потоку NaCl на катодную сторону, поэтому может образовываться NaOH (водный).
- Теперь вы можете заметить, что раствор с NaOH на катоде также будет содержать водный раствор NaCl, смешанный с ним из-за потока NaCl от анода к катоду.Следовательно, если нам нужен очень чистый NaOH для таких целей, как производство вискозы, нам нужно как-то очистить соль от NaOH. Как правило, перед очисткой раствор содержит примерно 14-16% NaCl (водн.) И 10-12% NaOH (водн.). Однако NaOH (водный) можно сконцентрировать, а NaCl (ы) можно кристаллизовать с образованием раствора с 50% NaOH (водн.) И примерно 1% NaCl (водн.).
Примечание
Если хлор вступает в контакт с водородом, образуется смесь, которая сильно взрывается под воздействием солнечного света или тепла.Будет производиться газообразный хлористый водород. Очевидно, эти два газа нужно держать отдельно.
Хлорно-щелочной процесс в ртутной ячейке
Чтобы еще больше повысить чистоту NaOH, вместо диафрагменной ячейки можно использовать ртутную ячейку для электролиза. В процессе с использованием ртутных элементов, также известном как процесс Кастнера – Келлнера, насыщенный солевой раствор плавает поверх тонкого слоя ртути. Ртуть является катодом, на котором вырабатывается натрий, который образует с ртутью натрий-ртутную амальгаму.Амальгама непрерывно вытягивается из ячейки и вступает в реакцию с водой, которая разлагает амальгаму на гидроксид натрия и ртуть. Ртуть возвращается в электролитическую ячейку. Хлор образуется на аноде и испаряется из электролизера. Производство ртутных элементов прекращается из-за опасений по поводу отравления ртутью из-за загрязнения ртутными элементами
Рисунок \ (\ PageIndex {2} \): Ртутная ячейка хлористо-щелочного процесса. Изображение является общественным достояниемСторона анода
- Аноды помещают в водный раствор NaCl над жидкой ртутью.
- Восстановление Cl – происходит с образованием газообразного хлора, Cl 2 (г).
Катодная сторона
- Слой Hg (l) на дне резервуара служит катодом.
- С ртутным катодом реакция H 2 O (l) с H 2 имеет довольно высокий перенапряжение, поэтому вместо этого происходит восстановление Na + до Na. Na растворяется в Hg (l), и эти два соединения образуют амальгаму сплава Na-Hg.Эту амальгаму можно удалить, а затем смешать с водой, чтобы вызвать следующую реакцию:
- \ (\ ce {2Na \ 🙁 in \: Hg) + 2h3O \ rightarrow 2 Na + + 2 OH- + H_ {2 \ large {(g)}} + Hg _ {\ large {(l)}}} \)
- Образующаяся Hg (l) возвращается обратно в жидкость на дне резервуара, которая действует как катод.
- H 2 газ выпущен.
- NaOH остается в очень чистой водной форме.
** Некоторые из основных проблем с ртутным элементом следующие:
- Для реакции требуется более высокое напряжение, чем у диафрагменной ячейки: 4.5 В в ртутной ячейке по сравнению с 3,5 в диафрагменной ячейке.
- Требуется довольно много электроэнергии, так как ему требуется 3400 кВтч / т Cl 2 , а не 2500 в диафрагменной ячейке.
- Возможный ущерб окружающей среде из-за отложений ртути. К счастью, объем отложений достигал 200 г ртути на тонну газообразного хлора, но теперь они никогда не превышают 0,25 г на тонну газообразного хлора.
Мембранно-клеточный процесс
Третий способ сделать NaOH еще более чистым – использовать мембранную ячейку.Он предпочтительнее метода с диафрагменным или ртутным элементом, поскольку он использует наименьшее количество электроэнергии и производит NaOH высочайшего качества. Например, он может производить NaOH со степенью загрязнения ионами хлора всего 50 ppm. Ионопроницаемая мембрана используется для разделения анода и катода.
Рисунок \ (\ PageIndex {3} \): это упрощенная реальная ячейка для отображения основных функций. Вы найдете другие схемы с входами и выходами в разных местах или более подробно.- \ rightarrow H_ {2 (g)} \]- H 2 O восстанавливается с образованием газа OH – и H 2 .
- \ (\ ce {2h3O \ rightarrow H_2 + 2OH-} \)
Ионы - Na + , которые протекли, и ионы OH –, полученные за счет восстановления воды, вступают в реакцию с образованием водного NaOH.
- H 2 газ также образуется как побочный продукт.
Мембрана изготовлена из полимера, который пропускает через нее только положительные ионы.Это означает, что через мембрану могут проходить только ионы натрия из раствора хлорида натрия, а не ионы хлорида. Преимущество этого заключается в том, что раствор гидроксида натрия, образующийся в правом отсеке, никогда не загрязняется каким-либо раствором хлорида натрия. Используемый раствор хлорида натрия должен быть чистым. Если бы он содержал ионы других металлов, они также прошли бы через мембрану и таким образом загрязнили бы раствор гидроксида натрия.
Список литературы
- Общая химия, принципы и современные приложения, Петруччи, 2007, 2002, 1997
Авторы и авторство
Производство водорода: электролиз | Министерство энергетики
Как это работает?
Подобно топливным элементам, электролизеры состоят из анода и катода, разделенных электролитом.Различные электролизеры функционируют немного по-разному, в основном из-за разного типа материала электролита.
Мембранные электролизеры с полимерным электролитом
В электролизере с полимерной электролитной мембраной (PEM) электролит представляет собой твердый специальный пластик.
- Вода реагирует на аноде с образованием кислорода и положительно заряженных ионов водорода (протонов).
- Электроны проходят через внешнюю цепь, и ионы водорода избирательно перемещаются через PEM к катоду.
- На катоде ионы водорода объединяются с электронами из внешнего контура с образованием газообразного водорода. Анодная реакция: 2H 2 O → O 2 + 4H + + 4e – Катодная реакция: 4H + + 4e – → 2H 2
Щелочные электролизеры
Щелочные электролизеры работают за счет переноса гидроксид-ионов (OH –) через электролит от катода к аноду с образованием водорода на катодной стороне.Электролизеры, использующие жидкий щелочной раствор гидроксида натрия или калия в качестве электролита, коммерчески доступны в течение многих лет. Новые подходы, использующие твердые щелочнообменные мембраны в качестве электролита, перспективны в лабораторных условиях.
Твердооксидные электролизеры
Твердооксидные электролизеры, в которых в качестве электролита используется твердый керамический материал, который избирательно проводит отрицательно заряженные ионы кислорода (O 2-) при повышенных температурах, генерируют водород немного по-другому.
- Вода на катоде соединяется с электронами из внешней цепи с образованием газообразного водорода и отрицательно заряженных ионов кислорода.
- Ионы кислорода проходят через твердую керамическую мембрану и реагируют на аноде с образованием газообразного кислорода и генерации электронов для внешней цепи.
Твердооксидные электролизеры должны работать при температурах, достаточно высоких, чтобы твердооксидные мембраны функционировали должным образом (около 700–800 ° C, по сравнению с электролизерами из ПЭМ, которые работают при 70–90 ° C, и промышленными щелочными электролизерами, которые работать при 100–150 ° C).Электролизеры на твердом оксиде могут эффективно использовать тепло, доступное при этих повышенных температурах (из различных источников, включая ядерную энергию), для уменьшения количества электроэнергии, необходимой для производства водорода из воды.
Почему рассматривается этот путь?
Водород, произведенный посредством электролиза, может привести к нулевым выбросам парниковых газов, в зависимости от источника используемой электроэнергии. Источник необходимой электроэнергии, включая ее стоимость и эффективность, а также выбросы в результате производства электроэнергии, необходимо учитывать при оценке выгод и экономической целесообразности производства водорода посредством электролиза.Во многих регионах страны сегодняшняя электросеть не идеальна для обеспечения электроэнергией, необходимой для электролиза, из-за выделяемых парниковых газов и необходимого количества топлива из-за низкой эффективности процесса производства электроэнергии. Производство водорода посредством электролиза используется для возобновляемых (ветряных) и ядерных источников энергии. Эти пути приводят к практически нулевым выбросам парниковых газов и загрязняющих веществ.
Потенциал для синергии с производством энергии из возобновляемых источников
Производство водорода посредством электролиза может открыть возможности для синергизма с производством переменного тока, что характерно для некоторых технологий возобновляемых источников энергии.Например, несмотря на то, что стоимость энергии ветра продолжает падать, присущая ветру изменчивость является препятствием для эффективного использования энергии ветра. Водородное топливо и производство электроэнергии могут быть интегрированы в ветряную электростанцию, что позволит гибко менять производство, чтобы наилучшим образом согласовать наличие ресурсов с эксплуатационными потребностями системы и рыночными факторами. Кроме того, во время избыточного производства электроэнергии ветряными электростанциями вместо того, чтобы сокращать потребление электроэнергии, как это обычно делается, можно использовать это избыточное электричество для производства водорода путем электролиза.
Важно отметить …
- Сегодняшняя электросеть не является идеальным источником электроэнергии для электролиза, поскольку большая часть электроэнергии вырабатывается с использованием технологий, которые приводят к выбросам парниковых газов и являются энергоемкими. Производство электроэнергии с использованием технологий возобновляемой или ядерной энергии, либо отдельно от сети, либо в качестве растущей части структуры сети, является возможным вариантом преодоления этих ограничений для производства водорода посредством электролиза.
- Министерство энергетики США и другие продолжают усилия по снижению стоимости производства электроэнергии из возобновляемых источников и развитию более эффективного производства электроэнергии на основе угля с улавливанием, использованием и хранением углерода. Например, производство электроэнергии на основе ветра быстро растет в Соединенных Штатах и во всем мире.
Исследования направлены на преодоление проблем
- Снижение капитальных затрат на электролизер и баланс системы, а также повышение энергоэффективности преобразования электроэнергии в водород.
- Интеграция компрессора в электролизер, чтобы избежать затрат на отдельный водородный компрессор, необходимый для увеличения давления для хранения водорода.
Что такое электролиз? – Определение, процесс и факты – Видео и стенограмма урока
Как работает электролиз?
Мы можем понять процесс электролиза, рассмотрев пример, связанный с очисткой металлической меди. Для этого процесса потребуется анод , , положительно заряженный электрод и катод , , отрицательно заряженный электрод.В этом случае примесная металлическая медь является анодом, а чистая металлическая медь – катодом. Цель состоит в том, чтобы использовать электролиз для переработки грязного старого куска медной трубы или грязной меди в красивую очищенную медную трубу.
Электролит или раствор сульфата меди обеспечивает наличие жидкой среды, способствующей движению ионов внутри ячейки (а). Когда ионы меди покидают загрязненную медную трубку с помощью источника энергии, они мигрируют от анода (b) к катоду (c).Достигнув катода, они собирают электроны, необходимые для образования нейтральной или нулевой металлической меди. Эти нейтральные атомы металлической меди собираются на катоде из чистой меди (d). Остаточные примеси с анода или те, которые не попадают на катод для очистки, собираются на дне электролизера.
Ключевые факты
Как видите, процесс электролиза включает перенос ионов через жидкий раствор или электролит. Давайте рассмотрим некоторые ключевые факты, связанные с электролизом, используя наш пример очистки меди для справки.Обратите внимание, что эти факты применимы ко всем процессам электролиза.
Факт №1: Положительно заряженные ионы мигрируют к отрицательно заряженному катоду; отрицательно заряженные ионы мигрируют к положительно заряженному аноду. Другими словами, ионы меди из загрязненной медной трубы не покинут этот анод, если они не будут притягиваться к катоду.
Факт № 2: Электролитические ячейки – это несамопроизвольные реакции, в которых для протекания реакции необходимо подавать энергию. В нашем примере с медью батарея обеспечивает электрическую работу, необходимую для миграции ионов меди от анода к катоду.
Факт № 3: Должен присутствовать электролит для облегчения движения электрического тока внутри и вне электролитической ячейки. Для очистки меди электролит из сульфата меди растворяли в жидком растворе и использовали в процессе электролиза. Он обеспечивает среду, через которую проходят ионы меди.
Краткое содержание урока
Электролиз – это процесс использования электрического тока для запуска несамопроизвольной реакции . Цели использования этого процесса включают выделение элементов из природных источников, очистку металлов и разложение соединений.Поскольку электролиз не является спонтанным процессом, для его запуска требуется подача энергии.
Весь процесс электролиза осуществляется в электролитической ячейке . В этой ячейке ионы будут мигрировать к аноду или от катода или от него. Эта миграция происходит в жидкой среде, содержащей электролиты. Отрицательно заряженные ионы мигрируют к положительно заряженному аноду. Положительно заряженные ионы мигрируют к отрицательно заряженному катоду.
Результаты обучения
Этот урок электролиза должен научить вас:
- Определить электролиз
- Объясните, что такое электролизер
- Обобщите, как работает электролиз
ЭЛЕКТРОЛИЗ
Электролиз – это процесс, который происходит в электрохимической ячейке, когда электроны проходят от анода к катоду через внешнюю цепь, соединяющую электроды. Для этого должен существовать механизм переноса заряда в электролите между электродами.Этот перенос заряда происходит из-за движения ионов в электролите. Эти ионы, приближаясь к электродам, подвергаются электролизу и либо принимают электроны с катода, либо выпускают электроны на анод. Таким образом, химические изменения происходят на обоих электродах.
Степень химического изменения зависит от пройденного заряда в соответствии с законами электролиза Фарадея. Скорость химического изменения зависит от плотности тока j = I / S (Am -2 ) на электроде и определяется выражением;
(1)где n – число электронов в реакции электрода, а F – постоянная Фарадея .Скорость химического изменения и, следовательно, плотность тока определяется кинетикой электродной реакции (реакций).
В условиях электролиза ячейка работает вне своих равновесных (обратимых) потенциалов, определенных термодинамикой. Некоторые электродные реакции очень быстрые и очень мало отклоняются от равновесного потенциала. Такие реакции часто называют обратимыми (см. Рисунок 1). Другие электродные реакции по своей природе медленны и требуют потенциала E, значительно превышающего по величине равновесный потенциал для достижения разумной плотности тока.Этот потенциал называется перенапряжением , η (= E – E e ), а электрод называется поляризованным . Такие реакции называют необратимыми (рис. 2). По мере увеличения перенапряжения (более отрицательного для катодных процессов, более положительного для анодных) плотность тока увеличивается, как правило, экспоненциально при высоких перенапряжениях. Связь между плотностью тока и потенциалом электрода является предметом кинетики электрода.
Рисунок 1.Кривая потенциала тока на поляризованном электроде.
Рис. 2. Электролиз раствора NaCl с образованием хлора и гидроксида натрия. Другие примеры электролиза, или более конкретно «реакции полуэлементов», включают:
Простой перенос электрона, например, анодное окисление ионов Ce (TO).
Осаждение металла, например никелирование
Преобразование поверхностной пленки, например, в свинцово-кислотных аккумуляторах
Анодное растворение, эл.г., из железа
Восстановление газа, например кислород в пористых газодиффузионных электродах, используемых в топливных элементах
На практике существует широкий спектр электрохимических элементов: батареи, в которых электрическая энергия вырабатывается в результате электродных реакций, электролитические ячейки, в которых химические изменения происходят за счет приложенного потенциала, и топливные элементы, в которых электрическая энергия непрерывно вырабатывается за счет подачи топливо. Электролиз может включать в себя различные типы процессов, включая реакции в жидкой фазе, реакции в твердой фазе, расположенной на поверхности электродов, и реакции с участием газовой фазы.Важным примером газофазных процессов является электролитическое образование газа, например,
(2) (3) (4)Анодное производство хлора и катодное образование H 2 и, следовательно, гидроксид-иона, является основой для хлорщелочной промышленности , использующей электролит хлорида натрия. Для этого процесса анодная и катодная реакции в ячейках разделены диафрагмой или мембраной, чтобы предотвратить реакцию газообразного хлора с гидроксидом (натрия). Этот метод разделения анодной и катодной реакций во время электролиза является обычным.Соответствующий сепаратор по необходимости должен обеспечивать транспортировку подходящих ионов через его структуру. При электролизе хлорида натрия для производства хлора сепаратор в идеале должен обеспечивать транспортировку одного иона натрия, как показано на рисунке 2, для образования гидроксида натрия с гидроксид-ионом, генерируемым на катоде (реакция 3).
Во всех ячейках электролиз включает реакции на обоих электродах, и общее движение ионов в растворах поддерживает нейтральность заряда в электролите.Поэтому, как правило, процессы электролиза записываются как общие реакции двухэлектродных процессов, например, в хлорщелочном электролизе реакция
(5)представляет собой электролиз хлорида натрия в воде с образованием гидроксида натрия, газообразного хлора и водорода.
Для проведения электролиза требуется источник энергии для перемещения ионов в электролитах и преодоления перенапряжения на электродах. Эта энергия поступает либо от внешнего источника питания, как в электролитических процессах (например,g., перезарядка свинцово-кислотных аккумуляторов) или получается из доступной «химической» или свободной энергии реакции (например, разрядки аккумуляторов). Он по существу превращается в тепло в электролите и напрямую связан с внутренним сопротивлением ячейки R и приложенным током, то есть I 2 R (Джоуля с -1 ).
При электролизе эта потребность в энергии может быть уменьшена за счет факторов, которые снижают внутреннее сопротивление (небольшое расстояние между электродами, высокая проводимость электролита) и которые уменьшают перенапряжение, например.например, с использованием электрокатализаторов или альтернативных электродных материалов. Электрокатализаторы обеспечивают альтернативные пути реакции для изначально кинетической медленной стадии электродного процесса и позволяют проводить реакцию при более высоких плотностях тока, близких к равновесному потенциалу. Многие электролизы выиграли от использования электрокатализаторов. Например, в 1960-х годах в конструкции анодов хлорных элементов произошла революция в связи с использованием покрытых титановых электродов (так называемые стабильные аноды , или DSA) в качестве замены углерода.Покрытие на основе оксида рутения, вентильных металлов, драгоценных металлов и переходных металлов позволило значительно снизить перенапряжение (<50 мВ для образования хлора). Такие материалы широко используются для многих промышленных электролизов.
Электролитические процессы для золота и других драгоценных металлов
Электролитические методы, используемые в процессах аффинажа золота и других драгоценных металлов
Электролиз – это электрохимический процесс, при котором электрический ток протекает между двумя электродами и через электролит .Этот процесс включает перенос ионов металлов через раствор ионизированного электролита, осаждение положительных ионов на катоде и отрицательных ионов на аноде.
СМОТРИ ТАКЖЕ : Процесс гальванопластики для ювелирной промышленности: все, что вам нужно знать
Большинство металлов, получаемых электролизом, исключительно чисты, и золото и драгоценные металлы не являются исключением. Электролитические процессы для золота и других драгоценных металлов аффинаж обычно обеспечивает наиболее экономичный метод отделения этих металлов от шлака или пустой породы.
Процесс электрорафинирования
Существует двух основных типов электролитических процессов , называемых электролитическим рафинированием и электролитическим рафинированием . В обоих процессах используется постоянный электрический ток, в результате чего на катоде осаждается чистый металл. Электрорафинирование является предпочтительным методом электролиза золота и других драгоценных металлов.
В процессе электрорафинирования используется расплавленная твердая смесь нечистого металла в качестве анода и тонкий лист металла в качестве катода .Когда электроды погружаются в электролит и подается электрический ток, чистый металл осаждается на катоде в результате растворения и переноса этого металла с анода.
Электролитические процессы для золота и других драгоценных металлов
В процессе электролитической очистки золота в качестве электролита используется соляная кислота. Анод изготовлен из сплава золота, а катод обычно представляет собой тонкий лист золота высокой чистоты. Электрический ток ионизирует электролит и переносит растворенное золото с анода на катод, тем самым повышая чистоту золота на катоде.
Этот процесс рафинирования известен как процесс Вольвилла . Серебро и другие драгоценные металлы могут быть аффинированы с использованием той же техники электрорафинирования. Имеются явные доказательства того, что электролитические процессы для золота и других драгоценных металлов производят металлов высокой чистоты .
17.7 Электролиз – химия
Цели обучения
К концу этого раздела вы сможете:
- Описать электролитические ячейки и их связь с гальваническими элементами
- Выполнение различных расчетов, связанных с электролизом
В гальванических элементах химическая энергия преобразуется в электрическую.Обратное верно для электролитических ячеек. В электролитических ячейках электрическая энергия вызывает несамопроизвольные реакции в процессе, известном как электролиз . Зарядный электромобиль, изображенный в главе 18 «Введение» в начале этой главы, демонстрирует один из таких процессов. Электрическая энергия преобразуется в химическую энергию в аккумуляторе по мере его зарядки. После зарядки аккумулятор можно использовать для питания автомобиля.
В электролитических ячейках используются те же принципы, что и в гальванических элементах.Мы рассмотрим три электролитических ячейки и количественные аспекты электролиза.
В расплавленном хлориде натрия ионы могут свободно перемещаться к электродам электролитической ячейки. Упрощенная схема ячейки, коммерчески используемой для производства металлического натрия и газообразного хлора, показана на рисунке 1. Натрий является сильным восстановителем, а хлор используется для очистки воды, а также в антисептических средствах и в производстве бумаги. {\ circ} = +1.{\ circ} = -4.0 \; \ text {V} \ end {array} [/ latex]
Источник питания (аккумулятор) должен обеспечивать минимум 4 В, но на практике применяемые напряжения обычно выше из-за неэффективности самого процесса.
Рисунок 1. При пропускании электрического тока через расплавленный хлорид натрия материал разлагается на металлический натрий и газообразный хлор. Необходимо следить за тем, чтобы продукты были разделены, чтобы предотвратить самопроизвольное образование хлорида натрия.Электролизом можно разделить воду на водород и кислород.{\ circ} = -1,229 \; \ text {V} \ end {array} [/ latex]
Обратите внимание, что серная кислота не расходуется, и что объем произведенного газообразного водорода в два раза превышает объем произведенного газообразного кислорода. Минимальное подаваемое напряжение 1,229 В.
Рисунок 2. Вода разлагается на кислород и водород во время электролиза. Серная кислота была добавлена для увеличения концентрации ионов водорода и общего количества ионов в растворе, но не принимает участия в реакции. Объем собранного газообразного водорода в два раза больше объема собранного газообразного кислорода из-за стехиометрии реакции.{\ circ} = +1.229 \; \ text {V} \ end {array} [/ latex]Эти значения предполагают, что вода должна окисляться на аноде, потому что потребуется меньший потенциал – использование реакции (ii) для окисления даст менее отрицательный потенциал ячейки. Когда эксперимент проводится, выясняется, что на аноде образуется хлор, а не кислород. Неожиданный процесс настолько распространен в электрохимии, что получил название перенапряжения. Перенапряжение – это разница между теоретическим напряжением ячейки и фактическим напряжением, необходимым для электролиза.{\ circ} = -2,71 \; \ text {V} \ end {array} [/ latex]
Реакция (v) исключена, потому что она имеет такой отрицательный восстановительный потенциал. В стандартных условиях реакция (iii) была бы предпочтительнее реакции (iv). Однако pH раствора хлорида натрия равен 7, поэтому концентрация ионов водорода составляет всего 1 × 10 −7 M . {\ circ} = -2.186 \; \ text {V} [/ латекс]
По мере протекания реакции ионы гидроксида замещают ионы хлора в растворе. Таким образом, гидроксид натрия можно получить путем испарения воды после завершения электролиза. Гидроксид натрия ценен сам по себе и используется для таких вещей, как очиститель для духовок, открывалка для слива, а также при производстве бумаги, тканей и мыла.
Гальваника
Важным применением электролитических ячеек является гальваника . Гальваника приводит к образованию тонкого покрытия из одного металла поверх проводящей поверхности.Причины нанесения гальванического покрытия включают повышение устойчивости объекта к коррозии, укрепление поверхности, получение более привлекательной отделки или очистку металла. Металлы, обычно используемые в гальванике, включают кадмий, хром, медь, золото, никель, серебро и олово. Обычные потребительские товары включают посеребренную или позолоченную посуду, хромированные автомобильные детали и ювелирные изделия. Мы можем получить представление о том, как это работает, исследуя, как производится посеребренная посуда (рис. 3).
Рисунок 3. Ложка, сделанная из недорогого металла, подключается к отрицательной клемме источника напряжения и действует как катод. Анод – серебряный электрод. Оба электрода погружены в раствор нитрата серебра. Когда через раствор пропускают постоянный ток, в конечном итоге металлическое серебро удаляется с анода и осаждается на катоде.На рисунке анод состоит из серебряного электрода, показанного слева. Катод расположен справа и представляет собой ложку, которая изготовлена из недорогого металла.{-} \; {\ longrightarrow} \; \ text {Ag} (s) [/ latex]
Конечный результат – перенос металлического серебра с анода на катод. Качество объекта обычно определяется толщиной наплавленного серебра и скоростью наплавки.
Величина тока, который может протекать в электролитической ячейке, зависит от количества молей электронов. Количество молей электронов может быть связано с реагентами и продуктами с использованием стехиометрии. Напомним, что единицей СИ для тока ( I ) является ампер (A), что эквивалентно 1 кулону в секунду (1 A = 1 [латекс] \ frac {\ text {C}} {\ text {s }}[/латекс]).Общий заряд ( Q , в кулонах) равен
.[латекс] Q = I \; \ times \; t = n \; \ times \; F [/ латекс]
Где t – время в секундах, n – количество молей электронов, а F – постоянная Фарадея.
Моли электронов могут быть использованы в задачах стехиометрии. Также может быть запрошено время, необходимое для внесения определенного количества металла, как во втором из следующих примеров.
Пример 1
Преобразование тока в моли электронов
В одном процессе, используемом для гальваники серебра, ток равен 10.23 А пропускали через электролитическую ячейку ровно за 1 час. Сколько молей электронов прошло через ячейку? Какая масса серебра была нанесена на катод из раствора нитрата серебра?
Раствор
Константу Фарадея можно использовать для преобразования заряда ( Q ) в моли электронов ( n ). { -}} = 0.{-}} \; \ times \; \ frac {107.9 \; \ text {g \; Ag}} {1 \; \ text {mol \; Ag}} = 41.19 \; \ text {g \; Ag} [/ латекс]
Проверьте свой ответ: исходя из стехиометрии, из 1 моля электронов получается 1 моль серебра. Было задействовано менее половины моля электронов и было произведено менее половины моля серебра.
Проверьте свои знания
Металлический алюминий можно получить из ионов алюминия электролизом. Какая будет половинная реакция на катоде? Какая масса металлического алюминия будет восстановлена, если ток 2?{-} \; {\ longrightarrow} \; \ text {Al} (s) [/ latex]; 7,77 моль Al = 210,0 г Al.
Пример 2
Время, необходимое для осаждения
В одном случае слой хрома толщиной 0,010 мм должен быть нанесен на деталь с общей площадью поверхности 3,3 м. 2 из раствора, содержащего ионы хрома (III). Сколько времени нужно, чтобы нанести слой хрома, если ток равен 33,46 А? Плотность хрома (металла) 7,19 г / см 3 .
Решение
Эта проблема затрагивает ряд тем, рассмотренных ранее.Схема того, что необходимо сделать:
- Если общий заряд можно определить, необходимое время – это просто заряд, деленный на текущий
- Общий заряд может быть получен из необходимого количества Cr и стехиометрии
- Количество Cr может быть получено исходя из плотности и необходимого объема Cr
- Требуемый объем Cr равен толщине, умноженной на площадь
Решая поэтапно и заботясь о единицах, требуемый объем Cr составляет
[латекс] \ text {volume} = (0.4 \; \ text {s} = 11.0 \; \ text {hr} [/ latex]
Проверьте свой ответ: В такой длинной задаче одной проверки, вероятно, недостаточно. Каждый из шагов дает разумное число, так что все, вероятно, правильно. Обратите особое внимание на преобразование единиц измерения и стехиометрию.
Проверьте свои знания
Какая масса цинка требуется для цинкования верхней части листа железа размером 3,00 м × 5,50 м до толщины 0,100 мм цинка? Если цинк поступает из раствора Zn (NO 3 ) 2 и ток равен 25.5 А сколько времени займет гальванизация верха утюга? Плотность цинка 7,140 г / см 3 .
Ответ:
231 г Zn потребовалось 446 минут.
Электролиз – это использование электричества для инициирования непредвиденного процесса. Электролитические ячейки – это электрохимические ячейки с отрицательными потенциалами ячейки (что означает положительную свободную энергию Гиббса), и поэтому они не являются спонтанными. Электролиз может происходить в электролитических ячейках при включении источника питания, который подает энергию, заставляющую электроны течь в неспонтанном направлении.Электролиз проводится в растворах, которые содержат достаточно ионов, чтобы ток мог течь. Если раствор содержит только один материал, например, при электролизе расплавленного хлорида натрия, легко определить, что окисляется, а что восстанавливается. В более сложных системах, таких как электролиз водного хлорида натрия, более одного вида могут быть окислены или восстановлены, и стандартные восстановительные потенциалы используются для определения наиболее вероятного окисления (полуреакция с наибольшим [наиболее положительным] стандартным восстановительным потенциалом ) и восстановления (полуреакция с наименьшим [наименее положительным] стандартным восстановительным потенциалом).Иногда из-за перенапряжения возникают неожиданные полуреакции. Перенапряжение – это разница между теоретическим потенциалом восстановления полуреакции и фактическим требуемым напряжением. Если он присутствует, приложенный потенциал должен быть увеличен, чтобы в электролитической ячейке могла произойти другая реакция. Полный заряд, Q , который проходит через электролитическую ячейку, может быть выражен как ток ( I ), умноженный на время ( Q = It ), или как моль электронов ( n ), умноженная на постоянную Фарадея. ( Q = нФ).Эти отношения могут использоваться для определения таких вещей, как количество материала, используемого или образованного во время электролиза, как долго должна продолжаться реакция или какое значение тока требуется.
Химия: упражнения в конце главы
- Укажите реакцию на аноде, реакцию на катоде, общую реакцию и приблизительный потенциал, необходимый для электролиза следующих расплавленных солей. Предположим, что стандартные состояния и стандартные восстановительные потенциалы в Приложении L такие же, как и при каждой из точек плавления.Предположим, что КПД равен 100%.
(а) CaCl 2
(б) LiH
(в) AlCl 3
(г) CrBr 3
- Какая масса каждого продукта производится в каждой из электролитических ячеек предыдущей задачи, если через каждую ячейку проходит общий заряд 3,33 × 10 5 Кл? Предположим, что напряжения достаточно для уменьшения.
- Сколько времени нужно, чтобы восстановить 1 моль каждого из следующих ионов с помощью указанного тока? Предположим, что напряжения достаточно для уменьшения.
(а) Al 3+ , 1,234 A
(б) Ca 2+ , 22,2 A
(в) Cr 5+ , 37,45 A
(г) Au 3+ , 3,57 А
- Ток в 2,345 А проходит через элемент, показанный на рисунке 2, в течение 45 минут. Какой объем водорода собирается при комнатной температуре, если давление составляет ровно 1 атм? Предположим, что напряжения достаточно для уменьшения. (Подсказка: водород – единственный газ, присутствующий над водой?)
- Металлическая деталь неправильной формы, изготовленная из определенного сплава, была оцинкована цинком с использованием раствора Zn (NO 3 ) 2 .При использовании силы тока 2,599 А для нанесения на деталь слоя цинка толщиной 0,01123 мм требовалось ровно 1 час. Какова была общая площадь поверхности детали? Плотность цинка 7,140 г / см 3 . Предположим, что КПД равен 100%.
Глоссарий
- электролизный
- Процесс, использующий электрическую энергию для возникновения несамопроизвольного процесса
- электролизер
- ячейка электрохимическая, в которой используется электролиз; ячейка электрохимическая с отрицательным потенциалом ячейки
- гальваника
- нанесение тонкого слоя одного металла поверх проводящей поверхности
- перенапряжение
- разность между теоретическим потенциалом и фактическим потенциалом в электролитической ячейке; «дополнительное» напряжение, необходимое для того, чтобы произошла некоторая несамопроизвольная электрохимическая реакция
Решения
Ответы на упражнения по химии в конце главы
2.(a) [латекс] \ begin {array} {r @ {{} = {}} l} \ text {mass \; Ca} & 69.1 \; \ text {g} \\ [0.5em] \ text {mass \; Cl} _2 & 122 \; \ text {g} \ end {array} [/ latex]; (б) [латекс] \ begin {array} {r @ {{} = {}} l} \ text {mass \; Li} & 23.9 \; \ text {g} \\ [0.5em] \ text {mass \; H} _2 & 3.48 \; \ text {g} \ end {array} [/ latex]; (c) [латекс] \ begin {array} {r @ {{} = {}} l} \ text {mass \; Al} & 31.0 \; \ text {g} \\ [0.5em] \ text {mass \; Cl} _2 & 122 \; \ text {g} \ end {array} [/ latex]; (d) [латекс] \ begin {array} {r @ {{} = {}} l} \ text {mass \; Cr} & 59.8 \; \ text {g} \\ [0.5em] \ text {mass \; Br} _2 & 276 \; \ text {g} \ end {array} [/ latex]
4. 0,79 л
.

