Электролиз расплавов и растворов (солей, щелочей, кислот).
Что такое электролиз? Для более простого понимания ответа на этот вопрос давайте представим себе любой источник постоянного тока. У каждого источника постоянного тока всегда можно найти положительный и отрицательный полюс:
Подсоединим к нему две химически стойких электропроводящих пластины, которые назовем электродами. Пластину, присоединенную к положительному полюсу назовем анодом, а к отрицательному катодом:
Далее, представьте, что у вас есть возможность опустить эти два электрода в расплав хлорида натрия:
Хлорид натрия является электролитом, при его расплавлении происходит диссоциация на катионы натрия и хлорид-ионы:
NaCl = Na+ + Cl−
Очевидно, что заряженные отрицательно анионы хлора направятся к положительно заряженному электроду – аноду, а положительно заряженные катионы Na+ направятся к отрицательно заряженному электроду – катоду. В результате этого и катионы Na+ и анионы Cl− разрядятся, то есть станут нейтральными атомами. Разрядка происходит посредством приобретения электронов в случае ионов Na+ и потери электронов в случае ионов Cl−. То есть на катоде протекает процесс:
В результате этого и катионы Na+ и анионы Cl− разрядятся, то есть станут нейтральными атомами. Разрядка происходит посредством приобретения электронов в случае ионов Na+ и потери электронов в случае ионов Cl−. То есть на катоде протекает процесс:
Na+ + 1e− = Na0,
А на аноде:
Cl− − 1e− = Cl
Поскольку каждый атом хлора имеет по неспаренному электрону, одиночное существование их невыгодно и атомы хлора объединяются в молекулу из двух атомов хлора:
Сl∙ + ∙Cl = Cl2
Таким образом, суммарно, процесс, протекающий на аноде, правильнее записать так:
2Cl− − 2e− = Cl2
То есть мы имеем:
Катод: Na+ + 1e− = Na0
Анод: 2Cl− − 2e− = Cl2
Подведем электронный баланс:
Na+ + 1e− = Na0 |∙2
2Cl− − 2e− = Cl2 |∙1<
Сложим левые и правые части обоих уравнений полуреакций, получим:
2Na+ + 2e− + 2Cl− − 2e−= 2Na0 + Cl2
Сократим два электрона аналогично тому, как это делается в алгебре получим ионное уравнение электролиза:
2Na++ 2Cl− = 2Na0 + Cl2
далее, объединив ионы Na+ и Cl− получим, уравнение электролиза расплава хлорида натрия:
2NaCl(ж. ) => 2Na + Cl2
) => 2Na + Cl2
Рассмотренный выше случай является с теоретической точки зрения наиболее простым, поскольку в расплаве хлорида натрия из положительно заряженных ионов были только ионы натрия, а из отрицательных – только анионы хлора.
Другими словами, ни у катионов Na+, ни у анионов Cl− не было «конкурентов» за катод и анод.
А, что будет, например, если вместо расплава хлорида натрия ток пропустить через его водный раствор? Диссоциация хлорида натрия наблюдается и в этом случае, но становится невозможным образование металлического натрия в водном растворе. Ведь мы знаем, что натрий – представитель щелочных металлов – крайне активный металл, реагирующий с водой очень бурно. Если натрий не способен восстановиться в таких условиях, что же тогда будет восстанавливаться на катоде?
Давайте вспомним строение молекулы воды. Она представляет собой диполь, то есть у нее есть отрицательный и положительный полюсы:
Именно благодаря этому свойству, она способна «облеплять» как поверхность катода, так и поверхность анода:
При этом могут происходить процессы:
Катод:
2H2O + 2e− = 2OH− + H2
Анод:
2H2O – 4e− = O2 + 4H+
Таким образом, получается, что если мы рассмотрим раствор любого электролита, то мы увидим, что катионы и анионы, образующиеся при диссоциации электролита, конкурируют с молекулами воды за восстановление на катоде и окисление на аноде.
Так какие же процессы будут происходить на катоде и на аноде? Разрядка ионов, образовавшихся при диссоциации электролита или окисление/восстановление молекул воды? Или, возможно, будут происходить все указанные процессы одновременно?
В зависимости от типа электролита при электролизе его водного раствора возможны самые разные ситуации. Например, катионы щелочных, щелочноземельных металлов, алюминия и магния просто не способны восстановиться в водной среде, так как при их восстановлении должны были бы получаться соответственно щелочные, щелочноземельные металлы, алюминий или магний т.е. металлы, реагирующие с водой.
В таком случае является возможным только восстановление молекул воды на катоде.
Запомнить то, какой процесс будет протекать на катоде при электролизе раствора какого-либо электролита можно, следуя следующим принципам:
1) Если электролит состоит из катиона металла, который в свободном состоянии в обычных условиях реагирует с водой, на катоде идет процесс:
2H2O + 2e− = 2OH− + H2
Это касается металлов, находящихся в начале ряда активности по Al включительно.
2) Если электролит состоит из катиона металла, который в свободном виде не реагирует с водой, но реагирует с кислотами неокислителями, идут сразу два процесса, как восстановления катионов металла, так и молекул воды:
2H2O + 2e− = 2OH− + H2
Men+ + ne = Me0
К таким металлам относятся металлы, находящиеся между Al и Н в ряду активности.
3) Если электролит состоит из катионов водорода (кислота) или катионов металлов, не реагирующих с кислотами неокислителями — восстанавливаются только катионы электролита:
2Н+ + 2е− = Н2 – в случае кислоты
Men+ + ne = Me0 – в случае соли
На аноде тем временем ситуация следующая:
1) Если электролит содержит анионы бескислородных кислотных остатков (кроме F−), то на аноде идет процесс их окисления, молекулы воды не окисляются. Например:
2Сl− − 2e = Cl2
S2- − 2e = So
Фторид-ионы не окисляются на аноде поскольку фтор не способен образоваться в водном растворе (реагирует с водой)
2) Если в состав электролита входят гидроксид-ионы (щелочи) они окисляются вместо молекул воды:
4ОН− − 4е− = 2H2O + O2
3) В случае того, если электролит содержит кислородсодержащий кислотный остаток (кроме остатков органических кислот) или фторид-ион (F−) на аноде идет процесс окисления молекул воды:
2H2O – 4e− = O2 + 4H+
4) В случае кислотного остатка карбоновой кислоты на аноде идет процесс:
2RCOO− − 2e− = R-R + 2CO2
Давайте потренируемся записывать уравнения электролиза для различных ситуаций:
Пример №1
Напишите уравнения процессов протекающих на катоде и аноде при электролизе расплава хлорида цинка, а также общее уравнение электролиза.
Решение
При расплавлении хлорида цинка происходит его диссоциация:
ZnCl2 = Zn2+ + 2Cl−
Далее следует обратить внимание на то, что электролизу подвергается именно расплав хлорида цинка, а не водный раствор. Другими словами, без вариантов, на катоде может происходить только восстановление катионов цинка, а на аноде окисление хлорид-ионов т.к. отсутствуют молекулы воды:
Катод: Zn2+ + 2e− = Zn0 |∙1
Анод: 2Cl− − 2e− = Cl2 |∙1
ZnCl2 = Zn + Cl2
Пример №2
Напишите уравнения процессов протекающих на катоде и аноде при электролизе водного раствора хлорида цинка, а также общее уравнение электролиза.
Так как в данном случае, электролизу подвергается водный раствор, то в электролизе, теоретически, могут принимать участие молекулы воды. Так как цинк расположен в ряду активности между Al и Н то это значит, что на катоде будет происходить как восстановление катионов цинка, так и молекул воды.
Катод:
2H2O + 2e− = 2OH− + H2
Zn2+ + 2e− = Zn0
Хлорид-ион является кислотным остатком бескислородной кислоты HCl, поэтому в конкуренции за окисление на аноде хлорид-ионы «выигрывают» у молекул воды:
Анод:
2Cl− − 2e− = Cl2
В данном конкретном случае нельзя записать суммарное уравнение электролиза, поскольку неизвестно соотношение между выделяющимися на катоде водородом и цинком.
Пример №3
Напишите уравнения процессов протекающих на катоде и аноде при электролизе водного раствора нитрата меди, а также общее уравнение электролиза.
Нитрат меди в растворе находится в продиссоциированном состоянии:
Cu(NO3)2 = Cu2+ + 2NO3−
Медь находится в ряду активности правее водорода, то есть на катоде восстанавливаться будут катионы меди:
Катод:
Cu2+ + 2e− = Cu0
Нитрат-ион NO3− — кислородсодержащий кислотный остаток, это значит, что в окислении на аноде нитрат ионы «проигрывают» в конкуренции молекулам воды:
Анод:
2H2O – 4e− = O2 + 4H+
Таким образом:
Катод: Cu2+ + 2e− = Cu0 |∙2
Анод: 2H2O – 4e− = O2 + 4H+ |∙1
2Cu2+ + 2H2O = 2Cu0 + O2 + 4H+
Полученное в результате сложения уравнение является ионным уравнением электролиза. Чтобы получить полное молекулярное уравнение электролиза нужно добавить по 4 нитрат иона в левую и правую часть полученного ионного уравнения в качестве противоионов. Тогда мы получим:
Чтобы получить полное молекулярное уравнение электролиза нужно добавить по 4 нитрат иона в левую и правую часть полученного ионного уравнения в качестве противоионов. Тогда мы получим:
2Cu(NO3)2 + 2H2O = 2Cu0 + O2 + 4HNO3
Пример №4
Напишите уравнения процессов, протекающих на катоде и аноде при электролизе водного раствора ацетата калия, а также общее уравнение электролиза.
Решение:
Ацетат калия в водном растворе диссоциирует на катионы калия и ацетат-ионы:
СН3СООК = СН3СОО− + К+
Калий является щелочным металлом, т.е. находится в ряду электрохимическом ряду напряжений в самом начале. Это значит, что его катионы не способны разряжаться на катоде. Вместо них восстанавливаться будут молекулы воды:
Катод:
2H2O + 2e− = 2OH− + H2
Как уже было сказано выше, кислотные остатки карбоновых кислот «выигрывают» в конкуренции за окисление у молекул воды на аноде:
Анод:
2СН3СОО− − 2e− = CH3−CH3 + 2CO2
Таким образом, подведя электронный баланс и сложив два уравнения полуреакций на катоде и аноде получаем:
Катод: 2H2O + 2e− = 2OH− + H2 |∙1
Анод: 2СН3СОО− − 2e− = CH3−CH3 + 2CO2 |∙1
2H2O + 2СН3СОО− = 2OH− + Н2+ CH3−CH3 + 2CO2
Мы получили полное уравнение электролиза в ионном виде. Добавив по два иона калия в левую и правую часть уравнения и сложив с противоионами мы получаем полное уравнение электролиза в молекулярном виде:
Добавив по два иона калия в левую и правую часть уравнения и сложив с противоионами мы получаем полное уравнение электролиза в молекулярном виде:
2H2O + 2СН3СООK = 2KOH + Н2+ CH3−CH3 + 2CO2
Пример №5
Напишите уравнения процессов, протекающих на катоде и аноде при электролизе водного раствора серной кислоты, а также общее уравнение электролиза.
Серная кислота диссоциирует на катионы водорода и сульфат-ионы:
H2SO4 = 2H+ + SO42-
На катоде будет происходить восстановление катионов водорода H+ , а на аноде окисление молекул воды, поскольку сульфат-ионы являются кислородсодержащими кислотными остатками:
Катод: 2Н+ + 2e− = H2 |∙2
Анод: 2H2O – 4e− = O2 + 4H+ |∙1
4Н+ + 2H2O = 2H2 + O2 + 4H+
Сократив ионы водорода в левой и правой и левой части уравнения получим уравнение электролиза водного раствора серной кислоты:
2H2O = 2H2 + O2
Как можно видеть, электролиз водного раствора серной кислоты сводится к электролизу воды.
Пример №6
Напишите уравнения процессов, протекающих на катоде и аноде при электролизе водного раствора гидроксида натрия, а также общее уравнение электролиза.
Диссоциация гидроксида натрия:
NaOH = Na+ + OH−
На катоде будут восстанавливаться только молекулы воды, так как натрий – высокоактивный металл, на аноде только гидроксид-ионы:
Катод: 2H2O + 2e− = 2OH− + H2 |∙2
Анод: 4OH− − 4e− = O2 + 2H2O |∙1
4H2O + 4OH− = 4OH− + 2H2 + O2 + 2H2O
Сократим две молекулы воды слева и справа и 4 гидроксид-иона и приходим к тому, что, как и в случае серной кислоты электролиз водного раствора гидроксида натрия сводится к электролизу воды:
2H2O = 2H2 + O2
Электролиз расплавов и растворов | ЕГЭ по химии
Электролиз расплавов и растворов (солей, щелочей)
Если в раствор или расплав электролита опустить электроды и пропустить постоянный электрический ток, то ионы будут двигаться направленно: катионы к катоду (отрицательно заряженному электроду), анионы к аноду (положительно заряженному электроду). {-}=2{Na}↖{0}+{Cl_2}↖{0}↑$
{-}=2{Na}↖{0}+{Cl_2}↖{0}↑$
или
$2NaCl{→}↖{\text”электролиз”}2Na+Cl_2↑$
На катоде образуется металлический натрий, на аноде — газообразный хлор.
Главное, что вы должны помнить: в процессе электролиза за счет электрической энергии осуществляется химическая реакция, которая самопроизвольно идти не может.
Электролиз водных растворов электролитов
Более сложный случай — электролиз растворов электролитов.
В растворе соли, кроме ионов металла и кислотного остатка, присутствуют молекулы воды. Поэтому при рассмотрении процессов на электродах необходимо учитывать их участие в электролизе.
Для определения продуктов электролиза водных растворов электролитов существуют следующие правила:
1. Процесс на катоде зависит не от материала, из которого сделан катод, а от положения металла (катиона электролита) в электрохимическом ряду напряжений, при этом если:
1.1. Катион электролита расположен в ряду напряжений в начале ряда по $Al$ включительно, то на катоде идет процесс восстановления воды (выделяется водород $Н_2↑$). {+}$
{+}$
2.1. Если анод растворяется (железо, цинк, медь, серебро и все металлы, которые окисляются в процессе электролиза), то окисляется металл анода, несмотря на природу аниона.
2.2. Если анод не растворяется (его называют инертным — графит, золото, платина), то:
а) при электролизе растворов солей бескислородных кислот (кроме фторидов) на аноде идет процесс окисления аниона;
б) при электролизе растворов солей кислородсодержащих кислот и фторидов на аноде идет процесс окисления воды (выделяется $О_2↑$). Анионы не окисляются, они остаются в растворе;
в) анионы по их способности окисляться располагаются в следующем порядке:
Попробуем применить эти правила в конкретных ситуациях.
Рассмотрим электролиз раствора хлорида натрия в случае, если анод нерастворимый и если анод растворимый.
1) Анод нерастворимый (например, графитовый).
В растворе идет процесс электролитической диссоциации:
Суммарное уравнение:
$2H_2O+2Cl^{-}=H_2↑+Cl_2↑+2OH^{-}$. {-}+O_2↑+2H_2O$
{-}+O_2↑+2H_2O$
Суммарное молекулярное уравнение:
$2H_2O{→}↖{\text”электролиз”}2H_2↑+O_2↑$
В данном случае, оказывается, идет только электролиз воды. Аналогичный результат получим и в случае электролиза растворов $H_2SO_4, NaNO_3, K_2SO_4$ и др.
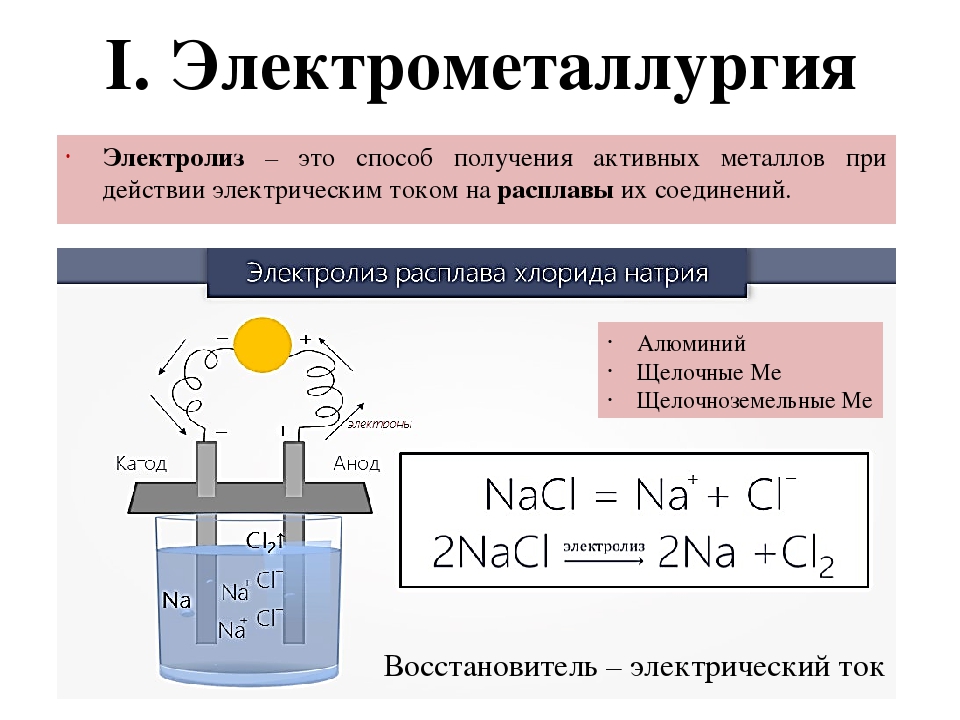
Электролиз расплавов и растворов веществ широко используется в промышленности:
- Для получения металлов (алюминий, магний, натрий, кадмий получают только электролизом).
- Для получения водорода, галогенов, щелочей.
- Для очистки металлов — рафинирования (очистку меди, никеля, свинца проводят электрохимическим методом).
- Для защиты металлов от коррозии (хрома, никеля, меди, серебра, золота) — гальваностегия.
- Для получения металлических копий, пластинок — гальванопластика.
Электролиз – это окислительно –
восстановительные реакции, протекающие на электродах, если через расплав или раствор электролита
пропускают постоянный электрический ток. Катод – восстановитель, отдаёт электроны катионам. Анод – окислитель, принимает электроны от анионов.
Процессы, протекающие на электродах при электролизе расплавов
(не зависят от материала электродов и природы ионов). 1. На аноде разряжаются анионы (Am–; OH–), превращаясь в нейтральные атомы или молекулы: Am– – mē → A°; 4OH– – 4ē → O2↑ + 2H2O (процессы окисления). 2. На катоде разряжаются катионы (Men Men+ + nē → Me° ; 2H+ + 2ē → H20↑ (процессы восстановления). Процессы, протекающие на электродах при электролизе растворов
ЭЛЕКТРОЛИЗ РАСПЛАВОВ Задание 1. Составьте схему электролиза расплава бромида натрия. (Алгоритм 1.)
Задание 2. Составьте схему электролиза расплава гидроксида натрия. (Алгоритм 2.)
Задание 3. Составьте схему электролиза расплава сульфата натрия. (Алгоритм 3.)
ЭЛЕКТРОЛИЗ РАСТВОРОВ Задание 1. Составить схему электролиза водного раствора хлорида натрия с использованием инертных электродов. (Алгоритм 1.)
Задание 2. Составить схему электролиза водного раствора сульфата меди (II) с использованием инертных электродов. (Алгоритм 2.)
Задание 3. Составить схему электролиза водного
раствора водного раствора гидроксида натрия с использованием инертных электродов.
Запомнить. При электролизе кислородсодержащих кислот (H2SO4и др.) , оснований (NaOH, Ca(OH)2 и др.), солей активных металлов и кислородсодержащих кислот (K2SO4 и др.) на электродах протекает электролиз воды: 2H2O = 2H2 ↑+ O2↑ Задание 4. Составить схему электролиза водного раствора нитрата серебра с использованием анода, изготовленного из серебра, т.е. анод – растворимый. (Алгоритм 4.)
| ||
Где применяют электролиз
Электролиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор, либо расплав электролита.
При прохождении через раствор или расплав электролита электрического тока, на электродах происходит выделение растворенных веществ или иных веществ, являющихся продуктами вторичных реакций на электродах. Этот физико-химический процесс и называется электролизом.
Суть электролиза
В создаваемом электродами электрическом поле, ионы в проводящей жидкости приходят в упорядоченное движение. Отрицательный электрод — это катод, положительный — анод.
К аноду устремляются отрицательные ионы, называемые анионами (ионы гидроксильной группы и кислотные остатки), а к катоду — положительные ионы, называемые катионами (ионы водорода, металлов, аммония и т. д.)
На электродах протекает окислительно-восстановительный процесс: на катоде происходит электрохимическое восстановление частиц (атомов, молекул, катионов), а на аноде — электрохимическое окисление частиц (атомов, молекул, анионов). Реакции диссоциации в электролите — это первичные реакции, а реакции, которые протекают непосредственно на электродах, называются вторичными.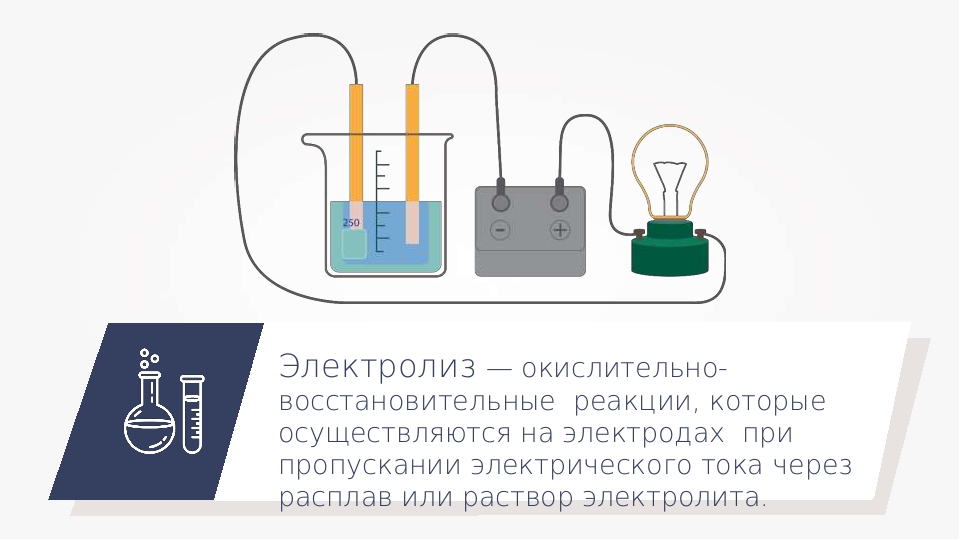
Законы электролиза Фарадея
Разделение реакций электролиза на первичные и вторичные помогло Майклу Фарадею установить законы электролиза:
- Первый закон электролиза Фарадея: масса вещества, осаждённого на электроде при электролизе, прямо пропорциональна количеству электричества, переданного на этот электрод. Под количеством электричества имеется в виду электрический заряд, измеряемый, как правило, в кулонах.
- Второй закон электролиза Фарадея: для данного количества электричества (электрического заряда) масса химического элемента, осаждённого на электроде, прямо пропорциональна эквивалентной массе элемента. Эквивалентной массой вещества является его молярная масса, делённая на целое число, зависящее от химической реакции, в которой участвует вещество.
m — масса осаждённого на электроде вещества, Q — полный электрический заряд, прошедший через вещество F = 96 485,33(83) Кл·моль−1 — постоянная Фарадея, M — молярная масса вещества (Например, молярная масса воды h3O = 18 г/моль), z — валентное число ионов вещества (число электронов на один ион).
Заметим, что M/z — это эквивалентная масса осаждённого вещества. Для первого закона Фарадея M, F и z являются константами, так что чем больше величина Q, тем больше будет величина m. Для второго закона Фарадея Q, F и z являются константами, так что чем больше величина M/z (эквивалентная масса), тем больше будет величина m.
Электролиз широко применяется сегодня в промышленности и в технике. Например, именно электролиз служит одним из эффективнейших способов промышленного получения водорода, пероксида водорода, диоксида марганца, алюминия, натрия, магния, кальция и прочих веществ. Применяется электролиз для очистки сточных вод, в гальваностегии, в гальванопластике, наконец — в химических источниках тока. Но обо всем по порядку.
Получение чистых металлов из руд путем электролиза
Благодаря электролизу многие металлы извлекается из руд и подвергается дальнейшей переработке. Так, когда руду или обогащенную руду — концентрат — подвергают обработке реагентами, металл переходит в раствор, затем путем электроэкстракции металл выделяют из раствора. Чистый металл выделяется при этом на катоде. Таким путем получают цинк, медь, кадмий.
Чистый металл выделяется при этом на катоде. Таким путем получают цинк, медь, кадмий.
Электрорафинированию металлы подвергают для устранения примесей и чтобы перевести содержащиеся примеси в удобную для дальнейшей переработки форму. Металл, подлежащий очистке, отливают в виде пластин, и применяют эти пластины в качестве анодов при электролизе.
Когда ток проходит, металл анода растворяется, переходит в виде катионов в раствор, затем катионы разряжаются на катоде, и образуют осадок чистого металла. Примеси анода не растворяются – выпадают анодным шламом, или переходят в электролит, откуда непрерывно или периодически удаляются.
Рассмотрим в качестве примера электрорафинирование меди. Главный компонент раствора – сульфат меди — наиболее распространенная и дешевая соль этого металла. Раствор обладает низкой электрической проводимостью. Для ее увеличения в электролит добавляют серную кислоту.
Кроме того, в раствор вводят небольшие количества добавок, способствующих получению компактного осадка металла. Вообще, электролитическому рафинированию подвергают медь, никель, свинец, олово, серебро, золото.
Вообще, электролитическому рафинированию подвергают медь, никель, свинец, олово, серебро, золото.
Очистка сточных вод путем электролиза
Электролиз находит применение в очистке сточных вод (процессы электрокоагуляции, электроэкстракции и электрофлотации). Электрохимический метод очистки — один из наиболее часто применяемых. Для электролиза используют нерастворимые аноды (магнетит, оксид свинца, графит, марганец, которые наносят на титановую основу), или растворимые (алюминий, железо).
Такой метод применяют для выделения из воды токсичных органических и неорганических веществ. К примеру, медные трубы очищают от окалины раствором серной кислоты, и промышленные сточные воды приходится затем очищать путем электролиза с нерастворимым анодом. На катоде выделяется медь, которая снова может использоваться на том же предприятии.
Щелочные сточные воды очищают электролизом от цианистых соединений. С целью ускорения окисления цианидов, повышения электропроводности и экономии электроэнергии, к водам применяют добавку в виде хлорида натрия.
Электролиз проводят с графитовым анодом и стальным катодом. Цианиды разрушаются в ходе электрохимического окисления и хлором, который выделяется на аноде. Результативность такой очистки близка к 100%.
Кроме непосредственно электохимической очистки можно включить в процесс электролиза коагуляцию. Исключив добавки солей, электролиз проводят с растворимыми алюминиевыми или железными анодами. Тогда не только разрушаются загрязнители на аноде, но и растворяется сам анод. Образуются активные дисперсные соединения, которые коагулируют (сгущают) коллоидно-дисперсные загрязнения.
Этот метод эффективен при очистке сточных вод от жиров, нефтепродуктов, красителей, масел, радиоактивных веществ и т. д. Он называется электрокоагуляцией.
Гальваностегия
Гальваностегия — это электролитическое нанесение определенных металлов с целью защиты изделий от коррозии и для придания им соответствующего эстетического оформления (покрытие производят хромом, никелем, серебром, золотом, платиной и т.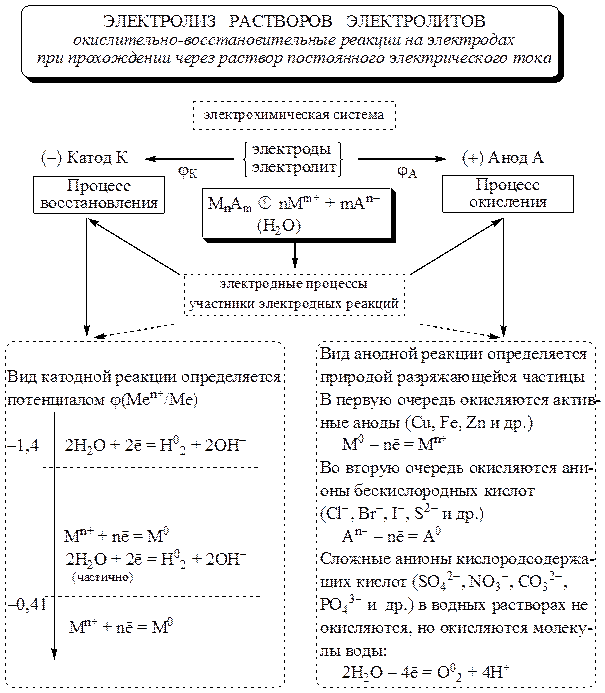 п.). Вещь тщательно очищают, обезжиривают, и используют как катод в электролитической ванне, в которую налит раствор соли того металла, которым необходимо покрыть изделие.
п.). Вещь тщательно очищают, обезжиривают, и используют как катод в электролитической ванне, в которую налит раствор соли того металла, которым необходимо покрыть изделие.
В качестве анода применяют пластину из этого же металла. Как правило применяют пару анодных пластин, а подлежащий гальваностегии предмет располагают между ними.
Гальванопластика
Гальванопластика – осаждение металла на поверхности разных тел для воспроизведения их формы: формы для отливки деталей, скульптур, печатных клише и т.д.
Гальваническое осаждение металла на поверхности предмета возможно лишь тогда, когда поверхность эта или весь предмет являются проводниками электрического тока, поэтому для изготовления моделей или форм желательно использовать металлы. Наиболее подходят для этой цели легкоплавкие металлы: свинец, олово, припои, сплав Вуда.
Эти металлы мягки, легко обрабатываются слесарным инструментом, хорошо гравируются и отливаются. После наращивания гальванического слоя и отделки металл формы выплавляют из готового изделия.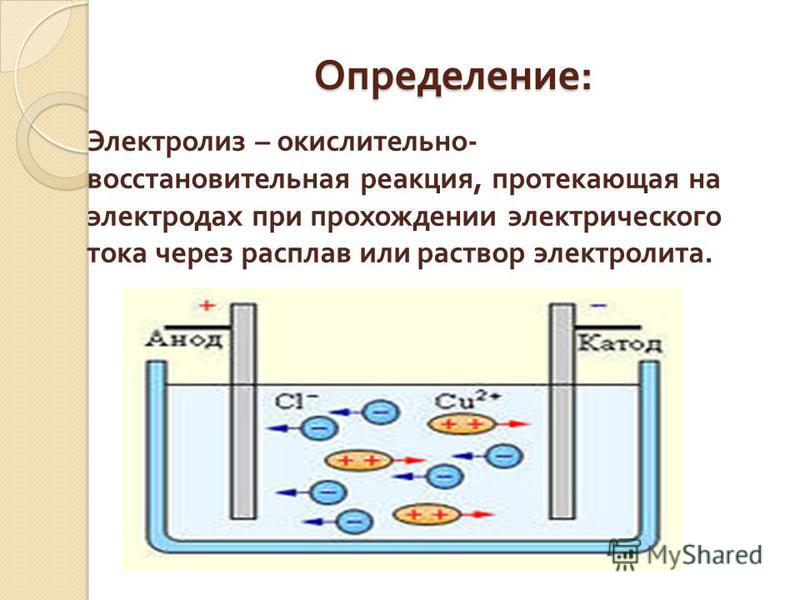
Однако наибольшие возможности для изготовления моделей все же представляют диэлектрические материалы. Чтобы металлизировать такие модели, нужно придать их поверхности электропроводность. Успех или неудача в конечном итоге зависят в основном от качества токопроводящего слоя. Слой этот может быть нанесен одним из трех способов.
Самый распространенный способ — графитирование, он пригоден для моделей из пластилина и других материалов, допускающих растирание графита по поверхности.
Следующий прием — бронзирование, способ хорош для моделей относительно сложной формы, для разных материалов, однако за счет толщины бронзового слоя несколько искажается передача мелких деталей.
И, наконец, серебрение, пригодное во всех случаях, но особенно незаменимое для хрупких моделей с очень сложной формой — растений, насекомых и т. п.
Химические источники тока
Также электролиз является основным процессом, благодаря которому функционируют самые современные химические источники тока, например батарейки и аккумуляторы. Здесь присутствуют два электрода, контактирующие с электролитом.
Здесь присутствуют два электрода, контактирующие с электролитом.
Между электродами устанавливается разность потенциалов — электродвижущая сила, соответствующая свободной энергии окислительно-восстановительной реакции.
Лимонная батарейка (для увеличения нажмите нажмите на картинку)
Действие химических источников тока основано на протекании при замкнутой внешней цепи пространственно-разделённых процессов: на отрицательном аноде восстановитель окисляется, образующиеся свободные электроны переходят по внешней цепи к положительному катоду, создавая разрядный ток, где они участвуют в реакции восстановления окислителя. Таким образом, поток отрицательно заряженных электронов по внешней цепи идет от анода к катоду, то есть от отрицательного электрода к положительному.
Ранее ЭлектроВести писали, что в недавнем докладе Cleantech Group авторы рассказали о трех самых важных для энергетики ближайших лет технологиях. Журналисты Business Insider обсудили их с Луисом Брасингтоном, одним из аналитиков компании.
По материалам: electrik.info.
Электролиз и химические реакции – Справочник химика 21
Аккумуляторы при разряде отдают ток, накопленный в процессе заряда в результате химических реакций, происходящих при электролизе. Простейшим аккумулятором является кислотный или свинцовый аккумулятор. Он состоит из свинцовых пластин, погруженных в сосуд, наполненный серной кислотой. Свинец и кислота вступают в реакцию [c.156] Как и в случае химического источника э.лектрической энергии, электрод, на котором происходит восстановление, называется катодом э.лектрод, на котором происходит окисление, называется анодом. Но при электролизе катод заряжен отрицательно, а анод — положительно, т. е. распределение знаков заряда электродов противоположно тому, которое имеется при работе гальванического элемента. Причина этого заключается в том, что процессы, протекающие при электролизе, в принципе обратны процессам, идущим при работе гальванического элемента. При электролизе химическая реакция осуществляется за счет энергии электрического тока, подводимой извне, в то время как при работе гальванического элемента энергия самопроизвольно протекающей в нем химической реакции превращается в электрическую энергию. [c.282]
При электролизе химическая реакция осуществляется за счет энергии электрического тока, подводимой извне, в то время как при работе гальванического элемента энергия самопроизвольно протекающей в нем химической реакции превращается в электрическую энергию. [c.282]
Химические процессы при электролизе. Электролиз представляет собой процесс, в котором химические реакции происходят под действием электрического тока. Химические превращения при электролизе могут быть весьма различными в зависимости главным образом от вида электролита и растворителя, а также от материала электродов и присутствия других веществ в растворе. Наиболее общей является следующая схема процесса. [c.443]
Наряду с научным интересом гальванические элементы имеют чрезвычайно большое техническое значение. Они служат, с одной стороны, как источники тока (например, аккумуляторы), с другой стороны, для проведения химических реакций, которые осуществляются трудно или в других условиях вообще не осуществляются.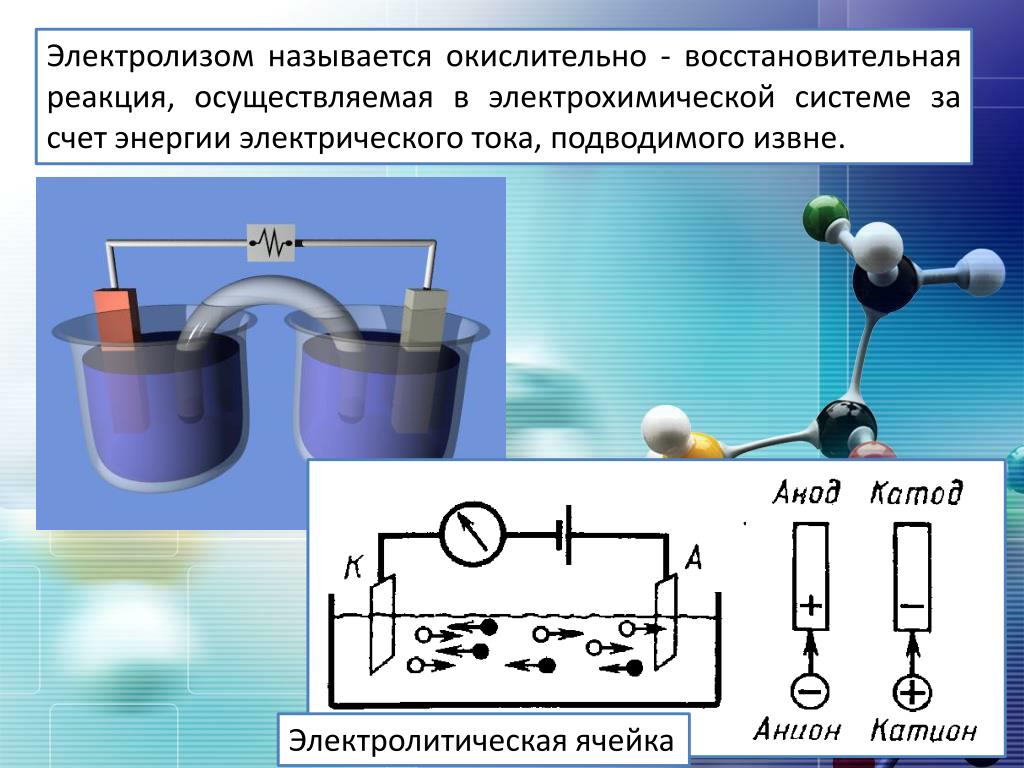 Известными примерами таких процессов, которые технически проводят в большом масштабе, является электролиз хлоридов щелочных металлов, электролитическое производство алюминия и электролитическое осаждение металлов в виде поверхностных слоев (гальванические покрытия). [c.272]
Известными примерами таких процессов, которые технически проводят в большом масштабе, является электролиз хлоридов щелочных металлов, электролитическое производство алюминия и электролитическое осаждение металлов в виде поверхностных слоев (гальванические покрытия). [c.272]
Электрогравиметрический метод основан на выделении элемента из раствора в свободном состоянии (иногда в виде оксидов) с помощью электролиза на взвешенном электроде. По увеличению массы предварительно взвешенного электрода вычисляют содержание определяемого элемента в пробе. Этот метод относится, как показывает его название, к гравиметрическим методам. При анализе продукции цветной металлургии электрогравиметрический метод применяют для определения содержания меди в сплавах, черновой меди, для разделения и определения содержания меди и никеля при совместном их присутствии. При электролизе химическая реакция на электродах протекает под действием электрического тока (внешний электролиз). [c.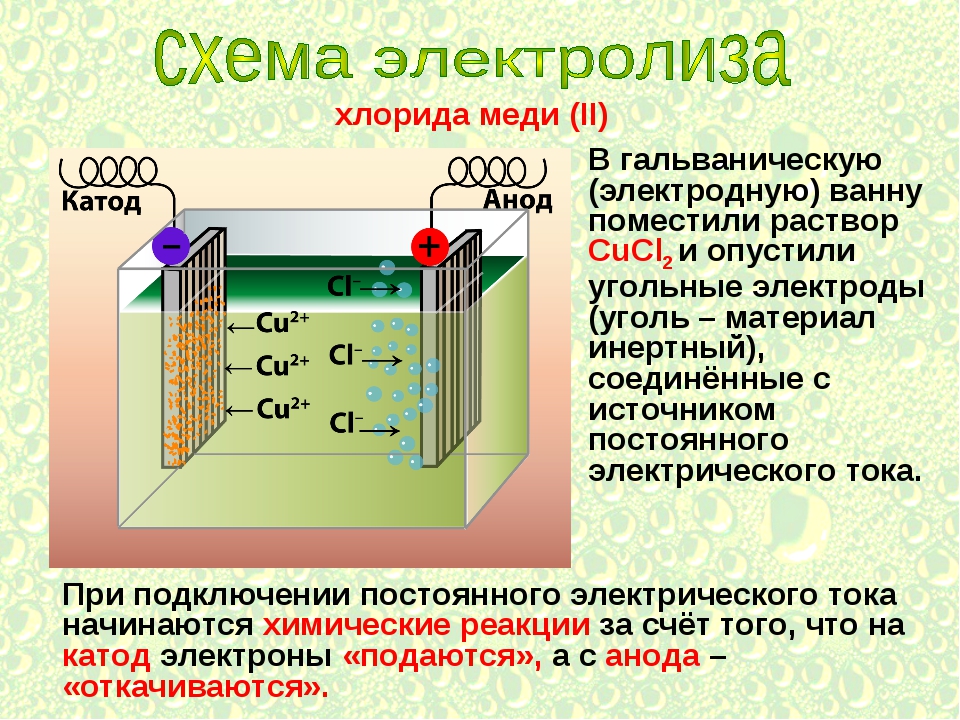 41]
41]
Другими словами, в основе электрохимических методов лежит процесс электролиза — химические реакции, протекающие под действием электрического тока на электродах, помещенных в раствор электролита. В электрическом поле положительно заряженные ионы (катионы) движутся к катоду, отрицательно заряженные (анионы) — к аноду. На катоде происходит восстановление, а на аноде — окисление ионов или молекул, входящих в состав электролита. Количество образующихся на электродах веществ и количество пропущенного электричества связаны законами Фарадея [1—5]. [c.307]
Рассматривая процессы в гальваническом элементе, мы видели, что в нем происходит реакция окисления-восстановления. При электролизе (рис. 40) окисление происходит на положительном электроде, к которому движутся анионы поэтому он называется анодом. Восстановление происходит на отрицательном электроде — катоде. В элементе нет”тока, посылаемого некоторой внешней э.
 д. с., — он сам является генератором электрической энергии. Поэтому процессы, происходящие в элементе, обратны по смыслу процессам, происходящим при электролизе. Если при электролизе химические реакции текут принудительно за счет электрической энергии, подводимой от постороннего источника, то в элементе, наоборот, химические реакции, текущие самопроизвольно, служат причиной возникновения электрической энергии. Окисление в элементе происходит на отрицательном электроде, восстановление — на положительном. Можно условиться связывать названия электродов не со знаком заряда, а с процессом. Тогда отрицательный электрод на котором протекает окисление, будет называться анодом, а положительный — катодом. [c.242]
д. с., — он сам является генератором электрической энергии. Поэтому процессы, происходящие в элементе, обратны по смыслу процессам, происходящим при электролизе. Если при электролизе химические реакции текут принудительно за счет электрической энергии, подводимой от постороннего источника, то в элементе, наоборот, химические реакции, текущие самопроизвольно, служат причиной возникновения электрической энергии. Окисление в элементе происходит на отрицательном электроде, восстановление — на положительном. Можно условиться связывать названия электродов не со знаком заряда, а с процессом. Тогда отрицательный электрод на котором протекает окисление, будет называться анодом, а положительный — катодом. [c.242] Инверсионной вольтамперометрией (ИВ) называют вольтамперометрию, в которой аналитический сигнал определяется концентрацией ЭАВ не в растворе, а на поверхности или в объеме электрода. Обычно регистрации вольтамперограммы в Р1В предшествует накопление ЭАВ из раствора путем электролиза, химической реакции или адсорбции. С этой целью электрод предварительно выдерживают в анализируемом растворе в течение определенного времени, называемого временем накопления н- В течение этого времени на поверхности электрода или в его объеме концентрируется определяемое вещество или продукт его электрохимического или химического превращения. [c.58]
С этой целью электрод предварительно выдерживают в анализируемом растворе в течение определенного времени, называемого временем накопления н- В течение этого времени на поверхности электрода или в его объеме концентрируется определяемое вещество или продукт его электрохимического или химического превращения. [c.58]
Такое равновесие достигается в некотором весьма значительном интервале изменения потенциалов пластин (электродов). Однако по мере увеличения потенциала электродов наступает момент, при котором установления такого равновесия уже не наблюдается, и между электродами начинает течь постоянный ток, подчиняющийся закону Ома. Процесс сопровождается химическими реакциями на электродах (электролиз). Потенциал, при котором в растворе начинает течь постоянный ток, получил название потенциала разложения. [c.553]
Электрохимия. Изучается взаимодействие электрических явлений и химических реакций (электролиз, химические источники электрического тока, теория электросинтеза). В электрохимию включают обычно учение о свойствах растворов электролитов, которое с равным правом можно отнести и к учению о растворах. [c.19]
В электрохимию включают обычно учение о свойствах растворов электролитов, которое с равным правом можно отнести и к учению о растворах. [c.19]
Химическая реакция цинковая обманка обжигается, затем обожженный материал обрабатывается серной кислотой. Полученный раствор сульфата цинка очищается от сопутствующих элементов и далее подвергается электролизу. [c.250]
При электролизе растворов и расплавов основными процессами являются окислительно-восстановительные электрохимические реакции на электродах. Причем, в отличие от аналогичных химических реакций, протекающих в объёме, процессы окисления и восстановления пространственно разделены на аноде идет отдача электронов (окисление), а на катоде их присоединение (восстановление). [c.187]
К электродным процессам относятся две группы процессов, тесно связанные между собой. Во-первых, процессы возникновения разности потенциалов и. следовательно, электрического тока в результате протекания химической реакции, например в гальванических элементах. Во-вторых, обратные им химические процессы, совершающиеся при электролизе, которые возникают при пропускании электрического тока через раствор и связаны с переходом тока с проводника одного рода в проводник другого рода. [c.414]
Во-вторых, обратные им химические процессы, совершающиеся при электролизе, которые возникают при пропускании электрического тока через раствор и связаны с переходом тока с проводника одного рода в проводник другого рода. [c.414]
Совокупность химических реакций, которые протекают на электродах в растворах или расплавах при пропускании через них электрического тока, называется электролизом. [c.84]
При протекании электрического тока на границе металл — раствор образуется тонкая плотная пленка барьерного типа (рис. 13.1), рост которой происходит в результате миграции в ней ионов алюминия навстречу ионам кислорода. Толщина барьерного слоя (0,01—0,1 мкм) остается приблизительно постоянной в течение электролиза, так как внешняя его сторона подвергается растворяющему воздействию электролита по химической реакции [c.80]
В настоящее время считается, что при электролизе растворов хлорида натрия ЫаСЮз образуется не только по электрохимической, но и по химической реакции. При сравнительно [c.180]
При сравнительно [c.180]
Лимитирующей стадией всего процесса окисления алифатических спиртов до карбоновых кислот является медленная химическая реакция (33.3). Следовательно, условия проведения процесса электролиза, оказывающие влияние на скорость лимитирующей стадии, будут в целом определять эффективность электрохимического окисления спиртов. [c.208]
Уравнения реакций электролиза являются такими же химическими уравнениями, как и все остальные уравнения реакций. Поэтому по ним можно производить все те же самые расчеты, что и по другим уравнениям химических реакций. Кроме того, при электролизе [c.178]
Применительно к химическим процессам второй закон термодинамики можно сформулировать так всякое химическое взаимодействие при неизменных давлении или объеме и постоянстве температуры протекает в направлении уменьшения свободной энергии системы. Пределом протекания химических реакций (т. е. условием равновесия) является достижение некоторого минимального для данных условий значения свободной энергии системы О или Р. Процессы протекают самопроизвольно и дают некоторую полезную работу, если Р0 и ДС>0 процессы не могут при заданных условиях (у, Т или р, Т) протекать самопроизвольно и возможны лишь при получении работы извне (например, реакции при электролизе, фотохимические реакции и др.). Изменение термодинамических функций А[1, АР, А/, АО и А5 для любых реакций рассчитывают по закону Гесса аналогично вычислению тепловых эффектов реакций. Значения термодинамических функций при стандартных условиях / = 25°С и р=101 325 Па приводятся в справочных таблицах. [c.61]
Процессы протекают самопроизвольно и дают некоторую полезную работу, если Р0 и ДС>0 процессы не могут при заданных условиях (у, Т или р, Т) протекать самопроизвольно и возможны лишь при получении работы извне (например, реакции при электролизе, фотохимические реакции и др.). Изменение термодинамических функций А[1, АР, А/, АО и А5 для любых реакций рассчитывают по закону Гесса аналогично вычислению тепловых эффектов реакций. Значения термодинамических функций при стандартных условиях / = 25°С и р=101 325 Па приводятся в справочных таблицах. [c.61]
Электрохимия — раздел физической химии, изучающий процессы превращения энергии химической реакции в электрическую и, наоборот, электрической энергии в химическую. Первый процесс протекает в гальванических элементах, второй при электролизе. [c.359]
Процессы, протекающие при электролизе, по существу обратны процессам, имеющим место в гальванических элементах. При электролизе анод заряжен положительно, а катод — отрицательно. При работе гальванического элемента энергия самопроизвольно протекающей реакщт превращается в электрическую, тогда как при электролизе химические реакции осуществляются за счет электрической энергии внешнего источника. На аноде, как и в случае химических источников тока, происходит окисление, на катоде— восстановление. При электролизе из возможных процессов будет [c.161]
При работе гальванического элемента энергия самопроизвольно протекающей реакщт превращается в электрическую, тогда как при электролизе химические реакции осуществляются за счет электрической энергии внешнего источника. На аноде, как и в случае химических источников тока, происходит окисление, на катоде— восстановление. При электролизе из возможных процессов будет [c.161]
Отличительной особенностью здесь является то, что при электролизе химические реакции осуществляются за счет электрической энергии внешнего источника, тогда как при работе гальванического элемента энергия самопроизвольно прохекающей химической реакции превращается в электрическую. [c.262]
Позднее, с открытием и исследованием электрической, лучистой, химТ1ческой и других форм энергии, постепенно в круг рассматриваемых термодинамикой вопросов включается и изучение этих форм энергии. Быстро расширялась и область практического применения термодинамических методов исследования. Уже не только паровая машина и процессы превращения механической энергии в теплоту исследуются на основе.законов термодинамики, но и электрические машины, холодильные машины, компрессоры, двигатели внутреннего сгорания, реактивные двигатели. Гальванические элементы, а также процессы электролиза, различные химические реакции, атмосферные явления, некоторые процессы, протекающие в растительных и животных организмах, и многие другие исследуются не только в отношении их энергетического баланса, но и в отношении возможности, направления и предела самопроизвольного протекания процесса в данных условиях. Они исследуются также в отношении установления условий равновесия, определения максимального количества полезной работы, которая может быть получена при проведении рассматриваемого процесса в тех или иных условиях, или, наоборот, минимального количества работы, которое необходимо затратить для осуществ- [c.178]
Уже не только паровая машина и процессы превращения механической энергии в теплоту исследуются на основе.законов термодинамики, но и электрические машины, холодильные машины, компрессоры, двигатели внутреннего сгорания, реактивные двигатели. Гальванические элементы, а также процессы электролиза, различные химические реакции, атмосферные явления, некоторые процессы, протекающие в растительных и животных организмах, и многие другие исследуются не только в отношении их энергетического баланса, но и в отношении возможности, направления и предела самопроизвольного протекания процесса в данных условиях. Они исследуются также в отношении установления условий равновесия, определения максимального количества полезной работы, которая может быть получена при проведении рассматриваемого процесса в тех или иных условиях, или, наоборот, минимального количества работы, которое необходимо затратить для осуществ- [c.178]
Окислительные и восстановительные процессы, происходящие на электродах при пропускании постоянного электрического тока через систему, включающую электролит, называются электролизом. Химические реакции, протекающие прн электролизе, осуществляются при помощи энергии электрического тока, подведенного извне. Следовательно, при электролизе происходит преобразование электрической энергии в химическую. Процесс , окисления и восстановления в этом случае протекают раздельно, т.е. на различных электродах. Электрод, на коттэром происходит восстановление, называется катодом, а электрод, на котором происходит окисление, — анодом. Катод подключен к отрицательному полюсу, и поэтому к нему движутся катионы, анод — к положИ тельному полюсу, и к нему движутся анионы. Вследствие этих процессов осуществляется перемещение электронов по внешней цепи. [c.239]
Химические реакции, протекающие прн электролизе, осуществляются при помощи энергии электрического тока, подведенного извне. Следовательно, при электролизе происходит преобразование электрической энергии в химическую. Процесс , окисления и восстановления в этом случае протекают раздельно, т.е. на различных электродах. Электрод, на коттэром происходит восстановление, называется катодом, а электрод, на котором происходит окисление, — анодом. Катод подключен к отрицательному полюсу, и поэтому к нему движутся катионы, анод — к положИ тельному полюсу, и к нему движутся анионы. Вследствие этих процессов осуществляется перемещение электронов по внешней цепи. [c.239]
В процессе электролиза химическая реакция протекает в иадравлении, противоположном самопроизвольному, при иаложеЕШИ на ячейку постоянного па пряжения от внешнего источника. Ячейка состоят из двух электродов, контактирующие с раствором. Если рщ, общее напряжение, наложенкое на ячейку, распределяется следующим образом [c. 384]
384]
Одно из первых конкретных представлений о природе химической связи возникло на основании экспериментального исследования электролиза английским ученым Майклом Фарадеем (1791-1867). (Электролиз означает разрыв на части при помощи электричества .) Если расплавить хлорид натрия, нагрев его выше 80ГС, и погрузить в расплав два электрода (катод и анод), как показано на рис. 1-8, а затем пропустить через расплавленную соль электрический ток, на электродах начнут протекать химические реакции ионы натрия будут мигрировать к катоду (где электроны поступают в расплав) и восстанавливаться там до металлического натрия [c.41]
Реакции электролиза являются такими же химическими реакциями, как и все остальные. Поэтому по реакциям электролиза можно производить стехиометрические расчеты точно так же, как это было сделано для других реакций. Останавливаться подробно мы на этом сейчас не станем. Но для реакций, протекающих под действием элеирического тока, существуют специфичные количественные соотношения, названные в честь ученого, установившего эти законы, законами Фарадея. [c.272]
[c.272]
Протекание электрического тока через электролиты приводит к их электролизу, при котбром химическая реакция поддерживается за счет электрической энергии внешнего источника. [c.78]
То же относится и к химическим процессам. Взаимодействие водорода и кислорода с образованием воды может происходить самопроизвольно, и осуществление этой реакции дает возможность получать соответствующее количессво работы. Но, затрачивая работу, можно осуществить и обратную реакцию — разложения воды на водород и кислород, — например, путем электролиза. И другие химические реакции, которые по своим термодинамическим параметрам не могут в данных условиях совершаться самопроизвольно, можно проводить, затрачивая работу извне. Большей частью это осуществляют или путем электролиза, или при электрическом разряде в газах, или действием света, или же путем повышения давления (причем одновременно изменяются и условия проведения реакции). Из хорошо известных процессов такого рода можно назвать фотосинтез в растениях, получение натрия и хлора путем электролиза расплавленного хлористого натрия, получение металлического алюминия из бокситов путем электролиза, синтез аммиака при высоком давлении и др.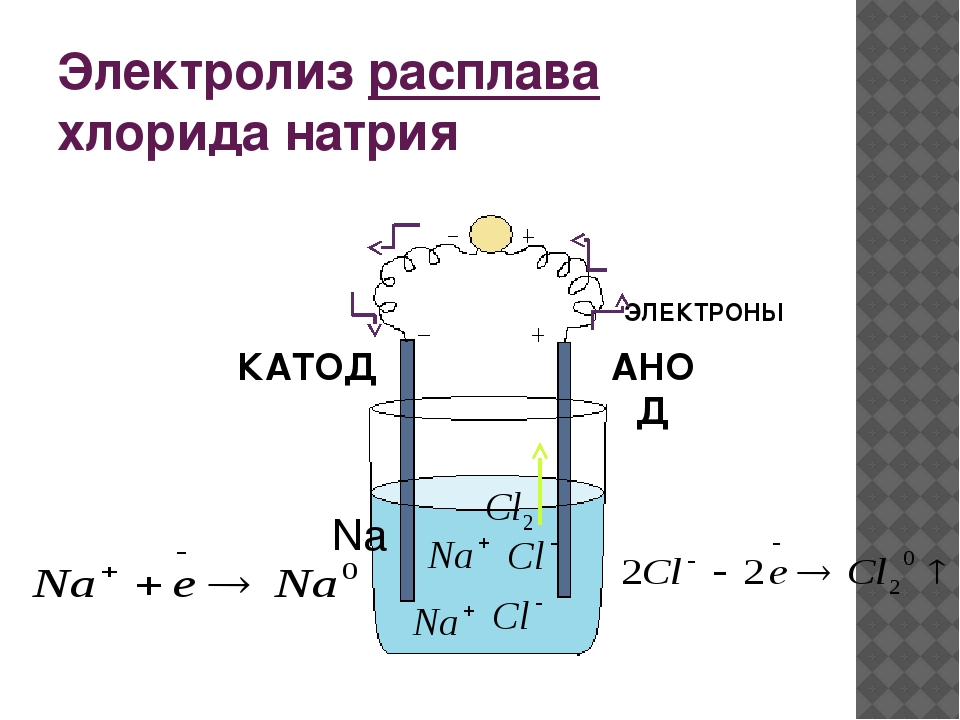 [c.209]
[c.209]
По направлению взаимного превращения электрической и химической форм энергии различают две группы электрохимических си- стем. При электролизе за счет внешней электрической энергии возникают химические реакции. Переход энергии химического процесса в электрическ.ую осуществляется в химических источниках тока (галь-ванические элементы, аккумуляторы). [c.454]
Электролиз щироко применяется при промышленном получении fнoгиx металлов (К, N3, Са, Mg, А1). В промьшшенных электролизерах под воздействием подводимого электрического тока на одном из электродов выделяются газовые образования. В результате электролитической диссоциации молекул на электродах происходит рост газовых пузырьков, которые изолируют часть поверхности элеюрода. Это приводит к перераспределению потенциала на электроде и изменяет скорость протекания химической реакции. Вследствие этого происходит увеличение разности потенциалов, что ведет к повьппению энергозатрат. Для эффективного управления производством необходим учет влияния пузырьков на распределение электрического поля. Математическое моделирование позволяет провести расчет и анализ электрического поля [1]. [c.118]
Математическое моделирование позволяет провести расчет и анализ электрического поля [1]. [c.118]
Пример 7 [30, с. 604—606]. Рассчитать количество теплоты, выделившееся при электрохимическом получении цинка, прн следующих исходных данных. Электролиз идет при силе тока 10000 А и напряжении 3,4 В. Выход по току для цинка т)=80%, концентрация h3SO4 в вытекающем отработанном электролите 80 г/л, концентрация цинка в протекающем свежем электролите 118 г/л. Суммарная химическая реакция процесса разложения ZnS04 следующая [c.229]
Во втором случае независимо от того, участвует ли определяемое вещество в электрохимической реакции или нет, из специально введенного электроактивного вещества (вспомогательный реагег т) электролитически получают кулонометрический титрант (промежуточный реагент), способный количественно вступать в химическую реакцию с определяемым компонентом. Зная количество электричества, израсходованное в процессе электролиза, можно рассчитать массу определяемого компонента.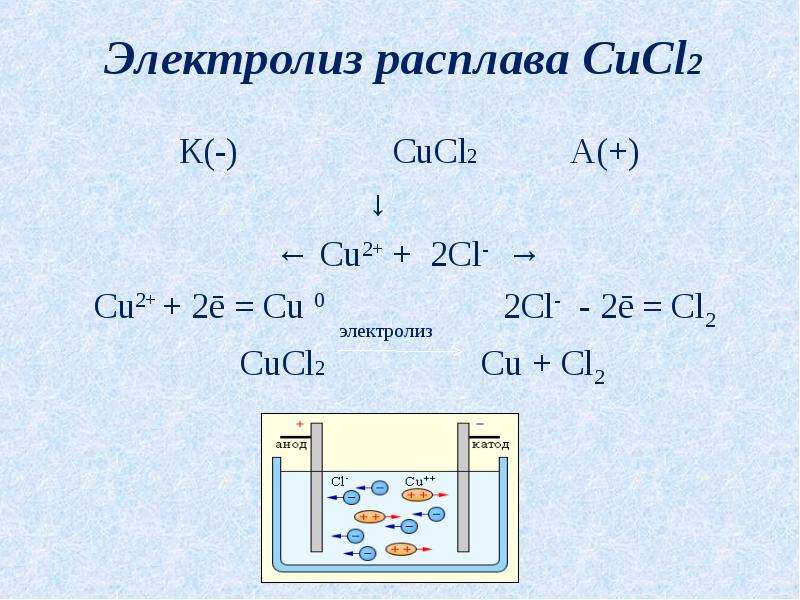 [c.144]
[c.144]
Роль вторичных химических реакций исключительно велика в условиях, благоприятствующих их протеканию, выход по току h3S2O8 приближается к нулю. Поэтому факторы, тормозящие скорость гидролиза целевого продукта, существенно повышают выход по току ионов персульфата. Такими факторами являются температура электролита, продолжительность электролиза и концентрация гидролизующегося вещества. [c.185]
Реакция (460) протекает самопроизвольно, что соответствует понижению свободной энтальпии. При протекании электродных реакций (461) и (462) между электродами измеряется разность потенциалов е. При этом потенциал водородного электрода оказывается отрицательнее хлорного. Пр1и образовании 1 моля соляной кислоты ток совершает работу Рг, где F — число Фарадея, равное количеству электричества, необходимому для выделения при электролизе 1 г-экв. вещества (/ = 96491 А-с/г-экв.). Если в реакции принимает участие п электронов, то суммарная работа равна пР , например, для реакции (460) 2Ръ. В том случае, если процесс проводится обратимо (при бесконечно малом токе), работа системы равна изменению свободной энтальпии химической реакции. Согласно первому закону термодинамики, [c.310]
В том случае, если процесс проводится обратимо (при бесконечно малом токе), работа системы равна изменению свободной энтальпии химической реакции. Согласно первому закону термодинамики, [c.310]
11 класс. Химия. Электролиз – Электролиз
Комментарии преподавателяПонятие электролиза
Электролиз – это окислительно-восстановительная реакция, которая протекает под действием электрического тока на электродах, погруженных в раствор или расплав электролита.
Существует два типа электродов.
Анод – это электрод, на котором происходит окисление.
Катод – это электрод, на котором происходит восстановление. К аноду стремятся анионы, так как он имеет положительный заряд. К катоду стремятся катионы, потому что он заряжен отрицательно и, согласно законам физики, разноименные заряды притягиваются. В любом электрохимическом процессе присутствуют оба электрода. Прибор, в котором осуществляется электролиз, называется электролизер. Рис. 1.
Прибор, в котором осуществляется электролиз, называется электролизер. Рис. 1.
Рис. 1
Электролиз расплава
I. Процессы, происходящие при электролизе расплавов электролитов
В расплавах электролиты диссоциируют на ионы. Это термическая диссоциация электролитов. При пропускании электрического тока катионы восстанавливаются на катоде, так как принимают от него электроны. Анионы кислотного остатка и гидроксид-анионы окисляются на катоде, так как отдают ему свои электроны.
Пример №1. Электролиз расплава хлорида натрия
При термической диссоциации хлорида натрия образуются ионы натрия и хлора.
Na Cl → Na+ + Cl−
– на катоде выделяется натрий:
2 Na+ + 2 e− → 2 Na
– на аноде выделяется хлор:
2 Cl− − 2 e− → Cl2
– суммарное ионное уравнение реакции (уравнение катодного процесса помножили на 2)
2 Na+ + 2 Cl− → 2 Na0 + Cl02
– суммарная реакция:
2 NaCl 2 Na + Cl2
Пример №2. Электролиз расплава гидроксида калия
Электролиз расплава гидроксида калия
При диссоциации гидроксида калия образуются ионы калия и гидроксид ионы.
КОН → К+ + ОН−
– на катоде выделяется калий:
К+ + 1 e− → К
– на аноде выделяется кислород и вода:
4ОН− − 4 e− → О2 + 2Н2О
– суммарное ионное уравнение реакции (уравнение катодного процесса помножили на 4)
4К+ + 4ОН− → 4 К0 + О2 + 2Н2О
– суммарная реакция:
4КОН 4 К0 + О2 + 2Н2О
Пример №3. Электролиз расплава сульфата натрия
При диссоциации расплава сульфата натрия образуются ионы натрия и сульфат-ионы.
Na2SO4 → 2Na+ + SО42−
– на катоде выделяется натрий:
Na+ + 1 e− → Na
– на аноде выделяется кислород и оксид серы (VI):
2SО42− − 4 e− → 2SО3 +О2
– суммарное ионное уравнение реакции (уравнение катодного процесса помножили на 4)
4 Na+ + 2SО42− → 4 Na 0 + 2SО3 +О2
– суммарная реакция:
4 Na2SO44 Na 0 + 2SО3 +О2
Закономерности электролиза расплавов электролита
1. При электролизе расплавов щелочей и солей на катоде осаждается металл.
При электролизе расплавов щелочей и солей на катоде осаждается металл.
2. Анионы бескислородных кислот окисляются на аноде, давая соответствующее соединение, например, хлорид-анионы образуют хлор.
3. Анионы кислородсодержащих кислот образуют соответствующий оксид и кислород.
Электролиз раствора
II. Процессы, происходящие при электролизе растворов электролитов
При электролизе растворов электролитов, кроме интересующих нас соединений есть еще и вода, которая также может подвергаться электролизу. Поэтому, исходя из строения соединения, электролиз может протекать либо с ионами соли, либо с водой.
Процессы, происходящие на катоде
1. Катионы активных металлов, стоящие в ряду напряжений до алюминия, не разряжаются на катоде. См. рис. 2. В этом случае происходит только восстановление воды.
Рис. 2
2Н2О+2 e− → Н2 + 2ОН−
2. Катионы металлов, расположенных в ряду напряжений от алюминия до водорода, разряжаются в той или иной степени одновременно с молекулами воды. При этом одновременно происходят следующие процессы:
При этом одновременно происходят следующие процессы:
Men++ne- → Me
2Н2О+2 e− → Н2 + 2ОН−
3. При наличии в растворе катионов металлов, расположенных в ряду напряжений после водорода, на катоде, прежде всего, происходит восстановление катионов этих металлов. Men++ne- →Me
Процессы, происходящие на аноде
Различают два типа анодов: инертный и активный. Инертный анод – это анод, материал которого не окисляется в процессе электролиза (Pt). Активный анод – это анод, который окисляется в процессе электролиза. Например, графит.
Электролиз с инертным анодом
В анодном процессе могут принимать участие анионы некоторых бескислородных кислот Cl- ,Br- ,I-, S2-и гидроксид-ионы ОН -( разряжаются только эти анионы), например:
2Br- – 2е- →Br2; 4ОН− − 4 e− → О2 +2Н2О (в щелочной среде)
Если в растворе присутствуют анионы F-,SO2-4, NO-3, PO43-, CO32- и некоторые другие, то окислению подвергается только вода:
2Н2О – 4 e− → О2 + 4Н+(в нейтральной и кислой среде)
Электролиз с активным анодом
В случае с активным анодом, число конкурирующих окислительных процессов увеличивается до трех:
– Электрохимическое окисление материала анода
– Окисление воды с выделением кислорода
– Окисление анионов растворенного соединения
Написание таких процессов рассматривается в высшей школе.
Примеры написания уравнений электролиза
Приведем примеры электролиза раствора некоторых веществ.
Пример №1. Электролиз раствора хлорида натрия
При диссоциации хлорида натрия образуются ионы натрия и хлора.
Na Cl → Na+ + Cl−
– Катодный процесс:
2Н2О+2 e− → Н2 + 2ОН−
– Анодный процесс:
2 Cl− − 2 e− → Cl2
– суммарное ионное уравнение реакции
2Н2О + 2 Cl− → Н2 + 2ОН−+ Cl02
– суммарная реакция:
2Н2О +2 NaCl 2NaОН + Cl2↑ + Н2↑
По этой реакции получается гидроксид натрия и хлор.
Пример №2. Электролиз раствора сульфата меди (II).
– на катоде выделяется медь:
Сu2+ + 2 e− → Cu0
– на аноде выделяется кислород
2Н2О – 4 e− → О2 + 4Н+
– суммарное ионное уравнение реакции (уравнение катодного процесса помножили на 2)
2Сu2+ + 2Н2О → 2 Cu0+ О2 + 4Н+
– суммарная реакция:
2CuSO4 + 2Н2О 2Cu 0+О2+ 2h3SO4
Пример №3.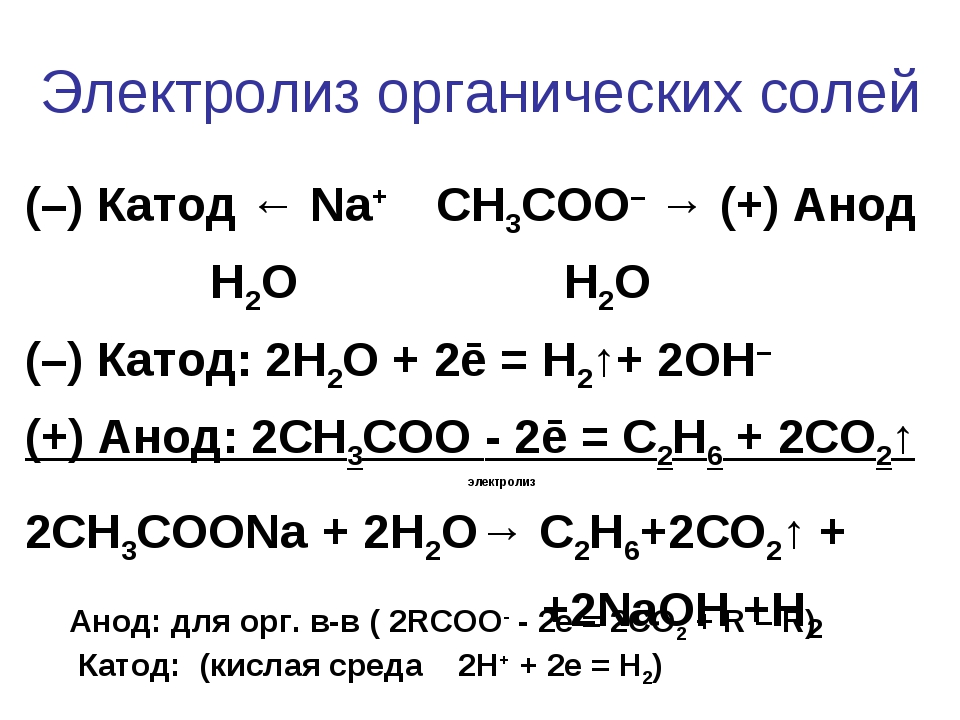 Электролиз раствора нитрата калия
Электролиз раствора нитрата калия
При диссоциации нитрата калия образуются ионы калия и нитрат-ионы.
КNO3 → К+ + NО3−
– Катодный процесс:
2Н2О+2 e− → Н2 + 2ОН−
– Анодный процесс:
2Н2О – 4 e− → О2 + 4Н+
– суммарное ионное уравнение реакции (уравнение катодного процесса помножили на 2)
2Н2О О2 ↑+2Н2↑
Это один из способов получения водорода.
Электролиз находит применение во многих отраслях промышленности: химической, металлургии, для изготовления деталей требуемой формы, для электрохимического покрытия металлов.
Источники
конспект http://interneturok.ru/ru/school/chemistry/11-klass
источник презентации – http://ppt4web.ru/khimija/ehlektroliz5.html
заставка http://www.youtube.com/watch?t=63&v=EVEIC4Z6xuQ
Электролиз воды в промышленных генераторах водорода
Электролиз
это окислительно-восстановительная реакция, которая протекает только под действием электричества. В промышленных генераторах водорода для получения водорода и кислорода проводят электролиз воды. Для протекания реакции необходимо поместить в электролит два электрода, подключенных к источнику питания постоянного тока:
В промышленных генераторах водорода для получения водорода и кислорода проводят электролиз воды. Для протекания реакции необходимо поместить в электролит два электрода, подключенных к источнику питания постоянного тока:- Анод – электрод к которому подключен положительный проводник;
- Катод – электрод к которому подключен отрицательный проводник.
Электролиз воды
Под действием электрического тока вода разделяется на составляющие ее молекулы: водород и кислород. Отрицательно заряженный катод притягивает катионы водорода а положительно заряженный анод – анионы ОН–.Деминерализованная вода, используемая в промышленных электролизных установках сама по себе является слабым электролитом, поэтому в нее добавляют сильные электролиты для увеличения проводимости электрического тока. Зачастую выбирают электролиты с меньшим катионным потенциалом, чтобы исключить конкуренцию с катионами водорода : KOH или NaOH. Электрохимическая реакция протекающая на электродах выглядит следующим образом:
Электрохимическая реакция протекающая на электродах выглядит следующим образом:
- Реакция на аноде: 2H2O → O2 + 4H+ + 4e− – выделение кислорода;
- Реакция на катоде: 2H2O + 2e− → H2 + 2OH− – выделение водорода.
Далее, чтобы получить чистый водород и кислород, требуется разделить газы образующиеся на электродах, и для этого применяют разделительные ионно-обменные мембраны (см. рисунок). Количество получаемого водорода в два раза больше получаемого кислорода и поэтому давление в водородной полости поднимается в два раза быстрее. Для уравнивания давления в полостях применяют уравнивающую давление мембрану на выходе из электролизера, которая предотвращает передавливание водорода в полость кислорода через каналы предназначенные для циркуляции электролита.
Данный метод является наиболее применяемым методом в промышленности и позволяет получать газообразный водород с КПД от 50 до 70% производительностью до 500 м3/час при удельных энергозатратах 4,5-5,5 Н2м3/кВт-ч.
ЭЛЕКТРОЛИЗ НА ТПЭ
В настоящий момент к наиболее эффективным методом разделения можно отнести электролиз с применением твердо-полимерных электролитов на основе перфторированной ионно обменной мембраны.
Данный тип электролизеров позволяет получать водород с КПД до 90% и является наиболее экологичным. Электролизеры с ТПЭ дороже щелочных в 6-7 раз и поэтому пока не получили свое распространение в промышленности.
Электролиз – Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Электролитическая ячейка против гальванической ячейки
- Участники и атрибуты
Использование электрического тока для стимуляции неспонтанной реакции. Электролиз может использоваться для разделения вещества на его исходные компоненты / элементы, и именно в этом процессе был обнаружен ряд элементов, которые до сих пор производятся в современной промышленности. В электролизе – электрический ток, направляемый через электролит в раствор, чтобы стимулировать поток ионов, необходимый для протекания в противном случае несамопроизвольной реакции. Процессы, включающие электролиз, включают: электрорафинирование , электросинтез и хлорщелочной процесс .
Электролиз может использоваться для разделения вещества на его исходные компоненты / элементы, и именно в этом процессе был обнаружен ряд элементов, которые до сих пор производятся в современной промышленности. В электролизе – электрический ток, направляемый через электролит в раствор, чтобы стимулировать поток ионов, необходимый для протекания в противном случае несамопроизвольной реакции. Процессы, включающие электролиз, включают: электрорафинирование , электросинтез и хлорщелочной процесс .
Электролитическая ячейка и гальваническая ячейка
Пример: когда мы электролизуем воду, пропуская через нее электрический ток, мы можем разделить ее на водород и кислород.
\ [2 H_2O (l) \ rightarrow 2H_2 (g) + O_2 (g) \]
Дополнительная информация: Электролиз воды
Электролитическая ячейка – это, по сути, гальваническая ячейка несамопроизвольной реакции (фактически, если мы изменили поток электричества в гальванической ячейке, превысив необходимое напряжение, мы создали бы электролитическую ячейку). Электролитические ячейки состоят из двух электродов (один действует как катод, а второй – как анод) и электролита. В отличие от гальванического элемента, реакции с использованием электролитических ячеек должны быть электрически индуцированы, а его анод и катод меняются местами (анод слева, катод справа).
Электролитические ячейки состоят из двух электродов (один действует как катод, а второй – как анод) и электролита. В отличие от гальванического элемента, реакции с использованием электролитических ячеек должны быть электрически индуцированы, а его анод и катод меняются местами (анод слева, катод справа).
| Гальванический | Электролитический |
| Окисление: X → X + + e – (отрицательный анод) | Y → Y + + e – (положительный анод ) |
| Редукция: Y + + e – → Y (положительный катод) | X + + e – → X (отрицательный катод) |
| В целом: X + Y + → X + + Y (G <0) | X + + Y → X + Y + (G> 0) |
| Эта реакция является спонтанной и высвободит энергию | Это реакция неспонтанная и будет поглощать энергию |
Соавторы и авторство
Электролиз | Безграничная химия
Прогнозирование продуктов электролиза
Электролиз – это способ разделения соединения путем пропускания через него электрического тока; продукты представляют собой ионы компонентов соединения.
Цели обучения
Предсказать продукты реакции электролиза
Основные выводы
Ключевые моменты
- Основными компонентами электролитической ячейки являются электролит, постоянный ток и два электрода.
- Ключевым процессом электролиза является обмен атомами и ионами путем удаления или добавления электронов во внешнюю цепь.
- Окисление ионов или нейтральных молекул происходит на аноде, а восстановление ионов или нейтральных молекул происходит на катоде.
Ключевые термины
- электролит : Вещество, которое в растворе или расплавленном состоянии ионизирует и проводит электричество.
- электролиз : химическое изменение, возникающее при пропускании электрического тока через проводящий раствор или расплав соли.
Что такое электролиз?
Чтобы предсказать продукты электролиза, нам сначала нужно понять, что такое электролиз и как он работает. Электролиз – это метод разделения связанных элементов и соединений путем пропускания через них электрического тока.Он использует постоянный электрический ток (DC) для запуска не спонтанной химической реакции. Электролиз очень важен с коммерческой точки зрения как стадия отделения элементов из природных источников, таких как руды, с использованием электролитической ячейки.
Электролиз – это метод разделения связанных элементов и соединений путем пропускания через них электрического тока.Он использует постоянный электрический ток (DC) для запуска не спонтанной химической реакции. Электролиз очень важен с коммерческой точки зрения как стадия отделения элементов из природных источников, таких как руды, с использованием электролитической ячейки.
Основные компоненты, необходимые для проведения электролиза:
- Электролит: вещество, содержащее свободные ионы, которые являются переносчиками электрического тока в электролите. Если ионы неподвижны, как в твердой соли, то электролиза не может быть.
- Источник постоянного тока (DC): обеспечивает энергию, необходимую для создания или разряда ионов в электролите. Электрический ток переносится электронами во внешней цепи.
- Два электрода: электрический проводник, который обеспечивает физический интерфейс между электрической цепью, обеспечивающей энергию, и электролитом.
Обмен атомами и ионами
Ключевой процесс электролиза – это обмен атомами и ионами путем удаления или добавления электронов во внешнюю цепь. Необходимые продукты электролиза находятся в физическом состоянии, отличном от состояния электролита, и могут быть удалены с помощью некоторых физических процессов.
Необходимые продукты электролиза находятся в физическом состоянии, отличном от состояния электролита, и могут быть удалены с помощью некоторых физических процессов.
Каждый электрод притягивает ионы с противоположным зарядом. Положительно заряженные ионы или катионы движутся к катоду, обеспечивающему электроны, который является отрицательным; отрицательно заряженные ионы или анионы движутся к положительному аноду. Вы могли заметить, что это противоположность гальванического элемента, где анод отрицательный, а катод положительный.
На электродах электроны поглощаются или высвобождаются атомами и ионами. Те атомы, которые приобретают или теряют электроны, становятся заряженными ионами, которые переходят в электролит . Те ионы, которые приобретают или теряют электроны, чтобы стать незаряженными атомами , отделяются от электролита. Образование незаряженных атомов из ионов называется разрядкой. Энергия, необходимая для миграции ионов к электродам, и энергия, вызывающая изменение ионного состояния, обеспечивается внешним источником. {4 -} _ 6 [/ латекс]
{4 -} _ 6 [/ латекс]
Нейтральные молекулы также могут реагировать на любом электроде. Реакции электролиза с участием ионов H + довольно распространены в кислых растворах. В щелочных водных растворах обычны реакции с участием гидроксид-ионов (OH – ). Окисленные или восстановленные вещества также могут быть растворителем, которым обычно является вода, или электродами. Возможен электролиз с участием газов.
Прогнозирование продуктов электролиза
Давайте посмотрим, как прогнозировать продукты.Например, на какие два иона распадется CuSO 4 ? Ответ: Cu 2+ и SO 4 2-. Давайте более внимательно посмотрим на эту реакцию.
Электролиз сульфата меди : два медных электрода помещают в раствор синего сульфата меди и подключают к источнику электрического тока. Ток включен на некоторое время.
Берем два медных электрода и помещаем их в раствор синего сульфата меди (CuSO 4 ) и включаем ток. – [/ латекс]
– [/ латекс]
Мы только что видели, как электрический ток расщепляет CuSO 4 на составляющие ионы. Это все, что нужно для прогнозирования продуктов электролиза; все, что вам нужно сделать, это разбить соединение на составляющие ионы.
Электролиз хлорида натрия
Два обычно используемых метода электролиза включают расплав хлорида натрия и водный раствор хлорида натрия, которые дают разные продукты.
Цели обучения
Предсказать продукты электролиза хлорида натрия в расплавленных и водных условиях
Основные выводы
Ключевые моменты
- Металлический натрий и газообразный хлор могут быть получены электролизом расплавленного хлорида натрия.
- Электролиз водного раствора хлорида натрия дает водород и хлор, при этом водный гидроксид натрия остается в растворе.
- Причина различия в том, что восстановление Na + (E ° = –2,7 v) энергетически сложнее, чем восстановление воды (–1,23 v).

Ключевые термины
- анод : Электрод электрохимической ячейки, на которой происходит окисление.
- катод : Электрод электрохимической ячейки, на котором происходит восстановление.
Электролиз NaCl
Как мы уже говорили, электролиз – это прохождение постоянного электрического тока через ионное вещество, которое либо расплавлено, либо растворено в подходящем растворителе. Это приводит к химическим реакциям на электродах и разделению материалов. Два обычно используемых метода электролиза включают расплав хлорида натрия и водный раствор хлорида натрия. Вы можете подумать, что оба метода дадут вам одинаковые продукты, но это не так. Давайте рассмотрим каждый из методов, чтобы понять различные процессы.
Электролиз расплавленного NaCl
Если хлорид натрия расплавляется (выше 801 ° C), два электрода вставляются в расплав и через расплав соли пропускается электрический ток, после чего на электродах происходят химические реакции.
Электролизная ячейка для расплавленного хлорида натрия : Промышленная электролизная ячейка для производства металлического натрия и газообразного хлора из расплавленного NaCl. Жидкий натрий всплывает в верхнюю часть расплава над катодом и сливается в резервуар для хранения.{-} [/ латекс]
Общая реакция – это разложение хлорида натрия на элементы:
[латекс] 2 \ text {NaCl} \ rightarrow 2 \ text {Na} (\ text {s}) + {\ text {Cl}} _ {2} (\ text {g}) [/ latex]
Электролиз водного NaCl
Что происходит, когда у нас есть водный раствор хлорида натрия? Что ж, мы не можем забыть, что мы должны учитывать воду в уравнении. Поскольку вода может как окисляться, так и восстанавливаться, она конкурирует с растворенными ионами Na + и Cl – .Вместо производства натрия производится водород.
Электролиз водного раствора хлорида натрия : Электролиз водного раствора NaCl приводит к образованию водорода и хлорида. На аноде (A) хлорид (Cl-) окисляется до хлора. Ионоселективная мембрана (B) позволяет противоиону Na + свободно проходить через нее, но предотвращает диффузию анионов, таких как гидроксид (OH-) и хлорид. На катоде (C) вода восстанавливается до гидроксида и газообразного водорода. Чистый процесс представляет собой электролиз водного раствора NaCl на промышленно полезные продукты – гидроксид натрия (NaOH) и газообразный хлор.{-} (\ text {aq}) + {\ text {H}} _ {2} (\ text {g}) + \ frac {1} {2} {\ text {Cl}} _ {2} ( \ text {g}) [/ latex]
На аноде (A) хлорид (Cl-) окисляется до хлора. Ионоселективная мембрана (B) позволяет противоиону Na + свободно проходить через нее, но предотвращает диффузию анионов, таких как гидроксид (OH-) и хлорид. На катоде (C) вода восстанавливается до гидроксида и газообразного водорода. Чистый процесс представляет собой электролиз водного раствора NaCl на промышленно полезные продукты – гидроксид натрия (NaOH) и газообразный хлор.{-} (\ text {aq}) + {\ text {H}} _ {2} (\ text {g}) + \ frac {1} {2} {\ text {Cl}} _ {2} ( \ text {g}) [/ latex]
Восстановление Na + (E ° = –2,7 об.) Энергетически сложнее, чем восстановление воды (–1,23 об.), Поэтому в водном растворе будет преобладать последнее.
Вывести продукты электролиза расплава соли. : Электролиз расплава соли дает элементы из соли. Итак, электролиз WCl4 дает W и Cl2. Ионы металлов получают электроны на отрицательном электроде, а неметаллы теряют их на положительном электроде.
Электролиз воды
Чистая вода не может подвергаться значительному электролизу без электролита, такого как кислота или основание.
Цели обучения
Вспомните свойства электролита, которые позволяют проводить электролиз воды
Основные выводы
Ключевые моменты
- Электролиз раствора серной кислоты или соли, такой как NaNO 3 , приводит к разложению воды на обоих электродах.
- На катоде появится водород, а на аноде появится кислород.
- Количество образующегося водорода в два раза больше количества молей кислорода, и оба они пропорциональны общему электрическому заряду, проводимому раствором.
Ключевые термины
- электролиз : химическое изменение, возникающее при пропускании электрического тока через проводящий раствор или расплав соли.

Чистая вода не может подвергаться значительному электролизу без добавления электролита.{-} [/ латекс]
E ° = -1,23 В
Умножение катодной реакции на 2, чтобы соответствовать количеству перенесенных электронов, дает это чистое уравнение после объединения ионов OH – и H + с образованием воды:
Сеть: [латекс] 2 {\ text {H}} _ {2} \ text {O} (\ text {l}) \ rightarrow 2 {\ text {H}} _ {2} (\ text {g} ) + {\ text {O}} _ {2} (\ text {g}) [/ latex]
E = -1,23 v
Водород появится на катоде, отрицательно заряженном электроде, где электроны входят в воду, и кислород появится на аноде, положительно заряженном электроде.Количество образовавшихся молей водорода в два раза больше количества молей кислорода, и оба они пропорциональны общему электрическому заряду, проводимому раствором. Количество электронов, проталкиваемых через воду, вдвое превышает количество образованных молекул водорода и в четыре раза больше количества образованных молекул кислорода.
Иоганн Риттер, который изобрел первый электрохимический элемент, был одним из первых, кто открыл разложение воды электричеством.
Электролиз воды : Устройство, изобретенное Иоганном Вильгельмом Риттером для разработки электролиза воды.
Стехиометрия электролиза
Количество химического изменения, которое происходит при электролизе, стехиометрически связано с количеством электронов, проходящих через элемент.
Цели обучения
Предсказать, сколько кулонов потребуется для данной электрохимической реакции.
Основные выводы
Ключевые моменты
- С точки зрения источника напряжения и цепи за пределами электродов, поток электронов обычно описывается в терминах электрического тока с использованием кулонов и ампер в единицах СИ.
- Требуется 96 485 кулонов, чтобы составить моль электронов, единицу, известную как фарадей (F).
- Эквивалентный вес вещества определяется как молярная масса, деленная на количество электронов, необходимых для окисления или восстановления каждой единицы вещества.

Ключевые термины
- кулонов : В Международной системе единиц – производная единица электрического заряда; количество электрического заряда, переносимого током в 1 ампер, протекающим в течение 1 секунды.Символ: C.
- Фарадей : количество электричества, необходимое для депонирования или высвобождения 1 грамма эквивалентного веса вещества во время электролиза; приблизительно 96 487 кулонов.
Стехиометрия электролитической ячейки
Степень химического изменения, происходящего в электролитической ячейке, стехиометрически зависит от количества молей электронов, проходящих через ячейку. С точки зрения источника напряжения и цепи вне электродов, поток электронов обычно описывается в терминах электрического тока с использованием единиц СИ – кулонов и ампер.Для образования моля электронов требуется 96 485 кулонов – единица, известная как фарадей (F).
Это соотношение было впервые сформулировано Майклом Фарадеем в 1832 году в форме двух законов электролиза:
- Вес веществ, образующихся на электроде во время электролиза, прямо пропорционален количеству электричества, которое проходит через электролит.

- Вес различных веществ, образованных в результате прохождения одного и того же количества электричества, пропорционален эквивалентному весу каждого вещества.- \ rightarrow \ text {V} [/ latex]).
Большинство стехиометрических задач, связанных с электролизом, могут быть решены без явного использования законов Фарадея. «Химия» в этих задачах обычно очень элементарна; основные трудности обычно возникают из-за незнания основных электрических устройств:
- ток (в амперах) – это скорость переноса заряда: 1 ампер = 1 [латекс] \ frac {\ text {Coulombs}} {\ text {second}} [/ latex]. Мощность
- (в ваттах) – это скорость производства или потребления энергии: 1 Вт = 1 [латекс] \ frac {\ text {Джоуль}} {\ text {second}} [/ latex].
- 1 киловатт-час = 3600 Дж.
Пример
Металлический предмет, покрываемый медью, помещают в раствор CuSO 4 . Какая масса меди выпадет, если через ячейку протекать ток 0,22 А в течение 1,5 часов?
Для решения задайте уравнение анализа размеров:
[латекс] 1,5 \ \ text {часы} \ times \ frac {3600 \ \ text {секунды}} {1 \ \ text {час}} \ times \ frac {.
 -} = 1184 \ \ text {Coulombs} [/ latex]
-} = 1184 \ \ text {Coulombs} [/ latex]1.5 часов эквивалентны 5400 секундам:
[латекс] \ frac {1184 \ \ text {Coulombs}} {5400 \ \ text {секунды}} = 0,22 \ \ text {Amps} [/ latex]
Прогнозирование продуктов электролиза
Цель обучения
- Предсказать продукты реакции электролиза
Ключевые моменты
- Основными компонентами электролитической ячейки являются электролит, постоянный ток и два электрода.
- Ключевым процессом электролиза является обмен атомами и ионами путем удаления или добавления электронов во внешнюю цепь.
- Окисление ионов или нейтральных молекул происходит на аноде, а восстановление ионов или нейтральных молекул происходит на катоде.
Условия
- электролиз: Химическое изменение, возникающее при пропускании электрического тока через проводящий раствор или расплав соли.
- электролит: Вещество, которое в растворе или расплавленном состоянии ионизирует и проводит электричество.

Что такое электролиз?
Чтобы предсказать продукты электролиза, нам сначала нужно понять, что такое электролиз и как он работает. Электролиз – это метод разделения связанных элементов и соединений путем пропускания через них электрического тока. Он использует постоянный электрический ток (DC) для запуска не спонтанной химической реакции. Электролиз очень важен с коммерческой точки зрения как стадия отделения элементов из природных источников, таких как руды, с использованием электролитической ячейки.
Основные компоненты, необходимые для проведения электролиза:
- Электролит: вещество, содержащее свободные ионы, которые являются переносчиками электрического тока в электролите. Если ионы неподвижны, как в твердой соли, то электролиза не может быть.
- Источник постоянного тока (DC): обеспечивает энергию, необходимую для создания или разряда ионов в электролите. Электрический ток переносится электронами во внешней цепи.
- Два электрода: электрический проводник, который обеспечивает физический интерфейс между электрической цепью, обеспечивающей энергию, и электролитом.

Обмен атомами и ионами
Ключевой процесс электролиза – это обмен атомами и ионами путем удаления или добавления электронов во внешнюю цепь. Необходимые продукты электролиза находятся в физическом состоянии, отличном от состояния электролита, и могут быть удалены с помощью некоторых физических процессов.
Каждый электрод притягивает ионы с противоположным зарядом. Положительно заряженные ионы или катионы движутся к катоду, обеспечивающему электроны, который является отрицательным; отрицательно заряженные ионы или анионы движутся к положительному аноду.Вы могли заметить, что это противоположность гальванического элемента, где анод отрицательный, а катод положительный.
На электродах электроны поглощаются или высвобождаются атомами и ионами. Те атомы, которые приобретают или теряют электроны, становятся заряженными ионами, которые переходят в электролит . Те ионы, которые приобретают или теряют электроны, чтобы стать незаряженными атомами , отделяются от электролита.
 Образование незаряженных атомов из ионов называется разрядкой. Энергия, необходимая для миграции ионов к электродам, и энергия, вызывающая изменение ионного состояния, обеспечивается внешним источником.{4 -} _ 6 [/ латекс]
Образование незаряженных атомов из ионов называется разрядкой. Энергия, необходимая для миграции ионов к электродам, и энергия, вызывающая изменение ионного состояния, обеспечивается внешним источником.{4 -} _ 6 [/ латекс]Нейтральные молекулы также могут реагировать на любом электроде. Реакции электролиза с участием ионов H + довольно распространены в кислых растворах. В щелочных водных растворах обычны реакции с участием гидроксид-ионов (OH – ). Окисленные или восстановленные вещества также могут быть растворителем, которым обычно является вода, или электродами. Возможен электролиз с участием газов.
Прогнозирование продуктов электролиза
Давайте посмотрим, как прогнозировать продукты.Например, на какие два иона распадется CuSO 4 ? Ответ: Cu 2+ и SO 4 2-. Давайте более внимательно посмотрим на эту реакцию.
Берем два медных электрода и помещаем их в раствор синего сульфата меди (CuSO 4 ) и включаем ток.
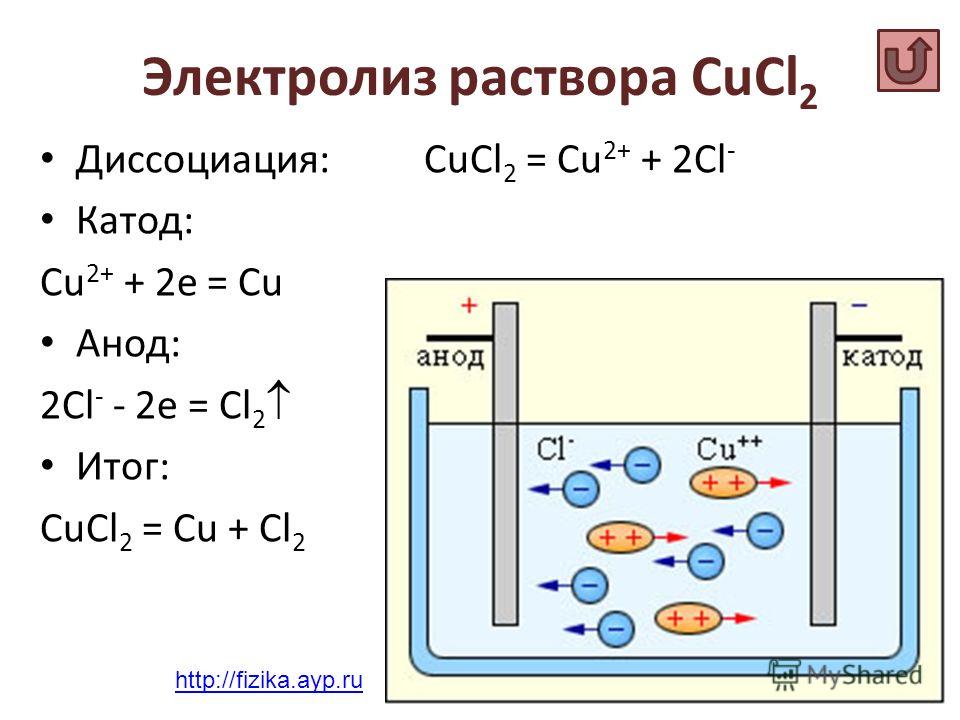 Мы замечаем, что первоначальный синий цвет раствора не изменился, но оказалось, что медь осаждалась на одном из электродов, но растворялась на другом.- [/ латекс]
Мы замечаем, что первоначальный синий цвет раствора не изменился, но оказалось, что медь осаждалась на одном из электродов, но растворялась на другом.- [/ латекс]Мы только что видели, как электрический ток расщепляет CuSO 4 на составляющие ионы. Это все, что нужно для прогнозирования продуктов электролиза; все, что вам нужно сделать, это разбить соединение на составляющие ионы.
Показать источникиBoundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета. В данном конкретном ресурсе использованы следующие источники:
Ячейки электролитические
электролитический Ячейки
Гальванические элементы используют спонтанную химическую реакцию, чтобы управлять электрический ток через внешнюю цепь.Эти клетки важны, потому что они являются основой для батарей, современное общество. Но это не единственный вид электрохимического ячейка. Также возможно построить ячейку, которая работает на химическую систему, пропуская электрический ток через система.
 Эти ячейки называются электролитическими ячейками .
Электролиз используется для запуска окислительно-восстановительной реакции в
направление, в котором это не происходит спонтанно.
Эти ячейки называются электролитическими ячейками .
Электролиз используется для запуска окислительно-восстановительной реакции в
направление, в котором это не происходит спонтанно.Электролиз Расплавленный NaCl
Идеализированная ячейка для электролиза хлорида натрия показано на рисунке ниже.Источником постоянного тока является подключен к паре инертных электродов, погруженных в расплавленный натрий хлористый. Поскольку соль нагревается до плавления, Na + ионы текут к отрицательному электроду, и Cl – ионы текут к положительному электроду.
Когда ионы Na + сталкиваются с отрицательным электродом, батарея имеет достаточно большой потенциал, чтобы заставить эти ионы собирать электроны с образованием металлического натрия.
Отрицательный электрод (катод) : Na + + e – Na Cl – ионы, которые сталкиваются с положительным электродом окисляются до газа Cl 2 , который при этом выделяется электрод.

Положительный электрод (анод) : 2 класса – Класс 2 + 2 e – Чистый эффект от прохождения электрического тока через расплав соли в этой ячейке должен разложить хлорид натрия на его элементы, металлический натрий и газообразный хлор.
Электролиз NaCl : Катод (-): Na + + e – Na Анод (+): 2 класса – Класс 2 + 2 e – Потенциал, необходимый для окисления ионов Cl – до Cl 2 равно -1.
 36 вольт и потенциал, необходимый для восстановления Na + ионов к металлическому натрию составляет -2,71 вольт. Аккумулятор, используемый для вождения
поэтому эта реакция должна иметь потенциал не менее 4,07
вольт.
36 вольт и потенциал, необходимый для восстановления Na + ионов к металлическому натрию составляет -2,71 вольт. Аккумулятор, используемый для вождения
поэтому эта реакция должна иметь потенциал не менее 4,07
вольт.Этот пример объясняет, почему процесс называется электролиз . Суффикс – лизис происходит от греческого корня, означающего ослабить или разделить. Электролиз буквально использует электрический current, чтобы разбить соединение на элементы.
электролиз 2 NaCl ( л ) 2 Na ( л ) + Cl 2 ( г ) Этот пример также иллюстрирует разницу между гальваническими ячейки и электролитические ячейки.Гальванические элементы используют данную энергию выключился в результате спонтанной реакции на выполнение электрических работ.
 Электролитический
клетки используют электрическую работу в качестве источника энергии, чтобы управлять
реакция в обратном направлении.
Электролитический
клетки используют электрическую работу в качестве источника энергии, чтобы управлять
реакция в обратном направлении.Пунктирная вертикальная линия в центре рисунка выше представляет собой диафрагму, удерживающую производимый газ Cl 2 на аноде от контакта с металлическим натрием генерируется на катоде. Функция этой диафрагмы может быть понять, обратившись к более реалистичному изображению Показана коммерческая ячейка Дауна, используемая для электролиза хлорида натрия на рисунке ниже.
Газообразный хлор, образующийся на графитовом аноде, вставленном в дно этой ячейки пузырится сквозь расплавленный натрий хлорид в воронку наверху ячейки. Натрий металлический, который формы на катоде всплывают через расплавленный хлорид натрия в натрий-улавливающее кольцо, из которого периодически осушен. Диафрагма, разделяющая два электрода, представляет собой экран из железной сетки, предотвращающий взрывную реакцию, произошло бы, если бы продукты реакции электролиза попали в контакт.

Сырье для ячейки Даунса представляет собой смесь 3: 2 по массе CaCl 2 и NaCl. Эта смесь используется, потому что она имеет температура плавления 580 o C, тогда как чистый хлорид натрия должен быть нагрет до температуры более 800 o C, прежде чем он расплавится.
Электролиз водного NaCl
На рисунке ниже показан идеализированный чертеж ячейки, в которой водный раствор хлорида натрия подвергается электролизу.
И снова ионы Na + мигрируют в сторону отрицательный электрод и ионы Cl – мигрируют в сторону положительный электрод. Но теперь есть два вещества, которые можно восстановленные на катоде: ионы Na + и молекулы воды.
Катод (-): Na + + e – Na E o красный = -2.  71 В
71 В2 H 2 O + 2 e – Н 2 + 2 ОН – E o красный = -0,83 В Потому что восстановить воду намного проще, чем Na + ионов, единственный продукт, образующийся на катоде, – газообразный водород.
Катод (-): 2 H 2 O ( l ) + 2 e – H 2 ( г ) + 2 OH – ( водн. ) Есть также два вещества, которые могут окисляться при анод: ионы Cl – и молекулы воды.
Анод (+): 2 класса – Класс 2 + 2 e – E o ox = -1,36 В 2 H 2 O O 2 + 4 H + + 4 e – E o вол = -1.  23 В
23 ВПотенциалы стандартного состояния для этих полуреакций таковы близко друг к другу, что мы можем ожидать увидеть смесь Cl 2 и O 2 газ собирают на аноде. На практике единственный Продукт этой реакции – Cl 2 .
Анод (+): 2 класса – Класс 2 + 2 e – На первый взгляд кажется, что окислить воду легче ( E o ox = -1.23 вольт), чем ионы Cl – ( E o ox = -1,36 вольт). Однако стоит отметить, что ячейка никогда не позволял достичь стандартных условий. Решение обычно 25% NaCl по массе, что значительно снижает потенциал, необходимый для окисления иона Cl – . PH ячейка также держится очень высоко, что снижает окисление потенциал для воды.
 Решающим фактором является явление, известное как перенапряжение , то есть дополнительное напряжение, которое должно быть
применяется к реакции, чтобы заставить ее происходить с той скоростью, с которой она
произошло бы в идеальной системе.
Решающим фактором является явление, известное как перенапряжение , то есть дополнительное напряжение, которое должно быть
применяется к реакции, чтобы заставить ее происходить с той скоростью, с которой она
произошло бы в идеальной системе.В идеальных условиях потенциал 1,23 В является большим достаточно, чтобы окислить воду до газа O 2 . Под реальным условиях, однако может потребоваться гораздо большее напряжение для инициировать эту реакцию. (Перенапряжение при окислении воды может достигать 1 В.) Тщательно выбирая электрод для максимального увеличения перенапряжения при окислении воды а затем тщательно контролируя потенциал, при котором ячейка работает, мы можем гарантировать, что в этом реакция.
Таким образом, электролиз водных растворов натрия хлорид не дает таких же продуктов, как электролиз расплава натрия хлорид. Электролиз расплавленного NaCl разлагает это составить его элементы.
электролиз 2 NaCl ( л ) 2 Na ( л ) + Cl 2 ( г ) Электролиз водных растворов NaCl дает смесь водород и газообразный хлор и водный гидроксид натрия решение.

электролиз 2 NaCl ( водн. ) + 2 H 2 O ( л ) 2 Na + ( водн. ) + 2 OH – ( водн. ) + H 2 ( г ) + Cl 2 ( г ) Потому что потребность в хлоре намного превышает потребность для натрия электролиз водного хлорида натрия является более важный процесс с коммерческой точки зрения.Электролиз водного NaCl Решение имеет два других преимущества. Производит газ H 2 . у катода, который можно собирать и продавать. Он также производит NaOH, который можно слить со дна электролитической сотовый и продан.
Пунктирная вертикальная линия на рисунке выше представляет диафрагма, предотвращающая образование Cl 2 на аноде в этой ячейке от контакта с NaOH, который накапливается на катоде.
 Когда эта диафрагма снимается с
ячейка, продукты электролиза водного натрия
хлорида реагируют с образованием гипохлорита натрия, который является первым
шаг в приготовлении гипохлоритных отбеливателей, таких как
Хлорокс.
Когда эта диафрагма снимается с
ячейка, продукты электролиза водного натрия
хлорида реагируют с образованием гипохлорита натрия, который является первым
шаг в приготовлении гипохлоритных отбеливателей, таких как
Хлорокс.Класс 2 ( г ) + 2 OH – ( водн. ) Cl – ( водн. ) + OCl – ( водн. ) + H 2 O ( l )
Электролиз воды
Стандартный аппарат для электролиза воды показан на рисунок ниже.
электролиз 2 H 2 O ( л ) 2 H 2 ( г ) + O 2 ( г) Пара инертных электродов запаяна на противоположных концах контейнер, предназначенный для сбора H 2 и O 2 газ выделяется в этой реакции.
 Затем электроды подключаются
к батарее или другому источнику электрического тока.
Затем электроды подключаются
к батарее или другому источнику электрического тока.Сама по себе вода является очень плохим проводником электричества. Мы поэтому добавьте в воду электролит, чтобы получить ионы, которые могут протекает через раствор, завершая тем самым электрическую цепь. Электролит должен быть растворим в воде. Следует также быть относительно недорогим. Самое главное, он должен содержать ионы которые сложнее окислить или восстановить, чем вода.
2 H 2 O + 2 e – Н 2 + 2 ОН – E o красный = -0.83 В 2 H 2 O O 2 + 4 H + + 4 e – E o ox = -1,23 В Следующие катионы восстановить труднее, чем вода: Li + , Rb + , K + , CS + , Ba 2+ , Sr 2+ , Ca 2+ , Na + и Mg 2+ .
 Два из этих катионов являются более вероятными кандидатами, чем другие
потому что они образуют недорогие растворимые соли: Na + и
К + .
Два из этих катионов являются более вероятными кандидатами, чем другие
потому что они образуют недорогие растворимые соли: Na + и
К + .Ион SO 4 2- может быть лучшим анионом для использовать, потому что это самый трудный для окисления анион. В потенциал окисления этого иона до пероксидисульфат-иона равен -2,05 вольт.
2 СО 4 2- S 2 O 8 2- + 2 e – E o вол = -2.05 В В водном растворе либо Na 2 SO 4 или K 2 SO 4 подвергается электролизу в аппарате как показано на рисунке выше, H 2 газ собирается в одном электрод и O 2 газ собирается на другом.
Что было бы, если бы мы добавили такой индикатор, как бромтимол синий к этому аппарату? Бромтимоловый синий желтеет в кислой среде.
 растворы (pH <6) и синий цвет в щелочных растворах (pH> 7.6).
Согласно уравнениям двух полуреакций
индикатор должен стать желтым на аноде и синим на
катод.
растворы (pH <6) и синий цвет в щелочных растворах (pH> 7.6).
Согласно уравнениям двух полуреакций
индикатор должен стать желтым на аноде и синим на
катод.Катод (-): 2 H 2 O + 2 e – Н 2 + 2 ОН – Анод (+): 2 H 2 O O 2 + 4 H + + 4 e – Закон Фарадея
Закон электролиза Фарадея можно сформулировать следующим образом. The количество вещества, потребляемого или производимого на одном из электродов в электролитической ячейке прямо пропорционально количество электричества, которое проходит через ячейку.
Чтобы использовать закон Фарадея, мы должны признать соотношение между током, временем и количеством электрического заряд, протекающий по цепи.
 По определению один кулон
заряда передается, когда в течение 1 секунды протекает ток 1 А.
По определению один кулон
заряда передается, когда в течение 1 секунды протекает ток 1 А.1 C = 1 ампер / с
Пример: Чтобы проиллюстрировать, как можно использовать закон Фарадея, давайте рассчитайте количество граммов металлического натрия, которое образуется при катод при 10.Через расплавленный натрия хлорид в течение 4.00 часов.
Начнем с расчета количества электрического заряда, который протекает через ячейку.
Прежде чем мы сможем использовать эту информацию, нам нужен мост между эта макроскопическая величина и явление, происходящее на атомный масштаб. Этот мост представлен постоянной Фарадея, который описывает количество кулонов заряда, которое несет моль электронов.
Таким образом, число молей электронов, перенесенных при 144000 кулонов электрического заряда, протекающего через ячейку, могут быть рассчитывается следующим образом.
Согласно сбалансированному уравнению реакции происходит на катоде этой ячейки, мы получаем один моль натрия за каждый моль электронов.

Катод (-): Na + + e – Na Таким образом, получаем 1.49 моль, или 34,3 грамма натрия в 4,00 часов.
Последствия этого расчета: интересно. Нам пришлось бы проводить этот электролиз более чем два дня, чтобы приготовить полкило натрия.
Мы можем расширить общую схему изложены в этом разделе, чтобы ответить на вопросы, которые могут показаться невозможно на первый взгляд.
ЭЛЕКТРОЛИЗ
Электролиз – это процесс, который происходит в электрохимической ячейке, когда электроны проходят от анода к катоду через внешнюю цепь, соединяющую электроды.Чтобы это произошло, должен существовать механизм переноса заряда в электролите между электродами. Этот перенос заряда происходит из-за движения ионов в электролите. Эти ионы, приближаясь к электродам, подвергаются электролизу и либо принимают электроны от катода, либо выпускают электроны на анод.
 Таким образом, химические изменения происходят на обоих электродах.
Таким образом, химические изменения происходят на обоих электродах.Степень химического изменения зависит от пройденного заряда в соответствии с законами электролиза Фарадея.Скорость химического изменения зависит от плотности тока j = I / S (Am −2 ) на электроде и определяется выражением;
(1)где n – число электронов в реакции электрода, а F – постоянная Фарадея . Скорость химического изменения и, следовательно, плотность тока определяется кинетикой электродной реакции (реакций).
В условиях электролиза ячейка работает вдали от своих равновесных (обратимых) потенциалов, определенных термодинамикой.Некоторые электродные реакции очень быстрые и очень мало отклоняются от равновесного потенциала. Такие реакции часто называют обратимыми (см. Рисунок 1). Другие электродные реакции по своей природе медленны и требуют потенциала E, значительно превышающего по величине равновесный потенциал для достижения разумной плотности тока. Этот потенциал называется перенапряжением , η (= E – E e ), а электрод называется поляризованным .
 Такие реакции называют необратимыми (рис. 2).По мере увеличения перенапряжения (более отрицательного для катодных процессов, более положительного для анодных) плотность тока увеличивается, как правило, экспоненциально при высоких перенапряжениях. Связь между плотностью тока и потенциалом электрода является предметом кинетики электрода.
Такие реакции называют необратимыми (рис. 2).По мере увеличения перенапряжения (более отрицательного для катодных процессов, более положительного для анодных) плотность тока увеличивается, как правило, экспоненциально при высоких перенапряжениях. Связь между плотностью тока и потенциалом электрода является предметом кинетики электрода.Рис. 1. Кривая потенциала тока на поляризованном электроде.
Рис. 2. Электролиз раствора NaCl с образованием хлора и гидроксида натрия. Другие примеры электролиза, или более конкретно «реакции полуэлементов», включают:
Простой перенос электрона, e.г., анодное окисление ионов Ce (TO)
Осаждение металла, например никелирование
Преобразование поверхностной пленки, например, в свинцово-кислотных аккумуляторах
Анодное растворение, например железа
Восстановление газа, например кислород в пористых газодиффузионных электродах, используемых в топливных элементах
На практике существует широкий спектр электрохимических элементов: батареи, в которых электроэнергия вырабатывается в результате электродных реакций, электролитические ячейки, в которых химическое изменение происходит за счет приложенного потенциала, и топливные элементы, в которых электрическая энергия непрерывно вырабатывается за счет подачи топливо.
(2) (3) (4) Электролиз может включать в себя различные типы процессов, включая реакции в жидкой фазе, реакции в твердой фазе, расположенной на поверхности электродов, и реакции с участием газовой фазы. Важным примером газофазных процессов является электролитическое образование газа, например,
Электролиз может включать в себя различные типы процессов, включая реакции в жидкой фазе, реакции в твердой фазе, расположенной на поверхности электродов, и реакции с участием газовой фазы. Важным примером газофазных процессов является электролитическое образование газа, например,Анодное производство хлора и катодное образование H 2 и, следовательно, гидроксид-иона, является основой для хлорщелочной промышленности , использующей электролит хлорида натрия.Для этого процесса анодная и катодная реакции в ячейках разделены диафрагмой или мембраной для предотвращения реакции газообразного хлора с гидроксидом (натрия). Этот метод разделения анодной и катодной реакций во время электролиза является обычным. Соответствующий сепаратор по необходимости должен обеспечивать транспортировку подходящих ионов через его структуру. При электролизе хлорида натрия для производства хлора сепаратор в идеале должен обеспечивать транспортировку одного иона натрия, как показано на рисунке 2, для образования гидроксида натрия с гидроксид-ионом, генерируемым на катоде (реакция 3).

Во всех ячейках электролиз включает реакции на обоих электродах, и общее движение ионов в растворах поддерживает нейтральность заряда электролита. Поэтому, как правило, процессы электролиза записываются как общие реакции двухэлектродных процессов, например, в хлорщелочном электролизе реакция
(5)представляет собой электролиз хлорида натрия в воде с образованием гидроксида натрия, газообразного хлора и водорода.
Для проведения электролиза требуется источник энергии для перемещения ионов в электролитах и преодоления перенапряжения на электродах.Эта энергия либо подается от внешнего источника энергии, как в электролитических процессах (например, перезарядка свинцово-кислотных аккумуляторов), либо получается из доступной «химической» или свободной энергии реакции (например, разрядки аккумуляторов). Он по существу превращается в тепло в электролите и напрямую связан с внутренним сопротивлением элемента R и приложенным током, то есть I 2 R (Джоуля с -1 ).

При электролизе эта потребность в энергии может быть уменьшена за счет факторов, снижающих внутреннее сопротивление (небольшое расстояние между электродами, высокая проводимость электролита) и снижающих перенапряжение, например.g., с использованием электрокатализаторов или альтернативных электродных материалов. Электрокатализаторы обеспечивают альтернативные пути реакции для изначально кинетической медленной стадии электродного процесса и позволяют проводить реакцию при более высоких плотностях тока, близких к равновесному потенциалу. Многие электролизы выиграли от использования электрокатализаторов. Например, в 1960-х годах в конструкции анодов хлорных элементов произошла революция в связи с использованием покрытых титановых электродов (так называемые стабильные аноды , или DSA) в качестве замены углерода.Покрытие на основе оксида рутения, вентильных металлов, драгоценных металлов и переходных металлов позволило значительно снизить перенапряжение (<50 мВ для образования хлора).
 Такие материалы широко используются для многих промышленных электролизов.
Такие материалы широко используются для многих промышленных электролизов.Карточки для электролиза | Quizlet
Используется для производства элементов из их соединений. При электролизе расплавленных солей катионы металлов перемещаются к катоду и восстанавливаются до металлов, а анионы неметаллов перемещаются к аноду и окисляются до неметаллов.Например …
Вода состоит из водорода и кислорода. Электролиз можно использовать для разделения воды на водород и кислород.
Вода плохо проводит электрический ток. Этого можно избежать, добавив небольшое количество электролита, например сульфата натрия. Это позволяет потоку заряда, необходимому для передачи электронов. Раствор внутри устройства подвергается электролизу, и газы собираются в камере над каждым инертным электродом.
Поскольку производятся кислород и водород, на поверхности электродов возникают пузырьки.
Обратите внимание, что два моля газообразного водорода производятся на каждый моль произведенного газообразного кислорода.
Вспомните теорию Авогадро. При одинаковых температуре и давлении каждый моль газа занимает один и тот же объем. Поскольку производится два моля газообразного водорода, водород будет занимать объем в два раза больше, чем газообразный кислород. Вы можете ясно видеть это на диаграмме выше.
Восстановление происходит на катоде:
2h3O (l) + 2e− → h3 (g) + 2OH− (aq)Окисление происходит на аноде:
2h3O (l) → O2 (g) + 4H + (aq) + 4e−Чистое уравнение реакции:
2h3O (l) → O2 (g) + 2h3 (g)—–
Большинство элементов встречаются в природе вместе с другими элементами в соединениях.Например, ионные соединения натрия, калия, лития, магния, кальция и алюминия в изобилии, но эти химически активные металлы не встречаются в природе без соединения.
Объяснение заключается в том, что потенциалы восстановления этих металлов очень отрицательны. Поэтому эти металлы легко окисляются практически всеми другими веществами. Даже вода имеет более положительный восстановительный потенциал, чем любой из этих ионов металлов.
 Если бы металлы действительно существовали естественным образом, спонтанная реакция преобразовала бы их в их ионы.
Если бы металлы действительно существовали естественным образом, спонтанная реакция преобразовала бы их в их ионы.Многие металлы можно получить электролизом без воды (поскольку вода является более сильным окислителем, чем многие активные катионы металлов). Ионные соединения можно плавить, и расплавленные ионные соединения являются хорошими электрическими проводниками, которые могут действовать как электролит в элементе.
Производство активных металлов (сильных восстановителей) из минералов обычно включает электролиз расплавленных соединений металла.
Например …
Хлорид стронция, где присутствуют Sr + 2 (l) и Cl- (l).
Катод:
Sr + 2 (l) + 2e- -> Sr (s)Анод:
2Cl- (l) -> Cl2 (g) + 2e-Который образует на катоде металлический стронций и хлор газ на аноде.
Электролиз воды
Электролиз водыВода может быть разложена при пропускании через нее электрического тока.
 Когда это
происходит, электроны от электрического тока вызывают реакцию окисления-восстановления.На одном электроде, называемом катодом, электроны переходят в раствор и вызывают
уменьшение. На другом электроде, называемом анодом, электроны покидают раствор.
замыкая цепь, и вызвать окисление.
Когда это
происходит, электроны от электрического тока вызывают реакцию окисления-восстановления.На одном электроде, называемом катодом, электроны переходят в раствор и вызывают
уменьшение. На другом электроде, называемом анодом, электроны покидают раствор.
замыкая цепь, и вызвать окисление.Для проведения электролиза раствор должен проводить электрический ток. Чистая вода – очень плохой проводник. Чтобы сделать вода лучше проводит, мы можем добавить в воду электролит. Это вводит еще один проблема хотя.Многие электролиты, которые мы добавляем, электролизуются легче, чем воды. Сульфат-ионы не подвергаются электролизу так же легко, как вода, поэтому сульфаты часто используется для повышения проводимости воды. На одном из электродов электроны (от источника тока, такого как батарея), добавляются к молекулам воды (поскольку электроны добавлены, это минус АКБ). Следующее сокращение происходит на катоде с образованием газообразного водорода.
2H 2 O + 2e – H 2 (г) + 2OH –
Восстановление = катод На другом электроде электроны удаляются из воды (так что это положительный полюс батареи) и введите электрод.
 Это завершает схему, поэтому
ток может течь. На этом электроде, называемом анодом, окисляется вода:
Это завершает схему, поэтому
ток может течь. На этом электроде, называемом анодом, окисляется вода:H 2 O 1 / 2O 2 (г) + 2H + + 2e – Окисление = анод Поскольку окисление не может происходить без восстановления, эти две реакции должно происходить одновременно. Если мы сложим их вместе и отменим аналогичные сроки, мы получим чистую общую реакцию.
2H 2 O + 2e – H 2 (г) + 2OH – H 2 O 1 / 2O 2 (г) + 2H + + 2e – 3H 2 O + 2e – H 2 + 1 / 2O 2 (г) + 2H 2 O + 2e – , что совпадает с
H 2 O H 2 + 1 / 2O 2 (г)
Материалы
Процедура
Электролиз воды
1.
 Подготовьте аппарат для электролиза, если он еще не настроен для вас.
Заточите оба конца карандаша. Присоедините провода зажима аккумулятора к заточенному
карандашный грифель. Если вы не используете зажимы из кожи аллигатора, снимите около 2 см конца
проволоку и оберните ею грифель карандаша. Приклейте эту проволоку изолентой или горячим клеем.
Подготовьте аппарат для электролиза, если он еще не настроен для вас.
Заточите оба конца карандаша. Присоедините провода зажима аккумулятора к заточенному
карандашный грифель. Если вы не используете зажимы из кожи аллигатора, снимите около 2 см конца
проволоку и оберните ею грифель карандаша. Приклейте эту проволоку изолентой или горячим клеем.2. Приготовьте раствор, насыщенный сульфатом натрия в деионизированной воде. Вам понадобится около 100 мл. В качестве альтернативы вы можете использовать раствор магния. сульфат.
3. Добавьте несколько капель кислотно-основного индикатора в раствор, который вы приготовили выше. Ваш раствор должен быть слегка окрашен. Выберите любой из индикаторов, которые удобный, хотя универсальный индикатор, бромкрезоловый зеленый или индикатор краснокочанной капусты подойдет дают наиболее очевидное изменение на для обоих электродов . Залейте этот раствор в чашку Петри
4. Положите свободный конец грифеля карандаша в чашку Петри, погруженную в воду, и примерно в 2 см друг от друга.

5. Установите аккумулятор и в течение нескольких минут наблюдайте за изменениями. Обратите внимание, какие конец положительный (красный провод) и отрицательный (черный провод), и что вы наблюдать.
Собрать газы, образующиеся в этом эксперименте, практически невозможно. В то время как кажется, что образуется много пузырей, на самом деле газа не так много произведено. Можно собрать газ в другом аппарате, который может использовать более высокие токи, чем описанный здесь.Пример этого показан в видео.
Заключение
Таблица цветов для различных кислотно-основные показатели. (Щелкните в любом месте изображения, чтобы скрыть его.)
1. Электроны перетекают из черного провода (отрицательного) в раствор. Что Вы наблюдать за изменением цвета отрицательного электрода? Сравните это с цветовой диаграммой кислотно-щелочного индикатора для индикатора.
 ты использовал.Объясните происходящую здесь полуреакцию
ты использовал.Объясните происходящую здесь полуреакцию2. Электроны перетекают из раствора в красный провод (положительный). Что вы наблюдаете изменение цвета на положительном электроде? Сравните это с цветовой диаграммой кислотно-щелочного индикатора для индикатора. ты использовал. Объясните происходящую там полуреакцию.
3. С помощью видео сравните объемы двух собранных газов. Какой вывод вы можете добраться?
Дополнительно
На самом деле для производства большого количества кислорода или водорода требуется довольно большой ток. газ.Например, сколько электрического тока потребуется для производства одного моля кислородный газ? Это масса 32 г, и при комнатной температуре и давлении занял бы около 24 литров.
Шаг 1: Из сбалансированного уравнения на аноде
H 2 O 1 / 2O 2 (г) + 2H + + 2e – Окисление = анод вы можете видеть, что для производства 1 моля газообразного кислорода требуется 4 моля электронов.
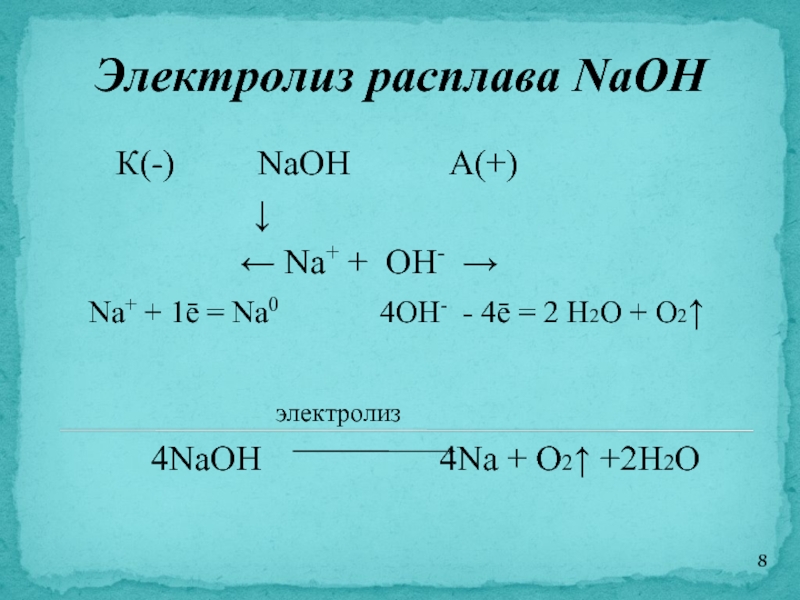
Шаг 2: Электрический ток обычно измеряется в амперах. Ток 1 ампер для 1 секунда – это один кулон (C) электронов. В моле примерно 95 500 ° C. электронов, поэтому наши 4 моля электронов составляют
4 x 96 500 = 386 000 C
Шаг 3: Поскольку кулон – это ампер в секунду (1 C / s = 1 ампер), мы не может пойти дальше, если мы не сделаем некоторые предположения о том, сколько времени это займет у нас чтобы сделать этот кислород.Предположим, что он будет займет у нас один час (3600 с). Тогда нам потребуется:
386,000 С
3600 с= 107 ампер Это довольно большой ток (учитывая, что обычная розетка дает максимум 15 ампер).
.


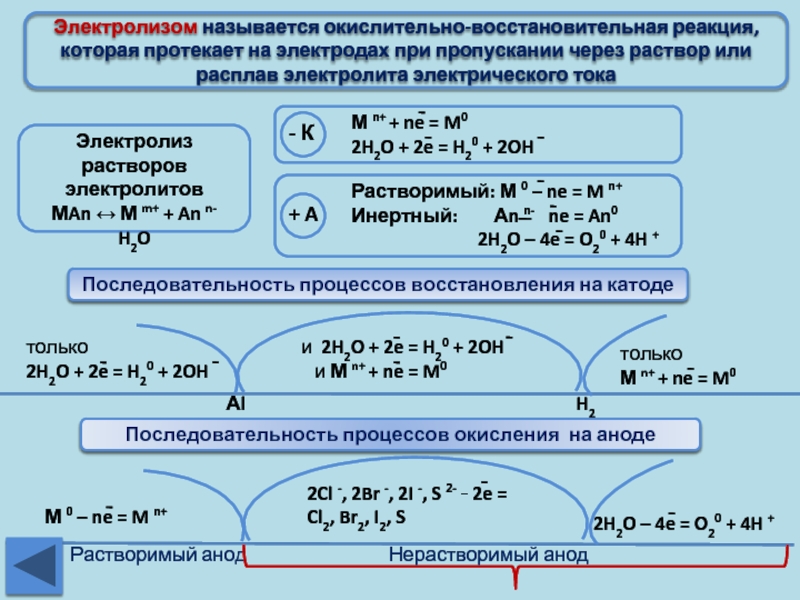



 При электролизе растворов щелочей окисляются ионы OH–:
При электролизе растворов щелочей окисляются ионы OH–: Составить схемы процессов окисления и восстановления
Составить схемы процессов окисления и восстановления
 Показать перемещение ионов к соответствующим электродам
Показать перемещение ионов к соответствующим электродам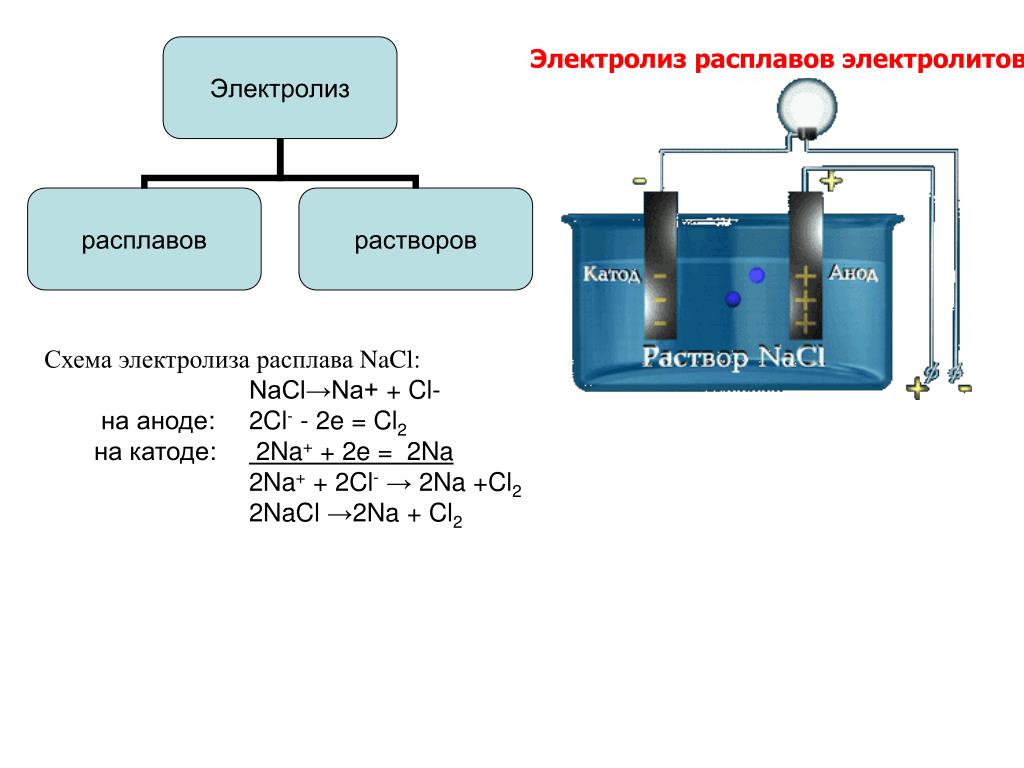 Составить уравнение диссоциации соли
Составить уравнение диссоциации соли Составить уравнение диссоциации соли
Составить уравнение диссоциации соли (Алгоритм 3.)
(Алгоритм 3.) е. электролиз водного раствора
щёлочи сводится к электролизу воды.
е. электролиз водного раствора
щёлочи сводится к электролизу воды. Выбрать ионы, которые будут разряжаться на электродах
Выбрать ионы, которые будут разряжаться на электродах