Где применяют электролиз
Электролиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор, либо расплав электролита.
При прохождении через раствор или расплав электролита электрического тока, на электродах происходит выделение растворенных веществ или иных веществ, являющихся продуктами вторичных реакций на электродах. Этот физико-химический процесс и называется электролизом.
Суть электролиза
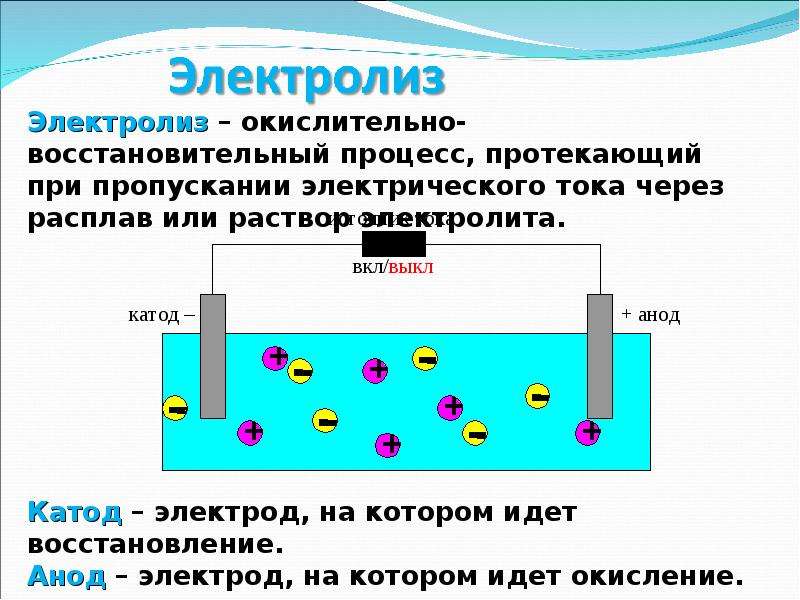
В создаваемом электродами электрическом поле, ионы в проводящей жидкости приходят в упорядоченное движение. Отрицательный электрод — это катод, положительный — анод.
К аноду устремляются отрицательные ионы, называемые анионами (ионы гидроксильной группы и кислотные остатки), а к катоду — положительные ионы, называемые катионами (ионы водорода, металлов, аммония и т.
На электродах протекает окислительно-восстановительный процесс: на катоде происходит электрохимическое восстановление частиц (атомов, молекул, катионов), а на аноде — электрохимическое окисление частиц (атомов, молекул, анионов). Реакции диссоциации в электролите — это первичные реакции, а реакции, которые протекают непосредственно на электродах, называются вторичными.
Законы электролиза Фарадея
Разделение реакций электролиза на первичные и вторичные помогло Майклу Фарадею установить законы электролиза:
- Первый закон электролиза Фарадея: масса вещества, осаждённого на электроде при электролизе, прямо пропорциональна количеству электричества, переданного на этот электрод. Под количеством электричества имеется в виду электрический заряд, измеряемый, как правило, в кулонах.
- Второй закон электролиза Фарадея: для данного количества электричества (электрического заряда) масса химического элемента, осаждённого на электроде, прямо пропорциональна эквивалентной массе элемента.
 Эквивалентной массой вещества является его молярная масса, делённая на целое число, зависящее от химической реакции, в которой участвует вещество.
Эквивалентной массой вещества является его молярная масса, делённая на целое число, зависящее от химической реакции, в которой участвует вещество.
m — масса осаждённого на электроде вещества, Q — полный электрический заряд, прошедший через вещество F = 96 485,33(83) Кл·моль−1 — постоянная Фарадея, M — молярная масса вещества (Например, молярная масса воды h3O = 18 г/моль), z — валентное число ионов вещества (число электронов на один ион).
Заметим, что M/z — это эквивалентная масса осаждённого вещества. Для первого закона Фарадея M, F и z являются константами, так что чем больше величина Q, тем больше будет величина m. Для второго закона Фарадея Q, F и z являются константами, так что чем больше величина M/z (эквивалентная масса), тем больше будет величина m.
Электролиз широко применяется сегодня в промышленности и в технике. Например, именно электролиз служит одним из эффективнейших способов промышленного получения водорода, пероксида водорода, диоксида марганца, алюминия, натрия, магния, кальция и прочих веществ.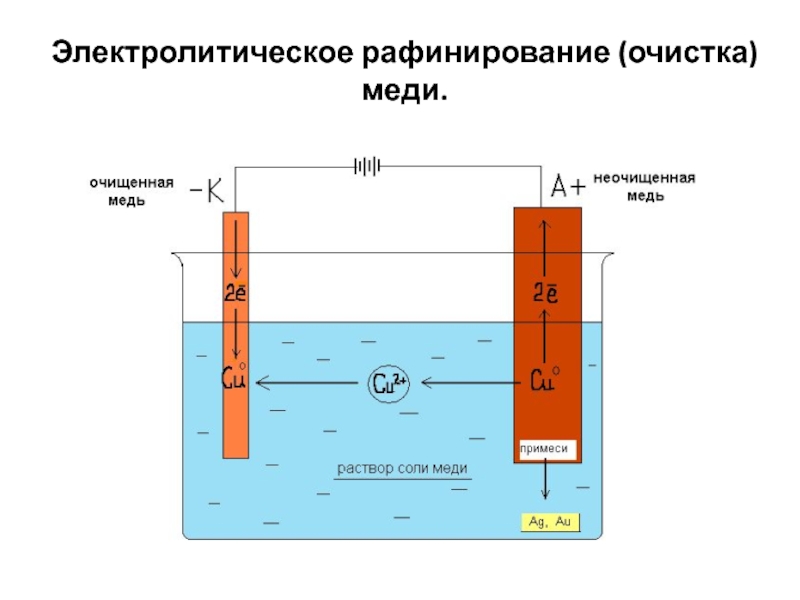 Применяется электролиз для очистки сточных вод, в гальваностегии, в гальванопластике, наконец — в химических источниках тока. Но обо всем по порядку.
Применяется электролиз для очистки сточных вод, в гальваностегии, в гальванопластике, наконец — в химических источниках тока. Но обо всем по порядку.
Получение чистых металлов из руд путем электролиза
Благодаря электролизу многие металлы извлекается из руд и подвергается дальнейшей переработке. Так, когда руду или обогащенную руду — концентрат — подвергают обработке реагентами, металл переходит в раствор, затем путем электроэкстракции металл выделяют из раствора. Чистый металл выделяется при этом на катоде. Таким путем получают цинк, медь, кадмий.
Электрорафинированию металлы подвергают для устранения примесей и чтобы перевести содержащиеся примеси в удобную для дальнейшей переработки форму. Металл, подлежащий очистке, отливают в виде пластин, и применяют эти пластины в качестве анодов при электролизе.
Когда ток проходит, металл анода растворяется, переходит в виде катионов в раствор, затем катионы разряжаются на катоде, и образуют осадок чистого металла. Примеси анода не растворяются – выпадают анодным шламом, или переходят в электролит, откуда непрерывно или периодически удаляются.
Примеси анода не растворяются – выпадают анодным шламом, или переходят в электролит, откуда непрерывно или периодически удаляются.
Рассмотрим в качестве примера электрорафинирование меди. Главный компонент раствора – сульфат меди — наиболее распространенная и дешевая соль этого металла. Раствор обладает низкой электрической проводимостью. Для ее увеличения в электролит добавляют серную кислоту.
Кроме того, в раствор вводят небольшие количества добавок, способствующих получению компактного осадка металла. Вообще, электролитическому рафинированию подвергают медь, никель, свинец, олово, серебро, золото.
Очистка сточных вод путем электролиза
Электролиз находит применение в очистке сточных вод (процессы электрокоагуляции, электроэкстракции и электрофлотации). Электрохимический метод очистки — один из наиболее часто применяемых. Для электролиза используют нерастворимые аноды (магнетит, оксид свинца, графит, марганец, которые наносят на титановую основу), или растворимые (алюминий, железо).
Такой метод применяют для выделения из воды токсичных органических и неорганических веществ. К примеру, медные трубы очищают от окалины раствором серной кислоты, и промышленные сточные воды приходится затем очищать путем электролиза с нерастворимым анодом. На катоде выделяется медь, которая снова может использоваться на том же предприятии.
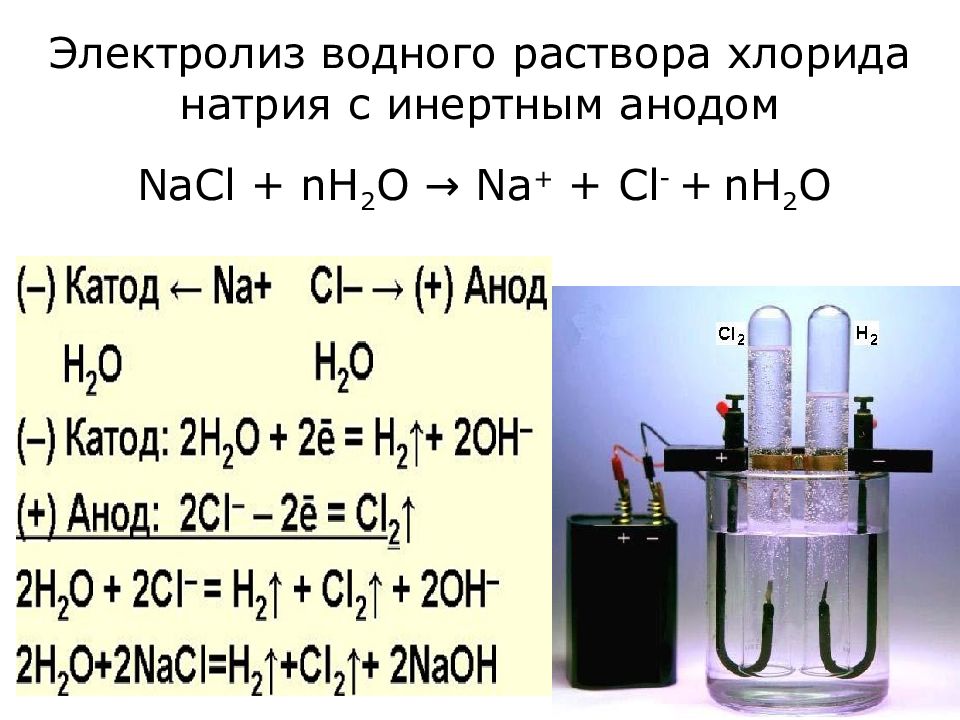
Щелочные сточные воды очищают электролизом от цианистых соединений. С целью ускорения окисления цианидов, повышения электропроводности и экономии электроэнергии, к водам применяют добавку в виде хлорида натрия.
Электролиз проводят с графитовым анодом и стальным катодом. Цианиды разрушаются в ходе электрохимического окисления и хлором, который выделяется на аноде. Результативность такой очистки близка к 100%.
Кроме непосредственно электохимической очистки можно включить в процесс электролиза коагуляцию. Исключив добавки солей, электролиз проводят с растворимыми алюминиевыми или железными анодами. Тогда не только разрушаются загрязнители на аноде, но и растворяется сам анод. Образуются активные дисперсные соединения, которые коагулируют (сгущают) коллоидно-дисперсные загрязнения.
Образуются активные дисперсные соединения, которые коагулируют (сгущают) коллоидно-дисперсные загрязнения.
Этот метод эффективен при очистке сточных вод от жиров, нефтепродуктов, красителей, масел, радиоактивных веществ и т. д. Он называется электрокоагуляцией.
Гальваностегия
Гальваностегия — это электролитическое нанесение определенных металлов с целью защиты изделий от коррозии и для придания им соответствующего эстетического оформления (покрытие производят хромом, никелем, серебром, золотом, платиной и т. п.). Вещь тщательно очищают, обезжиривают, и используют как катод в электролитической ванне, в которую налит раствор соли того металла, которым необходимо покрыть изделие.
В качестве анода применяют пластину из этого же металла. Как правило применяют пару анодных пластин, а подлежащий гальваностегии предмет располагают между ними.
Гальванопластика
Гальванопластика – осаждение металла на поверхности разных тел для воспроизведения их формы: формы для отливки деталей, скульптур, печатных клише и т.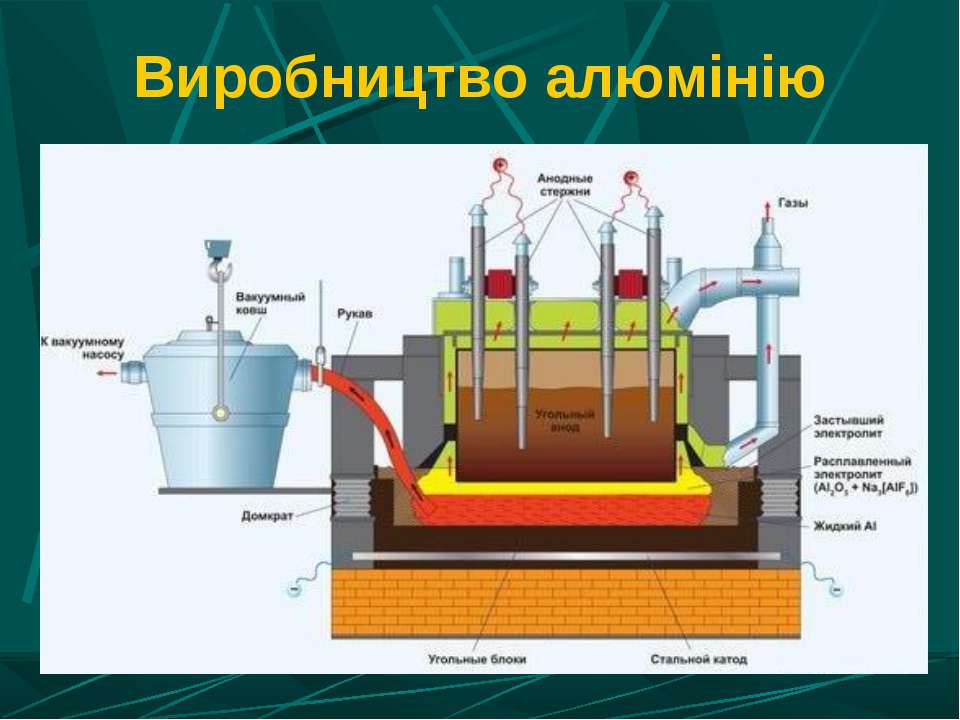
Гальваническое осаждение металла на поверхности предмета возможно лишь тогда, когда поверхность эта или весь предмет являются проводниками электрического тока, поэтому для изготовления моделей или форм желательно использовать металлы. Наиболее подходят для этой цели легкоплавкие металлы: свинец, олово, припои, сплав Вуда.
Эти металлы мягки, легко обрабатываются слесарным инструментом, хорошо гравируются и отливаются. После наращивания гальванического слоя и отделки металл формы выплавляют из готового изделия.
Однако наибольшие возможности для изготовления моделей все же представляют диэлектрические материалы. Чтобы металлизировать такие модели, нужно придать их поверхности электропроводность. Успех или неудача в конечном итоге зависят в основном от качества токопроводящего слоя. Слой этот может быть нанесен одним из трех способов.
Самый распространенный способ — графитирование

Следующий прием — бронзирование, способ хорош для моделей относительно сложной формы, для разных материалов, однако за счет толщины бронзового слоя несколько искажается передача мелких деталей.
И, наконец, серебрение, пригодное во всех случаях, но особенно незаменимое для хрупких моделей с очень сложной формой — растений, насекомых и т. п.
Химические источники тока
Также электролиз является основным процессом, благодаря которому функционируют самые современные химические источники тока, например батарейки и аккумуляторы. Здесь присутствуют два электрода, контактирующие с электролитом.
Между электродами устанавливается разность потенциалов — электродвижущая сила, соответствующая свободной энергии окислительно-восстановительной реакции.
Лимонная батарейка (для увеличения нажмите нажмите на картинку)
Действие химических источников тока основано на протекании при замкнутой внешней цепи пространственно-разделённых процессов: на отрицательном аноде восстановитель окисляется, образующиеся свободные электроны переходят по внешней цепи к положительному катоду, создавая разрядный ток, где они участвуют в реакции восстановления окислителя.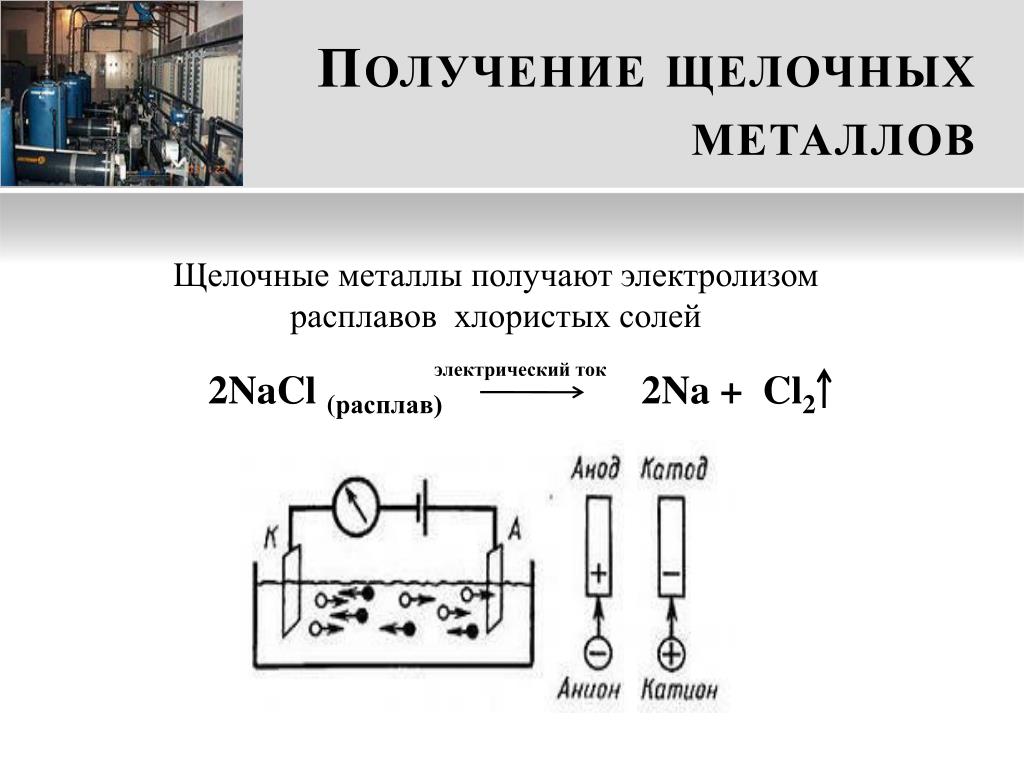 Таким образом, поток отрицательно заряженных электронов по внешней цепи идет от анода к катоду, то есть от отрицательного электрода к положительному.
Таким образом, поток отрицательно заряженных электронов по внешней цепи идет от анода к катоду, то есть от отрицательного электрода к положительному.
Ранее ЭлектроВести писали, что в недавнем докладе Cleantech Group авторы рассказали о трех самых важных для энергетики ближайших лет технологиях. Журналисты Business Insider обсудили их с Луисом Брасингтоном, одним из аналитиков компании.
По материалам: electrik.info.
Электролиз в промышленности
Машиностроение Электролиз в промышленности
просмотров – 463
Важнейшее применение электролиз находит в металлургической, химической промышленности и в гальванотехнике.
В химической промышленности методом электролиза получают различные продукты; к числу их относятся фтор, хлор, едкий натр, водород высокой степени чистоты, многие окислители, в частности пероксид водорода, пероксодисерную кислоту. Развивается электросинтез органических соединений.
В металлургической промышленности электролизом расплавленных соединений и водных растворов получают металлы (Си, Bi, Sn, Pb, Ni, Cd, Zn), а также производят электролитическое рафинирование — очистку металлов от вредных примесей и извлечение ценных компонентов.
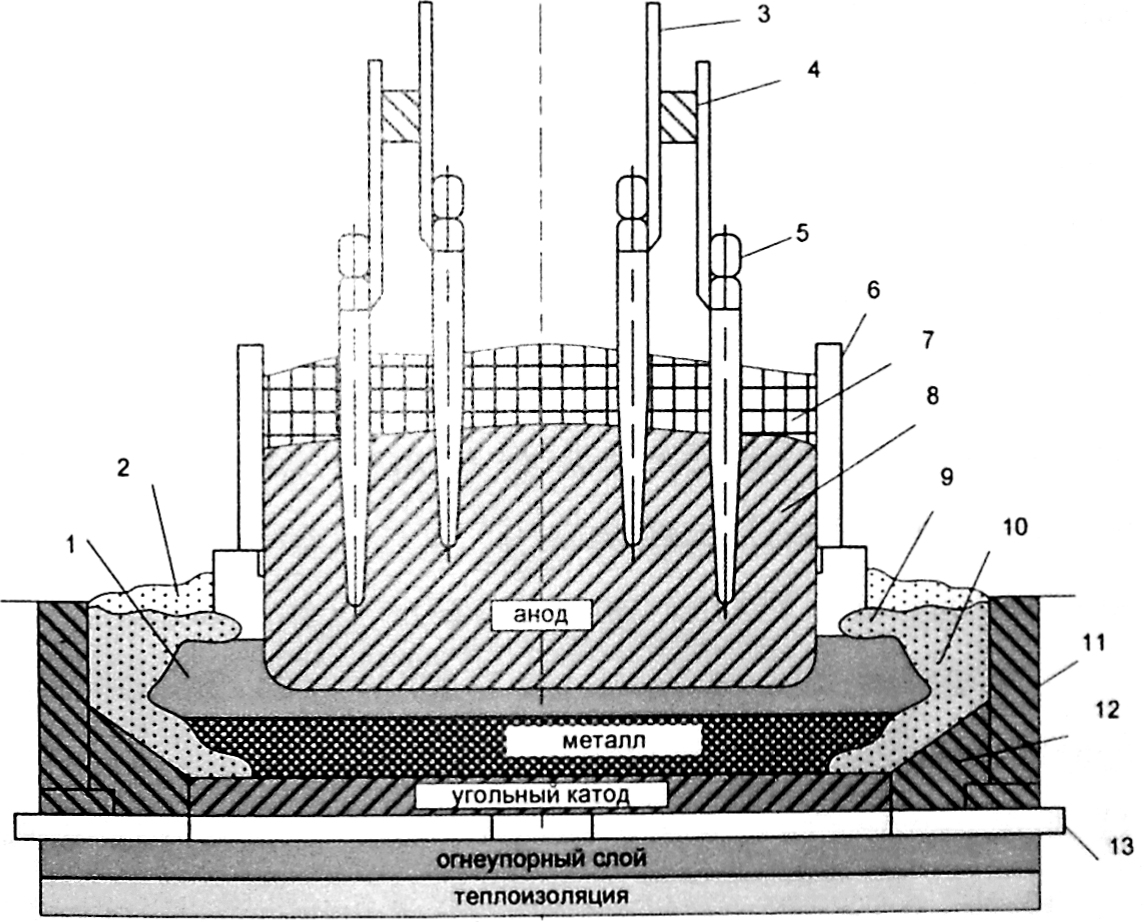
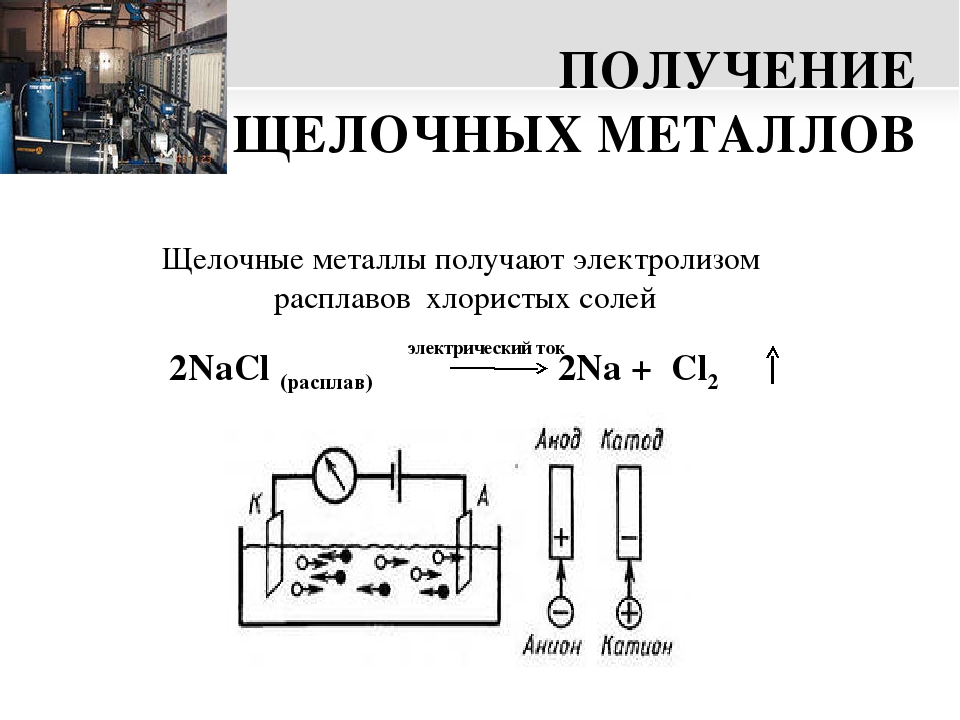
Электролизом расплавов получают металлы, имеющие сильно отрицательные электродные потенциалы, и некоторые их сплавы.
При высокой температуре электролит и продукты электролиза могут вступать во взаимодействие друг с другом, с воздухом, а также с материалами электродов и электролизера.
Электролитом обычно служат не индивидуальные расплавленные соединения, а их смеси. Важнейшим преимуществом смесей является их относительная легкоплавкость, позволяющая проводить электролиз при более низкой температуре.
Сегодня электролизом расплавов получают алюминий, магний, натрий, литий, бериллий и кальций. Электролизом расплавленных сред получают некоторые тугоплавкие металлы.
Электролитическому рафинированию металлы подвергают для удаления из них примесей и для перевода содержащихся в них компонентов в удобные для переработки продукты. Из металла, подлежащего очистке, отливают пластины и помещают их в качестве анодов в электролизер. При прохождении тока металл подвергается анодному растворению — переходит в виде катионов в раствор. Далее катионы металла разряжаются на катоде, образуя осадок чистого металла. Содержащиеся в аноде примеси либо остаются нерастворенными, выпадая в виде анодного шлама, либо переходят в электролит, откуда периодически или непрерывно удаляются.
Далее катионы металла разряжаются на катоде, образуя осадок чистого металла. Содержащиеся в аноде примеси либо остаются нерастворенными, выпадая в виде анодного шлама, либо переходят в электролит, откуда периодически или непрерывно удаляются.
Электролитическому рафинированию подвергают медь, никель, свинец, олово, серебро, золото.
К гальванотехнике относятся гальваностегия и гальванопластика. Процессы гальваностегии представляют собой нанесение путем электролиза на поверхность металлических изделий слоев других металлов для предохранения этих изделий от коррозии, для придания их поверхности твердости, а также в декоративных целях. Из многочисленных применяемых в технике гальванотехнических процессов важнейшими являются хромирование, цинкование, кадмирование, никелирование, меднение и др.
Сущность гальванического нанесения покрытий состоит в следующем. Хорошо очищенную и обезжиренную деталь, подлежащую защите, погружают в раствор, содержащий соль того металла, которым ее крайне важно покрыть, и присоединяют в качестве катода к цепи постоянного тока; при пропускании тока на детали осаждается слой защищающего металла. Наилучшая защита обеспечивается мелкокристаллическими плотными осадками. Такие осадки обладают, кроме того, лучшими механическими свойствами.
Наилучшая защита обеспечивается мелкокристаллическими плотными осадками. Такие осадки обладают, кроме того, лучшими механическими свойствами.
Гальванопластикой называются процессы получения точных металлических копий с рельефных предметов электроосаждением металла. Путем гальванопластики изготовляют матрицы для прессования различных изделий, матрицы для тиснения кожи и бумаги, печатные радиотехнические схемы. К гальванотехнике относятся также другие виды электрохимической обработки поверхности металлов: электрополирование стали, оксидирование алюминия, магния. Последнее представляет собой анодную обработку металла, в ходе которой определенным образом изменяется структура оксидной пленки на его поверхности. Это приводит к повышению коррозионной стойкости металла. Вместе с тем, металл приобретает при этом красивый внешний вид.
Читайте также
Важнейшее применение электролиз находит в металлургической, химической промышленности и в гальванотехнике.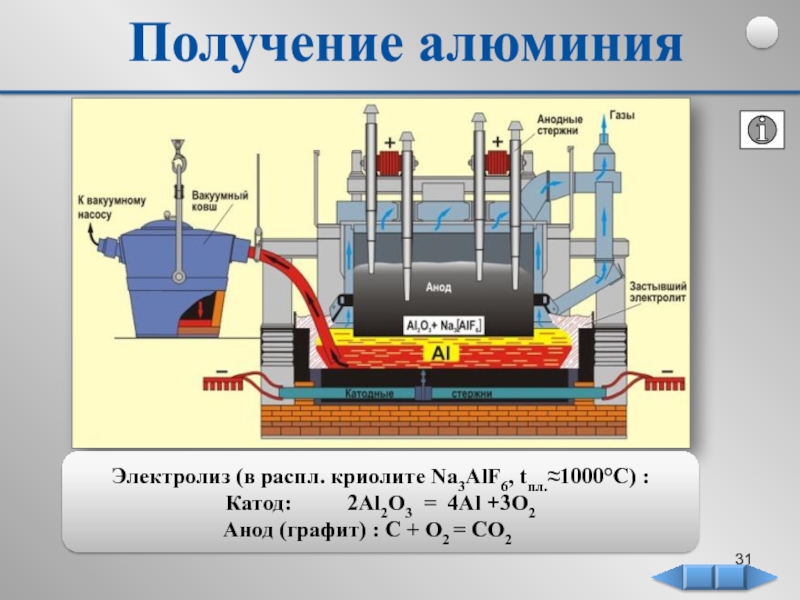 В химической промышленности методом электролиза получают различные продукты; к числу их относятся фтор, хлор, едкий натр, водород высокой степени чистоты,… [читать подробенее]
В химической промышленности методом электролиза получают различные продукты; к числу их относятся фтор, хлор, едкий натр, водород высокой степени чистоты,… [читать подробенее]
Важнейшее применение электролиз находит в металлургической, химической промышленности и в гальванотехнике. В химической промышленности методом электролиза получают различные продукты; к числу их относятся фтор, хлор, едкий натр, водород высокой степени чистоты,… [читать подробенее]
Применение электрохимических процессов в пищевой промышленности Текст научной статьи по специальности «Промышленные биотехнологии»
УДК 663.11, 663.05, 663.03,663.038
Д. Д. Темершин, С. В. Гаврилов ПРИМЕНЕНИЕ ЭЛЕКТРОХИМИЧЕСКИХ ПРОЦЕССОВ В ПИЩЕВОЙ ПРОМЫШЛЕННОСТИ
Ключевые слова: электролиз, электродиализ, электроактивация, деминерализация, электрофлотация, пищевые продукты.
Рассмотрены сферы применения электрохимических процессов в пищевой промышленности на примере мясного, молочного, мукомольного и овощепереабатывающего производств.
Keywords: Electrolysis, electrodialysis, an anode, a cathode, electroactivation, demoralization, electroflotation.
Consider the sphere of application of electrochemical processes in the food industry for example, meat, milk, flour and vegetable production.
Актуальность. Электрохимические
процессы широко применяется в современной промышленности. В частности, электролиз является одним из способов промышленного получения алюминия, а также гидроксида натрия,хлора, хлорорганических соединений, диоксида марганца, пероксида водорода. Значительное количество металлов извлекаются из руд и подвергаются переработке методом электролиза
(электроэкстракция, электрорафинирование). Также, электролиз является основным процессом, благодаря которому функционирует химический источник тока и принимает участие в очистке сточных вод (процессы электрокоагуляции, электроэкстракции, электрофлотации). Применяется для получения многих веществ (металлов, водорода, хлора и др.), при нанесении металлических покрытий (гальваностегия), воспроизведении формы предметов (гальванопластика) [1,2].
Также, электролиз является основным процессом, благодаря которому функционирует химический источник тока и принимает участие в очистке сточных вод (процессы электрокоагуляции, электроэкстракции, электрофлотации). Применяется для получения многих веществ (металлов, водорода, хлора и др.), при нанесении металлических покрытий (гальваностегия), воспроизведении формы предметов (гальванопластика) [1,2].
Цель данной работы — анализ областей применения электрохимических процессов в пищевой промышленности.
В мясной промышленности электролиз используется при посоле мяса, мясопродуктов, колбасных изделий и изделия из цельномышечного сырья. Способ включает приготовление посолочного рассола, включающего поваренную соль, активирование рассола путем проточной обработки в корпусном кавитационном реакторе или порционной обработки в бескорпусном кавитационном реакторе и смешивание активированного рассола с мясным сырьем. При этом активирование рассола осуществляют при отношении максимальной внутри реактора амплитуды давления акустической волны в пределах от 2 до 23 к значению гидростатического давления в реакторе. Смешивание полученного таким способом активированного посолочного рассола с мясным сырьем может осуществляться при перемешивании измельченого сырья путем дозирования активированного посолочного рассола в предварительно измельченное мясо, шприцеванием цельномышечного мяса активированным
При этом активирование рассола осуществляют при отношении максимальной внутри реактора амплитуды давления акустической волны в пределах от 2 до 23 к значению гидростатического давления в реакторе. Смешивание полученного таким способом активированного посолочного рассола с мясным сырьем может осуществляться при перемешивании измельченого сырья путем дозирования активированного посолочного рассола в предварительно измельченное мясо, шприцеванием цельномышечного мяса активированным
посолочным рассолом или путем погружения цельномышечного мяса в активированный посолочный рассол. Способ обеспечивает исключение из посолочного рассола, а следовательно, и из конечного продукта неорганических влагоудерживающих и
цветостабилизирующих добавок либо снижение их
содержания, снижение содержания вкусовых и консервирующих добавок, в частности поваренной соли, а также сокращение времени посола при сохранении традиционного вкуса и внешнего вида готового продукта [3].
Анализ опыта работы ряда отечественных и зарубежных предприятий показывает, что стабильно высокое качество мясных изделий (даже при колебании качества поступающего сырья) может быть получено за счет применения системы соответствующей водоподготовки. Это связано с тем, что большинство пищевых продуктов содержит значительное количество воды, которая находится в различном состоянии по формам и энергиям связи и существенно влияет на их физико – химические и реологические свойства [4].
При производстве красителя из щелухи лука используется электроактивация раствора. Техническим результатом изобретения является интенсификация экстрагирования. Этот результат достигается тем, что в способе производства красителя из шелухи лука, включающем экстрагирование водой при температуре 69 – 79 °С и давлении 7,2 – 10,0 МПа при непрерывном введении аммонийных солей угольной кислоты и отделение целевого продукта от шрота, согласно изобретению, воду перед экстрагированием подвергают электрохимической активации, а для экстрагирования используют католит. [5].
[5].
Аналогичный метод используется при добыче альгиновой кислоты из бурых водорослей. Водорослевое сырье обрабатывают кислотными и щелочными химическими реагентами, извлеченные альгинаты очищают и обесцвечивают, выделяют альгиновую кислоту с последующим получением альгината натрия нейтрализацией. В качестве кислотного и щелочного химических реагентов используют растворы анолита и католита, полученные электрообработкой электролита -водного раствора солей щелочных металлов, например поваренной соли, в анодной и катодной камерах двухкамерного электролизера
соответственно. Данный способ помогает упростить технологическую схему, а так же улучшить саниатрно – гигиенические условия [6].
Существующие технологии переработки водорослей отличает длительность,
многостадийность процессов, использование агрессивных химических реагентов, особенно на
стадии отбеливания. Разработана новая электрохимическая технология экстрагирования и обесцвечивания полисахаридов из водорослей и обоснованы рациональные параметры
Разработана новая электрохимическая технология экстрагирования и обесцвечивания полисахаридов из водорослей и обоснованы рациональные параметры
электрохимической обработки с интерпретацией научных основ процессов. Наработаны опытные партии образцов, проведена сравнительная оценка свойств полисахаридов, полученных традиционным и электрохимическим способами. Выбор оптимальных параметров электрообработки обеспечивает рациональные условия
экстрагирования полисахаридов из сырья и безопасные условия обесцвечивания, исключающие галогенирование и снижающие степень их деструкции [7].
Известно, что при производстве молочнокислых продуктов происходит закисление молока до 100 и более градусов Тернера. Молочный сахар превращается в молочную кислоту, белки денатурируют, молоко сворачивается и превращается в молочнокислый продукт. Для продления срока буферности свежего молока его обычно охлаждают или пастеризуют [8].
Альтернативой данному процессу являются современные разработки по электрохимической активации водных растворов – раскисление молока. Суть их состоит в том, что обработка молока в электроактиваторе позволяет поднять рН молока до требуемого уровня и, таким образом, восстановить необходимый уровень кислотности. В результате кислотность молока по шкале Тернера может постоянно находиться в требуемых пределах. При этом возрастает стойкость молока (время, в течение которого сохраняются микробиологические, биохимические и органолептические показатели на уровне) что повышает выход сухого продукта при термообработке электроактивированного молока [8].
В молочной промышленности все более широко применяется электродиализная обработка сыворотки. Использование этого процесса в технологии молока дает возможность получить дополнительный источник углеводсодержащего сырья, при правильной переработке которого значительно повышается эффективность работы молокоперерабатывающих предприятий,
организуется безотходное производство молочного сырья, а также расширяется ассортимент вырабатываемых продуктов. Основная задача электродиализной обработки сыворотки заключается в ее деминерализации. Удаление солей позволяет получить обессоленный раствор лактозы, переработка которого дает возможность вырабатывать молочный сахар повышенной чистоты, а также открывает новые возможности для переработки деминерализованного лактозного раствора. Следует отметить, что снижение содержание солей в сгущенном растворе лактозы способствует более быстрой ее кристаллизации и интенсифицирует производство молочного сахара
Основная задача электродиализной обработки сыворотки заключается в ее деминерализации. Удаление солей позволяет получить обессоленный раствор лактозы, переработка которого дает возможность вырабатывать молочный сахар повышенной чистоты, а также открывает новые возможности для переработки деминерализованного лактозного раствора. Следует отметить, что снижение содержание солей в сгущенном растворе лактозы способствует более быстрой ее кристаллизации и интенсифицирует производство молочного сахара
[9].
В связи с увеличением объемов и ассортимента производства молока и молочных продуктов его переработки в России и за рубежом,
стоит проблема утилизации молочной сыворотки отхода переработки молока.
Объемы получаемой молочной сыворотки теоретически достигает 90 % объема перерабатываемого молока: практически они несколько меньше из – за неполного сбора и технологических потерь.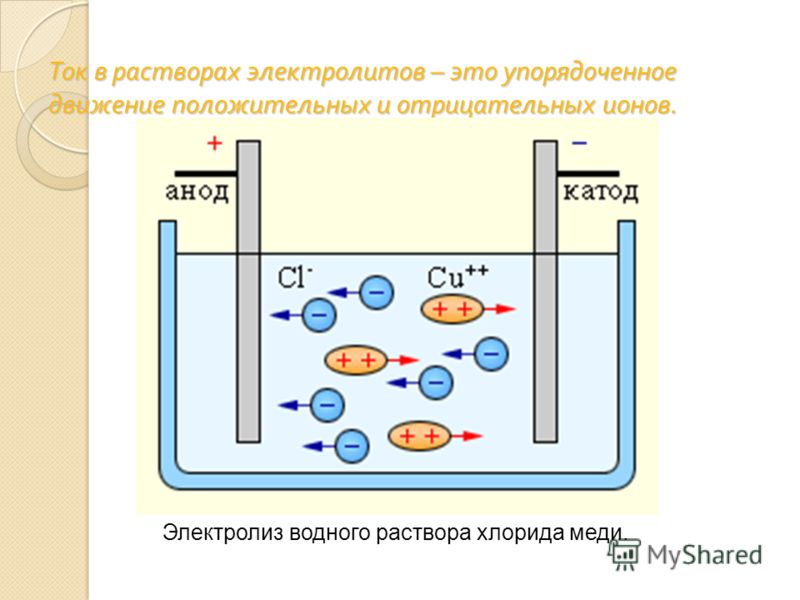 В сыворотку переходит около 50 % сухих веществ молока.
В сыворотку переходит около 50 % сухих веществ молока.
Очистка 1 м3 сточных вод с высоким содержанием молочной сыворотки приравнивается к очистке 400 м3 промышленных стоков. Возрастают проблемы охраны окружающей среды вследствие высокой биологической активности молочной сыворотки.
До недавнего времени молочную сыворотку считали отходом производства. В мировой печати, посвященной молочной промышленности, систематически публикуют материалы из которых следует, что молочная сыворотка по своему составу, пищевой и биологической ценности, относится к ценнейшему сырью, из которого можно производить необычайно широкий ассортимент пищевых и кормовых продуктов, полученных в результате применения специфических методов ее переработки.
Одним из способов утилизации молочной сыворотки – является получение спирта на её основе, а одним из путей интенсификации биохимических процессов – электрохимическое воздействие на сырье [10].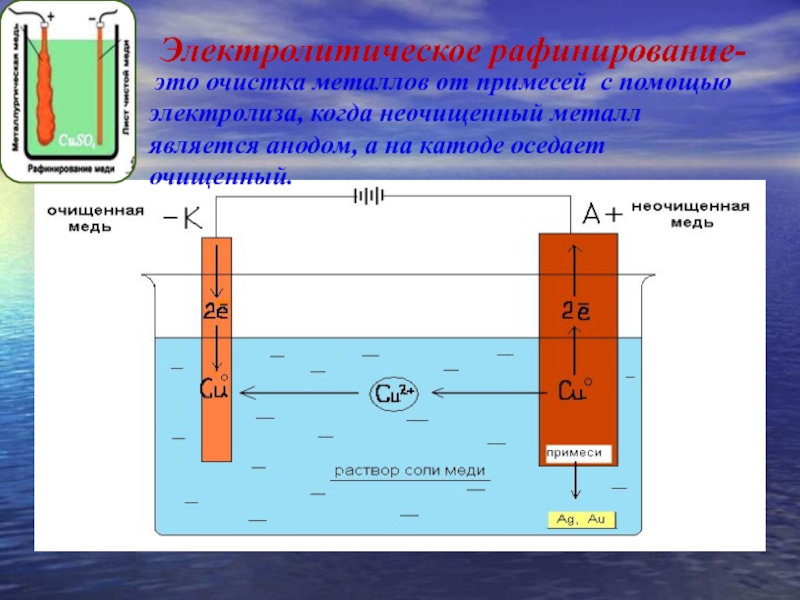
Способ деминерализации сладкой сыворотки сводится к электродеионизации в специальном устройстве. Устройство включает камеру разбавления, содержащую слой ионообменной смолы между катионопроницаемой и анионопроницаемой мембранами, камеры концентрирования
соответственно анионов и катионов, а также электроды для создания электрического поля. Пропускают субстрат через слой ионообменной смолы, который содержится в камере разбавления. При этом электрическое поле, создаваемое электродами, направляет катионы из камеры разбавления через катионопроницаемую мембрану в камеру концентрирования катионов и направляет анионы из камеры разбавления через анионопроницаемую мембрану в камеру концентрирования анионов. При этом через камеры концентрирования анионов и катионов пропускают промывочный раствор для удаления анионов и катионов из камер концентрирования. Обработанный продукт собирают из камеры разбавления. При этом сладкую сыворотку пропускают через слой смолы камеры разбавления, который содержит сильно катионообменную смолу, а рН промывочного раствора поддерживают так, чтобы раствор, присутствующий в камерах концентрирования анионов и катионов, имел уровень менее 5 мСм (милиСимменс). Также возможно дополнительно пропускать промывочный раствор через слой смолы, который присутствует в каждой камере концентрирования, содержащий сильно
При этом сладкую сыворотку пропускают через слой смолы камеры разбавления, который содержит сильно катионообменную смолу, а рН промывочного раствора поддерживают так, чтобы раствор, присутствующий в камерах концентрирования анионов и катионов, имел уровень менее 5 мСм (милиСимменс). Также возможно дополнительно пропускать промывочный раствор через слой смолы, который присутствует в каждой камере концентрирования, содержащий сильно
катионообменную смолу для поддержания рН раствора, присутствующего в каждой камере, на уровне ниже 5 мСм. Промывочный раствор может
быть кислым для поддержания рН на желательном уровне. Дополнительно может быть проведена обработка сладкой сыворотки так, чтобы пропускаемая к слою смолы сладкая сыворотка имела рН от 7,5 до 8. Другой вариант деминерализации сладкой сыворотки отличается от первого тем, что сладкую сыворотку пропускают через слой смолы камеры разбавления, который содержит катионообменную смолу и слабо анионообменную смолу, а рН промывочного раствора поддерживают так, чтобы раствор, присутствующий в камерах концентрирования анионов и катионов, имел уровень менее 5 мСм. Катионо – и анионообменные смолы находятся в форме гранул, при этом катионообменная смола является сильно катионообменной смолой. Весовое соотношение между сильно катионообменной смолой и слабо анионообменной смолой составляет 30 – 40 % катионообменной смолы и 60 – 70 % анионообменной смолы [11].
Катионо – и анионообменные смолы находятся в форме гранул, при этом катионообменная смола является сильно катионообменной смолой. Весовое соотношение между сильно катионообменной смолой и слабо анионообменной смолой составляет 30 – 40 % катионообменной смолы и 60 – 70 % анионообменной смолы [11].
Электрохимические процессы используются при производстве творога и творожных продуктов. При обезвоживании творожного сгустка находит применение электроосматическая фильтрация (фильтрация путем наложения на сгусток электрического поля напряженностью 112 – 220 В/м) [12].
В овощеперерабатывающей
промышленности электрохимические процессы используются для извлечения нитратов из сырья -овощей. Подготовленные к переработке овощи, содержащие нитраты, выдерживают в кислой среде анодной фракции электрохимически активированной воды с рН 2 – 3 и окислительно-восстановительным потенциалом 900 – 1200 мВ в течение 30 – 60 мин при объемном соотношении овощей и воды 1 : (0,5 – 1,0). Анодную фракцию можно освобождать от свободного хлора отстоем при перемешивании или пропускать через катализатор, в качестве которого может быть активный уголь или углерод оксидно-марганцевый. Для удаления остатков анолита и привкуса кислоты овощи после обработки можно промывать катодной фракцией активированной воды с рН 10- 11 и потенциалом 300 – 500 мВ. Это позволяет значительно повысить степень извлечения нитратов из овощей, упростить технологию и одновременно дезинфицировать овощи [13].
Анодную фракцию можно освобождать от свободного хлора отстоем при перемешивании или пропускать через катализатор, в качестве которого может быть активный уголь или углерод оксидно-марганцевый. Для удаления остатков анолита и привкуса кислоты овощи после обработки можно промывать катодной фракцией активированной воды с рН 10- 11 и потенциалом 300 – 500 мВ. Это позволяет значительно повысить степень извлечения нитратов из овощей, упростить технологию и одновременно дезинфицировать овощи [13].
В мукомольной промышленности электроконтактные методы используются для интенсификации проращивания ячменя при производстве ячменной крупы и муки. Было установлено, что скорость роста и качество проростков можно контролировать с помощью оптимальной продолжительности замачивания и обработки зерновки токами высокой частоты. При том продолжительность проростания ячменя сокращается, а качественные показатели пророщенного зерна сохраняются (активный комплекс ферментов, комплекс витаминов, пищевых волокон, минеральных солей, сахаров и т. д.) [13].
д.) [13].
Аналогичные методы используются для интенсификации проращивания льна. Метод заключается в обработке сырья 0.0025 % водным
раствором перманганата калия и последующей промывке дистиллированной водой. Затем семена льна помещают для набухания в плоскую емкость и заливают электрохимически активной водой с рН равной 9 и отношением семян и воды 1/2 с последующим помещением в термостат с температурой 25 °С на 12 часов. Способ позволяет интенсифицировать процесс проращивания семян, повысить выход биомассы на 30 – 40 %, увеличить энергию прорастания и процент ростовых параметров семян – 40 %. [14,15].
Широко используется при извлечении белка или белковых растворов из различных отходов рыбной, жировой промышленностей (сухой гаммарус, биомасса грибов Aspergillus Heger, соевый шрот, отходы рыбной разделки) [16]. Происходит измельчение сырья с раствором электролита, электрообработка в катодной камере двухкамерного электролизера и нагревание таким образом, чтобы при достижении pH смеси значения 10,0 – 12,5 температура последней не превышала температуры коагуляции белка. Процесс ведут до скачкообразного увеличения коэффициента светопропускания. Известен способ растворения белка в основном для получения белковых гидролизатов из белоксодержащего сырья включающий кислотный гидролиз сырья концентрированной кислотой и нагревание до 100 – 250 °С перед смешиванием. Недостатками способа являются относительно низкая степень растворения белка и соответственно ухудшенное качество конечного продукта -белоксодержащего раствора, а также необходимость использования сильнодействующих
Процесс ведут до скачкообразного увеличения коэффициента светопропускания. Известен способ растворения белка в основном для получения белковых гидролизатов из белоксодержащего сырья включающий кислотный гидролиз сырья концентрированной кислотой и нагревание до 100 – 250 °С перед смешиванием. Недостатками способа являются относительно низкая степень растворения белка и соответственно ухудшенное качество конечного продукта -белоксодержащего раствора, а также необходимость использования сильнодействующих
концентрированных кислот, в значительной степени ухудшающих экологию такого производства. Найден эффективный способ растворения белка, позволяющего совместить высокое качество конечного продукта – белоксодержащего раствора с одновременной гарантированной максимально высокой степенью содержания растворенного в нем белка, минимизацией энерго- и трудозатрат и расширением диапазона видов перерабатываемого сырья. Это достигается тем, что в предполагаемом способе растворения белка, включающем измельчение сырья, смешивание его с раствором электролита, обработку исходной смеси в электрическом поле, преимущественно в катодной камере двухкамерного электролизера, и нагревание.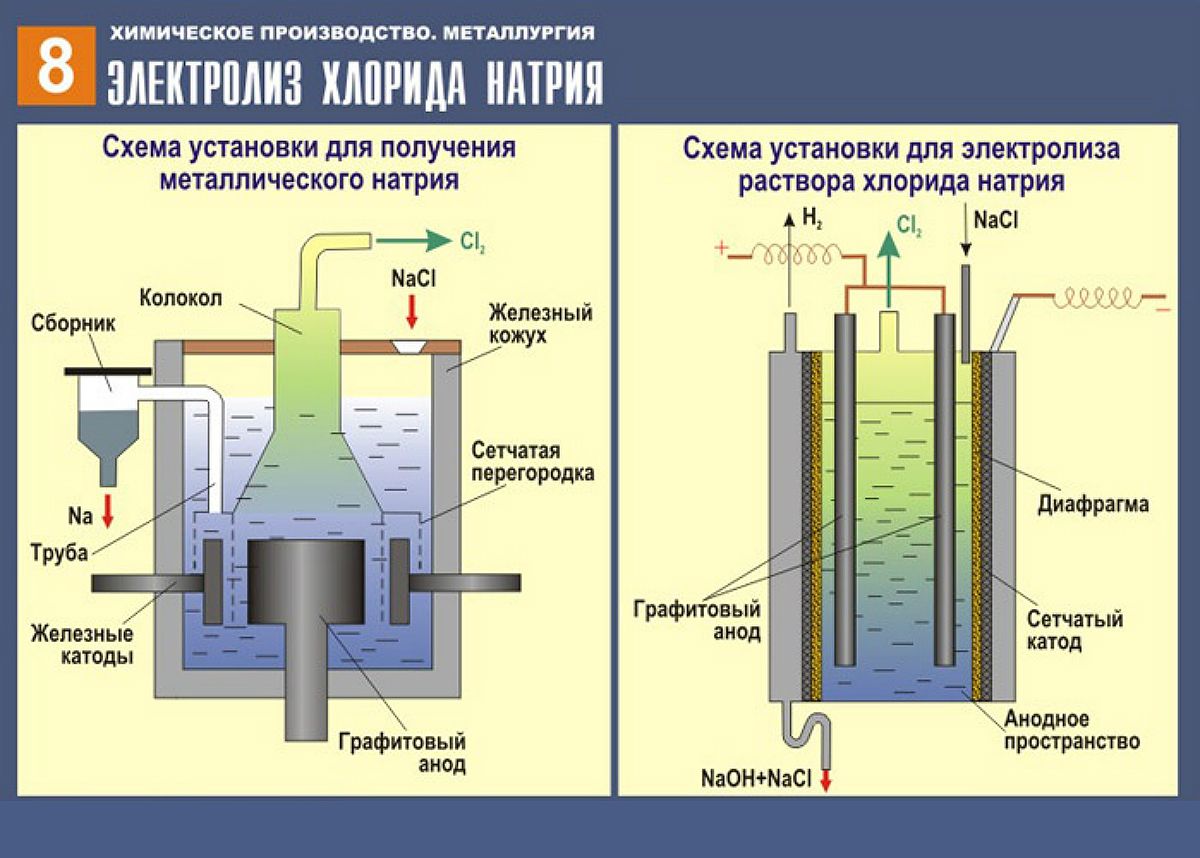 В отличие от прототипа, электрообработку и нагревание исходной смеси осуществляют таким образом, чтобы при достижении pH смеси значения 10,0 – 12,5 температура последней не превышала температуры коагуляции белка (соответствующего вида сырья).
В отличие от прототипа, электрообработку и нагревание исходной смеси осуществляют таким образом, чтобы при достижении pH смеси значения 10,0 – 12,5 температура последней не превышала температуры коагуляции белка (соответствующего вида сырья).
Процесс ведут до скачкообразного увеличения коэффициента светопропускания исходной смеси, на основании этого показателя делают вывод о полном растворении белка и окончании процесса. При этом скачкообразное увеличение коэффициента светопропускания среды исходной смеси сопровождается и совпадает по времени с образованием во всем объеме исходной смеси светопрозрачной, преимущественно
однородной, структуры. После этого прекращают процесс подвода тепла для поддержания температуры смеси. Коэффициент светопропускания определяют путем измерения степени мутности среды, например, при помощи
фотоэлектрокалориметра.
В качестве сырья для извлечения белка используются отходы из точных вод рыбного производства. Известен способ получения белковых препаратов, в частности рыбных, путем воздействия на мясную ткань рыбы и морских беспозвоночных нетермическим химико – механическим способом. Согласно изобретению тщательно раздробленное рыбное сырье экстрагируют органическими растворителями, липидную фракцию отделяют, мясную массу подвергают сверхдавлению, поддерживая при этом температуру 35 – 38 °С. Полученный полупродукт полоскают в слабом растворе этанола, затем обезвоживают и получают нескоагулированный белковый препарат [17].
Недостатком это способа является использование большого количества органических растворителей и неорганических веществ, а также технологических стадий, что делает этот способ длительным и дорогостоящим. Недостатки устраняются путем проведения электрофлотации сточных вод или отходов рыбного производства при напряжении 12 В, плотности тока 200 – 300 А/м2 в течение 60 мин при температуре 18-20 °С до достижения рН 6,5 – 7,2. Использование электрофлотации при заявленных параметрах обеспечивает максимальную степень извлечения белка из сырья при сохранении его высоких функциональных свойств.
Использование электрофлотации при заявленных параметрах обеспечивает максимальную степень извлечения белка из сырья при сохранении его высоких функциональных свойств.
Выводы
Электрохимические процессы все больше
находят применение в молочной, консервной,
овощеперерабатывающей, сахарной, рыбо- и
мясоперерабатывающих отраслях промышленности. Использование электрохимических процессов в пищевом производстве способствует повышению производительности оборудования, качества продукции и снижению капитальных затрат на организацию производства, а также снижению отрицательных факторов на окружающую среду.
Литература
1. «Электролиз» СИешр°г1 [Электронный ресурс] Режим доступа: http://www.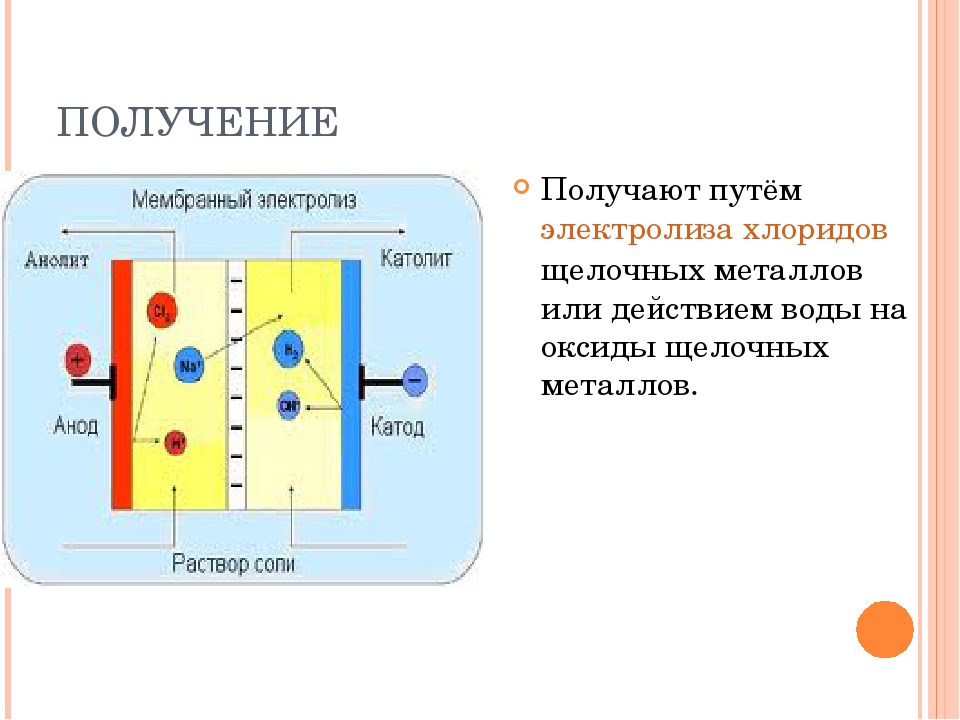 chemport.ru.
chemport.ru.
2. Р.Т. Валеева, С.Г. Мукачев, «Вестник Казанского технологического университета», 5, 135-138, (2014).
3. Патент РФ 2245624 (2004).
4. А.А. Чичко, автореферат дисс. канд. тех. наук, Москва, 2005. 8 с.
5. Патент РФ 2130472 (1999).
6. Патент РФ 2197840 (2001).
7. Е.Э Куприна «Рыбпром: технологии для обработки водных биоресурсов», 3, 10-14, (2010).
8. Патент РФ 2067435 (1997).
9. Применение электромембранных процессов в молокопереабатываемой промышленности, кафедра мембранной технологии, [Электронный ресурс] Режим доступа:
http://www. membrane.msk.ru/books/?id_b=14&id_bp=451.
membrane.msk.ru/books/?id_b=14&id_bp=451.
10. М.Т. Рашидов, автореферат дисс. канд. тех. наук Москва, 2003, 4 с.
11. Патент РФ 2192751 (2005).
12. Патент РФ 2028059 (1995).
13. Патент РФ 2241348 (2004).
14. Е.К. Иванов, В.И. Степанов, «Техника и технология пищевых производств», 2, 12-15, (2001).
15. Р.Т. Валеева, С.Г. Мукачев, «Вестник Казанского технологического университета», 10, 101-104, (2014).
16. Патент РФ 2528498 (2004).
17. Патент РФ 2133577 (2008).
© Д. Д. Темершин – магистр кафедры Пищевая инженерия малых предприятий КНИТУ, dima-lestreyd@mail. ru; С. В. Гаврилов – аспирант кафедры Пищевая инженерия малых предприятий КНИТУ [email protected].
ru; С. В. Гаврилов – аспирант кафедры Пищевая инженерия малых предприятий КНИТУ [email protected].
© D. D. Temershyn – master Department of food engineering in small enterprises, Kazan National Research Technological University, [email protected]; S. V. Gavrilov – Ph.D. Student, Department of food engineering in small enterprises, Kazan National Research Technological University, [email protected].
Конспект урока “Применение электролиза в промышленности и технике” 9 класс
Организуется работа в группах.
Задание группам
Опираясь на тезисы, составленные при изучении § и на текст § , повторить материал:
Группы 1 и 2 – изложенный в тексте;
Группы 3 и 4 – изложенный в тексте.
Используя домашние заготовки вопросов, составьте к повторенному материалу серию
вопросов, проверяющих:
а) уровень запоминания информации; б) уровень понимания сути процессов, описанных в
учебнике (в задании может быть ограничено количество вопросов).
В подготовленных учителем карточках-консультациях могут быть приведены слова,
которыми начинаются вопросы, проверяющие уровень понимания сути процессов,
описанных в учебнике: «Зачем…?»; «Какие факторы влияют на…?»; «Сделайте вывод…»;
«Сравните…» и т.д.
5. Осмысление и закрепление нового материала
Упражнение «Ты-мне, я – тебе»
Выполняется во время презентации работы групп. Группы 1 и 2 по очереди задают друг
другу по несколько вопросов уровней а и б (количество вопросов оговаривается),
выслушивают ответы и корректируют их. Весь класс участвует в уточнении предлагаемых
вопросов и ответов. Затем это же упражнение выполняется группами 3 и 4. Затем группам 1
и 2, 3 и 4 выдаются большие листы бумаги. Пары групп обсуждают составленные вопросы,
выбирают лучшие, записывают их на листы. Учитель оговаривает их количество. Например,
два лучших вопроса уровня а и три лучших вопроса уровня б.
Можно оговорить, что представленные вопросы рассмотрит экспертная комиссия и
определит лучшие из них, которые и станут победителями. В состав экспертной комиссии,
которую возглавляет учитель физики, входят эксперты старшеклассники, члены школьного
научного физического общества.
6. Подведение итогов урока
1. Делается вывод: основными промышленными применениями электролиза являются:
1) Электрометаллургия (получение металлов из расплавов солей и оксидов этих
металлов с помощью электролиза)
2) Очистка металлов от примесей (рафинирование металлов)
3) Гальванотехника, включающая гальваностегию и гальванопластику.
Внимание учащихся фиксируется на том, что в основу гальванотехники положено
покрытие проводящей ток поверхности слоем металла при электролизе, но при
гальванопластике получают более толстые слои покрытия (до нескольких миллиметров)
и принимают меры к тому, чтобы покрытия легко отслаивались.
2. Заполняется до конца таблица «Электрический ток в растворах и расплавах
электролитов» по методике, оговоренной раньше. При заполнении таблицы
учитывается информация о применениях электролиза, не описанных в учебнике (из
подготовленных учащимися сообщений). Для этого используются незаполненные
карточками и маркеры.
7. Домашнее задание
1. конспект; решить задачу (карточка)
2. Подготовить презентацию или сообщения по изученной теме.
| 21 мая 2020 г. | |||
| Органические вещества. Кислородосодержащие соединения | Химия 11 класс | 30 минут | Пяткова Ольга Борисовна, старший преподаватель кафедры естественно-математических дисциплин, ГБУ ДПО ЧИППКРО |
| Органические вещества. Углеводороды | Химия 11 класс | 30 минут | Пяткова Ольга Борисовна, старший преподаватель кафедры естественно-математических дисциплин, ГБУ ДПО ЧИППКРО |
15 мая 2020 г. | |||
| Итоговая видеоконсультация по химии | Химия 9 класс | 30 минут | Пяткова Ольга Борисовна, старший преподаватель кафедры естественно-математических дисциплин, ГБУ ДПО ЧИППКРО |
| 12 мая 2020 г. | |||
| Генетическая связь между классами неорганических соединений | Химия 11 класс | 30 минут | Пяткова Ольга Борисовна, старший преподаватель кафедры естественно-математических дисциплин, ГБУ ДПО ЧИППКРО |
| Кислоты неорганические и органические | Химия 11 класс | 30 минут | Пяткова Ольга Борисовна, старший преподаватель кафедры естественно-математических дисциплин, ГБУ ДПО ЧИППКРО |
| 5 мая 2020 г. | |||
| Неметаллы | Химия 11 класс | 30 минут | Пяткова Ольга Борисовна, старший преподаватель кафедры естественно-математических дисциплин, ГБУ ДПО ЧИППКРО |
29 апреля 2020 г. | |||
| Урок 1. Обобщение знаний. Виды химических связей и типы кристаллических решеток | Химия 9 класс | 30 минут | Пяткова Ольга Борисовна, старший преподаватель кафедры естественно-математических дисциплин, ГБУ ДПО ЧИППКРО |
| Урок 2. Обобщение знаний. Электроотрицательность. Степень окисления | Химия 9 класс | 30 минут | Пяткова Ольга Борисовна, старший преподаватель кафедры естественно-математических дисциплин, ГБУ ДПО ЧИППКРО |
| Окислительно-восстановительные реакции в природе, производственных процессах и жизнедеятельности организмов | Химия 11 класс | 30 минут | Пяткова Ольга Борисовна, старший преподаватель кафедры естественно-математических дисциплин, ГБУ ДПО ЧИППКРО |
| Свойства простых веществ – металлов главных и побочных подгрупп | Химия 11 класс | 30 минут | Пяткова Ольга Борисовна, старший преподаватель кафедры естественно-математических дисциплин, ГБУ ДПО ЧИППКРО |
6 апреля 2020 г. | |||
| Свойства, получение и применение углерода. Синтез-газ как основа современной промышленности | Химия 11 класс | 30 минут | Пяткова Ольга Борисовна, старший преподаватель кафедры естественно-математических дисциплин, ГБУ ДПО ЧИППКРО |
| Общая характеристика элементов IVА-группы | Химия 11 класс | 30 минут | Пяткова Ольга Борисовна, старший преподаватель кафедры естественно-математических дисциплин, ГБУ ДПО ЧИППКРО |
| Периодическая система химических элементов Д.И. Менделеева. Строение атома и вещества. | Химия 9 класс | 30 минут | Пяткова Ольга Борисовна, старший преподаватель кафедры естественно-математических дисциплин, ГБУ ДПО ЧИППКРО |
| Классификация химических реакций по различным признакам. Скорость химической реакции | Химия 9 класс | 30 минут | Пяткова Ольга Борисовна, старший преподаватель кафедры естественно-математических дисциплин, ГБУ ДПО ЧИППКРО |
Вихревой электролиз.
 Как это работает?
Как это работает?В современном мире все больше внимания уделяется вопросам рационального использования природных ресурсов и повышению экологической безопасности промышленных предприятий, в том числе предприятий по добыче и обогащению меди, никеля, кобальта, олова, цинка и некоторых драгоценных металлов. Компания emew Corporation (Ванкувер, Канада) в 1992 году разработала и запатентовала уникальную и передовую технологию «вихревого» электролиза, при которой рабочий раствор прокачивается между катодом и анодом под определенным давлением в закрытой системе. При этом все параметры процесса контролируются датчиками системы emew Net, благодаря чему достигается максимальная скорость извлечения металла.
Благодаря повышенному массопереносу увеличивается общее количество извлекаемого металла из раствора, вследствие чего значительно снижается его концентрация в растворе после процесса электролиза.
Применение заводов и технологии emew возможно как в качестве основной производственной системы, так и в качестве встраиваемой технологии в существующее производство.
На примере получения катодной меди, можно выделить следующие преимущества заводов и уникальной технологии emew:
- увеличение общих объемов извлекаемой меди в сравнении со стандартным обменным процессом, а значит получение дополнительной прибыли;
- производство товарной катодной меди высокой степени чистоты (>99,99%) в соответствии с требованиями Лондонской биржи металлов;
- снижение содержания меди в растворе после процесса электролиза – до 1 г/л в сравнении с более чем 20-30 г/л после стандартного обменного процесса;
- в связи со снижением содержания меди в сернокислом растворе, при его возврате в процесс кучного выщелачивания, повышается эффективность выщелачивания и увеличивается общее количество извлекаемой дополнительной меди из кучи;
- снижение добавляемых объемов серной кислоты, а значит дополнительное снижение затрат;
- закрытые электролизеры, отсутствие испарений кислоты, значительная экономия средств на проектировании, внедрении и обслуживании системы вентиляции.
 Снижение затрат на средства защиты для персонала;
Снижение затрат на средства защиты для персонала; - повышение экологической безопасности;
- низкие эксплуатационные расходы, снижение трудовых затрат;
- постоянный контроль за содержанием примесей;
- срок окупаемости <12 месяцев против >2 лет окупаемости завода стандартного обменного процесса.
При соблюдении определенных условий применение технологии emew возможно без предварительной подготовки рабочего раствора. Но при наличии некоторых примесей, для повышения эффективности использования emew существует ряд дополняющих технологий, таких как выщелачивание, жидкостная экстракция, ионный обмен.
За 26 лет существования, компания emew установила на 6 континентах более 65 заводов по извлечению цветных металлов. Дополнительная информация представлена на сайте https://ru.emew.com
С уважением к Вам и Вашему делу,
Директор по развитию в странах СНГ
Виталий Викторович Ковалев
email: Адрес электронной почты защищен от спам-ботов.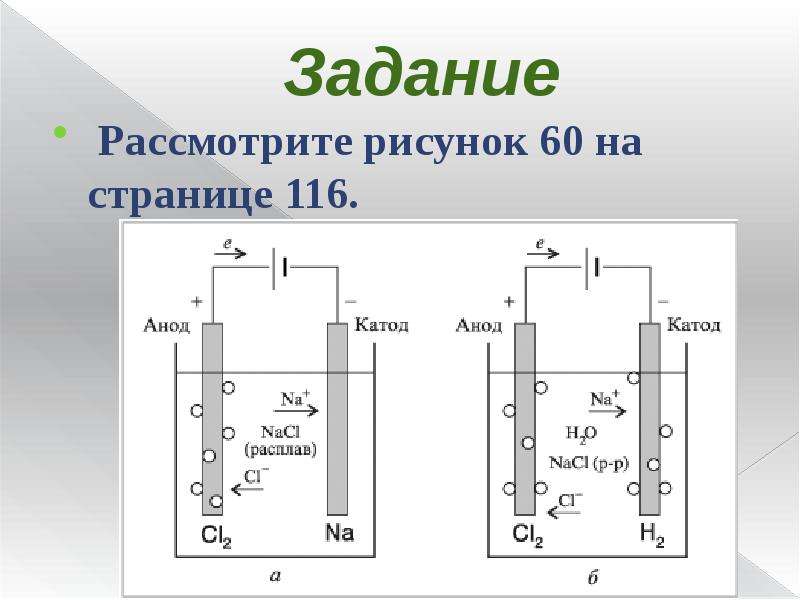 Для просмотра адреса в вашем браузере должен быть включен Javascript.
Для просмотра адреса в вашем браузере должен быть включен Javascript.
моб.: +375447979907 / telegram/ whatsapp/ viber
www.emew.com
Производство хлорщелочной продукции | Химическая цепочка (деловая деятельность и продукты) | «AGC Chemicals» – Информация
Компания «AGC Chemicals» поставляет хлорщелочные продукты, в основу рецептуры которых входит щелочная сода и полученные электролизом производные хлора. Помимо широкого использования этих продуктов в качестве сырья для многих химикатов, они также нашли применения в самых разных отраслях промышленности и тесно связаны с жизнью каждого человека..
- Крупнейший производитель едкого натра в Юго-Восточной Азии
- В дополнение к тому, что компании принадлежит большая доля внутреннего рынка в Японии, мы уже давно работаем на международном рынке и ввели в эксплуатацию заводы электролиза в Таиланде в 1960-х годах, а в Индонезии в 1980-х. В настоящее время мы установили свое присутствие в качестве крупнейшего поставщика едкого натра в Юго-Восточной Азии.
 Более того, реагируя на недавно выросший спрос на общем рынке Юго-Восточной Азии, мы укрепили свое присутствие в Индонезии, а в 2014 г. создали филиал с крупным вьетнамским производителем ПВХ
Более того, реагируя на недавно выросший спрос на общем рынке Юго-Восточной Азии, мы укрепили свое присутствие в Индонезии, а в 2014 г. создали филиал с крупным вьетнамским производителем ПВХ
- Процессы электролиза входят в число самых чистых и самых экологичных процессов на мировом рынке
- Мы производим едкий натр и хлор, пользуясь процессом с разработанными нашей компанией ионообменными мембранами “Flemion™”. По сравнению с традиционным ртутным и диафрагменным процессами, в которых используется асбест, в ионообменном мембранном процессе не только не применяются опасные вещества, но он также сберегает энергию и является самым чистым и экологичным электролизным процессом в мире.
- Поставка ключевых продуктов, поддерживающих жизни людей
- Едкий натр и хлор, получаемые электролизом соленой воды, являются базовыми продуктами в химической промышленности, а также сырьем для многочисленных химических продуктов.
 Гипохлорит натрия, получаемый из едкого натрия и хлора, применяется для обеззараживания в системах водоснабжения и канализации, являющихся одной из ключевых составляющих инфраструктуры, поддерживающей наше общество. Кроме того, бикарбонат натрия, производимый с едким натром как сырье, имеет самые разные виды использования, тесно переплетающиеся с обиходом людей: примером здесь служат фармацевтические продукты типа растворов для искусственных диализаторов, пищевые добавки, такие как разрыхлители теста, а также сырье для ванных добавок.
Гипохлорит натрия, получаемый из едкого натрия и хлора, применяется для обеззараживания в системах водоснабжения и канализации, являющихся одной из ключевых составляющих инфраструктуры, поддерживающей наше общество. Кроме того, бикарбонат натрия, производимый с едким натром как сырье, имеет самые разные виды использования, тесно переплетающиеся с обиходом людей: примером здесь служат фармацевтические продукты типа растворов для искусственных диализаторов, пищевые добавки, такие как разрыхлители теста, а также сырье для ванных добавок.
деловая деятельность и продукты
Как электролиз используется в промышленности?
Как электролиз используется в промышленности?Применение электролиза в промышленности:
Электролиз имеет множество промышленных применений. Наиболее распространены следующие приложения:
- Добыча металлов
- Очистка металлов
- Гальваника металлов
- Металлы с высокой реакционной способностью могут быть извлечены из руд только электролизом.
- Примеры включают извлечение алюминия из расплавленного оксида алюминия и натрия из расплавленного хлорида натрия.
Добыча алюминия:
- Алюминий извлекается из руды боксита, содержащего оксид алюминия, Al 2 O 3 .
- На рисунке показана электролитическая ячейка, используемая для извлечения алюминия.
- Оксид алюминия смешан с криолитом, Na 3 AlF 6 .Криолит добавляют для понижения температуры плавления оксида алюминия (2045 ° C) примерно до 900 ° C.
- Угольные блоки действуют как аноды, тогда как углеродная футеровка ячейки действует как катод.
- На катоде ионы алюминия разряжаются с образованием металлического алюминия.
Al 3+ (l) + 3e – → Al (l)
Жидкий алюминий более плотный, чем электролит, и собирается на дне ячейки. - На аноде ионы оксида выделяются с образованием газообразного кислорода.

2O 2- (л) → O 2 (г) + 4e – - Общая химическая реакция:
2Al 2 O 3 (л) → 4Al (л) + 3O 2 (г) - Кислород, выделяющийся на аноде, реагирует с угольным электродом с образованием газообразного диоксида углерода.
C (s) + O 2 (g) → CO 2 (g)
Следовательно, анод медленно корродирует, и его необходимо время от времени заменять.
Извлечение натрия:
- Натрий извлекается из расплавленного хлорида натрия NaCl.
- На рисунке показана электролитическая ячейка, используемая для извлечения натрия.
- Хлорид натрия смешан с хлоридом кальция, CaCl 2 . Хлорид кальция добавляют для понижения температуры плавления хлорида натрия (900 ° C) примерно до 600 ° C.
- Катод изготовлен из стали, а анод – из графита.
- На катоде ионы натрия разряжаются с образованием металлического натрия.

Na + (л) + e – → Na (л) - На аноде ионы хлора выделяются с образованием газообразного хлора.
2Cl – (л) → Cl 2 (г) + 2e – - Общая химическая реакция:
2NaCl (л) → 2Na (л) + Cl 2 (г)
Люди также спрашивают
Очистка меди электролизом- Металлы, извлеченные из руд, могут содержать другие металлы в качестве примесей. Для очистки этих металлов можно использовать электролиз.
- При очистке металлов нечистый металл используется в качестве анода, а чистый металл – в качестве катода.
- Используемый электролит представляет собой водный раствор соли металла.
Для очистки металла,
- Нечистый металл – анод.
- Катод выполнен из чистого металла.
- Электролит представляет собой раствор ионов металлов.
Цель: Изучить очистку меди.
Постановка проблемы: Как можно использовать процесс электролиза для очистки меди?
Гипотеза: Когда нечистая медь используется в качестве анода, а чистая медь используется в качестве катода во время электролиза раствора сульфата меди (II), нечистая медь может быть очищена.
Переменные:
(a) Управляемая переменная: Положения чистой меди и нечистой меди в качестве электродов
(b) Реагирующая переменная: Отложение меди на пластине из чистой меди
(c) Контролируемые переменные: Тип электролита, концентрация электролита, продолжительность электролиза
Материалы: 1 моль дм -3 Раствор сульфата меди (II), пластина из нечистой меди и пластина из чистой меди.
Аппарат: Батарейки, 250 см 3 стакан, соединительные провода с зажимами типа «крокодил», амперметр и выключатель.
Процедура:
- Стакан наполовину заполнен раствором сульфата меди (II) объемом 1 моль дм.
 -3 .
-3 . - Устройство настроено, как показано на рисунке, с использованием пластины из нечистой меди в качестве анода и пластины из чистой меди в качестве катода.
- Переключатель включен, чтобы позволить электрическому току проходить через электролит в течение 40 минут.
- Регистрируются изменения на аноде и катоде.
- Шаги с 1 по 4 повторяются с использованием нечистой меди в качестве катода и чистой меди в качестве анода.
Наблюдения:
| Электрод | Наблюдение | ||
| Анод | Катод | Анод | Катод |
| Неочищенная медь | Чистая медь | Загрязненный медный электрод растворяется в растворе. Анод становится тоньше. | Электрод из чистой меди становится толще. |
| Чистая медь | Неочищенная медь | Электрод из чистой меди растворяется в растворе. Анод становится тоньше. | Загрязненный медный электрод становится толще. |
Обсуждение:
- Во время электролиза с использованием нечистой меди в качестве анода и чистой меди в качестве катода нечистая медная пластина растворяется, и загрязнения падают на дно стакана.
Cu (s) → Cu 2+ (водн.) + 2e –
Ионы меди (II) разряжаются на пластине из чистой меди.На пластину из чистой меди нанесен слой меди.
Cu 2+ (водн.) + 2e – → Cu (s)
Происходит очистка меди. - Во время электролиза с использованием чистой меди в качестве анода и нечистой меди в качестве катода пластина из чистой меди растворяется, а медь осаждается на пластине из нечистой меди. Очистки от меди не происходит.
Заключение:
Очистка меди происходит, когда анодом является грязная медь, а катодом – чистая медь. Электролит – раствор сульфата меди (II). Гипотеза принята.
Электролит – раствор сульфата меди (II). Гипотеза принята.
- Гальваника – это процесс нанесения слоя металла на другое вещество с помощью электролиза.
- Объекты имеют гальваническое покрытие , чтобы защитить их от коррозии и придать им привлекательный внешний вид .
- Гальванизировать предмет металлом,
- покрываемый объект должен стать катодом.
- анод будет чистым металлическим покрытием.
- электролит должен содержать ионы металла покрытия.
- Условия, которые должны быть выполнены для покрытия хорошего качества , следующие:
- Металлический объект, подлежащий покрытию, должен быть чистым и обезжиренным.
- Концентрация ионов металлического покрытия должна быть низкой.
- Электрический ток должен быть небольшим.
- Покрываемый объект должен постоянно поворачиваться.

Преимущества электролиза в промышленности следующие:
- Химически активные металлы могут быть извлечены электролизом.
- С помощью электролиза на объект можно нанести очень тонкий слой металла.
- Можно использовать электролиз для получения очень чистого металла. Например, медь может быть очищена электролизом до 99,98%.
Недостатки электролиза заключаются в следующем.
- Электролиз может вызвать загрязнение.
- Электролиз – дорогостоящий процесс, поскольку требует большого количества энергии.
Цель: Изучить гальваническое покрытие медью железной ложки.
Постановка задачи: Как можно покрыть металлическую ложку медью посредством электролиза?
Гипотеза: Когда железная ложка используется в качестве катода, а металлическая медь используется в качестве анода во время электролиза раствора сульфата меди (II), железная ложка может быть покрыта медью.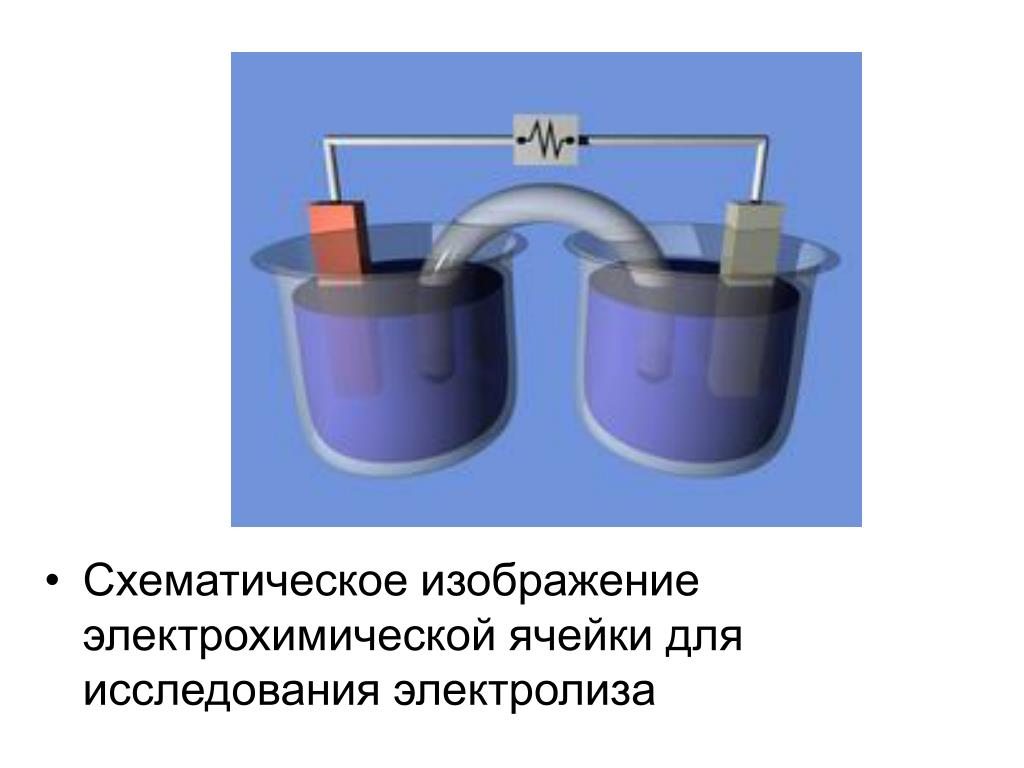
Переменные:
(a) Управляемая переменная: положение железной ложки как электрода
(b) Реагирующая переменная: осаждение меди на железной ложке
(c) Контролируемые переменные: тип электролита, концентрация электролита, продолжительность электролиза
Материалы: 1 моль дм -3 раствор сульфата меди (II), медный электрод, железная ложка и наждачная бумага.
Аппарат: Батарейки, 250 см 3 стакан, соединительные провода с зажимами типа «крокодил», амперметр, переключатель и реостат.
Процедура:
- Железную ложку зачищаем наждачной бумагой. Железную ложку промывают моющим средством, а затем тщательно ополаскивают водой.
- Стакан на две трети заполнен раствором сульфата меди (II).
- Устройство установлено с использованием железной ложки в качестве катода и медного электрода в качестве анода, как показано на рисунке.
- Переключатель включен, и ток с помощью реостата устанавливается на 0,2 А.

- Ток отключается через 30 минут.Рисунок Гальваника
- Железную ложку вынимают из электролита и сушат. Затем регистрируется замена железной ложки.
- Шаги с 1 по 6 повторяются с использованием меди в качестве катода и железной ложки в качестве анода.
Наблюдения:
| Анод | Катод | Наблюдение |
| Медь | Ложка железная | На железную ложку оседает коричневое твердое вещество.Медный электрод становится тоньше. |
| Ложка железная | Медь | На железной ложке не осталось коричневого твердого вещества. Медный электрод становится толще. |
Обсуждение:
- Во время электролиза с использованием меди в качестве анода и железной ложки в качестве катода медный анод растворяется с образованием ионов меди (II).
Cu (s) → Cu 2+ (водн.) + 2e –
На катоде металлическая медь осаждается на поверхности железной ложки.
Cu 2+ (водн.) + 2e – → Cu (s)
Происходит гальваническое покрытие железной ложки медью. - Во время электролиза с использованием железной ложки в качестве анода и меди в качестве катода, анод растворяется, а медь осаждается на медном катоде. Гальваника железной ложки медью не происходит.
Заключение:
Гальваническое покрытие железной ложки медью происходит, когда катод является железной ложкой, а анод – медью.Электролит – раствор сульфата меди (II). Гипотеза принята.
Топ-7 применений электролиза | Отрасли
Основными практическими применениями электролиза являются: 1. Извлечение металлов 2. Рафинирование металлов 3. Производство химикатов 4. Гальваника 5. Электротипирование 6. Электроформование 7. Электроочистка.
Заявка № 1. Добыча металлов:Существует два метода извлечения металла в зависимости от физического состояния руды.В первом методе руда обрабатывается сильной кислотой для получения соли, и раствор такой соли подвергается электролизу для высвобождения металла. Во втором процессе руда находится в расплавленном состоянии и подвергается электролизу в печи.
(i) Добыча цинка:
Цинковая руда обрабатывается серной кислотой. Полученный в результате раствор сульфата цинка затем подвергается электролизу. В электролитической ванне катоды из алюминия, а аноды из свинца.Плотность тока поддерживается 1000 А / м 2 , а на катоде осаждается цинк. Потребление энергии составляет от 3000 до 5000 кВт / ч на тонну.
(ii) Извлечение алюминия:
Руды алюминия бокситовые и криолитовые. Их подвергают химической обработке и восстанавливают до оксида алюминия, а затем растворяют в плавленом криолите и подвергают электролизу в печи. Алюминий оседает на катоде и оседает на дне. Для поддержания электролита в расплавленном состоянии температура печи составляет около 1000 ° C.Для завершения процесса необходим ток около 4000 ампер, а потребляемая энергия составляет от 20 000 до 25 000 кВтч на тонну.
Заявка № 2. Рафинирование металлов:Основные преимущества извлечения металла электролитическими процессами заключаются в том, что чистота получаемого продукта составляет от 98 до 99%. Дальнейшее рафинирование осуществляется электролизом. Анод изготовлен из добытого металла. На катоде осаждается чистый металл. Электролит состоит из металлического раствора e.г. для меди это сульфат меди, а для никеля – хлорид никеля. Потребление энергии при рафинировании меди электролитическим способом составляет от 150 до 300 кВтч на тонну рафинированной меди.
Информация о рафинировании металлов приведена в следующей таблице:
Заявка № 3. Производство химикатов:Многие химические вещества, такие как каустическая сода (NaOH), хлор и т. Д., Производятся электролизом в больших масштабах.Пермаганат калия, водород и кислород и т. Д. Также производятся электролизом в больших масштабах.
Заявка № 4. Гальваника:Это процесс покрытия изделий из дешевых металлов тонким покрытием из драгоценных металлов, таких как железо, хром никель, серебро или золото, с одной или несколькими из следующих целей обзора:
и. Защита металлов от коррозии.
ii. Придает изделиям блеск.
iii. Придание отражателям отражающих свойств.
iv. Замена тренировочного материала.
Заявка № 5. Электронный ввод:Это процесс, с помощью которого типы распилов дерева и т. Д. Воспроизводятся в меди с помощью процесса гальваники. В этом процессе сначала изготавливается форма из воска, затем она покрывается черным свинцом, чтобы придать ей металлическую поверхность, а затем подвергается процессу электроосаждения. Таким образом, на подготовленной поверхности образуется пленка меди.
Заявка № 6. Электроформование:Это еще одно применение электроосаждения. Воспроизведение объектов с помощью электроосаждения на какой-либо форме или форме известно как электроформование.
При воспроизведении монет, моллей, гравюры и т. Д. Пресс-форма сначала изготавливается путем оттиска предмета, например, воском. Поверхность воска, которая имеет точные отпечатки объекта, покрыта порошкообразным графитом, чтобы сделать его проводящим.Затем форму погружают в электроформовочную ячейку в качестве катода. После получения покрытия желаемой толщины изделие и восковая сердцевина выплавляют из металлической оболочки.
Заявка № 7. Электроочистка:Изделие, подлежащее очистке от масла и смазки, представляет собой катод, а чугунный резервуар или чан заполнен раствором электролита с электролитом, и через раствор пропускается сильный ток. На катоде образуются каустическая сода и водород, который удаляет жир с поверхности изделия.Этот процесс называется катодной очисткой и применим к цинку и алюминию. Для анодной очистки изделие изготавливается анодным.
применений электролиза в промышленности | Мини-химия
Гальваника
Гальваника используется для покрытия одного металла другим металлом с помощью электролиза. Гальваника обычно выполняется для улучшения внешнего вида металла или предотвращения коррозии металла.
Хромирование предотвращает ржавление железа.
Катод – это объект, который нужно покрыть, а анод – это желаемый металл для покрытия объекта. Раствор электролита должен содержать ионы того же металла, что и покрытие. Во время электролиза анод растворяется в растворе. Образовавшиеся ионы будут мигрировать к катоду, где они разряжаются и осаждаются в виде слоя на катоде.
Важно убедиться, что катод электрически проводящий. (В противном случае электролиз не работает.{-} долларов США
Добыча химически активных металлов
Химически активные металлы – это металлы, занимающие верхние позиции в электрохимическом ряду. Металлы с более высоким содержанием, чем цинк в электрохимическом ряду, извлекаются с помощью электролиза. Эти очень химически активные металлы не могут быть извлечены другими металлами, такими как восстановление углеродом. Химически активные металлы получают путем электролиза расплавленного ионного соединения металла.
Пример: добыча алюминия
Алюминий извлекается из оксида алюминия ($ Al_ {2} O_ {3} $) или известен как боксит.{-}
долларов СШАИоны алюминия разряжаются на катоде, образуя лужу расплавленного алюминия на дне резервуара.
При высокой температуре кислород реагирует с угольным анодом с образованием газообразного диоксида углерода. Следовательно, аноды медленно сгорают в виде углекислого газа и требуют частой замены.
CSEC Химия: промышленное применение электролиза
Электролиз имеет множество коммерческих применений, например:
извлечение химически активных металлов, таких как алюминий, из их руд или соединений
анодирование алюминия
извлечение активных неметаллов, таких как в виде галогенов
гальваника (включая хромирование и никелирование)
электрорафинирование (включая получение чистой меди из загрязненного образца
Такие процессы, как анодирование и цинкование, улучшают внешний вид металла или предотвращают коррозию. Коррозия возникает, когда металл вступает в реакцию с веществами в окружающей среде с образованием оксидов, а иногда и сульфидов, карбонатов и гидроксидов.
Анодирование алюминия
Анодирование – это процесс, при котором алюминий покрывается толстым защитным слоем из оксида алюминия посредством электролиза. При контакте с воздухом алюминий соединяется с кислородом с образованием оксида алюминия (Al2O3) . Этот оксид образует покрытие на внешней стороне металла, которое защищает его от дальнейшей коррозии.Электролиз используется для увеличения толщины и прочности этого оксидного слоя.
При анодировании алюминий используется в качестве анода электролитической ячейки, содержащей d илутосерную кислоту (или разбавленную хромовую (VI) кислоту) в качестве электролита . Однако можно использовать любой электролит, который выделяет кислород на аноде.
Реакция на аноде следующая:
4OH⁻ → 2H₂O (l) + O₂ + 4e⁻
Таким образом, выделившийся кислород соединяется с алюминиевым анодом, покрывающим его оксидом.Внешний слой также может впитывать красители.
Гальваника
Гальваника включает покрытие металла другим слоем посредством электролиза. Обычно внешний слой представляет собой менее химически активный металл. Гальваника металлических объектов служит нескольким целям, в том числе:
для улучшения внешнего вида покрытого объекта
для защиты покрытого металлического объекта от коррозии
для предотвращения использования больших количеств дорогих металлов для этого объекта
Во время гальваника, покрываемый объект используется как катод (отрицательный электрод) , а чистый металлический слой покрытия используется как анод . Электролит также должен содержать иона металла покрытия.
При гальванике ионы переходят в раствор с анода из чистого металла, разряжаются и осаждаются тонким слоем на катоде.
Электролитическое рафинирование
Рафинирование меди является примером рафинирования металлов посредством электролиза (электрорафинирования).
Электролит при электрорафинировании меди представляет собой смесь сульфата меди (II) и серной кислоты. Нечистый образец меди используется в качестве анода, а катод представляет собой полоску чистой металлической меди.
Атомы меди покидают анод и входят в электролит в виде ионов. Эти ионы затем разряжаются и осаждаются на катоде. Обычные примеси включают цинк и золото. Цинк потеряет электроны и перейдет в раствор в виде ионов цинка. Другие инертные примеси, такие как золото, собираются на дне анода в виде твердой смеси, известной как анодный шлам .
Определение и использование (поясняется схемой)
Электролиз: определение и применение (поясняется схемой)!
При пропускании электричества через электролиты вы могли заметить в них некоторые изменения.Вы также могли заметить пузырьки газа на электродах, а также изменения в металлических электродах.
Все это указывает на то, что при пропускании электрического тока через электролит происходит химическое изменение. Это химическое изменение называется электролизом. Электролит и электроды, используемые при электролизе, образуют электролитическую ячейку.
Когда электричество проходит через электролит, положительные ионы электролита движутся к катоду (отрицательному электроду), где они приобретают электроны, превращаясь в нейтральное вещество.Отрицательные ионы движутся к аноду (положительному электроду) и отдают электроны, чтобы стать нейтральными.
Если нейтральное вещество в своем естественном состоянии представляет собой газ, он выделяется на электроде. Если это металл, он осаждается на катоде. С образованием нейтральных веществ электролит разлагается. Таким образом, мы можем сказать, что разложение электролита при пропускании через него электричества называется электролизом.
Налейте немного воды в пластиковый или стеклянный сосуд.Добавьте в воду щепотку соли или несколько капель кислоты, например уксуса. Это заставит раствор проводить электричество. Взломайте две ячейки и используйте их угольные стержни в качестве электродов.
Поскольку углерод не вступает в реакцию легко, электроды не меняются во время электролиза. Поместите электроды в раствор и подключите их к батарее на 6 вольт. Вскоре вы увидите пузырьки газа на электродах. Газ, выделяющийся на катоде, представляет собой водород, а на аноде – кислород.Обратите внимание, что на катоде больше пузырьков.
Химическое изменение, происходящее в этой деятельности, называется электролизом воды, при котором вода разлагается на водород и кислород. Сначала вода расщепляется на ионы водорода (H + ) и гидроксида (OH – ). Они теряют заряд, образуя на электродах водород и кислород.
Общая реакция может быть представлена
Понятно, что выделяемый водород вдвое больше кислорода.Вот почему вы видите больше пузырей на катоде. Вы можете использовать электролиз, чтобы сделать электрическую ручку. Растворите немного йодида калия (KI) в растворе крахмала.
Смочите в этом растворе кусок жесткой бумаги и поместите его на оголенный конец проволоки. Подключите этот провод к отрицательной клемме аккумулятора. Используйте провод, подключенный к положительной клемме аккумулятора, чтобы написать на листе бумаги.
В растворе йодид калия состоит из ионов калия и йодида.
КИ → К + + Я –
Когда через раствор пропускается электричество, ионы йода теряют свой заряд, образуя йод.
2l – – 2e – → I 2 (на аноде)
Выделяемый йод образует вещество сине-черного цвета с крахмалом, который действует как «чернила» электрической ручки.
Гальваника :Гальваника – важное применение электролиза.Электрический процесс покрытия недорогого проводника металлом называется гальваникой. Гальваника делается для защиты или украшения.
Например, бамперы автомобилей хромированы для защиты от коррозии. По этой же причине водопроводные краны покрываются никелем или хромом. Утюг, покрытый оловом для предотвращения ржавчины, используется для изготовления «жестяных» банок. «Серебряная» ложка – образец гальваники для украшения.
Для гальваники стальной ложки серебром в качестве электролита используется раствор соли серебра.Ложку и серебряный стержень погружают в электролит и подключают к отрицательной и положительной клеммам батареи соответственно. Положительно заряженные ионы серебра перемещаются к отрицательному электроду (ложке) и образуют на нем серебряный осадок.
Вы можете покрыть медью гальваническую монету в пять рупий или угольный стержень, используя сульфат меди в качестве электролита. Закрепите металлический зажим на монете в пять рупий и подсоедините его к отрицательной клемме аккумулятора. Подключите положительный полюс аккумулятора к толстому медному проводу.Поместите монету и медную проволоку в раствор сульфата меди. Скоро монета покроется медью.
Раствор сульфата меди состоит из ионов меди и сульфата.
CuSO 4 → Cu 2+ + SO 4 2-
Когда через раствор пропускается электричество, положительно заряженные ионы меди движутся к катоду (монета, подключенная к отрицательной клемме батареи). Там ионы меди приобретают электроны и осаждаются в виде металлической меди.
Cu 2+ + 2e – → Cu
Ионы сульфата остаются в растворе. На медном аноде медь переходит в раствор, отдавая два электрона. Таким образом, прочность раствора остается неизменной.
Cu → Cu 2+ + 2e –
Применение электролиза :1. Электролиз используется для извлечения металлов из руд. Например, когда ток пропускается через расплавленный хлорид натрия, натрий осаждается на катоде, а газообразный хлор выделяется на аноде.Алюминий и калий также извлекаются электролизом.
2. Используется для рафинирования некоторых металлов, таких как медь и цинк.
3. Электролиз используется для производства хлора. На подводных лодках кислород, образующийся при электролизе воды, используется для дыхания.
4. Электролиз используется для гальваники многих вещей, которыми мы пользуемся каждый день.
Look4Chemistry: Применение электролиза
1. Гальваника(a) Гальваника, также известная как электроосаждение, процесс для создания тонкого и прочного слоя материала (например, металла) на поверхности с использованием электрического тока .
(b) Получаемое покрытие в первую очередь служит для декоративных целей, защиты от коррозии или улучшения определенных свойств поверхности.
(c) Некоторые из хорошо известных промышленных применений гальваники – это покрытие медью, для соединения печатных плат и хромирование стальных деталей автомобилей.
| Меднение для соединения печатных плат |
| Хромирование легкосплавных дисков на автомобилях |
Ртутный элемент | Мембранный элемент | Мембранный элемент | |
Основное сырье материал | |||
Механизм разделяя \ (\ text {Cl} _ {2} \) и \ (\ text {NaOH} \) | |||
Анод реакция | |||
Катод реакция | |||
Чистота NaOH произведено | |||
Чистота \ (\ text {Cl} _ {2} \) произведено | |||
Энергетика потребление | |||
Окружающая среда удар | |||
Стоимость производство |
Ртутный элемент | Мембранный элемент | Мембранный элемент | |
Основное сырье материал | рассол | рассол | рассол |
Механизм разделения \ (\ text {Cl} _ {2} \) и \ (\ text {NaOH} \) | уменьшение \ (\ text {Na} ^ {+} \) до \ (\ text {Na} \) в \ (\ text {Hg} \) амальгама | использование пористой диафрагма | использование мембраны (в зависимости от заряда) |
Анод реакция | \ (\ text {Cl} ^ {-} \) ионы \ (\ to \) \ (\ text {Cl} _ {2} \) газ | \ (\ text {Cl } ^ {-} \) ионы \ (\ to \) \ (\ text {Cl} _ {2} \) газ | \ (\ text {Cl} ^ {-} \) ионы \ (\ to \) \ (\ text {Cl} _ {2} \) газ |
Катод реакция | \ (\ text {Na} ^ {+} \) ion \ (\ to \) \ (2 \ text {Na} (\ text {Hg}) \) \ (2 \ text {Na} (\ text {Hg}) + 2 \ text {H} _ {2} \ text {O} (\ text {l}) \) \ (\ to \) \ (2 \ text {NaOH} (\ text {aq}) + \ text {H} _ {2} (\ text {g}) \) | \ (2 \ text {Na} ^ {+} (\ text {aq}) + \ text {H} _ {2} \ text {O} (\ text {l}) \) \ (\ to \) \ (2 \ text {NaOH} (\ text {l}) + \ text {H} _ {2} (\ text {g}) \) | \ (2 \ text {Na} ^ {+} (\ text {aq}) + \ text {H} _ {2 } \ text {O} (\ text {l}) \) \ (\ to \) \ (2 \ text {NaOH} (\ text {l}) + \ text {H} _ {2} (\ text { g}) \) |
Чистота NaOH | низкая чистота | средняя чистота низкая концентрация | высокая чистота |
Чистота \ (\ text {Cl} _ {2} \) | высокая чистота | смешанная с \ (\ text {O} _ {2} \) | в смеси с \ (\ text {O} _ {2} \) |
Энергия потребление | высокое | меньше, чем ртутный элемент | низкоэнергетический |
Экологический удар | высокий | ниже, чем ртутный элемент | ниже, чем Диафрагмаи ртутный элемент |
Стоимость производство | дорого | дорого, т.к. товар должен быть очищенный | низкопроизводительный стоимость |
Назовите «сырье» на этапе 1 .{-} (\ text {aq}) \)
Какой ион проходит через мембрану во время этих реакций?
Хлор используется для очистки питьевой воды и воды в плавательных бассейнах. Вещество, ответственное за этот процесс, – слабая кислота, хлорноватистая кислота (\ (\ text {HOCl} \)). Один из способов поместить \ (\ text {HOCl} \) в бассейн – это пропустить через воду газообразный хлор. Приведите уравнение, показывающее, как пузырьки \ (\ text {Cl} _ {2} (\ text {g}) \) через воду создают \ (\ text {HOCl} \).
\ (\ text {Cl} _ {2} (\ text {g}) + \ text {H} _ {2} \ text {O} (\ text {l}) \) \ (\ to \) \ (\ text {HOCl} (\ text {aq}) + \ text {HCl} (\ text {aq}) \)
Обычный способ очистки воды в бассейне – добавление «гранулированного хлора». {-} (\ text {aq}) \)
Добыча алюминия (ESCRS)
Алюминий – широко используемый металл в промышленности, где можно использовать его свойства легкости и прочности.Он используется при производстве таких изделий, как самолеты и автомобили. Металл присутствует в месторождениях бокситов. Боксит представляет собой смесь кремнезема, оксидов железа и гидратированного оксида алюминия (\ (\ text {Al} _ {2} \ text {O} _ {3} \). X \ (\ text {H} _ {2} \ text {O} \)).
Боксит – это порода, содержащая большое количество оксида алюминия (\ (\ text {Al} _ {2} \ text {O} _ {3} \)) и гидроксида алюминия (\ (\ text {Al} (\ текст {OH}) _ {3} \)), а также многие другие минералы, содержащие алюминий. Боксит – самый богатый источник алюминия по сравнению с любой другой распространенной породой и лучшая алюминиевая руда.
Электролиз может использоваться для извлечения алюминия из бокситов. Описанный ниже процесс дает алюминий чистотой 99%:
Алюминий плавится вместе с криолитом (\ (\ text {Na} _ {3} \ text {AlF} _ {6} \)), который действует как электролит.


