Фаза и ноль. Работа и измерения. Особенности
У хозяев дома появляется вопрос: что же такое фаза и ноль? Раньше они не вникали в то, как устроена электропроводка. А теперь понадобилось отремонтировать розетку, заменить лампочку, и хочется все это сделать самому.
Электросеть разделена на два типа: постоянного и переменного тока. Электрический ток является движением электронов в каком-либо направлении. При постоянном токе электроны двигаются в одну сторону, имеют полярность. При переменном токе электроны меняют свою полярность с определенной частотой.
В первую очередь домашнему умельцу нужно соблюдать электробезопасность, а потом уже думать об устранении неисправности. Некоторые пренебрежительно относятся к опасности попасть под действие тока.
Все части под напряжением должны быть защищены изоляцией, клеммы розеток углублены в корпус таким образом, чтобы не было доступа и нельзя было случайно коснуться рукой. Даже конструкция вилки сделана так, что невозможно попасть под напряжение электрического тока, держась рукой за вилку. Мы уже привыкли к электричеству, и не замечаем опасности при проведении работ по ремонту электрических устройств. Поэтому, лучше освежить в памяти правила безопасности и быть внимательными.
Мы уже привыкли к электричеству, и не замечаем опасности при проведении работ по ремонту электрических устройств. Поэтому, лучше освежить в памяти правила безопасности и быть внимательными.
Сеть электрического переменного тока разделена на фазу и ноль (рабочую и пустую). Нулевая фаза предназначена для образования постоянной электросети при включении устройств, а также для создания заземления. На фазе находится рабочее напряжение.
Для работы электроустройства не важно, где находится фаза, а где ноль. При установке электрических проводов и включении ее в сеть дома нужно учитывать, где фаза и ноль. Проводка прокладывается кабелем с двумя или тремя жилами. В кабеле с двумя жилами находится фаза и ноль, а в кабеле с 3-мя жилами третий провод отводится для заземления. Перед работой нужно точно определить расположение выводов проводов.
Электрический ток заходит от подстанции с трансформатором, преобразующим высокое напряжение до 380 вольт.
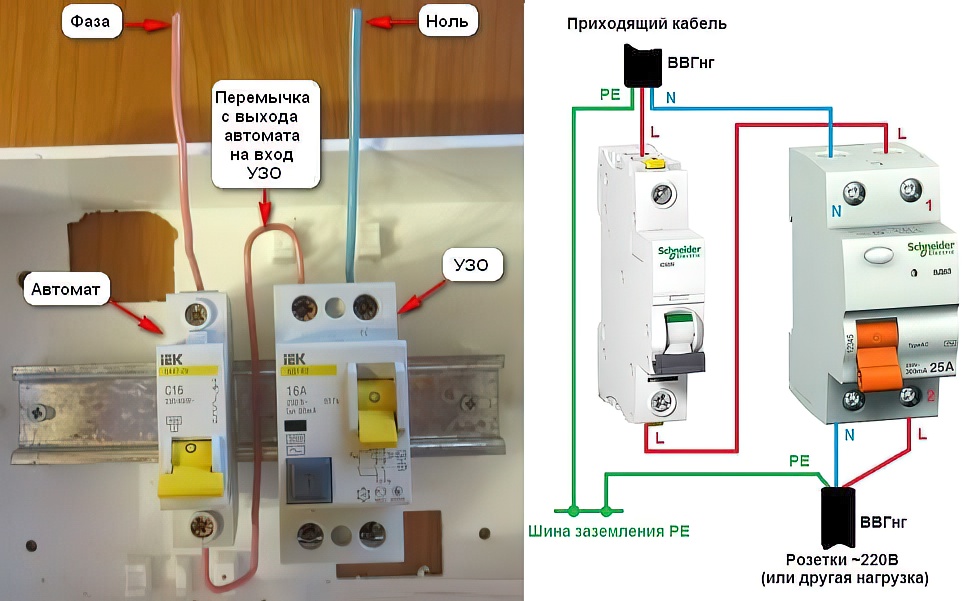 Низкая сторона трансформатора соединена в звезду. Три вывода соединены в нулевой точке, а оставшиеся выводятся на клеммы фаз.
Низкая сторона трансформатора соединена в звезду. Три вывода соединены в нулевой точке, а оставшиеся выводятся на клеммы фаз.Узел в нулевой точке подключается к заземляющему контуру подстанции. Ноль расщепляется на рабочий и защитный. Новые строящиеся дома оснащаются проводкой по такой схеме. На входе дома в щите располагается три фазы и два провода расщепленного ноля.
В старых зданиях остается схема проводки старого типа без расщепленного ноля, там вместо пяти проводов идут 4 жилы. Электрический ток от трансформатора проходит по воздуху или под землей к входному щиту, образует систему из трех фаз (питающая сеть 380) на 220. Производится разводка по щитам подъездов. В квартиру поступает кабель с 1-й фазой на 220 В и защитный провод.
Защитный провод не всегда есть в наличии, если старая проводка не переделана. В квартире нулем называется провод, который соединен с заземляющим контуром на подстанции, применяется для образования нагрузки фазы, которая подключена к противоположному выводу на трансформаторе. Защитный ноль из схемы удален, он служит для устранения неисправностей и аварий для отвода тока при повреждениях.
Защитный ноль из схемы удален, он служит для устранения неисправностей и аварий для отвода тока при повреждениях.
В такой цепи нагрузки распределены равномерно, так как на этажах сделана разводка и выведены щиты к линиям на 220В в распредщите подъезда. Напряжение, подходящее к дому, выполнено звездой. При выключенных в квартире всех устройств и отсутствии нагрузки в розетках, в линии питания тока не будет.
Это является простой рабочей схемой электроснабжения, которая использовалась много лет. Но в любой сети могут возникнуть неисправности, которые связаны с плохими контактами соединений, либо обрывом проводов.
Обрыв проводаПроводник может легко оторваться, или его могут забыть подключить. Это происходит довольно часто, так же, как и могут отгореть провода при некачественном контактном соединении и большой нагрузке. Если в квартире нет соединения потребителя с щитком напряжения, то устройство не будет работать. Какой именно провод разорван, не имеет значения.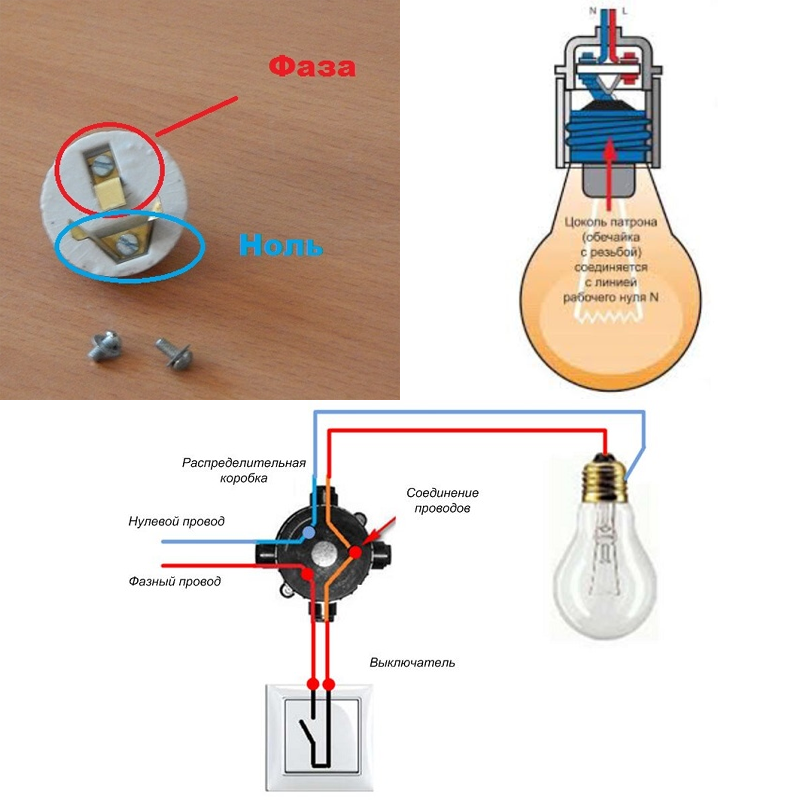 То же самое получается при обрыве провода одной из фаз, которая питает дом или подъезд. Квартиры, питающиеся от этой линии, не будут иметь возможность получать электричество.
То же самое получается при обрыве провода одной из фаз, которая питает дом или подъезд. Квартиры, питающиеся от этой линии, не будут иметь возможность получать электричество.
В двух остальных цепях все устройства будут работать в нормальном режиме, а ток ноля будет складываться из оставшихся составляющих. Все вышеописанные обрывы проводников связаны с выключением питания от квартиры, бытовые устройства при этом не ломаются. Опасным случаем может стать момент, когда исчезнет соединение между средней точкой потребителей щита дома и контуром заземления трансформатора подстанции. Это возникает у электриков, не имеющих достаточной квалификации.
Путь прохода тока через ноль к заземлению исчезает. Ток начинает идти по наружным контурам, имеющим напряжение в 380 В. В результате получается что на нагрузках вместо 220В будет 380В. На одном щите окажется небольшое напряжение, а на втором около 380 В. Высокое значение напряжения повредит изоляцию, нарушит работу устройств, приведет к поломкам и выходу из строя приборов.
Чтобы таких ситуаций не было, применяют защитные устройства для блокировки от повышенного напряжения. Они устанавливаются в щиток квартиры, либо внутри дорогостоящих приборов.
Способы определения где фаза и нольЛюбой домашний мастер при электромонтажных работах дома или в другом месте при подключении розетки или люстры сталкивается с вопросом определения фазы и ноля на проводах. Мы расскажем, какие существуют методы и способы правильного определения фазных проводов, нулевых жил, заземляющих защитных проводов. Конечно, для имеющего опыт в таких электромонтажных работах специалиста не доставит большого труда определить фазу и нулевой провод. Но как быть людям, которые не умеют этого делать?
Разберемся, как можно в домашних условиях без специальных инструментов для измерения и электронных приборов своими силами узнать наличие на проводах где фаза и ноль, заземление.
Во время поломок в сети тока часто домашние умельцы применяют недорогую индикаторную отвертку для проверки наличия напряжения китайского изготовления.
Она действует по закону емкостного тока, проходящего по телу человека. Такая отвертка состоит из следующих деталей:
- Наконечник металлический, заточенный под отвертку, присоединяется к фазе.
- Резистор для ограничения тока, который уменьшает амплитуду тока до небольшой величины.
- Лампочка неоновая, начинает светиться при прохождении тока, показывает наличие фазы на проводнике.
- Площадка для касания пальцем человека, чтобы создавалась цепь тока по телу через землю.
Квалифицированные специалисты применяют для контроля фазы приборы с качественными деталями и имеющими несколько функций, с индикаторами под отвертку, светодиод светится с помощью транзисторной схемы, подключенной от батареек на 3 вольта.
Такие устройства кроме фазы могут решать другие вспомогательные задачи. Они не имеют клеммы для контакта пальцем. Как проверять наличие фазы в розетках индикатором, показано на рисунке.
Днем плохо видно, как светится лампочка, требуется приглядываться. Там, где лампочка светится, есть фаза. На рабочем нуле и защитном заземлении лампочка не будет гореть. Если лампа светится в других случаях, то это говорит о том, что имеются неисправности в схеме.
Там, где лампочка светится, есть фаза. На рабочем нуле и защитном заземлении лампочка не будет гореть. Если лампа светится в других случаях, то это говорит о том, что имеются неисправности в схеме.
Во время работы с такой отверткой нужно проверить исправность ее изоляции, не касаться вывода индикатора без изоляции под напряжением. Также с помощью тестера можно в розетке определить наличие напряжения.
Показания на тестере:
- 220 В между фазой и нолем.
- Нет напряжения между защитным нолем и рабочим.
- Нет напряжения между защитным нолем и фазой.
Последний вариант – это исключение. При нормальной схеме стрелка будет показывать разность потенциалов 220 В. Но в наших розетках его нет, так как здание дома старое, электропроводка не изменялась. После реконструкции электропроводки вольтметр покажет напряжение 220 В.
Особенности нахождения неисправностиСостояние схемы электропроводки не всегда определяется путем обычной проверки напряжения. На выключателях имеется различное положение, которое иногда вводит в заблуждение электрика. На рисунке изображен случай, при выключенном выключателе на проводе фазы светильника нет напряжения при исправной проводке.
На выключателях имеется различное положение, которое иногда вводит в заблуждение электрика. На рисунке изображен случай, при выключенном выключателе на проводе фазы светильника нет напряжения при исправной проводке.
Поэтому, при измерениях в поиске поломок нужно проводить тщательный анализ возможных случаев.
Цветовка проводовОпределить, на какой жиле есть напряжение, а на какой нет, довольно просто. Существует много способов вычисления где находятся фаза и ноль.
Одним из методов является определение по цвету изоляции проводов. Каждая жила в кабеле и в электрооборудовании окрашена цветом изоляции определенной расцветки, определенной стандартом. Зная цвета распределения функциям проводов, можно легко произвести установку электропроводки.
Рабочие фазы подключают проводами с черным цветом изоляции, либо может быть коричневый или серый цвет. Нулевой провод монтируют в светло-синей изоляции. При установке вспомогательного дополнительного заземления применяют проводники с зеленым или желтым цветом изоляции.
Такой способ определения по цвету проводов, фаза и ноль, не является надежным, так как при монтаже электропроводки специалисты не всегда добросовестно соблюдают маркировку проводов по цвету жил.
Похожие темы:
- Активная и реактивная мощность. За что платим и работа
- Закон Ома. Для цепей и тока. Формулы и применение
- Электричество. Электрический ток. Электростанции
- Трехфазные и однофазные сети. Отличия и преимущества. Недостатки
- Ток и напряжение. Виды и правила. Работа и характеристики
- Качество электроэнергии. Показатели и характеристики. Факторы
- Перекос фаз. Причины возникновения и устранение. Защита
Фаза и ноль – что такое, как определить фазу и ноль в электричестве
Далеко не всегда хочется вызывать специалистов при необходимости заменить люстру, повесить бра или дополнительный светильник. Но когда электромонтажными работами занимаешься впервые, так или иначе начинаешь задаваться вопросом, что представляют собой такие понятия как
«ноль» и «фаза».
Разбираться в этих обозначениях необходимо хотя бы для того, чтобы правильно подключить провода. Желательно восполнить пробелы в знаниях об электричестве, при отсутствии опыта в данной сфере, перед началом работ.
Выделяют три обозначения проводов:
- фаза
- ноль
- заземление
Определить, какой кабель в розетке или осветительном приборе к чему относится, можно подручными средствами или по цвету. Под понятием «ноль», как правило, подразумевают «рабочий ноль», «фаза» – «фазные провода», а под «заземлением» – «защитный ноль».
Профессиональные электрики могут различать кабели с первого взгляда. А вот для рядового человека различать данные обозначения немного сложно. Тем более что специальные инструменты, позволяющие определить, где фаза и ноль, имеются далеко не у всех.
В реальности способов распознания проводов не так уж и много. А безопасных – еще меньше. Поэтому чаще всего определяют кабели по цвету.
А безопасных – еще меньше. Поэтому чаще всего определяют кабели по цвету.
Маркировка кабелей по цвету
Это один из наиболее простых методов. Чтобы определить, что такое фаза и ноль по цвету, необходимо четко знать какие оттенки и чему соответствуют. Можно воспользоваться информацией о принятых в стране стандартах.
Не секрет, что каждый провод имеет индивидуальный цвет. Поэтому распознавание нуля не должно составлять особых проблем. Полученные знания позволят легко справиться с монтажом осветительного прибора или установкой розетки.
Особенно актуален этот способ для новостроек. Ведь там, как правило, провода протягиваются опытными специалистами, которые четко соблюдают нормы и стандарты. Принятый на территории Российской Федерации в 2004 году стандарт IEC 60446 жестко регламентирует разделение фазы, заземления и нуля по цвету.
Стоит учесть, что:
- если провод имеет синий либо сине-белый оттенок, можно смело говорить о том, что это – рабочий ноль
- защитный ноль представлен кабелями в желто-зеленой оболочке
-
другие цвета характерны для фазы.

Такое обозначение успешно применяется в большинстве случаев. Но если проводка старая, или есть сомнения в профессионализме электриков, целесообразнее пользоваться дополнительными методами.
Самостоятельное определение фазы и ноля при помощи подручных средств
Специалисты рекомендуют для облегчения определения проводов начинать именно с распознавания фазы. Этот способ можно использовать совместно с предыдущим (по цвету).
Индикаторная отвертка непременно найдется в арсенале каждого домашнего мастера. Она необходима как для проведения комплекса работ по электромонтажу, так и при элементарной замене ламп либо установке осветительных приборов.
Метод до смешного прост. При касании жалом индикаторной отвертки провода определенного цвета, находящегося под напряжением, и одномоментного прикосновения контакта на инструменте, должен загореться индикатор.
Определение при помощи этого метода строится на том, что внутри инструмента располагается лампочка и резистор (сопротивление). Когда электрическая цепь замыкается, загорается сигнал. Именно наличие в индикаторной отвертке сопротивления и позволяет производить процедуру совершенно безопасно для человека, способствуя снижению тока до минимальных значений.
Метод определения фазы и ноля при помощи контрольной лампы
Этот способ подразумевает использование контрольной лампы для определения проводов определенного цвета в трехпроводной сети. Применять данный метод следует с особой осторожностью.
Применение этого метода подразумевает создание контрольной лампы. Для этого в патрон вкручивается обычная лампочка. В клеммах патрона размещаются провода, на концах которых отсутствует изоляция. При отсутствии возможности создать такую конструкцию допустимо использовать традиционную настольную лампу, оснащенную электрической вилкой.
Стоит отметить, что использование данного метода позволяет определить, присутствует ли среди пары проверяемых проводов фазный. А какой именно из этих двух – фаза, распознать будет непросто. Загорание контрольной лампы означает, что с высокой долей вероятности одни провод – фаза, а другой – ноль.
Отсутствие света говорит о том, что фазный провод среди проверяемых отсутствует. Хотя возможен вариант, что нет именно нуля. Поэтому применение этого метода целесообразно, скорее всего, для определения правильности монтажа и работоспособности проводки.
Определение сопротивления петли фаза-ноль
Для обеспечения нормального функционирования электрических приборов и проверки автоматов необходимо периодически проводить замеры сопротивления петли фаза-ноль. Потому как первоочередными причинами поломок осветительных приборов являются перегрузки сети и короткое замыкание. Измерение сопротивления позволяет в кратчайшие сроки выявить неисправность и предотвратить подобную ситуацию.
Измерение сопротивления позволяет в кратчайшие сроки выявить неисправность и предотвратить подобную ситуацию.
Далеко не все знают, что представляет собой понятие «петля фаза-ноль». Под этой фразой скрывается контур, образованный в результате соединения нулевого провода, находящегося в заземленной нейтрали. Замыкание этой электрической сети образует петлю фаза-ноль.
Измеряют сопротивление в этом контуре следующими методами:
- падением уровня напряжения в отключенной цепи
- падением уровня напряжения в результате сопротивления возрастающей нагрузки
- использованием профессионального инструмента, интерпретирующего короткое замыкание в цепи
Второй способ используется чаще всего, так как отличается удобством, возможностью быстро измерить сопротивление, а также безопасностью.
Клинические испытания фазы 0: концепции и заблуждения
- Список журналов
- Рукописи авторов HHS
- PMC7185299
Рак Дж. Авторская рукопись; доступно в PMC 2020 27 апреля.
Авторская рукопись; доступно в PMC 2020 27 апреля.
Опубликовано в окончательной редакции как:
Рак J. 2008 май-июнь; 14(3): 133–137.
doi: 10.1097/PPO.0b013e318172d6f3
PMCID: PMC7185299
NIHMSID: NIHMS1575547
PMID: 18536551
, MD, * , PhD, † , PhD, ‡ , PhD, ‡ , MD, * , MD, MS, FACP, † , PhD, ‡ , PhD, † , MBA, PhD, † , PhD, ‡ , DVM, PhD, † , MD, PhD, † , MD, * , PhD, * , PhD, † , PhD, † и , MD * †
Информация об авторе Ответы на информацию об авторских правах и лицензиях в клинических испытаниях, разработанных United Phases Disclaimer
1 Недавнее руководство Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) по исследовательским новым лекарственным средствам (IND) предназначено для ускорения клинической оценки новых молекулярных объектов.
Разработка нового противоракового препарата является дорогостоящим, долгосрочным и сопряженным с высоким риском предприятием с частотой неудач более 90%.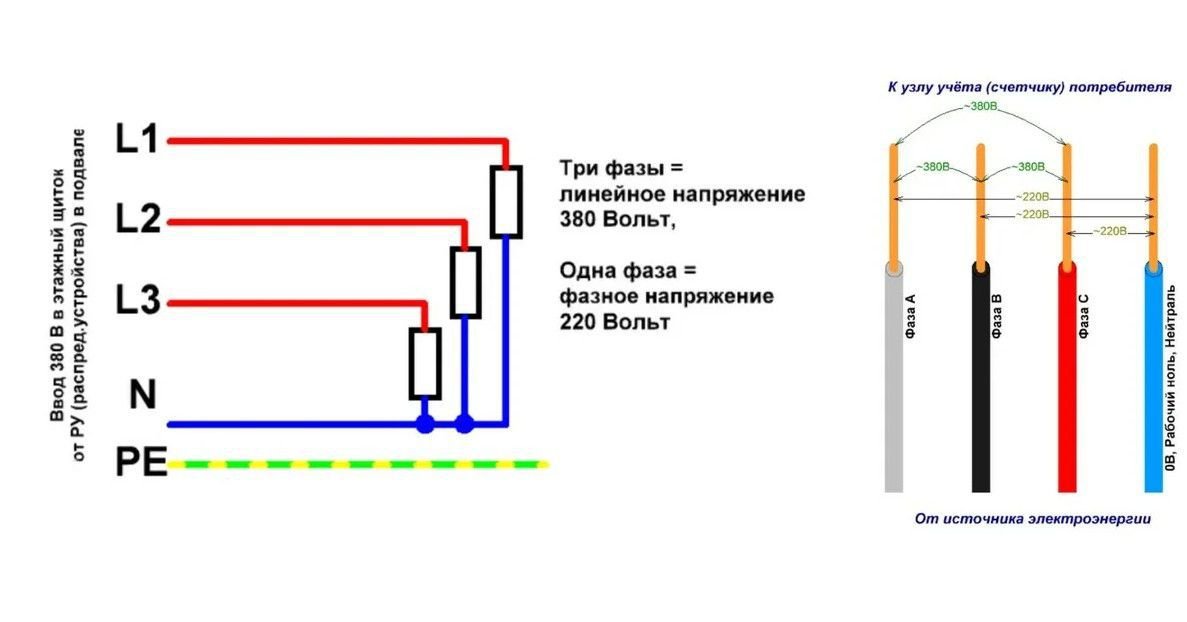 Более половины новых онкологических препаратов терпят неудачу на более поздних стадиях клинической разработки, что увеличивает затраты и время, необходимые для того, чтобы сделать эффективные методы лечения доступными для пациентов. 1,2 Чтобы ускорить открытие и разработку новых молекулярных соединений, в 2006 г. FDA выпустило руководство по исследовательскому новому лекарству (IND) для поддержки клинической оценки перед повышением дозы, исследованиями безопасности и переносимости, связанными с традиционным IND. 3 Цели и конечные точки исследований фазы 0 (или перед фазой I), проводимых в рамках исследовательского IND, могут включать оценку модуляции предполагаемого целевого лекарственного средства у людей; оптимизация методологии анализа мишеней с использованием образцов человека; предоставление фармакокинетических (ФК) данных; оценка ФК/фармакодинамических (ФД) взаимосвязей; и выбор наиболее перспективного ведущего агента из нескольких химических соединений или составов.
Более половины новых онкологических препаратов терпят неудачу на более поздних стадиях клинической разработки, что увеличивает затраты и время, необходимые для того, чтобы сделать эффективные методы лечения доступными для пациентов. 1,2 Чтобы ускорить открытие и разработку новых молекулярных соединений, в 2006 г. FDA выпустило руководство по исследовательскому новому лекарству (IND) для поддержки клинической оценки перед повышением дозы, исследованиями безопасности и переносимости, связанными с традиционным IND. 3 Цели и конечные точки исследований фазы 0 (или перед фазой I), проводимых в рамках исследовательского IND, могут включать оценку модуляции предполагаемого целевого лекарственного средства у людей; оптимизация методологии анализа мишеней с использованием образцов человека; предоставление фармакокинетических (ФК) данных; оценка ФК/фармакодинамических (ФД) взаимосвязей; и выбор наиболее перспективного ведущего агента из нескольких химических соединений или составов.
Основное различие между испытаниями фазы 0 и испытаниями, проводимыми в рамках традиционного IND, заключается в том, что испытания фазы 0 не имеют терапевтической цели. Участникам исследования, которыми могут быть как пациенты, так и здоровые добровольцы, вводят субтерапевтические, но фармакологически активные дозы препарата. Воздействие агента на участников ограничено, но допускается повышение дозы при условии, что конечной точкой не является установление профиля безопасности/токсичности. Поскольку дозы и воздействие лекарств низкие, значительных побочных эффектов, связанных с лекарствами, не ожидается, и FDA разрешает использовать более ограниченные (однократные дозы или короткие курсы) доклинические токсикологические исследования для установления границы безопасности, а не для ограничения дозы. токсичность. Кроме того, из-за небольшого количества исследуемого препарата, необходимого для проведения испытания фазы 0, полномасштабное коммерческое производство клинического уровня надлежащей производственной практики не требуется до начала испытания. Таким образом, испытания фазы 0 могут быть начаты раньше, чем традиционные исследования фазы I, что дает ценную возможность изучить фармакокинетические эффекты и целевые эффекты лекарственного средства у людей намного раньше в клинической разработке агента. Данные, полученные в результате таких пилотных испытаний с участием небольшого числа пациентов, могут служить ориентиром для принятия решений относительно дальнейшей клинической разработки и лучше информировать о дизайне последующих испытаний (2). Данные о ФК и ФД человека помогут ускорить последующие испытания, такие как ускоренные (т. е. с ограниченным уровнем дозы) исследования фазы I, испытания фазы I, сочетающие таргетные агенты с цитотоксическими препаратами, или испытания фазы I/II. На всех этих последующих этапах для продолжения клинической оценки необходимо подать традиционную заявку IND. В 2007 году авторы провели первую фазу 0 клинических испытаний терапевтического агента в онкологии для оценки ABT-888, ингибитора фермента репарации ДНК поли-АДФ-рибозополимеразы у пациентов с запущенными злокачественными новообразованиями.
Таким образом, испытания фазы 0 могут быть начаты раньше, чем традиционные исследования фазы I, что дает ценную возможность изучить фармакокинетические эффекты и целевые эффекты лекарственного средства у людей намного раньше в клинической разработке агента. Данные, полученные в результате таких пилотных испытаний с участием небольшого числа пациентов, могут служить ориентиром для принятия решений относительно дальнейшей клинической разработки и лучше информировать о дизайне последующих испытаний (2). Данные о ФК и ФД человека помогут ускорить последующие испытания, такие как ускоренные (т. е. с ограниченным уровнем дозы) исследования фазы I, испытания фазы I, сочетающие таргетные агенты с цитотоксическими препаратами, или испытания фазы I/II. На всех этих последующих этапах для продолжения клинической оценки необходимо подать традиционную заявку IND. В 2007 году авторы провели первую фазу 0 клинических испытаний терапевтического агента в онкологии для оценки ABT-888, ингибитора фермента репарации ДНК поли-АДФ-рибозополимеразы у пациентов с запущенными злокачественными новообразованиями. 5–7 Потенциальная ценность исследовательского IND для ускорения разработки традиционных лекарств также была признана благодаря его растущему использованию в фармацевтической промышленности. 8 Это особенно полезно для определения приоритетности потенциальных агентов для дальнейшего изучения на самых ранних этапах процесса клинической разработки.
5–7 Потенциальная ценность исследовательского IND для ускорения разработки традиционных лекарств также была признана благодаря его растущему использованию в фармацевтической промышленности. 8 Это особенно полезно для определения приоритетности потенциальных агентов для дальнейшего изучения на самых ранних этапах процесса клинической разработки.
Открыть в отдельном окне
Сокращение сроков клинической разработки с помощью руководства по поисковым новым лекарственным средствам (IND). Проведение испытания фазы 0 в рамках исследовательского IND может сократить время клинической разработки новых агентов и дать информацию для принятия дальнейших клинических решений. A. Испытания фазы I в рамках традиционного IND требуют серьезных доклинических токсикологических исследований и полномасштабного производства исследуемого агента в соответствии с надлежащей производственной практикой перед клиническим применением. Фармакодинамические (ФД) исследования обычно не проводятся до начала испытаний II фазы. B, Фаза 0 испытаний визуализации/биораспределения вводит субфармакологические дозы нового агента пациентам или здоровым добровольцам. Результаты этих испытаний могут быть достаточными для доказательства принципа, и дальнейшие исследования фазы I повышения дозы могут не потребоваться. Эти визуализирующие исследования можно использовать в качестве коррелятивных исследований в последующих исследованиях терапевтических агентов фазы II/III. C, испытания фазы 0 с конечной точкой PD должны иметь валидированный анализ PD до включения в клиническое исследование. Решение о продолжении дальнейшей клинической разработки и проведении ускоренных испытаний фазы I/фазы I или испытаний фазы I/II может быть принято на основании того, была ли достигнута цель ФД в испытании фазы 0.
B, Фаза 0 испытаний визуализации/биораспределения вводит субфармакологические дозы нового агента пациентам или здоровым добровольцам. Результаты этих испытаний могут быть достаточными для доказательства принципа, и дальнейшие исследования фазы I повышения дозы могут не потребоваться. Эти визуализирующие исследования можно использовать в качестве коррелятивных исследований в последующих исследованиях терапевтических агентов фазы II/III. C, испытания фазы 0 с конечной точкой PD должны иметь валидированный анализ PD до включения в клиническое исследование. Решение о продолжении дальнейшей клинической разработки и проведении ускоренных испытаний фазы I/фазы I или испытаний фазы I/II может быть принято на основании того, была ли достигнута цель ФД в испытании фазы 0.
Исследовательское руководство FDA по IND содержит 3 общих примера клинических испытаний на ранней стадии, которые касаются (1) ФК или визуализации, (2) фармакологически значимых доз и (3) оценки механизма действия агента. В первом примере, предоставленном FDA, исследования предназначены для получения данных о фармакокинетике, но с использованием доз препаратов, не обладающих фармакологическими эффектами; этот пример вводит понятие «микродозирование». Микродозы определяются в руководстве как менее 1/100 от рассчитанной в доклинических токсикологических исследованиях на животных фармакологической активности, но не более 100 мг (или не более 30 нмоль для белковых продуктов). На практике доклинические токсикологические исследования, проведенные в поддержку исследовательского IND, должны продемонстрировать, что доза, в 100 раз превышающая предлагаемую клиническую дозу, не вызывает нежелательных явлений. Для сравнения, начальная доза для первого онкологического исследования на человеке, проводимого в рамках традиционного IND, может составлять 1/10 дозы, которая привела к тяжелой токсичности или смерти у 10% протестированных грызунов. 9 Исследования микродозирования, также называемые скринингом абсорбции, распределения, метаболизма и выделения человека в следовых дозах, включают введение однократной субфармакологической дозы изотопно-меченого препарата для анализа с помощью «сверхчувствительной» ускорительной масс-спектрометрии или позитронно-эмиссионной томографии.
В первом примере, предоставленном FDA, исследования предназначены для получения данных о фармакокинетике, но с использованием доз препаратов, не обладающих фармакологическими эффектами; этот пример вводит понятие «микродозирование». Микродозы определяются в руководстве как менее 1/100 от рассчитанной в доклинических токсикологических исследованиях на животных фармакологической активности, но не более 100 мг (или не более 30 нмоль для белковых продуктов). На практике доклинические токсикологические исследования, проведенные в поддержку исследовательского IND, должны продемонстрировать, что доза, в 100 раз превышающая предлагаемую клиническую дозу, не вызывает нежелательных явлений. Для сравнения, начальная доза для первого онкологического исследования на человеке, проводимого в рамках традиционного IND, может составлять 1/10 дозы, которая привела к тяжелой токсичности или смерти у 10% протестированных грызунов. 9 Исследования микродозирования, также называемые скринингом абсорбции, распределения, метаболизма и выделения человека в следовых дозах, включают введение однократной субфармакологической дозы изотопно-меченого препарата для анализа с помощью «сверхчувствительной» ускорительной масс-спектрометрии или позитронно-эмиссионной томографии. Одна из основных проблем, связанных с исследованиями микродоз, заключается в том, что экстраполяция на терапевтические дозы может быть затруднена из-за наличия нелинейной фармакокинетики; в таких обстоятельствах фармакокинетика, определенная при исследовании микродоз, не является предиктором фармакокинетики агента при клинических уровнях дозы. 10–12
Одна из основных проблем, связанных с исследованиями микродоз, заключается в том, что экстраполяция на терапевтические дозы может быть затруднена из-за наличия нелинейной фармакокинетики; в таких обстоятельствах фармакокинетика, определенная при исследовании микродоз, не является предиктором фармакокинетики агента при клинических уровнях дозы. 10–12
Важно отличать исследования с применением микродоз от исследований с применением фармакологически активных, но субтерапевтических доз. В первых исследованиях измерялись фармакокинетические параметры лекарственного средства, такие как аффинность связывания и абсорбция, распределение, метаболизм и экскреция. Последний, рассматриваемый во втором и третьем примерах руководства FDA, оценивает конкретные, заранее определенные конечные точки ФК и ФД, представляющие особый интерес для разработки онкологических препаратов. Например, во втором примере руководства FDA исследования фазы 0 фармакологически значимых доз могут установить фармакокинетические параметры (такие как пероральная биодоступность) одного или нескольких исследуемых агентов, оценивая пригодность для дальнейшей разработки в дозах, несущих минимальный риск токсичности, связанной с лекарством. . Начальная доза определяется как 1/50 уровня отсутствия побочных эффектов, определенного в 2-недельном токсикологическом исследовании на грызунах. Если негрызуны являются наиболее чувствительным видом, агент-кандидат должен быть исключен из исследовательского IND. Повышение дозы для желаемого воздействия лекарственного средства или модуляции мишени разрешено, но ограничено в руководстве несколькими критериями максимальной дозы, например дозой, при которой впервые измеряется фармакологический эффект или модуляция мишени, или клинически эквивалентной 1/4 от рекомендуемой дозы. отсутствие наблюдаемого уровня побочных эффектов в 2-недельном токсикологическом исследовании на грызунах или 1/2 площади под кривой наиболее чувствительных видов, в зависимости от того, что меньше.
. Начальная доза определяется как 1/50 уровня отсутствия побочных эффектов, определенного в 2-недельном токсикологическом исследовании на грызунах. Если негрызуны являются наиболее чувствительным видом, агент-кандидат должен быть исключен из исследовательского IND. Повышение дозы для желаемого воздействия лекарственного средства или модуляции мишени разрешено, но ограничено в руководстве несколькими критериями максимальной дозы, например дозой, при которой впервые измеряется фармакологический эффект или модуляция мишени, или клинически эквивалентной 1/4 от рекомендуемой дозы. отсутствие наблюдаемого уровня побочных эффектов в 2-недельном токсикологическом исследовании на грызунах или 1/2 площади под кривой наиболее чувствительных видов, в зависимости от того, что меньше.
Третий пример руководства FDA охватывает исследования фазы 0 для оценки механизма действия агента. Эти исследования включают конечную точку PD, которая отражает активность лекарственного средства, такую как ингибирование целевого фермента в суррогатных образцах или образцах опухолевой ткани. Начальная доза для этих исследований соответствует таковой для исследований, измеряющих конечные точки ФК и ФД, и основана на эффективности на животных моделях. Руководство допускает значительную гибкость в дизайне исследования; в недавнем обзоре описывается, как FDA разрешило фармацевтической компании провести испытание фазы 0 с более длительным периодом дозирования, чем максимальные 7 дней, описанные в руководстве. 8
Начальная доза для этих исследований соответствует таковой для исследований, измеряющих конечные точки ФК и ФД, и основана на эффективности на животных моделях. Руководство допускает значительную гибкость в дизайне исследования; в недавнем обзоре описывается, как FDA разрешило фармацевтической компании провести испытание фазы 0 с более длительным периодом дозирования, чем максимальные 7 дней, описанные в руководстве. 8
Поскольку основное внимание в испытаниях фазы 0 уделяется проверке концепции, а не определению дозы, которую необходимо принять для испытаний фазы II на основе токсичности, необходимое количество участников обычно меньше, чем в испытаниях фазы I. только от 10 до 15. Таким образом, планы исследований фазы 0 должны учитывать статистические ограничения клинических исследований с небольшим размером выборки, аналитические характеристики используемого анализа ФД, вариабельность внутри пациента и молекулярную и гистологическую гетерогенность между пациентами при измерении эффектов ФК/ФД как первичные конечные точки. Вопрос изменчивости внутри пациента вызывает особую озабоченность, когда первичная конечная точка получена из инвазивных биопсий опухоли, которые по своей природе не позволяют часто брать образцы тканей. В этом случае эффекты после лечения должны быть измерены в сравнении с вариабельностью конечной точки до лечения, которую можно исследовать у разных пациентов, а не у отдельного пациента, что существенно затрудняет достижение статистической значимости, поскольку вариабельность конечной точки между пациентами по определению выше (часто гораздо больше), чем внутрибольничная вариабельность.
Вопрос изменчивости внутри пациента вызывает особую озабоченность, когда первичная конечная точка получена из инвазивных биопсий опухоли, которые по своей природе не позволяют часто брать образцы тканей. В этом случае эффекты после лечения должны быть измерены в сравнении с вариабельностью конечной точки до лечения, которую можно исследовать у разных пациентов, а не у отдельного пациента, что существенно затрудняет достижение статистической значимости, поскольку вариабельность конечной точки между пациентами по определению выше (часто гораздо больше), чем внутрибольничная вариабельность.
Право пациентов на участие в онкологических исследованиях фазы 0 и фазы I одинаково в том, что опухоли пациентов, вероятно, будут невосприимчивы к терапии, одобренной FDA; однако исследования фазы 0 из-за их ограниченной продолжительности могут также включать пациентов с вялотекущими заболеваниями, такими как хронический лимфолейкоз или фолликулярные лимфомы, для которых стандартная терапия не показана.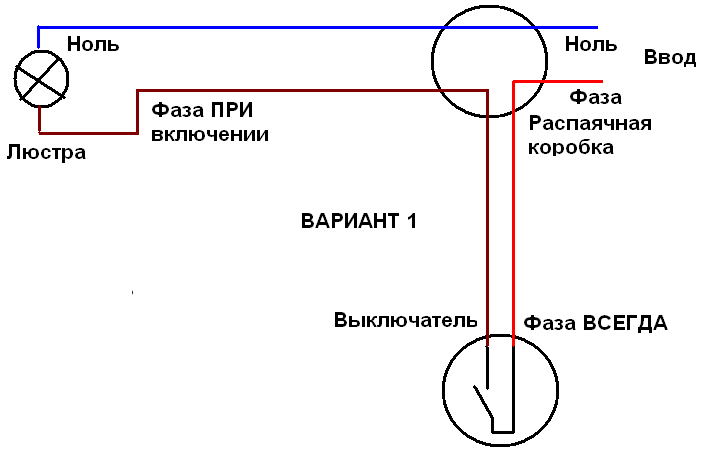 Выбор участия в фазе 0, а не в фазе I, проводимой впервые на людях, требует от пациента понимания того, что в случае исследования фазы 0 терапевтический эффект невозможен.
Выбор участия в фазе 0, а не в фазе I, проводимой впервые на людях, требует от пациента понимания того, что в случае исследования фазы 0 терапевтический эффект невозможен.
Решение об оценке нового исследуемого агента в рамках исследовательского, а не традиционного IND зависит от нескольких факторов. Для агента эти факторы включают низкую токсичность и широкий терапевтический индекс на животных моделях, что позволяет продемонстрировать целевую модуляцию при отсутствии значительных побочных эффектов. 4 Для испытаний фазы 0, оценивающих механизм действия, требуется значительный объем ранее существовавшей информации о молекулярной фармакологии лекарственного средства, а также доступность анализа PD, который может надежно измерять действие лекарственного средства на мишень либо непосредственно в опухоли, либо в суррогатном материале. салфетка. Таким образом, одним из препятствий для проведения исследования фазы 0 является наличие ресурсов для разработки анализа, который был бы достаточно чувствительным, устойчивым и надежным для получения значимых результатов на небольшой исследуемой популяции. 13 Анализ также должен быть клинически осуществим в том смысле, что исследуемый целевой эффект можно наблюдать в доступной ткани. Стандартные операционные процедуры обращения с клиническими образцами и их обработки также необходимо оптимизировать в доклинических моделях до начала испытаний. 14 Короче говоря, клиническая квалификация используемого анализа ФД имеет важное значение; анализ должен обеспечивать высокую степень уверенности в том, что эффект лекарственного средства на предполагаемую мишень может быть точно измерен, и должна быть возможность использовать результаты анализа для надежной поддержки решений о клинической разработке.
13 Анализ также должен быть клинически осуществим в том смысле, что исследуемый целевой эффект можно наблюдать в доступной ткани. Стандартные операционные процедуры обращения с клиническими образцами и их обработки также необходимо оптимизировать в доклинических моделях до начала испытаний. 14 Короче говоря, клиническая квалификация используемого анализа ФД имеет важное значение; анализ должен обеспечивать высокую степень уверенности в том, что эффект лекарственного средства на предполагаемую мишень может быть точно измерен, и должна быть возможность использовать результаты анализа для надежной поддержки решений о клинической разработке.
Некоторые из дополнительных проблем, связанных с использованием конечной точки PD в качестве основной цели в исследовании фазы 0, включают небольшое количество участвующих пациентов, внутри- и межпациентную изменчивость выборки опухоли и суррогатной ткани, различную гистологию опухоли в образце клинического исследования. , и молекулярная гетерогенность в пределах типа опухоли, все из которых могут ограничивать возможность демонстрации статистически значимого эффекта PD в опухоли-мишени или суррогатной ткани. 14,15
, и молекулярная гетерогенность в пределах типа опухоли, все из которых могут ограничивать возможность демонстрации статистически значимого эффекта PD в опухоли-мишени или суррогатной ткани. 14,15
Обычная критика испытаний фазы 0 состоит в том, что они представляют собой эксперименты на людях, в частности, на пациентах с неизлечимой формой рака, которые являются неэтичными, поскольку они не дают прямой терапевтической пользы. В онкологических исследованиях фазы I и фазы 0 участвуют пациенты с запущенными злокачественными новообразованиями, которые не поддаются стандартной терапии. Этические вопросы, связанные с испытаниями фазы I, в том числе уместность и добровольный характер полученного информированного согласия, научная достоверность исследования, а также восприятие и оценка риска/пользы, стали предметом серьезных дискуссий. 16–19 Испытания фазы 0 еще не подверглись такому же тщательному анализу, но присущее им отсутствие терапевтической цели является очевидной этической проблемой.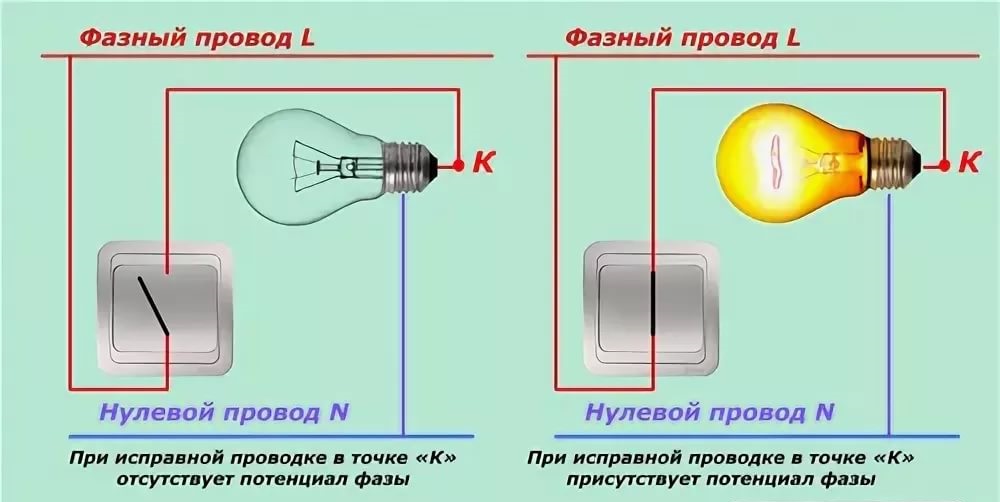 20–22
20–22
Как и во всех исследованиях с участием людей, потенциальные риски должны быть тщательно оценены, прежде чем получить одобрение протокола от Институционального наблюдательного совета, и безопасность пациентов имеет первостепенное значение. Институциональный наблюдательный совет должен гарантировать, что, помимо минимизации рисков, «риски для субъектов являются разумными в отношении ожидаемых выгод, если таковые имеются, и важности знаний, которые можно обоснованно ожидать в результате» (45CFR.46.111). 23 Поэтому оценка соотношения потенциальных рисков и потенциальных преимуществ при отсутствии прямой пользы для пациентов является сложной задачей. Даже при низких дозах и ограниченных схемах дозирования риски не являются незначительными и включают риски, связанные с процедурами биопсии. По нашему опыту, во время разработки протокола и документа о согласии полезны обсуждения с биоэтиками исследования и связанных с ним рисков. В документе о согласии должно быть четко указано отсутствие терапевтических целей, а также необходимость и связанные с этим риски биопсии опухоли. Кроме того, пациенты должны вербализовать свое понимание этих элементов до подписания документа о согласии. Однако стоит отметить, что пациенты с неизлечимыми заболеваниями ценят информацию как о рисках, связанных с исследованием, так и о ценности знаний, которые можно получить в результате их участия. 24 По опыту авторов, большинство пациентов принимали участие в нескольких клинических испытаниях, прежде чем рассматривать исследование фазы 0, и, таким образом, знакомы с концепциями клинических исследований и исследовательских биопсий. Недавний анализ участников онкологических исследований фазы I не выявил когнитивных, медицинских или демографических факторов, которые согласовывались бы со сниженной способностью принимать обоснованные решения. 25 Кроме того, в отличие от этических соображений, связанных с получением исследовательских биопсий в исследованиях фазы I и II, решение пациента участвовать и предоставить образцы биопсии для исследовательских целей в рамках исследования фазы 0 не омрачено никаким представлением о прямой медицинской пользе.
Кроме того, пациенты должны вербализовать свое понимание этих элементов до подписания документа о согласии. Однако стоит отметить, что пациенты с неизлечимыми заболеваниями ценят информацию как о рисках, связанных с исследованием, так и о ценности знаний, которые можно получить в результате их участия. 24 По опыту авторов, большинство пациентов принимали участие в нескольких клинических испытаниях, прежде чем рассматривать исследование фазы 0, и, таким образом, знакомы с концепциями клинических исследований и исследовательских биопсий. Недавний анализ участников онкологических исследований фазы I не выявил когнитивных, медицинских или демографических факторов, которые согласовывались бы со сниженной способностью принимать обоснованные решения. 25 Кроме того, в отличие от этических соображений, связанных с получением исследовательских биопсий в исследованиях фазы I и II, решение пациента участвовать и предоставить образцы биопсии для исследовательских целей в рамках исследования фазы 0 не омрачено никаким представлением о прямой медицинской пользе. . 26,27 Испытание, основной целью которого является предоставление доказательств воздействия лекарственного средства на предполагаемую цель, не может достичь этой цели без анализа, способного измерить эти эффекты. Поэтому важно убедиться, что существует надежный анализ ФД, который мог бы помочь ответить на научный вопрос с высокой степенью достоверности, прежде чем предлагать пациентам пройти инвазивные процедуры биопсии, которые сопряжены с известными рисками. 26–28
. 26,27 Испытание, основной целью которого является предоставление доказательств воздействия лекарственного средства на предполагаемую цель, не может достичь этой цели без анализа, способного измерить эти эффекты. Поэтому важно убедиться, что существует надежный анализ ФД, который мог бы помочь ответить на научный вопрос с высокой степенью достоверности, прежде чем предлагать пациентам пройти инвазивные процедуры биопсии, которые сопряжены с известными рисками. 26–28
Готовность пациентов к сотрудничеству в исследовании, предназначенном исключительно для получения общих знаний, примечательна и проистекает из желания помочь будущим больным раком. Поэтому важно информировать пациентов о результатах исследований и о том, как они повлияли на дальнейшее развитие возбудителя. Также важно обеспечить, чтобы участие в испытании фазы 0 не задерживает и не исключает пациентов из участия в других клинических испытаниях, которые действительно предлагают возможность прямой пользы. Этого можно достичь путем ограничения периода вымывания из предшествующей терапии (например, не более 2 недель) как для включения в исследование фазы 0, так и после завершения исследования перед включением в другое исследование. Кроме того, участие в исследовании фазы 0 не должно исключать пациентов из участия в последующих, более поздних стадиях исследования этого агента; теперь в нескольких протоколах фазы I и II NCI есть общий язык, специально посвященный этой проблеме. Мы надеемся, что этот язык будет широко принят другими центрами исследования рака.
Этого можно достичь путем ограничения периода вымывания из предшествующей терапии (например, не более 2 недель) как для включения в исследование фазы 0, так и после завершения исследования перед включением в другое исследование. Кроме того, участие в исследовании фазы 0 не должно исключать пациентов из участия в последующих, более поздних стадиях исследования этого агента; теперь в нескольких протоколах фазы I и II NCI есть общий язык, специально посвященный этой проблеме. Мы надеемся, что этот язык будет широко принят другими центрами исследования рака.
Испытания фазы 0 могут помочь решить некоторые из наиболее сложных проблем при разработке новых лекарств в онкологии, помогая определить приоритеты потенциальных агентов для будущих исследований, сокращая сроки разработки и демонстрируя целевое ингибирование для проверки концепции. Например, результатов исследования с визуализацией фазы 0 может быть достаточно, чтобы установить доказательство принципа и устранить необходимость в испытании фазы I с повышением дозы; визуализация вместо этого может быть включена в качестве корреляционного исследования в последующие оценки терапевтических агентов фазы II/III. Испытание фазы 0 с конечной точкой PD, которая соответствует его цели, может поддержать решение о переходе к ускоренной фазе I, комбинированной фазе I или испытаниям фазы I/II. Важно подчеркнуть, что испытания фазы 0 не заменят испытания фазы I, проводимые в рамках традиционной IND для установления максимально переносимой дозы и профиля токсичности лекарственного средства. Не все исследуемые агенты подходят для оценки фазы 0. Значительные затраты времени и ресурсов необходимы для разработки подходящих анализов ФД и процедур обращения с образцами. Кроме того, у исследователей могут возникнуть трудности с разработкой ресурсов для исследований фазы 0, поскольку нетерапевтические клинические испытания не покрываются большинством сторонних плательщиков. Этические соображения, необходимые для проведения испытания фазы 0, не являются незначительными, но откровенное и открытое обсуждение с участниками до, во время и после испытания будет взаимовыгодным.
Испытание фазы 0 с конечной точкой PD, которая соответствует его цели, может поддержать решение о переходе к ускоренной фазе I, комбинированной фазе I или испытаниям фазы I/II. Важно подчеркнуть, что испытания фазы 0 не заменят испытания фазы I, проводимые в рамках традиционной IND для установления максимально переносимой дозы и профиля токсичности лекарственного средства. Не все исследуемые агенты подходят для оценки фазы 0. Значительные затраты времени и ресурсов необходимы для разработки подходящих анализов ФД и процедур обращения с образцами. Кроме того, у исследователей могут возникнуть трудности с разработкой ресурсов для исследований фазы 0, поскольку нетерапевтические клинические испытания не покрываются большинством сторонних плательщиков. Этические соображения, необходимые для проведения испытания фазы 0, не являются незначительными, но откровенное и открытое обсуждение с участниками до, во время и после испытания будет взаимовыгодным.
Испытания фазы 0 предлагают возможность оценить фармакокинетику и подтвердить влияние агента на предполагаемую молекулярную мишень в человеческих образцах на гораздо более ранних этапах клинической разработки. На сегодняшний день опыт исследований, проведенных в рамках поисковых IND, ограничен, но положителен. 8 Если действие лекарственного средства на мишень можно оценить на более ранних этапах цикла разработки лекарственного средства и требуется меньше пациентов, чем при традиционном IND, то клинические испытания будут меньше, а сроки разработки могут быть сжаты.
На сегодняшний день опыт исследований, проведенных в рамках поисковых IND, ограничен, но положителен. 8 Если действие лекарственного средства на мишень можно оценить на более ранних этапах цикла разработки лекарственного средства и требуется меньше пациентов, чем при традиционном IND, то клинические испытания будут меньше, а сроки разработки могут быть сжаты.
Авторы благодарят д-ра Гуилио Драэтту за вдохновение и г-жу Джину Уленбраук, SAIC-Frederick, Inc., за редакторскую помощь в подготовке этой рукописи.
Этот проект полностью или частично финансируется за счет федеральных средств Национального института рака, Национальных институтов здравоохранения по контракту N01-CO-12400.
Содержание этой публикации не обязательно отражает точку зрения или политику Министерства здравоохранения и социальных служб, а упоминание торговых наименований, коммерческих продуктов или организаций не означает их одобрения правительством США.
1. Кола И., Лэндис Дж. Может ли фармацевтическая промышленность снизить процент отсева?
Nat Rev Drug Discov. 2004; 3: 711–715. [PubMed] [Google Scholar]
Может ли фармацевтическая промышленность снизить процент отсева?
Nat Rev Drug Discov. 2004; 3: 711–715. [PubMed] [Google Scholar]
2. Министерство здравоохранения и социальных служб США, Управление по санитарному надзору за качеством пищевых продуктов и медикаментов. Инновации или стагнация? Проблемы и возможности на критическом пути к новым медицинским продуктам. Маршировать 2004. Доступно по адресу: http://www.fda.gov/oc/initiatives/criticalpath/whitepaper.pdf. Доступ 21 февраля 2008 г.
3. Министерство здравоохранения и социальных служб США, Управление по санитарному надзору за качеством пищевых продуктов и медикаментов. Руководство для промышленности, исследователей и обозревателей: исследовательские исследования IND. январь 2006. Доступно по адресу: http://www.fda.gov/cder/guidance/7086fnl.pdf. Доступ 21 февраля 2008 г.
4. Куммар С., Киндерс Р., Рубинштейн Л. и соавт.
Сокращение сроков разработки лекарств в онкологии с использованием нулевой фазы испытаний. Нат Рев Рак. 2007; 7: 131–139. [PubMed] [Google Scholar]
Нат Рев Рак. 2007; 7: 131–139. [PubMed] [Google Scholar]
5. Kummar S, Kinders R, Gutierrez M, et al. Ингибирование поли(АДФ-рибозо)полимеразы (PARP) с помощью ABT-888 у пациентов с запущенными злокачественными новообразованиями: результаты исследования фазы 0 [аннотация]. Дж. Клин Онкол. 2007 г.; 25:3518. [Google Scholar]
6. Donawho CK, Luo Y, Luo Y, et al. ABT-888, перорально активный ингибитор поли(АДФ-рибозы) полимеразы, который потенцирует ДНК-повреждающие агенты в доклинических моделях опухолей. Клин Рак Рез. 2007; 13: 2728–2737. [PubMed] [Академия Google]
7. Ратнам К., Лоу Дж.А. Современные разработки клинических ингибиторов поли(АДФ-рибозо)полимеразы в онкологии. Клин Рак Рез. 2007; 13: 1383–1388. [PubMed] [Google Scholar]
8. Robinson WT. Инновационные подходы к регулированию раннего развития: expIND, expCTA, микродозирование. Клин Фармакол Тер. 2008; 83: 358–360. [PubMed] [Google Scholar]
9. DeGeorge JJ, Ahn CH, Andrews PA, et al.
Нормативные аспекты доклинической разработки противоопухолевых препаратов. Рак Chemother Pharmacol. 1998;41:173–185. [PubMed] [Google Scholar]
Рак Chemother Pharmacol. 1998;41:173–185. [PubMed] [Google Scholar]
10. Лаппин Г., Гарнер Р.С. Большая физика, малые дозы: использование АМС и ПЭТ для микродозирования лекарств для разработки человеком. Nat Rev Drug Discov. 2003; 2: 233–240. [PubMed] [Google Scholar]
11. Lappin G, Kuhnz W, Jochemsen R, et al. Использование микродозирования для прогнозирования фармакокинетики в терапевтической дозе: опыт применения 5 препаратов. Клин Фармакол Тер. 2006; 80: 203–215. [PubMed] [Google Scholar]
12. Бойд Р.А., Лалонд Р.Л. Нетрадиционные подходы к первым исследованиям на людях для повышения эффективности разработки лекарств: окажут ли значительное влияние исследования микродоз? Клин Фармакол Тер. 2007; 81: 24–26. [PubMed] [Академия Google]
13. Этапы разработки фармакодинамических тестов.
Веб-сайт программы развивающей терапии Национального института рака. Доступно по адресу: http://dtp.nci.nih.gov/docs/phase0/PharmacoDynamicAssaydeveloment.html.
Доступ
21 февраля 2008 г.
14. Kinders RJ, Hollingshead M, Parchment RE, et al. Доклиническое моделирование протокола клинического исследования фазы 0 [аннотация]. Дж. Клин Онкол. 2007;25: 14058. [Google Scholar]
15. Бетенский Р.А., Луис Д.Н., Кэрнкросс Дж.Г. и др. Влияние непризнанной молекулярной гетерогенности на рандомизированные клинические испытания. Дж. Клин Онкол. 2002;20:2495–2499. [PubMed] [Google Scholar]
16. Emanuel EJ, Wendler D, Grady C. Что делает клинические исследования этичными? ДЖАМА. 2000; 283:2701–2711. [PubMed] [Google Scholar]
17. Агравал М., Эмануэль Э.Дж. Этика онкологических исследований фазы I: пересмотр аргументов и данных. ДЖАМА. 2003; 290:1075–1082. [PubMed] [Google Scholar]
18. Joffe S, Miller FG. Переосмысление оценки риска и пользы для исследований рака I фазы. Дж. Клин Онкол. 2006; 24:2987–2990. [PubMed] [Академия Google]
19. Койфман С.А., Агравал М., Гарретт-Майер Э. и соавт.
Риски и польза, связанные с новыми дизайнами онкологических исследований фазы 1. Рак. 2007; 110: 1115–1124. [PubMed] [Google Scholar]
Рак. 2007; 110: 1115–1124. [PubMed] [Google Scholar]
20. Киммельман Дж. Этика на этапе 0: прояснение вопросов. J Law Med Ethics. 2007; 35: 727–733. [PubMed] [Google Scholar]
21. Hill TP. Испытания фазы 0: являются ли они этически сложными? Клин Рак Рез. 2007; 13: 783–784. [PubMed] [Google Scholar]
22. Marchetti S, Schellens JHM. Влияние рекомендаций FDA и EMEA на разработку лекарств в отношении испытаний фазы 0. Бр Дж Рак. 2007 г.; 97: 577–581. [Бесплатная статья PMC] [PubMed] [Google Scholar]
23. Министерство здравоохранения и социальных служб США. Свод федеральных правил, раздел 45 – Общественное благосостояние, Министерство здравоохранения и социальных служб, часть 46: Защита людей. Пересмотрено Июнь 23, 2005. Доступно по адресу: http://www.hhs.gov/ohrp/humansubjects/guidance/45cfr46.htm. Доступ 21 февраля 2008 г.
24. Агравал М. Добровольность клинических исследований в конце жизни. J Управление симптомами боли. 2003; 25:S25–S32. [PubMed] [Академия Google]
25. Seidenfeld J, Horstmann E, Emanuel EJ, et al.
Участники первой фазы онкологических исследований: уязвимы ли они?
Arch Intern Med. 2008 г.; 168:16–20. [PubMed] [Google Scholar]
Seidenfeld J, Horstmann E, Emanuel EJ, et al.
Участники первой фазы онкологических исследований: уязвимы ли они?
Arch Intern Med. 2008 г.; 168:16–20. [PubMed] [Google Scholar]
26. Agulnik M, Oza AM, Pond GR, et al. Влияние и восприятие обязательной биопсии опухоли для корреляционных исследований в клинических испытаниях новых противоопухолевых агентов. Дж. Клин Онкол. 2006; 24:4801–4807. [PubMed] [Google Scholar]
27. Helft PR, Догерти CK. Мы берем, не давая взамен? Этика биопсии, связанной с исследованиями, и преимущества участия в клинических испытаниях. Дж. Клин Онкол. 2006;24:4793–4795. [PubMed] [Google Scholar]
28. Stadler WM, Ratain MJ. Разработка противоопухолевых средств таргетного действия. Инвестируйте в новые лекарства. 2000; 18:7–16. [PubMed] [Академия Google]
Фазы клинических испытаний | Cancer Research UK
Эта страница посвящена различным фазам клинических испытаний. В нем есть информация о
Что такое пробные фазы?
Обзор фаз испытаний
Испытания фазы 0
Испытания фазы 1
Испытания фазы 2
Испытания фазы 3
Испытания фазы 4
Испытания, охватывающие более одной фазы
Что такое фазы испытаний?
Клинические испытания новых методов лечения делятся на несколько этапов, называемых фазами.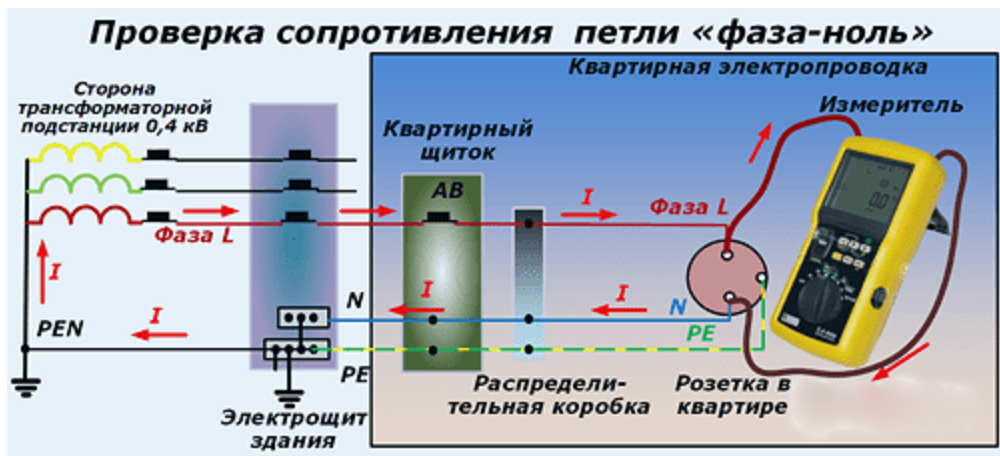 На самых ранних фазах испытаний может быть рассмотрен вопрос о безопасности препарата или побочных эффектах, которые он вызывает. Более поздние этапы испытаний направлены на то, чтобы проверить, лучше ли новое лечение, чем существующие.
На самых ранних фазах испытаний может быть рассмотрен вопрос о безопасности препарата или побочных эффектах, которые он вызывает. Более поздние этапы испытаний направлены на то, чтобы проверить, лучше ли новое лечение, чем существующие.
Существует 3 основных фазы клинических испытаний – фазы 1–3. Испытания фазы 1 – это самые ранние фазы испытаний, а фаза 3 – испытания более поздней фазы.
Некоторые испытания имеют более раннюю стадию, называемую фазой 0, а некоторые испытания фазы 4 проводятся после того, как лекарство было лицензировано.
Некоторые исследования рандомизированы. Это означает, что люди, принимающие участие, случайным образом помещаются в одну из лечебных групп. Это означает, что результаты более надежны.
Краткий обзор пробных фаз
| Фаза | Количество участников | Тип рака | Основные цели испытаний | Это случайно? |
| 0 | Небольшой – часто около От 10 до 20 человек | Часто много типов рака | Тестирование низкой дозы лечения, чтобы убедиться, что оно не вредно | № |
| 1 | Небольшой – часто около От 20 до 50 человек | Часто много типов рака | Как найти лучшую дозу лечения, каковы побочные эффекты и что происходит с лечением в организме | № |
| 2 | Средний – десятки человек, иногда свыше 100 | Обычно один или два типа рака, иногда больше | Проверка наилучшей дозы лечения, получение дополнительной информации о побочных эффектах и изучение эффективности лечения | Иногда |
| 3 | Крупные – сотни или тысяч человек | Обычно один тип рака , иногда несколько | Сравнение нового лечения со стандартным лечением или с фиктивным препаратом | Обычно |
| 4 | От среднего до большого, переменная | Обычно один тип рака , иногда несколько | Узнайте больше о долгосрочных преимуществах и побочных эффектах | № |
Испытания фазы 0
Самыми ранними испытаниями лекарств на людях обычно являются испытания фазы 1. Но ваш врач может спросить, не хотите ли вы присоединиться к исследованию фазы 0. Эти исследования направлены на то, чтобы выяснить, ведет ли себя лекарство так, как ожидают исследователи из своих лабораторных исследований
Но ваш врач может спросить, не хотите ли вы присоединиться к исследованию фазы 0. Эти исследования направлены на то, чтобы выяснить, ведет ли себя лекарство так, как ожидают исследователи из своих лабораторных исследований
В исследованиях фазы 0 обычно участвует небольшое количество людей, и в них используется очень маленькая доза препарата. Доза препарата слишком мала для лечения вашего рака, но у вас также меньше шансов получить побочные эффекты.
Испытания фазы 0 направлены на выяснение таких вещей, как:
- достигает ли лекарство раковых клеток
- что происходит с наркотиком в организме
- как раковые клетки в организме реагируют на препарат
Вы можете пройти дополнительное сканирование и дать дополнительные образцы крови и раковой ткани (
биопсия), чтобы помочь исследователям разобраться в том, что происходит.
Испытание фазы 1
Фаза 1 иногда обозначается как фаза I.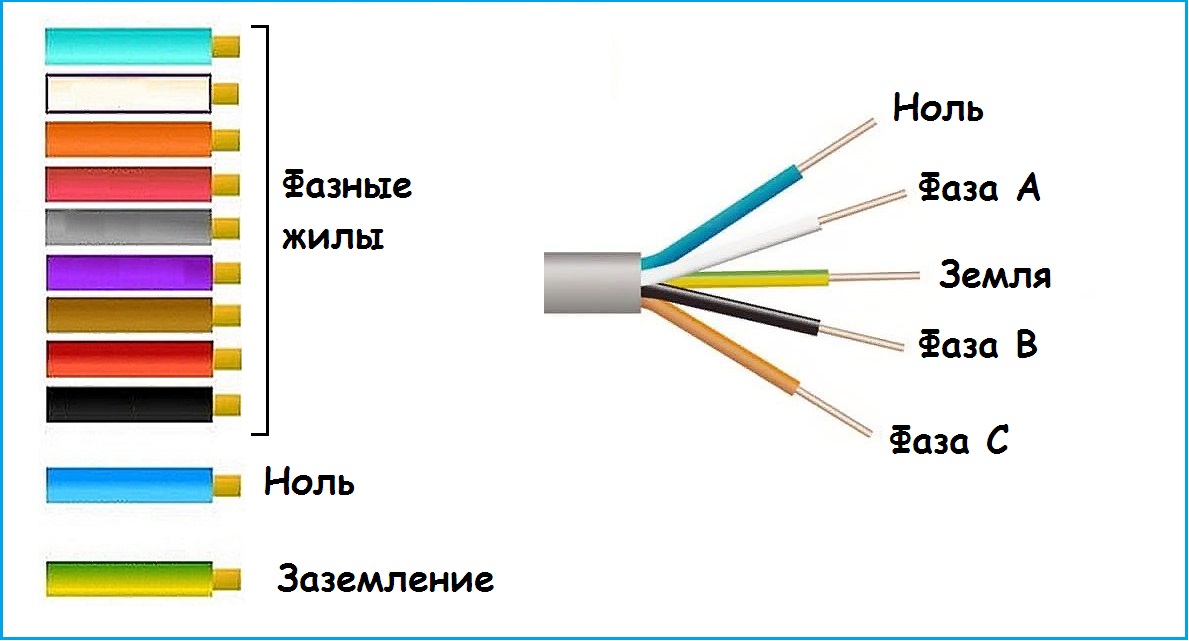 Обычно это небольшие испытания, в которых участвует всего несколько пациентов. Испытание может быть открыто для людей с любым типом распространенного рака, как правило, для тех, кто уже прошел все другие доступные методы лечения.
Обычно это небольшие испытания, в которых участвует всего несколько пациентов. Испытание может быть открыто для людей с любым типом распространенного рака, как правило, для тех, кто уже прошел все другие доступные методы лечения.
Испытания фазы 1 направлены на выяснение:
- какой дозы препарата безопасно давать
- какие побочные эффекты
- что происходит с лекарством в организме
- , если лечение помогает уменьшить рак
Пациенты очень медленно включаются в испытания фазы 1. Таким образом, даже если они не набирают много людей, их выполнение может занять много времени.
Часто это исследования с повышением дозы. Это означает, что первые несколько пациентов, которые принимают участие, получают очень маленькую дозу препарата. Если все пойдет хорошо, следующие несколько человек получат немного более высокую дозу. И так до тех пор, пока они не найдут лучшую дозу для введения. Исследователи следят за побочными эффектами, которые возникают у людей, и за тем, как они себя чувствуют.
На первой фазе исследования у вас может быть много анализов крови, потому что исследователи смотрят, как ваш организм справляется с наркотиком и избавляется от него. Они тщательно записывают любые побочные эффекты, которые могут у вас возникнуть, и время их появления.
Основная цель испытаний фазы 1 — узнать о дозах и побочных эффектах. Они должны сделать это в первую очередь, прежде чем тестировать потенциальное новое лечение, чтобы увидеть, работает ли оно. Некоторые люди, принимающие участие, могут получить пользу от нового лечения, но многие не получат.
Испытания фазы 2
Фаза 2 иногда обозначается как фаза II. Не все методы лечения, протестированные в ходе испытаний фазы 1, доходят до испытаний фазы 2.
Эти испытания могут проводиться для людей с одинаковым типом рака или для людей с разными типами рака.
Испытания фазы 2 направлены на то, чтобы выяснить:
- , достаточно ли хорошо работает новое лечение, чтобы его можно было протестировать в более крупном испытании фазы 3
- при каких видах рака эффективно лечение
- подробнее о побочных эффектах и способах борьбы с ними
- больше о лучшей дозе для введения
Эти методы лечения были протестированы в ходе испытаний 1 фазы, но у вас все еще могут быть побочные эффекты, о которых врачи не знают. Лечение может влиять на людей по-разному. Некоторые люди, принимающие участие, могут получить пользу от нового лечения, а некоторые нет.
Лечение может влиять на людей по-разному. Некоторые люди, принимающие участие, могут получить пользу от нового лечения, а некоторые нет.
Испытания фазы 2 обычно больше, чем фазы 1. В них может принимать участие до 100 или около того человек. Иногда в испытаниях фазы 2 новое лечение сравнивают с другим, уже используемым, или с фиктивным препаратом (9).0011 плацебо
).
Некоторые испытания фазы 2 являются рандомизированными. Это означает, что исследователи случайным образом поместили участников в лечебные группы.
Вы можете узнать о рандомизированных исследованиях.
Испытания фазы 3
Фаза 3 иногда обозначается как фаза III. Эти испытания сравнивают новые методы лечения с лучшими доступными в настоящее время методами лечения (стандартное лечение).
Исследования фазы 3 направлены на то, чтобы выяснить:
- какое лечение лучше работает при конкретном типе рака
- подробнее о побочных эффектах
- как лечение влияет на качество жизни людей
Они могут сравнить стандартное лечение с:
- совершенно новым лечением
- разных доз одного и того же препарата
- получают одинаковое лечение более или менее часто
- новый способ проведения стандартного лечения (например, лучевая терапия)
В испытаниях фазы 3 обычно участвует гораздо больше пациентов, чем в фазах 1 или 2. Это связано с тем, что различия в показателях успеха могут быть небольшими. Таким образом, для исследования нужно много пациентов, чтобы показать разницу.
Это связано с тем, что различия в показателях успеха могут быть небольшими. Таким образом, для исследования нужно много пациентов, чтобы показать разницу.
Иногда в испытаниях фазы 3 участвуют тысячи людей в разных больницах и даже в разных странах. Большинство испытаний фазы 3 являются рандомизированными. Это означает, что люди, принимающие участие, случайным образом помещаются в лечебные группы. См. нашу информацию о рандомизированных испытаниях.
Испытания фазы 4
Фаза 4 иногда обозначается как фаза IV. Эти испытания проводятся после того, как лекарство доказало свою эффективность и было лицензировано.
Исследования фазы 4 направлены на то, чтобы выяснить:
- дополнительную информацию о побочных эффектах, включая более редкие побочные эффекты и безопасность препарата
- каковы долгосрочные риски и преимущества
- насколько хорошо работает лекарство, когда оно используется более широко для людей, не включенных в исследование фазы 3
У нас есть информация о том, как лицензируются лекарства.


