Что такое ржавчина и как с ней бороться: оксиды железа
Химические основы процесса коррозии железа
Железо является химически активным металлом. Оно в присутствии кислорода и воды подвергается окислению, при этом образуя разнообразные соединения: оксиды, гидроксиды, гидраты оксидов. Химки констатируют, что определенной формулы ржавчины нет. Что такое ржавчина? Это коррозия, которая образуется вследствие окисления железа. Она обладает переменным составом, который зависит от окружающей среды.
Ржавчина поражает железо по его всей поверхности. Однако самыми уязвимыми являются внутренние и внешние узлы изделий, сварочные швы, резьбовые соединения. Структуры ржавого железа отличаются значительной степенью рыхлости. У ржавчины отсутствует какое-либо сцепление с металлом. Вследствие того, что поверхность высокопористой коррозии свободно удерживает в себе атмосферную влагу, создаются оптимальные условия для дальнейшего разрушения железа.
Обычно цвет ржавчины — красно-бурый, коричневый, который не позволяет оценить состояние железа под слоем коррозии. Под ржавчиной металл может быть окончательно разрушен. Если не принимать меры для предотвращения ее распространения, то результаты воздействия коррозии на железо могут оказаться катастрофическими, привести к полному разрушению конструкций. Это особенно опасно, если ржавчина разъела опоры ЛЭП или дно морского судна. Что такое ржавчина для автомобиля, и какой вред она несет, известно каждому автомобилисту.
Под ржавчиной металл может быть окончательно разрушен. Если не принимать меры для предотвращения ее распространения, то результаты воздействия коррозии на железо могут оказаться катастрофическими, привести к полному разрушению конструкций. Это особенно опасно, если ржавчина разъела опоры ЛЭП или дно морского судна. Что такое ржавчина для автомобиля, и какой вред она несет, известно каждому автомобилисту.
Коррозия железа
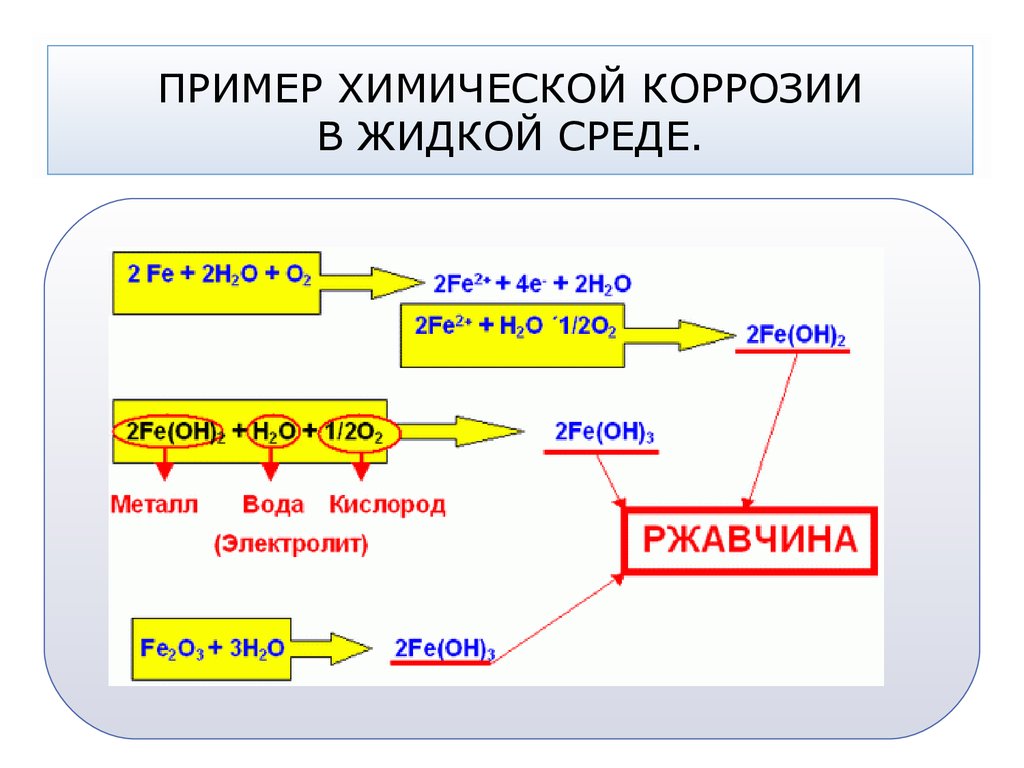
Процесс коррозии железа чаще всего сводится к его окислению кислородом воздуха или кислотами, содержащимися в растворах, и превращению его в оксиды. Коррозия металлов (ржавление) вызывается окислительно-восстановительными реакциями, протекающими на границе металла и окружающей среды. В зависимости от механизма возникновения, различают такие виды коррозии железа, как: химическая, электрохимическая и электрическая.
Процесс химической коррозии железа
Окислительно-восстановительные реакции в данном случае проходят через переход электронов на окислитель. В процессе коррозии такого типа кислород воздуха взаимодействует с поверхностью железа. При этом образуется оксидная пленка, которая называется ржавчиной:
В процессе коррозии такого типа кислород воздуха взаимодействует с поверхностью железа. При этом образуется оксидная пленка, которая называется ржавчиной:
3Fe + 2O2 = Fe3O4 (FeO•Fe2O3)
В отличие от плотно прилегающих оксидных пленок, которые образуются в процессе коррозии на щелочных металлах, алюминии, цинке, рыхлая оксидная пленка на железе свободно пропускает к поверхности металла кислород воздуха, а также другие газы и пары воды. Это способствует дальнейшей коррозии железа.
Процесс электрохимической коррозии
Этот вид коррозии проходит в среде, которая проводит электрический ток. Металл в грунте подвергается, преимущественно, электрохимической коррозии. Процесс коррозии такого типа – это результат химических реакций с участием компонентов окружающей среды. Также электрохимическая коррозия возникает в случае контакта металлов, находящихся в ряду напряжений на некотором расстоянии друг от друга, в результате чего возникает гальваническая пара катод-анод.
Атмосферный и грунтовый процесс коррозии выражается схемой:
Fe + O2 + h3O → Fe2O3 · xh3O
В результате образуется ржавчина различной расцветки, что обусловлено тем, что образуются различные окислы железа.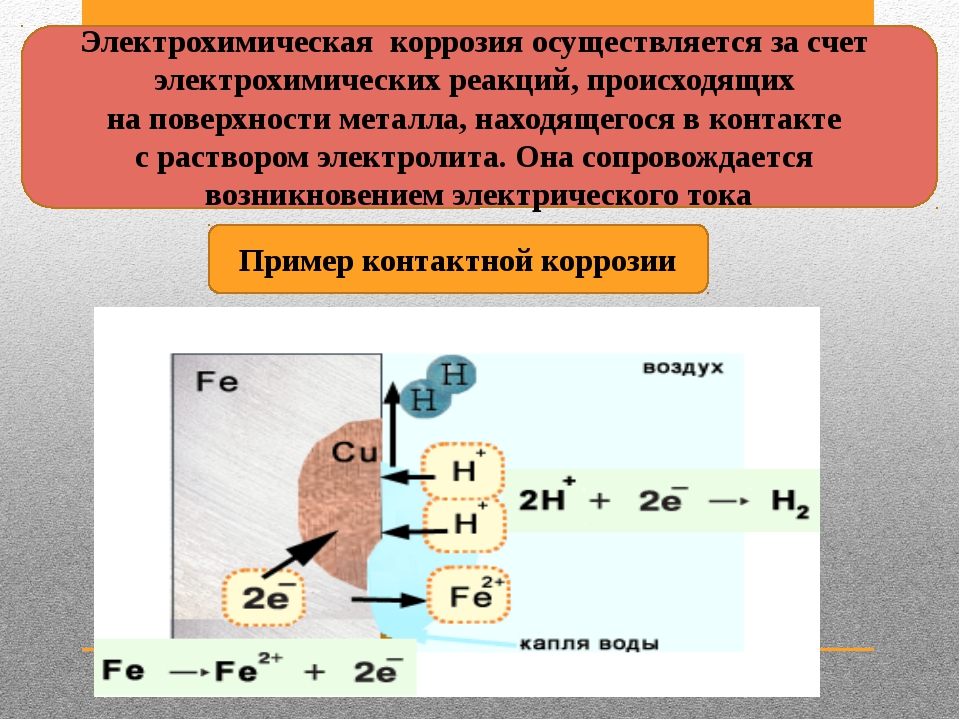 Какое именно вещество образуется в процессе коррозии железа, зависит от давления кислорода, влажности воздуха, температуры, длительности процесса, состава железного сплава, состояния поверхности изделия и т. д. Скорость разрушения разных металлов различна.
Какое именно вещество образуется в процессе коррозии железа, зависит от давления кислорода, влажности воздуха, температуры, длительности процесса, состава железного сплава, состояния поверхности изделия и т. д. Скорость разрушения разных металлов различна.
Процесс коррозии металла в растворах электролитов – это результат работы большого количества микроскопических гальванических элементов, у которых в качестве катода выступают примеси в металле, а в качестве анода – сам металл. В результате чего возникают микроскопические гальванические элементы.
Также атомы железа на разных участках имеют различную способность отдавать электроны (окисляться). Участки металла, на котором протекает этот процесс, выступают в роли анода. Остальные участки – катодные, на которых происходят процессы восстановления воды и кислорода:
h3O + 2e– = 2OH– + h3↑
O2 + 2h3O + 4e– = 4OH–
Результат – из ионов железа (II) и гидроксид-ионов образуется гидроксид железа (II). Далее идет его окисление до гидроксида железа (III) – основного компонента ржавчины:
Fe2+ + 2OH– = Fe(OH)2 Fe(OH)2 + O2 + h3O → Fe2O3 · xh3O
Для того чтобы гальванический элемент работал, необходимо наличие двух металлов различной химической активности и среды, которая проводит электрический ток, – электролита. При контакте железа и другого металла (например, цинка) коррозия железа замедляется, а более активного металла (цинка) – ускоряется. Это обусловлено тем, что поток электронов идет от более активного металла (анода) к менее активному металлу (катоду). Так, при контакте железа с менее активным металлом, коррозия железа ускоряется.
При контакте железа и другого металла (например, цинка) коррозия железа замедляется, а более активного металла (цинка) – ускоряется. Это обусловлено тем, что поток электронов идет от более активного металла (анода) к менее активному металлу (катоду). Так, при контакте железа с менее активным металлом, коррозия железа ускоряется.
Процесс электрической коррозии
Такой вид разрушения металлических подземных конструкций, кабелей и сооружений могут вызывать блуждающие токи, исходящие от трамваев, метро, электрических железных дорог и различных электроустановок с постоянным током.
Ток с металлических конструкций выходит в грунт в виде положительных ионов металла – происходит электролиз металла. Участок выхода токов – это анодные зоны. Именно в них и протекают активные процессы электрической коррозии железа. Блуждающие токи могут достигать 300 А и действовать в радиусе нескольких десятков километров.
Блуждающими токами, исходящими от источников переменного тока, вызывается слабая коррозия подземных стальных конструкций, и сильная – конструкций из цветных металлов. Защита металлических конструкций от коррозии является очень важной задачей, так как она причиняет огромные убытки.
Защита металлических конструкций от коррозии является очень важной задачей, так как она причиняет огромные убытки.
Причины появления ржавчины
Ржавчина начинает появляться тогда, когда металл контактирует с кислородом, водой, окислителями либо кислотами. Одним из условий того, что металл подвергается ржавчине, является наличие в нем примесей либо добавок. Если имеет место контакт железа с внешними раздражителями в присутствии соли (соленая вода), то коррозия разрушает его значительно быстрее в виду начала электрохимических реакций.
Если железо является чистым, без примесей, то оно к воздействиям кислорода и воды значительно устойчивее. Так же, как и у них металлов, таких как алюминий, на его поверхности образуется плотное оксидное покрытие (слой пассивации), который обеспечивает защиту основной массы железа от более глубокого окисления. Однако и этот слой может быть разрушен, если начинается взаимодействие железа с кислородом и водой совместно.
Иными факторами, которые активно разрушают железо, являются углекислый газ в воде и серный диоксид. При их воздействии очень активно образуются разнообразные типы гидроксида железа. Они, в отличие от оксидов железа, не могут защитить металл. Гидроксид, формируясь, начинает отслаиваться от поверхности железа, после чего негативному воздействию подвергается нижний слой, который также отслаивается. И этот процесс длится до того времени, пока весь металл не будет уничтожен, либо в окружающей среде не останется кислорода, диоксида углерода, серы и воды.
При их воздействии очень активно образуются разнообразные типы гидроксида железа. Они, в отличие от оксидов железа, не могут защитить металл. Гидроксид, формируясь, начинает отслаиваться от поверхности железа, после чего негативному воздействию подвергается нижний слой, который также отслаивается. И этот процесс длится до того времени, пока весь металл не будет уничтожен, либо в окружающей среде не останется кислорода, диоксида углерода, серы и воды.
Если железо, подвергаясь сгоранию на воздухе, контактирует с кислородом, то имеет место образование оксида железа ii.
При сгорании в чистом кислороде — оксид IV.
Оксид железа iii образуется тогда, когда через металл, находящийся в расплавленном состоянии, проходит воздух или кислород.
О ржавчине рассказывается на многих сайтах. Есть много фотографий, но только изделий или, в крайнем случае, макроструктура. Как выглядит ржавчина под микроскопом?
Ржавчиной, как правило, называют продукт коррозии только железа и его сплавов, таких, как сталь или чугун, хотя многие другие металлы тоже подвергаются коррозии. Все знают красный налет на поверхности металлических материалов или изделий, которые находятся под воздействием влаги или некоторых реактивов. Этот налет — окислы, которые образуются при взаимодействии железа с кислородом. Химическая формула ржавчины Fe2O3nh3O (гидратированный оксид трехвалентного железа), а также метагидрооксид (FeO(OH), Fe(OH)3). На рис.1 показаны красные окислы железа – Fe2O3 и Fe3O4.
Все знают красный налет на поверхности металлических материалов или изделий, которые находятся под воздействием влаги или некоторых реактивов. Этот налет — окислы, которые образуются при взаимодействии железа с кислородом. Химическая формула ржавчины Fe2O3nh3O (гидратированный оксид трехвалентного железа), а также метагидрооксид (FeO(OH), Fe(OH)3). На рис.1 показаны красные окислы железа – Fe2O3 и Fe3O4.
Рисунок 1. Красные окислы железа: а — Fe2O3; б — Fe3O4.
Если поверхность железных изделий не защищать, то в конце концов изделие рассыплется в порошок. Красный окисел не пассивирует поверхность, т.е. не защищает ее от дальнейшего разрушения. (Кстати, концентрированная серная кислота пассивирует поверхность. При взаимодействии железа с кислотой на поверхности железа образуется сернокислое железо и окисление железа прекращается). Окисление возможно и на воздухе, т.к. он в наших условиях содержит некоторое количество влаги. На рис. 2 показана ржавчина на изломе пластинки быстрорежущей стали Р6М5.
Рисунок 2. Излом стали Р6М5; окисление в комнатных условиях; светлопольное изображение
Ржавчина образуется и при коррозии металла в почве (рис. 3 и 4). На рис. 3 показан фрагмент детали сельхозтехники, пролежавшей несколько лет в поле. Это макроструктура, которая показывает расположение окисленных участков на поверхности. Более красивую и интересную картину дает микроструктура (рис. 4). Видны кристаллы красной ржавчины (рис. 4 а) и осадки другого типа (рис. 4 б), состав которых не определялся.
Рисунок 3. Фрагмент детали сельхозтехники; почвенная коррозия.
Рисунок 4. Ржавчина и осадки на изломе детали; темнопольное изображение
Поскольку влага присутствует и в воздухе, окисляются и шлифы металлов и сплавов, хранящиеся не в специальных условиях. Окисление их усиливается еще и потому, что они протравлены. Нетравленные шлифы хранятся куда лучше. На рис. 5 показано окисление протравленных шлифов стали ШХ15. Ржавчина в основном располагается на матрице (мартенсит), карбиды (белая фаза) видны хорошо (рис.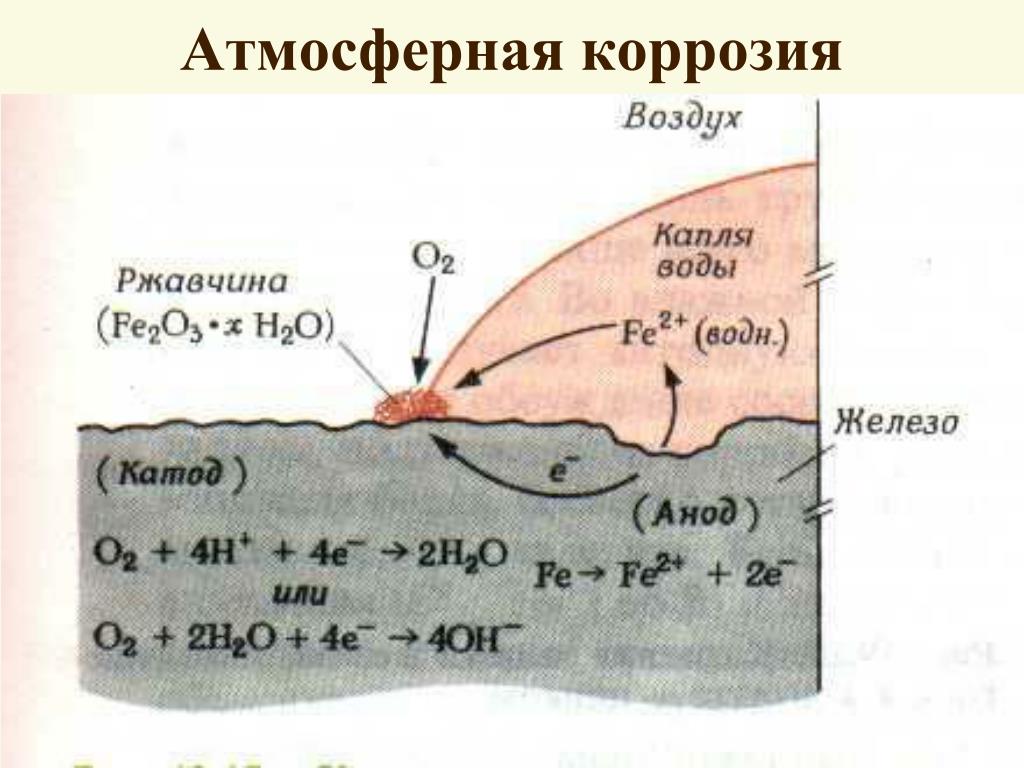 5а). В структуре зернистого перлита (рис. 5 б) окисляется феррит, на изображении он имеет голубой и зеленый цвет; ржавчина сосредоточена в виде отельных пятен (до поры, пока не окислится весь образец).
5а). В структуре зернистого перлита (рис. 5 б) окисляется феррит, на изображении он имеет голубой и зеленый цвет; ржавчина сосредоточена в виде отельных пятен (до поры, пока не окислится весь образец).
Рисунок 5. Окисление шлифов стали ШХ15 после травления и длительного хранения в комнатных условиях: а — закалка и отпуск, равномерное окисление поверхности; б – зернистый перлит, формирование островков окисной пленки.
На рис. 6а показано крупное скопление окислов. Некоторые из них имеют красный цвет, это ржавчина, другие – светлый (рис. 6 б). Состав их не анализировали; также это может быть и пыль, поскольку шлиф находился на открытом воздухе.
Рисунок 6. Скопления окислов на поверхности шлифа: а – светлое поле, б- темное поле.
Если процесс зашел далеко, то практически вся поверхность покрыта ржавчиной (рис. 7). Участков чистого металла осталось мало.
Рисунок 7. Сплошной окисный слой на шлифе
Все, что содержит железо, может ржаветь. В том числе и метеориты (рис. 8).
8).
Рисунок 8. Окислы железа на метеоритах
Состав ржавчины
Ржавчина, которая образуется в обычных условиях, является как правило смесью 3 оксидов железа. Они образуются не в один момент и имеют разные физико-механические свойства. Железные оксиды с самого нижнего слоя по направлению к поверхности представляют собой сочетание следующих составляющих:
- Вюстит (оксид железа) — мягкая структура, зависящая от условий, в которых находится металл. Если температура хранение высокая, то этот слой наибольший.
- магнетит (магнитный железняк) – окись-закись железа, обладающая более высокой пористостью, чем вюстидный слой, и меньшей твердостью. Это структура имеет выраженные магнитные свойства.
- Гематит (красный железняк) – обычно это структура красно-серого цвета, твердое абразивное вещество. Гематит обладает более высокой плотностью, разъедает металл и увеличивает коэффициент трения при соприкосновении с поверхностями.
Перед тем, как заняться работами по ликвидации ржавчины, необходимо узнать состав металла, особенно на его поверхности, а также установить условия, которые способствовали ее появлению.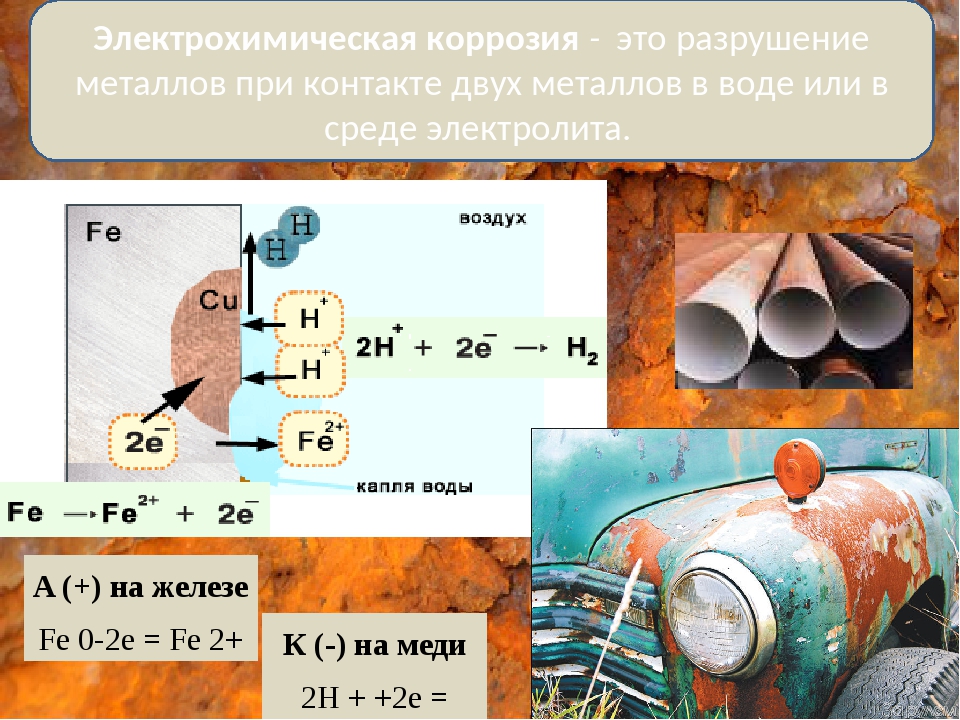 Располагая такой информацией, достаточно просто найти оптимальный вариант для удаления оксида железа и выбрать наиболее эффективные средства для борьбы с ржавчиной.
Располагая такой информацией, достаточно просто найти оптимальный вариант для удаления оксида железа и выбрать наиболее эффективные средства для борьбы с ржавчиной.
Классификация способов борьбы с коррозией
С учетом основных составляющих коррозии, способы, как вывести ржавчину, делятся на следующие:
- Механический — ликвидация оксидного слоя осуществляется посредством жестких металлических щеток, наждачной бумаги и т. п.
- Тепловой — осуществляется посредством воздействия на коррозию высоких температур, обычно в сочетании с водяным и (или) воздушным потоками.
- химический — удаление оксидов железа осуществляется вследствие воздействия на них специальными средствами, растворяющими ржавчину, при нанесении их на поверхность металла.
Необходимо учитывать, что эффективность вышеуказанных методов различна. Так, если процесс образования коррозии установлен своевременно, и это небольшое пятно, то поверхность железа можно эффективно обработать стальной щеткой, наждачный крупнозернистой бумагой, угловой шлифовальной машиной с соответствующей насадкой.
Однако если установлено, что ржавчина захватила большие поверхности, то тогда оптимальными методами будут химические.
Если площади ржавого металла очень большие, их невозможно транспортировать, то тогда оптимальным считается тепловая обработка, но она связана с высокой трудоемкостью.
Обычно обработка металла для удаления ржавчины осуществляется комбинированными способами, при которых различные методы применяют в определенной последовательности.
Типы коррозии
В современном мире представлено большое количество видов такого процесса, как образование ржавчины на поверхности материалов отдельных видов.
Виды коррозии сегодня встречаются следующие:
- Электрохимическая коррозия. Данный вид образования коррозии характеризуется тем, что на поверхности металлов появляются гальванические элементы, которые вызывают появление ржавчины. Для появления данного типа коррозии необходимо наличие электролита. В его роли чаще всего выступает вода.
 При соприкосновении с конденсатом или водой электроды или другие элементы металла меняют свой оксилительно-восстановительный потенциал.
При соприкосновении с конденсатом или водой электроды или другие элементы металла меняют свой оксилительно-восстановительный потенциал. - Водородная коррозия. При данном виде коррозии отмечается водородная деполяризация. При этом водород восстанавливается.
- Кислородная коррозия. Бывают ситуации, когда водород в щелочной среде не имеет возможности выделяться. В результате выделяется кислород, который приводит к появлению налета ржавчины на металлической поверхности.
- Химическая коррозия. При данном виде коррозии поверхность металла соприкасается со средой, которая провоцирует появления ржавчины.
Таблица. Виды электрохимической коррозии
| № пп | Вид электрохимической коррозии | Способ прокладки трубопровода (вид оборудования) | Дополнительные коррозионные факторы |
| 1. | Атмосферная коррозия | Наружные поверхности трубопроводов наземной и канальной прокладки (при уровне подтопления и заиливания канала, не достигающим изоляционных конструкций).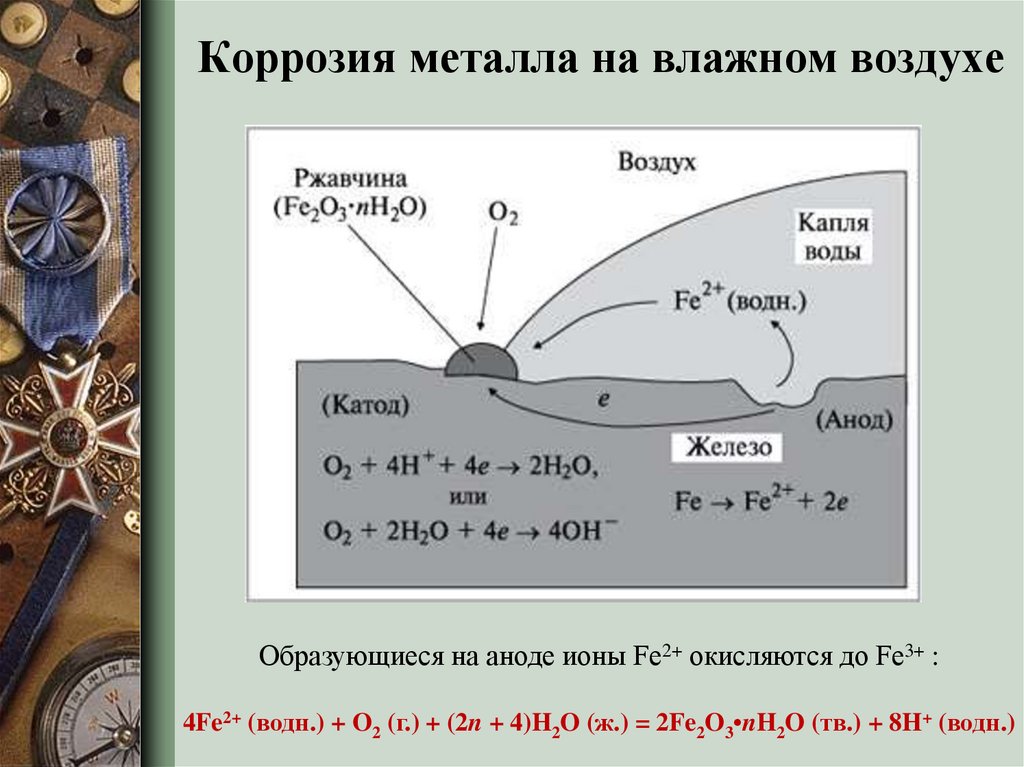 Поверхности различных металлоконструкций и оборудования, не контактирующие с водой и грунтом. Поверхности различных металлоконструкций и оборудования, не контактирующие с водой и грунтом. | Внутренние напряжения в металле трубопровода и металлоконструкций, ударно-механическое воздействие капели с перекрытий. Характерные коррозионные повреждения: равномерная коррозия, в местах капели возможна коррозия пятнами. |
| 2. | Подземная коррозия | Наружные поверхности трубопроводов бесканальной прокладки (при нарушении целостности изоляции), канальной прокладки (периодическое подтопление и заиливание канала, сопровождающееся увлажнением тепловой изоляции). | Внутренние напряжения в металле, коррозия внешним постоянным и переменным током, воздействие капели. Характерные коррозионные повреждения: неравномерная коррозия, коррозия пятнами, при воздействии блуждающих токов возможны сквозные поражения стенки трубопровода. |
| 3. | Подводная коррозия | Наружные поверхности трубопроводов канальной прокладки. (Постоянное подтопление канала при отсутствии тепловой изоляции на трубопроводе).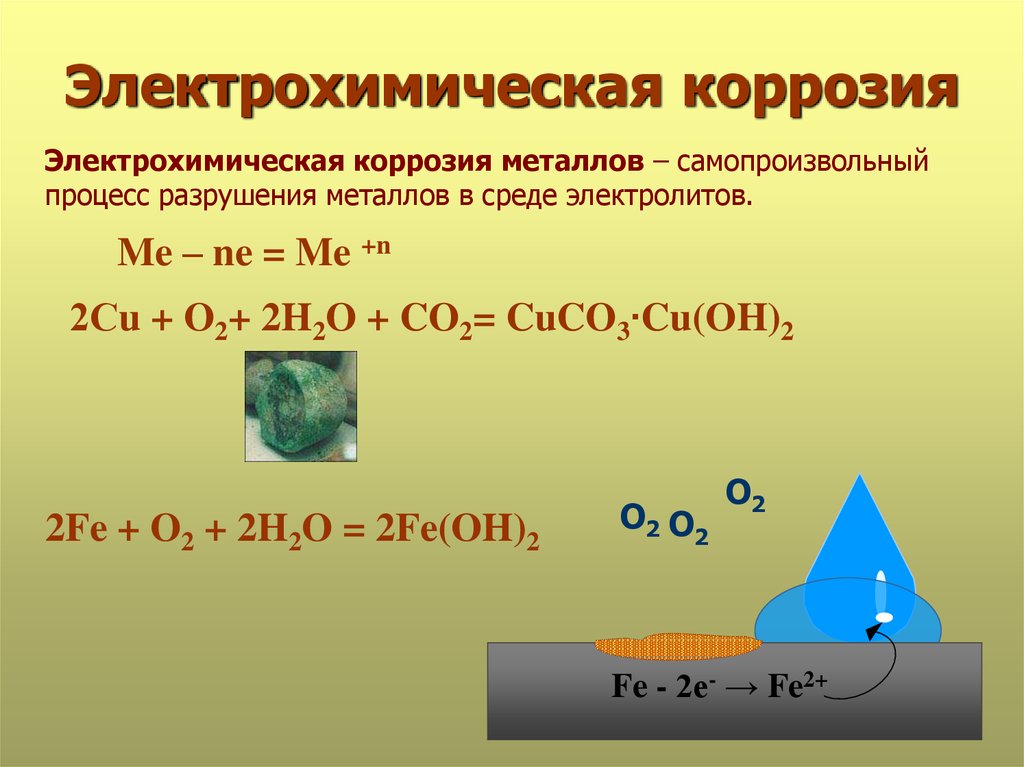 Внутренние поверхности трубопроводов и оборудования химводоподготовки (деаэраторы, фильтры и т.п.) Внутренние поверхности трубопроводов и оборудования химводоподготовки (деаэраторы, фильтры и т.п.) | Внутренние напряжения в металле, коррозия внешним постоянным и переменным током. При неполном погружении трубопровода возможна коррозия по ватерлинии. Характерные коррозионные повреждения: неравномерная коррозия, при воздействии блуждающих токов возможны сквозные поражения стенки трубопровода, язвенные поражения в районе ватерлинии. На трубопроводах горячего водоснабжения возможно протекание процесса микробиологической коррозии железобактериями. Характерные коррозионные повреждения: язвенная коррозия (для внутренних поверхностей трубопроводов), точечная коррозия, неравномерная коррозия. |
Механические способы
Выбор определенного способа механической обработки зависит от вида поверхности железа. Так для мотков стальной проволоки применяют ее перематывание с одного носителя на другой. В этом случае при перегибах ржавчина отделяется от поверхности металла.
При удалении коррозии механическим способом обычно используют жесткие щетки из стальной щетины или наждачную бумагу (крупнозернистую).
К недостаткам механических способов избавления от ржавчины относится тот факт, что на поверхности железа остаются следы, образованные очистительным инструментом. Поэтому рекомендуется поверхность очищенного железа подвергать полировке для придания ей прежнего внешнего вида.
Тепловая очистка
Для удаления ржавчины тепловыми методами необходимы специальные установки (промышленные парогенераторы либо строительные фены). Способ очистки от оксидов железа основан на том, что контакт ржавчины с основным металлом не прочен. Воздействие повышенной температуры и горячей влаги при большом скоростном воздушном потоке такое, что ржавчина удаляется практически полностью.
Наиболее эффективен этот метод тогда, когда на обрабатываемую поверхность подается и горячий пар. Паровоздушная смесь в струе, которая подается на металлическую поверхность под давлением, приводит к размягчению ржавчины, дроблению на отдельные фрагменты, которые удаляются с поверхности железа воздушным потоком.
Эти методы особенно эффективны, когда необходимо удалить ржавчину со стальных дверей, вентиляционных конструкций, металлических структур, демонтировать которые невозможно либо затруднительно.
Характеристики коррозии
Коррозия в простонародии больше известная под названием ржавчина. Она представляет собой процесс самопроизвольного образования на металлической поверхности налета в результате влияния окружающей среды. Ржавчина обычно имеет темно-коричневый оттенок, который портит внешние качества изделия из того или иного металла.
Коррозия металла сегодня встречается достаточно часто. Причиной ее появления является то, что некоторые виды металлических материалов являются неустойчивыми к температурным перепадам и изменениям влажности. Изделиям из металлов достаточно часто приходится контактировать с различными веществами. Они могут влиять на них по-разному. В результате образуется коррозия различных видов.
Коррозия влияет не только на внешние качества изделий и объектов, но и способствуют разрушению металлического материала.
В результате конструкция, которая из него создана, приходит в негодность.
Коррозии подвергаются не только металлы, но и другие материалы. Сегодня довольно часто встречаются случаи, когда она появляется на пластмассе. Образование ржавчины присуще и бетонным изделиям.
Скорость коррозии зависит от размера температуры. С повышением температуры на каждые сто градусов появление ржавчины становится быстрее.
Химическая очистка
В настоящее время методы химической очистки металлических поверхностей от ржавчины очень разнообразны. Однако у всех в основе лежит один процесс — удаление коррозии посредством химического воздействия на нее растворами кислот.
К наиболее эффективным способам избавления от окислов железа относят воздействие на ржавчину соляной кислотой, особенно когда ее концентрация в растворе составляет не менее 15%. Если концентрация меньше, то растворение ржавчины существенно замедляется.
Кислотные составы, сделанные на основе серной кислоты, применять не следует, так как в результате воздействия на поверхности железа образуется слой гидридов, которые повышают хрупкость металла.
Если необходимо осуществить химическую очистку металла в домашних условиях, то возможно применение неагрессивных веществ, таких как лимон, уксус и т.п. Принцип воздействия на коррозию такой же. Эти вещества достаточно хорошо растворяют ржавчину, которая потом легко удаляется ветошью. Что такое ржавчина и как ее удалить, вероятно, знает большинство домохозяек.
Применение иного оборудования для удаления коррозии металла
Механические методы борьбы со ржавчиной возможно использовать далеко не всегда, особенно если металлические изделия имеют сложные формы.
Химические методы имеют также определенные недостатки. Если не соблюдать технику безопасности, то можно получить химический ожог либо отравление. Есть сложности с утилизацией отработанных растворов.
Вследствие этого наиболее оптимальным является применение способа так называемого мягкого бластинга. Его принцип состоит в том, что на поверхность металла, поврежденного ржавчиной, направляется струя сжатого воздуха, которая содержит в себе абразивные составляющие.
Изменяя давление в струе, можно регулировать глубину слоя, который снимается. Это приводит к тому, что удаляется только ржавчина, тогда как сам металл остается сохранным. Гранулы, которые действуют на коррозию, состоят из мелкодисперсной соды и мела, можно применять и очень мелкий песок.
Что такое ржавчина и как ее удалить с поверхности металла?
По статистике, потери от ржавчины (коррозии) составляют до 12% от всего производимого металла. Условия эксплуатации металлических изделий и конструкций постоянно ужесточаются, в том числе и из-за загрязнения атмосферы. Так, выбросы оксидов серы или азота приводят к образованию микрокапель серной или азотной кислот, при этом скорость образования ржавчины увеличивается в несколько раз.
Ржавчина – химические основы процесса
Железо – химически активный металл, который в присутствии воды и кислорода легко окисляется, образуя несколько соединений – оксидов, гидроксидов и их гидратов. Как ни странно, но точной формулы ржавчины не существует: в зависимости от условий окружающей среды продукт окисления железа имеет переменный состав: nFe(OH)3*mFe(OH)2*ph3O. Поражение ржавчиной происходит по всей поверхности металла, но наиболее уязвимыми местами являются сварные швы, внутренние углы конструкций, отверстия для резьбовых соединений. По своей структуре ржавчина очень рыхлая, сцепление с металлом практически отсутствует. Из-за высокой пористости слой ржавчины легко задерживает атмосферную влагу, создавая благоприятные условия для дальнейшего разрушения металла.
Поражение ржавчиной происходит по всей поверхности металла, но наиболее уязвимыми местами являются сварные швы, внутренние углы конструкций, отверстия для резьбовых соединений. По своей структуре ржавчина очень рыхлая, сцепление с металлом практически отсутствует. Из-за высокой пористости слой ржавчины легко задерживает атмосферную влагу, создавая благоприятные условия для дальнейшего разрушения металла.
Опасность процесса в том, что визуально оценить степень поражения металлической конструкции не представляется возможным: под красно-бурым слоем ржавчины металл может быть полностью разрушен. Если своевременно не принять меры, результат может оказаться плачевным, вплоть до полного разрушения изделия. Одно дело, если это – ржавый гвоздь в стене дачного домика, и совсем другое – если ржавчина поразила опору ЛЭП или корпус морского судна.
Способы удаления ржавчины
Народная мудрость гласит, что любую проблему проще предотвратить, чем потом прикладывать героические усилия для устранения ее последствий.
Если ржавчина все-таки появилась – это не повод опускать руки: есть немало эффективных способов ее удаления, и чем раньше предприняты активные меры, тем большим будет эффект от их применения. Итак, обо всем по порядку.
Механическое удаление ржавчины
Продукты коррозии обладают малой адгезией и поэтому легко удаляются с поверхности металла при механическом воздействии – например, при обработке металлической щеткой. Снять ржавый налет с крупных изделий можно с помощью шлифовального станка, соблюдая при этом простое правило: начинать нужно с крупного зерна, а для финишной обработки использовать самое мелкое. Участки металла, с которых удалена ржавчина, оказываются совершенно беззащитными перед атмосферным воздействием. Если их не обработать антикоррозионными составами, предотвращающими контакт с водой и кислородом, процесс ржавления только ускорится.
Химические способы удаления ржавчины
Зная природу и химический состав ржавчины, логично предположить, что удалить ее можно с помощью кислот. Из школьного курса химии известно, что оксиды и гидроксиды металлов легко взаимодействуют с кислотами, при этом образуются соли железа и соответствующей кислоты, и вода.
Например, при действии соляной кислоты происходят следующие реакции:
- 2Fe (OH)3 + 6HCL → 2FeCl3 + 6h3O
- Fe (OH)2 + 2HCL → FeCl2 +2h3O
Образующийся хлорид железа – водорастворимая соль, которую необходимо удалить с поверхности обрабатываемого изделия простым ополаскиванием в воде, а затем насухо вытереть поверхность. Не надо ждать, пока ржавчина начнет образовываться снова, очищенные участки следует обработать защитными составами.
При обработке кислотами существует опасность растворения металла, поскольку железо в электрохимическом ряду напряжений стоит до водорода, оно активно реагирует со многими разбавленными кислотами:
- Fe + 2HCl → FeCl2 + h3↑
По этой причине прежде, чем заняться химическими экспериментами в домашних условиях, необходимо почитать соответствующую литературу. Устранить побочный эффект поможет ингибитор коррозии – уротропин, при добавлении всего 1-2 г на литр раствора соляной кислоты реакция с железом не протекает.
Устранить побочный эффект поможет ингибитор коррозии – уротропин, при добавлении всего 1-2 г на литр раствора соляной кислоты реакция с железом не протекает.
Преобразователи ржавчины
Жидкие составы на основе ортофосфорной кислоты являются отличным способом предотвратить дальнейшее образование ржавчины на поверхности стальных и железных изделий. При таком способе обработки предварительно удаляются лишь те участки ржавчины, которые слабо держатся на основе. Образующийся в процессе реакции ортофосфат железа создает прочную защитную пленку, через которую не проникает влага и кислород, благодаря чему предотвращается дальнейшая коррозия металла. Для ускорения процесса высыхания на литр 25%-ого раствора ортофосфорной кислоты можно добавить 30-40 мл изобутилового спирта или 15 граммов винной кислоты.
Современное оборудование для удаления ржавчины
Механические способы очистки поверхности от ржавчины с помощью подручных средств применимы далеко не всегда, если изделие имеет сложную форму, то обработать все участки не представляется возможным.Химические способы тоже имеют свои недостатки, при несоблюдении элементарных правил техники безопасности можно получить химический ожог или отравление. Определенную проблему представляет и утилизация отработанных растворов.
Оптимальным способом удаления ржавчины, особенно с поверхности изделий сложной геометрической формы, является мягкий бластинг. Суть метода состоит в следующем, на металлическое изделие направляется струя сжатого воздуха, содержащая особые абразивные гранулы. Меняя давление, можно регулировать глубину слоя, снимаемого с поверхности – таким образом удаляется только слой ржавчины или окалины, а металл остается нетронутым. Гранулы ARMEX, используемые в аппарате для мягкого бластинга Nordblast NB 28-2, состоят из мельчайших частиц соды и мела. Попадая под большим давлением на поверхность, они легко удаляют не только ржавчину, но и лакокрасочные материалы.
Отличительной особенностью метода является абсолютная экологическая безопасность: применяемые компоненты химически инертны.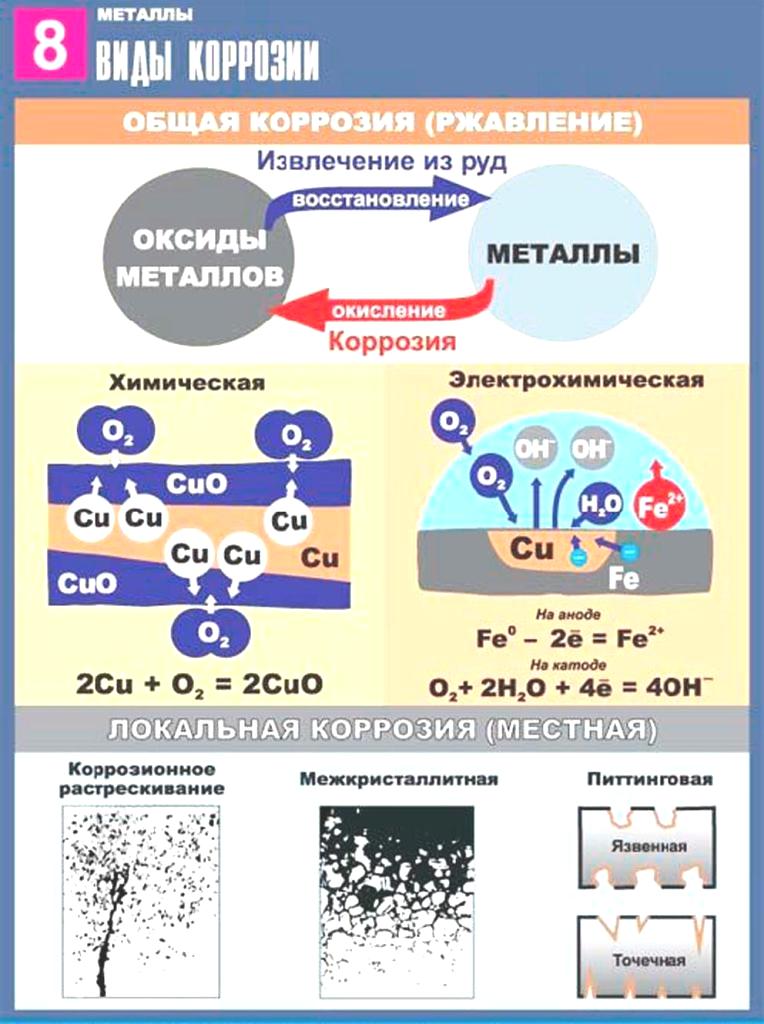 Многочисленные исследования доказали, что на поверхности металла практически не образуются царапины и иные микроскопические дефекты, которые последствии могут стать центрами повторного образования ржавчины. Щелочная природа гранул способствует образованию пассивной пленки на изделиях из железа или стали, предохраняя основной объем металла от коррозионного разрушения.
Многочисленные исследования доказали, что на поверхности металла практически не образуются царапины и иные микроскопические дефекты, которые последствии могут стать центрами повторного образования ржавчины. Щелочная природа гранул способствует образованию пассивной пленки на изделиях из железа или стали, предохраняя основной объем металла от коррозионного разрушения.
Наилучшие результаты применения аппарата мягкого бластинга Nordblast NB 28-2 получены при обработке деталей машин или яхт. Процесс чистки от ржавчины зависит от степени коррозии, обычно на полную обработку автомобиля уходит 1 день, яхты – 2 дня.
Чем раньше обнаружена проблема, тем проще бороться с ржавчиной. Какой способ наиболее предпочтителен – каждый решает самостоятельно, но не стоит пользоваться дедовскими методами, если есть оборудование, удаляющее ржавчину со 100%-ой эффективностью!
Как написать сбалансированную химическую реакцию для ржавления железа
Обновлено 26 апреля 2018 г.
Автор Chris Deziel
Ржавчина — это факт жизни на Земле, а также по крайней мере на одной другой планете Солнечной системы: Марсе. Красноватый оттенок этой планеты во многом обусловлен наличием оксида железа или ржавчины на ее поверхности. Ржавчина является результатом соединения железа с кислородом в процессе, называемом окислением, и наличие ржавчины на Марсе предполагает, что в прошлом на планете могло быть больше молекулярного кислорода, хотя углекислый газ, который является основным компонентом Марса «Настоящая атмосфера, также может поставлять кислород. Помимо газообразного кислорода для образования ржавчины нужна вода, потому что это двухэтапный процесс. Это указывает на то, что вода на Марсе могла быть в изобилии давным-давно.
TL;DR (слишком длинный; не читал)
Для образования ржавчины требуется железо, вода и кислород. Хотя это сложный процесс, химическое уравнение простое: 4Fe + 3O 2 + 6H 2 O → 4Fe(OH) 3 .
Первый шаг: Окисление твердого железа
Общеизвестно, что ржавчина возникает, когда вы оставляете воду на металлическом инструменте или подвергаете его воздействию влажного воздуха. Это потому, что первый шаг в процессе ржавчины включает растворение твердого железа в растворе. Формула для этого:
Fe(s) → Fe 2+ (водн.) + 2e –
Электроны, образовавшиеся в результате этой реакции, соединяются с ионами водорода в воде, а также с растворенным кислородом, образуя воду:
4e – + 4H + (водн.) + O 2 (водн.) → 2H 2 O(l)
В этих двух реакциях образуются вода и ионы железа(II), но не ржавчина. Чтобы это образовалось, должна произойти другая реакция.
Второй этап: образование гидратированного оксида железа (ржавчины)
Потребление ионов водорода, происходящее при растворении железа, оставляет в воде преобладание ионов гидроксида (ОН – ). Ионы железа(II) реагируют с ними с образованием грин раста:
Ионы железа(II) реагируют с ними с образованием грин раста:
Fe 2+ (водн.) + 2OH – (водн.) → Fe(OH) 2 (тв)
То есть т конец истории. Ионы железа (II) также соединяются с водородом и кислородом в воде с образованием ионов железа (III):
4Fe 2+ (водн.) + 4H + (водн.) + O 2 (водн.) → 4Fe 3+ (водн.) + 2H 2 O(л)
Эти ионы железа ответственны за образование красноватого осадка, который постепенно проедает дырки в автомобильные кузова и металлические кровли по всему миру. Они объединяются с дополнительными ионами гидроксида с образованием гидроксида железа (III):
Fe 3+ (водн.) + 3OH – (водн.) → Fe(OH) 3
Это соединение дегидратируется, превращаясь в Fe 2 О 3 .H 2 O — химическая формула ржавчины.
Написание сбалансированного уравнения
Если вы хотите составить сбалансированное уравнение для всего процесса, вам нужно знать только исходные реагенты и продукты реакции. Реагентами являются железо (Fe), кислород (O 2 ) и вода (H 2 O), а продуктом является гидроксид железа (III) Fe(OH) 3 , поэтому Fe + O 2 + H 2 O → Fe(OH) 3 . В сбалансированном уравнении одинаковое количество атомов кислорода, водорода и железа должно фигурировать в обеих частях уравнения. Сбалансируйте количество атомов водорода, умножив количество молекул воды на 6 и количество молекул гидроксида на 4. Затем вам нужно умножить количество O 2 молекул на 3 и число ионов Fe на 4. Результат:
4Fe + 3O 2 + 6H 2 O → 4Fe(OH) 3
900 Определение – Ржавление железа , Химическая формула, Профилактика В присутствии влаги железо соединяется с кислородом воздуха, образуя химическое вещество коричневого цвета, называемое ржавчиной (оксид железа). Оставшееся от ржавчины железо (оксид железа) не имеет физического процесса. Это дорогостоящая неприятность. Процесс замедления может сэкономить много денег.
Оставшееся от ржавчины железо (оксид железа) не имеет физического процесса. Это дорогостоящая неприятность. Процесс замедления может сэкономить много денег.
Многие металлы подвергаются коррозии на воздухе. Коррозия стали и железа называется ржавлением. Наиболее распространенным примером коррозии является то, что ржавчина отслаивается от поверхности металла, ржавление железа приводит к тому, что железо превращается в ржавчину – оранжево-красный порошок, обнажается свежая поверхность металла, и процесс коррозии продолжается.
| Содержание |
|
Химическая формула соединения известна как символическое представление состава соединения. Химическая формула ржавчины – Fe2O3, также известная как оксид железа или оксид железа. Последний продукт представляет собой серию химических реакций, упомянутых ниже. Формула ржавчины железа 4Fe + 3O 2 + 6H 2 O → 4Fe(OH) 3 . Процесс ржавчины требует как элементов воды, так и кислорода. Процесс обычно ускоряется при контакте с менее активными металлами, кислотами, напряжением в железе и наличием самой ржавчины.
Химическая формула ржавчины – Fe2O3, также известная как оксид железа или оксид железа. Последний продукт представляет собой серию химических реакций, упомянутых ниже. Формула ржавчины железа 4Fe + 3O 2 + 6H 2 O → 4Fe(OH) 3 . Процесс ржавчины требует как элементов воды, так и кислорода. Процесс обычно ускоряется при контакте с менее активными металлами, кислотами, напряжением в железе и наличием самой ржавчины.
Что такое уравнение для ржавчины?
Ржавление железа содержит усиление окисления железа, сопровождающееся потерей электронов. Ржавчина в основном состоит из двух разных оксидов железа. Они различаются степенью окисления атома железа – оксид железа или оксид железа со степенью окисления +2 и оксид железа или оксид железа со степенью окисления +3.
Ржавление по формуле железа представляет собой серию химических реакций, которые выглядят следующим образом:
- Fe(OH) 2 ⇌ FeO + H 2 O
- 4Fe(OH) 2 + O 2 + xH 2 O → 2Fe 2 O 3 .
 (x+4)H 2 O
(x+4)H 2 O - Fe(OH) 3 ⇌ FeO(OH) + H 2 O
- FeO(OH) ⇌ Fe
Ряд уравнений для коррозии приводит к красновато-коричневому отложению, называемому ржавчиной, которое образуется на железе при воздействии влажного воздуха. Ржавеющее железо претерпевает химические изменения, которые невозможно восстановить в виде чистого железа, изменив условия.
Как предотвратить ржавление железа?
Коррозия возникает при контакте железного предмета с воздухом и водой. Следовательно, если воздух и вода не контактируют с железными предметами, ржавчина не возникнет. Таким образом, большинство методов предотвращения ржавления железа включают покрытие железных предметов «чем-то», чтобы не допустить проникновения воздуха и воды. Некоторые из способов предотвратить ржавление железа перечислены ниже.
- Окраска
Ржавчину можно предотвратить, просто покрасив поверхность железа.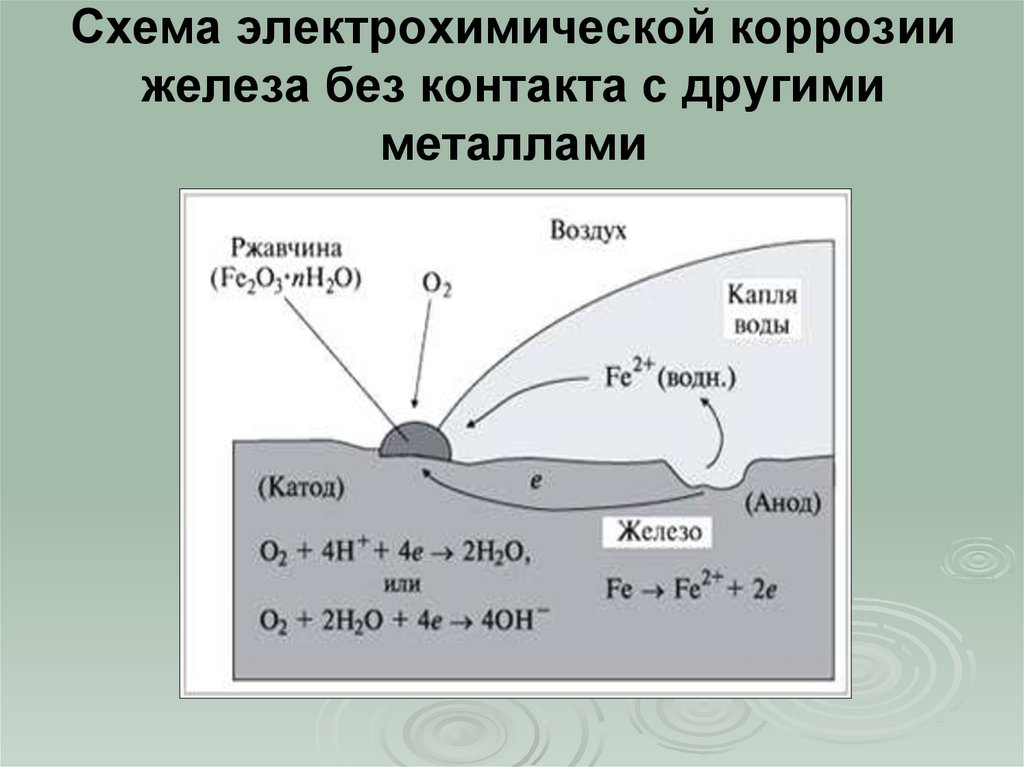 Лакирование создает барьер на поверхности железа, аналогичный цинкованию. Присутствие красителя образует границу между железом и окружающей атмосферой. Однако недостатком покраски железа является то, что она не держится так долго, как другие виды обработки поверхности.
Лакирование создает барьер на поверхности железа, аналогичный цинкованию. Присутствие красителя образует границу между железом и окружающей атмосферой. Однако недостатком покраски железа является то, что она не держится так долго, как другие виды обработки поверхности.
- Масло или смазка
Масло не только смазывает и облегчает движение металлических деталей с меньшим трением, но также обеспечивает защиту от коррозии. Идея здесь довольно проста; влага не будет мешать железу в металле с масляным покрытием и вызывать коррозию. Использование масла или смазки значительно снижает риск коррозии железа. В основном, подобно чернилам, смазка или масло образуют защитное покрытие на железе и, таким образом, предотвращают образование ржавчины.
- Гальванизация
Оцинковка является профилактическим средством против коррозии. Тонкий слой цинка покрывал железный или стальной предмет. Это предотвращает доступ кислорода и воды к основному металлу, но цинк также служит жертвенным металлом. Цинк более реактивен, чем железо, но он окисляется предпочтительнее, чем железный предмет. Оцинкованный металл, такой как навесы для хранения, сетка и металл на лодках, чаще всего используется для наружных предметов или всего, что может контактировать с влагой или водой.
Цинк более реактивен, чем железо, но он окисляется предпочтительнее, чем железный предмет. Оцинкованный металл, такой как навесы для хранения, сетка и металл на лодках, чаще всего используется для наружных предметов или всего, что может контактировать с влагой или водой.
Железо покрыто хромом для предотвращения коррозии:
Хром используется для гальваники из-за его свойств. После гальваники блестит, что делает материал привлекательным. Он невосприимчив к коррозии и царапинам. Это предотвращает появление царапин и коррозии объекта. В том смысле, что хром является единственным элементарным твердым телом, проявляющим антиферромагнитный порядок при комнатной температуре (и ниже), хром обладает уникальными магнитными свойствами. Его магнитное расположение меняется на парамагнитное при температуре выше 38 ° C.
Часто задаваемые вопросы (FAQ)
Q1. Какова химическая формула ржавчины?
Ответ. Химическая формула ржавчины: Fe 2 O 3 , который называется оксидом железа, но также известен как оксид железа.