Гальванические элементы и батареи | Основы электроакустики
Гальванические элементы и батареи
Гальванический элемент, изобретенный Вольтом (в честь его названа ныне всем известная единица измерения напряжения или электродвижущей силы — вольт), как все гениальное, предельно прост — это просто два электрода, опущенных в баночку с раствором электролита. Работа гальванического элемента основана на возникновении так называемой контактной разности потенциалов между проводящим ток предметом (электродом) и электролитом. В качестве последнего обычно выступают кислотные, соляные или щелочные растворы. Когда электроды изготовлены из разных материалов, то между ними, находящимися в электролите, возникают разные по величине электродвижущие силы. Их разность и используется для питания различных радиоэлектронных устройств. Она имеет порядок от долей вольта до нескольких вольт. Упомянутая конструкция, разумеется, давно не применяется. Хотя бы потому, что не является герметичной. А между тем раствор электролита (соляной или щелочной) опасен для человека и способен разъедать все, на что он попадает. Современные элементы имеют герметичный корпус. Наиболее распространены цилиндрические элементы, но существуют и элементы в прямоугольных корпусах и таблеточных. Они имеют металлический стаканчик (например, цинковый) — один электрод, и угольный стержень в нем — другой электрод. Стаканчик заполнен пористым веществом, пропитанным электролитом, и имеет герметичную крышку.
А между тем раствор электролита (соляной или щелочной) опасен для человека и способен разъедать все, на что он попадает. Современные элементы имеют герметичный корпус. Наиболее распространены цилиндрические элементы, но существуют и элементы в прямоугольных корпусах и таблеточных. Они имеют металлический стаканчик (например, цинковый) — один электрод, и угольный стержень в нем — другой электрод. Стаканчик заполнен пористым веществом, пропитанным электролитом, и имеет герметичную крышку.
К. сожалению, как только гальванический элемент начинает отдавать ток во внешнюю цепь, в нем происходит химическая реакция, ведущая к растворению материалов электродов и ослаблению концентрации электролита (его истощению). Это та неизбежная цена, которую приходится платить за преобразование химической энергии в электрическую. Эта реакция медленно идет и при отсутствии тока во внешней цепи, что приводит к саморазряду элемента и снижению его емкости по мере хранения.
Как отмечалось, сейчас используются почти исключительно герметичные конструкции гальванических элементов, например, в цилиндрических корпусах (стаканчиках) . К сожалению, абсолютно герметичные элементы используются лишь в технике специального назначения (например, космической или военной). Они очень дороги. Обычные элементы имеют неплохую степень герметичности — как правило, утечка электролита из них возможна только после примерно года эксплуатации, а у некоторых элементов даже спустя много лет.
К сожалению, абсолютно герметичные элементы используются лишь в технике специального назначения (например, космической или военной). Они очень дороги. Обычные элементы имеют неплохую степень герметичности — как правило, утечка электролита из них возможна только после примерно года эксплуатации, а у некоторых элементов даже спустя много лет.
Химические источники тока (ХИТ) в течении многих лет прочно вошли в нашу жизнь. В быту потребитель редко обращает внимание на отличия используемых ХИТ. Для него это батарейки и аккумуляторы. Обычно они используются в устройствах таких, как карманные фонари, игрушки, радиоприемники или автомобили. В том случае, когда потребляемая мощность относительно велика (10Ач), используются аккумуляторы, в основном кислотные, а также никель-железные и никель-кадмиевые. Они применяются в портативных ЭВМ (Laptop, Notebook, Palmtop), носимых средствах связи, аварийном освещении и пр. В последние годы такие аккумуляторы широко применяются в резервных источниках питания ЭВМ и электромеханических системах, накапливающих энергию для возможных пиковых нагрузок и аварийного питания электроэнергией жизненно-важных систем.
ГАЛЬВАНИЧЕСКИЕ ИСТОЧНИКИ ТОКА Гальванические источники тока одноразового действия представляют собой унифицированный контейнер, в котором находятся электролит, абсорбируемый активным материалом сепаратора, и электроды (анод и катод), поэтому они называются сухими элементами. Этот термин используется применительно ко всем элементам, не содержащим жидкого электролита. К обычным сухим элементам относятся углеродно-цинковые элементы. Сухие элементы применяются при малых токах и прерывистых режимах работы. Поэтому такие элементы широко используются в телефонных аппаратах, игрушках, системах сигнализации и др. Действие любого гальванического элемента основано на протекании в нем окислительно-восстановительной реакции. В простейшем случае гальванический элемент состоит из двух пластин или стержней, изготовленных из различных металлов и погруженных в раствор электролита. Такая система делает возможным пространственное разделение окислительно-восстановительной реакции: окисление протекает на одном металле, а восстановление – на другом. Таким образом, электроны передаются от восстановителя к окислителю по внешней цепи. Рассмотрим в качестве примера медно-цинковый гальванический элемент, работающий за счет энергии приведенной выше реакции между цинком и сульфатом меди. Этот элемент (элемент Якоби-Даниэля) состоит из медной пластины, погруженной в раствор сульфата меди (медный электрод), и цинковой пластины, погруженной в раствор сульфата цинка (цинковый электрод). Оба раствора соприкасаются друг с другом, но для предупреждения смешивания они разделены перегородкой, изготовленной из пористого материала. При работе элемента, т.е. при замкнутой цепи, цинк окисляется: на поверхности его соприкосновения с раствором атомы цинка превращаются в ионы и, гидратируясь, переходят в раствор. Высвобождающиеся при этом электроны движутся по внешней цепи к медному электроду. Вся совокупность этих процессов схематически изображается уравнением полуреакции, или электрохимическим уравнением: Zn = Zn2+ + 2e- На медном электроде протекает восстановление ионов меди.
Таким образом, электроны передаются от восстановителя к окислителю по внешней цепи. Рассмотрим в качестве примера медно-цинковый гальванический элемент, работающий за счет энергии приведенной выше реакции между цинком и сульфатом меди. Этот элемент (элемент Якоби-Даниэля) состоит из медной пластины, погруженной в раствор сульфата меди (медный электрод), и цинковой пластины, погруженной в раствор сульфата цинка (цинковый электрод). Оба раствора соприкасаются друг с другом, но для предупреждения смешивания они разделены перегородкой, изготовленной из пористого материала. При работе элемента, т.е. при замкнутой цепи, цинк окисляется: на поверхности его соприкосновения с раствором атомы цинка превращаются в ионы и, гидратируясь, переходят в раствор. Высвобождающиеся при этом электроны движутся по внешней цепи к медному электроду. Вся совокупность этих процессов схематически изображается уравнением полуреакции, или электрохимическим уравнением: Zn = Zn2+ + 2e- На медном электроде протекает восстановление ионов меди. Электроны, приходящие сюда от цинкового электрода, соединяются с выходящими из раствора дегидратирующимися ионами меди; образуются атомы меди, выделяющиеся в виде металла. Соответствующее электрохимическое уравнение имеет вид: Cu2+ + 2e- = Cu Суммарное уравнение реакции, протекающей в элементе, получится при сложении уравнений обеих полуреакций. Таким образом, при работе гальванического элемента, электроны от восстановителя переходят к окислителю по внешней цепи, на электродах идут электрохимические процессы, в растворе наблюдается направленное движение ионов.
Электроны, приходящие сюда от цинкового электрода, соединяются с выходящими из раствора дегидратирующимися ионами меди; образуются атомы меди, выделяющиеся в виде металла. Соответствующее электрохимическое уравнение имеет вид: Cu2+ + 2e- = Cu Суммарное уравнение реакции, протекающей в элементе, получится при сложении уравнений обеих полуреакций. Таким образом, при работе гальванического элемента, электроны от восстановителя переходят к окислителю по внешней цепи, на электродах идут электрохимические процессы, в растворе наблюдается направленное движение ионов.
В принципе электрическую энергию может дать любая окислительно- восстановительная реакция. Однако, число реакций, практически используемых в химических источниках электрической энергии, невелико. Это связано с тем, что не всякая окислительно-восстановительная реакция позволяет создать гальванический элемент, обладающий технически ценными свойствами. Кроме того, многие окислительно-восстановительные реакции требуют расхода дорогостоящих веществ. В отличие от медно-цинкового элемента, во всех современных гальванических элементах и аккумуляторах используют не два, а один электролит; такие источники тока значительно удобнее в эксплуатации.
В отличие от медно-цинкового элемента, во всех современных гальванических элементах и аккумуляторах используют не два, а один электролит; такие источники тока значительно удобнее в эксплуатации.
ТИПЫ ГАЛЬВАНИЧЕСКИХ ЭЛЕМЕНТОВ
Угольно-цинковые элементы Угольно-цинковые элементы (марганец-цинковые) являются самыми распространенными сухими элементами. В угольно-цинковых элементах используется пассивный (угольный) коллектор тока в контакте с анодом из двуокиси марганца (MnO2), электролит из хлорида аммония и катодом из цинка. Электролит находится в пастообразном состоянии или пропитывает пористую диафрагму.Такой электролит мало подвижен и не растекается, поэтому элементы называются сухими. Угольно-цинковые элементы “восстанавливаются” в течении перерыва в работе. Это явление обусловлено постепенным выравниванием локальных неоднородностей в композиции электролита, возникающих в процессе разряда. В результате периодического “отдыха” срок службы элемента продлевается. Достоинством угольно-цинковых элементов является их относительно низкая стоимость. К существенным недостаткам следует отнести значительное снижение напряжения при разряде, невысокую удельную мощность (5…10 Вт/кг) и малый срок хранения. Низкие температуры снижают эффективность использования гальванических элементов, а внутренний разогрев батареи его повышает. Повышение температуры вызывает химическую коррозию цинкового электрода водой, содержащейся в электролите, и высыхание электролита. Эти факторы удается несколько компенсировать выдержкой батареи при повышенной температуре и введением внутрь элемента, через предварительно проделанное отверстие, солевого раствора.
Достоинством угольно-цинковых элементов является их относительно низкая стоимость. К существенным недостаткам следует отнести значительное снижение напряжения при разряде, невысокую удельную мощность (5…10 Вт/кг) и малый срок хранения. Низкие температуры снижают эффективность использования гальванических элементов, а внутренний разогрев батареи его повышает. Повышение температуры вызывает химическую коррозию цинкового электрода водой, содержащейся в электролите, и высыхание электролита. Эти факторы удается несколько компенсировать выдержкой батареи при повышенной температуре и введением внутрь элемента, через предварительно проделанное отверстие, солевого раствора.
Щелочные элементы Как и в угольно-цинковых, в щелочных элементах используется анод из MnO2 и цинковый катод с разделенным электролитом. Отличие щелочных элементов от угольно-цинковых заключается в применении щелочного электролита, вследствие чего газовыделение при разряде фактически отсутствует, и их можно выполнять герметичными, что очень важно для целого ряда их применений.
Ртутные элементы Ртутные элементы очень похожи на щелочные элементы. В них используется оксид ртути (HgO). Катод состоит из смеси порошка цинка и ртути. Анод и катод разделены сепаратором и диафрагмой, пропитанной 40% раствором щелочи. Так как ртуть дефицитна и токсична, ртутные элементы не следует выбрасывать после их полного использования. Они должны поступать на вторичную переработку.
Серебряные элементы Они имеют “серебряные” катоды из Ag2O и AgO.
Литиевые элементы В них применяются литиевые аноды, органический электролит и катоды из различных материалов. Они обладают очень большими сроками хранения, высокими плотностями энергии и работоспособны в широком интервале температур, поскольку не содержат воды.
Так как литий обладает наивысшим отрицательным потенциалом по отношению ко всем металлам, литиевые элементы характеризуются наибольшим номинальным напряжением при минимальных габаритах. Ионная проводимость обеспечивается введением в растворители солей, имеющих анионы больших размеров. К недостаткам литиевых элементов следует отнести их относительно высокую стоимость, обусловленную высокой ценой лития, особыми требованиями к их производству (необходимость инертной атмосферы, очистка неводных растворителей). Следует также учитывать, что некоторые литиевые элементы при их вскрытии взрывоопасны.
К недостаткам литиевых элементов следует отнести их относительно высокую стоимость, обусловленную высокой ценой лития, особыми требованиями к их производству (необходимость инертной атмосферы, очистка неводных растворителей). Следует также учитывать, что некоторые литиевые элементы при их вскрытии взрывоопасны.
Литиевые элементы широко применяются в резервных источниках питания схем памяти, измерительных приборах и прочих высокотехнологичных системах.
Гальванический элемент: схема, принцип работы, состав
Главная » Виды батареек
На чтение 5 мин Просмотров 6.3к.
Впервые в мире гальванический элемент был разработан Луиджи Гальвани. Об его истории читайте в этой статье. По сути это временный источник электрического тока, который формируется за счет протекания химической реакции. Поток электронов формируется за счет взаимодействия между двумя разноименными металлами. В результате этого химическая энергия преобразуется в электрическую, которую уже можно использовать в повседневной жизни.
Поток электронов формируется за счет взаимодействия между двумя разноименными металлами. В результате этого химическая энергия преобразуется в электрическую, которую уже можно использовать в повседневной жизни.
Концентрационный гальванический элемент – это источник тока в состав которого входит 2 однотипных металлических электродов помещенных в смесь солей этого металла в различных концентрациях.
Кроме Гальвани созданием эффективной батареи занимался Даниэль Якоби. Он немного видоизменил свой источник энергии. В его состав входит пластина, выполненная из меди, помещенная в CuSO4 и пластина из цинка погруженная в ZnSO4. Чтобы не дать им воздействовать прямо друг на друга между ними установлена пористая стенка. Ниже представлена схема гальванического элемента Даниэля Якоби.
Цинк и медь обладают разной активностью и поэтому их заряд по величине будет различным. В итоге уровень электродов также не однозначен. Это позволяет им перемещаться и производить электрический или гальванический ток. Он начинает протекать, когда любой человек или изобретатель тока хранящего аппарата присоединяет нагрузку. В качестве нее может быть лампочка, приемник, компьютерная мышка и другие электрические устройства.
Он начинает протекать, когда любой человек или изобретатель тока хранящего аппарата присоединяет нагрузку. В качестве нее может быть лампочка, приемник, компьютерная мышка и другие электрические устройства.
Содержание
- Схема гальванического элемента
- Устройство гальванического элемента
- Принцип работы гальванического элемента
- Ответы на часто задаваемые вопросы
- Типы гальванических элементов
- Таблица гальванических элементов
- Назначение гальванического элемента
- Гальванический элемент в домашних условиях
- Процесс изготовления
Под схемой подразумевают его состав и устройство. Он может быть выполнен из нескольких химических элементов с применением вспомогательных приспособлений. Ниже об строение гальванического элемента будет рассказано кратко. Подробнее о нем читайте в этой статье!
Устройство гальванического элементаСамый простой энергетический накопитель состоит из:
- Стрежня из угля.

- Двух разнородных металлов.
- Электролита.
- Смола или пластик.
- Изолятора.
Как видно из этой схемы в составе строения гальванического элемента имеется отрицательный и положительный электрод. Они могут быть выполнены из меди, цинка и других металлов. Имеют название по типу медно цинковые. Иногда их называют сухие батарейки.
Обозначение гальванического элемента на схеме выполнено в виде двух вертикальных прямых приближенных друг к другу на небольшом расстоянии. Одна из которых будет меньше. По краям возле каждой такой линии имеются знаки, обозначающие полярность. У длинной линии ставят плюс, а у короткой минус. Рядом может располагаться вольтаж. Это означает что схема в которой используется батарейка работает только от этого напряжения.
Работа гальванического элемента осуществляется за счет движения электронов от одного металлического контакта к другому. Идет некое химическое превращение. Подробнее про термодинамику гальванического элемента и образование гальванического электричества читайте здесь.
Подробнее про термодинамику гальванического элемента и образование гальванического электричества читайте здесь.
| Гальванический/ая | Разъяснение |
| Батарея | Источник энергии работающий за счет процессов, происходящих в ограниченном миниатюрном пространстве. В частности, энергия появляется, когда идет химическая реакция. |
| Элемент Вольта или Вольтов столб | Это энергетический элемент впервые созданный ученым по фамилии Вольт. |
| Процесс | Взаимодействие между химическими элементами в результате которого образуется электрический ток. |
| Разряд | Это завершение протекания химической реакции. То есть взаимодействия между веществами не будет.Гальванический разряд есть в игре Warframe. По сути это модификация, которая находится в большом дефиците. Ее используют для холодного оружия. Полярность V2. |
| Гальванический контакт | Это контакт между электродами и раствором. |
| Эффект | Появление разности между двумя контактами из 2-х типов металлов. Величина зависит от температуры и химии проводников. По сути это первый закон Вольта. |
| Соединение/связь/цепь | Объединение 2-х и более участков электрической цепи с источником тока. |
| Гальванический заряд | Наполнение батареи энергией. |
Гальваника – это протекание химических процессов с использование электрического тока. В ходе реакция сокращается количество растворенных катионов металла до такой степени что в конечном итоге они создают единое покрытие на металлическом электроде. В итоге предмет получается более прочным, исчезают небольшие вмятины и его вид становится более привлекательным.
Выделяют ряд батареек определенных типов.
Таблица гальванических элементов| Тип | Напряжение | Основные плюсы |
| Литиевые | 3 V | Большая емкость, высокая сила тока. |
| Солевые батарейки или угольно — цинковые | 1.5 в | Самые дешевые. |
| Никельоксигидроксильные NiOOH | 1.6 вольт | Повышенный ток. Большая емкость. |
| Щелочные или алкалиновые | 1.6 V | Большая сила тока. Хороший объем. |
Более детальнее эта тема раскрыта в статье виды батареек!
Назначение гальванического элементаОн предназначен для запуска электрической технике. Это могут быть:
- Часы.
- Пульты.
- Фонарики.
- Медицинское оборудование.
- Ноутбуки.
- Игрушки.
- Брелки.
- Телефоны.
- Лазерные указки.
- Калькуляторы.
И им подобные окружающие нас вещи.
Гальванический элемент в домашних условияхПростой источник тока можно сделать и своими руками. Для этого нам потребуется следующий инвентарь:
- Пластиковый стакан.
- Электролит.
 В качестве него можно взять соленый раствор, газировку или лимонную кислоту, разведенную в воде.
В качестве него можно взять соленый раствор, газировку или лимонную кислоту, разведенную в воде. - Пластинки двух разных металлов. К примеру алюминий и медь.
- Провода
Берем пластиковый стаканчик и наливаем в него электролит. Не следует наполнять стакан до самых краев. Лучше на 1-2 сантиметра не долить. К металлическим пластинам прикрепите проводники. Далее установите на края нашей емкости пластины из меди и алюминия. Они должны располагаться параллельно друг к другу. Когда все готова можно замерить с помощью вольтметра напряжение.
Подключите прибор и прикоснитесь щупами к контактам нашего источника тока. Держите и не отрывайте их пока на дисплее не высветится напряжение. Обычно оно составляет 0.5-0.7 вольт. Такие цифры показываются в зависимости от электролита. Точнее используемого вещества в его качестве.
Более детально создание батареи своими руками описано в этой статье.
Таким образом изготавливается самодельный гальванический элемент.
Batareykaa.ru
Гальваническая батарея – Проект Джозефа Генри
Описание Джозефом Генри своей батареи
Appelton-Cyclopedia.pdf
» Первая батарея – Резюме доклада Вольты 1800 г. в Королевском обществе (JSTOR)
Выдержки, относящиеся к гальванической батарее Генри
Заметки Генри К. Кэмерона. Лекция 11 февраля.
«Простейшая форма гальванической батареи состоит из стакана с кислотой, в который погружены два металла, к которым кислота имеет притяжение. Кислота, слегка растворяя один (или, скорее, оксид одного, чистый металл не подвергается воздействию), получает от него часть, оставляя его отрицательным, и передает его другому, делая его положительным. Направление тока от металла, на который действует кислота, к другому металлу, а оттуда обратно к первому металлу, когда есть соединение, тонкая платиновая проволока, помещенная в соединение, при прохождении тока становится красной.

 Вольта в 1798 обнаружил сваю (только модификацией которой является батарея. Она состоит из цинковых пластин, лежащих на медных пластинах с фланелью, пропитанной кислотой между каждой парой. Это вызывает возражения, поскольку кислота выдавливается под действием веса в дно. Затем действие относилось к простому контакту. Круикшенкс превратил его в гальванический желоб, который представляет собой только груду на боку. Пластины цинка и меди спаяны вместе, а кислота находится между парами. Принцип этого был Объяснение выше. Эффект усиливается при пропускании разряда через катушку с проволокой. Объяснение этого ниже.
Вольта в 1798 обнаружил сваю (только модификацией которой является батарея. Она состоит из цинковых пластин, лежащих на медных пластинах с фланелью, пропитанной кислотой между каждой парой. Это вызывает возражения, поскольку кислота выдавливается под действием веса в дно. Затем действие относилось к простому контакту. Круикшенкс превратил его в гальванический желоб, который представляет собой только груду на боку. Пластины цинка и меди спаяны вместе, а кислота находится между парами. Принцип этого был Объяснение выше. Эффект усиливается при пропускании разряда через катушку с проволокой. Объяснение этого ниже. Доктор Хэйр из Филадельфии уделял большое внимание усовершенствованию и совершенствованию аппаратуры и сделал много ценных изобретений и т. д., особенно в отношении гальванических батарей. Для одного из них пластины были так закреплены, что их можно было снимать без ограничений. Он назвал это дефлагратором, и причина его изобретения заключалась в том, что хотя батарея сначала действовала мощно, но постепенно она становилась все слабее и, наконец, почти перестала действовать. Причина этого была неизвестна до недавнего времени. Причиной износа сваи или батареи являются (1) образование сульфата цинка, который, диффундируя в раствор, оседает (в виде металлического цинка) на медь; таким образом создается противоток электричества, который в некоторой степени нейтрализует старый: (2) Местное действие. Промышленный цинк очень нечистый, содержит железо и т. д., поэтому [???] электричества, вырабатываемого цинком, нейтрализуется таким образом. (3) Образуется водород, который, будучи непроводником и прилипая к меди, покрывает ее пленкой, препятствуя тем самым быстрому прохождению тока и т. д. Лекарство от сульфата цинка состоит в том, чтобы положить бумажную перегородку, через которую кислота проходит легко, но с большим трудом.
Причина этого была неизвестна до недавнего времени. Причиной износа сваи или батареи являются (1) образование сульфата цинка, который, диффундируя в раствор, оседает (в виде металлического цинка) на медь; таким образом создается противоток электричества, который в некоторой степени нейтрализует старый: (2) Местное действие. Промышленный цинк очень нечистый, содержит железо и т. д., поэтому [???] электричества, вырабатываемого цинком, нейтрализуется таким образом. (3) Образуется водород, который, будучи непроводником и прилипая к меди, покрывает ее пленкой, препятствуя тем самым быстрому прохождению тока и т. д. Лекарство от сульфата цинка состоит в том, чтобы положить бумажную перегородку, через которую кислота проходит легко, но с большим трудом.
Гальваническое действие объясняется с помощью химической теории, автором которой является Воллартон (sp?). Дэви Беккилер, Фарадей и Генри значительно улучшили его. Предполагается, что атомы разных тел существуют в разных электрических состояниях, т. е. кислород естественно отрицательный, а водород положительный. Соединяясь вместе, они притягиваются, объединяются и образуют каплю воды. Кислота никогда не действует на чистый металл; его необходимо предварительно окислить; этот оксид растворяется кислотой; это постоянно представляет новую поверхность для действия и т.д. Оксид образуется при соединении кислорода в воде с цинком, водород как бы незаметно выходит на медь. Цинк, являющийся положительным, заставляет кислород или отрицательный конец атома воды по индукции занимать приблизительное положение, и, следовательно, мы имеем ряд атомов, расположенных, как на первом рисунке напротив. Теперь, когда провода соединяются, цинк становится настолько сильно положительным, что благодаря индукции он заставляет соседний атом кислорода становиться более сильно отрицательным, так что он покидает атом водорода, соединяется с одним из цинков, образуя оксид цинка и т. д. Освобожденный таким образом атом водорода соединяется с кислородом следующего атома воды и так до медной пластины, где последний атом водорода, не имеющий кислорода, с которым можно было бы соединиться, отделяется и поднимается и т.
е. кислород естественно отрицательный, а водород положительный. Соединяясь вместе, они притягиваются, объединяются и образуют каплю воды. Кислота никогда не действует на чистый металл; его необходимо предварительно окислить; этот оксид растворяется кислотой; это постоянно представляет новую поверхность для действия и т.д. Оксид образуется при соединении кислорода в воде с цинком, водород как бы незаметно выходит на медь. Цинк, являющийся положительным, заставляет кислород или отрицательный конец атома воды по индукции занимать приблизительное положение, и, следовательно, мы имеем ряд атомов, расположенных, как на первом рисунке напротив. Теперь, когда провода соединяются, цинк становится настолько сильно положительным, что благодаря индукции он заставляет соседний атом кислорода становиться более сильно отрицательным, так что он покидает атом водорода, соединяется с одним из цинков, образуя оксид цинка и т. д. Освобожденный таким образом атом водорода соединяется с кислородом следующего атома воды и так до медной пластины, где последний атом водорода, не имеющий кислорода, с которым можно было бы соединиться, отделяется и поднимается и т. д. Атомы, будучи свободными для движения, располагаются, как прежде, и происходит то же самое действие. Новая строка также может быть представлена последовательно. Если атомам не позволено двигаться между собой (?), т.е. при замораживании воды вышеупомянутые эффекты не будут иметь место. Цифры напротив показывают внешний вид до и после действия.
д. Атомы, будучи свободными для движения, располагаются, как прежде, и происходит то же самое действие. Новая строка также может быть представлена последовательно. Если атомам не позволено двигаться между собой (?), т.е. при замораживании воды вышеупомянутые эффекты не будут иметь место. Цифры напротив показывают внешний вид до и после действия.
За последние несколько лет в батарею было внесено много усовершенствований. (1) Между пластинами вводится пористая мембрана, через которую действует кислота, но которая препятствует переходу сульфата цинка в медь. (2) Используя различные жидкости на разных сторонах мембраны. Высвобожденный водород, будучи непроводником, проникает в медную пластину, тем самым препятствуя ее действию. На поверхность медной пластины наливаем азотную кислоту, часть кислорода которой соединяется с образующимся водородом, образуя воду, и сама восстанавливается до азотистой кислоты. Таким образом предотвращается образование пленки, и получается новый ток, который добавляется к предыдущему току от пластины к пластине. (3) Мы предотвращаем влияние местного действия, используя чистый или амальгамированный цинк. Покрытый ртутью, он сопротивляется действию кислоты, но все же производит электрический ток. Мы также можем использовать пластину из платинированной меди между 2 пластинами из цинка. Постоянная батарея Даниэля состоит из куска чистого или амальгамированного цинка в бумажном конверте, содержащем сульфат меди (или серную кислоту, ПРИМЕЧАНИЕ: похоже, что серная кислота была написана поверх сульфата меди), все это находится в цилиндрическом сосуде, состоящем из меди. табличке, и содержащей сульфат меди/серной кислоты (опять же, одно написано над другим). Сульфат меди отдает кислород образующемуся водороду, образуя воду, и, таким образом, постоянно откладывается некоторое количество чистой меди, увеличивая тем самым толщину медной пластины. Таким образом, оно становится постоянным.
(3) Мы предотвращаем влияние местного действия, используя чистый или амальгамированный цинк. Покрытый ртутью, он сопротивляется действию кислоты, но все же производит электрический ток. Мы также можем использовать пластину из платинированной меди между 2 пластинами из цинка. Постоянная батарея Даниэля состоит из куска чистого или амальгамированного цинка в бумажном конверте, содержащем сульфат меди (или серную кислоту, ПРИМЕЧАНИЕ: похоже, что серная кислота была написана поверх сульфата меди), все это находится в цилиндрическом сосуде, состоящем из меди. табличке, и содержащей сульфат меди/серной кислоты (опять же, одно написано над другим). Сульфат меди отдает кислород образующемуся водороду, образуя воду, и, таким образом, постоянно откладывается некоторое количество чистой меди, увеличивая тем самым толщину медной пластины. Таким образом, оно становится постоянным.
Батарея Грейва, которая на сегодняшний день является самой мощной из всех используемых, состоит из серной кислоты с одной стороны и азотной кислоты с другой. Цинковая пластина помещается в первую, а медная пластина (которую в более мощных заменяет платина) вставляется во вторую и т. д. Азотная кислота воздействовала бы на медь, и таким образом индуцировался бы противоток, который существенно мешал бы действию. Поэтому мы используем платину. Теория Ома в отношении рабочей мощности батареи дала желаемое, которого научный мир искал в течение долгого времени. Это то, что эффективная или рабочая мощность батареи прямо пропорциональна электродвижущей силе и обратно пропорциональна сопротивлению или A = n*E/(n*R+r), где E = электродвижущая сила, R = сопротивление кислоты, r = сопротивление провода и n = количество пластин. По этому мы можем рассчитать мощность любой батареи. (1) Эффекты гальванизма в покое. Являются ли электрические эффекты (2) Его эффекты в движении являются физиологическими, механическими, магнитными, химическими и теплотворными. и т. д. и т. д. Существует также гальваническая индукция. Электродвижущая сила увеличивается с увеличением количества пластин.
Цинковая пластина помещается в первую, а медная пластина (которую в более мощных заменяет платина) вставляется во вторую и т. д. Азотная кислота воздействовала бы на медь, и таким образом индуцировался бы противоток, который существенно мешал бы действию. Поэтому мы используем платину. Теория Ома в отношении рабочей мощности батареи дала желаемое, которого научный мир искал в течение долгого времени. Это то, что эффективная или рабочая мощность батареи прямо пропорциональна электродвижущей силе и обратно пропорциональна сопротивлению или A = n*E/(n*R+r), где E = электродвижущая сила, R = сопротивление кислоты, r = сопротивление провода и n = количество пластин. По этому мы можем рассчитать мощность любой батареи. (1) Эффекты гальванизма в покое. Являются ли электрические эффекты (2) Его эффекты в движении являются физиологическими, механическими, магнитными, химическими и теплотворными. и т. д. и т. д. Существует также гальваническая индукция. Электродвижущая сила увеличивается с увеличением количества пластин. Электрические эффекты лучше всего показаны стопкой Де Люка. Это образуется путем наклеивания покрытия из оловянной фольги на одну сторону листа бумаги и черного оксида марганца на другую и высушивания. Разрезание пушечным молотком и укладка этих круглых кусков один на другой так, чтобы образовалась стопка, причем одна и та же сторона каждого куска всегда должна быть обращена вверх и т. д. Их помещают в стеклянную трубку и запаивают. Влага пасты в бумаге служит кислоте, марганец — цинку. Один конец, конечно, положительный, а другой отрицательный и т. д.
Электрические эффекты лучше всего показаны стопкой Де Люка. Это образуется путем наклеивания покрытия из оловянной фольги на одну сторону листа бумаги и черного оксида марганца на другую и высушивания. Разрезание пушечным молотком и укладка этих круглых кусков один на другой так, чтобы образовалась стопка, причем одна и та же сторона каждого куска всегда должна быть обращена вверх и т. д. Их помещают в стеклянную трубку и запаивают. Влага пасты в бумаге служит кислоте, марганец — цинку. Один конец, конечно, положительный, а другой отрицательный и т. д.
Лекция 13 февраля.
” Эксперименты в гальванизме и т. д.
Постоянная батарея Даниэля была показана в действии сегодня утром. Он состоял из 22 цилиндрических медных кувшинов, расположенных таким образом, что образовывал то, что французы называют couronne des tasses1 (по-французски «венец из очков»), каждый из которых содержал пластину из амальгамированного цинка, разделенную, однако, перегородкой из бумаги, сульфата меди. помещают в каждую ячейку, чтобы поглощать водород, как только он образуется. Количество гальванизма зависит от размера пластин, интенсивность от их количества. Эта батарея давала искры и влияла на электрометр, тем самым показывая идентичность гальванической и электрической жидкости. Двенадцать чашек батареи Гроувса по действию равны большим батареям в Философском зале, состоящим из 300 пластин по плану д-ра Хора для внезапного [??].
помещают в каждую ячейку, чтобы поглощать водород, как только он образуется. Количество гальванизма зависит от размера пластин, интенсивность от их количества. Эта батарея давала искры и влияла на электрометр, тем самым показывая идентичность гальванической и электрической жидкости. Двенадцать чашек батареи Гроувса по действию равны большим батареям в Философском зале, состоящим из 300 пластин по плану д-ра Хора для внезапного [??].
Энергия находится в нестабильном состоянии. Некоторые считают, что мозг представляет собой гальваническую батарею, и что, когда мы проявляем нашу волю в отношении движения какой-либо части нашего тела, поток электричества проходит вдоль нерва, заставляя мышцу сокращаться и т. д. Но это не исследовано. Исследования Matteuci (sp?), выдающегося итальянца, стремились показать, что сокращения мышцы происходят из-за электрического тока, существующего в самой мышце, а не проводящегося туда нервом из мозга. . .
Если мы погрузим провод батареи в воду, он разложится на свои элементы водород и кислород, первый станет отрицательным, а второй положительным.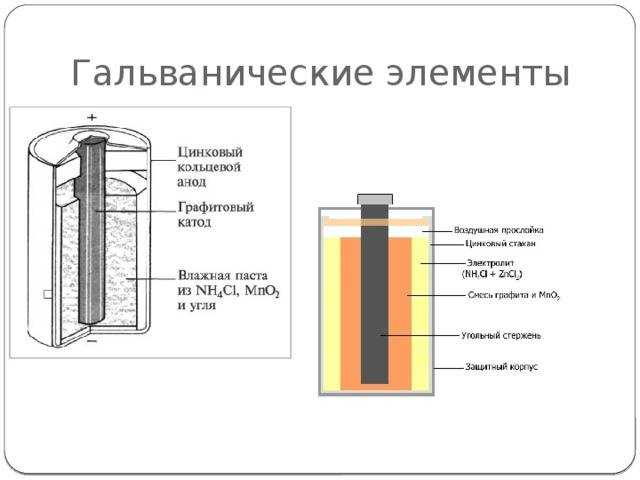 Если мы поместим перевернутый стеклянный сосуд над каждым полюсом, чтобы получать образующиеся газы, мы обнаружим, что на одну часть кислорода приходится две части водорода. После этого газы могут быть сожжены и т. д. Никакого действия не происходит между полюсами (по крайней мере, микроскопическое наблюдение ничего не обнаруживает), но происходит над каждым полюсом. Если гальваническую жидкость пропустить через смесь водорода и кислорода, она произведет взрыв, заставив их объединиться и снова превратиться в воду».
Если мы поместим перевернутый стеклянный сосуд над каждым полюсом, чтобы получать образующиеся газы, мы обнаружим, что на одну часть кислорода приходится две части водорода. После этого газы могут быть сожжены и т. д. Никакого действия не происходит между полюсами (по крайней мере, микроскопическое наблюдение ничего не обнаруживает), но происходит над каждым полюсом. Если гальваническую жидкость пропустить через смесь водорода и кислорода, она произведет взрыв, заставив их объединиться и снова превратиться в воду».
- Google Книги: Элементы электричества и электрохимии
Теория гальванической батареи Генри
Батарея Джозефа Генри была одним из самых ранних и простых типов батарей. Он состоял из медного и цинкового электродов, погруженных в раствор разбавленной серной кислоты и соединенных внешним проводником.
Чтобы понять работу батареи Генри на языке современной химии, проще всего начать с понимания работы аналогичной батареи, элемента Даниэля. Идеальная ячейка Даниэля состоит из медного электрода, погруженного в 1М раствор сульфата меди, и цинкового электрода, погруженного в 1М раствор сульфата цинка. Два раствора соединены солевым мостиком или пористой мембраной, которая пропускает положительные ионы, но предотвращает смешивание растворов.
Идеальная ячейка Даниэля состоит из медного электрода, погруженного в 1М раствор сульфата меди, и цинкового электрода, погруженного в 1М раствор сульфата цинка. Два раствора соединены солевым мостиком или пористой мембраной, которая пропускает положительные ионы, но предотвращает смешивание растворов.
Электрохимические элементы, такие как элемент Даниэля, работают благодаря протеканию определенного типа химической реакции, реакции окисления/восстановления или «окислительно-восстановительной». Окислительно-восстановительная реакция происходит, когда один металл отдает электроны, что известно как окисление, а другой металл одновременно получает эти электроны, что является восстановлением. Место, где происходит восстановление, называется катодом, а место, где происходит окисление, — анодом. Чтобы записать эти реакции, используя химическую терминологию, окисление некоторого данного металла M записывается как:
M → M n+ + ne –
Точно так же восстановление данного металла записывается как:
M n+ + ne – →n
3 90,0023 90,0023 90,0023 90,0023 – число электронов, связанных с реакцией. Например, в окислении цинка участвуют два электрона, так что реакция будет записана как:
Например, в окислении цинка участвуют два электрона, так что реакция будет записана как:
Zn → Zn 2+ + 2e –
С другой стороны, в восстановлении водорода участвует только один электрон, поэтому такая реакция будет:
H + + e – →H
Очень важно отметить, что невозможно окисление без восстановления, и наоборот. Всякий раз, когда что-то окисляется, что-то еще должно быть восстановлено. Каждая из этих реакций называется полуреакцией, а полная электрохимическая реакция представляет собой простую сумму двух полуреакций. В ячейке Даниэля соответствующими реакциями являются восстановление меди и окисление цинка. Реакция восстановления меди:
Cu 2+ + 2e – →Cu
В сочетании с приведенной выше реакцией окисления цинка общая реакция для ячейки Даниэля составляет:
Cu 2+ + Zn →Cu + Zn 2+
Для того, чтобы понять, как эта реакция образует батарею, необходима еще одна очень важная идея — концепция электродного потенциала. Электродный потенциал представляет собой электрический потенциал (измеряемый в вольтах), связанный с каждой окислительно-восстановительной реакцией. Этот потенциал возникает из-за того, что не все металлы имеют одинаковую электроотрицательность, которая является мерой того, насколько легко элемент может быть ионизирован. Электроотрицательность обычно измеряется по безразмерной шкале от 0,7 до 3,3, которая откалибрована по тому, насколько легко различные элементы образуют и разрывают связи. Электроотрицательность также можно рассматривать как меру того, насколько сильно металл хочет удерживать свои электроны. Если соединить два металла с разной электроотрицательностью, металл с более низкой электроотрицательностью будет стремиться отдать свои электроны другому металлу. Именно эта тенденция вызывает разность потенциалов и, следовательно, поток электронов.
Электродный потенциал представляет собой электрический потенциал (измеряемый в вольтах), связанный с каждой окислительно-восстановительной реакцией. Этот потенциал возникает из-за того, что не все металлы имеют одинаковую электроотрицательность, которая является мерой того, насколько легко элемент может быть ионизирован. Электроотрицательность обычно измеряется по безразмерной шкале от 0,7 до 3,3, которая откалибрована по тому, насколько легко различные элементы образуют и разрывают связи. Электроотрицательность также можно рассматривать как меру того, насколько сильно металл хочет удерживать свои электроны. Если соединить два металла с разной электроотрицательностью, металл с более низкой электроотрицательностью будет стремиться отдать свои электроны другому металлу. Именно эта тенденция вызывает разность потенциалов и, следовательно, поток электронов.
Различные электроотрицательности
[ПРОДОЛЖЕНИЕ СЛЕДУЕТ]
Теория гальванической батареи Генри
Батарея Джозефа Генри была одним из самых ранних и простых типов батарей. Он состоял из медного и цинкового электродов, погруженных в раствор разбавленной серной кислоты и соединенных внешним проводником.
Он состоял из медного и цинкового электродов, погруженных в раствор разбавленной серной кислоты и соединенных внешним проводником.
Чтобы понять работу батареи Генри на языке современной химии, проще всего начать с понимания работы аналогичной батареи, элемента Даниэля. Идеальная ячейка Даниэля состоит из медного электрода, погруженного в 1М раствор сульфата меди, и цинкового электрода, погруженного в 1М раствор сульфата цинка. Два раствора соединены солевым мостиком или пористой мембраной, которая пропускает положительные ионы, но предотвращает смешивание растворов.
Электрохимические элементы, такие как элемент Даниэля, работают благодаря протеканию определенного типа химической реакции, реакции окисления/восстановления или «окислительно-восстановительной». Окислительно-восстановительная реакция происходит, когда один металл отдает электроны, что известно как окисление, а другой металл одновременно получает эти электроны, что является восстановлением. Место, где происходит восстановление, называется катодом, а место, где происходит окисление, — анодом. Чтобы записать эти реакции, используя химическую терминологию, окисление некоторого данного металла M записывается как:
Чтобы записать эти реакции, используя химическую терминологию, окисление некоторого данного металла M записывается как:
M → M n+ + ne –
Точно так же восстановление данного металла записывается как:
M n+ + ne – →n
3 90,0023 – число электронов, связанных с реакцией. Например, в окислении цинка участвуют два электрона, так что реакция будет записана как:
Zn → Zn 2+ + 2e –
С другой стороны, в восстановлении водорода участвует только один электрон, поэтому такая реакция будет:
H + + e – →H
Очень важно отметить, что невозможно окисление без восстановления, и наоборот. Всякий раз, когда что-то окисляется, что-то еще должно быть восстановлено. Каждая из этих реакций называется полуреакцией, а полная электрохимическая реакция представляет собой простую сумму двух полуреакций. В ячейке Даниэля соответствующими реакциями являются восстановление меди и окисление цинка. Реакция восстановления меди:
В ячейке Даниэля соответствующими реакциями являются восстановление меди и окисление цинка. Реакция восстановления меди:
Cu 2+ + 2e – →Cu
В сочетании с приведенной выше реакцией окисления цинка общая реакция для ячейки Даниэля:
Cu 2+ + Zn →Cu + Zn 2+
Для того чтобы понять, как эта реакция образует батарею, необходима еще одна важная идея — концепция электродного потенциала. Электродный потенциал представляет собой электрический потенциал (измеряемый в вольтах), связанный с каждой окислительно-восстановительной реакцией. Этот потенциал возникает из-за того, что не все металлы имеют одинаковую электроотрицательность, которая является мерой того, насколько легко элемент может быть ионизирован. Электроотрицательность обычно измеряется по безразмерной шкале от 0,7 до 3,3, и более подробное объяснение можно найти в конце этого раздела. Электроотрицательность также можно рассматривать как меру того, насколько сильно металл хочет удерживать свои электроны. Если соединить два металла с разной электроотрицательностью, металл с более низкой электроотрицательностью будет стремиться отдать свои электроны другому металлу. Именно эта тенденция вызывает разность потенциалов и, следовательно, поток электронов. В этом случае напряжение, связанное с восстановлением меди, составляет 0,340 вольт, а напряжение, связанное с окислением цинка, составляет -0,763 вольта. Общая разница напряжений между двумя ячейками представляет собой простую разницу между этими двумя напряжениями: 0,340 – 9 В.0045 – .763 = 1,103 В
Если соединить два металла с разной электроотрицательностью, металл с более низкой электроотрицательностью будет стремиться отдать свои электроны другому металлу. Именно эта тенденция вызывает разность потенциалов и, следовательно, поток электронов. В этом случае напряжение, связанное с восстановлением меди, составляет 0,340 вольт, а напряжение, связанное с окислением цинка, составляет -0,763 вольта. Общая разница напряжений между двумя ячейками представляет собой простую разницу между этими двумя напряжениями: 0,340 – 9 В.0045 – .763 = 1,103 В
Трудно определить напряжение, связанное с данной окислительно-восстановительной реакцией, поскольку полуреакции не могут протекать независимо, и можно непосредственно измерить только разницу в напряжениях. Чтобы решить эту проблему, восстановление/окисление водорода было определено как имеющее электродный потенциал 0 В, а все потенциалы полуэлемента представляют собой разницу между окислением/восстановлением рассматриваемого элемента и окислением/восстановлением водорода – положительные значения. означают, что элемент вызывает окисление водорода, а отрицательные значения означают, что он вызывает восстановление водорода. Все эти напряжения определяются экспериментально, и доступно множество таблиц для различных элементов.
означают, что элемент вызывает окисление водорода, а отрицательные значения означают, что он вызывает восстановление водорода. Все эти напряжения определяются экспериментально, и доступно множество таблиц для различных элементов.
Кроме того, потенциалы определены для электрода из чистого металла, погруженного в 1М раствор его ионов при 25°С, что важно, поскольку и температура, и концентрация ионов влияют на создаваемое напряжение. Этот эффект описывается уравнением Нернста, которое дает изменение напряжения от стандартного потенциала, вызванное изменениями концентрации и температуры.
Поскольку медь имеет более высокую электроотрицательность (1,90), чем цинк (1,65), электроны имеют тенденцию покидать атомы цинка и перемещаться к меди, создавая ток через соединительный провод. Cu 9Ионы 0045 2+ подхватывают эти электроны и превращаются в атомы Cu, которые осаждаются на медном электроде. Атомы Zn на цинковом электроде превращаются в ионы Zn 2+ , которые переходят в раствор, что в конечном итоге приводит к полной коррозии цинкового электрода. Для предотвращения дисбаланса заряда одновременно положительные ионы H + будут перетекать через пористую мембрану из сульфата цинка в сульфат меди, а SO 4 – – в обратном направлении. Поток электронов через провод, соединяющий цинковый и медный электроды, представляет собой ток, обеспечивающий эффективность батареи.
Для предотвращения дисбаланса заряда одновременно положительные ионы H + будут перетекать через пористую мембрану из сульфата цинка в сульфат меди, а SO 4 – – в обратном направлении. Поток электронов через провод, соединяющий цинковый и медный электроды, представляет собой ток, обеспечивающий эффективность батареи.
Батарейки, которые использовал Джозеф, немного, но существенно отличались от описанной выше. Они по-прежнему использовали цинковые и медные электроды, но электроды не были разделены в двух контейнерах и не были погружены в растворы их ионов, а просто были помещены вместе в раствор разбавленной серной кислоты (насколько разбавленным в настоящее время является вопросом некоторой неопределенности). Это означает, что реакция коренным образом отличается от реакции в ячейке Даниэля, потому что медь больше не является восстановителем, поскольку в растворе, подлежащем восстановлению, нет свободных ионов меди. Вместо этого восстановителем становится водород, поэтому реакция становится
2H + + Zn →H 2 + Zn 2+
Когда медь и цинк соединяются вместе за счет внешней проводимости, на поверхности меди заметно образуются пузырьки водорода, указывающие на то, что это реакция происходит.
Это снижает теоретическое напряжение батареи — поскольку водород определяется как 0 В, теоретическое напряжение становится всего 0,763 вольта. Однако для концентрации кислоты 0,8 М это становится примерно 0,87 вольт, что было измерено экспериментально.
Внутреннее сопротивление аккумуляторов Генри трудно точно определить. Реплики его аккумуляторов имели измеренное сопротивление 3-5 Ом, что довольно много (большинство современных аккумуляторов имеют внутреннее сопротивление менее 0,1 Ом). Однако неясно, какой молярности была его кислота, и чем выше концентрация кислоты, тем ниже внутреннее сопротивление до определенного предела. Большая площадь поверхности также снижает внутреннее сопротивление. Однако его эксперименты с магнитом Олбани и другими, кажется, предполагают, что его батареи имели довольно низкое внутреннее сопротивление. Одно из возможных объяснений состоит в том, что его кислоты были не более концентрированными, а на самом деле гораздо более разбавленными, чем 0,8М, при которой были сделаны некоторые предварительные измерения.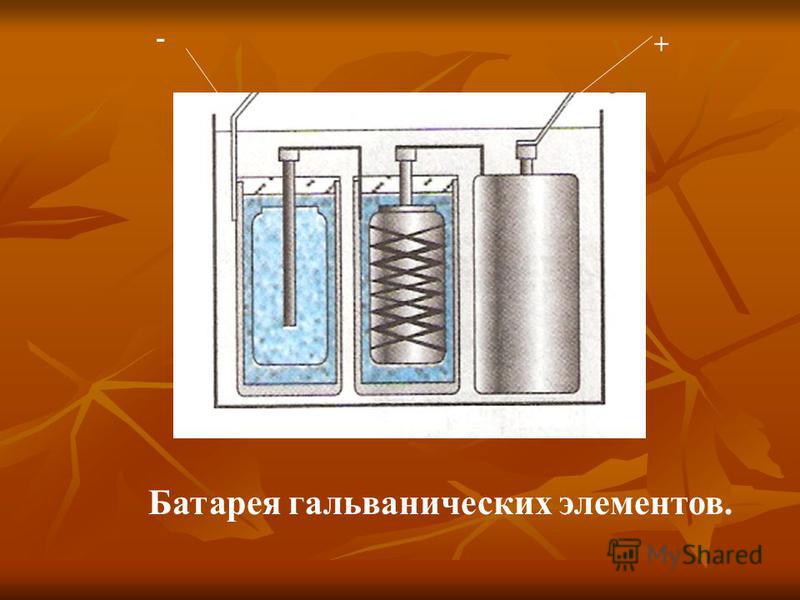 При погружении в кислоту 0,8 М цинк подвергается коррозии, выделяя газообразный водород, который пузырится на поверхности в результате реакции, отличной от той, которая создает батарею. Эта реакция продолжается независимо от того, присоединен ли цинк к медному электроду или нет, и протекает более или менее бурно в зависимости от концентрации кислоты. Большое количество пузырьков, образующихся на цинковом электроде, эффективно удаляет почти всю площадь поверхности, что может привести к резкому увеличению внутреннего сопротивления. Если бы концентрация кислоты была достаточно низкой, чтобы не возникала эта коррозия, тогда была бы открыта гораздо большая площадь поверхности цинка, и тогда внутреннее сопротивление уменьшилось бы пропорционально. Необходимы дальнейшие исследования в этой области.
При погружении в кислоту 0,8 М цинк подвергается коррозии, выделяя газообразный водород, который пузырится на поверхности в результате реакции, отличной от той, которая создает батарею. Эта реакция продолжается независимо от того, присоединен ли цинк к медному электроду или нет, и протекает более или менее бурно в зависимости от концентрации кислоты. Большое количество пузырьков, образующихся на цинковом электроде, эффективно удаляет почти всю площадь поверхности, что может привести к резкому увеличению внутреннего сопротивления. Если бы концентрация кислоты была достаточно низкой, чтобы не возникала эта коррозия, тогда была бы открыта гораздо большая площадь поверхности цинка, и тогда внутреннее сопротивление уменьшилось бы пропорционально. Необходимы дальнейшие исследования в этой области.
battery_background.pdf
Гальванические элементы | Brilliant Math & Science Wiki
Джордан Калмс, Аамир Фейсал Ансари, и Эли Росс внес
Содержание
- Открытие
- Конструкция гальванического элемента
- Типы электрохимических ячеек
- Коррозия
- Электролитические ячейки
- Рекомендации
Гальванические элементы были впервые описаны в 1790 году итальянским ученым Луиджи Гальвани. В экспериментах Гальвани лягушку разрезали, чтобы обнажить нервы в нижней половине лягушки. Медная проволока была прикреплена к обнаженному нерву, а цинковая проволока была прикреплена к мышце ноги. Когда два типа металла соприкасались друг с другом, мышца сокращалась, в результате чего полулягушка исполняла жуткий танец.
Иллюстрация эксперимента Гальвани. [1]
В экспериментах Гальвани лягушку разрезали, чтобы обнажить нервы в нижней половине лягушки. Медная проволока была прикреплена к обнаженному нерву, а цинковая проволока была прикреплена к мышце ноги. Когда два типа металла соприкасались друг с другом, мышца сокращалась, в результате чего полулягушка исполняла жуткий танец.
Иллюстрация эксперимента Гальвани. [1]
Гальвани сделал неправильный вывод, что электричество исходит от тканей животного. Другой итальянский ученый, Алессандро Вольта, позже установил, что источником электричества был поток электронов между двумя металлами и что жидкости тела лягушки были просто проводящей средой. (По этой причине гальванические элементы часто также называют гальваническими элементами ). Однако Гальвани открыл электрическую природу нервных импульсов. Его эксперимент с лягушкой считается началом электрофизиологии и понимания того, как тела преобразуют информацию между химическими и электрическими системами обмена сообщениями [2]. 9{+2}\) принимает электроны, чтобы стать элементарной медью. Если эти две полуреакции протекают в двух отдельных сосудах, соединенных токопроводящей проволокой, то в результате переноса электронов из одного сосуда в другой будет образовываться электрический ток. Цинковые и медные электроды погружают в водные растворы их солей, таких как \(ZnSO_4\) и \(CuSO_4\), в соответствующих контейнерах. Эти два электрода соединены проводом, а растворы соединены средой или мостом, который позволяет переносу ионов, но не позволяет растворам смешиваться напрямую.
9{+2}\) принимает электроны, чтобы стать элементарной медью. Если эти две полуреакции протекают в двух отдельных сосудах, соединенных токопроводящей проволокой, то в результате переноса электронов из одного сосуда в другой будет образовываться электрический ток. Цинковые и медные электроды погружают в водные растворы их солей, таких как \(ZnSO_4\) и \(CuSO_4\), в соответствующих контейнерах. Эти два электрода соединены проводом, а растворы соединены средой или мостом, который позволяет переносу ионов, но не позволяет растворам смешиваться напрямую.
Соляной мостик служит двум целям: он несет электрический заряд для замыкания цепи и гарантирует, что оба раствора остаются электрически нейтральными. Идентификация соли в мостике не имеет значения, пока она не мешает окислительно-восстановительной реакции, окисляясь или восстанавливаясь, или образуя осадок, который удаляет ионы, участвующие в клетке, из раствора.
Что произошло бы, если бы в показанном выше гальваническом элементе не было солевого мостика?
Окислительно-восстановительная реакция начнется таким же образом, но вскоре остановится, потому что растворы не сохранят свою электрическую нейтральность.
Первичные элементы одноразовые. Реакция в электроде необратима.
Сухая батарея — это наиболее распространенный тип батареи, используемый для питания небольших бытовых устройств, таких как фонарики, радиоприемники и калькуляторы. Несмотря на свое название, эти клетки построены из пасты на водной основе, содержащей \(MnO_{2}\) и \(Zn\). Химические реакции, используемые в сухой ячейке, можно модифицировать для работы в кислых или щелочных растворах. Щелочные батареи чаще доступны в продаже.
Ртутные элементы обычно меньше по размеру и основаны на другой химической реакции, чем сухие батареи. Эти батареи полезны в камерах, слуховых аппаратах и подобных устройствах, для которых требуются маленькие и надежные батареи. Батареи с ртутными элементами часто дороже, чем щелочные батареи, и, поскольку они содержат тяжелый металл, они могут представлять опасность для окружающей среды, если их взломать или утилизировать ненадлежащим образом.
Общая реакция для ртутного элемента выглядит следующим образом: \(Zn(s) + HgO(s) \to Hg(l) + ZnO(s)\) 9{-}(водн.)\)
Дополнительные элементы перезаряжаемые. Реакцию в электроде можно обратить, приложив к ячейке электрический потенциал. Процесс перезарядки временно превращает гальванический элемент в электролитический элемент. Примеры включают никель-кадмиевые батареи, используемые в перезаряжаемых электроинструментах, и свинцовые аккумуляторные батареи, используемые в автомобилях.
Коррозия — это гальванический процесс. Когда металлы подвергаются воздействию воздуха или воды, многие из них реагируют с кислородом с образованием оксида металла. Ржавчина, например, представляет собой оксид железа \(Fe_2O_3\). Потускнение серебра или сине-зеленый цвет меди являются другими примерами коррозии. В частности, ржавчина может быть серьезной промышленной проблемой, потому что железо широко распространено в производстве, а красноватый продукт отслаивается, подвергая окислению еще больше металла. Металлические изделия, от автомобилей до кранов и банок из-под газировки, часто покрывают тонким слоем пластика, оксида металла или нереакционноспособного металла (например, хрома) для предотвращения коррозии.
Анодный индекс между болтами и пластиной допускает гальваническую коррозию. [3]
Разнородные металлы также могут разъедать друг друга. Этот процесс, иногда называемый Гальваническая коррозия возникает при контакте двух металлов, имеющих разные электрические свойства. Анодный индекс можно использовать для определения потенциала напряжения между двумя металлами. Металлы с большой разницей в анодном индексе следует хранить изолированными друг от друга, чтобы предотвратить коррозию.
Металлические изделия, от автомобилей до кранов и банок из-под газировки, часто покрывают тонким слоем пластика, оксида металла или нереакционноспособного металла (например, хрома) для предотвращения коррозии.
Анодный индекс между болтами и пластиной допускает гальваническую коррозию. [3]
Разнородные металлы также могут разъедать друг друга. Этот процесс, иногда называемый Гальваническая коррозия возникает при контакте двух металлов, имеющих разные электрические свойства. Анодный индекс можно использовать для определения потенциала напряжения между двумя металлами. Металлы с большой разницей в анодном индексе следует хранить изолированными друг от друга, чтобы предотвратить коррозию.
Подобно тому, как энергия спонтанной химической реакции может быть использована для создания электричества, электричество можно использовать для запуска несамопроизвольной химической реакции.
Иллюстрация медного гальванического покрытия. Применение электричества позволяет ионам меди в растворе прикрепляться к металлу, образуя тонкий внешний слой. [4]
Применение электричества позволяет ионам меди в растворе прикрепляться к металлу, образуя тонкий внешний слой. [4]
Электролизеры выполняют множество коммерческих функций. Одним из примеров является гальваническое покрытие , процесс, при котором тонкий слой одного металла наносится поверх другого металла. Этот процесс используется в производстве ювелирных изделий и других отраслях, где производители хотят, чтобы качество драгоценного или не тускнеющего металла использовалось в качестве лицевой стороны их продукции, но также хотели бы продавать свою продукцию по цене ниже, чем требовалось бы для чистого золота или платины.
[1] Уэллс, Д. А. (1857 г.). Наука об обычных вещах: знакомое объяснение первых принципов физической науки. Для школ, семей и молодых студентов. Нью-Йорк: Айвисон, Блейкман, Тейлор. Доступ с https://archive.org/details/sciencecommonth00wellgoog 15 февраля 2016 г.
[2] Haas, LF J Neurol Neurosurg Psychiatry. 1993 г., октябрь; 56(10): 1084.



