Задачи на постоянный ток с подробными решениями
Закон Ома для участка цепи. Сопротивление
7.1.1 Определить силу тока, проходящего через сопротивление 15 Ом, если напряжение на нем
7.1.2 Определить падение напряжения на проводнике, имеющем сопротивление 10 Ом
7.1.3 Через лампочку накаливания проходит ток 0,8 А. Сколько электронов проводимости
7.1.4 Удлинитель длиной 30 м сделан из медного провода диаметром 1,3 мм. Каково сопротивление
7.1.5 Эквивалентное сопротивление трех параллельно соединенных проводников равно 30 Ом
7.1.6 Проволока имеет сопротивление 36 Ом. Когда ее разрезали на несколько равных частей
7.1.7 Определить плотность тока, текущего по медной проволоке длиной 10 м, на которую
7.1.8 Определить плотность тока, если за 0,4 с через проводник сечением 1,2 мм2 прошло
7.1.9 Найти плотность тока в стальном проводнике длиной 10 м, на который подано напряжение
7.1.10 Какое напряжение надо приложить к концам стального проводника длиной 30 см
7. 1.11 Допустимый ток для изолированного медного провода площадью поперечного сечения
1.11 Допустимый ток для изолированного медного провода площадью поперечного сечения
7.1.12 Определить падение напряжения на полностью включенном реостате, изготовленном
7.1.13 Определить падение напряжения в линии электропередачи длиной 500 м при токе
7.1.14 Найти массу алюминиевого провода, из которого изготовлена линия электропередачи
7.1.15 Вольтметр показывает 6 В. Найти напряжение на концах участка цепи, состоящей
7.1.16 На сколько надо повысить температуру медного проводника, взятого
7.1.17 Медная проволока при 0 C имеет сопротивление R_0. До какой температуры надо нагреть
7.1.18 Вольфрамовая нить электрической лампы при температуре 2000 C имеет сопротивление
7.1.19 Определить сопротивление вольфрамовой нити электрической лампы при 24 C
7.1.20 Сопротивление медной проволоки при температуре 20 C равно 0,04 Ом
7.1.21 При нагревании металлического проводника от 0 до 250 C его сопротивление увеличилось
7.1.22 До какой температуры нагревается нихромовая электрогрелка, если известно, что ток
7. 1.23 Плотность тока в проводнике сечением 0,5 мм2 равна 3,2 мА/м2. Сколько электронов
1.23 Плотность тока в проводнике сечением 0,5 мм2 равна 3,2 мА/м2. Сколько электронов
7.1.24 По проводнику с поперечным сечением 0,5 см2 течет ток силой 3 А. Найти среднюю скорость
7.1.25 Средняя скорость упорядоченного движения электронов в медной проволоке сечением
7.1.26 К концам медного провода длиной 200 м приложено напряжение 18 В. Определить среднюю
7.1.27 Какой ток покажет амперметр, если напряжение U=15 В, сопротивления R1=5 Ом, R2=10 Ом
7.1.28 За одну минуту через поперечное сечение проводника прошел заряд 180 Кл
7.1.29 Какой ток покажет амперметр, если R1=1,25 Ом, R2=1 Ом, R3=3 Ом, R4=7 Ом, напряжение
7.1.30 В рентгеновской трубке пучок электронов с плотностью тока 0,2 А/мм2 попадает на участок
7.1.31 За какое время в металлическом проводнике с током 32 мкА через поперечное сечение
7.1.32 Анодный ток в радиолампе равен 16 мА. Сколько электронов попадает на анод лампы
7.1.33 Участок цепи AB состоит из пяти одинаковых проводников с общим сопротивлением 5 Ом
7. 1.34 Четыре лампы накаливания сопротивлением 110 Ом каждая включены в сеть с напряжением
1.34 Четыре лампы накаливания сопротивлением 110 Ом каждая включены в сеть с напряжением
Закон Ома для полной цепи
7.2.1 Источник тока с ЭДС 18 В имеет внутреннее сопротивление 6 Ом. Какой ток потечет
7.2.2 Кислотный аккумулятор имеет ЭДС 2 В, а внутреннее сопротивление 0,5 Ом. Определить
7.2.3 Определить ЭДС источника питания, если при перемещении заряда 10 Кл сторонняя сила
7.2.4 К источнику тока с ЭДС 12 В и внутренним сопротивлением 2 Ом подсоединили
7.2.5 При внешнем сопротивлении 3,75 Ом в цепи идет ток 0,5 А. Когда в цепь ввели еще
7.2.6 Источник тока замкнут внешним резистором. Определить отношение электродвижущей силы
7.2.7 ЭДС аккумуляторной батареи равна 12 В, внутреннее сопротивление 0,06 Ом, а сопротивление
7.2.8 ЭДС батареи равна 1,55 В. При замыкании ее на нагрузку сопротивлением 3 Ом
7.2.9 В цепи, состоящей из источника тока с ЭДС 3 В и резистора сопротивлением 20 Ом
7.2.10 ЭДС элемента 15 В. Ток короткого замыкания равен 20 А. Чему равно внутреннее сопротивление
Чему равно внутреннее сопротивление
7.2.11 Определить ток короткого замыкания источника тока, если при внешнем сопротивлении
7.2.12 Батарея с ЭДС в 6 В и внутренним сопротивлением 1,4 Ом питает внешнюю цепь
7.2.13 Определить силу тока в проводнике R1, если ЭДС источника 14 В, его внутреннее сопротивление
7.2.14 В сеть с напряжением 220 В включены последовательно десять ламп сопротивлением по 24 Ом
7.2.15 ЭДС источника 6 В. При внешнем сопротивлении цепи 1 Ом сила тока 3 А. Какой будет
7.2.16 Источник тока с внутренним сопротивлением 1,5 Ом замкнут на резистор 1,5 Ом. Когда в цепь
7.2.17 Генератор с ЭДС 80 В и внутренним сопротивлением 0,2 Ом соединен со сварочным аппаратом
7.2.18 Для включения в сеть дуговой лампы, рассчитанной на напряжение 42 В и силу тока 10 А
7.2.19 Определить внутреннее сопротивление источника тока, имеющего ЭДС 1,1 В
7.2.20 Какой ток покажет амперметр, если R1=1,5 Ом, R2=1 Ом, R3=5 Ом, R4=8 Ом, ЭДС источника
7.2.21 Батарея гальванических элементов с ЭДС 15 В и внутренним сопротивлением 5 Ом замкнута
7. 2.22 В сеть с напряжением 24 В включены два последовательно соединенных резистора. При этом
2.22 В сеть с напряжением 24 В включены два последовательно соединенных резистора. При этом
7.2.23 Щелочной аккумулятор создает силу тока 0,8 А, если его замкнуть на сопротивление 1,5 Ом
7.2.24 Какова ЭДС источника, если при измерении напряжения на его зажимах вольтметром
7.2.25 Два источника тока с ЭДС 2 и 1,2 В, внутренними сопротивлениями 0,5 и 1,5 Ом соответственно
7.2.26 Аккумулятор подключен для зарядки к сети с напряжением 12,5 В. Внутреннее сопротивление
7.2.27 Батарея элементов замкнута двумя проводниками сопротивлением 4 Ом каждый
7.2.28 Цепь состоит из аккумулятора с внутренним сопротивлением 5 Ом и нагрузки 15 Ом
7.2.29 Два источника с одинаковыми ЭДС 2 В и внутренними сопротивлениями 0,2 и 0,4 Ом соединены
7.2.30 Источник тока имеет ЭДС 12 В. Сила тока в цепи 4 А, напряжение на внешнем сопротивлении 11 В
7.2.31 Два элемента с внутренним сопротивлением 0,2 и 0,4 Ом соединены одинаковыми полюсами
7.2.32 Два элемента соединены параллельно. Один имеет ЭДС E1=2 В и внутреннее сопротивление
Один имеет ЭДС E1=2 В и внутреннее сопротивление
7.2.33 Два элемента с ЭДС, равными E1=1,5 В и E2=2 В, соединены одинаковыми полюсами
7.2.34 Определить число последовательно соединенных элементов с ЭДС 1,2 В и внутренним
7.2.35 Источник тока с внутренним сопротивлением 1,5 Ом замкнут на резистор 1,5 Ом. Когда
7.2.36 В схеме, показанной на рисунке, внутреннее и внешние сопротивления одинаковы, а расстояние
7.2.37 Имеется 5 одинаковых аккумуляторов с внутренним сопротивлением 1 Ом каждый
7.2.38 Определите заряд на обкладках конденсатора C=1 мкФ в цепи, изображенной на рисунке
7.2.39 Конденсатор и проводник соединены параллельно и подключены к источнику с ЭДС 12 В
7.2.40 Определите заряд на обкладках конденсатора C=1 мкФ. ЭДС источника 4 В, внутреннее
7.2.41 Проволока из нихрома изогнута в виде кольца радиусом 1 м. В центре кольца помещен
7.2.42 Указать направление вектора сторонней силы, действующей на положительный заряд q
7.2.43 В конце заряда батареи аккумуляторов током I1 присоединенный к ней вольтметр показывал
7. 18 ионов в секунду. Найти силу тока в газе
18 ионов в секунду. Найти силу тока в газе
7.3.3 Определите массу алюминия, который отложится на катоде за 10 ч при электролизе Al2(SO4)3
7.3.4 Цинковый анод массой 5 г поставлен в электролитическую ванну, через которую проходит ток
7.3.5 При какой силе тока протекает электролиз водного раствора сульфата меди, если за 50 мин
7.3.6 Определить затраты электроэнергии на получение 1 кг алюминия из трехвалентного состояния
7.3.7 Через раствор медного купороса в течение 2 с протекал электрический ток силой 3,2 А
7.3.8 При электролизе сернокислого цинка ZnSO4 в течение 4 ч выделилось 24 г цинка. Определить
7.3.9 Электролиз алюминия проводится при напряжении 10 В на установке с КПД 80%. Какое
7.3.10 Определите массу выделившейся на электроде меди, если затрачено 6 кВтч электроэнергии
7.3.11 При никелировании изделий в течение 2 ч отложился слой никеля толщиной 0,03 мм. Найти
7.3.12 При электролизе медного купороса за 1 ч выделяется медь массой, равной 0,5 г. Площадь
Площадь
7.3.13 При электролизе раствора серной кислоты за 50 минут выделилось 0,3 г водорода. Определить
7.3.14 Определите сопротивление раствора серной кислоты, если известно, что при прохождении тока
7.3.15 Две электролитические ванны соединены последовательно. В первой ванне выделилось
7.3.16 Какой толщины слой серебра образовался на изделии за 3 мин, если плотность тока в растворе
7.3.17 Плотность тока при серебрении контактов проводов равна 40 А/м2. Определить толщину
7.3.18 В ряде производств водород получают электролизом воды. При каком токе, пропускаемом
7.3.19 Никелирование пластинок производится при плотности тока 0,4 А/дм2. С какой скоростью
7.3.20 Электролиз воды ведется при силе тока 2,6 А, причем в течение часа получено 0,5 л кислорода
7.3.21 Сколько электроэнергии надо затратить для получения 2,5 л водорода при температуре 25 C
7.3.22 Электрический пробой воздуха наступает при напряженности поля 3 МВ/м. Определить потенциал
7.3. (-7) кг/Кл. Сколько меди выделится на электроде
(-7) кг/Кл. Сколько меди выделится на электроде
7.3.27 К источнику с ЭДС 200 В и внутренним сопротивлением 2 Ом подсоединены последовательно
Работа и мощность тока
7.4.1 По проводнику сопротивлением 20 Ом за 5 мин прошло количество электричества 300 Кл
7.4.2 Электрический паяльник рассчитан на напряжение 120 В при токе 0,6 А. Какое количество
7.4.3 Батарея, включенная на сопротивление 2 Ом, дает ток 1,6 А. Найти мощность, которая теряется
7.4.4 Дуговая сварка ведется при напряжении 40 В и силе тока 500 А. Определить энергию
7.4.5 К источнику тока с внутренним сопротивлением 0,6 Ом подключено внешнее сопротивление
7.4.6 Чему равен КПД источника тока с ЭДС 12 В и внутренним сопротивлением 0,5 Ом
7.4.7 Кипятильник работает от сети с напряжением 125 В. Какая энергия расходуется в кипятильнике
7.4.8 Во сколько раз увеличится количество теплоты, выделяемое электроплиткой, если сопротивление
7.4.9 Какое количество электроэнергии расходуется на получение 5 кг алюминия, если электролиз
7. 4.10 Во сколько раз изменятся тепловые потери в линии электропередачи при увеличении напряжения
4.10 Во сколько раз изменятся тепловые потери в линии электропередачи при увеличении напряжения
7.4.11 Найти полезную мощность, которую может дать батарея, ЭДС которой равна 24 В
7.4.12 Два резистора сопротивлением 2 и 5 Ом соединены последовательно и включены в сеть
7.4.13 Определите силу тока в кипятильнике, если при подключении к напряжению 12 В, он нагревает
7.4.14 Напряжение на зажимах автотранспортного генератора равно 24 В. Определить работу
7.4.15 Поперечное сечение медной шины 80 мм2. Какое количество теплоты выделится на 1 м длины
7.4.16 Мощность автомобильного стартера 6000 Вт. Какова сила тока, проходящего через стартер
7.4.17 Две лампы имеют одинаковые мощности. Одна из них рассчитана на напряжение 120 В
7.4.18 ЭДС источника тока равна 2 В, внутреннее сопротивление 1 Ом. Внешняя цепь потребляет
7.4.19 На сколько градусов изменится температура воды в калориметре, если через нагреватель
7.4.20 Через поперечное сечение спирали нагревательного элемента паяльника каждую секунду
7. 4.21 Какую максимальную полезную мощность может выделить аккумулятор с ЭДС 10 В
4.21 Какую максимальную полезную мощность может выделить аккумулятор с ЭДС 10 В
7.4.22 Два проводника, соединенных параллельно, имеют сопротивления 4 и 8 Ом. При включении
7.4.23 Масса воды в нагревателе 2,5 кг. На сколько градусов повысится температура воды, если
7.4.24 Мощность, выделяемая на резисторе, подключенном к источнику тока с ЭДС 3,0 В
7.4.25 Из комнаты за сутки теряется 87 МДж тепла. Какой длины нужна нихромовая проволока
7.4.26 Две одинаковые лампочки мощностью 50 Вт каждая, рассчитанные на напряжение 10 В
7.4.27 Электролампа с вольфрамовой спиралью в момент включения при 20 C потребляет мощность
7.4.28 Электробритва имеет мощность 15 Вт и рассчитана на напряжение 110 В. При напряжении
7.4.29 При замыкании источника тока с внутренним сопротивлением 2 Ом на сопротивление 4 Ом
7.4.30 Емкость аккумулятора 75 А*ч. Какую работу должен совершить источник тока для зарядки
7.4.31 Электроплитка, работающая от сети с напряжением 220 В, расходует мощность 600 Вт
7. 4.32 Девять нагревательных элементов с сопротивлением 1 Ом каждый соединены
4.32 Девять нагревательных элементов с сопротивлением 1 Ом каждый соединены
7.4.33 Скоростной лифт массой 1600 кг за 300 с поднимается на высоту 30 м. Определить силу тока
7.4.34 Четыре одинаковых источника тока соединены, как показано на рисунке. ЭДС каждого
7.4.35 На сколько градусов поднимется температура медного стержня, если по нему в течение 0,5 с
7.4.36 Определить ток короткого замыкания источника питания, если при токе 15 А он отдает
7.4.37 ЭДС батареи аккумуляторов 12 В. Сила тока короткого замыкания 5 А. Какую наибольшую
7.4.38 В электрочайник с сопротивлением 140 Ом налита вода массой 1,5 кг при температуре 20 С
7.4.39 Два элемента с ЭДС 5 и 10 В и внутренними сопротивлениями 1 и 2 Ом соединены последовательно
7.4.40 Батарея состоит из параллельно соединенных источников тока. При силе тока во внешней цепи
7.4.41 Три лампочки мощностью P01=50 Вт и P02=25 Вт и P03=50 Вт, рассчитанные на напряжение
7.4.42 К источнику тока подключен реостат. При сопротивлении реостата 4 Ом и 9 Ом получается
При сопротивлении реостата 4 Ом и 9 Ом получается
7.4.43 Определить ЭДС аккумулятора, если при нагрузке в 5 А он отдает во внешнюю цепь 10 Вт
7.4.44 На резисторе внешней цепи аккумулятора выделяется тепловая мощность 10 Вт
7.4.45 При подключении к источнику тока ЭДС 15 В сопротивления 15 Ом КПД источника равен 75%
7.4.46 По линии электропередачи протяженностью в 100 км должен пройти электрический ток
7.4.47 Линия имеет сопротивление 300 Ом. Какое напряжение должен иметь генератор
7.4.48 Источник тока с ЭДС 5 В замыкается один раз на сопротивление 4 Ом, а другой раз – на 9 Ом
7.4.49 При замыкании на сопротивление 5 Ом батарея элементов дает ток 1 А
7.4.50 Определите КПД электропаяльника сопротивлением 25 Ом, если медная часть его массой
7.4.51 Найти ток короткого замыкания в цепи генератора с ЭДС 70 В, если при увеличении
7.4.52 Два чайника, каждый из которых потребляет при напряжении 200 В по 400 Вт, закипают
7.4.53 При силе тока 2 А во внешней цепи выделяется мощность 24 Вт, а при силе тока 5 А – мощность 30 Вт
7. 4.54 Элемент замыкают один раз сопротивлением 4 Ом, другой – резистором сопротивлением 9 Ом
4.54 Элемент замыкают один раз сопротивлением 4 Ом, другой – резистором сопротивлением 9 Ом
7.4.55 Сила тока, протекающего в проводнике, сопротивление которого равно 15 Ом, меняется
7.4.56 Лампу, рассчитанную на напряжение U1=220 В, включили в сеть с напряжением U2=110 В
7.4.57 Две лампочки имеют одинаковые мощности. Первая лампочка рассчитана на напряжение 127 В
7.4.58 При ремонте бытовой электрической плитки ее спираль была укорочена на 0,2 первоначальной
7.4.59 Сопротивление лампочки накаливания в рабочем состоянии 240 Ом. Напряжение в сети 120 В
7.4.60 Два резистора с одинаковым сопротивлением каждый включаются в сеть постоянного напряжения
7.4.61 Стоимость 1 кВт*ч электроэнергии равна 50 коп. Паяльник, включенный в сеть с напряжением
7.4.62 Определите силу тока в обмотке двигателя электропоезда, развивающего силу тяги 6 кН
Амперметр и вольтметр в электрической цепи. Шунты и добавочные сопротивления
7.5.1 Сопротивление вольтметра 400 Ом, предел измерения 4 В. Какое дополнительное сопротивление
Какое дополнительное сопротивление
7.5.2 Какое дополнительное сопротивление нужно подключить к вольтметру со шкалой 100 В
7.5.3 Миллиамперметр имеет сопротивление 25 Ом, рассчитан на предельный ток 50 мА
7.5.4 К амперметру с сопротивлением 0,1 Ом подключен шунт с сопротивлением 11,1 мОм
7.5.5 Какой шунт нужно подсоединить к гальванометру со шкалой на 100 делений, ценой деления 1 мкА
7.5.6 Вольтметр постоянного тока рассчитан на измерение максимального напряжения 3 В
7.5.7 Для измерения напряжения сети 120 В последовательно соединили два вольтметра
7.5.8 Амперметр имеет сопротивление 0,02 Ом, его шкала рассчитана на 1,2 А. Каково должно
7.5.9 Имеется миллиамперметр с внутренним сопротивлением 10 Ом, который может измерять
7.5.10 Предел измерения амперметра с внутренним сопротивлением 0,4 Ом 2 А. Какое шунтирующее
7.5.11 Зашунтированный амперметр измеряет токи до 10 А. Какую наибольшую силу тока
7.5.12 Амперметр показывает ток 0,04 А, а вольтметр – напряжение 20 В. Найти сопротивление
Найти сопротивление
7.5.13 Вольтметр, рассчитанный на измерение напряжения до 20 В, необходимо включить в сеть
7.5.14 Гальванометр имеет сопротивление 200 Ом, и при силе тока 100 мкА стрелка отклоняется
7.5.15 Гальванометр со шкалой из 100 делений и ценой деления 50 мкА/дел, надо использовать как
7.5.16 К амперметру с внутренним сопротивлением 0,03 Ом подключен медный шунт длиной 10 см
7.5.17 Предел измерения амперметра 5 А, число делений шкалы 100, внутреннее сопротивление
7.5.18 Вольтметр, внутреннее сопротивление которого 50 кОм, подключенный к источнику
7.5.19 Вольтметр с внутренним сопротивлением 3 кОм, включенный в городскую осветительную сеть
7.5.20 Если подключить к гальванометру шунт 100 Ом, вся шкала соответствует току во внешней цепи
7.5.21 Стрелка миллиамперметра отклоняется до конца шкалы, если через миллиамперметр идет ток
7.5.22 Гальванометр со шкалой из 50 делений имеет цену деления 2 мкА/дел
7.5.23 Вольтметр, соединенный последовательно с сопротивлением R1=10 кОм, при включении
7. 5.24 Амперметр с внутренним сопротивлением 2 Ом, подключенный к батарее, показывает ток 5 А
5.24 Амперметр с внутренним сопротивлением 2 Ом, подключенный к батарее, показывает ток 5 А
7.5.25 Вольтметр, подключенный к источнику с ЭДС 12 В, показывает напряжение 9 В. К его клеммам
7.5.26 Аккумулятор замкнут на некоторый проводник. Если в цепь включить два амперметра
7.5.27 К источнику тока подключены последовательно амперметр и резистор. Параллельно резистору
7.5.28 Два вольтметра, подключенные последовательно к ненагруженной батарее, показывают
7.5.29 В цепь, состоящую из источника ЭДС и сопротивления 2 Ом, включают амперметр сначала
7.5.30 Каково удельное сопротивление проводника, если его длина 10 км, площадь поперечного
7.5.31 Медный провод длиной 500 м имеет сопротивление 2,9 Ом. Найти вес провода
7.5.32 Проводники сопротивлением 2, 3 и 4 Ом соединены параллельно. Найти общее
7.5.33 Какого сопротивления проводник нужно соединить параллельно с резистором 300 Ом
7.5.34 Три проводника сопротивлением 2, 3 и 6 Ом соединены параллельно. Найти наибольший ток
7. 5.35 В городскую осветительную сеть включены последовательно электрическая плитка, реостат
5.35 В городскую осветительную сеть включены последовательно электрическая плитка, реостат
7.5.36 Во сколько раз площадь поперечного сечения алюминиевого провода больше, чем у медного
7.5.37 Цепь состоит из трех сопротивлений 10, 20 и 30 Ом, соединенных последовательно
7.5.38 Два электронагревателя сопротивлением 25 и 20 Ом находятся под напряжением 100 В
7.5.39 ЭДС батареи 6 В, внутреннее и внешнее сопротивления соответственно равны 0,5 и 11,5 Ом
7.5.40 Атомная масса золота 197,2, валентность 3. Вычислить электрохимический эквивалент золота
7.5.41 Лампу, рассчитанную на напряжение 220 В, включили в сеть напряжением 110 В. Во сколько
7.5.42 Спираль электронагревателя укоротили на 0,1 первоначальной длины. Во сколько раз
7.5.43 Сколько времени длилось никелирование, если был получен слой никеля массой 1,8 г
7.5.44 Электромотор имеет сопротивление 2 Ом. Какую мощность потребляет мотор при токе
7.5.45 Через раствор сернокислой меди (медного купороса) прошло 2*10^4 Кл электричества
7. 5.46 Какой ток должен проходить по проводнику в сети напряжением 120 В, чтобы в нем
5.46 Какой ток должен проходить по проводнику в сети напряжением 120 В, чтобы в нем
7.5.47 По проводнику сопротивлением 4 Ом в течение 2 минут прошло 500 Кл электричества
7.5.48 В схеме, изображенной на рисунке, R1=5 Ом, R2=6 Ом, R3=3 Ом, сопротивлением амперметра
7.5.49 Вольтметр, внутреннее сопротивление которого равно 50 кОм, подключенный к источнику
7.5.50 Определите показание амперметра в электрической цепи, изображенной на рисунке
7.5.51 Какой величины надо взять дополнительное сопротивление, чтобы можно было включить
Пожалуйста, поставьте оценку
( 46 оценок, среднее 4 из 5 )
Вы можете поделиться с помощью этих кнопок:
Электрическая цепь и ее составные части.
Электрическая цепь
и ее составные части.
разработал: Дубоделов Сергей Иванович
учитель физики МБОУ СОШ №70 г.Томска
ТРИ УСЛОВИЯ НАЛИЧИЯ ЭЛЕКТРИЧЕСКОГО ТОКА:
1. наличие зарядов;
наличие зарядов;
2. наличие источника тока (гальванического элемента и др.). Источник тока создает электрическое поле внутри проводника, что является причиной движения зарядов;
3. наличие электрической цепи.
Источники питания
Аккумулятор
Гальванический элемент
Электростанция
Электрическая цепь должна содержать источник тока, т. е. элемент, который создает в цепи электрическое поле и обеспечивает движение заряженных частиц, и потребитель тока, т. е. например, любой бытовой прибор: лампочку, фонарик, компьютер, телевизор, стиральную машину, холодильник и т. п. Источник тока и потребители всегда соединяются проводами (проводниками), т. е. такими элементами, которые способны проводить электрический ток и обладают большим количеством свободных заряженных частиц.
Потребители тока
Таким образом, электрическая цепь имеет следующие основные составные элементы: источник тока, потребители тока, соединительные провода.
– Гальванический элемент (источник тока)
Как видно из рисунка, длинной полоской обозначают положительный полюс источника, а короткой – отрицательный
– Гальваническая батарея (аккумулятор)
Таким образом обозначается соединение нескольких гальванических элементов
– Соединяющиеся провода
Место соединения проводов обозначается жирной точкой, которую еще зачастую именуют узлом
– Не соединяющиеся провода
Провода, которые не соединяются, в точке пересечения никак особо не выделяются
– Лампа накаливания (лампочка)
– Зажимы для подключения электроприборов
К подобному элементу на схеме можно подключать какой-либо электроприбор
– Ключ (выключатель)
Элемент цепи для ее замыкания и размыкания
– Электрический звонок
Для запоминания этого обозначения можно заметить, что оно похоже на грибочек
– Резистор
Этот элемент цепи имеет большое сопротивление
– Нагревательный элемент
– Плавкий предохранитель
Прибор, который обеспечивает безопасность работы электрической цепи
Задание:
Собрать цепь на примере обычного Фонарика: аккумулятор, лампочка, переключатель.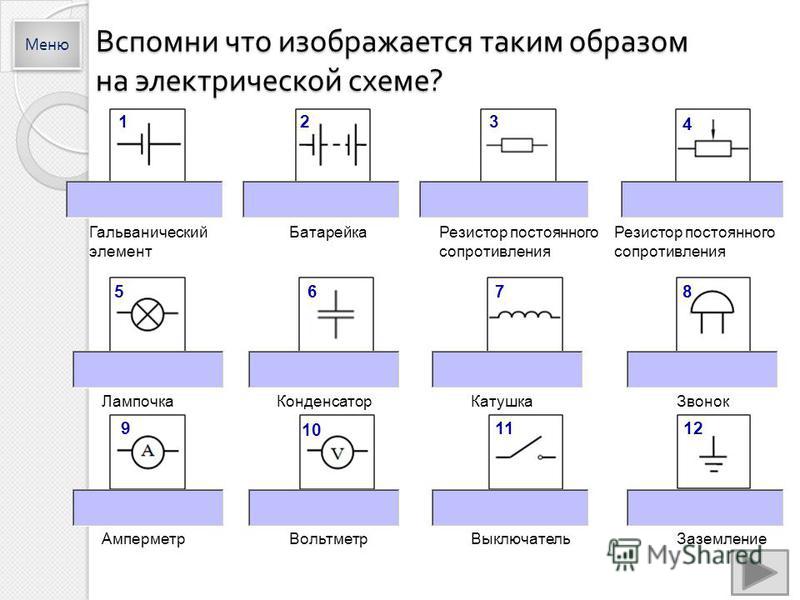
- В вашем распоряжении есть гальванический элемент, лампочка, два ключа и соединительные провода. Нарисуйте принципиальную схему электрической цепи, в которой лампочка загорается только тогда, когда включены оба ключа.
- Железный гвоздь и отрезок медного провода воткнули в лимон. Потечет ли ток через провод, которым соединяют гвоздь и медный провод?
- С потолка в месте крепления люстры свисают три провода, по которым после подключения люстры идет ток. Если люстру подключить правильно, два выключателя работают таким образом, что один из них включает и выключает одну лампу, а другой – остальные три. Нарисуйте схему соединения ламп в люстре, выключателей и источника тока.
19.3: Гальванические (или гальванические) элементы: генерация электричества в результате спонтанных химических реакций
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 84988
Цели обучения
- Чтобы понять основы гальванических элементов
- Для подключения напряжения от гальванического элемента к базовой окислительно-восстановительной химии
В любом электрохимическом процессе электроны перетекают от одного химического вещества к другому в результате окислительно-восстановительной (окислительно-восстановительной) реакции. Окислительно-восстановительная реакция происходит при переносе электронов от вещества, которое окисляется, к тому, которое восстанавливается. Восстановитель
Окислительно-восстановительная реакция происходит при переносе электронов от вещества, которое окисляется, к тому, которое восстанавливается. Восстановитель
Поскольку восстановление невозможно без окисления и наоборот, окислительно-восстановительную реакцию можно описать как две полуреакции , одна представляет собой процесс окисления, а другая — процесс восстановления. Для реакции цинка с бромом общая химическая реакция выглядит следующим образом: 9{−} }\nonumber \]
Каждая полуреакция записывается, чтобы показать, что на самом деле происходит в системе; \(\ce{Zn}\) является восстановителем в этой реакции (он теряет электроны), а \(\ce{Br2}\) является окислителем (он приобретает электроны).
В любой окислительно-восстановительной реакции количество электронов, потерянных в результате реакции (реакций) окисления, равно количеству электронов, полученных в результате реакции (реакций) восстановления.
В большинстве наших обсуждений химических реакций мы предполагали, что реагенты находятся в тесном физическом контакте друг с другом. Кислотно-основные реакции, например, обычно проводят с кислотой и основанием, диспергированными в одной фазе, такой как жидкий раствор. Однако с окислительно-восстановительными реакциями можно физически разделить полуреакции окисления и восстановления в пространстве, если существует полная цепь, включая внешнее электрическое соединение, например провод, между двумя полуреакциями.
Существует два типа электрохимических элементов: гальванические элементы и электролитические элементы. Гальванические клетки названы в честь итальянского физика и врача Луиджи Гальвани (1737–1798), который заметил, что рассеченные мышцы лягушачьей лапки подергиваются при приложении небольшого электрического удара, демонстрируя электрическую природу нервных импульсов. Гальванический (гальванический) элемент использует энергию, высвобождаемую во время спонтанной окислительно-восстановительной реакции (\(ΔG < 0\)) для выработки электроэнергии. Этот тип электрохимического элемента часто называют гальваническим элементом в честь его изобретателя, итальянского физика Алессандро Вольта (1745–1827). Напротив, 9Электролитическая ячейка 0032 потребляет электрическую энергию от внешнего источника, используя ее для возникновения несамопроизвольной окислительно-восстановительной реакции (\(ΔG > 0\)). Оба типа содержат два электрода из твердых металлов, подключенных к внешней цепи, обеспечивающей электрическое соединение между двумя частями системы (рис. \(\PageIndex{1}\)). Половина реакции окисления протекает на одном электроде (анод
Этот тип электрохимического элемента часто называют гальваническим элементом в честь его изобретателя, итальянского физика Алессандро Вольта (1745–1827). Напротив, 9Электролитическая ячейка 0032 потребляет электрическую энергию от внешнего источника, используя ее для возникновения несамопроизвольной окислительно-восстановительной реакции (\(ΔG > 0\)). Оба типа содержат два электрода из твердых металлов, подключенных к внешней цепи, обеспечивающей электрическое соединение между двумя частями системы (рис. \(\PageIndex{1}\)). Половина реакции окисления протекает на одном электроде (анод 
 В обоих типах электрохимических элементов анодом является электрод, на котором происходит полуреакция окисления, а катодом является электрод, на котором происходит полуреакция восстановления. 9{2+} (водн.) + Cu(s)} \label{20.3.4} \]
В обоих типах электрохимических элементов анодом является электрод, на котором происходит полуреакция окисления, а катодом является электрод, на котором происходит полуреакция восстановления. 9{2+} (водн.) + Cu(s)} \label{20.3.4} \]Мы можем вызвать эту реакцию, вставив цинковый стержень в водный раствор сульфата меди(II). По мере протекания реакции цинковый стержень растворяется и образуется масса металлической меди. Эти изменения происходят спонтанно, но вся высвобождаемая энергия находится в форме тепла, а не в форме, которую можно использовать для совершения работы.
Рисунок \(\PageIndex{2}\): Реакция металлического цинка с водными ионами меди(II) в одном отсеке. Когда цинковый стержень вставляют в химический стакан, содержащий водный раствор сульфата меди (II), происходит спонтанная окислительно-восстановительная реакция: цинковый электрод растворяется с образованием \(\ce{Zn^{2+}(aq)}\) ионы, а ионы \(\ce{Cu^{2+}(aq)}\) одновременно восстанавливаются до металлической меди. Реакция происходит так быстро, что медь осаждается в виде очень мелких частиц, которые кажутся черными, а не обычным красноватым цветом меди. (youtu.be/2gPRK0HmYu4) 9{2+}}\) ионов в растворе уменьшается (рис. \(\PageIndex{3b}\)). Таким образом, мы провели ту же реакцию, что и в одном стакане, но на этот раз окислительная и восстановительная полуреакции физически отделены друг от друга. Электроны, которые высвобождаются на аноде, проходят через провод, производя электрический ток. Таким образом, гальванические элементы преобразуют химическую энергию в электрическую, которую затем можно использовать для выполнения работы. Рисунок \(\PageIndex{3}\): Реакция металлического цинка с водными ионами меди(II) в гальваническом элементе. (а) Гальванический элемент можно сконструировать, вставив медную полоску в химический стакан, содержащий 1 М водный раствор Cu 2 + ионов и полоску цинка в другой химический стакан, содержащий 1 М водный раствор ионов Zn 2 + ионов.
Реакция происходит так быстро, что медь осаждается в виде очень мелких частиц, которые кажутся черными, а не обычным красноватым цветом меди. (youtu.be/2gPRK0HmYu4) 9{2+}}\) ионов в растворе уменьшается (рис. \(\PageIndex{3b}\)). Таким образом, мы провели ту же реакцию, что и в одном стакане, но на этот раз окислительная и восстановительная полуреакции физически отделены друг от друга. Электроны, которые высвобождаются на аноде, проходят через провод, производя электрический ток. Таким образом, гальванические элементы преобразуют химическую энергию в электрическую, которую затем можно использовать для выполнения работы. Рисунок \(\PageIndex{3}\): Реакция металлического цинка с водными ионами меди(II) в гальваническом элементе. (а) Гальванический элемент можно сконструировать, вставив медную полоску в химический стакан, содержащий 1 М водный раствор Cu 2 + ионов и полоску цинка в другой химический стакан, содержащий 1 М водный раствор ионов Zn 2 + ионов. Две металлические полоски соединены проводом, по которому течет электричество, а стаканы соединены соляным мостом. Когда переключатель замкнут, чтобы замкнуть цепь, цинковый электрод (анод) самопроизвольно окисляется до ионов Zn 2 + в левом отсеке, в то время как ионы Cu 2 + одновременно восстанавливаются до металлической меди при медный электрод (катод). (b) По мере развития реакции цинковый анод теряет массу по мере растворения с образованием Zn 9.0086 2 + (водн.) ионов, в то время как катод Cu набирает массу по мере того, как ионы Cu 2 + (водн.) восстанавливаются до металлической меди, которая осаждается на катоде. (CC BY-SA-NC; анонимно)
Две металлические полоски соединены проводом, по которому течет электричество, а стаканы соединены соляным мостом. Когда переключатель замкнут, чтобы замкнуть цепь, цинковый электрод (анод) самопроизвольно окисляется до ионов Zn 2 + в левом отсеке, в то время как ионы Cu 2 + одновременно восстанавливаются до металлической меди при медный электрод (катод). (b) По мере развития реакции цинковый анод теряет массу по мере растворения с образованием Zn 9.0086 2 + (водн.) ионов, в то время как катод Cu набирает массу по мере того, как ионы Cu 2 + (водн.) восстанавливаются до металлической меди, которая осаждается на катоде. (CC BY-SA-NC; анонимно) Электролит в солевом мостике служит двум целям: он замыкает цепь, перенося электрический заряд, и поддерживает электрическую нейтральность в обоих растворах, позволяя ионам мигрировать между ними. Идентичность соли в солевом мостике не имеет значения, пока ионы компонентов не реагируют или не подвергаются окислительно-восстановительной реакции в условиях работы ячейки. {2+}}\ ) решение. В отсутствие солевого мостика или какого-либо другого подобного соединения реакция быстро прекращалась бы, поскольку нельзя было поддерживать электрическую нейтральность.
{2+}}\ ) решение. В отсутствие солевого мостика или какого-либо другого подобного соединения реакция быстро прекращалась бы, поскольку нельзя было поддерживать электрическую нейтральность.
Вольтметр можно использовать для измерения разницы электрических потенциалов между двумя отсеками. Размыкание переключателя, соединяющего провода с анодом и катодом, предотвращает протекание тока, поэтому химической реакции не происходит. Однако при замкнутом переключателе внешняя цепь замыкается, и электрический ток может течь от анода к катоду. Потенциал (\(E_{cell}\)) клетки, измеренный в вольтах, представляет собой разность электрических потенциалов между двумя полуреакциями и связан с энергией, необходимой для перемещения заряженной частицы в электрическом поле. . В описанной нами ячейке вольтметр показывает потенциал 1,10 В (рис. \(\PageIndex{3a}\)). Поскольку электроны из полуреакции окисления высвобождаются на аноде, анод в гальваническом элементе заряжен отрицательно. Катод, к которому притягиваются электроны, заряжен положительно.
Катод, к которому притягиваются электроны, заряжен положительно.
Не все электроды подвергаются химическому превращению в ходе окислительно-восстановительной реакции. Электрод может быть изготовлен из инертного металла с высокой проводимостью, такого как платина, чтобы предотвратить его реакцию во время окислительно-восстановительного процесса, когда он не участвует в общей электрохимической реакции. Это явление показано в примере \(\PageIndex{1}\).
Гальванический (гальванический) элемент преобразует энергию, выделившуюся в результате спонтанной химической реакции, в электрическую энергию. Электролитическая ячейка потребляет электрическую энергию от внешнего источника, чтобы управлять самопроизвольная химическая реакция.
Пример \(\PageIndex{1}\)
Химик сконструировал гальванический элемент, состоящий из двух стаканов. Один стакан содержит полоску олова, погруженную в водный раствор серной кислоты, а другой содержит платиновый электрод, погруженный в водный раствор азотной кислоты. Два раствора соединены солевым мостиком, а электроды соединены проводом. Начинает течь ток, и на платиновом электроде появляются пузырьки газа. Происходящая спонтанная окислительно-восстановительная реакция описывается следующим сбалансированным химическим уравнением: 9{2+} (водн.) + 2NO (г) + 4h3O (л)} \номер \]
Два раствора соединены солевым мостиком, а электроды соединены проводом. Начинает течь ток, и на платиновом электроде появляются пузырьки газа. Происходящая спонтанная окислительно-восстановительная реакция описывается следующим сбалансированным химическим уравнением: 9{2+} (водн.) + 2NO (г) + 4h3O (л)} \номер \]
Для этого гальванического элемента
- напишите полуреакцию, которая происходит на каждом электроде.
- указывают, какой электрод является катодом, а какой анодом.
- указывают, какой электрод является положительным электродом, а какой отрицательным.
Дано: гальванический элемент и окислительно-восстановительная реакция
Запрошено: полуреакции, идентичность анода и катода и назначение электродов как положительных или отрицательных
Стратегия:
- Определите полуреакцию окисления и полуреакцию восстановления. Затем определите анод и катод по полуреакции, которая происходит на каждом электроде.

- По направлению потока электронов назначьте каждый электрод либо положительным, либо отрицательным.
Раствор
A В полуреакции восстановления нитрат восстанавливается до оксида азота. (Затем оксид азота будет реагировать с кислородом воздуха с образованием NO 9{−}} \nonumber \]
Таким образом, нитрат восстанавливается до NO, а оловянный электрод окисляется до Sn 2 + .
Поскольку реакция восстановления происходит на платиновом электроде, он является катодом. И наоборот, реакция окисления происходит на оловянном электроде, поэтому он является анодом.
B Электроны перетекают от оловянного электрода через провод к платиновому электроду, где они переходят в нитраты. Электрическая цепь замыкается солевым мостиком, который обеспечивает диффузию катионов к катоду и анионов к аноду. Поскольку электроны текут от оловянного электрода, он должен быть электрически отрицательным. Напротив, электроны текут к платиновому электроду, так что электрод должен быть электрически положительным. 9{−}} \end{align*} \nonumber \]
Напротив, электроны текут к платиновому электроду, так что электрод должен быть электрически положительным. 9{−}} \end{align*} \nonumber \]
Платиновый электрод в растворе перманганата является катодом; тот, что в растворе олова, является анодом.
Катод (электрод в стакане с раствором перманганата) положительный, а анод (электрод в стакане с раствором олова) отрицательный.
Электрохимические элементы: Электрохимические элементы (открывается в новом окне) [youtu.be]
Построение диаграмм ячеек (обозначение ячеек)
Поскольку описание любого гальванического элемента словами несколько громоздко, было разработано более удобное обозначение . В этом линейном обозначении, называемом диаграммой ячейки, идентичность электродов и химическое содержимое отсеков обозначены их химическими формулами, причем анод написан в крайнем левом углу, а катод – в крайнем правом. Границы фаз показаны одиночными вертикальными линиями, а солевой мостик, имеющий две границы фаз, двойной вертикальной линией. Таким образом, диаграмма ячейки для ячейки \(\ce{Zn/Cu}\), показанная на рисунке \(\PageIndex{3a}\), записывается следующим образом:
Границы фаз показаны одиночными вертикальными линиями, а солевой мостик, имеющий две границы фаз, двойной вертикальной линией. Таким образом, диаграмма ячейки для ячейки \(\ce{Zn/Cu}\), показанная на рисунке \(\PageIndex{3a}\), записывается следующим образом:
Гальванические элементы могут иметь расположение, отличное от примеров, которые мы видели до сих пор. Например, напряжение, возникающее в результате окислительно-восстановительной реакции, можно более точно измерить, используя два электрода, погруженных в один химический стакан, содержащий электролит, замыкающий цепь. Такое расположение уменьшает ошибки, вызванные сопротивлением потоку заряда на границе, называемой потенциал соединения . Один пример этого типа гальванического элемента выглядит следующим образом:
Такое расположение уменьшает ошибки, вызванные сопротивлением потоку заряда на границе, называемой потенциал соединения . Один пример этого типа гальванического элемента выглядит следующим образом:
\[\ce{Pt(s)\, | \, h3(g) | HCl(aq, \, 1\,M)\,|\, AgCl(s) \,Ag(s)} \nonumber \]
Эта клеточная диаграмма не включает двойную вертикальную линию, представляющую солевой мостик, поскольку нет солевого мостика, обеспечивающего соединение между двумя разнородными растворами. Кроме того, концентрации растворов не указаны, поэтому они не включены в диаграмму ячеек. Полуреакции и общая реакция для этой клетки следующие: 9{+}(aq)} \nonumber \]
Гальванический элемент с одним отсеком первоначально будет иметь то же напряжение, что и гальванический элемент, построенный с использованием отдельных отсеков, но он будет быстро разряжаться из-за прямой реакции реагента на аноде. с окисленным членом катодной окислительно-восстановительной пары. Следовательно, элементы этого типа не особенно полезны для производства электроэнергии. {-}}\)) не участвует в общей реакции , так что особо указывать не надо. Катодное отделение содержит водный раствор азотной кислоты, которая не участвует в общей реакции, вместе с продуктом реакции (\(\ce{NO}\)) и \(\ce{Pt}\) электродом. Они записываются как \(\ce{HNO3(aq)∣NO(g)∣Pt(s)}\) с одиночными вертикальными чертами, обозначающими фазовые границы. Объединив два отсека и используя двойную вертикальную черту для обозначения соляного моста, 9+(aq, \;1\, M)\,|\,Ag(s)} \nonumber \]
{-}}\)) не участвует в общей реакции , так что особо указывать не надо. Катодное отделение содержит водный раствор азотной кислоты, которая не участвует в общей реакции, вместе с продуктом реакции (\(\ce{NO}\)) и \(\ce{Pt}\) электродом. Они записываются как \(\ce{HNO3(aq)∣NO(g)∣Pt(s)}\) с одиночными вертикальными чертами, обозначающими фазовые границы. Объединив два отсека и используя двойную вертикальную черту для обозначения соляного моста, 9+(aq, \;1\, M)\,|\,Ag(s)} \nonumber \]
Схемы ячеек: Схемы ячеек(opens in new window) [youtu.be]
Резюме
Гальванический (гальванический) элемент использует энергию, высвобождаемую во время спонтанной окислительно-восстановительной реакции, для выработки электричества, в то время как электролитический элемент потребляет электричество. энергию из внешнего источника, чтобы вызвать реакцию. Электрохимия – это наука о взаимосвязи между электричеством и химическими реакциями. Реакция окисления-восстановления, происходящая во время электрохимического процесса, состоит из двух полуреакций, одна из которых представляет собой процесс окисления, а другая — процесс восстановления. Сумма полуреакций дает общую химическую реакцию. Общая окислительно-восстановительная реакция уравновешена, когда количество электронов, потерянных восстановителем, равно количеству электронов, полученных окислителем. Электрический ток создается потоком электронов от восстановителя к окислителю. Электрохимическая ячейка может либо генерировать электричество в результате спонтанной окислительно-восстановительной реакции, либо потреблять электричество для запуска несамопроизвольной реакции. В гальваническом (гальваническом) элементе энергия спонтанной реакции генерирует электричество, тогда как в электролитической ячейке электрическая энергия потребляется для запуска неспонтанной окислительно-восстановительной реакции. Оба типа ячеек используют два электрода, которые обеспечивают электрическую связь между системами, разделенными в пространстве.
Реакция окисления-восстановления, происходящая во время электрохимического процесса, состоит из двух полуреакций, одна из которых представляет собой процесс окисления, а другая — процесс восстановления. Сумма полуреакций дает общую химическую реакцию. Общая окислительно-восстановительная реакция уравновешена, когда количество электронов, потерянных восстановителем, равно количеству электронов, полученных окислителем. Электрический ток создается потоком электронов от восстановителя к окислителю. Электрохимическая ячейка может либо генерировать электричество в результате спонтанной окислительно-восстановительной реакции, либо потреблять электричество для запуска несамопроизвольной реакции. В гальваническом (гальваническом) элементе энергия спонтанной реакции генерирует электричество, тогда как в электролитической ячейке электрическая энергия потребляется для запуска неспонтанной окислительно-восстановительной реакции. Оба типа ячеек используют два электрода, которые обеспечивают электрическую связь между системами, разделенными в пространстве. На аноде протекает окислительная полуреакция, на катоде – восстановительная полуреакция. Солевой мостик соединяет разделенные растворы, позволяя ионам мигрировать в любой раствор, чтобы обеспечить электрическую нейтральность системы. Вольтметр — это прибор, измеряющий протекание электрического тока между двумя полуреакциями. Потенциал клетки, измеряемый в вольтах, представляет собой энергию, необходимую для перемещения заряженной частицы в электрическом поле. Электрохимическую ячейку можно описать с помощью линейных обозначений, называемых диаграммой ячейки, на которой вертикальные линии указывают границы фаз и расположение солевого мостика. Сопротивление потоку заряда на границе называется потенциалом перехода.
На аноде протекает окислительная полуреакция, на катоде – восстановительная полуреакция. Солевой мостик соединяет разделенные растворы, позволяя ионам мигрировать в любой раствор, чтобы обеспечить электрическую нейтральность системы. Вольтметр — это прибор, измеряющий протекание электрического тока между двумя полуреакциями. Потенциал клетки, измеряемый в вольтах, представляет собой энергию, необходимую для перемещения заряженной частицы в электрическом поле. Электрохимическую ячейку можно описать с помощью линейных обозначений, называемых диаграммой ячейки, на которой вертикальные линии указывают границы фаз и расположение солевого мостика. Сопротивление потоку заряда на границе называется потенциалом перехода.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
D40.1 Потенциал гальванических элементов — химия 109 Осень 2021 г.
Перейти к содержимому
Когда гальванический элемент подключен к нагрузке, такой как лампочка, протекает электрический ток, потому что между двумя электродами существует разница электрических потенциалов. Эту разность электрических потенциалов можно измерить с помощью потенциометра (вольтметра).
Показанный ниже гальванический элемент включает самопроизвольную реакцию:
Cu(тв) + 2 Ag + (водн.) ⟶ Cu 2+ (водн.) + 2 Ag(тв)
Рисунок: Разность потенциалов между электродами. В этом гальваническом элементе разность электрических потенциалов между электродами измеряется вольтметром. При концентрации обоих растворов 1 М разность потенциалов для этой ячейки составляет 0,46 В.
Согласно уравнению реакции медь теряет электроны и окисляется до ионов меди(II), поэтому полуячейка с медным электродом анод. Согласно уравнению реакции, ионы серебра приобретают электроны и восстанавливаются до серебра, поэтому полуэлемент с серебряным электродом является катодом. Медный электрод имеет более отрицательный потенциал, чем серебряный.
Когда более отрицательный медный электрод подключен к отрицательной клемме вольтметра, а более положительный серебряный электрод подключен к положительной клемме вольтметра, счетчик показывает +0,46 В. Это показание называется потенциалом ячейки , E. ячейка . Это мера энергии на единицу заряда, полученная в результате окислительно-восстановительной реакции (V = J/C). Положительный потенциал ячейки показывает, какую электрическую работу может совершить спонтанная реакция в гальванической ячейке на единицу электрического заряда, перемещающегося по цепи.
В стандартных условиях (1 бар или 1 М) потенциал ячейки соответствует стандартному потенциалу ячейки, E ° ячейка (произносится как «E-стандартная-ячейка»). Таким образом, исходя из показаний вольтметра на рисунке выше, E ° ячейки = 0,46 В.
Таким образом, исходя из показаний вольтметра на рисунке выше, E ° ячейки = 0,46 В.
Вольтметр измеряет разность электрических потенциалов между положительным и отрицательным выводами. Поскольку положительная клемма измерителя находится справа на рисунке выше, потенциал ячейки представляет собой разницу электрических потенциалов между правой и левой полуэлементами, и мы можем написать:
E ячейка = E правая полуячейка – E левая полуячейка
На приведенном выше рисунке все концентрации равны 1 M (условия стандартного состояния), поэтому мы можем также написать
.E ° ячейка = E ° правая полуячейка – E ° левая полуячейка
Если соединения проводов поменять местами, типичный вольтметр покажет -0,46 В. Это дает экспериментальный способ определить, какая полуэлемента является катодом, а какая анодом: положительное показание вольтметра указывает на то, что отрицательная клемма измерителя подключена к анод и плюсовая клемма соединены с катодом; отрицательное показание вольтметра указывает на то, что отрицательная клемма подключена к катоду, а положительная клемма подключена к аноду.


