Как устроен литий-ионный аккумулятор | Полезная информация | Cписок категорий | Блог
Берем два длинных листка: из графита и из оксида лития с кобальтом (LiCoO2). Смазываем их электролитом, прокладываем между ними тонкую перфорированную пластиковую пленку и сворачиваем рулончиком. Литий-ионный аккумулятор готов.Когда мы подаем на пластинки напряжение — на графит минус, а на оксид лития плюс — от молекул оксида отцепляются положительно заряженные ионы лития и перепрыгивают на углеродную пластинку. Так происходит зарядка аккумулятора.
Первый в мире серийный электрический спорткар Tesla Roadster, питается как раз от литий-ионных аккумуляторов. Принципиально они не отличаются от аккумулятора для шуруповерта, ноутбука или телефона.
Когда аккумулятор заряжен и вы решаете им воспользоваться, то все происходит наоборот: положительно заряженные ионы лития перепрыгивают обратно на оксид лития, в свое нормальное состояние. В полученной батарейке графитовая пластинка становится минусом, а оксид лития — плюсом.
Такие аккумуляторы обладают большой емкостью, у них нет эффекта памяти, они легкие и компактные.
Эффект памяти аккумулятора — в настоящий момент под эффектом памяти понимается обратимая потеря ёмкости, имеющая место в некоторых типах электрических аккумуляторов при нарушении рекомендованного режима зарядки, в частности, при подзарядке не полностью разрядившегося аккумулятора. Название связано с внешним проявлением эффекта: аккумулятор как будто «помнит», что в предыдущие циклы работы его ёмкость не была использована полностью, и при разряде отдаёт ток до «запомненной границы».
Но при неправильном использовании у них есть и минусы:
- При сильном нагревании аккумулятор может загореться.
- Если аккумулятор сядет ниже определенного критического уровня, то его больше никогда нельзя будет зарядить.
Поэтому такие аккумуляторы объединяют в батареи со встроенной электроникой, которая следит за температурой и режимами зарядки каждого отдельного аккумулятора.
Как работает литиевый (литий-ионный) аккумулятор?
- Категория: Поддержка по аккумуляторным батареям
- Опубликовано 29.03.2016 22:48
- Автор: Abramova Olesya
Пионером разработки литий-содержащих батарей считается Г. Н. Льюис, сделавший первые исследования в этой сфере в далеком 1912 году. Но только в 1970-х технологии продвинулись настолько, что позволили создать первую коммерчески оправданную неперезаряжаемую литиевую батарею. Попытки разработать перезаряжаемую версию предпринимались в 1980-х, но из-за нестабильности металлического лития претерпели неудачу. (Металл-литиевая батарея использует литий в качестве анода, а литий-ионная – графит, активный же материал находится в ней на катоде).
Литий является самым легким из всех металлов, имеет наибольший электрохимический потенциал и обеспечивает самую большую удельную энергоемкость на единицу веса. Аккумуляторные батареи с литиевым анодом могут обеспечивать чрезвычайно высокую плотность энергии, но в середине 1980-х было обнаружено, что циклический режим работы приводит к образованию дендритов на аноде. Эти нежелательные образования могут проникать в сепаратор и приводить к короткому замыканию. При этом будет быстро расти температура ячейки и литий расплавится, что приведет к возгоранию или даже взрыву. Большинство батарей с металлическим литием были отозваны после случаев нанесения ожогов людям.
Присущая металлическому литию неустойчивость, особенно во время зарядки, привела к поиску неметаллических решений с использованием ионов лития. Уже в 1991 году корпорация Sony выпустила первую коммерческую версию литий-ионного аккумулятора, и сейчас эта электрохимическая система является наиболее перспективной и быстрорастущей на рынке. Хотя, в сравнении с литий-металлической батареей, литий-ионная имеет более низкую удельную энергоемкость, она безопаснее (при условии соблюдения значений напряжения и предельного тока).
Заслуга изобретения литий-кобальт-оксидной батареи, прообраза современной литий-ионной, должна принадлежать Джону Б. Гудэнафу (родился в 1922 году). Говорят, что во время своих исследований, он бы нанят кампанией Nippon Telegraph and Telephone (NTT), работая на нее в США и Японии. Когда в 1991 году корпорация Sony запатентовала литий-кобальт-оксидную батарею, обнаружилось, что в ней использовались наработки Гудинэфа, но ему не удалось в судебном порядке доказать свою причастность к этому изобретению. В 2014 году, в честь признания заслуг в разработке литий-ионных батарей, он был награжден премией Национальной Инженерной Академии США. В 2015 году Израиль наградил Гудэнафа грантом в 1 миллион долларов США, которые тот пожертвовал Техасскому Университету на научные изыскания.
Ключевой момент прекрасного показателя удельной энергоемкости кроется в высоком напряжении ячейки аккумулятора — 3,60 В. Развитие и улучшение активных веществ и электролита открывают потенциал для дальнейшего увеличения плотности энергии. Нагрузочные характеристики крайне хороши, кривая разряда батареи указывает на эффективное использование накопленной энергии в широком диапазоне напряжений – от 3,70 до 2,80 В на ячейку.
В 1994 году себестоимость литий-ионной ячейки типоразмера 18650 (цилиндр 65 мм длиной и 18 мм в диаметре) была $10, а емкость составляла 1100 мАч. В 2001 году цена опустилась до $3, а емкость возросла до 1900 мАч. Сегодня же емкость высокоэнергетичных моделей типоразмера 18650 доходит до 3000 мАч, а затраты на производство снизились еще более. Снижение затрат, повышение удельной энергоемкости и отсутствие в составе токсичных материалов открыли путь литий-ионной электрохимической системе для становления в общепринятый формат аккумуляторов, используемых в портативных устройствах, тяжелой промышленности, электротранспорте и спутниках. ( Смотрите: История форматов и типоразмеров электрических батарей).
Литий-ионные аккумуляторы не нуждаются в обслуживании, и это дает им преимущество, которым большинство других электрохимических систем не может похвалиться. Им не присущ эффект “памяти”, соответственно, отпадает необходимость в периодическом полном разряде для поддержания максимальной емкости. Саморазряд в разы меньше показателей батарей на основе никеля, что облегчает работу систем индикации уровня заряда. Номинальное напряжении ячейки в 3,6 В позволяет непосредственно питать мобильные телефоны, планшеты и цифровые камеры, позволяя сократить расходы на конструкции. Недостатком является необходимость встраивания системы защиты, что влияет на конечную цену аккумулятора.
Типы литий-ионных аккумуляторовКак и все электрические батареи, литий-ионная состоит из катода (положительный электрод), анода (отрицательный электрод) и электролита в качестве проводника. Катод представляет собой оксид металла, а анод состоит из пористого углерода. Во время разряда ионы движутся от анода к катоду через электролит и сепаратор, при заряде же процесс меняет направление на противоположное – ионы теперь текут от катода к аноду. На рисунке 1 показан этот процесс.
Рисунок 1: Ионный поток литий-ионного аккумулятора. При заряде и разряде ячеек ионы курсируют между катодом (положительный электрод) и анодом (отрицательный электрод). При разряде на аноде происходит окислительный процесс, или потеря электронов; на катоде в то же время происходит восстановительный процесс, или присоединение электронов. При зарядке процессы меняются местами.
Существует много видов литий-ионных батарей, но все они имеют общую черту – модный термин “литий-ионный” в названии. Несмотря на то, что они поразительно похожи на первый взгляд, эти батареи различаются по производительности и выбору активного вещества, которое и определяет их уникальные особенности. ( Смотрите: Виды литий-ионных аккумуляторов).
Оригинальный литий-ионный аккумулятор Sony использовал кокс (материал на основе углерода) в качестве анода. Начиная с 1997 года большинство производителей, в том числе и Sony, перешли на графит для достижения пологой кривой разряда. Графит является формой углерода, которая имеет долговременный цикл стабильности и используется, например, как грифель в карандашах. Это наиболее распространенный углеродный материал после жестких и мягких углеродов. Нанотрубки на основе углерода до сих пор не нашли своего применения в коммерческих моделях литий-ионных аккумуляторов, поскольку они, как правило, имеют сложную структуру и влияют на производительность. Материал, на который возлагаются большие надежды и благодаря которому надеются повысить производительность, –
На рисунке 2 показаны кривые напряжения при разряде современного литий-ионного аккумулятора и его ранней версии с анодом из кокса.
Для повышения производительности графитового анода, в его состав могут быть добавлены различные примеси, в том числе и на основе кремниевых сплавов. Молекулярная структура графита такова, что с одним ионом лития взаимодействуют шесть атомов углерода, один же атом кремния взаимодействует с четырьмя ионами лития. Это означает, что кремниевый анод теоретически может хранить в десять раз больше энергии в сравнении с графитовым, но у него есть недостаток – расширение во время заряда. Поэтому из соображений стабильности в состав анода добавляется только определенное количество кремния.
Использование наноструктурированного литий-титаната в качестве анодной примеси показывает многообещающие показатели количества жизненных циклов, хорошие нагрузочные возможности, отличную производительность при низких температурах и высокую безопасность, но имеются и недостатки – низкая удельная энергоемкость и высокая стоимость.
Эксперименты с материалами для анода и катода позволяют производителям усиливать определенные характеристики батареи, но повышение одних параметров приводит к ослаблению других. Существуют разные модели аккумуляторов, оптимизированные под определенную специфику работы. Например, есть специальные литий-ионные аккумуляторы с большой емкостью для увеличения времени автономной работы, а есть и с повышенным значением удельной мощности, где емкость не играет первоочередную роль. Существуют и гибридные модели, где соблюден баланс между характеристиками. (Смотрите: Базовые знания о разряде электрохимического источника тока).
Например, есть специальные литий-ионные аккумуляторы с большой емкостью для увеличения времени автономной работы, а есть и с повышенным значением удельной мощности, где емкость не играет первоочередную роль. Существуют и гибридные модели, где соблюден баланс между характеристиками. (Смотрите: Базовые знания о разряде электрохимического источника тока).
Для достижения высокой удельной энергоемкости и уменьшения себестоимости можно заменить кобальт более дешевым никелем, но это скажется на стабильности батареи. И если для новых компаний, которые только выходят на рынок литий-ионных аккумуляторных батарей, включение в состав никеля выглядит допустимым, то солидные производители делают упор на безопасность и долговечность батареи. В таблице 3 приведены преимущества и недостатки литий-ионной электрохимической системы.
| Преимущества | Высокая удельная энергоемкость и высокие нагрузочные характеристики Долгий срок службы; необслуживаемые Высокая производительность, низкое внутреннее сопротивление, хорошая кулоновская эффективность Простой алгоритм и достаточно короткое время зарядки Низкий саморазряд (более чем в два раза меньше показателя NiCd и NiMH) |
| Недостатки | Необходимость во встроенной системе защиты Деградационные процессы при высоких значениях температуры и напряжения Необходимость в дополнительном обогреве при низких температурах зарядки Специальные регламентирующие правила при транспортировке в больших количествах |
Таблица 3: Преимущества и недостатки литий-ионных аккумуляторов.
Последнее обновление 2016-02-16
Литий-ионные аккумуляторы. Устройство и виды.Работа и применение
Сегодня именно литий-ионные аккумуляторы наиболее часто применяются в различных областях. Особенно широко они используются в мобильной электронике (КПК, мобильные телефоны, ноутбуки и многое другое), электромобилях и так далее. Это связано с их преимуществами в сравнении с ранее широко применявшимися никель-кадмиевыми (Ni-Cd) и никель-металлогидридными (Ni-MH) аккумуляторами. И если последние приблизились вплотную к своему теоретическому пределу, то технологии литий-ионные аккумуляторы находятся в начале пути.
Это связано с их преимуществами в сравнении с ранее широко применявшимися никель-кадмиевыми (Ni-Cd) и никель-металлогидридными (Ni-MH) аккумуляторами. И если последние приблизились вплотную к своему теоретическому пределу, то технологии литий-ионные аккумуляторы находятся в начале пути.
Устройство
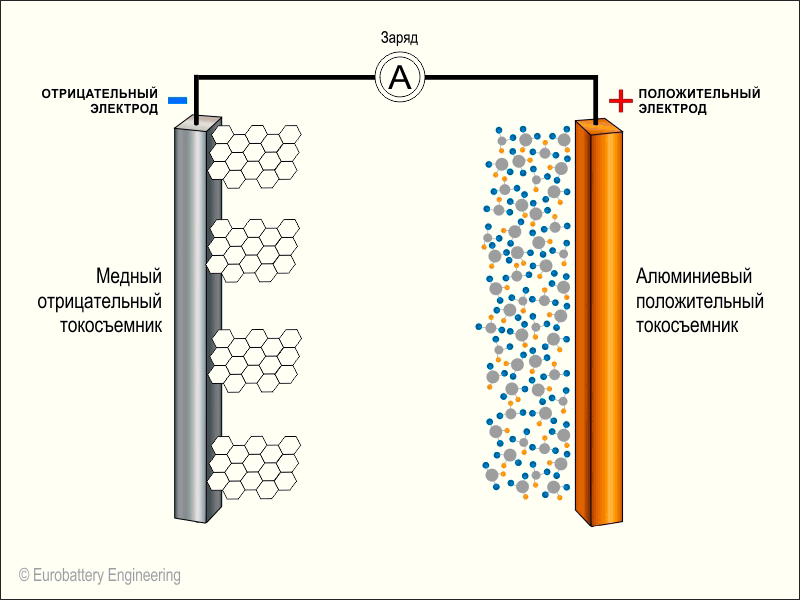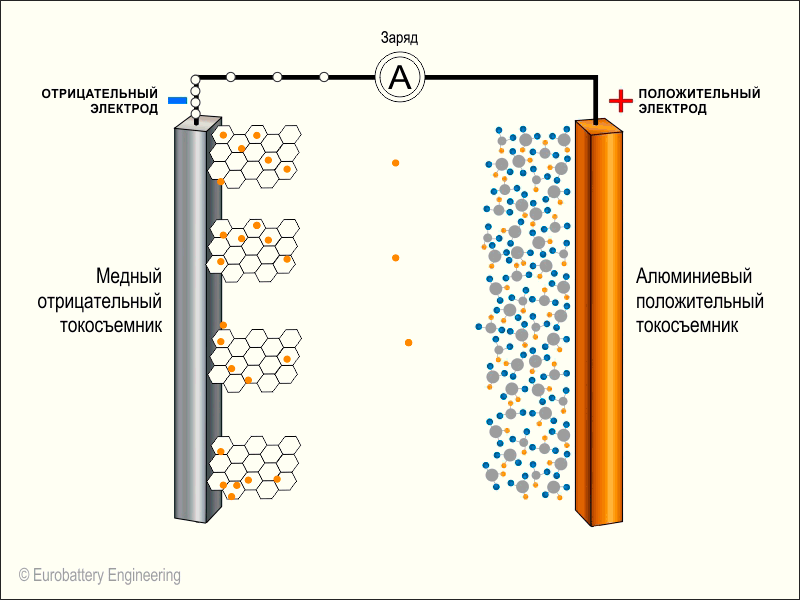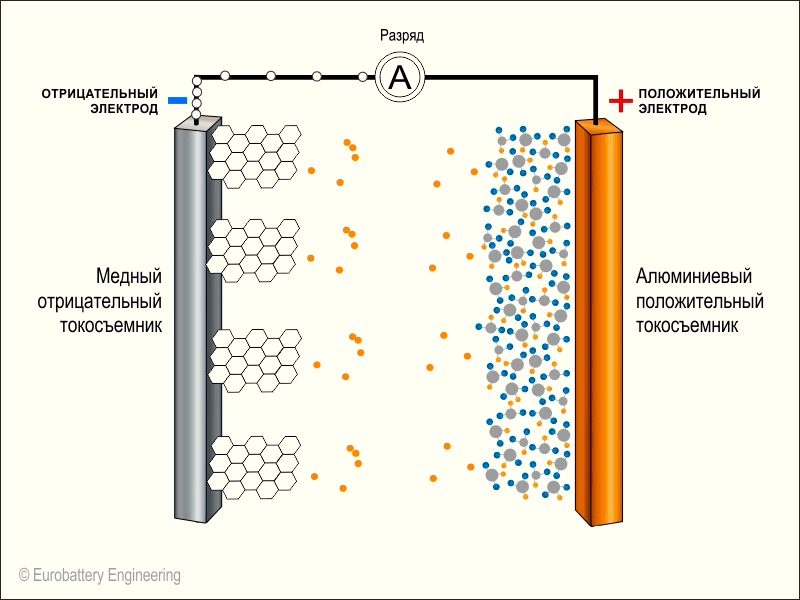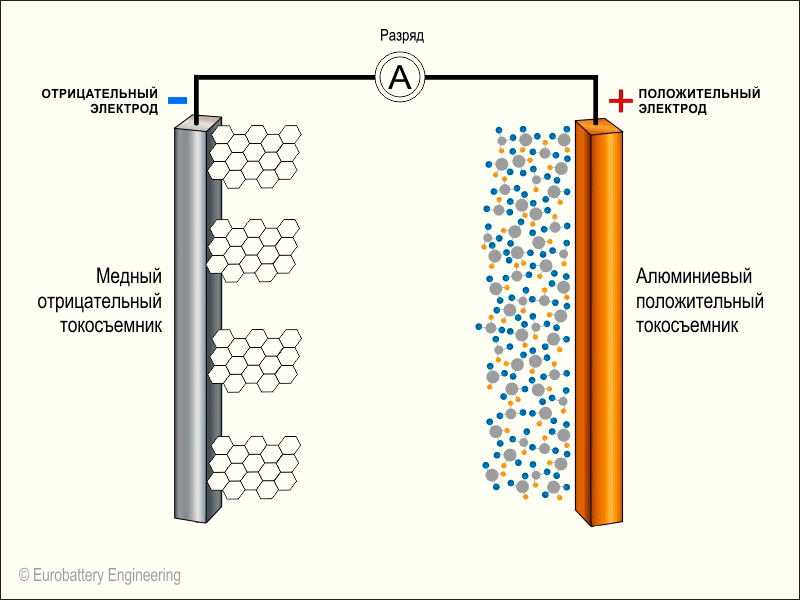
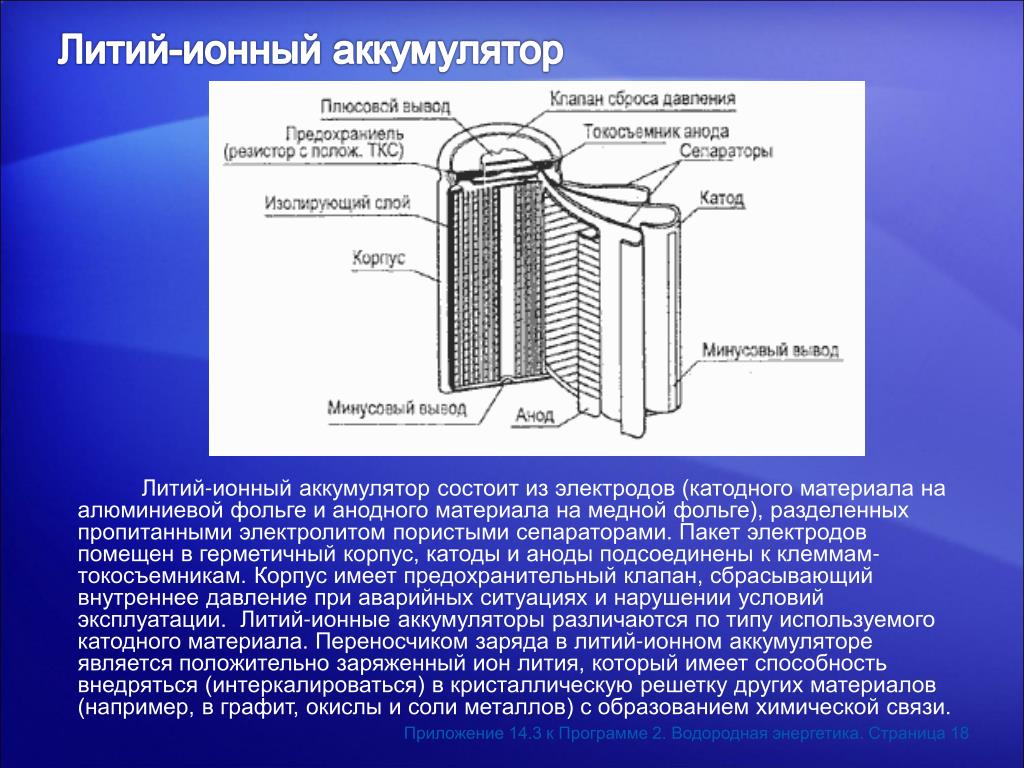
В литий-ионных аккумуляторах в качестве отрицательного электрода (катода) работает алюминий, а положительным электродом (анодом) выступает медь. Электроды могут быть выполнены в разной форме, однако, как правило, это фольга в форме продолговатого пакета или цилиндра.
- Анодный материал на медной фольге и катодный материал на алюминиевой фольге разделяются пористым сепаратором, который пропитан электролитом.
- Пакет электродов устанавливаются в герметичный корпус, а аноды и катоды подсоединяются к клеммам-токосъемникам
- Под крышкой аккумулятора могут быть специальные устройства. Одно устройство реагирует увеличением сопротивления на положительный температурный коэффициент. Второе устройство разрывает электрическую связь между положительной клеммой и катодом при повышении давления газов в аккумуляторе сверх допустимого предела. В некоторых случаях корпус оснащается предохранительным клапаном, который сбрасывает внутреннее давление при нарушениях условий эксплуатации или аварийных ситуациях.
- Для повышения безопасности эксплуатации в ряде аккумуляторов применяется и внешняя электронная защита. Она не допускает возможности чрезмерного разогрева, короткого замыкания и перезаряда аккумулятора.
- Конструктивно аккумуляторы производятся в призматическом и цилиндрическом вариантах. Свернутый в виде рулона пакет сепаратора и электродов в цилиндрических аккумуляторах помешен в алюминиевый или стальной корпус, с которым соединяется отрицательный электрод. Через изолятор на крышку выводится положительный полюс аккумулятора. Призматические аккумуляторы создаются складыванием прямоугольных пластин друг на друга.
Подобные литий-ионные аккумуляторы позволяют обеспечить более плотную упаковку, однако в них труднее поддерживать сжимающие усилия на электроды, чем в цилиндрических.
 В ряде призматических батарей используется рулонная сборка пакета электродов, скрученных в эллиптическую спираль.
В ряде призматических батарей используется рулонная сборка пакета электродов, скрученных в эллиптическую спираль.Большая часть аккумуляторов производится в призматических вариантах, так как основное их назначение — обеспечение работы ноутбуков и мобильников. Конструкция Li-ion аккумуляторов отличается абсолютной герметичностью. Данное требование продиктовано недопустимостью вытекания жидкого электролита. Если пары воды или кислород попадут внутрь, то происходит реакция с электролитом и материалами электродов, что ведет к полному выводу аккумулятора из строя.
Принцип действия- В литий-ионных аккумуляторах имеются два электрода в виде анода и катода, между ними находится электролит. На аноде при подключении батареи в замкнутую цепь образуется химическая реакция, которая приводит к образованию свободных электронов.
- Указанные электроны стремятся попасть на катод, где меньше их концентрация. Однако от прямого пути к катоду от анода удерживает их электролит, который находится между электродами. Остается единственный путь – через цепь, куда замыкается батарея. При этом электроны, двигаясь по указанной цепи, питают устройство энергией.
- Положительно заряженные ионы лития, которые были оставлены убежавшими электронами, в то же время через электролит направляются к катоду, дабы удовлетворить потребность в электронах на стороне катода.
- После перемещения всех электронов к катоду наступает «смерть» батарейки. Но литий-ионный аккумулятор является перезаряжаемым, то есть процесс можно обратить вспять.
При помощи зарядного устройства можно впустить энергию в цепь, тем самым будет запущена реакция протекания в обратном направлении. В результате будет получено скопление электронов на аноде. После перезаряда аккумулятора он по большей части будет оставаться таковым до момента приведения его в действие. Однако с течением времени батарея будет утрачивать часть своего заряда даже в режиме ожидания.
- Емкость батареи подразумевает количество ионов лития, которые могут внедриться в кратеры и крошечные поры анода или катода.
 Со временем, после многочисленных перезарядок катод и анод деградируют. В результате число ионов, которые они могут вместить, уменьшается. При этом аккумулятор более не может удерживать прежнее количество заряда. В конце концов, он полностью утрачивает свои функции.
Со временем, после многочисленных перезарядок катод и анод деградируют. В результате число ионов, которые они могут вместить, уменьшается. При этом аккумулятор более не может удерживать прежнее количество заряда. В конце концов, он полностью утрачивает свои функции.
Литий-ионные аккумуляторы выполнены так, что их зарядку нужно постоянно контролировать. С этой целью в корпус устанавливается специальная плата, она называется контроллер заряда. Чип на плате производит управление процессом зарядки аккумулятора.
Стандартная зарядка аккумулятора выглядит следующим образом:
- Контроллер в начале процесса заряда подает ток величиной 10% от номинального. В данный момент напряжение поднимается до 2,8 В.
- Затем ток заряда повышается до номинального. В данный период напряжение при постоянном токе растет до 4,2 В.
- В завершении процесса заряда ток падает при постоянном напряжении 4,2 В до момент 100% заряда батареи.
Стадийность может отличаться в виду применения разных контроллеров, что ведет к разной скорости зарядки и соответственно суммарной стоимости аккумулятора. Литий-ионные аккумуляторы могут быть без защиты, то есть контроллер находится в зарядном устройстве, либо со встроенной защитой, то есть контроллер располагается внутри батареи. Могут быть устройства, где плата защиты встроена непосредственно в аккумулятор.
Разновидности и применениеСуществуют два форм-фактора литий-ионных аккумуляторов:
Цилиндрические литий-ионные аккумуляторы.
Таблеточные литий-ионные аккумуляторы.
Разные подвиды электрохимической литий-ионной системы называются по типу применяемого активного вещества. Объединяет все эти литий-ионные аккумуляторы то, что все они являются герметичными необслуживаемым аккумуляторам.
Можно привести 6 наиболее распространенных типов литий-ионных аккумуляторов:
- Литий-кобальтовый аккумулятор.
 Он является популярным решением для цифровых камер, ноутбуков и мобильных телефонов в виду высокого показателя удельной энергоемкости. Аккумулятор состоит из катода из оксида кобальта и графитового анода. Недостатки литий-кобальтовых аккумуляторов: ограниченные возможности нагрузки, низкая термическая стабильность и относительно короткий срок службы.
Он является популярным решением для цифровых камер, ноутбуков и мобильных телефонов в виду высокого показателя удельной энергоемкости. Аккумулятор состоит из катода из оксида кобальта и графитового анода. Недостатки литий-кобальтовых аккумуляторов: ограниченные возможности нагрузки, низкая термическая стабильность и относительно короткий срок службы.
Области применения
; мобильная электроника.- Литий-марганцевый аккумулятор. Катод из кристаллической литий-марганцевой шпинели выделяется трехмерной каркасной структурой. Шпинель обеспечивает низкое сопротивление, однако отличается более умеренной удельной энергоемкостью, чем кобальт.
Области применения; электрические силовые агрегаты, медицинское оборудование, электроинструмент.
- Литий-никель-марганец-кобальт-оксидный аккумулятор. В катоде батареи сочетаются кобальт, марганец и никель. Никель славится высокой удельной энергоемкостью, однако низкой стабильностью. Марганец обеспечивает низкое внутреннее сопротивление, однако приводит к низкой удельной энергоемкости. Сочетание металлов позволяет компенсировать их минусы и задействовать сильные стороны.
Области применения; для частного и промышленного использования (источники бесперебойного питания, системы безопасности, солнечные электростанции, аварийное освещение, телекоммуникации, электромобили, электровелосипеды и так далее).
- Литий-железо-фосфатный аккумулятор. Его основные преимущества: длительный срок службы, высокие показатели силы тока, стойкость к неправильному использованию, повышенная безопасность и хорошая термическая стабильность. Однако у такого аккумулятора небольшая емкость.
Области применения;
стационарные и портативные специализированные устройства, где нужны выносливость и высокие токи нагрузки.- Литий-никель-кобальт-алюминий-оксидный аккумулятор.
 Его основные преимущества: высокие показатели плотности энергии и энергоемкости, долговечность. Однако показатели безопасности и высокая стоимость ограничивают его применение.
Его основные преимущества: высокие показатели плотности энергии и энергоемкости, долговечность. Однако показатели безопасности и высокая стоимость ограничивают его применение.
Области применения; электрические силовые агрегаты, промышленность и медицинское оборудование.
- Литий-титанатный аккумулятор. Его основные преимущества: быстрая зарядка, длительный срок службы, широкий температурный диапазон, отличные показатели производительности и безопасности. Это наиболее безопасная литий-ионная аккумуляторная батарея.
Однако у нее высокая стоимость и низкая удельная энергоемкость. На данный момент ведутся разработки по удешевлению производства и увеличению удельной энергоемкости.
Области применения; уличное освещение на солнечных элементах, электрические силовые агрегаты автомобилей (Honda Fit-EV, Mitsubishi i-MiEV), ИБП.
Типичные характеристикиВ целом литий-ионные аккумуляторы имеют следующие типичные характеристики:
- Минимальное напряжение — не ниже 2,2-2,5В.
- Максимальное напряжение – не выше 4,25-4,35В.
- Время заряда: 2-4 часа.
- Саморазряд при комнатной температуре – порядка 7 % в год.
- Диапазон рабочих температур, начиная от −20 °C и заканчивая +60 °C.
- Число циклов заряд/разряд до достижения потери 20% емкости составляет 500-1000.
К преимуществам можно отнести:
- Высокая энергетическая плотность при сравнении с щелочными аккумуляторами с применением никеля.
- Достаточно высокое напряжение одного аккумуляторного элемента.
- Отсутствие «эффекта памяти», что обеспечивает простую эксплуатацию.
- Значительное число циклов заряда-разряда.
- Длительный срок эксплуатации.
- Широкий температурный диапазон, обеспечивающий неизменные рабочие характеристики.
- Относительная экологическая безопасность.
Среди недостатков можно выделить:
- Умеренный ток разряда.

- Относительно быстрое старение.
- Сравнительно высокая стоимость.
- Невозможность работы без встроенного контроллера.
- Вероятность самовозгорания при высоких нагрузках и при слишком глубоком разряде.
- Конструкция требует существенных доработок, ведь она не доведена до совершенства.
Похожие темы:
Литий-ионные технологии продления срока службы
Литий-ионные аккумуляторные батареи радикально меняют рынок промышленных электрических погрузчиков. И неудивительно: по своим выдающимся характеристикам и потрясающей добавленной ценности мощные энергоносители существенно превосходят обычные свинцово-кислотные АКБ. Благодаря продолжительной работе литий-ионные аккумуляторные батареи помогут вам опередить конкурентов, повышая эффективность складских операций и обработки товаров. Боле того, небольшое время зарядки и отсутствие необходимости в обслуживании гарантируют непрерывность работы. Обладая длительным сроком службы, литий-ионные батареи обеспечат вам максимум преимуществ. На литий-ионные батареи собственного производства компания Jungheinrich дает 5 лет гарантии при 10000 часов эксплуатации. Это лучшее предложение на рынке. Литий-ионные аккумуляторы Jungheinrich — залог успеха в Вашей конкурентной борьбе.
5 лет без забот. Гарантировано.
Давая 5 лет гарантии на литий-ионные аккумуляторы, мы подтверждаем их долгую безукоризненную работу независимо от часов эксплуатации.
Встроенный контент требует вашего подтверждения
К сожалению, содержимое этой страницы недоступно из-за ваших текущих настроек cookie.
Пожалуйста, разрешите «маркетинговые» cookie для отображения контента.
Преимущества литий-ионных аккумуляторов
Высокая мощность, быстрая зарядка, отсутствие потребности в обслуживании и долговечность — узнайте, как литий-ионные АКБ помогут Вам быть впереди конкурентов.
ПодробноБыстрый возврат к работе.
Невероятно быстрая зарядка.
Литий-ионные аккумуляторы всегда заряжены и готовы к работе даже в несколько смен. Промежуточный заряд длительностью всего 30 минут обеспечит батарее на 24 В заряд до 50 % емкости. Чтобы зарядить наполовину аккумулятор на 80 В, достаточно всего 53 минут. Полная зарядка батареи на 24 В занимает 80 минут, а на 80 В — 105 минут. Технологии ускоренного и промежуточного заряда, например, в перерывах и во время спонтанных пауз, гарантируют непрерывную готовность техники, что повышает гибкость ежедневных складских операций.
Максимальная мощность в любое время.
Неизменно высокие рабочие характеристики.
Литий-ионные АКБ обладают более высокой производительностью по сравнению со свинцово-кислотными аккумуляторами. Более глубокий разряд и постоянные характеристики напряжения гарантируют, что даже при низком заряде литий-ионная АКБ может выдать больше мощности, чем свинцово-кислотные аккумуляторные батареи. При каждом торможении батарея набирает заряд, а высокая общая эффективность позволяет аккумулировать до 20 % больше энергии. Кроме того, обмен данными между батареей и зарядным устройством гарантирует эффективную и быструю зарядку.
Всегда готовы к работе.
Без вынужденных простоев.
Литий-ионные аккумуляторы всегда готовы к работе. Им не нужен отдых. Они не требуют обслуживания и не выделяют вредных газов. Это значит, что Вам не придется тратить время и деньги на обслуживание аккумуляторных батарей или дополнительную инфраструктуру. С литий-ионными аккумуляторными батареями вынужденные простои останутся в прошлом.
Работают в три раза дольше.
Благодаря продолжительному сроку службы.
Подобно хорошему спринтеру, литий-ионные АКБ эффективны на любом этапе соревнований. Потому что они работают в три раза дольше, чем традиционные аккумуляторы. Выдающаяся выносливость и более высокая общая эффективность защитят Ваши инвестиции за счет сокращения расходов на электроэнергию.
Председатель Совета директоров
«На сегодняшний день большинство используемой в мире подъемно-погрузочной техники с литий-ионными аккумуляторами выпущены под маркой Jungheinrich».
Максимальный результат с лучшей командой.
Идеально синхронизированная система.
Чтобы спортсмен мирового класса выложился на полную, ему нужна надежная команда. То же самое относится и к литий-ионным АКБ. Полного раскрытия потенциала можно добиться лишь в том случае, если все элементы системы работают согласованно. Компания Jungheinrich — единственный производитель складской техники, который предлагает Вам комплексную взаимосвязанную систему, в которой АКБ, зарядное устройство и погрузчик эффективно взаимодействуют друг с другом, значительно снижая потребности в электроэнергии. Подобный уровень эффективности стал закономерным следствием того, что на сегодняшний день Jungheinrich — единственная в мире компания, занимающаяся разработкой и вводом в эксплуатацию электрических погрузчиков с литий-ионными аккумуляторами собственного производства. Суть нашей командной работы заключается в том, что мы всегда готовы оказать поддержку на каждом этапе Вашего проекта, в котором используются литий-ионные АКБ. Вне зависимости от того, что требуется в данный момент: заменить АКБ на одной машине или перевести на литий-ионные АКБ целый парк техники. Наши консультанты будут рады помочь Вам на любом этапе процесса: от планирования до введения в эксплуатацию.
Обратитесь к нам уже сегодня!
Идеальная согласованность на пути к успеху.
Комплексная система Jungheinrich.
У Jungheinrich есть все, что связано с литий-ионными АКБ:
аккумуляторы (1), зарядные устройства (2), техника (3) и поддержка (4).
Аренда вместо покупки.
Переоснастите Ваш парк погрузочной техники и воспользуйтесь преимуществами литий-ионных АКБ и зарядных устройств в рамках комплексной программы аренды Li-Ion Performance Rental. Это позволит снизить затраты и одновременно быстро и легко повысить производительность Ваших электроштабелеров.
Это позволит снизить затраты и одновременно быстро и легко повысить производительность Ваших электроштабелеров.
Подробнее о программе аренды литий-ионных аккумуляторов
Универсальное зарядное устройство SLH 300 позволяет легко заряжать литий-ионные и свинцово-кислотные аккумуляторы.
Новатор в сфере технологий литий-ионных АКБ.
Серийное производство готовой к эксплуатации подъемно-погрузочной техники с 2011 года.
В сфере электрической мобильности для складской логистики компания Jungheinrich уверенно завоевала лидерство и добилась непревзойденных успехов в разработке технологий для литий-ионных АКБ. Уже в 2011 году электротележка EJE 112i стала первой в своем роде моделью на литий-ионных батареях, готовой к серийному производству. С тех пор подразделение Jungheinrich Energy and Drive Systems (EDS) последовательно совершенствует эту технологию, непрерывно пополняя линейку складской техники с литий-ионными АКБ. Сегодня практически все модели техники Jungheinrich могут оснащаться литий-ионными АКБ.
Встроенный контент требует вашего подтверждения
К сожалению, содержимое этой страницы недоступно из-за ваших текущих настроек cookie.
Пожалуйста, разрешите «маркетинговые» cookie для отображения контента.
Безопасность при достижении целей — в любое время.
Литий-ионные АКБ Jungheinrich отличаются высоким уровнем безопасности.
Литий-ионные аккумуляторы Jungheinrich гарантируют безопасность работ в любых условиях. Наши АКБ изготовлены с использованием самых надежных компонентов для аккумуляторов (литий-железо-фосфат). Они нетоксичны и не выделяют вредных газов. Благодаря развитому набору функций разработанная нами система управления АКБ контролирует каждый элемент, плавно выключая АКБ при отклонениях в работе. Транспортировку и утилизацию осуществляет наша собственная сервисная служба. Это означает максимальную безопасность людей и техники.
Новый выносливый профессионал для повышения скорости обработки грузов.

ETV 216i — первый в мире штабелер с выдвижной мачтой, оборудованный литий-ионным аккумулятором.
ETV 216i — наша последняя новинка в линейке техники, оснащенной литий-ионной АКБ. Это первый в мире штабелер с выдвижной мачтой и встроенным литий-ионным аккумулятором. Благодаря высокой мощности и неизменной производительности этот выносливый профессионал заметно повысит эффективность и грузооборот Вашего склада. Революционное обновление дизайна также способствует улучшению эргономики и повышению безопасности при одновременном повышении производительности Вашего склада.
Подробнее о ETV216i
Молодой спортсмен в слаженной команде.
EFG с литий-ионным аккумулятором.
Теперь почти весь парк техники Jungheinrich готов к установке литий-ионных АКБ. В том числе наши штабелеры с противовесом EFG. Теперь они выходят на старт не только с традиционными свинцово-кислотными аккумуляторами, но и с мощными литий-ионными АКБ 80 В (500 Ач). Они долговечны, быстро заряжаются и не требуют технического обслуживания. С литий-ионным аккумулятором EFG легко справится с увеличением грузооборота и повышением энергоэффективности.
Подробнее о EFG
Максимальная производительность комплектования.
EKS с литий-ионным аккумулятором (48 В).
Все больше единиц серийной напольной подъемно-погрузочной техники оборудуется литий-ионными АКБ. Теперь вертикальные комплектовщики заказов EKS серии 3 могут оборудоваться инновационными литий-ионными АКБ 48 В, позволяющими повысить производительность, безопасность и энергоэффективность техники. Это стало возможным благодаря быстрой зарядке, отсутствию необходимости в обслуживании и очень длительному сроку службы.
Подробнее о EKS
Как увеличить пропускную способность склада?
На старт с литий-ионными аккумуляторами.
Заряженный «Нобель»
Альфред Нобель писал, что его премия должна вручаться тем, чье открытие принесло наибольшую пользу человечеству. Премия по химии 2019 года как нельзя лучше соответствует завещанию мецената. Литий-ионные аккумуляторы, созданные усилиями лауреатов — Джона Гуденафа, Стенли Виттингхэма и Акиры Ёсино — стали важнейшей частью революции в области портативной электроники. Можно быть уверенным, что у любого человека, читающего этот текст, найдется под рукой хотя бы один литий-ионный аккумулятор — питающий телефон, ноутбук, фитнес-браслет, фотоаппарат или, может, даже электромобиль. В нашем материале мы расскажем о том, как работает литий-ионный аккумулятор, в чем были сложности его создания и каково будущее этих источников питания.
Премия по химии 2019 года как нельзя лучше соответствует завещанию мецената. Литий-ионные аккумуляторы, созданные усилиями лауреатов — Джона Гуденафа, Стенли Виттингхэма и Акиры Ёсино — стали важнейшей частью революции в области портативной электроники. Можно быть уверенным, что у любого человека, читающего этот текст, найдется под рукой хотя бы один литий-ионный аккумулятор — питающий телефон, ноутбук, фитнес-браслет, фотоаппарат или, может, даже электромобиль. В нашем материале мы расскажем о том, как работает литий-ионный аккумулятор, в чем были сложности его создания и каково будущее этих источников питания.
В начале немного о самих лауреатах премии.
Джон Гуденаф (John B. Goodenough) родился в 1922 году в немецкой Йене. На момент вручения премии химику исполнилось 97 лет, что, кстати, делает его старейшим нобелевским лауреатом — на год старше Артура Эшкина, удостоившемуся премии в 96 лет. Сейчас Гуденаф — сотрудник Университета Техаса в Остине, США.
Стенли Виттингхэм (M. Stanley Whittingham) родился в 1941 году в Великобритании. В настоящее время химик работает в Университете Бингемтона, США.
Акира Ёсино (Akira Yoshino) родился в 1948 году в городе Суйта, Япония. Сегодня он является почетным сотрудником Asahi Kasei Corporation и профессором в японском Университете Мейдзо.
Ну а теперь расскажем о том, за что новоиспеченные лауреаты получили свою премию.
Если б не было гвоздя
Некоторые реакции между молекулами протекают так, что с одной молекулы на другую при этом переносится электрон — носитель элементарного заряда. К таким реакциям относятся все окислительно-восстановительные процессы в химии, от фотосинтеза до реакции щелочных металлов с водой. А как известно, движение электронов — это химический ток.
А как известно, движение электронов — это химический ток.
Если некоторым специальным образом сделать так, чтобы электрон от одной молекулы к другой молекуле переносился не напрямую, а через провод или капилляр с электропроводящим раствором, то можно попытаться заставить этот ток еще и выполнить какую-нибудь полезную работу, например зажечь лампочку.
Примерно таким способом и работают все известные химические источники тока. Например, есть известный опыт, когда в лимон втыкают цинковый и медный гвоздь. Если подключить между ними амперметр, то легко обнаружить протекающий между гвоздями ток. Взяв побольше лимонов и гвоздей, с помощью этого тока можно заставить светиться небольшой светодиод.
При этом внутри лимона происходит следующее: металлический цинк окисляется и выпускает положительно заряженные ионы цинка в лимон. Электроны при этом бегут по проводам к меди, на поверхности которой участвуют в восстановлении катионов водорода (их в лимоне очень много благодаря, в частности, лимонной кислоте) до газообразного водорода.
При этом им настолько «удобнее» протекать через провода, что они не против одновременно с этим еще и зажечь лампочку. Эта степень удобства выражается в напряжении, или, как еще говорят, разности потенциалов между двумя гвоздями, и измеряется в вольтах.
Фактически реакция, протекающая в системе в целом, выглядит так: металлический цинк реагирует с катионами водорода, отдает им электроны и сам становится положительно заряженным, а нейтральные атомы водорода объединяются по двое и всплывают в виде пузырьков газа.
Без медного гвоздя весь этот процесс шел бы только на цинке и никакого электрического тока через лампочку бы не пошло. Но появление медного гвоздя заставляет электроны нестись к нему и разделяет простую химическую реакцию на два процесса, протекающих в разных местах лимона. Цинк, на котором происходит генерация электронов за счет окисления называют анодом, а медь — катодом.
На зарядку становись
Лимонный источник тока прекратит работать, как только весь цинк из цинкового гвоздя прореагирует и растворится (лимон после этого есть, конечно, не стоит). Скорее всего, у вас не получится сделать из лимона перезаряжаемый аккумулятор.
Скорее всего, у вас не получится сделать из лимона перезаряжаемый аккумулятор.
Литий-ионные источники тока устроены так, что в них есть возможность вернуть практически весь растворенный анод. Это возможно благодаря специально подобранным материалам со строго определенными свойствами.
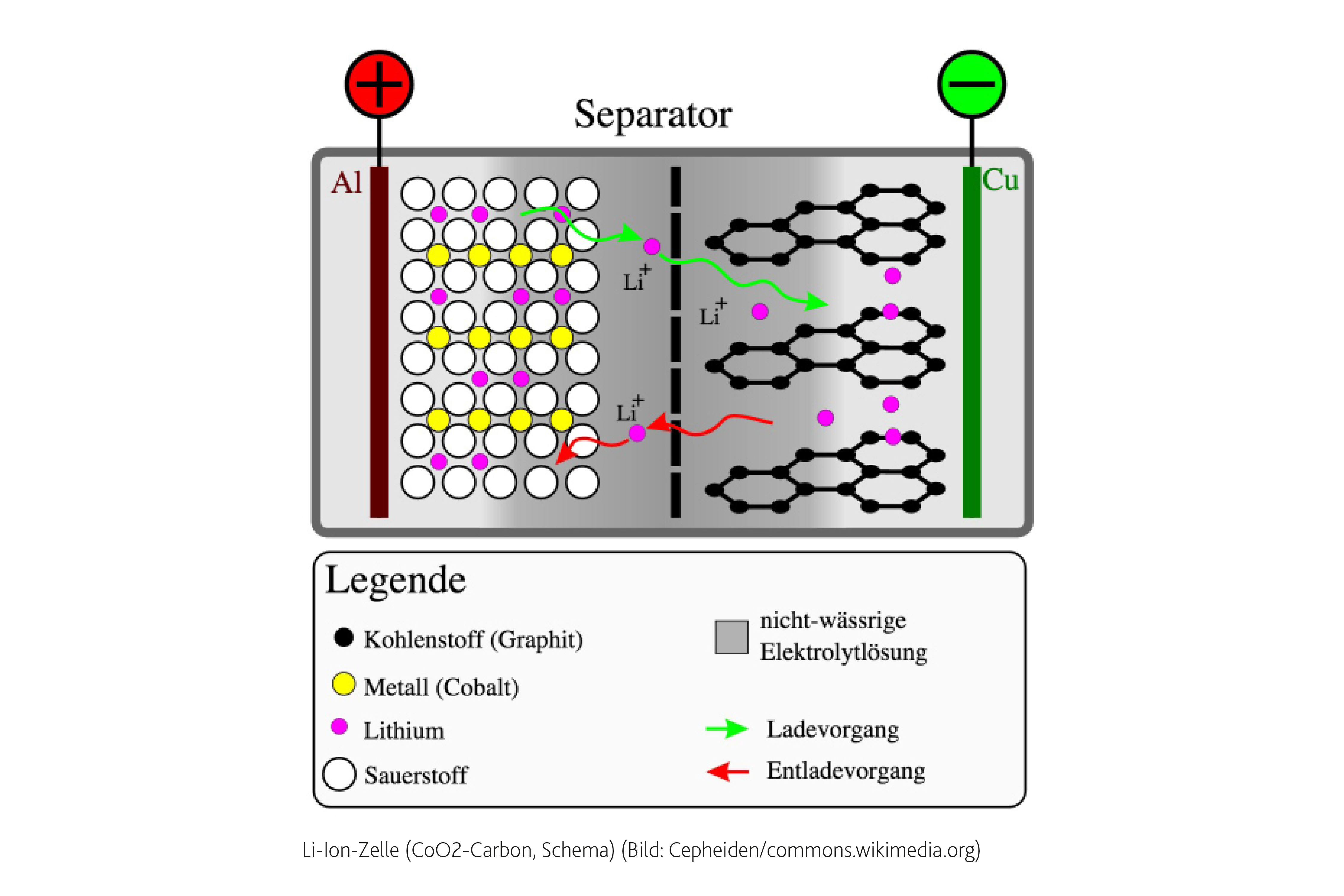
Химическая реакция, протекающая в простейшем литий-ионном аккумуляторе, при разрядке сводится к восстановлению некоторого катодного материала металлическим литием. Например, так:
Li + TiS2 = LiTiS2
Каждый атом металлического лития формально отдает по одному электрону атомам титана в сульфиде титана. Именно на такой химической реакции был построен первый простейший литий-ионный аккумулятор, созданный Виттингхэмом.
Аккумулятор состоял из анода, металлического лития, и катода — сульфида титана, разделенных мембраной. И анод и катод находились при этом в растворе электролита, проводящем электрический ток и содержащем литий.
При разрядке аккумулятора атом лития из анода теряет электрон и в форме катиона движется к катоду. Входя в сульфид титана, катион лития встраивается между его слоями. При этом атом титана получает электрон из электрической цепи, соединяющей катод и анод.
При зарядке литий ионного аккумулятора происходит обратный процесс: под действием приложенного электрического напряжения катионы лития выходят из катода и перемещаются к аноду. При этом катод теряет электроны, и они под действием приложенного напряжения движутся к аноду, соединяясь с катионами лития из катода и восстанавливая их.
Вся история развития литий-ионных аккумуляторов состояла в поиске подходящих материалов для катода, анода и электролита между ними. Дело в том, что в такой простой схеме аккумулятора был целый ряд существенных изъянов.
Во-первых, требовалось добиться того, чтобы катодный материал, в который бы входили катионы лития, мог пережить несколько циклов входа и выхода катионов из него.
Это означает, что в кристаллической решетке катодного материала должны быть достаточно большие поры, куда может войти литий. В противном случае материал «дышит» при зарядке/разрядке и растрескивается, разрушаясь и быстро ухудшая емкость аккумулятора.
В противном случае материал «дышит» при зарядке/разрядке и растрескивается, разрушаясь и быстро ухудшая емкость аккумулятора.
Во-вторых, у первых аккумуляторов была существенная проблема, связанная с тем, что литий при зарядке вместо того, чтобы равномерно покрывать анод, образует дендриты — похожие на дерево структуры из металлического лития. С каждым циклом они все ближе и ближе приближались к катоду и в какой-то момент происходило короткое замыкание. Оно могло привести к резкому разогреву, возгоранию и даже взрыву батареи.
В-третьих и далее оставался целый список требований для материалов, определявший возможную скорость зарядки аккумуляторов и другие характеристики: большое количество лития, которое они способны в себя вместить, высокая скорость, с которой литий может входить в структуру катода или анода, хорошая электропроводность, нерастворимость в электролите батареи. Да и саму батарею необходимо было собирать в таких условиях, когда в нее гарантированно не попадет вода или кислород.
Компактнее, еще компактнее
Первые существенные шаги к созданию коммерческих литий-ионных аккумуляторов сделал Стэнли Виттингхэм, работавший тогда в нефтедобывающей компании Exxon. Сам интерес к аккумуляторам был связан с опасениями того, что нефть в скором времени может закончиться и потребуются новые источники энергии.
В 1973 году Виттингхэм выяснил, что сульфид титана TiS2 может интеркалировать, то есть включать в себя, большие количества лития. Это было как раз то, что нужно для аккумуляторов.
Exxon начала разработку и выпуск аккумуляторов на основе предложенного Виттингхэмом сульфида титана — были разработаны ячейки, емкость которых достигала 45 ватт-часов. В качестве растворителя в них использовался диоксолан, а основным электролитом был перхлорат лития.
Литий-ионный аккумулятор Виттингхэма на основе металлического лития и сульфида титана
Nobelprize. org
org
Но проблему дендритов и риск возгорания решить простым путем не удалось. Постепенно аккумуляторы были сняты с производства, а разработки замедлились из-за падения цен на нефть.
В 1979-1980 годах к развитию литий-ионных аккумуляторов присоединился Джон Гуденаф, заметивший, что не обязательно использовать именно сульфидные материалы для катода. Слоистый сульфид титана химик заменил оксидом кобальта CoO2.
Этот материал в точности повторял структуру сульфида титана, он состоял из гофрированных слоев оксида кобальта, лежащих друг над другом, — в это пространство легко может входить литий, не деформируя при этом кристаллическую решетку.
Но группа Гуденафа подобрала материал, который не просто сравнялся по свойствам с сульдом титана Виттингхэма. Аккумуляторы на основе кобальтита лития выдавали примерно в два раза большее напряжение (4-5 вольт) за счет нового катодного материала, что кратно увеличило и их энергоемкость.
Литий-ионный аккумулятор Гуденафа на основе металлического лития и оксида кобальта
Nobelprize.org
Параллельно с созданием новых катодных материалов шла борьба с образованием литиевых вискеров и дендритов. Лучшим выходом оказалась замена анодного материала аккумулятора. По аналогии с катодом, анодный материал должен был интеркалировать в себя уже металлический литий, тем самым не давая ему вырастать в дендриты.
Поначалу химики использовали чистый графит — этот материал способен включить в себя один атом лития на каждые шесть атомов углерода. Избавившись от металлического лития, ученым удалось сделать аккумуляторы безопаснее, правда, ценой уменьшения их энергоемкости. Кроме того, растворители постепенно разрушали и отслаивали графит, уменьшая срок службы аккумуляторов.
Кроме того, растворители постепенно разрушали и отслаивали графит, уменьшая срок службы аккумуляторов.
Следующий шаг в 1985 году сделал Акира Ёсино, работавший в тот момент в японской Asahi Kasei Corporation. Он объединил успех Гуденафа с новым анодным материалом, предложив использовать вместо графита кокс, продукт термической обработки нефти.
Дело в том, что кокс содержит в себе сажу — аморфный углерод — и графит. Такая смесь оказалась весьма стабильной в условиях электрохимической интеркаляции лития.
Литий-ионный аккумулятор Ёсино на основе лития, интеркалированного в кокс и оксида кобальта
Nobelprize.org
Благодаря этому в 1991 году компания Sony выпустила на рынок первые коммерческие литий-ионные аккумуляторы. Их электродвижущая сила достигала 4,1 вольта, а плотность энергии была порядка 80 ватт-часов на килограмм или 200 ватт-часов на литр.
Эти величины были значительно лучше, чем у других доступных на рынке аккумуляторов. Со временем благодаря оптимизации состава электролитов емкость литий-ионных аккумуляторов возросла до 400 ватт-часов на литр — аккумуляторы стали еще компактнее.
На этом разработка материалов для литий-ионных аккумуляторов не остановилась. Например, как рассказывает профессор химического факультета МГУ и Сколтеха, член корреспондент РАН Евгений Антипов, через 17 лет после работы по кобальтитам Джон Гуденаф опубликовал статью, в которой предложил новый катодный материал на основе фосфата железа, еще более безопасный и стабильный, чем кобальтит лития, к тому же позволяющий гораздо быстрее заряжать аккумулятор.
Любопытно, что сначала звучали голоса скептиков, говоривших о том, что это интересно только для фундаментальной науки, но не для промышленности. Сейчас материал широко производится коммерчески.
Сейчас материал широко производится коммерчески.
Кроме того, такие аккумуляторы могут заряжаться и разряжаться гораздо больше раз, чем свинец-кислотные, у них срок службы выше. Есть еще целый ряд характеристик, например саморазряд и работоспособность при низких температурах, которые существенно превосходят характеристики прежних аккумуляторов.
Поэтому смартфоны, например, были бы немыслимы без литий-ионных батарей. Представьте себе, что аккумулятор в вашем телефоне весил бы не 50 граммов, а 300. Был бы он таким удобным?
Вспомним еще развитие электромобилей: в начале ХХ века было больше электромобилей, чем автомобилей с двигателями внутреннего сгорания. Первый рекорд скорости выше 100 километров в час поставил именно электромобиль. Но из-за большой массы аккумуляторов электромобили уступили обычным автомобилям.
А сейчас ситуация отыгрывается в обратную сторону. Появляются электромобили, потому что их характеристики стали привлекательными для покупателей — для нас с вами.
Евгений Антипов,
профессор химического факультета МГУ и Сколтеха, член корреспондент РАН
Химическое будущее
Сейчас химические источники тока стремительно развиваются, можно говорить о том, что литий-ионные аккумуляторы близки к своему теоретическому пределу плотности энергии.
Как рассказывает Евгений Антипов, в будущем станут гораздо более распространены индустриальные проекты, полагающиеся на литий-ионные аккумуляторы. «Вы уже через некоторое время пересядете на электромобили», — утверждает ученый.
Кроме того, солнечная и ветровая энергетика нуждаются в накопителях электроэнергии. Они необходимы для того, чтобы запасать энергию в моменты, когда ее потребление минимально и, наоборот, расходовать ее в моменты пикового потребления.
Они необходимы для того, чтобы запасать энергию в моменты, когда ее потребление минимально и, наоборот, расходовать ее в моменты пикового потребления.
Благодаря развитию технологий цена литий-ионных аккумуляторов постепенно падает и они становятся все более выгодными для этих применений.
Одно из возможных направлений развития химических источников тока — создание натрий-ионных аккумуляторов. Дело в том, что лития в земной коре содержится довольно мало, и его уже даже сравнивают по важности с нефтью. Натрия же в земной коре в 1000 раз больше, чем лития, да и выделять его гораздо проще.
Конечно, натрий-ионные аккумуляторы будут тяжелее, чем литиевые аккумуляторы, но зато они наверняка будут дешевле и доступнее литиевых. Потребность человечества в устройствах для запасания электроэнергии никуда не денется — электричество нужно всем.
Владимир Королёв
Литий-ионные аккумуляторы cat® – Пора переключиться?
Технологий литий-ионных аккумуляторов доступны в качестве опции практически на всех моделях вилочной и складской электротехники Cat®. Пока свинцово-кислотные аккумуляторы остаются довольно популярным решением среди заказчиков, и бесспорно, предлагают множество преимуществ, тем не менее, Литий-ионным решениям есть что предложить взамен.
Возможно самым заметным преимуществом перехода на Li-ion является возможность подзарядки. Вместо того, чтобы менять АКБ между сменами, Вы можете быстро подзарядить батарею во время короткого перерыва и использовать её 24/7. Вместе с другими преимуществами, такими как: эффективность, экологичность и безопасность – это делает Li-ion отличной альтернативой.
Преимущества Cat Li-ion относительно свинцово-кислотных аналогов
Литий-ионные батареи предоставляют огромные преимущества по сравнению с традиционными свинцово-кислотными аккумуляторами в части экономии электроэнергии, оборудования, персонала и сокращении простоев.
- Больший срок службы – примерно в 3-4 раза в сравнении со свинцово-кислотными – сокращают расходы на АКБ
- Повышенная эффективность – при зарядке и разрядке потери энергии ниже на 30%, поэтому снижается потребление электроэнергии.
- Более длительное время работы – благодаря более эффективной работе АКБ и использованию возможных зарядов, которые могут быть предоставлены в любое время без повреждения батареи или сокращения срока ее службы.
- Неизменно высокая производительность – с более стабильной кривой напряжения – поддерживает более высокую производительность погрузчика, даже в конце смены
- Более быстрая зарядка – обеспечивает полную зарядку всего за 1 час с помощью самых быстрых зарядных устройств
- Без замены батареи – возможность быстрой подзарядки – 15 минут заряд достаточно для нескольких часов дополнительного времени работы – обеспечение непрерывной работы с одним аккумулятором и минимизация потребности в покупке, хранении и обслуживании запасных частей.
- Без обслуживания – батарея остается на борту погрузчика во время зарядки, не нужно доливать воду или проверять уровень электролита.
- Отсутствует выделение вредных газов – и кислоты – позволяет сэкономить на месте, оборудовании и расходах по содержанию помещения для зарядки аккумуляторов и вентиляционной системы.
- Встроенная защита – интеллектуальная система управления аккумулятором (BMS) автоматически предотвращает чрезмерные значения разряда, зарядки, напряжения и температуры, а также практически исключая ошибки приложений.
В наличии есть аккумуляторы и зарядные устройства различной емкости. Ваш дилер определит лучшее сочетание исходя из Ваших задач. Уточняйте у дилера информацию о дополнительной 5-летней гарантии и условиях ежегодной проверки, которые обеспечат более комфортную эксплуатацию.
К погрузчикам Cat с опциями литий-ионного аккумулятора относятся следующие:
Электрические тележки с вилочным захватом для поддонов:
- NPP16PD
- NPV20-25N3/NPF20-25N3(R)(S)
- NPV20PD
Погрузчики-штабелеры:
Рич-траки:
Политика зарядки – Наука – Коммерсантъ
В 2019 году долгожданную Нобелевскую премию по химии получили создатели литий-ионного аккумулятора Джон Гуденаф (США), Акира Ёсино (Япония) и Стэнли Уиттингем (Великобритания). «Литий-ионные аккумуляторы произвели революционные изменения в нашей жизни с тех пор, как впервые появились на рынке в 1991 году. Они заложили основу беспроводного общества, свободного от углеводородного топлива, их появление принесло неоценимую пользу человечеству»,— объяснил решение Нобелевский комитет.
Николай Козин
Если не литий, то…
Литий-ионные аккумуляторы появились в начале 1990-х годов и очень быстро совершенствовались: росла популярность портативной электроники, сначала ноутбуков, затем смартфонов, планшетов и других гаджетов, питавшихся их энергией. Новый импульс развитию аккумуляторов дали электромобили, роботы, системы хранения и распределения электроэнергии. Но по мере развития выявились и недостатки литий-ионных батарей: пожароопасность, быстрое старение и чувствительность к температуре. Кроме того, технологии, использующие литий, упираются в серьезное ограничение: лития в природе не так много, добывать его дорого, сырье, карбонат лития, стоит свыше $20 тыс. за тонну.
Но заменить литий сложно. К примеру, удельная емкость, то есть соотношение заряда и массы иона, у него максимальная, более легкого иона металла не существует. Сообщения о перспективных материалах, способных составить конкуренцию литию, появляются регулярно, но их разработчики не скрывают проблем и ограничений, которые могут быть в принципе неразрешимы.
К примеру, команда из Стэнфорда объявила, что изобрела алюминий-ионный аккумулятор, выдерживающий 7 тыс. циклов зарядки, которая еще и происходит всего за секунды. Вообще-то алюминий-ионные аккумуляторы появились более 30 лет назад, они небезопасны, недружественны к окружающей среде и быстро теряют способность перезаряжаться. Стэнфордская батарейка вроде опровергала эту репутацию, но ученые сообщили, что носитель заряда в аккумуляторе – не трехзарядный катион алюминия Al3+ (он мог бы «нести» в три раза больше заряда, чем однозарядный лития), а комплексный ион AlCl4– — тяжелая однозарядная частица, а значит, емкость батареи невелика. А низкое напряжение на выходе батареи лишает ее возможности конкурировать с литиевой.
циклов зарядки, которая еще и происходит всего за секунды. Вообще-то алюминий-ионные аккумуляторы появились более 30 лет назад, они небезопасны, недружественны к окружающей среде и быстро теряют способность перезаряжаться. Стэнфордская батарейка вроде опровергала эту репутацию, но ученые сообщили, что носитель заряда в аккумуляторе – не трехзарядный катион алюминия Al3+ (он мог бы «нести» в три раза больше заряда, чем однозарядный лития), а комплексный ион AlCl4– — тяжелая однозарядная частица, а значит, емкость батареи невелика. А низкое напряжение на выходе батареи лишает ее возможности конкурировать с литиевой.
Группа израильского профессора Дорона Орбаха занимается магнием — металлом с зарядом +2, то есть батарейка на магнии должна иметь большую емкость, чем на однозарядном литии. Но исследователи не могут найти в пару магнию катод: стабильные и безопасные оксиды оказываются ловушками для магния, а у сульфидов, в которых скорость движения катионов магния выше, слишком низкое напряжение.
Есть надежды на проточные ванадиевые окислительно-восстановительные аккумуляторы — гигантские баки с жидким электролитом (сернокислый раствор солей ванадия), способные хранить избыточную возобновляемую энергию. Когда солнечные панели или ветрогенераторы вырабатывают электричество, насосы прокачивают электролит через электроды системы, он заряжается и возвращается обратно в емкость. В Китае собирались построить крупнейшую в мире ванадиевую проточную батарею емкостью 800 МВт•ч.
Поклонники жидких батарей упирают на их надежность: тысячи циклов зарядки, а это три-четыре года службы, без признаков деградации! Но КПД проточных аккумуляторов значительно ниже, чем металл-ионных — не более 70%. Да и система из баков с серной кислотой может быть только статичной — об электробусах и электрокарах точно можно забыть. Наконец, ванадий недешев — $50 за килограмм пятивалентного оксида.
Так что, пишут британские ученые в обзоре аккумуляторных технологий, литий-ионные аккумуляторы будут доминировать на рынке по крайней мере до середины XXI века. Ключевое достоинство лития неоспоримо — этот металл очень легкий и «быстрый», и миниатюрные батареи для смартфонов, ноутбуков и других гаджетов уже прочно закреплены за ним. Но уже для электромобиля (десятки киловатт-часов энергии) и тем более для электростанции (мега- и гигаватт-часы) удельная и объемная энергоемкость (энергия на единицу массы и объема) становятся не так важны, и прорыв могут обеспечить натрий-ионные аккумуляторы, заменив сразу и дорогие литий-ионные, и морально устаревшие свинцово-кислотные.
Ключевое достоинство лития неоспоримо — этот металл очень легкий и «быстрый», и миниатюрные батареи для смартфонов, ноутбуков и других гаджетов уже прочно закреплены за ним. Но уже для электромобиля (десятки киловатт-часов энергии) и тем более для электростанции (мега- и гигаватт-часы) удельная и объемная энергоемкость (энергия на единицу массы и объема) становятся не так важны, и прорыв могут обеспечить натрий-ионные аккумуляторы, заменив сразу и дорогие литий-ионные, и морально устаревшие свинцово-кислотные.
Сравнение натрий-ионного и свинцового аккумулятора по основным параметрам
…натрий!
Свинцово-кислотные аккумуляторы изобретены 150 лет назад и знакомы любому, кто хотя бы раз открыл капот машины,— но продажи их по-прежнему опережают продажи литий-ионных батарей: $40 млрд против $30 млрд в 2019 году.
Натриевый аккумулятор имеет близкие к литиевому энергетические характеристики, но натрий примерно в сто раз дешевле лития, а химические свойства натрия позволяют использовать легкий и дешевый алюминий вместо тяжелой и дорогой меди на анодном токосъемнике. Есть и минусы: радиус иона натрия больше, чем иона лития, и значит, плотность энергии на натриевом электроде ниже, и для энергоемкости, сравнимой с литий-ионной батареей, натрий-ионная должна быть размером на 30–50% больше. Но там, где размер не так важен, натрий-ионные батареи будут теснить свинцово-кислотные и захватывать новые ниши, предсказывают специалисты,— например, электротранспорт, для которого важней скорость зарядки, чем миниатюрность и емкость.
«Поиск нового материала для электрохимических приложений по большей части выглядит как эмпирические предположения ученых — они отмечают интересные свойства в соединениях сходного состава и структуры и пытаются получить новые, улучшенные материалы. Специалисты химического факультета МГУ обнаружили интересную структуру, ранее описанную только для крупных щелочных катионов — калия, рубидия, цезия,— и попробовали синтезировать новое соединение с натрием с целью проверить его электрохимические свойства. Они оказались уникальными»,— рассказал декан факультета, член-корреспондент РАН Степан Калмыков.
Сотрудники кафедры электрохимии МГУ под руководством старшего научного сотрудника, кандидата химических наук Олега Дрожжина впервые синтезировали и охарактеризовали электрохимические свойства натрий-ванадиевого пирофосфата β-NaVP2O7. Энергоемкость его достигает 420 Вт•ч/кг, всего на 20% меньше, чем у литиевого катодного материала LiCoO2 — 530 Вт•ч/кг. Другая важная характеристика этого электродного материала — крайне малое, всего полпроцента, изменение объема при зарядке-разрядке. Схожими свойствами обладает разве что литий-титановая шпинель, самый стабильный, мощный и безопасный анодный материал, работающий в электротранспорте.
Схема натрий-ионного аккумулятора
«Изменение объема при зарядке-разрядке напрямую влияет на такой важный показатель, как потеря емкости со временем. Чем меньше меняется объем материала, тем дольше он сможет стабильно работать. Множество соединений так и не нашли применение в аккумуляторах из-за значительного изменения в объеме»,— объясняет Олег Дрожжин.
Электрохимики получили материал, каркас которого может обратимо отдавать и внедрять до двух катионов натрия на одну элементарную ячейку, от состава VP2O7 до Na2VP2O7. Суммарная емкость такого циклирования — около 220 мАч/г, рекорд для подобных материалов. Ученые из МГУ планируют модифицировать электрохимические свойства соединения за счет изменения начальной степени окисления ванадия и частичного замещения его на другие катионы, в том числе и для снижения стоимости электродных материалов. Работа специалистов поддержана грантом Российского научного фонда.
Как работает литий-ионный аккумулятор?
Литий-ионные батареи чрезвычайно популярны и универсальны. Эти перезаряжаемые батареи, которые используются в сотовых телефонах, автомобилях, электроинструментах и некоторых других типах электронных устройств, также оказывают влияние на оборудование для погрузочно-разгрузочных работ и наземного обслуживания аэропортов.
Технология, лежащая в основе литий-ионных аккумуляторов, делает их отличным выбором из-за их явных преимуществ и экологических преимуществ.
Но как именно работают литий-ионные аккумуляторы? И что делает их такими популярными во многих приложениях?
Вот что вам нужно знать о компонентах, из которых состоит литий-ионный аккумулятор, и о том, как они работают вместе для создания высокоэффективных и долговечных источников энергии.
Компоненты
Литий-ионные батареи
доступны во многих различных формах и размерах. Однако внутри они обычно выглядят одинаково. Чтобы понять, как работает литий-ионный аккумулятор, важно знать роль, которую играют отдельные части.
Ячейка
Литий-ионный аккумулятор состоит из нескольких частей. Элемент, служащий рабочей лошадкой для батареи, является наиболее важным компонентом батареи.
Элемент состоит из следующих материалов батареи:
- Электроды – это два конца батареи. Один – анод, другой – катод.
- Анод накапливает литий и обычно изготавливается из углерода.
- Катод также хранит литий и сделан из химического соединения, которое представляет собой оксид металла.
- Сепаратор блокирует поток отрицательных и положительных электронов внутри батареи, но позволяет ионам проходить через нее.
- Электролит , жидкость находится между двумя электродами. Он переносит положительно заряженные ионы лития от анода к катоду и наоборот, в зависимости от того, заряжается батарея или разряжается.
Аккумулятор
Батарейный блок, в котором находятся литий-ионные элементы, работает как компьютер. Он содержит следующее:
- Как минимум один датчик температуры для контроля температуры батареи.
- Преобразователь напряжения и схема регулятора , которая фокусируется на поддержании напряжения и тока на безопасных уровнях.

- Разъем евро, который позволяет питанию и информации поступать в аккумуляторную батарею и извлекаться из нее.
- Элемент отвод , который контролирует напряжения элементов в аккумуляторной батарее.
- Система мониторинга батареи , небольшой компьютер, который контролирует всю батарею и обеспечивает безопасность пользователя.
Движение в камере
Так как же ячейка обеспечивает питание оборудования?
Когда вы подключаете литий-ионную батарею к устройству или части оборудования, положительно заряженные ионы перемещаются от анода к катоду.В результате катод становится более положительно заряженным, чем анод. Это, в свою очередь, притягивает к катоду отрицательно заряженные электроны.
Сепаратор в ячейке включает электролиты, которые образуют катализатор. Это способствует перемещению ионов между ними. Движение ионов через раствор электролита – это то, что заставляет электроны перемещаться через устройство, в которое вставлен аккумулятор.
Литий-ионные аккумуляторы. При перезарядке ионы лития проходят тот же процесс, но в противоположном направлении.Это восстанавливает аккумулятор для дополнительного использования.
Общая конструкция литий-ионной батареи обеспечивает множество преимуществ для пользователей оборудования:
- Время работы значительно увеличивается с их использованием по сравнению с батареями других типов.
- Возможности быстрой зарядки сокращают время простоя сменных рабочих и повышают производительность.
- Они имеют плоские кривые разряда и обеспечивают более высокую постоянную мощность. Это означает, что больше не будет раздражающей медлительности в работе оборудования при снижении уровня заряда аккумулятора.
Система управления батареями (BMS)
Система управления играет важную роль в обеспечении максимальной работы аккумуляторной батареи. Это также влияет на работу аккумулятора, предлагая несколько защит и функций.
Это также влияет на работу аккумулятора, предлагая несколько защит и функций.
Например:
- BMS поддерживает температуру элементов в идеальном рабочем диапазоне для предотвращения перегрева или замерзания.
- BMS контролирует ток и напряжение, чтобы поддерживать их на безопасном уровне.Дендриты начинают формироваться в ячейке, если напряжение падает слишком низко, что может привести к короткому замыканию ячейки, поэтому важно, чтобы литий-ионный аккумулятор имел систему, позволяющую контролировать это.
- В аккумуляторе нет встроенной «памяти», поэтому частичные разряды не повреждают аккумулятор. Литий-ионные аккумуляторы могут заряжаться и разряжаться в наиболее удобное для оператора оборудования время.
- Встроенные контроллеры предотвращают перезарядку, чтобы предотвратить образование, которое может привести к значительному повреждению литий-ионных аккумуляторов.
- Балансировка ячеек контролируется, поэтому выравнивающие заряды не нужны. Поскольку литий-ионные батареи не нуждаются в уравнительном заряде, они не выделяют опасные газы.
- Система управления батареями также позволяет менеджерам отслеживать состояние батареи своего флота с помощью бортовых компьютеров, которые отправляют жизненно важные данные через облачные сервисы.
Литий-ионные батареи содержат несколько элементов передовых технологий, которые работают вместе, чтобы обеспечить пользователям явные преимущества.
Вы можете узнать о том, почему литий-ионные батареи являются лучшим вариантом, чем свинцово-кислотные, в нашей статье Литий-ионные батареи для вилочных погрузчиков лучше, чем свинцово-кислотные?
Как работает литий-ионный аккумулятор?
Представьте себе мир без литий-ионных батарей (часто называемых литий-ионными батареями или LIBs ). Нужна помощь? Мобильные устройства не будут выглядеть так, как сейчас. Представьте себе огромные, тяжелые сотовые телефоны и ноутбуки.Также представьте, что обе эти вещи настолько дороги, что их могут себе позволить только очень богатые люди. Вы представляете 1980-е. Страшно, правда?
Представьте себе огромные, тяжелые сотовые телефоны и ноутбуки.Также представьте, что обе эти вещи настолько дороги, что их могут себе позволить только очень богатые люди. Вы представляете 1980-е. Страшно, правда?
Литий-ионные батареиЗнаете ли вы?
Литий-ионные батареи были впервые произведены и произведены компанией SONY в 1991 году.
стали огромной частью нашей мобильной культуры. Они обеспечивают питание большей части технологий, которые использует наше общество.
Что входит в состав литий-ионного аккумулятора?
Батарея состоит из нескольких отдельных ячеек , которые соединены друг с другом.Каждая ячейка содержит три основные части: положительный электрод , (катод , ), отрицательный электрод (анод , ) и жидкий электролит , .
Части литий-ионной батареи (© Let’s Talk Science, 2019 г., на основе изображения ser_igor с iStockphoto).Литий-ионные батареи, подобно сухим щелочным батареям, используемым в часах и пультах дистанционного управления от телевизора, обеспечивают питание за счет движения ионов. Литий в своей элементарной форме чрезвычайно реактивен.Вот почему в литий-ионных батареях не используется элементарный литий. Вместо этого литий-ионные батареи обычно содержат оксид лития-металла, такой как оксид лития-кобальта (LiCoO 2 ). Это поставляет литий-ионы. В катоде используются оксиды лития-металла, а в аноде – литий-углеродные соединения. Эти материалы используются, потому что они допускают интеркаляцию. Интеркаляция означает, что молекулы могут что-то в них вставлять. В этом случае электроды могут легко перемещать ионы лития в свою структуру и выходить из нее.
Каков химический состав литий-ионных батарей?
Внутри литий-ионного аккумулятора протекают окислительно-восстановительные реакции.
Восстановление происходит на катоде. Здесь оксид кобальта соединяется с ионами лития с образованием оксида лития-кобальта (LiCoO 2 ). Половина реакции:
Половина реакции:
CoO 2 + Li + + e – → LiCoO 2
Окисление происходит на аноде.Здесь соединение интеркаляции графита LiC 6 образует графит (C 6 ) и ионы лития. Половина реакции:
LiC 6 → C 6 + Li + + e –
Вот полная реакция (слева направо = разрядка, справа налево = зарядка):
LiC 6 + CoO 2 ⇄ C 6 + LiCoO 2
Как работает подзарядка литий-ионного аккумулятора?
Когда литий-ионный аккумулятор в мобильном телефоне питает его, положительно заряженные ионы лития (Li +) перемещаются от отрицательного анода к положительному катоду.Они делают это, перемещаясь через электролит, пока не достигнут положительного электрода. Там они хранятся. С другой стороны, электроны движутся от анода к катоду.
Что происходит в литий-ионной батарее при разряде (© Let’s Talk Science, 2019 г., на основе изображения ser_igor с iStockphoto). Иллюстрация – текстовая версияКогда батарея используется, ионы лития текут от анода к катоду, а электроны движутся от катода к аноду.
Когда вы заряжаете литий-ионный аккумулятор, происходит прямо противоположный процесс. Ионы лития возвращаются от катода к аноду. Электроны движутся от анода к катоду.
Что происходит с литий-ионным аккумулятором при зарядке (© Let’s Talk Science, 2019 г., на основе изображения ser_igor с iStockphoto). Иллюстрация – текстовая версияКогда батарея заряжается, ионы лития текут от катода к аноду, а электроны движутся от анода к катоду.
Пока ионы лития переходят от одного электрода к другому, существует постоянный поток электронов. Это дает энергию для работы вашего устройства. Поскольку этот цикл может повторяться сотни раз, этот тип батареи перезаряжаемый .
Знаете ли вы?
Иногда литий-ионные батареи называют «батареями для кресел-качалок».
Это потому, что ионы лития «качаются» между электродами.
Что делает литий-ионные аккумуляторы подходящими для мобильных технологий?
Все просто. Литий-ионные батареи имеют наивысшую плотность заряда среди всех сопоставимых систем. Это означает, что они могут дать вам массу энергии, не будучи очень тяжелыми.
Это по двум причинам. Во-первых, литий – это самый электроположительный элемент . Электроположительность – это мера того, насколько легко элемент может отдавать электроны для образования положительных ионов. Другими словами, это показатель того, насколько легко элемент может производить энергию.Литий очень легко теряет электроны. Это означает, что он может легко производить много энергии.
Литий также самый легкий из всех металлов. Как вы узнали, в качестве электродов в литий-ионных батареях используются интеркаляционные материалы, а не настоящий металлический литий. Тем не менее, эти батареи весят намного меньше, чем батареи других типов, в которых используются такие металлы, как свинец или никель.
Есть ли риски при использовании литий-ионных батарей?
Хотя эти батареи впечатляют, у них есть свои недостатки.Самая большая жалоба заключается в том, что они довольно быстро изнашиваются, независимо от того, используете вы их или нет. Обычный литий-ионный аккумулятор прослужит около 2–3 лет, прежде чем его потребуется заменить. Это может обойтись дорого! Производство и утилизация литий-ионных батарей также оказывает большое влияние на окружающую среду, поэтому чем дольше эти батареи могут прослужить, тем лучше.
Как вы узнали, литий чрезвычайно реактивен. Когда производители производят литий-ионные батареи, они должны принимать определенные меры предосторожности, чтобы их можно было безопасно использовать.Однако вы, возможно, слышали о некоторых электронных устройствах, таких как ноутбуки или сотовые телефоны, которые загорелись из-за своих батарей. Хотя это может быть хорошим предлогом для того, чтобы не сдать эссе на английском вовремя, это довольно опасная ситуация. По соображениям безопасности литий-ионные батареи включают сепаратор. Это предотвращает соприкосновение электродов элементов батареи друг с другом. Но если этот разделитель будет порван или поврежден, электроды могут соприкоснуться. Это может вызвать сильное перегревание. Если это нагревание вызывает искру, легко воспламеняющийся электролит может загореться.
Хотя это может быть хорошим предлогом для того, чтобы не сдать эссе на английском вовремя, это довольно опасная ситуация. По соображениям безопасности литий-ионные батареи включают сепаратор. Это предотвращает соприкосновение электродов элементов батареи друг с другом. Но если этот разделитель будет порван или поврежден, электроды могут соприкоснуться. Это может вызвать сильное перегревание. Если это нагревание вызывает искру, легко воспламеняющийся электролит может загореться.
Как только в одной камере возникает пламя, оно может быстро распространиться на другие. И прежде чем вы это заметите, ваш ноутбук представляет собой лужу расплавленного пластика. Накопление тепла также может вызвать очень быстрое повышение давления в вашем ноутбуке и БУМ!
Посмотрите, что происходит при коротком замыкании литий-ионного аккумулятора (1:13 мин.).Однако не стоит особо волноваться. Эти события очень редки. На самом деле литий-ионные батареи очень безопасны. Кроме того, прямо сейчас проводится множество исследований по улучшению каждой части этих батарей.Например, исследователи создали жидкий электролит, который при ударе превращается в твердое тело. Это поможет предохранить батареи от нагрева или возгорания в случае их повреждения! Вскоре литий-ионные батареи, вероятно, станут еще безопаснее, прослужат дольше и будут стоить еще дешевле.
Знаете ли вы?
Большинство электромобилей работают на литий-ионных батареях. Мы начинаем видеть все больше и больше автомобилей, которые подключаются к сети вместо того, чтобы заправляться бензином!
Как работают литий-ионные батареи?
Как работают батареи Батареи – это устройства, преобразующие химическую энергию в электрическую.Перезаряжаемые батареи, также известные как аккумуляторы, могут принимать и накапливать электрическую энергию и выделять ее при необходимости. Это означает, что их можно разряжать и снова заряжать обратимым процессом. Одноразовые электрические батареи поставляют электричество Форму энергии, возникающую в результате движения заряженных частиц (электронов) по проводнику …
к внешней цепи, пока они не разрядятся.
Одноразовые электрические батареи поставляют электричество Форму энергии, возникающую в результате движения заряженных частиц (электронов) по проводнику …
к внешней цепи, пока они не разрядятся.
Литий-ионные батареи могут хранить в три-четыре раза больше энергии на единицу массы, чем батареи, использующие другие технологии
Батареи содержат два электрода, погруженные в электролит – проводящую жидкость или твердое тело – и соединенные за пределами электролита проводящим проводом.При разряде отрицательный электрод (анод) высвобождает электроны, которые движутся по проводу и поглощаются положительным электродом (катодом). Это движение электронов создает электрический ток, который затем может быть преобразован в энергию. В физике мощность – это количество энергии, поставляемой системой в единицу времени. Проще говоря, мощность можно рассматривать как выход энергии … двигатель или электронное устройство. Чтобы уравновесить электрон, Материя состоит из атомов. Атом состоит из ядра, состоящего из протонов (положительно заряженных частиц) и нейтронов (нейтральный заряд)… обмена положительные ионы проходят через электролит между двумя электродами. Когда аккумулятор снова заряжается от внешнего источника электричества, этот процесс меняется на противоположный.
Различные типы аккумуляторных батарей В аккумуляторных батареяхиспользуются комбинации материалов, которые могут легко и надолго обмениваться электронами и положительными ионами. В автомобилях с двигателями внутреннего сгорания чаще всего используются свинцово-кислотные аккумуляторы, которые содержат отрицательный электрод из свинца, положительный электрод из оксида свинца и электролит, состоящий из серной кислоты и воды.Другие материалы, используемые в батареях, включают никель, кадмий, натрий и серу 1 .
Ученые особенно заинтересовались литием для батарей, поскольку это очень легкий металл (третий элемент в периодической таблице после водорода. Самый простой и легкий атом, самый распространенный элемент во Вселенной.
и гелий). Атомы лития могут легко высвободить один из своих трех электронов, создавая положительно заряженные ионы Li +. Изначально производители использовали металлический литий для отрицательного электрода, который излучает электроны.Однако они заметили, что повторяющиеся циклы использования и перезарядки изменили металл. Чтобы избежать этого, катоды в настоящее время часто изготавливают из оксида кобальта и небольшого количества лития с графитовым анодом. Электролит состоит из солей лития в растворителе, а это означает, что он содержит очень много ионов лития. Отсюда и название «литий-ионный аккумулятор».
Самый простой и легкий атом, самый распространенный элемент во Вселенной.
и гелий). Атомы лития могут легко высвободить один из своих трех электронов, создавая положительно заряженные ионы Li +. Изначально производители использовали металлический литий для отрицательного электрода, который излучает электроны.Однако они заметили, что повторяющиеся циклы использования и перезарядки изменили металл. Чтобы избежать этого, катоды в настоящее время часто изготавливают из оксида кобальта и небольшого количества лития с графитовым анодом. Электролит состоит из солей лития в растворителе, а это означает, что он содержит очень много ионов лития. Отсюда и название «литий-ионный аккумулятор».
Основным компонентом литий-ионной батареи является элемент, который немного похож на слоеное тесто, с алюминиевой пластиной для сбора тока, за которой следуют катод, электролит, анод и, наконец, медная пластина (см. Диаграмму) .
Когда батарея заряжается, ионы лития Li + покидают положительный электрод (катод) и накапливаются в отрицательном электроде (аноде). Когда он разряжается для образования электрического тока, ионы Li + движутся в противоположном направлении 2 .
Эти элементы, каждая из которых имеет напряжение в несколько вольт, могут быть сгруппированы вместе в различное количество, в зависимости от емкости, необходимой для питания сотового телефона или автомобильного аккумулятора.
Преимущества и недостатки Литий-ионные батареи имеют высокую плотность энергии Количество энергии, запасенной в объекте, выраженное в ватт-часах на килограмм (1 Втч / кг = 3.6 кДж / кг) …
Это означает, что они могут хранить в три-четыре раза больше энергии на единицу массы, чем батареи, использующие другие технологии. Они быстро перезаряжаются и могут использоваться снова и снова, выполнив не менее 500 циклов разрядки / зарядки на 100%.
Однако они подвержены риску внезапного возгорания и выделения токсичных газов из-за перегрева электролита выше 100 ° C, известного как тепловой разгон. Это привело к тому, что в последние годы производители отозвали тысячи сотовых телефонов и планшетов.В 2013 году в самолете Boeing 787 после приземления загорелась батарея.
Исследования показали, что перегрев чаще всего вызывается коротким замыканием, вызванным неправильной сборкой или ударами. В результате от производителей теперь требуется строгое соблюдение процессов и установка литий-ионных батарей, которые они производят, с электронной системой управления батареями (BMS), которая отключает питание при обнаружении аномалии.
Кроме того, производители изучают инновационные технологии, которые могут помочь предотвратить перегрев, например твердые электролиты из ультратонких полимерных пленок.
На рынке аккумуляторов доминируют азиатские компании, что можно рассматривать как геополитический риск, учитывая стратегическое значение этого оборудования для мировой экономики. Еще одна проблема – крайне неравномерное распределение ресурсов лития по всему миру, что может привести к экологическим осложнениям при их добыче. См. Отчет по редким металлам.
(1) Сравнение батарей – Lycée Eiffel (на французском языке)
(2) Посмотреть анимацию BASF
Как работают литий-ионные аккумуляторы?
Трое исследователей, которые разработали технологию, лежащую в основе эпохи смартфонов – и связанных с ней социальных преобразований, – получили Нобелевскую премию по химии 2019 года.Работы Джона Б. Гуденафа, Стэнли Уиттингема и Акиры Йошино сделали решающие шаги в разработке литий-ионных аккумуляторов, которые накапливают большое количество энергии в небольших аккумуляторных элементах и быстро и легко перезаряжаются.
Впервые проданные Sony в 1991 году для своих видеокамер, эти типы батарей подходят не только для портативной бытовой электроники. Они находятся в центре двух других технологических революций, способных преобразовать общество: переход от двигателей внутреннего сгорания к электромобилям и переход от электросети, работающей на ископаемом топливе, к генераторам возобновляемой энергии, которые хранят излишки электроэнергии в батареях для будущее использование.
Они находятся в центре двух других технологических революций, способных преобразовать общество: переход от двигателей внутреннего сгорания к электромобилям и переход от электросети, работающей на ископаемом топливе, к генераторам возобновляемой энергии, которые хранят излишки электроэнергии в батареях для будущее использование.
Так как же работают эти батарейки? Ученые и инженеры всю свою карьеру пытались создать батареи лучшего качества, но до сих пор остаются загадки, которые мы не до конца понимаем. Улучшение аккумуляторов требует от химиков и физиков изучения изменений на атомном уровне, а также от инженеров-механиков и электриков, которые могут спроектировать и собрать аккумуляторные блоки, питающие устройства. Как специалист по материалам Вашингтонского университета и Тихоокеанской северо-западной национальной лаборатории, моя работа помогла исследовать новые материалы для литий-воздушных батарей, магниевых батарей и, конечно же, литий-ионных батарей.
Рассмотрим день из жизни двух электронов. Назовем одного из них Алексом, и у него есть друг по имени Джордж.
Анатомия батареи
Как выглядит стандартная щелочная батарейка AA внутри. Ведущий / Wikimedia CommonsAlex живет внутри стандартной щелочной батарейки AA, как в вашем фонарике или пульте дистанционного управления. Внутри батареи AA есть отсек, заполненный цинком, а другой – оксидом марганца.С одной стороны, цинк слабо держится на электронах, как Алекс. С другой стороны, оксид марганца сильно притягивает электроны к себе. Между тем, чтобы электроны не переходили прямо с одной стороны на другую, находится лист бумаги, пропитанный раствором калия и воды, которые сосуществуют как положительные ионы калия и отрицательные ионы гидроксида.
Когда аккумулятор вставляется в устройство и включается, внутренняя цепь устройства замыкается. Алекс вытаскивается из цинка через цепь в оксид марганца.По пути его движение приводит в действие устройство, лампочку или что-то еще, подключенное к батарее. Когда Алекс уходит, он не может вернуться: цинк, который потерял электронную связь с гидроксидом, образует оксид цинка. Это соединение чрезвычайно стабильно и не может быть легко превращено обратно в цинк.
На другой стороне батареи оксид марганца получает атом кислорода из воды и оставляет ионы гидроксида, чтобы уравновесить гидроксид, потребляемый цинком. После того, как все соседи Алекса оставили цинк и перешли на оксид марганца, батарея разряжена и ее необходимо утилизировать.
Литий-ионные преимущества
Давайте сравним это с Джорджем, который живет в литий-ионной батарее. Литий-ионные батареи имеют те же основные строительные блоки, что и щелочные элементы AA, с некоторыми отличиями, которые дают основные преимущества.
Джордж живет в графите, который даже слабее цинка удерживает электроны. А другая часть его батареи – это оксид лития-кобальта, который притягивает электроны гораздо сильнее, чем оксид марганца, что дает его батарее возможность хранить гораздо больше энергии в том же объеме пространства, чем щелочная батарея.Раствор, разделяющий графит и оксид лития-кобальта, содержит положительно заряженные ионы лития, которые легко образуют и разрывают химические связи, когда батарея разряжается и заряжается.
Когда электроны выходят за пределы батареи, ионы лития перемещаются внутри нее, чтобы поддерживать электрическое равновесие. Ислам и Фишер, Обзоры химического общества, 2014 г., CC BYЭти химические реакции обратимы, в отличие от образования оксида цинка, который позволяет электронам и ионам лития перемещаться вперед и назад в течение многих циклов зарядки и разрядки.
Однако этот процесс не является эффективным на 100% – все батареи со временем теряют способность удерживать энергию. Тем не менее, семейство литий-ионных химических элементов оказалось достаточно мощным, чтобы сегодня доминировать в аккумуляторной технологии.
Примечание редактора: это обновленная версия статьи, первоначально опубликованной 15 июля 2019 года.
[ Спасибо за прочтение! Мы можем отправлять вам рассказы The Conversation каждый день в информативном электронном письме. Зарегистрироваться Сегодня. ]
литий-ионных батарей (LI-ION) | Ассоциация накопителей энергии
После того, как химик Exxon Стэнли Уиттингем разработал концепцию литий-ионные батареи в 1970-х годах Sony и Asahi Kasei создали Первый коммерческий продукт в 1991 году.Первые батареи использовались для бытовой электроники и теперь, опираясь на успех этих литий-ионных батарей, многие компании разрабатывают элементы большего формата для использования в приложения для хранения энергии. Многие также ожидают значительных синергия с появлением электромобилей (EV) на базе Литий-ионные аккумуляторы. Гибкость литий-ионной технологии в электромобилях приложений, от небольших мощных батарей для буферизации мощности в гибриды, аккумуляторы средней мощности, обеспечивающие запас хода только на электричестве и буферизация мощности в подключаемых гибридах, к высокоэнергетическим батареям в только электромобили, имеют аналогичное значение для стационарных накопителей энергии.
Литий-ионные аккумуляторыбыли развернуты в широком диапазоне приложения для хранения энергии, начиная от аккумуляторных батарей нескольких киловатт-часов в жилых системах с солнечными батареями на крыше к многомегаваттным контейнерным батареям для обеспечения сети дополнительные услуги.
Как работают литий-ионные батареи
Термин «литий-ионный» не относится к одной электрохимической паре. но с широким спектром различных химикатов, все из которых характеризуется переносом ионов лития между электродами во время реакций заряда и разряда.Литий-ионные элементы не содержат металлический литий; скорее, ионы вставлены в структуру другие материалы, такие как литированные оксиды металлов или фосфаты в положительный электрод (катод) и углерод (обычно графит) или литий титанат в минусе (анод).
Термин «литиевый полимер» (или, точнее, литий-ионный полимер) относится к литий-ионной конструкции, в которой электроды соединены вместе посредством пористая полимерная матрица. Жидкий электролит вливается в пористую матрица и становится иммобилизованной, позволяя пакетам электродов быть собран в «мешочки» из фольги, которые обеспечивают геометрическую гибкость и улучшенная плотность энергии по сравнению с цилиндрическими ячейками.Однако такие преимущества менее значительны, поскольку ячейки увеличиваются до более крупных мощности.
Обратите внимание, что в металлический литиевый отрицательный элемент выполнен из проводящего полимера сделать твердотельную аккумуляторную систему. Такие технологии не падают под зонтиком Li-ion и еще не были успешно развернуты в приложения для хранения энергии.
Технологии с позитивами из литированного оксида металла и углерода негативы имеют высокое напряжение ячеек (обычно 3.От 6 В до 3,7 В) и соответственно высокая плотность энергии. Эти технологии получили широкое распространение отличающиеся характеристики жизни и безопасности. Ячейки с положительными материалами на основе фосфата лития и железа по своей природе более безопасны, чем их металлические оксидные / углеродные аналоги, но напряжение ниже (около 3,2 В), как и плотность энергии. Конструкции с позитивами из литированного оксида металла и негативы титаната лития имеют самое низкое напряжение (около 2,5 В) и низкая плотность энергии, но гораздо более высокая мощность и безопасность преимущества.
Литий-ионные элементымогут изготавливаться цилиндрическими или призматическими. (прямоугольный) формат. Эти ячейки обычно встраиваются в многоячеечные модули в последовательных и / или параллельных массивах, и модули соединены вместе, чтобы сформировать батарею с требуемым напряжением, при этом каждая струна контролируется системой управления батареями. Электронные подсистемы – важная особенность литий-ионных аккумуляторов, которым не хватает возможностей водных технологий (например, свинцово-кислотных батареи) для рассеивания избыточной энергии.Характеристики безопасности Литий-ионные аккумуляторы в конечном итоге определяются характеристиками системы. конструкция, включая механические и тепловые характеристики, электроника и коммуникации, и алгоритмы управления – независимо от электрохимия.
Как мы доберемся до следующего большого прорыва в области аккумуляторных батарей – Quartz
Вы читаете эксклюзивную статью Quartz, доступную всем читателям в течение ограниченного времени. Чтобы разблокировать доступ ко всем Quartz, станьте участником.
Электрические самолеты могут быть будущим авиации.Теоретически они будут намного тише, дешевле и чище, чем те самолеты, которые есть у нас сегодня. Электрические самолеты с дальностью полета 1000 км (620 миль) на одной зарядке могут использоваться сегодня для половины всех рейсов коммерческих самолетов, сокращая глобальные выбросы углерода в авиации примерно на 15%.
То же самое и с электромобилями. Электромобиль – это не просто более чистая версия своего кузена, извергающего загрязнения. По сути, это лучший автомобиль: его электродвигатель мало шумит и молниеносно реагирует на решения водителя.Зарядка электромобиля обходится намного дешевле, чем оплата эквивалентного количества бензина. Электромобили могут быть построены с небольшим количеством движущихся частей, что удешевляет их обслуживание.
Так почему же электромобили уже не повсюду? Это связано с тем, что батареи дороги, поэтому первоначальная стоимость электромобиля намного выше, чем стоимость аналогичной модели с бензиновым двигателем. И если вы не водите много, экономия на бензине не всегда компенсирует более высокие первоначальные затраты. Короче говоря, электромобили по-прежнему не экономичны.
Точно так же современные батареи не обладают достаточной энергией по весу или объему для питания пассажирских самолетов. Нам все еще нужны фундаментальные прорывы в аккумуляторных технологиях, прежде чем это станет реальностью.
Портативные устройства с батарейным питанием изменили нашу жизнь. Но есть еще много вещей, которые могут вывести из строя батареи, если бы только более безопасные, более мощные и энергоемкие батареи могли быть сделаны дешево. Никакой закон физики не исключает их существования.
И все же, несмотря на более чем два столетия тщательного изучения с момента изобретения первой батареи в 1799 году, ученые до сих пор не до конца понимают многие основы того, что именно происходит внутри этих устройств.Что мы действительно знаем, так это то, что, по сути, есть три проблемы, которые необходимо решить, чтобы батареи снова действительно изменили нашу жизнь: мощность, энергия и безопасность.
Не существует универсальной литий-ионной батареи
Каждая батарея имеет два электрода: катод и анод. Большинство анодов литий-ионных батарей изготовлено из графита, но катоды изготавливаются из различных материалов, в зависимости от того, для чего будет использоваться батарея. Ниже вы можете увидеть, как различные материалы катода меняют работу типов батарей по шести параметрам.
Проблема питания
В просторечии люди используют термины «энергия» и «мощность» как синонимы, но при разговоре об аккумуляторах важно различать их. Мощность – это скорость, с которой может высвобождаться энергия.
Батарея, достаточно мощная для запуска и удержания в воздухе коммерческого реактивного самолета на расстояние 1000 км, требует большого количества энергии, чтобы высвободиться за очень короткое время, особенно во время взлета. Так что дело не только в накоплении большого количества энергии, но и в способности очень быстро извлекать эту энергию.
Решение проблемы энергоснабжения требует от нас заглянуть в черный ящик коммерческих аккумуляторов. Будет немного занудно, но терпи меня. Новые аккумуляторные технологии часто преувеличиваются, потому что большинство людей не уделяют должного внимания деталям.
Самая современная химия батарей, которая у нас есть, – это литий-ионные. Большинство экспертов сходятся во мнении, что никакая другая химия не сможет подорвать ионно-литиевый сплав как минимум еще десять лет или больше. Литий-ионный аккумулятор имеет два электрода (катод и анод) с сепаратором (материал, который проводит ионы, но не электроны, предназначен для предотвращения короткого замыкания) в середине и электролит (обычно жидкий) для обеспечения обратного потока ионов лития и вперед между электродами.Когда батарея заряжается, ионы перемещаются от катода к аноду; когда батарея питает что-то, ионы движутся в противоположном направлении.
Представьте себе две буханки нарезанного хлеба. Каждая буханка – это электрод: левый – катод, а правый – анод. Предположим, что катод состоит из пластин никеля, марганца и кобальта (NMC) – одного из лучших в своем классе – и что анод состоит из графита, который по сути представляет собой слоистые листы или кусочки атомов углерода. .
В разряженном состоянии, то есть после того, как энергия была истощена, буханка NMC содержит ионы лития, расположенные между каждым ломтиком. Когда батарея заряжается, каждый ион лития извлекается из промежутков между пластинами и вынужден проходить через жидкий электролит. Сепаратор действует как контрольно-пропускной пункт, гарантирующий, что только ионы лития проходят через графитовую буханку. При полной зарядке в катодной буханке батареи не останется ионов лития; все они будут аккуратно зажаты между ломтиками графитового хлеба.По мере того, как энергия батареи расходуется, ионы лития возвращаются к катоду, пока на аноде не останется ни одного. Вот тогда и нужно снова зарядить аккумулятор.
Емкость аккумулятора в основном определяется скоростью этого процесса. Но не так-то просто увеличить скорость. Слишком быстрое извлечение ионов лития из катодной буханки может привести к появлению дефектов на ломтиках и, в конечном итоге, к их разрушению. Это одна из причин, почему чем дольше мы пользуемся смартфоном, ноутбуком или электромобилем, тем хуже время автономной работы.Каждая зарядка и разрядка заставляют буханку немного ослабевать.
Над решением проблемы работают разные компании. Одна из идей – заменить слоистые электроды чем-то более прочным. Например, швейцарская компания по производству аккумуляторов Leclanché со 100-летней историей работает над технологией, в которой используется фосфат лития-железа (LFP), который имеет структуру «оливина» в качестве катода, и оксид титаната лития (LTO), который имеет Структура «шпинель», как анод. Эти структуры лучше справляются с потоком ионов лития в материал и из него.
Leclanché в настоящее время использует свои аккумуляторные элементы в автономных складских вилочных погрузчиках, которые можно полностью зарядить за девять минут. Для сравнения: лучший нагнетатель Tesla может зарядить автомобильный аккумулятор Tesla примерно до 50% за 10 минут. Leclanché также внедряет свои батареи в Великобритании для быстрой зарядки электромобилей. Эти батареи находятся на зарядной станции, медленно потребляя небольшое количество энергии в течение длительного периода времени из сети, пока они не будут полностью заряжены. Затем, когда автомобиль стыкуется, аккумуляторы док-станции быстро заряжают аккумулятор автомобиля.Когда машина уезжает, аккумулятор станции снова начинает заряжаться.
Такие усилия, как шоу Лекланше, можно изменить с химическим составом батарей, чтобы увеличить их мощность. Тем не менее, никто еще не построил батарею, достаточно мощную, чтобы быстро доставить энергию, необходимую коммерческому самолету для преодоления гравитации. Стартапы стремятся строить самолеты меньшего размера (вмещающие до 12 человек), которые могли бы летать на относительно менее энергоемких батареях, или электрические гибридные самолеты, где реактивное топливо выполняет тяжелую работу, а батареи – инерцию.
Но на самом деле в этой сфере нет ни одной компании, которая могла бы даже приблизиться к коммерциализации. Кроме того, технический скачок, необходимый для полностью электрического коммерческого самолета, вероятно, займет десятилетия, – говорит Венкат Вишванатан, эксперт по аккумуляторным батареям из Университета Карнеги-Меллона.
Reuters / Alister Doyle
Двухместный электрический самолет, сделанный словенской фирмой Pipistrel, стоит у ангара в аэропорту Осло, Норвегия.Энергетическая проблема
Tesla Model 3, самая доступная модель компании, стоит от 35 000 долларов.Он работает от батареи на 50 кВтч, что стоит примерно 8750 долларов, или 25% от общей стоимости автомобиля.
Это все еще удивительно доступно по сравнению с тем, что было не так давно. По данным Bloomberg New Energy Finance, средняя мировая стоимость литий-ионных аккумуляторов в 2018 году составила около 175 долларов за киловатт-час, что ниже почти 1200 долларов за киловатт-час в 2010 году.
Министерство энергетики США подсчитало, что как только стоимость батарей упадет ниже 125 долларов за киловатт-час. владение и эксплуатация электромобиля будет дешевле, чем бензиновый в большинстве частей мира.Это не означает, что электромобили победят автомобили с бензиновым двигателем во всех нишах и сферах – например, для грузовиков дальнего следования еще нет электрического решения. Но это переломный момент, когда люди начнут отдавать предпочтение электромобилям просто потому, что в большинстве случаев они будут иметь более экономичный смысл.
Один из способов добиться этого – увеличить удельную энергию батарей – втиснуть в аккумуляторную батарею больше киловатт-часов без снижения ее цены. Теоретически это может сделать специалист по производству аккумуляторов, увеличив удельную энергию катода или анода, либо того и другого.
Катод с наибольшей энергоемкостью на пути к коммерческой доступности – это NMC 811 (каждая цифра в номере представляет собой соотношение никеля, марганца и кобальта, соответственно, в смеси). Это еще не идеально. Самая большая проблема заключается в том, что он может выдержать только относительно небольшое количество жизненных циклов заряда-разряда, прежде чем он перестанет работать. Но эксперты прогнозируют, что отраслевые исследования и разработки должны решить проблемы NMC 811 в течение следующих пяти лет. Когда это произойдет, батареи, использующие NMC 811, будут иметь более высокую плотность энергии на 10% или более.
Однако увеличение на 10% – это не так уж и много в общей картине.
И хотя ряд инноваций за последние несколько десятилетий поднял плотность энергии катодов еще выше, аноды – это то, где открываются самые большие возможности в области плотности энергии.
Графит был и остается доминирующим анодным материалом. Он дешевый, надежный и относительно энергоемкий, особенно по сравнению с современными катодными материалами. Но он довольно слаб, если сравнивать его с другими потенциальными анодными материалами, такими как кремний и литий.
Кремний, например, теоретически намного лучше поглощает ионы лития в виде графита. Вот почему ряд производителей аккумуляторов пытаются добавить кремний вместе с графитом в свои конструкции анодов; Генеральный директор Tesla Илон Маск сказал, что его компания уже делает это в своих литий-ионных батареях.
Большим шагом была бы разработка коммерчески жизнеспособного анода, полностью сделанного из кремния. Но у этого элемента есть черты, которые затрудняют это. Когда графит поглощает ионы лития, его объем не сильно меняется.Однако кремниевый анод по тому же сценарию набухает в четыре раза по сравнению с исходным объемом.
К сожалению, вы не можете просто сделать корпус больше, чтобы приспособиться к этому вздутию, потому что расширение разрушает то, что называется «межфазной границей твердого электролита», или SEI, кремниевого анода.
SEI можно рассматривать как своего рода защитный слой, который анод создает для себя, подобно тому, как железо образует ржавчину, также известную как оксид железа, для защиты от элементов: когда вы оставляете кусок недавно кованое железо снаружи, оно медленно вступает в реакцию с кислородом воздуха, образуя ржавчину.Под слоем ржавчины остальная часть железа не постигает та же участь и, таким образом, сохраняет структурную целостность.
В конце первого заряда батареи электрод образует собственный слой «ржавчины» – SEI, отделяющий неэродированную часть электрода от электролита. SEI предотвращает потребление электрода дополнительными химическими реакциями, гарантируя, что ионы лития могут течь как можно более плавно.
Но с кремниевым анодом SEI ломается каждый раз, когда батарея используется для питания чего-либо, и восстанавливается каждый раз, когда батарея заряжается.И во время каждого цикла зарядки расходуется немного кремния. В конце концов, кремний рассеивается до такой степени, что батарея перестает работать.
За последнее десятилетие несколько стартапов Кремниевой долины работали над решением этой проблемы. Например, подход Sila Nano состоит в том, чтобы заключить атомы кремния в наноразмерную оболочку с большим количеством пустого места внутри. Таким образом, SEI формируется снаружи оболочки, и расширение атомов кремния происходит внутри нее, не разрушая SEI после каждого цикла заряда-разряда.Компания, оцениваемая в 350 миллионов долларов, заявляет, что ее технология будет использоваться в устройствах уже в 2020 году.
Enovix, с другой стороны, применяет особую технологию производства, чтобы подвергнуть 100% кремний анод огромному физическому давлению, заставляя его поглощать меньше ион лития и, таким образом, ограничивает расширение анода и предотвращает разрушение SEI. У компании есть инвестиции от Intel и Qualcomm, и она также ожидает, что к 2020 году ее батареи будут в устройствах.
Эти компромиссы означают, что кремниевый анод не может достичь своей теоретической высокой плотности энергии.Однако обе компании заявляют, что их аноды работают лучше, чем графитовые. Третьи стороны в настоящее время тестируют аккумуляторы обеих фирм.
Tesla
В 2020 году новый Tesla Roadster должен стать первым электромобилем, который может проехать 1000 км (620 миль) без подзарядки.Проблема безопасности
Все молекулярные переделки, предпринятые для накопления большего количества энергии в батареях, могут происходить за счет безопасности. С момента своего изобретения литий-ионный аккумулятор вызывает головные боли из-за того, как часто он воспламеняется.Например, в 1990-х годах канадская компания Moli Energy выпустила на рынок литий-металлический аккумулятор для использования в телефонах. Но в реальном мире его батареи начали воспламеняться, и Moli был вынужден отозвать свой заказ и, в конечном итоге, объявить о банкротстве. (Некоторые из его активов были куплены тайваньской компанией, и она по-прежнему продает литий-ионные батареи под торговой маркой E-One Moli Energy.) Совсем недавно смартфоны Samsung Galaxy Note 7, которые были сделаны с современными литий-ионными батареями, начали взрываться. в карманах людей.В результате отзыв продукции в 2016 году обошелся южнокорейскому гиганту в 5,3 миллиарда долларов.
Современные литий-ионные батареи по-прежнему сопряжены с рисками, поскольку в них почти всегда используются легковоспламеняющиеся жидкости в качестве электролита. Одна из прискорбных (для нас, людей) причуд природы заключается в том, что жидкости, способные легко переносить ионы, также имеют более низкий порог воспламенения. Одно из решений – использовать твердые электролиты. Но это означает другие компромиссы. Конструкция батареи может легко включать жидкий электролит, который контактирует с каждым битом электродов, что позволяет эффективно переносить ионы.С твердыми телами намного сложнее. Представьте, что вы бросаете пару кубиков в чашку с водой. А теперь представьте, что те же кости бросают в чашку с песком. Очевидно, что вода будет касаться гораздо большей площади поверхности игральных костей, чем песок.
До сих пор коммерческое использование литий-ионных батарей с твердыми электролитами ограничивалось приложениями с низким энергопотреблением, такими как датчики, подключенные к Интернету. Усилия по увеличению масштабов твердотельных батарей, то есть не содержащих жидкий электролит, можно в общих чертах разделить на две категории: твердые полимеры при высоких температурах и керамика при комнатной температуре.
Твердые полимеры при высоких температурах
Полимеры представляют собой длинные цепочки молекул, связанных вместе. Они очень распространены в повседневном использовании – например, одноразовые полиэтиленовые пакеты делают из полимеров. Когда некоторые типы полимеров нагреваются, они ведут себя как жидкости, но без воспламеняемости жидких электролитов, используемых в большинстве батарей. Другими словами, они обладают высокой ионной проводимостью, как жидкий электролит, без каких-либо рисков.
Но у них есть ограничения.Они могут работать только при температуре выше 105 ° C (220 ° F), что означает, что они не подходят, например, для смартфонов. Но их можно использовать, например, для хранения энергии от сети в домашних батареях. По крайней мере, две компании – SEEO (США) и Bolloré (Франция) – разрабатывают твердотельные батареи, в которых в качестве электролита используются высокотемпературные полимеры.
Керамика при комнатной температуре
За последнее десятилетие два класса керамики – LLZO (оксид лития, лантана и циркония) и LGPS (литий, германий, сульфид фосфора) – показали почти такие же хорошие проводящие ионы при комнатной температуре. как жидкости.
Toyota, а также стартап из Кремниевой долины QuantumScape (который в прошлом году привлек 100 миллионов долларов финансирования от Volkswagen) работают над применением керамики в литий-ионных батареях. Включение крупных игроков в пространство свидетельствует о том, что прорыв может быть ближе, чем многие думают.
«Мы очень близки к тому, чтобы увидеть что-то реальное [с использованием керамики] через два или три года», – говорит Вишванатан из Карнеги-Меллона.
Закон о балансе
Аккумуляторы – это уже большой бизнес, и их рынок продолжает расти.Все эти деньги привлекают множество предпринимателей с еще большим количеством идей. Но стартап с аккумуляторными батареями – сложная ставка – они терпят неудачу даже чаще, чем компании-разработчики программного обеспечения, которые известны своим высоким уровнем отказов. Это потому, что инновации в области материаловедения – это сложно.
На данный момент химики по производству аккумуляторов обнаружили, что, пытаясь улучшить одну характеристику (скажем, плотность энергии), они вынуждены идти на компромисс с другой характеристикой (например, безопасностью). Такой баланс означает, что прогресс на каждом фронте был медленным и чреват проблемами.
Но если внимательнее присмотреться к проблеме – Йет-Мин Чан из Массачусетского технологического института считает, что сегодня в США в три раза больше ученых, занимающихся аккумуляторными батареями, чем всего 10 лет назад, – шансы на успех возрастут. Потенциал аккумуляторов остается огромным, но, учитывая предстоящие задачи, лучше относиться к каждому заявлению о новых аккумуляторах с хорошей долей скептицизма.
Литий-ионные батареи – Любопытный
Эта тема является частью нашей серии из четырех статей об аккумуляторах. Для дальнейшего чтения посмотрите, как работает аккумулятор, типы аккумуляторов и аккумуляторы будущего.В наши дни наш лучший друг – литий-ионный аккумулятор. Именно он используется в наших мобильных телефонах и ноутбуках, устройствах, которые внесли огромный вклад в изменение того, как мы работаем и взаимодействуем с нашими друзьями, коллегами, продавцами и даже незнакомцами. Потребляемая мощность наших смартфонов разряжает никель-кадмиевые или никель-металлогидридные батареи менее чем за час, но благодаря эффективности литий-ионной химии мы можем общаться с мамой, смотреть видео, общаться с друзьями, слушать под музыку, купите пару обуви в Интернете, получите инструкции по навигации и сделайте бесчисленное количество фотографий в течение всего дня.
Так что же такого особенного в литий-ионных батареях? Их основная черта – плотность энергии – она примерно вдвое больше, чем у никель-кадмиевых батарей, а это означает, что батарея вдвое меньшего размера будет давать такое же количество энергии. Они легкие и компактные, а это значит, что они лучше подходят для таких вещей, как портативная электроника, чем тяжелые свинцово-кислотные батареи, от которых запускаются наши бензиновые автомобили.
Литий-ионные аккумуляторы используются сегодня в большинстве портативных электронных устройств. Источник изображения: Edvvc / Flickr.Так в чем же химический состав литий-ионного элемента, который дает ему преимущество перед конкурентами?
Литий-ионный аккумулятор
Как следует из названия, ионы лития (Li + ) участвуют в реакциях, приводящих в движение аккумулятор.Оба электрода в литий-ионном элементе изготовлены из материалов, которые могут интеркалировать или «поглощать» ионы лития (что-то вроде гидрид-ионов в батареях NiMH). Интеркаляция – это когда заряженные ионы элемента могут «удерживаться» внутри структуры материала-хозяина, не нарушая ее. В случае литий-ионного аккумулятора ионы лития «привязаны» к электрону в структуре анода. Когда батарея разряжается, интеркалированные ионы лития высвобождаются из анода, а затем проходят через раствор электролита и абсорбируются (интеркалируются) на катоде.
Литий-ионный аккумулятор начинает свою жизнь в состоянии полного разряда: все его ионы лития интеркалированы внутри катода, и его химический состав еще не позволяет производить электричество. Прежде чем вы сможете использовать аккумулятор, вам необходимо его зарядить. Когда батарея заряжается, на катоде происходит реакция окисления, что означает, что он теряет часть отрицательно заряженных электронов. Для поддержания баланса заряда в катоде равное количество положительно заряженных интеркалированных ионов лития растворяется в растворе электролита.Они перемещаются к аноду, где внедряются в графит. Эта реакция интеркаляции также откладывает электроны на графитовый анод, чтобы «связать» ион лития.
Во время разряда ионы лития деинтеркалируются с анода и возвращаются через электролит к катоду. Это также высвобождает электроны, которые связывали их с анодом, и они текут по внешнему проводу, обеспечивая электрический ток, который мы использовали для работы.Именно соединение внешнего провода позволяет реакции протекать – когда электроны могут свободно перемещаться, положительно заряженные ионы лития уравновешивают движение своего отрицательного заряда.
Когда катод заполняется ионами лития, реакция прекращается и батарея разряжается. Затем мы снова заряжаем наши литий-ионные аккумуляторы, и применяемый нами внешний электрический заряд толкает ионы лития обратно в анод от катода.
Электролит в литий-ионном элементе обычно представляет собой раствор солей лития в смеси растворителей (например, диметилкарбонат или диэтилкарбонат), предназначенный для улучшения характеристик аккумулятора.Растворение солей лития в электролите означает, что раствор содержит ионы лития. Это означает, что отдельные ионы лития не должны совершать полный путь от анода до катода, чтобы замкнуть цепь. Когда ионы выбрасываются из анода, другие ионы, которые уже находятся в электролите у поверхности электрода, могут легко абсорбироваться (внедряться) в катод. Во время зарядки происходит обратное.
Микроскопические материалы, используемые для литий-ионных катодов.Источник изображения: BASF / Flickr.Будучи маленьким и легким, много лития может накапливаться (интеркалироваться) в обоих электродах. Это то, что придает литий-ионным аккумуляторам высокую плотность энергии. Например, один ион лития может накапливаться на каждые шесть атомов углерода в графите, и чем больше ионов лития должно делиться на пути от анода к катоду (и обратно во время циклов перезарядки), тем больше электронов остается для уравновешивают их движение и обеспечивают электрический ток.
Передача ионов лития между электродами происходит при гораздо более высоком напряжении, чем в батареях других типов, и, поскольку они должны уравновешиваться равным количеством электронов, один литий-ионный элемент может производить напряжение 3,6 В или выше, в зависимости от материалов катода. Типичный щелочной элемент выдает всего около 1,5 вольт. Для стандартного свинцово-кислотного автомобильного аккумулятора требуется шесть ячеек по 2 вольта, соединенных вместе, чтобы вырабатывать 12 вольт.
Благодаря их высокой плотности энергии и сравнительной легкости, размещение множества литий-ионных элементов вместе в одном месте позволяет получить аккумуляторную батарею намного легче и компактнее, чем стопки из других типов батарей.Если мы сложим вместе достаточно литий-ионных элементов, мы сможем достичь довольно высокого напряжения, такого как необходимое для работы электромобиля. Конечно, у всех наших автомобилей уже есть аккумуляторы, но они нужны только для того, чтобы запустить бензиновый или дизельный двигатель, а потом всю работу сделает топливо. Аккумулятор электромобиля – это весь его источник энергии, и именно он заставляет его взбираться на крутой холм. Таким образом, он обычно имеет напряжение 96 вольт или даже больше, что даже при высоком напряжении литий-ионного элемента требует довольно большого количества элементов, установленных вместе.
Объединение литий-ионных элементов вместе может создать напряжение, достаточное для запуска электромобиля. Источник изображения: Håkan Dahlström / Flickr.Анод обычно графитовый. Однако повторное введение ионов лития в стандартную структуру графита в типичной литий-ионной батарее в конечном итоге приводит к разрушению графита. Это снижает производительность батареи, и графитовый анод в конечном итоге выйдет из строя, и батарея перестанет работать. Исследователи работают над разработкой вариантов использования графена (листы углерода толщиной в один атом), а не графита.Вы узнаете больше о графене и его преимуществах в предстоящей теме Nova.
Что касается материала, используемого для катода, существует довольно много вариаций, обычно состоящих из комбинации лития, кислорода и какого-либо металла.
Катоды, используемые в литий-ионных аккумуляторах
Оксид лития-кобальта (LiCoO
2 )Наиболее распространенные литий-ионные элементы имеют анод из углерода (C) и катод из оксида лития-кобальта (LiCoO 2 ).Фактически, литий-кобальтооксидная батарея была первой литий-ионной батареей, разработанной на основе новаторской работы Р. Язами и Дж. Гуденафа и проданной Sony в 1991 году. Кобальт и кислород связываются вместе, образуя слои октаэдрических структур оксида кобальта. , разделенные листами лития. Важно, что эта структура позволяет ионам кобальта изменять свои валентные состояния между Co +3 и Co +4 (терять и приобретать отрицательно заряженный электрон) при зарядке и разрядке.
Из всех литий-ионных аккумуляторов у этих парней самая высокая плотность энергии, поэтому в настоящее время они используются в наших телефонах, цифровых камерах и ноутбуках. Их недостаток – термическая нестабильность. Их аноды могут перегреваться, и при высоких температурах катод из оксида кобальта может разлагаться с образованием кислорода. Если вы объедините кислород и тепло, у вас есть довольно хорошие шансы разжечь огонь, и, поскольку химические вещества, иногда используемые в растворе электролита, такие как диэтилкарбонат, легко воспламеняются, с этой батареей могут возникнуть некоторые проблемы с безопасностью.
Литий-ионные батареиимеют встроенную защиту, предотвращающую перегрев и полную разрядку батареи, которая также может быть повреждена. Кроме того, эти схемы защиты иногда могут использоваться для предотвращения чрезмерной зарядки литий-ионных аккумуляторов, что может иметь серьезные последствия. Литий-ионные батареи бывают самых разных форм и размеров, а некоторые из них содержат встроенные защитные устройства, такие как вентиляционные колпачки, для повышения безопасности.
- Смотрите реакцию: литий-кобальтоксидные батареи
Во время разряда
На аноде окисляется литий.- \ to \ text {LiCoO} _2 $$
Общая реакция:
$$ \ text {C} _6 + \ text {LiCoO} _2 \ longleftrightarrow \ text {Li} _x \ text {C} _6 + \ text {Li} _ {1-x} \ text {CoO} _2 $$
Литий-фосфат железа (LiFePO
4 )Этот элемент имеет высокую скорость разряда и, поскольку фосфат (PO 4 ) может выдерживать высокие температуры, аккумулятор имеет хорошую термическую стабильность, повышая его безопасность. Это делает его хорошим выбором для электромобилей и электроинструментов, а также для хранения энергии на электростанциях.Он также имеет длительный срок службы, то есть его можно многократно разряжать и заряжать. Однако он имеет более низкую плотность энергии, чем элемент из оксида лития-кобальта, и более высокую скорость саморазряда.
Литий-железо-фосфатный аккумуляторный элемент аналогичен литиево-кобальтово-оксидному элементу. Анод все еще графитовый, и электролит тоже почти такой же. Разница в том, что катод из диоксида лития-кобальта был заменен более стабильным фосфатом лития-железа. Фактически, на катоде из фосфата железа (FePO4) полностью заряженного элемента не остается ионов лития или железа.Ионы лития могут внедряться в катодный материал или из него через четко определенные туннели в его структуре без значительного изменения железо-фосфатного каркаса.
Катод этого типа ячейки изготовлен из отрицательно заряженного фосфата. анионы , связанный с положительно заряженным железом катионы в структуре, способной накапливать ионы лития в молекулах фосфата железа. Расположение связей в этой структуре означает, что атомы кислорода прочно связаны в структуре, что придает катоду его химическую стабильность.- \ to \ text {LiFePO} _4 $$
Общая реакция:
$$ \ text {LiFePO} _4 + \ text {6C} \ to \ text {LiC} _6 + \ text {FePO} _4 $$
Литий оксид марганца (LiMn
2 O 4 )В литиевых батареях этого типа используется катод из литий-марганцевой шпинели (Li + Mn 3+ Mn 4+ O 4 ). Шпинель – это минерал с характерной структурой AB 2 O 4 .Структура шпинели имеет очень хорошую термическую стабильность, повышая безопасность батареи. Это также способствует потоку ионов в электролите и снижает внутреннее сопротивление, которое способствует потере мощности батареи с течением времени.
Хотя этот тип литиевой батареи обеспечивает высокую скорость разряда и перезарядки (в том числе из-за шпинельной структуры катода), он имеет меньшую емкость и меньший срок службы.
Литий-никель-марганец-кобальт оксид (LiNiMnCoO
2 или NMC)Добавление никеля и кобальта в смесь снова немного меняет ситуацию.Никель обеспечивает высокую удельную энергию и, при добавлении к стабильной структуре марганцевой шпинели, также приводит к созданию батареи с преимуществами структуры марганцевой шпинели (низкое внутреннее сопротивление, высокая скорость зарядки, хорошая стабильность и безопасность).
Эти батареи обычно изготавливаются с катодом, состоящим из одной трети никеля, одной трети марганца и одной трети кобальта, но это соотношение может варьироваться в зависимости от секретных формул производителя. Эти батареи используются в электроинструментах, электромобилях и медицинских устройствах.
Литий-марганцевые батареи часто сочетаются с литий-никель-марганцево-оксидно-кобальтовыми батареями, в результате чего получается комбинация, которая используется во многих электромобилях. Высокие всплески энергии (для быстрого ускорения) обеспечивается литий-марганцевым компонентом, а большой диапазон движения обеспечивается компонентом оксида лития, никеля, марганца, кобальта.
Литий-полимерный
Замена жидкого электролита в литий-ионной батарее твердым электролитом повышает безопасность батареи и делает ее легче.Поскольку сам полимер чрезвычайно тонкий, он также обеспечивает большую гибкость с точки зрения формы и конструкции – его не нужно помещать в жесткий корпус, и его можно сделать чрезвычайно компактным.
Полимерный электролит – это непроводящий материал, который по-прежнему допускает ионный обмен. В ранних разработках полимер был настолько плохим проводником, что не мог способствовать ионному обмену, если не нагревали его примерно до 60 градусов по Цельсию, поэтому теперь добавляются небольшие количества геля, чтобы избежать этой проблемы.
В литий-полимерной батарее можно использовать любую комбинацию электродов литий-ионных батарей; отличается просто электролит.
Литий-ионные аккумуляторы, как и батареи в целом, бывают всех форм, размеров и химического состава. Их различный химический состав и структура предлагают разные характеристики, часто с компромиссом между эффективностью, стоимостью и безопасностью.
Литий-ионные аккумуляторы незаменимы в повседневной жизни. Они будут с нами еще какое-то время, так как в настоящее время они являются лучшим выбором для питания электромобилей и хранения энергии, генерируемой ветровыми и солнечными источниками, для использования в периоды, когда не дует ветер или не светит солнце.


