Электролиз водных растворов солей | Дистанционные уроки
12-Окт-2012 | комментария 63 | Лолита Окольнова
Тема электролиза довольна большая, формул в ней много и, как мне кажется, больше ее изучают на уроках физики… Я хочу рассмотреть ту часть, которая касается химии, и при этом только формат ЕГЭ — электролиз водных растворов солей.
Электролиз водных растворов солей
Для начала давайте представим себе систему, в которой происходит электролиз.
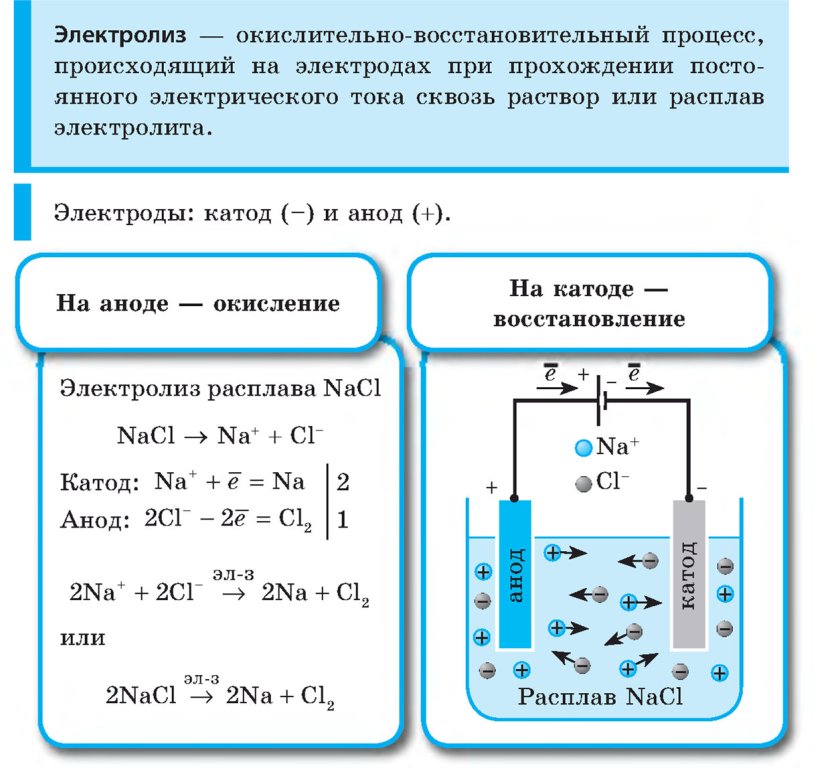
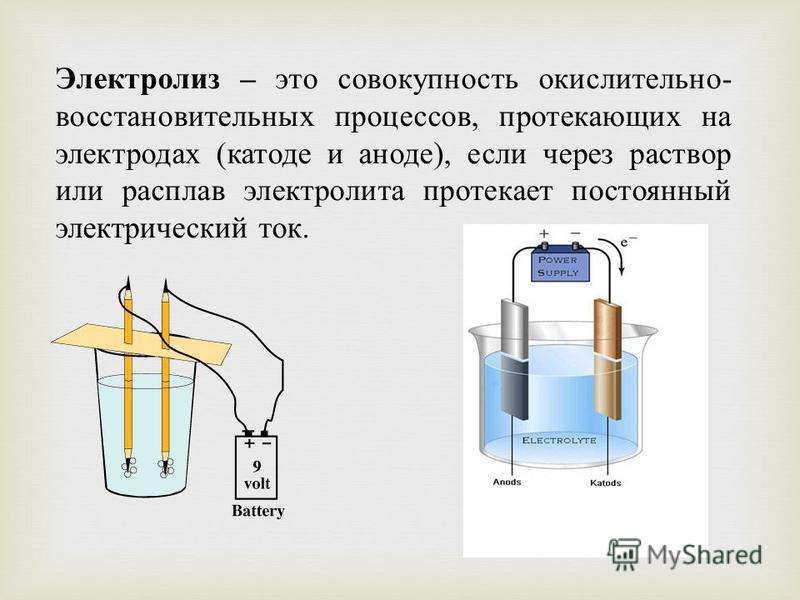
Электролиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, который возникает при прохождении электрического тока через раствор либо расплав электролита.
Электроды — это такие пластинки или стержни, опущенные в раствор, они подключены к источнику тока.
- Анод — положительно заряженный электрод
- Катод — отрицательно заряженный электрод
Мы будем рассматривать случай инертных электродов — т. е. они не будут вступать ни в какие химические реакции.
е. они не будут вступать ни в какие химические реакции.
При пропускании электрического тока, вещество раствора будет претерпевать химические изменения, т.е. буду образовываться новые химические вещества. Они будут притягиваться к электродам следующим образом:
- Неметаллы и их производны, анионы — к аноду
- Металлы и их производный, катионы — к катоду
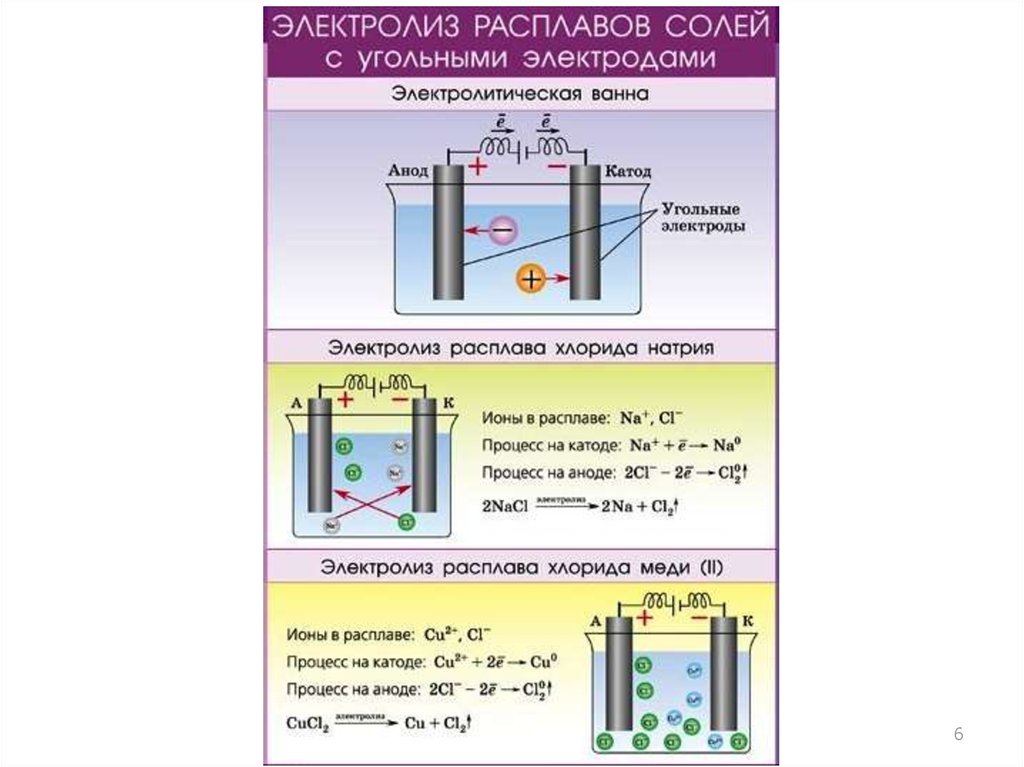
Теперь рассмотрим электролиз водных растворов различных солей
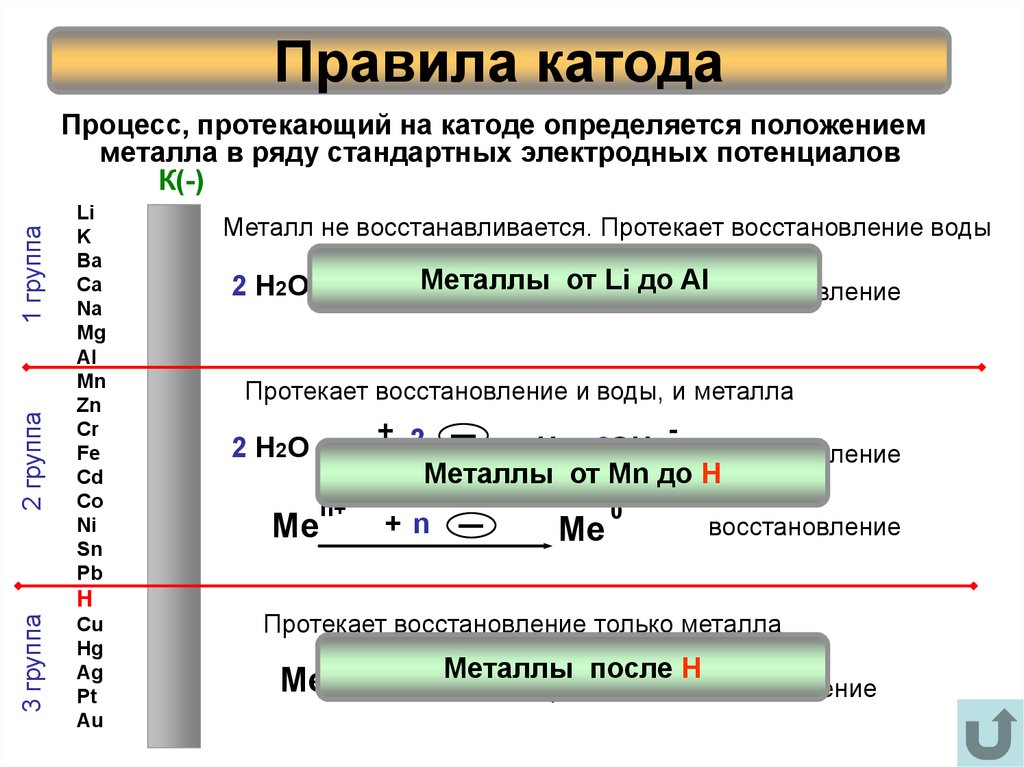
Для этого нам понадобится ряд активности металлов \ электрохимический ряд напряжений:
Разберем сначала катионы:
- Если металл стоит до Н, то вместо него электролизу подвергается вода:
2H2O + 2 е = H2 + 2OH– Образовавшийся водород h3 идет к катоду - Если металл стоит после Н, то он сам восстанавливается:
Cu2+ + 2е = Cu0 Медь осаждается на катоде - Катионы металлов, стоящие в ряду напряжений после алюминия до водорода, могут восстанавливаться вместе с молекулами воды:
2Н2О + 2е = Н2 + 2ОН—Zn2+ + 2e = Zn0
Теперь анионы-кислотные остатки:
- Кислородсодержащие кислотные остатки — вместо них электролизу подвергается вода:
2H2O — 4e = O2 + 4H+ Образовавшийся O2 выделяется на аноде - Бескислородные кислотные остатки — окисляются до простого вещества:
Cl− - Исключение: F− — вместо него будет выделяться кислород.
Примеры:
1.1. Катион стоит в ряду до Н, кислотный остаток содержит кислород О:
K2SO4↔2K++SO42−
K(-): 2H2O + 2e = H2 + 2OH−
A(+): 2H2O — 4e = O2 + 4H+
2H2O (электролиз) → 2H2 + O2
1.2. Катион стоит в ряду до Н, кислотный остаток беcкислородный:
LiCl ↔ Li+ + Cl−
катод (-): 2H2O + 2e = H2 + 2OH−
анод (+): Cl− — 1e = Cl0; Cl0+Cl0=Cl 2
2LiCl + 2H2O(электролиз) → H2 + Cl2 +2LiOH
2.1. Катион стоит в ряду после Н, кислотный остаток содержит кислород О:
СuSO4 ↔ Cu2++SO42−
K(-): Cu2+ + 2e = Cu0
A(+): 2H2O — 4e = O2 + 4Н+
2CuSO4 + 2H2O(электролиз) → 2Cu + 2H2SO4 + O2
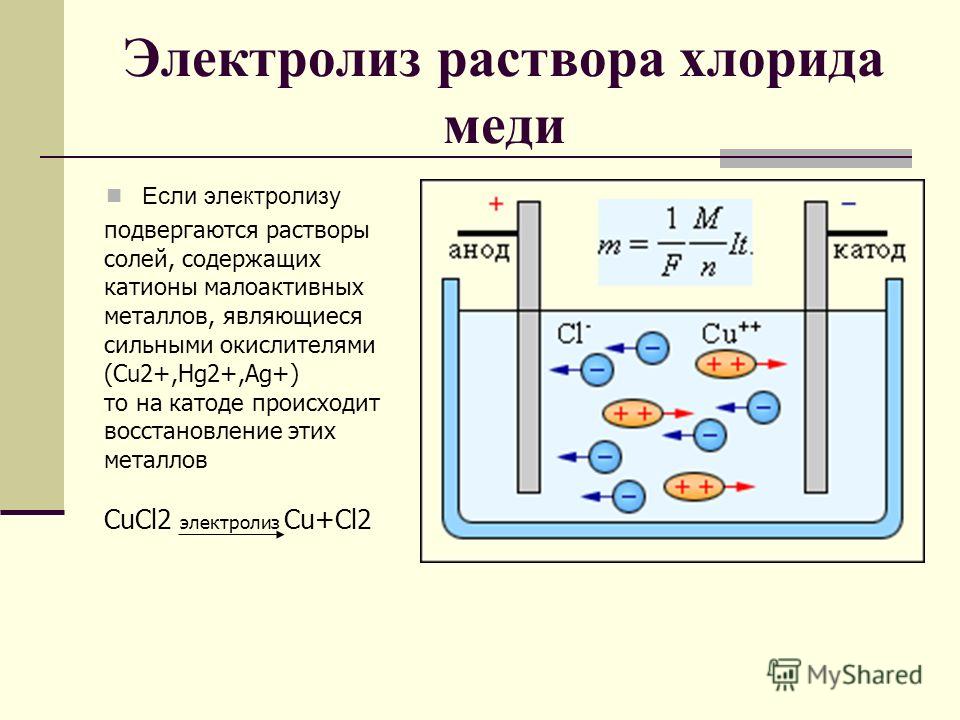
2. 2. Катион стоит в ряду после Н, кислотный остаток беcкислородный:
2. Катион стоит в ряду после Н, кислотный остаток беcкислородный:
катод (-): Cu2+ + 2e = Cu0
анод (+): 2Cl− — 2e = 2Cl0
CuCl2 (электролиз) →Cu + Cl2
Электролиз водных растворов солей отличается от электролиза расплавов.
Отличие — в наличии растворителя. При
электролизе водных растворов солей кроме ионов самого вещества в процессе участвуют ионы растворителя. При электролизе расплавов — только ионы самого вещества.
- ЕГЭ это вопрос Части B № 3
[TESTME 56]
Категории: |
(Правила комментирования)
Электролиз – HIMI4KA
ЕГЭ 2018 по химии › Подготовка к ЕГЭ 2018
Электролизом называют химические реакции, которые протекают под действием электрического тока на электродах в растворах и расплавах электролитов.
Катодом называют отрицательно заряженный электрод. На его поверхности ионы, молекулы или атомы присоединяют электроны, т. е. протекает реакция электрохимического восстановления катионов.
Анодом называют положительно заряженный электрод. На его поверхности происходит отдача электронов, т. е. реакция окисления.
Для установления продуктов электролиза водных растворов солей используют так называемый электрохимический ряд напряжений металлов, а также ряд восстановительной активности анионов.
Электрохимический ряд напряжений металлов:
Ряд восстановительной активности анионов:
Рассмотрим несколько примеров реакций электролиза, протекающих на инертных, т.е. не вступающих в какие-либо химические реакции, электродах.
Прогнозировать происходящие при электролизе водных растворов процессы можно с помощью ряда напряжений металлов и некоторых экспериментально обоснованных закономерностей.
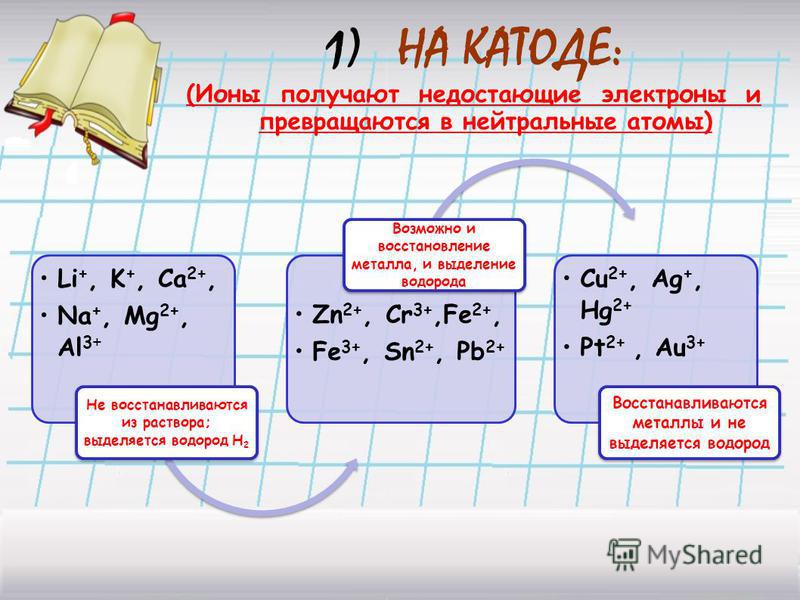
Для катодных процессов существуют следующие закономерности:
1. Катионы металлов, стандартные электродные потенциалы которых выше, чем у водорода, т.е. расположенные в этом ряду правее его (Cu, Hg, Ag, Pt, Au), при электролизе полностью восстанавливаются на катоде в виде металла: Men+ + nе– → Me0.
Катионы металлов, стандартные электродные потенциалы которых выше, чем у водорода, т.е. расположенные в этом ряду правее его (Cu, Hg, Ag, Pt, Au), при электролизе полностью восстанавливаются на катоде в виде металла: Men+ + nе– → Me0.
2. Катионы металлов с малой величиной стандартного электродного потенциала (Li+, Na+, K+, Rb+, …, до Al3+ включительно) при электролизе на катоде не восстанавливаются, а вместо них восстанавливаются молекулы воды: 2H2O + 2e– → Н2 + 2ОН–.
3. Катионы металлов со стандартными электродными потенциалами меньше, чем у водорода, но больше, чем у алюминия (Mn2+, Zn2+, Cr3+, Fe2+, …, до H), при электролизе восстанавливаются на катоде одновременно с молекулами воды, т.е. одновременно идут два процесса:
При электролизе водных растворов кислот и щелочей на катоде всегда выделяется водород.
Для анодных процессов:
1. При электролизе водных растворов щелочей, кислородсодержащих кислот и их солей, в которых атомы неметаллов или металлов находятся в высшей степени окисления (NO3–, SO42–, PO43–, ClO4–, MnO4– и т.п.), а также фторид-ионов F– на аноде будут окисляться не анионы, а гидроксид-ионы и молекулы воды и выделяться кислород:
2. При электролизе хлоридов, бромидов, йодидов у анода будут разряжаться анионы и выделяться соответствующие галогены:
3. При электролизе анионов, содержащих неметалл в промежуточной степени окисления (SO32–, NO2– и др.), они сами окисляются на аноде:
Усвоение учебного материала по данной теме на ЕГЭ проводят с помощью заданий повышенного уровня сложности.
Пример 1. Установите соответствие между формулой вещества и продуктами, которые могут образовываться на катоде в результате электролиза его водного раствора.
Установите соответствие между формулой вещества и продуктами, которые могут образовываться на катоде в результате электролиза его водного раствора.
Нитрат меди (II). Медь в электрохимическом ряду напряжений металлов стоит после водорода. Следовательно, при электролизе она выделится на катоде в виде металла: Cu2+ + 2е– → Cu0. На аноде при этом будет происходить окисление молекул воды и выделяться кислород: 2H2O – 4e– → О2 + 4Н+. Уравниваем процессы окисления и восстановления:
Окончательно получаем:
Нитрат серебра. Серебро в электрохимическом ряду напряжений металлов стоит после водорода. Следовательно, при электролизе оно выделится на катоде в виде металла: Ag+ + 1е– → Ag0. На аноде при этом будет происходить окисление молекул воды и выделяться кислород: 2H2O – 4e– → О2 + 4Н+. Уравниваем процессы окисления и восстановления:
Окончательно получаем:
Хлорид железа (II), FeCl2. Железо в ряду напряжений стоит после алюминия и до водорода. При электролизе на катоде восстанавливаются и металл, и молекулы воды, т. е. одновременно идут два процесса: Fe2+ + 2е– → Fe0; 2H2O + 2e– → Н2 + 2ОН–. На аноде будет выделяться хлор: 2Cl– – 2e– → Cl20.
Железо в ряду напряжений стоит после алюминия и до водорода. При электролизе на катоде восстанавливаются и металл, и молекулы воды, т. е. одновременно идут два процесса: Fe2+ + 2е– → Fe0; 2H2O + 2e– → Н2 + 2ОН–. На аноде будет выделяться хлор: 2Cl– – 2e– → Cl20.
Уравниваем процессы окисления и восстановления:
Окончательно получаем:
Сульфат калия. Катион калия в ряду напряжений металлов стоит до алюминия. Поэтому катион калия при электролизе на катоде не восстанавливается, а вместо него восстанавливаются молекулы воды: 2H2O + 2e– → Н2 + 2ОН–. На аноде будут окисляться молекулы воды: 2H2O – 4e– → О2 + 4Н+.
Уравниваем процессы окисления и восстановления:
После сокращения получаем:
Ответ: А – 1; Б – 5; В – 6; Г – 2.
Обменные реакции →
← Окислительно-восстановительные реакции
Электролизеры – Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 270
Вольтовы элементы приводятся в действие спонтанной химической реакцией, которая производит электрический ток через внешнюю цепь. Эти элементы важны, потому что они являются основой для батарей, питающих современное общество. Но они не единственный вид электрохимической ячейки. Обратная реакция в каждом случае не является самопроизвольной и требует электрической энергии.
Эти элементы важны, потому что они являются основой для батарей, питающих современное общество. Но они не единственный вид электрохимической ячейки. Обратная реакция в каждом случае не является самопроизвольной и требует электрической энергии.
Введение
Общая форма реакции может быть записана как: rightleftharpoons \text{Продукты} + \text{Электроэнергия}}}\]
Можно сконструировать ячейку, которая будет воздействовать на химическую систему, пропуская через нее электрический ток. Эти клетки называются 9Электролизер 0026. Электролитические элементы, как и гальванические элементы, состоят из двух полуэлементов: один полуэлемент восстановительный, другой полуэлемент окислительный. Однако направление потока электронов в электролитических элементах может быть противоположным направлению спонтанного потока электронов в гальванических элементах, но определение как катода, так и анода остается прежним, когда на катоде происходит восстановление, а на аноде происходит окисление.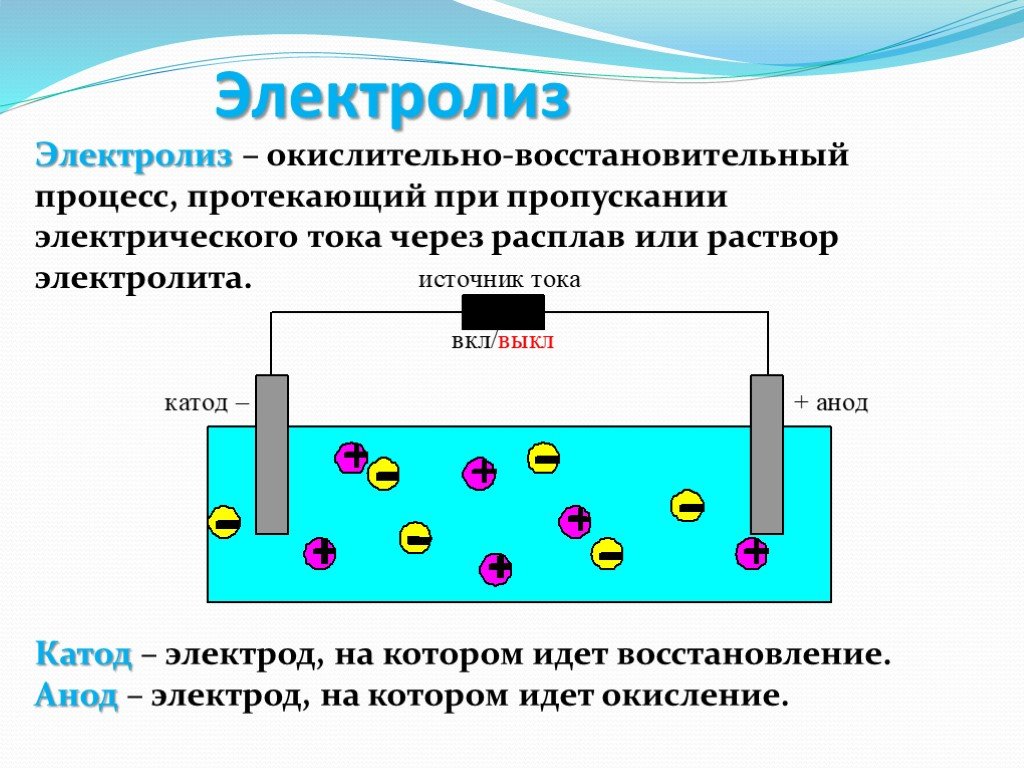
Электролитические элементы очень похожи на гальванические (гальванические) элементы в том смысле, что оба требуют солевого мостика, оба имеют катод и анод, и оба имеют постоянный поток электронов от анода к катоду. Однако между двумя клетками есть и поразительные различия. Основные отличия представлены ниже:
Рисунок \(\PageIndex{1}\): Электрохимические ячейки . Гальванический элемент (слева) преобразует энергию, выделяемую в результате спонтанной окислительно-восстановительной реакции, в электрическую энергию, которую можно использовать для выполнения работы. Окислительные и восстановительные полуреакции обычно протекают в отдельных отсеках, соединенных внешней электрической цепью; кроме того, для поддержания электрической нейтральности необходимо второе соединение, которое позволяет ионам течь между отсеками (показанное здесь вертикальной пунктирной линией для обозначения пористого барьера). Разность потенциалов между электродами (напряжение) заставляет электроны течь от восстановителя к окислителю через внешнюю цепь, генерируя электрический ток. В электролитической ячейке (справа) внешний источник электрической энергии используется для создания разности потенциалов между электродами, которая заставляет электроны течь, вызывая неспонтанную окислительно-восстановительную реакцию; в большинстве приложений используется только одно отделение. В обоих типах электрохимических элементов анодом является электрод, на котором происходит полуреакция окисления, а катодом является электрод, на котором происходит полуреакция восстановления.
Разность потенциалов между электродами (напряжение) заставляет электроны течь от восстановителя к окислителю через внешнюю цепь, генерируя электрический ток. В электролитической ячейке (справа) внешний источник электрической энергии используется для создания разности потенциалов между электродами, которая заставляет электроны течь, вызывая неспонтанную окислительно-восстановительную реакцию; в большинстве приложений используется только одно отделение. В обоих типах электрохимических элементов анодом является электрод, на котором происходит полуреакция окисления, а катодом является электрод, на котором происходит полуреакция восстановления.
| Электрохимический элемент (гальванический элемент) | Электролитическая ячейка |
|---|---|
Гальванический элемент преобразует химическую энергию в электрическую. | Электролитическая ячейка преобразует электрическую энергию в химическую. |
| Здесь окислительно-восстановительная реакция протекает самопроизвольно и отвечает за производство электроэнергии. | Окислительно-восстановительная реакция не является самопроизвольной, и для запуска реакции необходимо подать электрическую энергию. |
| Две полукамеры установлены в разных контейнерах, соединенных через соляной мост или пористую перегородку. | Оба электрода помещаются в одну емкость в раствор расплавленного электролита. |
Здесь анод отрицательный, а катод положительный электрод. Реакция на аноде – окисление, на катоде – восстановление. | Здесь анод положительный, а катод отрицательный. Реакция на аноде – окисление, на катоде – восстановление. |
| Электроны поставляются окисляющимися частицами. Они движутся от анода к катоду во внешней цепи. | Внешняя батарея поставляет электроны. Они входят через катод и выходят через анод. |
Электролизеры
Чтобы объяснить, что происходит в электролизере, давайте рассмотрим разложение расплавленного хлорида натрия на металлический натрий и газообразный хлор. Реакция написана ниже.
———> Самопроизвольный (электролитическая ячейка) | ||||
2 NaCl (л) | \(\rightleftharpoons\) | 2 На (ы) | + | Класс 2 (г) |
<--------- самопроизвольный (электрохимический элемент) | ||||
Если расплавленный \(NaCl_{(l)}\) поместить в контейнер и вставить инертные электроды \(C_{(s)}\), прикрепленные к положительному и отрицательному полюсам батареи, произойдет электролитическая реакция. 9-\]
9-\]
Прогнозирование реакции электролиза
Существует четыре основных фактора, определяющих, будет ли происходить электролиз, даже если внешнее напряжение превышает расчетное значение: поверхность. Этот случай чаще случается с газами. Например. H 2 (g) требует перенапряжения 1,5 В, а Pt (s) требует перенапряжения 0 В
Этот случай чаще случается с газами. Например. H 2 (g) требует перенапряжения 1,5 В, а Pt (s) требует перенапряжения 0 В
- Концентрация иона хлорида = 5,5M, а не единица активности 1M. Это означает, что восстановление хлорида = 1,31 В, а не 1,36 В
- Стандартным условием является наличие pH 4 в анодной полуэлементе, но иногда в нестандартных состояниях pH может быть выше или ниже при изменении напряжения.
- Способность инертного электрода к электролизу зависит от реагентов в растворе электролита, в то время как активный электрод может работать сам по себе для проведения полуреакции окисления или восстановления.

Если учесть все четыре фактора, мы можем успешно прогнозировать электродные полуреакции и реакции в целом при электролизе.
Упражнение \(\PageIndex{1}\)
Предскажите электродные реакции и общую реакцию, когда анод сделан из меди (а) и платины (б).
Количественные аспекты электролиза
Майкл Фарадей в 1833 году открыл, что всегда существует простая зависимость между количеством вещества, образующегося или потребляемого на электроде во время электролиза, и количеством электрического заряда Q , прошедшего через ячейку. Например, полууравнение 9– \rightarrow Ag\]
говорит нам, что когда 1 моль Ag + высеивается как 1 моль Ag, 1 моль e – должен поступать с катода. Поскольку известно, что отрицательный заряд одного электрона составляет 1,6022 × 10 –19 Кл, мы можем умножить его на постоянную Авогадро, чтобы получить заряд на моль электронов. Эта величина называется постоянной Фарадея , символ F :
F = 1,6022 × 10 –19 C × 6,0221 × 10 23 9-}\) и \(Q\).
Часто в экспериментах по электролизу измеряется электрический ток, а не количество электрического заряда. Поскольку кулонов определяется как количество заряда, которое проходит через фиксированную точку электрической цепи, когда в течение одной секунды протекает ток в один ампер, заряд в кулонах можно рассчитать, умножив измеренный ток (в амперах) на время (в секундах), в течение которого он течет:
\[Q = It\]
В этом уравнении I представляет ток, а t представляет время. Если вы помните, что
кулон = 1 ампер × 1 секунда 1 Кл = 1 А с
, вы можете настроить единицы времени, чтобы получить правильный результат. Теперь, когда мы можем предсказать электродные полуреакции и общие реакции при электролизе, также важно иметь возможность рассчитать количество потребленных реагентов и произведенных продуктов. Для этих расчетов мы будем использовать постоянную Фарадея:
1 моль электрона = 96,485 Кл
заряд ( Кл ) = ток ( Кл/с ) x время (с)
( Кл/с 90 027 ) = 1 кулон заряда в секунду = 1 ампер ( A )
Простое преобразование для любого типа задач:
- Преобразование любого заданного времени в секунды
- Возьмите заданный ток ( A ) за секунды, [1 c = (A)/(s)]
- Наконец, используйте стехиометрическую конверсию 1 моль электрона = 9-\].
 Какая масса брома может быть осаждена за 3,00 часа током силой 1,18 А?
Какая масса брома может быть осаждена за 3,00 часа током силой 1,18 А?Решение :
3,00 часа x 60 мин/час x 60 с/1 мин x 1,18 C(A) / 1 с x 1 моль e – /96,485 C
= 0,132 моль e –
Задачи
1) Предсказать продукты электролиза, заполнив график:
Cl – , Br – , I – , H + , OH – , Cu 2+ , Pb 2+ , Ag+, K + , На + ,
2 ) Рассчитайте количество электрического заряда, необходимого для электролиза 1,386 моль Cr из кислого раствора K 2 Cr 2 O 7 в соответствии с полууравнением
H 2 Cr 2 О 7 ( водный раствор ) + 12H + ( водный раствор ) + 12 e – → 2Cr( s ) + 7 H 2 O( l )
3) Перекись водорода, H 2 O 2 , может быть получен электролизом холодной концентрированной серной кислоты кислота.
 Реакция на аноде
Реакция на аноде2H 2 SO 4 → H 2 S 2 O 8 + 2H + + 2 9002 4 e –
Когда образуется пероксидисерная кислота, Н 2 С 2 O 8 , кипятится при пониженном давлении, разлагается:
2H 2 O + H 2 S 2 O 8 → 2H 2 SO 4 + H 2 O 2
Рассчитайте массу перекиси водорода, образовавшейся при протекании тока 0,893 в течение 1 часа.
4) Электролиз образца растворенного хлорида можно использовать для определения содержания хлорида в образце. На катоде идет полуреакция восстановления Cl 2 + (водн.) + 2 e – -> 2 Кл – . Какая масса хлорида может быть осаждена за 6,25 ч током силой 1,11 А?
5) В электролитической ячейке электрод, на котором электроны входят в раствор, называется ______ ; химическое изменение, происходящее на этом электроде, называется _______.

- анод, оксидирование
- анод, редуктор
- катод, оксидирование
- катод, редукция
- не может сказать, если мы не знаем, какие виды окисляются и восстанавливаются.
6) Как долго (в часах) должен поддерживаться ток силой 5,0 ампер для гальванического осаждения 60 г кальция из расплавленного CaCl 2 ?
- 27 часов
- 8,3 часа
- 11 часов
- 16 часов
- 5,9 часа
- 7) Сколько времени в часах потребуется для гальванического покрытия 78 г платины из раствора [PtCl 6 ] 2 – , используя средний ток 10 ампер при эффективности электрода 80%?
- 8.4
- 5,4
- 16,8
- 11,2
- 12,4
8) Сколько фарадеев требуется для превращения 1,00 г алюминия(III) в металлический алюминий?
- 1,00
- 1,50
- 3,00
- 0,111
- 0,250
9) Найдите стандартный потенциал гальванического элемента с помощью следующей реакции элемента.

Zn(s) + Cu 2+ (водн.) → Zn 2+ (водн.) + Cu(s)
Ответы
1) . Cl – хлор H + водород
Cl – хлор Cu 2+ медь
I – йод H + Hводород
2) 12 моль e – is требуется для нанесения 2 моль Cr, что дает нам стехиометрическое соотношение S ( e – /Cr). Затем по константе Фарадея можно найти количество заряда.
n Cr n e – Q
Q = 1,386 моль Cr × × = 8 .024 × 10 5 C
3) Произведение тока на время дает нам количество электроэнергии, Q . Зная это, мы легко вычисляем количество электронов, n e –. Тогда из первого полууравнения мы можем найти количество пероксидисерной кислоты, а второе приводит к n h3O2 и, наконец, m h3O2 .

= 05666 × г H 2 O 2 = 0,5666 г H 2 O 2
9 0023 4) 0,259 моль д –5) г
6) d
7) b
8) d
9) Напишите полуреакции для каждого процесс.
Zn(s) → Zn 2+ (водн.) + 2 e –
Cu 2+ (водн.) + 2 e – → Cu(s)
Найдите стандартные потенциалы полуреакции восстановления.
E o восстановление Cu2+ = + 0,339 В
E o восстановление Zn2+ = – 0,762 В
Определить общий стандартный клеточный потенциал.
E o ячейка = + 1,101 В
Ссылки
- Petrucci, et al. Общая химия: принципы и современные приложения.
 9изд. Река Аппер-Сэдл, Нью-Джерси: Пирсон / Прентис-Холл, 2007. .
9изд. Река Аппер-Сэдл, Нью-Джерси: Пирсон / Прентис-Холл, 2007. . - Кольбе, Герман. Электролиз органических соединений. Эдинбург: Э. и С. Ливингстон, 1947. .
- Стюарт, А.Т. «Электролиз воды». Производство водорода 2001 13 мая
- А также все упомянутые “внешние ссылки”.
Авторы и ссылки
- Жасмин Брионес, Калифорнийский университет в Дэвисе, 2012 г.
Electrolytic Cells распространяется под лицензией CC BY-NC-SA 4.0, автором, ремиксом и/или куратором является LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.
- Теги
- электрохимическая ячейка
- гальванический элемент
- Батареи Вольта
Электрохимия – Химия средней школы
Все ресурсы по химии для старших классов
6 диагностических тестов 143 практических теста Вопрос дня Карточки Learn by Concept
← Предыдущая 1 2 3 Следующая →
Химия в старших классах Справка » Электрохимия
Какое утверждение верно для гальванического элемента?
Возможные ответы:
Электроны перемещаются от анода к катоду, восстановление происходит на катоде, анод является отрицательным электродом, реакция идет самопроизвольно
Электроны перемещаются от анода к катоду, окисление происходит на катоде, катод является отрицательным электродом, и реакция идет самопроизвольно
Электроны перемещаются от катода к аноду, окисление происходит на аноде, анод является отрицательным электродом, и реакция идет самопроизвольно
Электроны движутся от катода к аноду, восстановление происходит на аноде, катод является отрицательным электродом, и реакция идет несамопроизвольно
Электроны движутся от анода к катоду, восстановление происходит на катоде, анод является отрицательный электрод, и реакция идет самопроизвольно
Правильный ответ:
Электроны перемещаются от анода к катоду, восстановление происходит на катоде, анод является отрицательным электродом, реакция идет самопроизвольно
Пояснение:
В гальванических элементах всегда происходят спонтанные окислительно-восстановительные реакции.
 В любой электрохимической ячейке электроны всегда движутся от анода к катоду. Кроме того, анод всегда является местом окисления, а катод всегда является местом восстановления. Поскольку реакция является самопроизвольной (чистое высвобождение свободной энергии), она вызывает движение электронов от анода к катоду. Помните, окисление — это потеря электронов, а восстановление — это приобретение электронов. Поскольку окисление всегда происходит на аноде, у нас остается избыток электронов, что делает его отрицательным электродом. Логично, что дополнительные электроны с анода спонтанно перемещаются к катоду (положительному электроду).
В любой электрохимической ячейке электроны всегда движутся от анода к катоду. Кроме того, анод всегда является местом окисления, а катод всегда является местом восстановления. Поскольку реакция является самопроизвольной (чистое высвобождение свободной энергии), она вызывает движение электронов от анода к катоду. Помните, окисление — это потеря электронов, а восстановление — это приобретение электронов. Поскольку окисление всегда происходит на аноде, у нас остается избыток электронов, что делает его отрицательным электродом. Логично, что дополнительные электроны с анода спонтанно перемещаются к катоду (положительному электроду).Чтобы лучше запомнить процессы окисления-восстановления, рассмотрите мнемоники «НЕФТЯНАЯ ВЫШИНА» и «Бык, рыжий кот». OIL RIG расшифровывается как «окисление — это потеря, восстановление — это усиление» по отношению к электронам. Бык, Рыжий Кот говорит нам, что анод — это место окисления, а катод — место восстановления.
Сообщить об ошибке
Какое из следующих различий между гальваническими элементами и электролитическими элементами неверно?
Возможные ответы:
Электролизеры имеют положительную свободную энергию Гибба
Электролизеры самопроизвольные
Электролизеры имеют отрицательное напряжение
Электролизеры имеют окисление на катоде
Правильный ответ:
Электролизеры имеют окисление на катоде
Пояснение:
В электролитических ячейках используются неспонтанные реакции, для протекания которых требуется внешний источник питания.
 Значения между гальваническими и электролитическими элементами противоположны друг другу. Гальванические элементы имеют положительный потенциал напряжения, а электролитический потенциал напряжения отрицательный. Однако в обоих типах элементов окисление происходит на катоде, а восстановление происходит на аноде.
Значения между гальваническими и электролитическими элементами противоположны друг другу. Гальванические элементы имеют положительный потенциал напряжения, а электролитический потенциал напряжения отрицательный. Однако в обоих типах элементов окисление происходит на катоде, а восстановление происходит на аноде.Сообщить об ошибке
Для следующей реакции электрохимический элемент гальванический или гальванический?
Возможные ответы:
Электролитический
Ни один
Гальванический
Оба
Правильный ответ: 9002 7
Гальванический
Пояснение:
Сначала мы должны переставить восстановительные потенциалы так, чтобы при суммировании они соответствовали реакции, происходящей в электрохимической ячейке.
В общей реакции находится на стороне реагента, поэтому уравнение нужно инвертировать.

Используйте уравнение: чтобы найти .
– это продукт, а – реагент.
Ячейка должна быть гальванической, поскольку значение положительное. Это означает, что данная реакция является самопроизвольной реакцией, происходящей без внешнего источника энергии.
Сообщить об ошибке
Чем электролитическая ячейка отличается от гальванической?
Возможные ответы:
Окисление происходит на аноде в гальваническом элементе, но на катоде в электролитическом элементе
В электролитическом элементе потенциал элемента положительный
В электролитическом элементе катод отмечен отрицательным
Окисление происходит на аноде в электролизере, но на катоде в гальваническом элементе
Правильный ответ:
Катод в электролизере отмечен отрицательным знаком
Пояснение:
Окисление всегда происходит на аноде, независимо от типа электрической ячейки.
 Заряды на аноде и катоде меняются местами между гальваническими и электролитическими элементами. В электролитических ячейках катоды помечены как отрицательные, а аноды — как положительные. В гальванических элементах верно обратное: катоды помечены как положительные, а аноды помечены как отрицательные.
Заряды на аноде и катоде меняются местами между гальваническими и электролитическими элементами. В электролитических ячейках катоды помечены как отрицательные, а аноды — как положительные. В гальванических элементах верно обратное: катоды помечены как положительные, а аноды помечены как отрицательные.Сообщить об ошибке
К какому полюсу движутся электроны в электролитической ячейке?
Возможные ответы:
К положительному полюсу
К аноду
К катоду
Электроны не движутся; путешествуют только протоны
Требуется дополнительная информация
Правильный ответ:
К катоду
Пояснение:
Восстановление всегда происходит на катоде, а окисление всегда происходит на аноде. Поскольку восстановление — это добавление электронов, электроны должны двигаться к месту восстановления.

В электролитической ячейке отрицательный заряд находится на катоде, а положительный — на аноде. Поскольку электролитической ячейке требуется энергия для продолжения реакции, мы толкаем электроны против градиента их потенциала. Электроны, заряженные отрицательно, движутся к катоду, который также заряжен отрицательно.
Сообщить об ошибке
В гальваническом элементе происходит следующая реакция:
Элемент гальванический или гальванический?
Возможные ответы:
Электролитический
Гальванический
Оба
Ни один
Правильный ответ:
Гал ваник
Пояснение:
Поскольку наша общая реакция включает твердый магний в реагентах, мы должны инвертировать первое уравнение, включая знак электрического потенциала.
Эта ячейка гальваническая, потому что электрический потенциал положительный.
 Гальванические элементы включают спонтанные реакции и, следовательно, не нуждаются во внешнем источнике энергии для запуска реакции.
Гальванические элементы включают спонтанные реакции и, следовательно, не нуждаются во внешнем источнике энергии для запуска реакции.Сообщить об ошибке
В электрохимической ячейке происходит следующая реакция:
Что из следующего лучше всего описывает эту ячейку?
Возможные ответы:
Гальванический
Ни один
Электролитический
Оба
Правильный ответ:
9002 3 ЭлектролитическийПояснение:
Поскольку наша общая реакция включает твердый кальций в реагентах, мы должны инвертировать второе уравнение, включая знак электрического потенциала.
Эта ячейка является электролитической, поскольку электрический потенциал отрицателен. Электролитические элементы включают неспонтанные реакции и, следовательно, должны иметь внешний источник напряжения, такой как батарея, для управления своими реакциями.

Сообщить об ошибке
Какой из следующих видов наиболее вероятно окислится, если его поместить в электрохимическую ячейку с другим веществом?
Возможные ответы:
Правильный ответ:
Объяснение:
Используя уравнение: , чтобы произошла спонтанная реакция, должно быть положительным. С твердым цинком в качестве реагента любое другое твердое вещество может действовать как продукт и все же давать положительный результат. Это потому, что вычитание отрицательного числа даст положительное значение.
В результате уравнение инвертируется, и твердый цинк становится реагентом. . Твердый цинк будет отдавать электроны и окисляться, чтобы восстановить другие ионы.
Сообщить об ошибке
Для следующей реакции электрохимический элемент гальванический или гальванический?
Возможные ответы:
Электролитический
Оба
Гальванический
Ни один
Правильный ответ: 900 27
Электролитический
Пояснение:
Сначала мы должны переставить восстановительные потенциалы так, чтобы при суммировании они соответствовали реакции, происходящей в электрохимической ячейке.

В общей реакции находится на стороне реагента, поэтому уравнение нужно инвертировать.
Используйте уравнение: чтобы найти .
– это продукт, а – реагент.
Ячейка должна быть электролитической, поскольку значение отрицательное. Это означает, что эта реакция не является самопроизвольной реакцией, и для ее осуществления требуется прикладной источник энергии.
Сообщить об ошибке
Чем электролитическая ячейка отличается от гальванической?
Возможные ответы:
В гальваническом элементе окисление происходит на аноде, а в электролитическом элементе – на катоде
В электролитическом элементе катод отмечен отрицательным
Окисление происходит на аноде в электролизере, но на катоде в гальваническом элементе
Правильный ответ:
Катод в электролизере отмечен отрицательным знаком
Пояснение:
Окисление всегда происходит на аноде, независимо от типа электрической ячейки.