Контрольная работа по теме “Электрический ток в жидкостях”.
1. Какова физическая природа электропроводности в электролитах?
Верный ответ : 1. Ионная.
Неверный ответ: 2. Электронная.
Неверный ответ: 3. Смешанная (электронно-ионная).
2. Укажите неверный ответ.
Верный ответ : 1. Все жидкости являются электролитами.
Неверный ответ: 2. Жидкости могут быть диэлектриками, проводниками, полупроводниками.
Неверный ответ: 3. Растворы солей, щелочей, кислот и расплавленные соли, обладающие электрической проводимостью, называются электролитами.
3. Электролитической диссоциацией называется…
Верный ответ : 1. образование положительных и отрицательных ионов при растворении веществ в жидкости.
Неверный ответ: 2. процесс выделения на электродах веществ, входящих в состав электролита.
Неверный ответ: 3. объединение ионов разных знаков в нейтральные молекулы.
4. Рекомбинацией называется …
Верный ответ : 1. объединение ионов разных знаков в нейтральные молекулы.
Неверный ответ: 2. процесс выделения на электродах веществ, входящих в состав электролита.
Неверный ответ: 3. образование положительных и отрицательных ионов при растворении веществ в жидкости.
5. Электролизом называется …
Верный ответ : 1. процесс выделения на электродах веществ, входящих в состав электролита.
Неверный ответ: 2. объединение ионов разных знаков в нейтральные молекулы.
Неверный ответ: 3. образование положительных и отрицательных ионов при растворении веществ в жидкости.
6. С увеличением температуры; электролита, его электропроводность…
Верный ответ : 1. увеличивается.
увеличивается.
Неверный ответ: 2. уменьшается.
Неверный ответ: 3. не изменяется.
7. Согласно первому закону Фарадея масса вещества, выделившегося при электролизе…
Верный ответ : 1. пропорциональна величине заряда, прошедшего через электролит, и зависит от сорта вещества.
Неверный ответ: 2. зависит только от силы тока, идущего через электролит, и от сорта вещества.
Неверный ответ: 3. зависит только от сорта вещества и времени электролиза.
8. Электрохимическим эквивалентом вещества называют величину, численно равную…
Верный ответ : 1. отношению массы выделившегося вещества к заряду, прошедшему через раствор.
Неверный ответ: 2. отношению атомной массы к валентности его атомов.
Неверный ответ: 3. отношению валентности его атомов к атомной массе вещества.
Неверный ответ: 4. произведению атомной массы вещества на валентность его атомов.
9. При электролизе металл всегда оседает на…
Верный ответ : 1. катоде.
Неверный ответ: 2. аноде.
10. Формула первого закона Фарадея для электролиза
Верный ответ : 1. m=Ikt
Неверный ответ: 2. k=mIt
Неверный ответ: 3. I=mkt
Неверный ответ: 4. t=mIk
Самостоятельная работа по теме “Электрический ток в жидкостях”. на Сёзнайке.ру
1. С увеличением температуры; электролита, его электропроводность…
1. не изменяется. 2. увеличивается. 3. уменьшается.
??????????????????????????????????????????????????????????????????????
2. Электролитической диссоциацией называется…
1. процесс выделения на электродах веществ, входящих в состав электролита.
процесс выделения на электродах веществ, входящих в состав электролита.
2. образование положительных и отрицательных ионов при растворении веществ в жидкости.
3. объединение ионов разных знаков в нейтральные молекулы.
??????????????????????????????????????????????????????????????????????
3. Согласно первому закону Фарадея масса вещества, выделившегося при электролизе…
1. зависит только от силы тока, идущего через электролит, и от сорта вещества.
2. пропорциональна величине заряда, прошедшего через электролит, и зависит от сорта вещества.
3. зависит только от сорта вещества и времени электролиза.
??????????????????????????????????????????????????????????????????????
4. При электролизе металл всегда оседает на…
1. катоде. 2. аноде.
??????????????????????????????????????????????????????????????????????
5. Электролизом называется …
Электролизом называется …
1. образование положительных и отрицательных ионов при растворении веществ в жидкости.
2. объединение ионов разных знаков в нейтральные молекулы.
3. процесс выделения на электродах веществ, входящих в состав электролита.
??????????????????????????????????????????????????????????????????????
6. Рекомбинацией называется …
1. образование положительных и отрицательных ионов при растворении веществ в жидкости.
2. процесс выделения на электродах веществ, входящих в состав электролита.
3. объединение ионов разных знаков в нейтральные молекулы.
??????????????????????????????????????????????????????????????????????
7. Какова физическая природа электропроводности в электролитах?
1. Электронная. 2.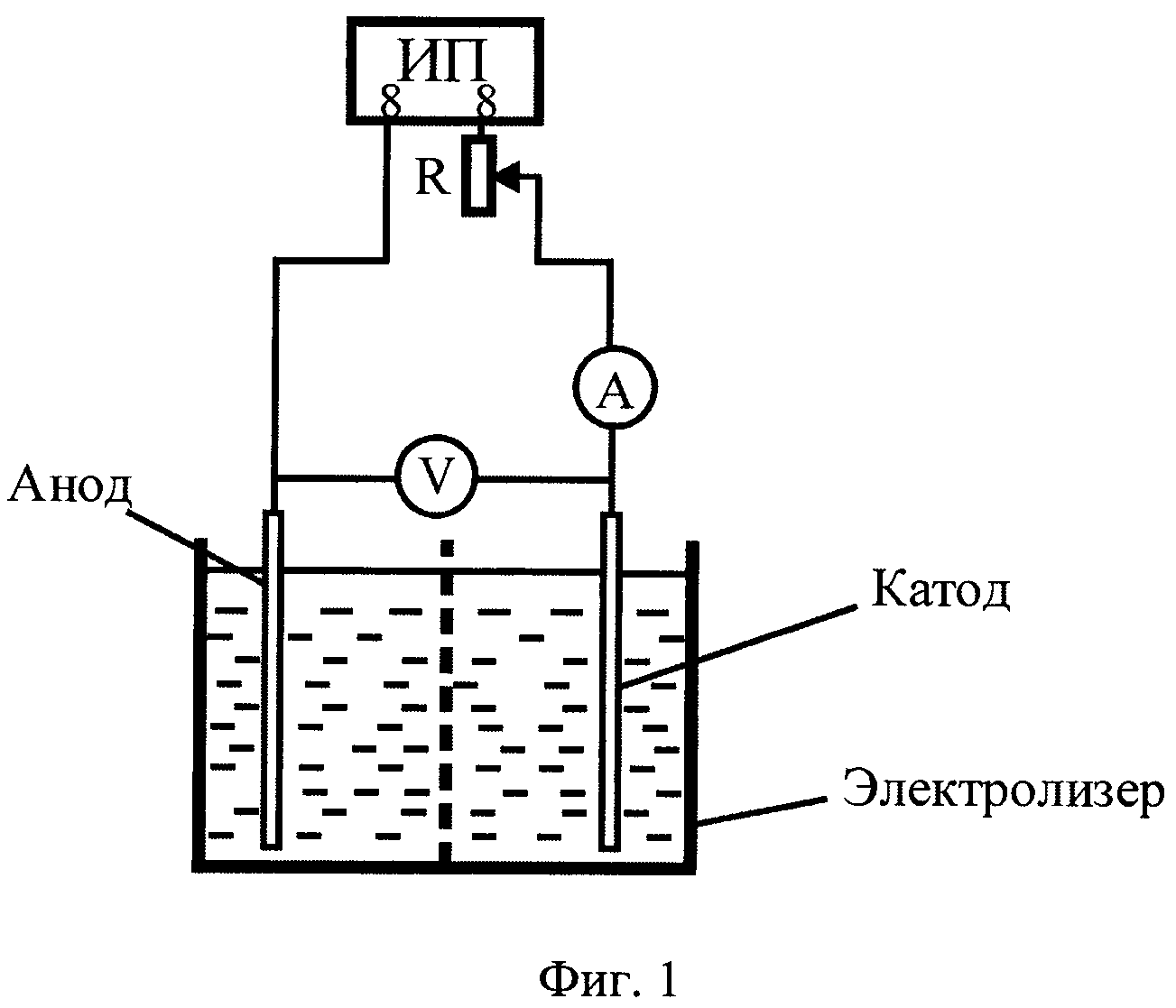 Смешанная (электронно-ионная). 3. Ионная.
Смешанная (электронно-ионная). 3. Ионная.
??????????????????????????????????????????????????????????????????????
8. Электрохимическим эквивалентом вещества называют величину, численно равную…
1. произведению атомной массы вещества на валентность его атомов.
2. отношению валентности его атомов к атомной массе вещества.
3. отношению атомной массы к валентности его атомов.
4. отношению массы выделившегося вещества к заряду, прошедшему через раствор.
??????????????????????????????????????????????????????????????????????
9. Формула первого закона Фарадея для электролиза
1. I=mkt 2. k=mIt 3. t=mIk 4. m=Ikt
??????????????????????????????????????????????????????????????????????
10. Укажите неверный ответ.
1. Жидкости могут быть диэлектриками, проводниками, полупроводниками.
2. Растворы солей, щелочей, кислот и расплавленные соли, обладающие электрической проводимостью, называются электролитами.
3. Все жидкости являются электролитами.
??????????????????????????????????????????????????????????????????????
Электрический ток в жидкостях. Законы электролиза
1. ЭЛЕКТРИЧЕСКИЙ ТОК В ЖИДКОСТЯХ. ЗАКОНЫ ЭЛЕКТРОЛИЗА.
Подготовил:студент 2 курса группы 120942
факультета МФиИ
Харламов Игорь
2. ОГЛАЛЕНИЕ
ОглавлениеОГЛАЛЕНИЕ
Фарадей
Основные понятия
Закон Электролиза
Применение электролиза в технике
Выводы
Тесты
Видеофрагмент
Задачи
Контрольные вопросы
3. МАЙКЛ ФАРАДЕ́Й
МАЙКЛ ФАРАДЕЕЙ⦿
Майкл ФарадеЕ й ( 1791- 1867) английский физик-экспериментатор и химик.
Член Лондонского королевского общества и
множества других научных организаций, в том
числе иностранный почётный
член Петербургской академии наук.

Открыл электромагнитную индукцию, лежащую
производства электричества и многих его
применений. Создал первую
модель электродвигателя. Среди других его
открытий — первый трансформатор,
химическое действие тока, законы
электролиза, действие магнитного поля на
свет, диамагнетизм. Первым
предсказал электромагнитные волны. Фарадей
ввёл в научный обиход
термины ион, катод, анод, электролит, диэлект
рик, диамагнетизм, парамагнетизм и др.
К оглавлению
4. ОСНОВНЫЕ ПОНЯТИЯ
ЭлектролитыЭлектролиз
Электролитическая диссоциация
К оглавлению
5. ЭЛЕКТРОЛИТЫ
Проводниками электрического тока являютсяне только металлы и полупроводники.
Электрический ток проводят растворы
многих веществ в воде. Как показывает
опыт, чистая вода не проводит
электрический ток, то есть в ней нет
свободных носителей электрических
зарядов. Не проводят электрический ток и
кристаллы поваренной соли, хлорида
натрия.
Однако раствор хлорида натрия является
хорошим проводником электрического
тока.
Растворы солей, кислот и оснований,
способные проводить электрический ток,
называются электролитами.
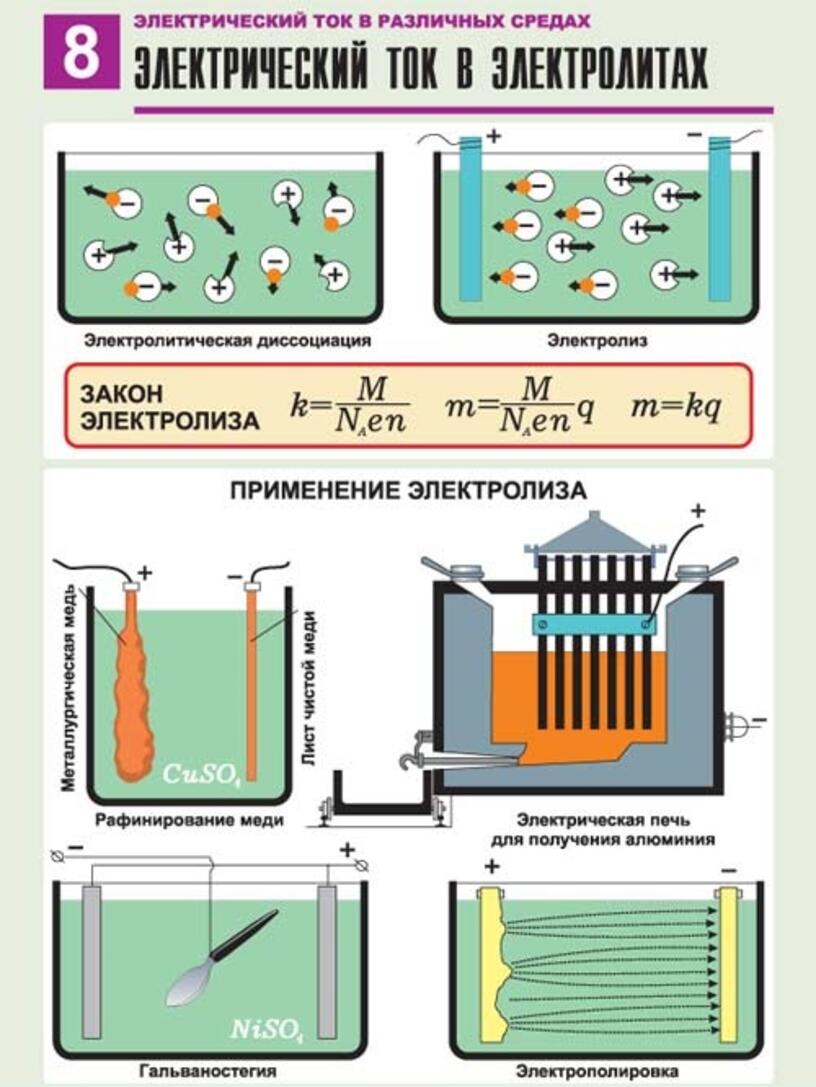
6. ЭЛЕКТРОЛИЗ
⦿ Прохождениеэлектрического тока через
электролит обязательно сопровождается
выделением вещества в твёрдом или
газообразном состоянии на поверхности
электродов. Выделение вещества на
электродах показывает, что в электролитах
электрические заряды переносят
заряженные атомы вещества – ионы. Этот
процесс называется электролизом.
⦿
К оглавлению
7. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
⦿ Электролитическаядиссоциация —
процесс распада электролита на ионы при
его растворении или плавлении.
⦿ Степень диссоциации — величина,
характеризующая
состояние равновесия в реакции диссоциац
ии в гомогенных (однородных) системах.
свободных носителей
противоположного заряда в среде с
выделением энергии
К оглавлению
8.
 ЗАКОН ЭЛЕКТРОЛИЗА Майкл Фарадей на основе экспериментов с различными
ЗАКОН ЭЛЕКТРОЛИЗА Майкл Фарадей на основе экспериментов с различнымиэлектролитами установил, что при электролизе масса m
выделившегося на электроде вещества пропорциональна
прошедшему через электролит заряду ∆q или силе тока I
и времени ∆t прохождения тока:
где z — валентность атома (иона)
вещества, e — заряд электрона
Фарадея
– постоянная
Это уравнение называется законом электролиза.
Коэффициент k, зависящий от выделившегося вещества,
называется электрохимическим эквивалентом вещества.
К оглавлению
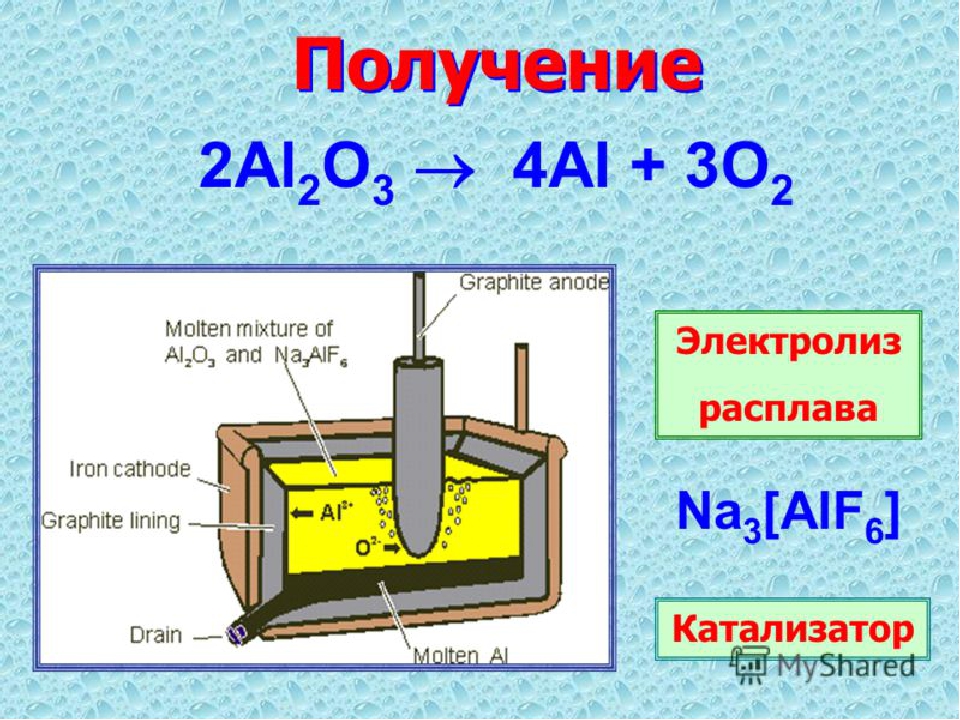
9. ПРИМЕНЕНИЕ ЭЛЕКТРОЛИЗА В ТЕХНИКЕ
Покрытие металлов слоем другого металла при помощиПРИМЕНЕНИЕ
ЭЛЕКТРОЛИЗА В
электролиза (гальваностегия)
Гальванопластика — процесс осаждения металла на форме,
ТЕХНИКЕ
позволяющий создавать идеальные копии исходного предмета.
⦿
⦿
⦿
Электрометаллургия — методы получения металлов, основанные на
электролизе, т. е. выделении металлов из растворов или расплавов их
соединений при пропускании через них постоянного электрического
тока.

⦿
Рафинирование металлов – очистка металлов от примесей
К оглавлению
10. ВЫВОДЫ
ВыводыВЫВОДЫ
⦿
При растворении электролитов под влиянием электрического поля
полярных молекул воды происходит распад молекул электролитов на
ионы – этот процесс называется электролитической диссоциацией.
⦿
При тепловом (хаотическом) движении может происходить обратный
процесс – рекомбинация – ионы разных знаков при встрече могут снова
объединиться в нейтральные молекулы. В растворе электролита
наряду с ионами находятся и молекулы.
⦿
Масса вещества, выделившегося на электроде за время t при
прохождении электрического тока, пропорциональна силе тока и
времени. Это утверждение, полученное нами теоретически, впервые
было установлено экспериментально Фарадеем, носит название
закона электролиза Фарадея.
К оглавлению
11. ТЕСТ
1. Какова физическая природа электропроводности в электролитах?а) Ионная.
б) Электронная.
в) Смешанная
2. Укажите неверный ответ.
а) Все жидкости являются электролитами.
б) Жидкости могут быть диэлектриками, проводниками, полупроводниками.
в)Растворы солей, щелочей, кислот и расплавленные соли, обладающие
электрической проводимостью, называются электролитами.
3. Электролитической диссоциацией называется…
а) образование положительных и отрицательных ионов при растворении
веществ в жидкости.
б) процесс выделения на электродах веществ, входящих в состав электролита.
в) объединение ионов разных знаков в нейтральные молекулы.
4. Рекомбинацией называется …
а)объединение ионов разных знаков в нейтральные молекулы.
б)процесс выделения на электродах веществ, входящих в состав электролита.
в)образование положительных и отрицательных ионов при растворении
веществ в жидкости.
5)Электролизом называется …
1. процесс выделения на электродах веществ, входящих в состав электролита.

2. объединение ионов разных знаков в нейтральные молекулы.
3. образование положительных и отрицательных ионов при растворении веществ в жидкости.
6. С увеличением температуры; электролита, его электропроводность…
1. увеличивается.
2. уменьшается.
3. не изменяется.
7. Согласно первому закону Фарадея масса вещества, выделившегося при электролизе…
1. пропорциональна величине заряда, прошедшего через электролит, и зависит от сорта вещества.
2. зависит только от силы тока, идущего через электролит, и от сорта вещества.
3. зависит только от сорта вещества и времени электролиза.
8. Электрохимическим эквивалентом вещества называют величину, численно равную…
1. отношению массы выделившегося вещества к заряду, прошедшему через раствор.
2. отношению атомной массы к валентности его атомов.
3. отношению валентности его атомов к атомной массе вещества.
4. произведению атомной массы вещества на валентность его атомов.
9. При электролизе металл всегда оседает на…
1.
 катоде.
катоде.2. аноде.
10. Формула первого закона Фарадея для электролиза
1. m=Ikt
2. k=mIt
3. I=mkt
4. t=mIk
К оглавлению
Электрический ток в жидкостях. Движение
ионов. Видеофрагмент.
К оглавлению
14. Задачи
№ 1. Последовательно с электролитической ванной, заполненной солью никеля,включена ванна, в которой находится соль хрома. После размыкания цепи в
первой ванне выделилось 10 г никеля. Сколько хрома выделилось во второй
ванне?
Задачи
Дано:
Решение:
Ответ: m2 = 5 г.
№ 886. При электролитическом способе получения алюминия используются
ванны, работающие под напряжением 5 В при силе тока 40 кА. Сколько времени
потребуется для получения 1 т алюминия и каков при этом расход энергии?
Дано:
Решение:
Ответ: t = 3,1 суток, А = 15 МВт⋅ч.
Контрольные вопросы:
Какие вещества относятся к электролитам?
Что такое электролиз? Как он происходит?
Что такое ионы?
Величина, характеризующая
состояние равновесия в реакции диссоциации
в гомогенных (однородных) системах
называется – ?
Кто является создателем теории
электромагнитного поля?
Ответы.
К оглавлению
Ответы:
1) Растворы солей, кислот и оснований, способные проводить
электрический ток
2) Прохождение электрического тока через электролит
обязательно сопровождается выделением вещества в твёрдом или
газообразном состоянии на поверхности электродов. Выделение
вещества на электродах показывает, что в электролитах
электрические заряды переносят заряженные атомы вещества –
ионы. Этот процесс называется электролизом.
3) Электрически заряженная частица (атом, группа атомов).
4) Степень диссоциации
5) Степень диссоциации
По типовым технологиям производства
На тему: «ЭЛЕКТРОЛИЗ.
Водные растворы солей»
План
Электролиз – это
совокупность процессов, протекающих в растворе или расплаве электролита, при
пропускании через него электрического тока. Электролиз является одним из
важнейших направлений в электрохимии.
Электролиз является одним из
важнейших направлений в электрохимии.
Электрохимия принадлежит к числу тех немногих наук, дата рождения которых может быть установлена с высокой точностью. Это рубеж XVIII и XIX веков, когда благодаря знаменитым опытам итальянского физиолога Л. Гальвани и созданию итальянским физиком А. Вольта в 1799 г. “вольтова столба” – первого в истории человечества химического источника тока -были сформулированы проблемы, решение которых определило основные задачи электрохимии. “Без химии путь к познанию истинной природы электричества закрыт” – сказал М.В. Ломоносов. И, действительно, как бы следуя словам великого ученого, создавалась и развивается наука – электрохимия.
Еще в начале позапрошлого столетия было
установлено, что при прохождении электрического тока через водные растворы
солей происходят химические превращения, приводящие к образованию новых
веществ. В результате этого, в начале прошлого века возникло научное
направление по изучению электрохимических процессов в растворах и расплавах
веществ – электрохимия. К концу семидесятых годов оно разделилось на два
самостоятельных раздела – ионику, изучающую явления электропроводности и
движения заряженных частиц под воздействием электрического поля, и
электродику, изучающую явления происходящие непосредственно на поверхности
электродов, когда через границу электрод-раствор (расплав) протекает
электрический ток. Химические превращения, происходящие при воздействии
электрического тока на вещества, называются электролитическими.
К концу семидесятых годов оно разделилось на два
самостоятельных раздела – ионику, изучающую явления электропроводности и
движения заряженных частиц под воздействием электрического поля, и
электродику, изучающую явления происходящие непосредственно на поверхности
электродов, когда через границу электрод-раствор (расплав) протекает
электрический ток. Химические превращения, происходящие при воздействии
электрического тока на вещества, называются электролитическими.
Электролиз представляет собой довольно сложную совокупность процессов, к которым относятся: миграция ионов (положительных к катоду, отрицательных к аноду), диффузия ионов, разряжающихся на электродах, электрохимические реакции разряда ионов, вторичные химические реакции продуктов электролиза между собой, с веществом электролита и электрода.
Технический или
прикладной электролиз характеризуется сложностью протекающих в промышленных
условиях электролитических процессов, различными видами электролиза, их
зависимостью от природы электролита, типа электролитической ванны,
оптимизации самих электролизных процессов.
Электролитические процессы классифицируются следующим образом:
получение неорганических веществ(водорода, кислорода, хлора, щелочей и т.д.)
· получение металлов (литий, натрий, калий, бериллий, магний, цинк, алюминий, медь и т.д.)
· очистка металлов (медь, серебро, …)
· получение металлических сплавов
· получение гальванических покрытий
· обработка поверхностей металлов (азотирование, борирование, электрополировка, очистка)
· получение органических веществ
· электродиализ и обессоливание воды
· нанесение пленок при помощи электрофореза
Актуальность электролиза объясняется тем, что
многие вещества получают именно этим способом. Например, такие металлы как
никель, натрий, чистый водород и другие, получают только с помощью этого
метода. Кроме того с его помощью электролиза относительно легко можно
получить чистые металлы, массовая доля самого элемента в которых стремиться
к ста процентам. В промышленности алюминий и медь в большинстве случаев
получают именно электролизом. Преимущество этого способа в относительной
дешевизне и простоте. Однако чтобы производство было наиболее выгодным: с
наименьшими затратами электроэнергии и с наибольшим выходом продукции,
необходимо учитывать различные факторы, влияющие на количество и качество
продуктов электролиза (сила тока, плотность тока, температура электролита,
материал электродов и др.).
Кроме того с его помощью электролиза относительно легко можно
получить чистые металлы, массовая доля самого элемента в которых стремиться
к ста процентам. В промышленности алюминий и медь в большинстве случаев
получают именно электролизом. Преимущество этого способа в относительной
дешевизне и простоте. Однако чтобы производство было наиболее выгодным: с
наименьшими затратами электроэнергии и с наибольшим выходом продукции,
необходимо учитывать различные факторы, влияющие на количество и качество
продуктов электролиза (сила тока, плотность тока, температура электролита,
материал электродов и др.).
На сегодняшний день большой популярностью пользуются различные предметы, покрытые драгоценными металлами. (позолоченные или посеребренные вещи).
К тому же металлические изделия покрывают слоем другого металла электролитическим способом целью защитить его от коррозии.
Таким образом, исследование электрохимических
процессов, определение факторов, влияющих на них, установление новых
способов использования процессов электролиза в промышленных условиях
сохранило свою актуальность и востребованность в наши дни.
В своей работе нами были определены следующие задачи:
— ознакомление с теоретическими основами электролитических процессов;
— определить влияние различных факторов на качественный и количественный состав продуктов электролиза;
— выделить области практического применения электролиза;
— экспериментально определить влияние качественного состава исходного электролита на состав продуктов электролиза.
Теоретическое обоснование процессов электролиза.
Электролиз протекает только в тех средах, которые проводят электрический ток. Способностью проводить ток обладают также водные растворы оснований и солей. Безводные кислоты – очень плохие проводники, но водные растворы кислот хорошо проводят ток. Растворы кислот, оснований и солей в других жидкостях в большинстве случаев тока не проводят, но и осмотическое давление таких растворов оказывается нормальным, точно так же не проводят тока водные растворы сахара, спирта, глицерина и другие растворы с нормальным осмотическим давлением.
Различные отношения веществ к электрическому току можно иллюстрировать следующим опытом.
Соединим провода идущие от осветительной сети, с двумя угольными электродами. В один из проводов включим электрическую лампу, позволяющую грубо судить о наличии тока в цепи. Погрузим теперь свободные концы электродов в сухую поваренную соль или безводную серную кислоту. Лампа не загорается, т.к. эти вещества не проводят тока и цепь остается не замкнутой. То же самое происходит, если погрузить электроды в стакан с чистой дистиллированной водой. Но стоит только растворить в воде немного соли или прибавить к ней какой-нибудь кислоты или основания, как лампа тотчас же начинает ярко светиться. Свечение прекращается если опустить электроды в раствор сахара или глицерина и т.п.
Таким образом, среди растворов способностью проводить ток обладают преимущественно водные растворы кислот, оснований и солей. Сухие соли, безводные кислоты и основания (в твердом виде) тока не проводят; почти не проводит тока чистая вода, очевидно, что при растворении в воде кислоты основания или соли подвергаются каким-то глубоким изменениям, которые и обуславливают электропроводность получаемых растворов.
Электрический ток, проходя через растворы, вызывает в них, так же как и в расплавах, химические изменения, выражающиеся в том, что из растворов выделяются продукты разложения растворенного вещества или растворителя. Вещества, растворы которые проводят электрический ток, получили названия электролитов. Электролитами являются кислоты, основания и соли.
Химический процесс, происходящий при пропускании тока через раствор электролита, называется электролизом. Исследуя продукта, выделяющиеся у электрода, при электролизе кислот, оснований и солей, установили, что у катодов всегда выделяются металлы и водород, а у анода кислотные остатки или гидроксильные группы, которые затем подвергаются дальнейшим изменениям. Таким образом, первичными продуктами электролиза оказываются те же части кислот, оснований и солей, которые при реакциях обмена, не изменяются, переходят из одного вещества в другое.
Теперь, рассмотрим процесс электролиза подробнее.
Через проводники первого рода электричество переносится электронами, а через проводники второго рода—ионами. В тех местах электрической цепи, где проводник первого рода граничит с проводником второго рода, электроны вступают во взаимодействие с ионами — происходят электрохимические процессы. Если эти процессы протекают самопроизвольно, то система называется химическим источником энергии. Если же их протекание обусловлено подводом электрической энергии извне, то происходит электролиз.
Примером электролиза может служить электролиз расплава хлорида магния. При прохождении тока через расплав MgCl2 катионы магния по действием электрического поля движутся к отрицательному электроду. Здесь, взаимодействуя с приходящими по внешней цепи электронами, они восстанавливаются.
Mg2++2e–=Mg
Анионы хлора перемещаются к положительному электроду, и, отдавая избыточные электроны, окисляются. При этом первичным процессом является собственно электрохимическая стадия—окисление ионов хлора
2Cl–=2Cl+2e–
а вторичным — связывание образующихся атомов хлора в молекулы:
2Cl=Cl2
Складывая уравнения процессов, протекающих у электродов, получим суммарное уравнение окислительно-восстановительной реакции, происходящей при электролизе расплава MgCl2:
Mg2+ + 2Cl-l=Mg + Cl2
Эта реакция не может протекать самопроизвольно; энергия, необходимая для её осуществления, поступает от внешнего источника тока.
Как и в случае химического источника электрической энергии, электрод, на котором происходит восстановление, называется катодом; электрод, на котором происходит окисление, называется анодом. Но при электролизе катод заряжен отрицательно, а анод — положительно, т.е. распределение знаков заряда электродов противоположно тому, которое имеется при работе гальванического элемента. При электролизе химическая реакция осуществляется за счёт энергии электрического тока, подводимой извне, в то время как при работе гальванического элемента энергия самопроизвольно протекающей в нем химической реакции превращается в электрическую энергию.
При рассмотрении электролиза растворов нельзя упускать из виду, что, кроме ионов электролита, во всяком водном растворе имеются ещё ионы, являющиеся ещё продуктами диссоциации воды—Н+ и ОН–.В электролитическом поле ионы водорода перемещаются к катоду, а гидроксила—к аноду. Таким образом, у катода могут разряжаться как катионы электролита, так и катионы водорода. Аналогично у анода может происходить разряд, как анионов электролита, так и ионов гидроксила. Кроме того, молекулы воды также могут подвергаться электрохимическому окислению или восстановлению.
Какие именно электрохимические процессы будут протекать у электродов при электролизе, прежде всего, будет зависеть от соотношения электродных потенциалов соответствующих электрохимических систем. Это означает, что на катоде будут восстанавливаться окисленные формы электрохимических систем. Из нескольких возможных процессов будет протекать тот, осуществление которого сопряжено с минимальной затратой энергии. Это означает, что на катоде будут восстанавливаться окисленные формы электрохимических систем, имеющих наибольший электродный потенциал, а на аноде будут окисляться восстановленные формы систем с наименьшим электродным потенциалом. На протекание некоторых электрохимических процессов оказывает тормозящее действие материал электрода; такие случаи оговорены ниже.
Рассматривая катодные процессы, протекающие при электролизе
водных растворов, нужно учитывать величину потенциала процесса
восстановления ионов водорода. Этот потенциал зависит от концентрации ионов
водорода и в случае нейтральных растворов (рН=7) имеет значение
φ=-0,059*7=-0,41 В. Отсюда ясно, что если электролит образован металлом,
электродный потенциал которого значительно положительнее, чем –0,41 В, то из
нейтрального раствора у катода будет выделяться металл. Такие металлы
находятся в ряду напряжений вблизи водорода (начиная приблизительно от
олова) и после него. Наоборот, в случае электролитов, металл которых имеет
потенциал значительно более отрицательный, чем –0,41 В, металл
восстанавливаться не будет, а произойдёт выделение водорода. К таким
металлам относятся металлы начала ряда напряжений—приблизительно до титана.
Наконец, если потенциал металла близок к величине –0,41 В (металлы средней
части ряда—Zn,Cr,Fe,Ni),
то в зависимости от концентрации раствора и условий электролиза возможно как
восстановление металла, так и выделение водорода; нередко наблюдается
совместное выделение металла и водорода.
Электрохимическое выделение водорода из кислых растворов происходит вследствие разряда ионов водорода. В случае же нейтральных или щелочных сред оно является результатом электрохимического восстановления воды:
2Н2О + 2е– =Н2 + 2ОН–
Таким образом, характер катодного процесса при электролизе водных растворов определяется прежде всего положением соответствующего металла в ряду напряжений. В ряде случаев большое значение имеют р.-Н. раствора, концентрация ионов металла и другие условия электролиза.
При рассмотрении анодных процессов следует иметь в виду, что материал анода в ходе электролиза может окисляться. В связи с этим различают электролиз с инертным анодом и электролиз с активным анодом. Инертным называется анод, материал которого не претерпевает окисления в ходе электролиза. Активным называется анод, материал которого может окисляться в ходе электролиза. В качестве материалов для инертных анодов чаще применяют графит уголь, платину.
На инертном аноде при электролизе водных растворов щелочей, кислородсодержащих кислот и их солей, а также фтористоводородной кислоты и фторидов происходит электрохимическое окисление воды с выделением кислорода. В зависимости от р.-Н. раствора этот процесс протекает по-разному и может быть записан различными уравнениями. В щелочной среде уравнение имеет вид
4ОН– =О2 + 2Н2О + 4е–
а в кислой или нейтральной:
2Н2О =О2 + 4Н+ + 4е–
В рассматриваемых случаях электрохимическое окисление воды является энергетически наиболее выгодным процессом. Кислородсодержащие анионы или не способны окисляться, или их окисление происходит при очень высоких потенциалах. Например, стандартный потенциал окисления иона SO42-
2SO42- =S2O82- + 2e–
равен 2,010 В, что значительно превышает стандартный потенциал окисления воды (1,228 В). Стандартный потенциал окисления иона F– имеет ещё большее значение (2,87 В).
в ряду стандартных электродных потенциалов. Эта аномалия связана со значительным перенапряжением второго из этих двух электродных процессов—материал анода оказывает тормозящее действие на процесс выделения кислорода.
Законы Фарадея
1. Закон Фарадея.
Масса вещества, выделившегося на электроде при прохождении по раствору электролита электрического тока, прямо пропорциональна количеству электричества.
∆m=kэQ
где ∆m
– количество прореагировавшего вещества;
Q – количество электричества;
kэ – коэффициент пропорциональности, показывающий, сколько вещества
прореагировало при прохождении единицы количества электричества. Величина,
k
называется электрохимическим эквивалентом.
k=M/(NAz│e│)
где z – валентность иона; M – молярная масса вещества, выделившегося на электроде; NA—постоянная Авогадро. │e│= 1,6• 10-19Кл.
2. Закон Фарадея.
Согласно второму закону Фарадея, при определённом количестве прошедшего электричества отношения масс прореагировавших веществ равно отношению их химических эквивалентов:
∆m1/A1 =∆m2/A2=∆m3/A3=const
Химический эквивалент элемента, равен отношению части массы элемента, которая присоединяет или замещает в химических соединениях одну атомную массу водорода или половину атомной массы кислорода, к 1/12 массы атома С12. Понятие “ химический эквивалент” применимо и к соединениям. Так, химический эквивалент кислоты численно равен ее молярной массе, деленной на основность (число ионов водорода), химический эквивалент основания – его молярная массе, деленной на кислотность (у неорганического основания – на число гидроксильных групп), химический эквивалент соли – ее молярной массе, деленной на сумму зарядов катионов или анионов.
Факторы от которых зависит электролиз
Эффективность электролиза оценивают рядом факторов, к которым относятся: сила тока, напряжение, плотность тока, КПД источника тока, выход по току, выход по веществу, коэффициент полезного действия электроэнергии (выход по энергии), расход электроэнергии на единицу полученного продукта.
Сила тока или нагрузка на электролизёр характеризуют его производительность. Чем выше сила тока, пропускаемого через электролизёр, тем больше продукта можно получить при эксплуатации данного электролизёра. Наблюдается тенденция к созданию мощных электролизёров, рассчитанных в некоторых случаях на десятки и сотни тысяч Ампер (производство хлора, алюминия и т.д.) напряжение на электролизёре складывается из нескольких составляющих:
U=ea-ek + ∆ea + ∆ek + eэл.-eдиафр.+ eконт.
где: U—общее напряжение на ячейке; ea и ek – равновесные потенциалы анодной и катодной реакции; eэл. и eдиафр – падение напряжения в электролите и в диафрагме; eконт.—падение напряжения в контактах. Сумма ea-ek называется напряжением разложения. Эта величина соответствует расходу на электролиз электроэнергии, которая идёт непосредственно на изменение внутренней энергии веществ.
При электролизе стремятся к уменьшению напряжения на ячейке за счёт величины поляризации и омического состояния баланса напряжения, то есть слагаемых, обусловленных необратимостью процесса. Напряжение разложения обусловлено природой реагирующего вещества, а поэтому не может быть изменено. Значения ∆ek и ∆ea могут быть изменены в зависимости от характера электрохимической реакции, протекающей на электроде, путём перемешивания, повышения температуры электролита, изменения состояния поверхности электрода и за счёт ряда других факторов.
Падение напряжения в электролите, выражаемое уравнением R=ρl/s, где ρ—удельное сопротивление электролита, Ом·см, l—расстояние между электродами, см (без учета диафрагмы), S—площадь поперечного сечения электролита, через которую проходит электрический ток см2, может быть уменьшено, как следует из приведённого выражения, сближением электродов, введением в раствор более электроотрицательных добавок, а также повышением температуры. Если электролиз сопровождается образованием газов, то приведённое выше выражение не всегда точно соответствует падению напряжения в электролите. Это объясняется тем, что выделяющиеся на электродах пузырьки газов уменьшают активное сечение электролита S и удлиняют путь тока от одного электрода к другому. Это явление называется газонаполнением, которое может быть определено как отношение объёма занимаемого в данный момент пузырьком воздуха к общему объёму электролитической ячейки. Влияние газонаполнения на электропроводность электролита может быть учтено с помощью следующего выражения:
ρ/ρ0=1-1.78φ+φ2
где ρ и ρ0 – соответственно удельные сопротивления сплошного и газонаполненного электролита, φ – газонаполнение. Величина φ может быть уменьшена повышением температуры, а также особым устройством электродов, обеспечивающих свободное удалением газов из ячейки.
Падение напряжения в диафрагме было оценено при решении вопроса о роли диафрагмы в электролизе. Что касается падения напряжения в контактах, то эта величина зависит от совершенства контактов, чистоты контактирующих поверхностей. Существует довольно много конструктивных решений электродных контактов.
Коэффициентом полезного использования напряжения называется отношение напряжения разложения к общему напряжению на ванне:
ηнапр=( ea-ek)/U
Плотностью тока называется отношение силы, проходящего через электролит тока к величине поверхности электрода; измеряют в А/см2 (дм2 или м2). В промышленности работают с различными плотностями тока – от нескольких сотен А/см2 (гальваностегия, гидроэлектрометаллургия, производство Хлора) до нескольких тысяч А/см2 (электролиз расплавов, электросинтез и т.д.)
Величина плотности тока характеризует количество продукта, получаемого с единицы электродной поверхности, т.е. продуктивность электролизёра. Поэтому, если повышение плотности тока не вызывает падения выхода продукта электролиз, стремятся к проведению процесса с максимально возможными плотностями тока. Однако при выборе оптимальных значений плотностей тока в некоторых случаях необходимо принимать во внимание увеличение себестоимости продукта за счёт повышения расхода электроэнергии на электролиз вследствие увеличения напряжения с ростом плотности тока. При электролизе ток, который пропускают через электролит, может расходоваться на несколько параллельных электрохимических реакций. Например, при электролизе водных растворов реакциям электрохимического окисления или восстановления, сопутствует реакция разложения воды на О2 и Н2, выделяющиеся соответственно на аноде и катоде. При электролизе, криолитоглиноземных расплавов ток в определённых условиях может расходоваться не только на выделение алюминия, но и на образование на катоде металлического натрия.
Следовательно, пропускаемый через электролит ток распределяется между несколькими процессами, протекающими на данном электроде одновременно:
I=i1+i2+i3+…+i n
где: I
– ток, протекаемый через электролизёр;
i1 и i2 – ток, расходуемый в единицу на первую и второю электролитическую реакцию.
Для того чтобы учитывать эффективность использования пропущенного через электролизёр количества электричества на образования того или иного продукта вводится понятие выхода по току.
Выход по току – отношение количества теоретически необходимого для получения того или иного количества электричества (по закону Фарадея) к практически затраченному количеству электричества. С целью уменьшения затрат электроэнергии на побочные электрохимические реакции и повышения по току стремятся проводить электролиз в таких условиях, при которых затруднено разложение растворителя, т.е. велика поляризация при окислении или восстановлении растворителя (например перенапряжение кислорода или водорода). Это достигается повышением плотности тока, изменением температуры электролита, подбором материала электролита и т. д.
Выход по веществу – это отношение количества
полученного в результате электрохимических реакций продукта к тому
количеству, которое должно образоваться теоретически, исходя из данной
загрузки исходного продукта. КПД использования электроэнергии (выход по
энергии) – это отношение теоретически необходимого для получения единицы
количества вещества электроэнергии к практически израсходованному.
Теоретически необходимое количество электроэнергии – то количество ее,
которое было бы необходимым для получения единицы количества вещества, если
бы процесс происходил со 100% выходом по току и при напряжении, равном
напряжению разложения. Следовательно, выход по энергии может быть определен
по формуле:
η э = Wп/N=η тока * η напр
Выход по току ηтока и по веществу, а
также коэффициент полезного действия использования электроэнергии ηнапр обычно измеряют в процентах. Расход электроэнергии обычно относят к
единице произведенного количества продукта измеряют в Вт ч/кг или кВт ч/т.
Для расчета расхода электроэнергии постоянного тока на 1т произведенного
электролизом продукта можно воспользоваться следующей формулой:
W=1*106*U/k
η тока *1000
где: W
– расход электроэнергии постоянного тока кВтч/т;
U – напряжение на электролизере,
В; k
электрохимический эквивалент, грамм/а*r;
ηтока – выход по току, доли единицы; 1000 – коэффициент для
перевода вт*ч в квт*ч. Расход электроэнергии переменного тока на единицу
произведенного продукта может быть определен делением расхода электроэнергии
постоянного тока на то же количество коэффициента при образовании
переменного тока в постоянный.
Между временем пропускания через раствор или расплав электролита электрического тока (количеством электричества) и количеством образующегося и расходуемого вещества имеются строгие количественные соотношения, определяемые законами Фарадея.
Электродный потенциал
Если металл погрузить в воду, то его катионы начнут переходить в жидкость. Благодаря наличию электрического заряда у катиона на поверхности металла остается равный по величине, но противоположный по знаку заряд в виде избыточных электронов, то есть поверхность металла становиться отрицательно заряженной. Она начинает притягивать к себе положительно заряженные ионы металла, которые уже перешли в раствор и, таким образом, катионы не могут свободно перемещаться в объем раствора. Поэтому на границе металла с раствором возникает двойной электрический слой, который можно представить себе в виде плоского конденсатора, отрицательная обкладка которого – это поверхность металла, а положительная – соприкасающийся с ним слой растворенных ионов. Уже после растворения очень небольшого числа ионов заряд двойного слоя настолько возрастает, что дальнейшее растворение металла прекращается.
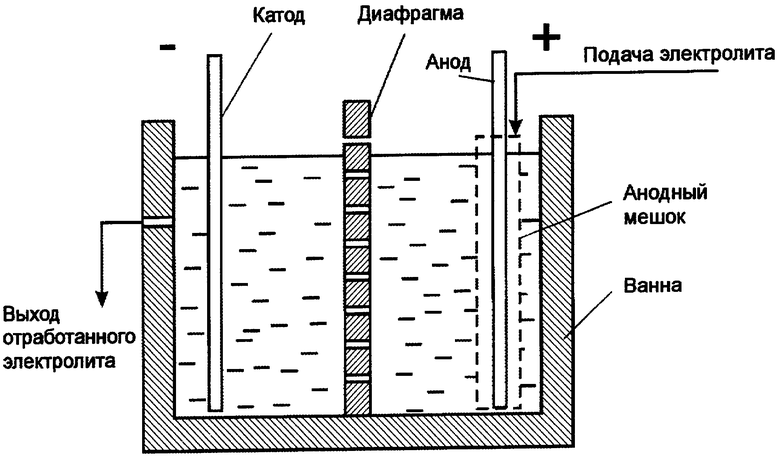
Диафрагма
В тех случаях, когда необходимо исключить взаимодействие продуктов электролиза, образующихся на аноде и катоде, в электролизёр вводится пористая перегородка – диафрагма, разделяющая его минимум на два электродных пространства – анодное и катодное. Раствор, заливаемый в анодное пространство, называется анолитом, в катодное – католитом. Диафрагмы бывают погружённые и фильтрующие. Погружённые диафрагмы должны иметь диффузионное сопротивление и быть селективно проницаемы лишь для ионов электролита, но задерживать продукты электролиза. Фильтрующие диафрагмы, обладающие низким диффузионным сопротивлением применяют в тех случаях, когда, электролиз проводят в противоположном направлении – электролит перетекает через диафрагму из одного электродного пространства в другое, навстречу движению ионов, обуславливающих электропроводность раствора.
Диафрагмы характеризуются объёмной пористостью, протекаемостью, электрическим сопротивлением. Объёмная пористость диафрагмы, характеризуемая долей объёма пор к общему объёму диафрагмы, определяется уравнением
g=1-d каж/d ист
где dкаж — кажущаяся плотность диафрагмы, dист – истинная плотность. Объёмная пористость измеряется в долях единицы или процентах. Протекаемость диафрагмы p зависит от площади диафрагмы, поверхности диафрагмы (S м2), толщины (δ см), гидростатическое давление h (см. вод. ст.), вязкости η (спуаз) и времени протекания r (час).
p=kShr/δ η
где k – коэффициент протекаемости, величина, характерная для данного вида диафрагмы. Электрическое сопротивление диафрагмы R может быть определено из следующего соотношения:
R=ρδβ2/gS
где – β
– коэффициент извилистости пор, показывающий, во сколько раз длина поры
превышает длину диафрагмы.
Диафрагмы должны обладать хорошей химической стойкостью в условиях электролиза и достаточной механической прочностью. Материалом для изготовления диафрагмы служат асбест, керамика, пластмассы. В некоторых случаях, например при электролиз расплавов, применяют металлические диафрагмы. В последние годы в процессе электролиза получают распространение ионитовые диафрагмы, проницаемые только для ионов одного заряда (катионы или анионы) не только препятствует взаимодействию продуктов электролиза, но и позволяют предотвратить или существенно уменьшить образование окисления или восстановления этих продуктов на электродах. В этом случае применяют либо погруженные диафрагмы, либо ионитовые.
Количественное описание электролитических процессов.
Электролиз связан с наложением определённого электрического поля, под действием которого в электролите могут возникать некоторые характерные процессы. Электрокинетические процессы происходят в тех случаях, когда одна фаза диспергированна в другой; к их числу относится электрофорез – движение взвешенных твёрдых частиц внутри жидкости. При наложении электрического поля наблюдается явление электроосмоса – движение жидкости относительно твердого тела.
Аппарат для электролиза называется электролизёром или электролитической ванной. Простейшая схема электролизёра представлена на рис. 1. Корпус электролизёра изготовляют из стали, керамики, пластмассы, стекла. Для защиты от коррозии и действия высоких температур корпус электролизёра иногда изнутри гумлеируют, выкладывают пластмассой, огнеупорным кирпичом или коррозионностойкими в данной среде металлами. Для поддержания определённого теплого режима в некоторых случаях снабжают теплоизоляцией.
Для изготовления катодов применяют сталь, многие цветные металлы, ртуть, свинец, платину, цинк, олово, медь, алюминий, сплавы металлов, уголь или графит. Аноды бывают растворимые и нерастворимые. Растворимые аноды изготавливают из вышеупомянутых цветных металлов, углеродной стали, некоторых других сплавов, нерастворимые аноды – из платины, графита или угля, никеля, нержавеющей стали, двуокиси свинца, двуокиси марганца, магнетита., в некоторых случаях используют биометаллические аноды, у которых тонкий слой драгоценного металла, например платины, наносится на токопроводящую основу из другого металла, инертного в данном электролите и в данных условиях. Материал для электрода выбирается с учётом многих факторов – природы исходного и конечного продуктов электролиза, природы электролита, условий проведения процесса и т.д.
Электролитами могут быть минеральные или органические кислоты, соли и их смеси. В некоторых случаях электролит одновременно является исходным веществом для получения того или иного продукта электрохимического окисления или восстановления, в других случаях – лишь токопроводящей добавкой. Растворителями для электролитов служат вода, спирты, пиридин, диметилформальдегид, ацетонитрил и некоторые другие органические соединения или их смеси. Электролиз можно проводить и без растворителя, в расплаве электролита или смеси электролитов.
Электролиз широко применяется в различных отраслях промышленности. В химической промышленности электролизом получают такие важные продукты как хлор и щелочи, хлораты и перхлораты, надсерную кислоту и персульфаты, перманганат калия, органические соединения, химически чистые водород, кислород, фтор и ряд других ценных продуктов.
В цветной металлургии электролиз используется для рафинирования металлов, для извлечения металлов из руд. Металлы, которые не могут быть выделены из водных растворов вследствие высокого отрицательного потенциала получают в цветной металлургии электролизом расплавленных сред, в качестве которых служат соли этих металлов, содержащие добавки различных соединений, вводимые с целью понижения температуры плавления расплава, повышения электропроводности и т.д. К числу металлов, получаемых электролизом расплавленных сред относятся алюминий, магний, цирконий, титан, уран, бериллий и ряд других металлов.
Электролиз применяют во многих отраслях машиностроения, радиотехники, электронной, полиграфической промышленности для нанесения тонких покрытий металлов на поверхность изделий для защиты их от коррозии, придания декоративного вида, повышения износостойкости, жаростойкости, получения металлических копий.
В основу классификации промышленных ванн могут быть положены различные признаки. Например, по типу полярности ванны могут быть монополярными, биполярными и комбинированными.
В промышленных ваннах применяются различные типы катодов: неподвижные цельнометаллические, подвижные цельнометаллические(лента), неподвижные пористые неметаллические, насыпные металлические и т.д.
Аноды же могут быть расходуемые(вступающие в химическую реакцию),
растворимые твердые, растворимые жидкие, нерастворимые твердые и пористые, нерастворимые.
Сочетание вышеперечисленных типов анодов и катодов с учетом целей электролиза приводит к следующим типам электролизеров: горизонтальные с жидким ртутным катодом, с вертикальными катодами и фильтрующей диафрагмой, с горизонтальной диафрагмой, с проточным электролитом, с движущимися электродами, с насыпными электродами и т.д.
Для электролиза могут быть использованы следующие типы электролитов: водные растворы солей, кислот, оснований; неводные растворы в неорганических растворителях; неводные растворы в органических растворителях ; расплавленные соли; твердые электролиты; газы.
К лучшим материалам для нерастворимых анодов относятся специальные сорта графита, двуокись свинца, магнетит, композиции на основе тантала и титана.
Несмотря на большое разнообразие электролитов, электродов, электролизеров, имеются общие проблемы технического электролиза. К ним следует отнести перенос зарядов, тепла, массы, распределение электрических полей. Для ускорения процесса переноса целесообразно увеличивать скорости всех потоков и применять принудительную конвекцию. Электродные процессы могут контролироваться путем измерения предельных токов.
При проектировании любого электрохимического производства необходимо выяснить все возможности оптимизации электролизных процессов. Оптимизация условий электролиза имеет большое значение как при составлении энергетического баланса, так и при определении капиталовложений.
Оптимизации должны быть подвергнуты число ванн, способы очистки электролита, конструкции ванн, материалы электродов, типы электродов. Кроме того очень важно оценить оптимальные значения силы тока, сопротивления электролизной ячейки.
Экспериментальная часть.
Электролиз проводился при силе тока 2 А. Электролизер состоял из стеклянной электролитической ванны и графитовых электродов.
Электролиз водных растворов меди – Энциклопедия по машиностроению XXL
Экстракция 65, 182, 224 Электролиз водных растворов меди 170 [c.439]Электролиз водных растворов Медь, железо, свинец, олово 0,1—30 Пористые подшипники, щетки электромашин, контакты, магнитные материалы [c.104]
Электролиз. Электролиз водных растворов является наиболее распространённым методом для изготовления медных порошков. При электролизе меди осадок отлагается на катоде непосредственно в порошкообразном виде. Отложению на катоде порошкообразного, легко удаляемого и дисперсного осадка благоприятствуют малая концентрация ионов металла в исходном растворе, низкая температура и высокая плотность тока. Регулируя эти условия, а также циркуляцию электролита, с повышением которой уменьшается дисперсность порошка, можно получить продукцию с желаемой характеристикой. [c.531]
Электролитическое рафинирование меди (электролиз водных растворов) [c.443]
Электролитическое рафинирование меди (электролиз водных растворов). ………………….443 [c.9]
Технологически более просто получать порошки электролизом водных растворов. Катодный осадок извлекают из электролитической ванны, промывают в холодной воде, снимают с катода и при необходимости подвергают размолу. Этим методом изготавливают порошки железа, меди, никеля и других металлов. [c.18]
Сплавы индия с таллием обычно получают методом прямого сплавления. В работе [28] описан метод получения покрытий из этих сплавов на меди электролизом водных растворов их солей. [c.496]
Электролиз водных растворов и расплавленных сред — второй по значению (после способа восстановления) способ можно получать порошки почти всех металлов получаемые порошки являются весьма чистыми благодаря очистке от примесей в процессе электролиза, однако стоимость получаемых порошков очень высока из-за низкой производительности и больших затрат электроэнергии получают порошки железа, никеля, меди, тантала, титана, тория, бериллия, серебра, хрома, марганца и различных сплавов на основе железа, никеля, меди. [c.14]
Производство металлических порошков методом электролиза водных растворов в настоящее время с успехом конкурирует с другими методами, особенно в области получения таких технически важных металлов, как медь и железо. [c.100]
Защитными и одновременно декоративными являются никелевые, хромовые, многослойные из меди—никеля—хрома, серебряные, золотые покрытия. Нанесение этих металлов в основном производится гальваническим методом, основанным на электролизе водных растворов солей металла, предназначенного для покрытия. Защищаемый металл помещают в ванну в качестве катода, а анодом является металл, предназначенный для покрытия. [c.210]
В ряду напряжений легкие металлы расположены значительно ниже водорода и их не удается выделить электролизом из водных солей по аналогии с медью, никелем и цинком, так как на катоде при электролизе водных растворов солей алюминия, магния и других легких металлов выделяется водород. Поэтому многие легкие металлы получают электролизом расплавленных солей, не содержащих ионов водорода. Кроме того, электроотрицательный характер легких металлов предъявляет очень высокие требования к чистоте всех материалов, поступающих на электролиз. Присутствующие в этих материалах примеси или комплексы [c.365]
Электролизом водных растворов получаются. порошки меди, железа, кобальта, никеля, хрома, олова, свинца, серебра. Порошки металлов, осаждение к-рых в водных растворах затруднительно, получают электролизом расплавленных солей при темп-рах ниже точки плавления металла. Таким путем можно получать порошки W, Мо, Сг, Т1, Та, и и других металлов. Существенной трудностью при электролизе расплавленных сред является отделение металлич. порошка от солей. [c.394]
Технологически более просто получать порошки электролизом водных растворов. Катодный осадок извлекают из электролитической ванны, промывают в холодной воде, снимают с катода и при необходимости подвергают размолу. Этим методом изготавливают порошки железа, меди, никеля и других металлов. Электролизом расплавов солей получают порошки тугоплавких металлов, таких как цирконий, хром, титан, тантал н другие, которые невозможно выделить из водных растворов ввиду их высокого сродства к кислороду. Электролитически можно также получать порошки сплавов способом совместного осаждения компонентов сплава на катоде. [c.68]
Электролитическое получение железного порошка из водных растворов становится более выгодным при комплексной гидрометаллургической переработке некоторых видов сырья цветных металлов (меди, никеля) с попутным получением чистых растворов железных солей. Некоторое количество железных порошков в США и Японии производят электролизом водных растворов. [c.150]
Тамман [12] подвергал электролизу водные растворы сульфатов меди и кадмия при различных соотношениях металла в растворе и при разных плотностях тока и измерял потенциалы полученных сплавов по [c.131]
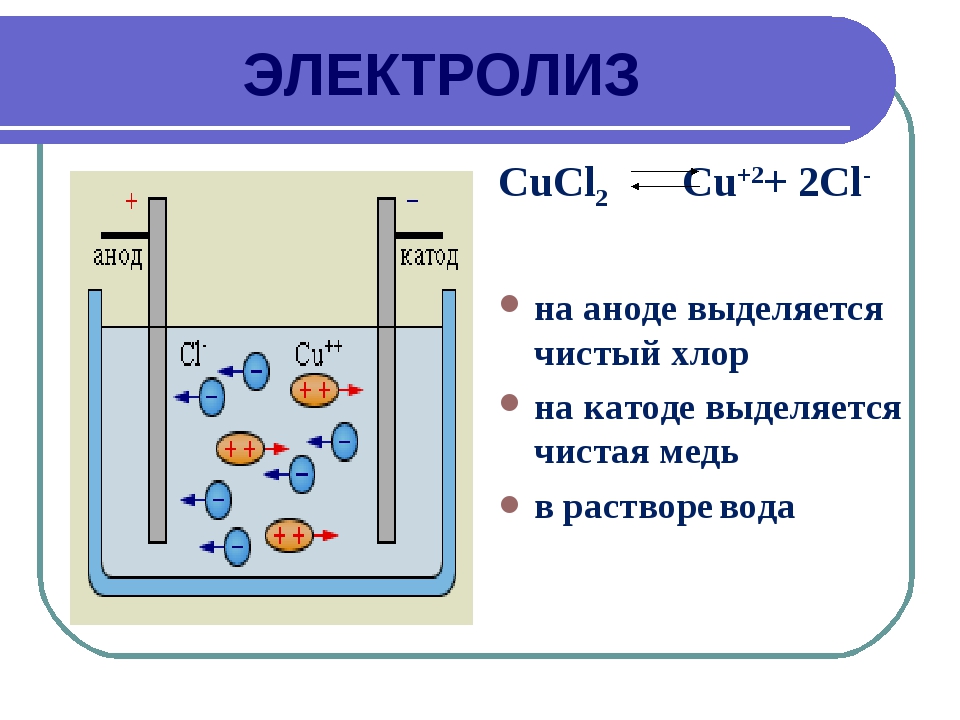
Закон электролиза. Вещества, растворы которых проводят электрический ток, называются электролитами. Вода и кристаллы хлорида меди практически не проводят электрический ток. Раствор хлорида меди в воде является хорошим проводником. При прохождении электрического тока через водный раствор хлорида меди у положительного электрода, называемого анодом, выделяется газообразный хлор. На отрицательном электроде, называемом катодом, выделяется медь. [c.163]
Получение композиционного материала на основе меди, содержащего в качестве упрочнителя вольфрамовую проволоку, описано в работе [87]. По удельной прочности этот материал значительно уступает многим другим композициям и представляет интерес более как модельный материал для исследования напряженного состояния, микромеханики разрушения, чем как конструкционный. При содержании 40 об. % проволоки материал имел прочность, равную 134 кгс/мм , и плотность 13 г/см . Обычный электролит для осаждения медных покрытий содержит водный раствор сернокислой меди (188 г/л) и серной кислоты (74 г/л). Электролиз ведется при комнатной температуре при плотности тока 0,24 А/дм [c.183]
Электролиз Осаждение металлического порошка из водного раствора соли или ее расплава при помощи постоянного электрического тока Медь, железо, кобальт, хром и некоторые тугоплавкие металлы Высокая чистота металла, форма частиц преимущественно дендритная Изделия ответственного назначения и ряд тугоплавких металлов [c.322]
Для обеспечения этого условия можно применить в узле трения коррозионно-стойкий сплав, содержащий медь или металлоплакирующий смазочный материал в виде водного раствора соли меди. Необходимым источником энергии для осуществления процесса осаждения медного слоя является ТЭДС. Процесс осаждения меди на поверхностях трения имеет общую природу с электролизом. Возникновение ТЭДС объясняют явлением Зеебека, согласно которому Б замкнутой электрической цепи возникает ТЭДС, если температура на контактах разная. [c.306]
Электролиз — пропускание постоянного тока через расплав солей или водный раствор металла металл в виде порошка или крупного осадка оседает на катоде. Применяют для получения порошков меди, титана и др. [c.92]
Процесс электролиза основан на следующем принципе. В ванну с 12—16-процентным водным раствором медного купороса в серной кислоте погружают две медные пластины, одну из которых соединяют с положительным полюсом (анодом), а другую — с отрицательным (катодом). При пропускании тока анод будет растворяться, а ионы меди осаждаться на катоде. [c.179]
Процесс электролиза выполняется следующим образом ванну с 12—16%-ным водным раствором медного купороса в серной кислоте погружают две медные пластины, одну из которых соединяют с положительным полюсом (анодом), а другую — с отрицательным (катодом). При пропускании тока анод будет растворяться, а ионы меди осаждаться на катоде. Аноды отливаются из рафинированной огневым способом или из черновой меди в виде плит весом 200—250 кг, размером 0,9 X 0,9 м и толщиной 40—50 мм. В качестве катодов берутся тонкие листы (0,5—0,7 мм) электролитической меди, на которых в течение 10—12 дней осаждается до 100 кг металла. Расход электроэнергии составляет 250—350 квт-ч на 1 т катодной меди. [c.153]
Электролиз расплавленных солей подчиняется тем же основным законам, которые выведены для электрохимии водных растворов. Ток через расплавленные соли проходит так же, как и в водных растворах электролитов, с помощью ионов, поэтому электролиз солевых расплавов подчиняется законам Фарадея. Электропроводность солевых расплавов при высоких температурах несколько выше, чем электропроводность водных электролитов при комнатной температуре. Положение металлов в ряде напряжений для расплавленных солей [364] и в водных электролитах принципиально мало различается между собой. Как и в водных растворах, наиболее отрицательные значения электродных потенциалов имеют щелочные и щелочноземельные металлы более положительные потенциалы имеют сурьма, висмут, медь, ртуть и серебро. Электродные потенциалы одних и тех же металлов в расплавленных хлоридах, бромидах и йодидах сравнительно мало отличаются. Это объяснимо, если считать, что электродные потенциалы металлов в основном определяются, электронным строением атомов, т. е. положением их в периодической системе элементов Д. И. Менделеева. Как и в водных электролитах, электроосаждение металлов из солевых расплавов протекает с поляризацией, однако степень ее значительно меньше, чем в водных растворах. Электролиз расплавленных солей проводится при высоких температурах в электролизерах, обычно имеющих огнеупорную футеровку, диафрагму, отделяющую анодное пространство от катодного. В ряде случаев необходима герметизация электролизера или защитная атмосфера. [c.102]
Медь (из кислой медной ванны) п серебро (из цианистой ванны серебрения) осаждаются в обычной области плотности тока со 100°/о-ным выходом по току. В этих ваннах можно достичь совместного с металлом выделения водорода, если при соответствующих условиях электролиза будет превзойдена область предельной плотности тока. Это наблюдается в ваннах предварительного серебрения. В этом случае поляризационные кривые располагаются согласно рис. 16,а, причем А означает металл, В — водород. Случай, при котором А является водородом, а В — металлом в применяемых для осаждения металла водных электролитах, не встречается, так как для выделения водорода из водных растворов нет предельной плотности тока. Для разряда ионов водорода всегда имеются большие количества воды. [c.42]
Если через водный раствор солей металла пропускать постоянный ток, то они не остаются химически неизменными, как металлические проводники (например, проводник из меди). В зависимости от состава раствора соль разлагается при этом на газообразные, твердые и жидкие составные части. Это и есть электролитическое разложение соли, т. е. электролиз ее. [c.5]
Тамман (О. Таттапп) подвергал электролизу водные растворы сульфатов меди и кадмия при различных соотношениях металла в растворе и при различных плотностях тока и измерял потенциалы полученных сплавов по отношению к кадмию. При этом было установлено, что с уменьшением содержания в электролите меди, осадки становятся по цвету менее похожи на медь, а также уменьшается потенциал сплава по отношению к кадмию. Такое уменьшение разности [c.88]
Производство металлических порошков методом электролиза водных растворов в настоящее время с успехом конкурирует с другими методами, особенно в области получения такого технически важного металла, как медь. Это объясняется рядом преимуществ электролиза по сравнению с другими методами производства порошков. К числу этих преимуществ прежде всего можно отнести высокую чистоту получающихся порошков и хорошие технологические характеристики (прессуе-мость и спекаемость). При использовании этого метода [c.128]
Электролитическое рафинирование проводят для получения чистой от примесей меди (99,95 % Си). Электролиз ведут в ваннах, покрытых изнутри винипластом или свинцом. Аноды делают из меди огневого рафинирования, а катоды — из листов чистой меди. Электролитом служит водный раствор USO4 (10—16 %) и HaS04 (10—16 %). При пропускании постоянного тока анод растворяется, медь переходит в раствор, а на катодах разряжаются ионы меди [c.49]
К химическим методам получения порошков относится восстановление оксидов и солей металлов твердыми или газообразными восстановителями, диссоциация карбонилов и неустойчивых соединений, металлотермия. Большую rpjoiny порошков — олово, серебро, медь и железо — получают методами электролитического осаждения металлов в виде порошка из водных растворов солей, а также электролизом расплавленных сред (тантал, ниобий, уран и др.). [c.781]
К химическим методам получения порошков относят такие методы, которые связаны с изменением химического состава исходного сырья или его агрегатного состояния 1) восстановление окислов металлов из окалины, воздействием на нее водородом или твердым углеродом при высокой температуре (железо, медь, никель, кобальт, вольфрам, молибден и др.), 2) термическая диссоциация карбонилов [химических соединений типа Ре(С0)5, N ( 0)4 и др. ] при давлении 30—40 МнЬл (300—400 кПсм ) и температуре 200—300° С (железо, никель, кобальт), 3) электролиз (осаждение) металлических порошков из водных растворов солей и расплавленных сред соответствующих металлов (олово, серебро, медь, железо, тантал, ниобий, цирконий и т. д.). [c.434]
Кроме бестокового осаждения, употребляют также и обычный электролиз. Тогда и свинец и полоний могут осаждаться или на катоде в виде металлов, или на аноде в виде высших окислов, в зависимости от состава раствора и приложенной разности потенциалов [44, 45, 16, 30, 34]. Висмут большей частью осаждается на катоде [26, 33, 38]. Недавно было обнаружено [10, 3, 32, 33, 34], что протоактиний поддается электроосаждению из водных растворов как на катоде, так и на аноде, однако неясно, в какой химической форме он при этом получается. Радий, который всегда является основанием, был выделен Кюри и Дебьерном электролитически в виде амальгамы на ртутном катоде. Литературу об электролитических работах с макроскопическими количествами урана, радия и тория см. [33]. Такие искусственные радиоэлементы, как медь [56, 58], кадмий [61] и индий [47], легко поддаются электроосаждению. Электролиз радиожелеза в присутствии неактивного железа в качестве носителя использовался при работе с радиоактивны. и индикаторами в биохимии [57, 23]. Наконец, электролиз был применен и к новому элементу 43 (Тс) [19]. Как и в бестоковом осаждении, перемешивание ускоряет процесс использование вращающегося катода [18] было рекомендовано при работе с микроколичествами [9]. [c.30]
Электрометаллургический заключается в вы- плавке металлов и сплавов в дуговых, индукционных и других электрических печах. Кроме того, некоторые металлы получают путем электролиза из расплавов их химических соединений (например, получение алюминия из глинозема А12О3) или же из водных растворов солей (например, рафинирование, т. е. получение чистой меди из раствора сернокислой меди СиЗО . [c.17]
Электролитическое рафинирование обеспечивает получение наиболее чистой, высококачественной меди. Электролиз проводят в дере- вянных или бетонных ваннах, футерованных листовым свинцом, пластмассами и другими кислотостойкими материалами. В качестве электролита используют водный раствор серной кислоты (10—16%) и сернокислой меди USO4 (10—16%). Анодами являются пластины размером 1 X 1 м толщиной 40—50 мм, отлитые из рафинируемой меди. В качестве катодов используют тонкие листы (0,5—0,7 мм), изготовленные из электролитической меди, [c.73]
Электролитическое рафинирование проводят с целью получения чистой от примесей меди (до 99,95% Си). В железобетонные ванны 1 (рис. 38), облицованные изнутри винипластом 2, подвешивают поочередно плиты 4 из меди после огневого рафинирования толщиной 30—45 мм (аноды) и тонкие листы 5 электролитической меди (основы), которые в процессе электролиза служат катодами. В ванне циркулирует электролит 7 при температуре 55—65° С. Электролит представляет собой водный раствор Си504 (10—16%) и Н2504 (10—16%). При прохождении через всю цепь постоянного электрического тока по направлению от анода через электролит к катоду происходит растворение меди с анода и осаждение меди на катоде по реакции [c.96]
Как варят золото – ZAVODFOTO.RU
Золото – это всего лишь элемент I группы, шестого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 79, которое обозначается символом Au. Но так уж получилось, что во все времена именно этот благородный металл жёлтого цвета является мерой богатства, благополучия, стабильности и процветания. Так вот, сегодня я опять про «Уралэлектромедь». Помните, в прошлый раз я заикнулся, что в процессе электролиза меди часть примесей оседает на дно электролизных ванн, и, так называемый этот шлам, отправляется в Химико-металлургический цех завода, где из него извлекают золото, серебро и другие драгоценные и редкие металлы. Мне очень повезло, большой респект заводу, что открыли для нас и эти тайны, поэтому сегодня я Вам покажу, как разливают этот дивный металл.Химико-металлургический цех включает на четыре отделения : отделение переработки шламов, отделение производства селена и теллура, аффинажное отделение и гидрометаллургическое отделение.
Продукцией цеха являются благородные и редкие металлы: золото и серебро в слитках банковской чистоты, концентрат металлов платиновой группы, теллур и селен. Продукция получается отменная, недаром в августе 2004 года серебру в слитках был присвоен статус «GOOD Delivery» – одобренный поставщик на Лондонской бирже благородных металлов, а 12 мая 2006 года аналогичный статус был присвоен и золоту. На сегодняшний день «Уралэлектромедь» входит в сотню лучших производителей золота.
2.
3. В начале девяностых пришла идея организовать собственное аффинажное производство. До этого на заводе получали только серебряно-золотой сплав, который в дальнейшем отправлялся на специализированные предприятия, где и производили из него товарное золото и серебро. И только в 1997 году эта идея воплотилась в жизнь. Вот он, первый слиток золота, произведенный здесь.
4. Прошло 10 лет, и, как мы видим, это уже 977 слиток по счёту, но зато юбилейный. На нём уже есть логотип компании.
5. Увидев такое счастье, разные мысли полезли в голову, да и охранник отвернулся…
6. Но меня сразу другим купить решили. “А хочешь при тебе мы новый слиток выплавим?” Конечно! ХОЧУ! Знают, чем купить… производство это я люблю!
Коротко про сам процесс производства. Шлам, образовавшийся при электролизе меди, является сырьём для производства золота и других драгоценных металлов, поступая сюда, он проходит ряд аффинажных операций, т.е. процедур по очистке золота (раз мы о нём сегодня) от других примесей. Вначале шлам подвергается плавке с флюсами для получения серебряно-золотого сплава . Потом в аффинажном производстве этот сплав растворяют в азотной кислоте. А полученный раствор очищают и подвергают электроэкстракции. Далее золотистый шлам после обработки растворяют в «царской водке» (смесь соляной и азотной кислоты). И уже полученное при восстановлении золото плавят в слитки.
7.
8. Температура плавления золота составляет 1 063 ºС
9. И вот оно нарядное на столике лежит. Тёпленькое еще!!! Масса получаемых таких слитков составляет от 11 000 до 13 300 грамм.
10. Да, ребята, у меня в руках полмиллиона долларов
11. Новоиспечённый слиток и самородок золота.
12. Кроме золота я посмотрел еще, как получают здесь серебро.
Честно скажу, сильно размахивать фотоаппаратом не стал, технологии у них особые, конкуренты не дремлют, вдруг сниму, что не надо. Если вкратце, серебро тут получают гидрохимическим способом и электроэкстракцией. Полученное кристаллическое серебро направляется потом на плавку в слитки.
13. Эх, хороши серебряные плантации
14.
15. Масса таких слитков серебра составляет от 28 000 до 32 000 грамм. В год «Уралэлектромедь» выпускает где-то 250 тонн серебра.
Большое спасибо пресс-службе Уральской горно-металлургической компании («УГМК») за возможность побывать на этом заводе, а так же сотрудникам АО «Уралэлектромедь» за открытость и тёплый прием!
Вся наша история с предприятиями Уральской горно-металлургической компании («УГМК»):
Р. S. Уважаемые собственники и акционеры, представители пресс-служб компаний, отделы маркетинга и другие заинтересованные лица, если на Вашем предприятие есть, что показать – “Как это делается и почему именно так!”, мы всегда рады принять участие. Не стесняйтесь, пишите нам сами [email protected] и расскажите о себе, пригласив нас к ВАМ в гости. Берите пример с лидеров!
Уже более 250 предприятий открыли перед нами свои двери, а вот и наши репортажи оттуда:
Почему наша промышленность самая лучшая в мире: http://zavodfoto.livejournal.com/4701859.h
ZAVODFOTO – Шагает по стране! – ЭНЕРГЕТИКА РОССИИ: http://zavodfoto.livejournal.com/2133307.h
«Пермский край – Нам есть, чем гордиться!»: http://zavodfoto.livejournal.com/1823939.h
Лучшие Корпоративные музеи России и другие промрепортажи: http://zavodfoto.livejournal.com/5338699.html
100+ моих промрепортажей 2016 года!: http://zavodfoto.livejournal.com/4863210.html
Мы всегда рады новым друзьям, добавляйтесь и читайте нас в:
А ещё прошу всех в гости: http://ok.ru/zavodfoto и https://www.facebook.com/groups/ZAVODFOT
Автор: Никитин Дмитрий Иванович Физические свойства озона весьма характерны: это легко взрывающийся газ голубого цвета. Литр озона весит примерно 2 грамма, а воздух – 1,3 грамма. Следовательно, озон тяжелее воздуха. Температура плавления озона – минус 192,7ºС. Такой «растаявший» озон представляет собой тёмно-синюю жидкость. Озоновый «лед» имеет темно-синюю окраску с фиолетовым оттенком и при толщине свыше 1 мм становится непрозрачным. Температура кипения озона – минус 112ºС. В газообразном состоянии озон диамагнитен, т.е. не обладает магнитными свойствами, а в жидком состоянии – слабопарамагнитен. Растворимость озона в талой воде в 15 раз больше, чем у кислорода и составляет примерно 1,1 г/л. В литре уксусной кислоты при комнатной температуре растворяется 2,5 грамма озона. Он также хорошо растворяется в эфирных маслах, скипидаре, четыреххлористом углероде. Запах озона ощущается при концентрациях свыше 15 мкг/м3 воздуха. В минимальных концентрациях воспринимается как «запах свежести», в более значительных концентрациях приобретает резкий раздражающий оттенок. Озон образуется из кислорода по следующей формуле: 3O2 + 68 ккал → 2O3. Классические примеры образования озона: под действием молнии во время грозы; под действием солнечного света в верхних слоях атмосферы. Озон также способен образовываться при любых процессах, сопровождающихся выделением атомарного кислорода, например, при разложении перекиси водорода. Промышленный синтез озона связан с использованием электрических разрядов при низких температурах. Технологии получения озона могут отличаться друг от друга. Так, для получения озона применяемого для медицинских целей используется только чистый (без примесей) медицинский кислород. Отделение образовавшегося озона от примеси кислорода обычно не составляет труда в силу различий физических свойств (озон легче сжижается). Если не требуется соблюдения определенных качественных и количественных параметров реакции, то получение озона не представляет особых трудностей. Молекула О3 неустойчива и довольно быстро превращается в O2 с выделением тепла. При небольших концентрациях и без посторонних примесей озон разлагается медленно, при больших — со взрывом. Спирт при соприкосновении с ним моментально воспламеняется. Нагревание и контакт озона даже с ничтожными количествами субстрата окисления (органических веществ, некоторых металлов или их окислов) резко ускоряет его разложение. Озон может сохраняться длительное время при − 78ºС в присутствии стабилизатора (небольшого количества HNO3), а также в сосудах из стекла, некоторых пластмасс или благородных металлов. Озон – сильнейший окислитель. Причина такого явления кроется в том, что в процессе распада образуется атомарный кислород. Такой кислород гораздо агрессивнее молекулярного, потому что в молекуле кислорода дефицит электронов на внешнем уровне вследствие их коллективного использования молекулярной орбитали не так заметен. Еще в XVIII веке было замечено, что ртуть в присутствии озона теряет блеск и прилипает к стеклу, т.е. окисляется. А при пропускании озона через водный раствор йодистого калия начинает выделяться газообразный йод. Такие же «фокусы» с чистым кислородом не получались. В дальнейшем открывались свойства озона, которые сразу же были приняты на вооружение человечества: озон оказался прекрасным антисептиком, озон быстро удалял из воды органические вещества любого происхождения (парфюмерия и косметика, биологические жидкости), стал широко использоваться в промышленности и быту, прекрасно зарекомендовал себя в качестве альтернативы стоматологической бормашине. В XXI веке применение озона во всех областях жизни и деятельности человека растет и развивается, а потому мы становимся свидетелями его превращения из экзотики в привычный инструмент для повседневной работы. ОЗОН O3, аллотропная форма кислорода.
Получение и физические свойства озона. Впервые ученые узнали о существовании неизвестного им газа, когда начали экспериментировать с электростатическими машинами. Случилось это в 17 веке. Но начали изучать новый газ лишь в конце следующего столетия. В 1785 голландский физик Мартин ван Марум получил озон, пропуская через кислород электрические искры. Название же озон появилось лишь в 1840; его придумал швейцарский химик Кристиан Шенбейн, произведя его от греческого ozon – пахнущий. По химическому составу этот газ не отличался от кислорода, но был значительно агрессивнее. Так, он мгновенно окислял бесцветный иодид калия с выделением бурого иода; эту реакцию Шенбейн использовал для определения озона по степени посинения бумаги, пропитанной раствором иодида калия и крахмала. Даже малоактивные при комнатной температуре ртуть и серебро в присутствии озона окисляются. Оказалось, что молекулы озона, как и кислорода, состоят только из атомов кислорода, только не из двух, а из трех. Кислород О2 и озон О3 – единственный пример образования одним химическим элементом двух газообразных (при обычных условиях) простых веществ. В молекуле О3 атомы расположены под углом, поэтому эти молекулы полярны. Получается озон в результате «прилипания» к молекулам О2 свободных атомов кислорода, которые образуются из молекул кислорода под действием электрических разрядов, ультрафиолетовых лучей, гамма-квантов, быстрых электронов и других частиц высокой энергии. Озоном всегда пахнет около работающих электрических машин, в которых «искрят» щетки, около бактерицидных ртутно-кварцевых ламп, которые излучают ультрафиолет. Атомы кислорода выделяются и в ходе некоторых химических реакций. Озон образуется в малых количествах при электролизе подкисленной воды, при медленном окислении на воздухе влажного белого фосфора, при разложении соединений с высоким содержанием кислорода (KMnO4, K2Cr2O7 и др.), при действии на воду фтора или на пероксид бария концентрированной серной кислоты. Атомы кислорода всегда присутствуют в пламени, поэтому если направить струю сжатого воздуха поперек пламени кислородной горелки, в воздухе обнаружится характерный запах озона. Реакция 3O2 → 2O3 сильно эндотермичная: для получения 1 моль озона надо затратить 142 кДж. Обратная реакция идет с выделением энергии и осуществляется очень легко. Соответственно озон неустойчив. В отсутствие примесей газообразный озон медленно разлагается при температуре 70° С и быстро – выше 100° С. Скорость разложения озона значительно увеличивается в присутствии катализаторов. Ими могут быть и газы (например, оксид азота, хлор), и многие твердые вещества (даже стенки сосуда). Поэтому чистый озон получить трудно, а работать с ним опасно из-за возможности взрыва. Не удивительно, что в течение многих десятилетий после открытия озона неизвестны были даже основные его физические константы: долго никому не удавалось получить чистый озон. Как писал в своем учебнике Основы химии Д.И.Менделеев, «при всех способах приготовления газообразного озона содержание его в кислороде всегда незначительно, обыкновенно лишь несколько десятых долей процента, редко 2%, и только при очень пониженной температуре оно достигает 20%». Лишь в 1880 французские ученые Ж.Готфейль и П.Шаппюи получали озон из чистого кислорода при температуре минус 23° С. Оказалось, что в толстом слое озон имеет красивую синюю окраску. Когда охлажденный озонированный кислород медленно сжали, газ стал темно-синим, а после быстрого сброса давления температура еще более понизилась и образовались капли жидкого озона темно-фиолетового цвета. Если же газ не охлаждали или сжимали быстро, то озон мгновенно, с желтой вспышкой, переходил в кислород. Позднее разработали удобный метод синтеза озона. Если подвергнуть электролизу концентрированный раствор хлорной, фосфорной или серной кислоты с охлаждаемым анодом из платины или из оксида свинца(IV), то выделяющийся на аноде газ будет содержать до 50% озона. Были уточнены и физические константы озона. Он сжижается намного легче кислорода – при температуре –112° С (кислород – при –183° С). При –192,7° С озон затвердевает. Твердый озон имеет сине-черный цвет. Опыты с озоном опасны. Газообразный озон способен взрываться, если его концентрация в воздухе превысит 9%. Еще легче взрываются жидкий и твердый озон, особенно при контакте с окисляющимися веществами. Озон можно хранить при низких температурах в виде растворов во фторированных углеводородах (фреонах). Такие растворы имеют голубой цвет.
ОЗОН Химические свойства озона. Для озона характерна чрезвычайно высокая реакционная способность. Озон – один из сильнейших окислителей и уступает в этом отношении только фтору и фториду кислорода OF2. Действующее начало озона как окислителя – атомарный кислород, который образуется при распаде молекулы озона. Поэтому, выступая в качестве окислителя, молекула озона, как правило, «использует» только один атом кислорода, а два других выделяются в виде свободного кислорода, например, 2KI + O3 + h3O → I2 + 2KOH + O2. Так же происходит окисление многих других соединений. Однако бывают и исключения, когда молекула озона использует для окисления все три имеющиеся у нее атома кислорода, например, 3SO2 + O3 → 3SO3; Na2S + O3 → Na2SO3. Очень важное отличие озона от кислорода в том, что озон проявляет окислительные свойства уже при комнатной температуре. Например, PbS и Pb(OH)2 в обычных условиях не реагируют с кислородом, тогда как в присутствии озона сульфид превращается в PbSO4, а гидроксид – в PbO2. Если в сосуд с озоном налить концентрированный раствор аммиака, появится белый дым – это озон окислил аммиак с образованием нитрита аммония Nh5NO2. Особенно характерна для озона способность «чернить» серебряные изделия с образованием AgO и Ag2O3. Присоединив один электрон и превратившись в отрицательный ион О3–, молекула озона становится более стабильной. Содержащие такие анионы «озонокислые соли» или озониды были известны давно – их образуют все щелочные металлы, кроме лития, причем устойчивость озонидов растет от натрия к цезию. Известны и некоторые озониды щелочноземельных металлов, например, Са(О3)2. Если направить на поверхность твердой сухой щелочи струю газообразного озона, то образуется оранжево-красная корка, содержащая озониды, например, 4КОН + 4О3 → 4КО3 + О2 + 2Н2О. При этом твердая щелочь эффективно связывает воду, что предохраняет озонид от немедленного гидролиза. Однако при избытке воды озониды бурно разлагаются: 4КО3+ 2Н2О → 4КОН + 5О2. Разложение идет и при хранении: 2КО3 → 2КО2 + О2. Озониды хорошо растворимы в жидком аммиаке, что позволило выделить их в чистом виде и изучить их свойства. Органические, вещества, с которыми озон соприкасается, он обычно разрушает. Так, озон, в отличие от хлора, способен расщеплять бензольное кольцо. При работе с озоном нельзя использовать резиновые трубки и шланги – они моментально «прохудятся». Реакции озона с органическими соединениями идут с выделением большого количества энергии. Например, эфир, спирт, вата, смоченная скипидаром, метан и многие другие вещества самовоспламеняются при соприкосновении с озонированным воздухом, а смешение озона с этиленом приводит к сильному взрыву.
Применение озона. Озон не всегда «сжигает» органические вещества; в ряде случаев удается провести специфические реакции с сильно разбавленным озоном. Например, при озонировании олеиновой кислоты (она в больших количествах содержится в растительных маслах) образуется азелаиновая кислота НООС(СН2)7СООН, которую используют для получения высококачественных смазочных масел, синтетических волокон и пластификаторов для пластмасс. Аналогично получают адипиновую кислоту, которую используют при синтезе найлона. В 1855 Шенбейн открыл реакцию с озоном непредельных соединений, содержащих двойные связи С=С, но только в 1925 немецкий химик Х.Штаудингер установил механизм этой реакции. Молекула озона присоединяется к двойной связи с образованием озонида – на этот раз органического, причем на место одной из связей С=С встает атом кислорода, а на место другой – группировка –О–О–. Хотя некоторые органические озониды выделены в чистом виде (например, озонид этилена), эту реакцию обычно проводят в разбавленном растворе, так как в свободном виде озониды – очень неустойчивые взрывчатые вещества. Реакция озонирования непредельных соединений пользуется у химиков-органиков большим почетом; задачи с этой реакцией часто предлагают даже на школьных олимпиадах. Дело в том, что при разложении озонида водой образуются две молекулы альдегида или кетона, которые легко идентифицировать и далее установить строение исходного непредельного соединения. Таким образом химики еще в начале 20 века установили строение многих важных органических соединений, в том числе природных, содержащих связи С=С. Важная область применения озона – обеззараживание питьевой воды. Обычно воду хлорируют. Однако некоторые примеси в воде под действием хлора превращаются соединения с очень непpиятым запахом. Поэтому уже давно предложено заменить хлор озоном. Озонированная вода не приобретает постороннего запаха или вкуса; при полном окислении озоном многих органических соединений образуются только углекислый газ и вода. Очищают озоном и сточные воды. Продукты окисления озоном даже таких загрязнителей как фенолы, цианиды, повеpхностно-активные вещества, сульфиты, хлоpамины, представляют собой безвредные соединения без цвета и запаха. Избыток же озона довольно быстро распадается с образованием кислорода. Однако озонирование воды обходится дороже, чем хлорирование; кроме того, озон нельзя перевозить, и он должен производиться на месте использования.
Озон в атмосфере. Озона в атмосфере Земли немного – 4 млрд. тонн, т.е. в среднем всего 1 мг/м3. Концентрация озона растет с удалением от поверхности Земли и достигает максимума в стратосфере, на высоте 20–25 км – это и есть «озоновый слой». Если весь озон из атмосферы собрать у поверхности Земли при нормальном давлении, получится слой толщиной всего около 2–3 мм. И вот такие малые количества озона в воздухе фактически обеспечивают жизнь на Земле. Озон создает «защитный экран», не пропускающий к поверхности Земли жесткие ультрафиолетовые солнечные лучи, губительные для всего живого. В последние десятилетия большое внимание уделяется появлению так называемых «озоновых дыр» – областях со значительно уменьшенным содержанием стратосферного озона. Через такой «прохудившийся» щит до поверхности Земли доходит более жесткое ультрафиолетовое излучение Солнца. Поэтому ученые давно следят за озоном в атмосфере. В 1930 английский геофизик С.Чепмен для объяснения постоянной концентрации озона в стратосфере предложил схему из четырех реакций (эти реакции получили название цикла Чепмена, в них М означает любой атом или молекулу, которые уносят избыточную энергию): О2 → 2О О + О + М → О2 + М О + О3 → 2О2 О3 → О2 + О. Первая и четвертая реакции этого цикла – фотохимические, они идут под действием солнечной радиации. Для распада молекулы кислорода на атомы требуется излучение с длиной волны менее 242 нм, тогда как озон распадается при поглощении света в области 240–320 нм (последняя реакция как раз и защищает нас от жесткого ультрафиолета, так как кислород в этой спектральной области не поглощает). Остальные две реакции термические, т.е. идут без действия света. Очень важно, что третья реакция, приводящая к исчезновению озона, имеет энергию активации; это означает, что скорость такой реакции может увеличиваться под действием катализаторов. Как выяснилось, основной катализатор распада озона – оксид азота NO. Он образуется в верхних слоях атмосферы из азота и кислорода под действием наиболее жесткой солнечной радиации. Попадая в озоносферу, он вступает в цикл из двух реакций O3 + NO → NO2 + O2, NO2 + O → NO + O2, в результате которой его содержание в атмосфере не меняется, а стационарная концентрация озона снижается. Существуют и другие циклы, приводящие к снижению содержания озона в стратосфере, например, с участием хлора: Cl + O3 → ClO + O2 ClO + O → Cl + O2. Разрушают озон также пыль и газы, которые в большом количестве попадают в атмосферу при извержении вулканов. В последнее время возникло предположение, что озон также эффективно разрушает водород, выделяющийся из земной коры. Совокупность всех реакций образования и распада озона приводит к тому, что среднее время жизни молекулы озона в стратосфере составляет около трех часов. Предполагают, что помимо природных, существуют и искусственные факторы, влияющие на озоновый слой. Хорошо известный пример – фреоны, которые являются источниками атомов хлора. Фреоны – это углеводороды, в которых атомы водорода замещены атомами фтора и хлора. Их используют в холодильной технике и для заполнения аэрозольных баллончиков. В конечном счете, фреоны попадают в воздух и медленно поднимаются с потоками воздуха все выше и выше, достигая, наконец, озонового слоя. Разлагаясь под действием солнечной радиации, фреоны сами начинают каталитически разлагать озон. Пока не известно в точности, в какой степени именно фреоны повинны в «озоновых дырах», и, тем не менее, уже давно принимают меры по ограничению их применения. Как показывают расчеты, через 60–70 лет концентрация озона в стратосфере может уменьшиться на 25%. И одновременно увеличится концентрации озона в приземном слое – тропосфере, что тоже плохо, так как озон и продукты его превращений в воздухе ядовиты. Основной источник озона в тропосфере – перенос с массами воздуха стратосферного озона в нижние слои. Ежегодно в приземный слой озона поступает примерно 1,6 млрд. тонн. Время жизни молекулы озона в нижней части атмосферы значительно выше – более 100 суток, поскольку в приземном слое меньше интенсивность ультрафиолетового солнечного излучения, разрушающего озон. Обычно озона в тропосфере очень мало: в чистом свежем воздухе его концентрация составляет в среднем всего 0,016 мкг/л. Концентрация озона в воздухе зависит не только от высоты, но и от местности. Так, над океанами озона всегда больше, чем над сушей, так как там озон распадается медленнее. Измерения в Сочи показали, что воздух у морского побережья содержит на 20% больше озона, чем в лесу в 2 км от берега. Современные люди вдыхают значительно больше озона, чем их предки. Основная причина этого – увеличение количества метана и оксидов азота в воздухе. Так, содержание метана в атмосфере постоянно растет, начиная с середины 19 века, когда началось использование природного газа. В загрязненной оксидами азота атмосфере метан вступает в сложную цепочку превращений с участием кислорода и паров воды, итог которой можно выразить уравнением Ch5 + 4O2 → HCHO + h3O + 2O3. В роли метана могут выступать и другие углеводороды, например, содержащиеся в выхлопных газах автомобилей при неполном сгорании бензина. В результате в воздухе крупных городов за последние десятилетия концентрация озона выросла в десятки раз. Всегда считалось, что во время грозы концентрация озона в воздухе резко увеличивается, так как молнии способствуют превращению кислорода в озон. На самом деле увеличение незначительно, причем оно происходит не во время грозы, а за несколько часов до нее. Во время же грозы и в течение нескольких часов после нее концентрация озона снижается. Объясняется это тем, что перед грозой происходит сильное вертикальное перемешивание воздушных масс, так что дополнительное количество озона поступает из верхних слоев. Кроме того, перед грозой увеличивается напряженность электрического поля, и создаются условия для образования коронного разряда на остриях различных предметов, например, кончиков ветвей. Это также способствует образованию озона. А затем при развитии грозового облака под ним возникают мощные восходящие потоки воздуха, которые и снижают содержание озона непосредственно под облаком. Интересен вопрос о содержании озона в воздухе хвойных лесов. Например, в Курсе неорганической химии Г. Реми можно прочитать, что «озонированный воздух хвойных лесов» – выдумка. Так ли это? Ни одно растение озон, конечно, не выделяет. Но растения, особенно хвойные, выделяют в воздух множество летучих органических соединений, в том числе ненасыщенных углеводородов класса терпенов (их много в скипидаре). Так, в жаркий день сосна выделяет в час 16 мкг терпенов на каждый грамм сухой массы хвои. Терпены выделяют не только хвойные, но и некоторые лиственные деревья, среди которых – тополь и эвкалипт. А некоторые тропические деревья способны выделить в час 45 мкг терпенов на 1 г сухой массы листьев. В результате в сутки один гектар хвойного леса может выделить до 4 кг органических веществ, лиственного – около 2 кг. Покрытая лесом площадь Земли составляет миллионы гектаров, и все они выделяют в год сотни тысяч тонн различных углеводородов, в том числе и терпенов. А углеводороды, как это было показано на примере метана, под действием солнечной радиации и в присутствии других примесей способствуют образованию озона. Как показали опыты, терпены в подходящих условиях действительно очень активно включаются в цикл атмосферных фотохимических реакций с образованием озона. Так что озон в хвойном лесу – вовсе не выдумка, а экспериментальный факт.
Озон и здоровье. Как приятно прогуляться после грозы! Воздух чист и свеж, его бодрящие струи, кажется, без всяких усилий сами втекают в легкие. «Озоном пахнет, – часто говорят в таких случаях. – Очень полезно для здоровья». Так ли это? Когда-то озон, безусловно, считали полезным для здоровья. Но если его концентрация превышает определенный порог, он может вызывать массу неприятных последствий. В зависимости от концентрации и времени вдыхания озон вызывает изменения в легких, раздражение слизистых глаз и носа, головную боль, головокружение, снижение кровяного давления; озон уменьшает сопротивляемость организма бактериальным инфекциям дыхательных путей. Предельно допустимая его концентрация в воздухе составляет всего 0,1 мкг/л, а это означает, что озон намного опаснее хлора! Если несколько часов провести в помещении при концентрации озона всего лишь 0,4 мкг/л, могут появиться загрудинные боли, кашель, бессонница, снижается острота зрения. Если долго дышать озоном при концентрации больше 2 мкг/л, последствия могут быть более тяжелыми – вплоть до оцепенения и упадка сердечной деятельности. При содержании озона 8–9 мкг/л через несколько часов происходит отек легких, что чревато смертельным исходом. А ведь такие ничтожные количества вещества обычно с трудом поддаются анализу обычными химическими методами. К счастью, человек чувствует присутствие озона уже при очень малых его концентрациях – примерно 1 мкг/л, при которых йодкрахмальная бумажка еще и не собирается синеть. Одним людям запах озона в малых концентрациях напоминает запах хлора, другим – сернистого газа, третьим – чеснока. Ядовит не только сам озон. С его участием в воздухе образуется, например, пероксиацетилнитрат (ПАН) СН3–СО–ООNО2 – вещество, оказывающее сильнейшее раздражающее, в том числе слезоточивое, действие, затрудняющее дыхание, а в более высоких концентрациях вызывающее паралич сердца. ПАН – один из компонентов образующегося летом в загрязненном воздухе так называемого фотохимического смога (это слово образовано от английского smoke – дым и fog – туман). Концентрация озона в смоге может достигать 2 мкг/л, что в 20 раз больше предельно допустимой. Следует также учесть, что совместное действие озона и оксидов азота в воздухе в десятки раз сильнее, чем каждого вещества порознь. Не удивительно, что последствия возникновения такого смога в больших городах могут быть катастрофическими, особенно если воздух над городом не продувается «сквозняками» и образуется застойная зона. Так, в Лондоне в 1952 от смога в течение нескольких дней погибло более 4000 человек. А смог в Нью-Йорке в 1963 убил 350 человек. Аналогичные истории были в Токио, других крупных городах. Страдают от атмосферного озона не только люди. Американские исследователи показали, например, что в областях с повышенным содержанием озона в воздухе время службы автомобильных шин и других изделий из резины значительно уменьшается. Как уменьшить содержание озона в приземном слое? Снизить поступление в атмосферу метана вряд ли реалистично. Остается другой путь – уменьшить выбросы оксидов азота, без которых цикл реакций, приводящих к озону, идти не может. Путь это тоже непростой, так как оксиды азота выбрасываются не только автомобилями, но и (главным образом) тепловыми электростанциями. Источники озона – не только на улице. Он образуется в рентгеновских кабинетах, в кабинетах физиотерапии (его источник – ртутно-кварцевые лампы), при работе копировальной техники (ксероксов), лазерных принтеров (здесь причина его образования – высоковольтный разряд). Озон – неизбежный спутник производства пергидроля, аргонодуговой сварки. Для уменьшения вредного действия озона необходимо оборудование вытяжки у ультрафиолетовых ламп, хорошее проветривание помещения. И все же вряд ли правильно считать озон, безусловно, вредным для здоровья. Все зависит от его концентрации. Как показали исследования, свежий воздух очень слабо светится в темноте; причина свечения – реакции окисления с участием озона. Свечение наблюдали и при встряхивании воды в колбе, в которую был предварительно напущен озонированный кислород. Это свечение всегда связано с присутствием в воздухе или воде небольших количеств органических примесей. При смешении свежего воздуха с выдыхаемым человеком интенсивность свечения повышалась в десятки раз! И это не удивительно: в выдыхаемом воздухе обнаружены микропримеси этилена, бензола, уксусного альдегида, формальдегида, ацетона, муравьиной кислоты. Они-то и «высвечиваются» озоном. В то же время «несвежий», т.е. полностью лишенный озона, хотя и очень чистый, воздух свечения не вызывает, а человек его ощущает как «затхлый». Такой воздух можно сравнить с дистиллированной водой: она очень чистая, практически не содержит примесей, а пить ее вредно. Так что полное отсутствие в воздухе озона, по-видимому, тоже неблагоприятно для человека, так как увеличивает содержание в нем микроорганизмов, приводит к накоплению вредных веществ и неприятных запахов, которые озон разрушает. Таким образом, становится понятной необходимость регулярного и длительного проветривания помещений, даже если в нем нет людей: ведь попавший в комнату озон долго в ней не задерживается – частично он распадается, а в значительной степени оседает (адсорбируется) на стенках и других поверхностях. Сколько должно быть озона в помещении, пока сказать трудно. Однако в минимальных концентрациях озон, вероятно, необходим и полезен. Таким образом, озон это мина замедленного действия. Если его правильно использовать, то он будет служить человечеству, но стоит его начать использовать не по назначению, как это моментально приведет к глобальной катастрофе и Земля превратится в такую планету как Марс. |
17.7 Электролиз – химия
Цели обучения
К концу этого раздела вы сможете:
- Описать электролитические ячейки и их связь с гальваническими элементами
- Выполнение различных расчетов, связанных с электролизом
В гальванических элементах химическая энергия преобразуется в электрическую. Обратное верно для электролитических ячеек. В электролитических ячейках электрическая энергия вызывает несамопроизвольные реакции в процессе, известном как электролиз .Зарядка электромобиля, изображенная в главе 18 «Введение» в начале этой главы, демонстрирует один из таких процессов. Электрическая энергия преобразуется в химическую энергию в аккумуляторе по мере его зарядки. После зарядки аккумулятор можно использовать для питания автомобиля.
В электролитических элементах используются те же принципы, что и в гальванических элементах. Мы рассмотрим три электролитических ячейки и количественные аспекты электролиза.
В расплавленном хлориде натрия ионы могут свободно перемещаться к электродам электролитической ячейки.{\ circ} = -4.0 \; \ text {V} \ end {array} [/ latex]
Источник питания (аккумулятор) должен обеспечивать минимум 4 В, но на практике применяемые напряжения обычно выше из-за неэффективности самого процесса.
Рисунок 1. При пропускании электрического тока через расплавленный хлорид натрия материал разлагается на металлический натрий и газообразный хлор. Необходимо следить за тем, чтобы продукты были разделены, чтобы предотвратить самопроизвольное образование хлорида натрия.Электролизом можно разделить воду на водород и кислород.{\ circ} = -1,229 \; \ text {V} \ end {array} [/ latex]
Обратите внимание на то, что серная кислота не расходуется и объем произведенного газообразного водорода в два раза превышает объем произведенного газообразного кислорода. Минимальное подаваемое напряжение 1,229 В.
Рисунок 2. Вода разлагается на кислород и водород во время электролиза. Серная кислота была добавлена для увеличения концентрации ионов водорода и общего количества ионов в растворе, но не принимает участия в реакции. Объем собранного газообразного водорода в два раза превышает объем собранного газообразного кислорода из-за стехиометрии реакции.{\ circ} = +1.229 \; \ text {V} \ end {array} [/ latex]Эти значения предполагают, что вода должна окисляться на аноде, потому что потребуется меньший потенциал – использование реакции (ii) для окисления даст менее отрицательный потенциал ячейки. Когда эксперимент проводится, выясняется, что на аноде образуется хлор, а не кислород. {\ circ} = -2.186 \; \ text {V} [/ латекс]
По мере протекания реакции ионы гидроксида заменяют ионы хлорида в растворе. Таким образом, гидроксид натрия можно получить путем испарения воды после завершения электролиза. Гидроксид натрия ценен сам по себе и используется для таких вещей, как средство для чистки духовок, открывалка для слива, а также при производстве бумаги, тканей и мыла.
Гальваника
Важным применением электролитических ячеек является гальваника . Гальваника приводит к тонкому покрытию одного металла поверх проводящей поверхности.Причины нанесения гальванического покрытия включают в себя повышение устойчивости объекта к коррозии, укрепление поверхности, создание более привлекательной отделки или очистку металла. Металлы, обычно используемые в гальванике, включают кадмий, хром, медь, золото, никель, серебро и олово. Обычные потребительские товары включают посеребренную или позолоченную посуду, хромированные автомобильные детали и ювелирные изделия. Мы можем получить представление о том, как это работает, исследуя, как производится посеребренная посуда (рис. 3).
Рисунок 3. Ложка, сделанная из недорогого металла, подключается к отрицательной клемме источника напряжения и действует как катод. Анод – серебряный электрод. Оба электрода погружены в раствор нитрата серебра. Когда через раствор пропускают постоянный ток, в конечном итоге металлическое серебро удаляется с анода и осаждается на катоде.На рисунке анод состоит из серебряного электрода, показанного слева. Катод расположен справа и представляет собой ложку, которая изготовлена из недорогого металла.{-} \; {\ longrightarrow} \; \ text {Ag} (s) [/ latex]
Конечный результат – перенос металлического серебра с анода на катод. Качество объекта обычно определяется толщиной наплавленного серебра и скоростью наплавки.
Величина тока, который может протекать в электролитической ячейке, зависит от количества молей электронов. Количество молей электронов может быть связано с реагентами и продуктами с использованием стехиометрии. Напомним, что единицей СИ для тока ( I ) является ампер (А), что эквивалентно 1 кулону в секунду (1 А = 1 [латекс] \ frac {\ text {C}} {\ text {s }}[/латекс]).Общий заряд ( Q , в кулонах) равен
.[латекс] Q = I \; \ times \; t = n \; \ times \; F [/ латекс]
Где t – время в секундах, n – количество молей электронов, а F – постоянная Фарадея.
Моли электронов могут быть использованы в задачах стехиометрии. Также может быть запрошено время, необходимое для внесения определенного количества металла, как во втором из следующих примеров.
Пример 1
Преобразование тока в моль электронов
В одном процессе, используемом для гальваники серебра, ток равен 10.23 А пропускали через электролитическую ячейку ровно за 1 час. Сколько молей электронов прошло через ячейку? Какая масса серебра была нанесена на катод из раствора нитрата серебра?
Раствор
Константу Фарадея можно использовать для преобразования заряда ( Q ) в моль электронов ( n ). { -}} = 0.{-}} \; \ times \; \ frac {107.9 \; \ text {g \; Ag}} {1 \; \ text {mol \; Ag}} = 41.19 \; \ text {g \; Ag} [/ латекс]
Проверьте свой ответ: исходя из стехиометрии, из 1 моля электронов получается 1 моль серебра. Было задействовано менее половины моля электронов и было произведено менее половины моля серебра.
Проверьте свои знания
Металлический алюминий можно получить из ионов алюминия электролизом. Какая будет половинная реакция на катоде? Какая масса металлического алюминия будет восстановлена, если ток 2?{-} \; {\ longrightarrow} \; \ text {Al} (s) [/ latex]; 7,77 моль Al = 210,0 г Al.
Пример 2
Время, необходимое для осаждения
В одном случае слой хрома толщиной 0,010 мм должен быть нанесен на деталь с общей площадью поверхности 3,3 м. 2 из раствора, содержащего ионы хрома (III). Сколько времени нужно, чтобы нанести слой хрома, если ток равен 33,46 А? Плотность хрома (металла) 7,19 г / см 3 .
Решение
Эта проблема связана с рядом рассмотренных ранее тем.Схема того, что необходимо сделать:
- Если можно определить общий заряд, необходимое время – это просто заряд, деленный на текущий .
- Общий заряд может быть получен из необходимого количества Cr и стехиометрии
- Количество Cr может быть получено исходя из плотности и необходимого объема Cr
- Требуемый объем Cr равен толщине, умноженной на площадь
Решая поэтапно и заботясь о единицах, требуемый объем Cr составляет
[латекс] \ text {volume} = (0.4 \; \ text {s} = 11.0 \; \ text {hr} [/ latex]
Проверьте свой ответ: В такой длинной задаче одной проверки, вероятно, недостаточно. Каждый из шагов дает разумное число, так что все, вероятно, правильно. Обратите особое внимание на преобразование единиц измерения и стехиометрию.
Проверьте свои знания
Какая масса цинка требуется для цинкования верхней части листа железа размером 3,00 м × 5,50 м до толщины 0,100 мм цинка? Если цинк поступает из раствора Zn (NO 3 ) 2 и ток равен 25.5 А сколько времени займет гальванизация верха утюга? Плотность цинка 7,140 г / см 3 .
Ответ:
231 г Zn потребовалось 446 минут.
Электролиз – это использование электричества для инициирования непредвиденного процесса. Электролитические ячейки – это электрохимические ячейки с отрицательными потенциалами ячейки (что означает положительную свободную энергию Гиббса), и поэтому они не являются спонтанными. Электролиз может происходить в электролитических ячейках путем включения источника питания, который подает энергию, заставляющую электроны течь в неспонтанном направлении.Электролиз проводится в растворах, которые содержат достаточно ионов для протекания тока. Если раствор содержит только один материал, например, при электролизе расплавленного хлорида натрия, легко определить, что окисляется, а что восстанавливается. В более сложных системах, таких как электролиз водного хлорида натрия, более одного вида могут быть окислены или восстановлены, и стандартные восстановительные потенциалы используются для определения наиболее вероятного окисления (полуреакция с наибольшим [наиболее положительным] стандартным восстановительным потенциалом ) и восстановления (полуреакция с наименьшим [наименее положительным] стандартным восстановительным потенциалом).Иногда возникают неожиданные полуреакции из-за перенапряжения. Перенапряжение – это разница между теоретическим потенциалом восстановления полуреакции и фактическим требуемым напряжением. Если он присутствует, приложенный потенциал должен быть увеличен, чтобы в электролитической ячейке могла произойти другая реакция. Полный заряд Q , который проходит через электролитическую ячейку, может быть выражен как ток ( I ), умноженный на время ( Q = It ), или как моль электронов ( n ), умноженная на постоянную Фарадея. ( Q = нФ).Эти отношения могут использоваться для определения таких вещей, как количество материала, используемого или образованного во время электролиза, как долго должна продолжаться реакция или какое значение тока требуется.
Химия: упражнения в конце главы
- Укажите реакцию на аноде, реакцию на катоде, общую реакцию и приблизительный потенциал, необходимый для электролиза следующих расплавов солей. Предположим, что стандартные состояния и стандартные восстановительные потенциалы в Приложении L такие же, как и при каждой из точек плавления.Предположим, что КПД равен 100%.
(а) CaCl 2
(б) LiH
(в) AlCl 3
(г) CrBr 3
- Какая масса каждого продукта производится в каждой из электролитических ячеек предыдущей задачи, если через каждую ячейку проходит общий заряд 3,33 × 10 5 Кл? Предположим, что напряжения достаточно для уменьшения.
- Сколько времени нужно, чтобы восстановить 1 моль каждого из следующих ионов с помощью указанного тока? Предположим, что напряжения достаточно для уменьшения.
(а) Al 3+ , 1,234 A
(б) Ca 2+ , 22,2 A
(в) Cr 5+ , 37,45 A
(г) Au 3+ , 3,57 А
- Ток в 2,345 А проходит через элемент, показанный на рисунке 2, в течение 45 минут. Какой объем водорода собирается при комнатной температуре, если давление составляет ровно 1 атм? Предположим, что напряжения достаточно для уменьшения. (Подсказка: водород – единственный газ, присутствующий над водой?)
- Металлическая деталь неправильной формы, изготовленная из определенного сплава, была оцинкована цинком с использованием раствора Zn (NO 3 ) 2 .При использовании силы тока 2,599 А для нанесения на деталь слоя цинка толщиной 0,01123 мм требовалось ровно 1 час. Какова была общая площадь поверхности детали? Плотность цинка 7,140 г / см 3 . Предположим, что КПД равен 100%.
Глоссарий
- электролиз
- Процесс, использующий электрическую энергию для возникновения несамопроизвольного процесса
- электролизер
- ячейка электрохимическая, в которой используется электролиз; электрохимическая ячейка с отрицательным потенциалом ячейки
- гальваника
- нанесение тонкого слоя одного металла поверх проводящей поверхности
- перенапряжение
- разность между теоретическим потенциалом и фактическим потенциалом в электролитической ячейке; «дополнительное» напряжение, необходимое для того, чтобы произошла некоторая несамопроизвольная электрохимическая реакция
Решения
Ответы на упражнения в конце главы по химии
2.(a) [латекс] \ begin {array} {r @ {{} = {}} l} \ text {mass \; Ca} & 69.1 \; \ text {g} \\ [0.5em] \ text {mass \; Cl} _2 & 122 \; \ text {g} \ end {array} [/ latex]; (б) [латекс] \ begin {array} {r @ {{} = {}} l} \ text {mass \; Li} & 23.9 \; \ text {g} \\ [0.5em] \ text {mass \; H} _2 & 3.48 \; \ text {g} \ end {array} [/ latex]; (c) [латекс] \ begin {array} {r @ {{} = {}} l} \ text {mass \; Al} & 31.0 \; \ text {g} \\ [0.5em] \ text {mass \; Cl} _2 & 122 \; \ text {g} \ end {array} [/ latex]; (d) [латекс] \ begin {array} {r @ {{} = {}} l} \ text {mass \; Cr} & 59.8 \; \ text {g} \\ [0.5em] \ text {mass \; Br} _2 & 276 \; \ text {g} \ end {array} [/ latex]
4. 0,79 л
Механизм и технологические возможности плазменной электролитической полировки поверхностей металлов и сплавов
https://doi.org/10.1016/j.apsadv.2020.100016Получить права и содержаниеОсновные моменты
- •
Физические и электрохимические процессы в паре- газовая оболочка при полировке.
- •
Корреляция параметров процесса с характеристиками плазменного электролитического полирования.
- •
Контроль плазменного электролитического полирования на месте.
- •
Перспективы разработки более эффективных методов плазменного электролитического полирования.
Реферат
Плазменная электролитическая полировка – это относительно новый метод, который благодаря ряду преимуществ успешно применяется для чистовой обработки металлов и сплавов. К ним можно отнести высокое качество полированной поверхности, использование экологически чистых и недорогих водных растворов, высокую скорость обработки и т. Д.К настоящему времени разработаны составы электролитов и режимы обработки для широкого класса изделий из различных металлов и сплавов, а также оригинальные технические решения по реализации процесса и созданию оборудования. Вся информация, полученная многими исследовательскими группами, требует анализа и обобщения. В обзоре исследуются физико-химические аспекты плазменной электролитической полировки, ее место среди других плазменных электролитических технологий, а также условия и результаты ее практического использования.Действие электрических разрядов в системе и электрохимического растворения на заготовку при увеличении шероховатости поверхности остается дискуссионным. Существуют гипотезы относительно важных аспектов процесса, которые не всегда подтверждаются экспериментально. Также обращено внимание на влияние основных факторов плазменной электролитической полировки на достигаемую шероховатость и скорость съема обрабатываемого материала. Отдельный раздел посвящен проблеме управления технологическими процессами.
Ключевые слова
Плазменная электролитическая полировка
Плазменная электролитическая обработка
Модификация поверхности
Металлы и сплавы
Шероховатость поверхности
Рекомендуемые статьи Цитирующие статьи (0)
© 2020 Автор (ы).Опубликовано Elsevier B.V.
Рекомендуемые статьи
Цитирующие статьи
Электролитическое (автокаталитическое) против электролитического покрытия
При выборе формы покрытия вам необходимо знать различия между гальваническим и химическим способом. Некоторые проекты больше выиграют от химического нанесения покрытия, также известного как автокаталитическое, чем от электролитического. Прежде чем принимать важное решение о том, как будут завершены ваши детали, узнайте больше о вариантах покрытия металлической поверхности.
Покрытие ENP – это еще одно название для химического никелирования, также известного как автокаталитическое покрытие. Автокаталитическое покрытие покрывает основной материал в металле посредством химической реакции. Катализатор – это то, что запускает цепную реакцию, но при нанесении покрытия химическим способом вам не нужно ничего добавлять в раствор, чтобы начать процесс. Это происходит автоматически, что и дало этой отделке свое название.
Обычно мы применяем химическое покрытие для никелирования. В отличие от гальваники, для которой требуется металлическая основа, мы можем покрыть любой материал химическим способом.Сначала тщательно очищаем деталь от мусора. Во-вторых, окунаем изделие в раствор и добавляем его в смесь антиокислительных компонентов.
Что такое процесс никелирования?
Во время процесса химические вещества в ванне нестабильны и откладывают металл на основном материале. Некоторые виды химического нанесения покрытия требуют постоянной фильтрации раствора, чтобы предотвратить попадание мусора на деталь. Однако никелирование не требует такой строгой фильтрации, и для этого процесса не требуется электричество.
В некоторых отраслях промышленности, например в следующих, химическое нанесение покрытия используется для получения прочных, коррозионно-стойких никелевых покрытий на своих деталях:
- Автомобильная промышленность: Компоненты двигателя, которые подвергаются повышенным температурам и регулярно используются, требуют прочного внешнего вида, который производители деталей могут получить благодаря химическому никелированию.
- Производство: Формы, детали машин, штампы и многое другое обычно покрывают никелем для защиты от ржавчины и износа в любых производственных условиях.
- Аэрокосмическая промышленность: Аэрокосмическая отрасль, как и автомобильная промышленность, требует теплостойких и устойчивых к ржавчине деталей в двигателе и во всех самолетах. Никелирование – это один из способов повышения прочности, необходимой для этих компонентов.
- Нефтехимическая промышленность: Нефтехимические заводы регулярно нуждаются в замене клапанов, труб, заглушек и прочего. Долговечное никелевое покрытие выдерживает сильное трение, которое могут выдержать эти детали, одновременно защищая компоненты от коррозии.
Из двух видов покрытия химическое нанесение является наиболее простым процессом. Поскольку автокаталитическое покрытие – не лучший вариант для всех проектов, мы также предлагаем электролитическое покрытие.
Что такое гальваническое покрытие?
Электролитическое нанесение покрытия не требует электричества, но электролитическое покрытие требует. Процесс гальваники требует токопроводящей основы, электрического тока и ванны с электролитом. Перед погружением в раствор электролита необходимо тщательно очистить основной материал.Вместе с подложкой погружаем пруток из металла, используемого для обшивки. Этот металл, анод, помогает пополнять запасы ионов металлов в ванне по мере их осаждения на основании. Далее подключаем к электричеству и основание, и металлическую обшивку. Положительный провод подключается к аноду, а отрицательный провод присоединяется к пластине.
Когда электричество проходит через металлы и раствор, оно вытягивает ионы металлов из раствора и наносит их тонким слоем на основу. Количество напряжения, которое проходит через раствор, в значительной степени зависит от размера покрытой детали.Поскольку расчеты напряжения настолько точны, а время электроосаждения так мало, гальваника не является задачей для любителей.
Гальваника стоит меньше, чем нанесение покрытия химическим способом, и цена становится для некоторых решающим фактором. С помощью гальваники мы можем получить более толстую поверхность, чем с помощью химического нанесения. Однако то, как вы можете использовать гальванические материалы, зависит от того, что вам нужно от готового продукта:
- Матовая поверхность: Для применений, где внешний вид менее важен, чем прочность и износостойкость, выберите сульфаматно-никелевое покрытие с матовым покрытием, которое улучшает долговечность и прочность.
- Блестящая отделка: Если вашему проекту требуется эстетическая привлекательность блестящего никеля, выберите гальваническое покрытие на основе сульфатного никеля. Хотя это покрытие выглядит потрясающе благодаря своей блестящей отделке, оно не обеспечивает долговечность сульфамата никеля. Он также имеет меньшую глубину по сравнению с его альтернативой с матовым покрытием.
Соответствует ли электролитическое никелирование требованиям директивы RoHS?
Директива RoHS, Ограничения по опасным веществам, наложила жесткие ограничения на количество опасных материалов, которые производители могут использовать:
- Свинец : Свинец, используемый в батареях и различной электронике, не может превышать 1000 частей на миллион.
- Меркурий : Уровень содержания ртути в выключателях освещения и автомобильных деталях должен оставаться ниже 100 частей на миллион.
- Кадмий : Как и ртуть, содержание кадмия должно составлять менее 100 частей на миллион. Кадмий чаще всего появляется в батареях.
- Полибромированный дифениловый эфир (PBDE) : PBDE, электронный антипирен, не должен превышать 1000 частей на миллион.
- Полибромированные дифенилы (PBB) : Как и PBDE, PBB является антипиреном для электроники, содержание которого не может превышать 1000 частей на миллион.
- Шестивалентный хром : Шестивалентный хром покрывает металлы для предотвращения коррозии, но это вещество не может измерять более 1000 частей на миллион.
В SPC мы используем методы гальваники, соответствующие последней директиве RoHS от 2013 года, которая установила самые жесткие ограничения на использование химикатов. Если вам необходимо химическое никелирование в соответствии с требованиями RoHS, мы выполним ваш запрос.
Преимущества и недостатки химического нанесения покрытия
Методы плакированиябудут иметь различные преимущества и недостатки в зависимости от вашего проекта, того, что вам нужно покрыть, и того, как вам нужно готовое изделие для работы.Гальваническое покрытие может быть лучшим вариантом для конкретных проектов, но из-за его недостатков этот метод отделки может быть непригоден для выполнения других работ.
Преимущества автокаталитического покрытия
Гальваническое покрытие без применения электролита дает несколько преимуществ по сравнению с гальваническим покрытием. Единообразие и необходимые ресурсы могут сделать это лучшим выбором для вашего проекта.
1. Однородность
При нанесении покрытия химическим способом осаждение может быть не таким толстым, как при нанесении электролитического покрытия, но покрытие наносится на поверхность более равномерно.Поскольку единственный фактор, определяющий, насколько толстое покрытие наносится на поверхность, зависит от контакта основы с раствором, на каждую поверхность нанесено одинаковое количество металла, нанесенного на нее. Качество покрытия, полученного химическим способом, невозможно превзойти по качеству покрытия.
2. Прочность
Слой никеля, нанесенный на объект методом химического восстановления, обеспечивает превосходную прочность покрываемого объекта. Никелевое покрытие толщиной 0,001 дюйма продержалось 1000 часов в камере солевого тумана, прежде чем образовалась красная ржавчина.Эта долговечность в 10 раз больше, чем у хрома, который выдерживает только солевой туман в течение 100 часов. Чтобы получить такой же высокий уровень коррозионной стойкости при никелировании, выберите сплав с большим количеством фосфора. Обратной стороной повышения коррозионной стойкости является снижение твердости. Уравновешивайте эти два качества при выборе количества фосфора в растворе для никелирования.
3. Проводимость не требуется
Для нанесения покрытия методом химического восстановления не требуется токопроводящая поверхность.Любая должным образом очищенная поверхность может подвергнуться никелированию в результате автокаталитического процесса. Поскольку не требуются токопроводящие материалы, диапазон вариантов химического нанесения покрытий значительно превосходит возможности нанесения гальванических покрытий. Метод нанесения покрытия без электричества также устраняет потребность в электроэнергии, которая может усложнять процесс нанесения гальванического покрытия.
Недостатки химического нанесения покрытия
Таких преимуществ, как нанесение химического покрытия, этого метода недостаточно для всех областей применения.Проблемы с этой техникой отделки могут быть для вас незначительными неудобствами или проблемами, которые могут потребовать от вас использования электролитического покрытия. Определиться с ответом вам помогут только параметры вашего проекта.
1. Ограниченная продолжительность жизни в ванне
Во время электролитической обработки металл в растворе постоянно пополняет ионы металлов в жидкости. Поскольку в растворе химического нанесения покрытия нет отдельного куска металла, в ванне со временем закончатся ионы металла, и ее потребуется пополнить.Регулярный мониторинг жидкости и добавление раствора по мере необходимости увеличивает стоимость и сложность автокаталитического покрытия. Если вам нужна самая низкая цена, рассмотрите преимущества и недостатки гальваники.
Каковы преимущества и недостатки гальваники?
Электролитическое покрытие намного лучше подходит для конкретных применений. Если для вас важнее всего время и деньги, возможно, вам подойдет гальваника. Тем не менее, вам всегда нужно будет уравновешивать результат и стоимость.
Преимущества гальваники
Когда время или ваша прибыль становятся решающими факторами при выборе метода нанесения покрытия для вашего проекта, вы можете извлечь выгоду из гальваники. Этот метод быстро дает результаты.
1. Быстрое завершение
Процесс гальваники происходит прямо у вас на глазах. Как только вы подключите питание, процесс начнется. Точная скорость зависит от концентрации металла в растворе и силы тока. Чтобы ускорить процесс электроосаждения, увеличьте концентрацию ионов или мощность электрического тока.
2. Недорого
По сравнению с нанесением покрытия химическим способом, нанесение электролитического покрытия дешевле. Хотя для этого процесса требуется электричество, он не требует регулярного обслуживания ванны на протяжении всего процесса. Кроме того, некоторые решения для нанесения покрытия методом химического восстановления требуют нагрева, что увеличивает расходы на коммунальные услуги. Более быстрый темп означает одновременное нанесение покрытия на большее количество элементов, что снижает затраты времени на оборудование для нанесения покрытия.
3. Стабильность ванны
Поддержание раствора электролита для электролитической отделки требует меньшего ухода, чем ванна без химического восстановления.Использование анода в ванне заменяет все ионы металлов, потерянные в процессе нанесения покрытия. Поскольку ванна не требует постоянного ухода из-за ее химической устойчивости, инженеру не нужно тратить на процесс столько времени.
Недостатки гальваники
Хотя гальваника может звучать великолепно, у нее все же есть несколько недостатков. Это в значительной степени зависит от причин, по которым вам нужно покрытие. Не все недостатки электроосаждения применимы к вашему проекту.
1.Ограниченные базовые материалы
Обычно для электролитического покрытия требуется токопроводящая основа. Некоторые материалы могут принимать графитовую краску для нанесения гальванического покрытия, но результаты не будут так прочно прикреплены к основному материалу, как нанесение покрытия методом химического восстановления. Если вам нужно металлическое покрытие на керамической или пластиковой основе, химическое покрытие может быть лучшим выбором для вас.
2. Варианты покрытия
Покрытие, нанесенное химическим способом, всегда создает идеальное ровное покрытие. Однако электролитическое покрытие может иметь более толстые участки отложений.В частности, эти более плотные области возникают на углах деталей, где ионы могут собираться и увеличивать количество металла на участке.
3. Пониженная коррозионная стойкость
Гальванические покрытия не могут достичь твердости покрытия, нанесенного химическим способом. По сравнению с химическим способом никель с электролитическим покрытием имеет меньшую стойкость к коррозии и истиранию, а также более низкую твердость поверхности. За этими атрибутами стоит чистота металла, используемого в процессе. При гальванике основание покрывается 99-процентным никелем.Хотя этот уровень чистоты обеспечивает адекватное металлическое покрытие, ему не хватает дополнительной защиты от износа, присущей никелевым сплавам с фосфором.
Как выбрать подходящее покрытие для вашего проекта
Выбор наилучшего варианта покрытия для вашего проекта зависит от множества факторов. Вы должны учитывать вашу отрасль, требуемое время выполнения работ и основу, которую вы будете использовать, чтобы выбрать лучший для вас метод нанесения покрытия.
1. Промышленность
Множество отраслей используют как химическое, так и электролитическое нанесение покрытия.Оптимальный вариант для вас зависит от того, зачем вам нужно металлическое покрытие предмета.
- Долговечность: Если вам требуется дополнительная прочность, вы получите лучшие результаты от химического никелирования. Никель-фосфорные сплавы обладают превосходной стойкостью к истиранию и коррозии, особенно когда вы выбираете большее количество фосфора. Для повышения твердости поверхности выберите более низкий уровень фосфора, который обратно пропорционален твердости. Морские нефтяные вышки, постоянно подвергающиеся воздействию брызг морской соли, – это лишь одно из применений, в которых используется высокая коррозионная стойкость, обеспечиваемая химическим никелированием.
- Толщина: В то время как мы можем контролировать глубину химического покрытия, гальваника предлагает более глубокую металлическую отделку вашего проекта, хотя, если вы выберете химическое никелирование с чрезвычайно низким уровнем фосфора, вы можете получить покрытие почти такой же толщины, как гальваническое покрытие. поверхность.
- Стоимость: Имеет ли значение исключительно стоимость? Во многих случаях гальваника стоит меньше, но запросите у нас бесплатное предложение, чтобы получить точную оценку цены. Цена химического нанесения покрытия также зависит от другого металла, используемого в сплаве.
- Внешний вид: Только с помощью гальваники можно получить блестящее никелевое покрытие на ваших деталях. Если вы используете компоненты в области, где внешний вид важнее износостойкости покрытия, выберите гальваническое покрытие из блестящего никеля. Автомобильные бамперы и решетки являются примерами того, когда гальваника для презентации является лучшим вариантом.
2. Оборотный период
Как быстро нужно завершить проект? Гальваника требует меньше времени, но вы пожертвуете долговечностью в обмен на эту скорость.Если вам не нужна дополнительная износостойкость, характерная для химического нанесения покрытия, выбор электролитической отделки может ускорить выполнение вашего проекта.
3. Подложка
То, что находится под поверхностью вашей металлической отделки, так же важно для выбора метода нанесения покрытия, как и металл, используемый для покрытия. Если у вас непроводящий основной материал, вы можете получить больше пользы от химического нанесения покрытия. Если вы должны покрыть такие изделия электролитическими методами, то сначала потребуется металлическое покрытие, нанесенное химическим способом.Этот металлический слой позволяет электролитически нанесенному покрытию прилипать к поверхности. Без токопроводящей основы вы не сможете использовать электролитическое покрытие для своего проекта.
Что нужно знать о никелировании
Внимательно изучите различные факторы, которые могут повлиять на ваш процесс принятия решений в отношении химического нанесения никеля и никелевого гальванического покрытия:
Получите ответы на свои последние вопросы или наше предложение
Электролитическое и электролитическое покрытие имеет преимущества и недостатки, и вы должны тщательно взвесить их с ожиданиями вашего проекта, чтобы принять правильное решение.Используемые детали также помогут вам выбрать лучший метод покрытия. Выбор правильного метода покрытия повлияет на качество, время и стоимость готовой продукции. Не думайте, что вы одиноки в своем решении. В SPC у нас есть опыт в отделке, чтобы помочь вам получить информацию, необходимую для выбора метода, необходимого для вашего проекта.
Если у вас есть вопросы о различных вариантах покрытия, свяжитесь с нами в SPC. Мы также предоставим вам бесплатное ценовое предложение для вашего проекта, как только вы узнаете, какой метод покрытия принесет вашему проекту наибольшую пользу.
Решения NCERT для науки класса 9 Глава 2 – Это вопрос вокруг нас Чистый
Решения NCERT Решения класса 9 Наука Глава 2 – это вопрос вокруг нас Чистый – Вот все решения NCERT для науки класса 9 Глава 2. Это решение содержит вопросы и ответы , изображения, пошаговые объяснения всей главы 2, озаглавленной «Вокруг нас материя». Чисто от науки, преподаваемой в классе 9. Если вы ученик 9 класса и изучает естествознание с помощью учебника NCERT, то вы должны прочитать главу 2. Материя вокруг нас чистая.После того, как вы изучили урок, вы должны искать ответы на его вопросы. Здесь вы можете получить полные решения NCERT для науки класса 9 Глава 2 «Вокруг нас чистая материя» в одном месте. Чтобы лучше понять эту главу, вам также следует ознакомиться с примечаниями к главе 2 «Есть ли материя вокруг нас» Чистый класс 9 «Наука».
Решения NCERT для науки класса 9 Глава 2 Вокруг нас чисто
Темы и подтемы в классе 9 «Наука» Глава 2 «Вокруг нас имеет значение Чистота»:
- Чистая материя вокруг нас
- Что такое смесь?
- Что такое решение?
- Разделение компонентов смеси
- Физические и химические изменения
- Какие типы чистых веществ?
Эти решения являются частью NCERT Solutions for Class 9 Science.Здесь мы дали учебник NCERT по естествознанию 9 класса. Решения для главы 2 «Материя вокруг нас чиста».
РЕШЕНИЕ ВОПРОСОВ В ТЕКСТЕ
NCERT Учебник для 9 класса естественных наук – Страница 15
Вопрос 1. Что подразумевается под веществом?
Ответ: Чистое вещество состоит из частиц одного типа.
Вопрос 2. Перечислите отличия гомогенных и гетерогенных смесей.
Ответ:
Дополнительные ресурсы для естественных наук 9 класса
Учебник NCERT по естествознанию, класс 9 Страница 18
Вопрос 1.Различайте гомогенные и гетерогенные смеси с помощью примеров.
Ответ:
Справочник по формулам для математических и естественных наук 9 класса Кредиты на образование в Индии
Вопрос 2. Чем золь, раствор и суспензия отличаются друг от друга?
Ответ:
Вопрос 3. Чтобы приготовить насыщенный раствор, 36 г хлорида натрия растворяют в 100 г воды при температуре 293 К. Найдите его концентрацию при этой температуре.
Ответ: Масса растворенного вещества (хлорид натрия) = 36 г
Масса растворителя (воды) = 100 г
Масса раствора = Масса растворенного вещества + Масса растворителя
= 36 г + 100 г = 136 г
Класс 9 Учебник NCERT по науке Страница 24
Вопрос 1. Как вы разделите смесь, содержащую керосин и бензин (разница в их точках кипения более 25 ° C), которые смешиваются друг с другом?
Ответ: Смешиваемую между собой смесь керосина и бензина можно разделить дистилляцией.
Метод
- Взять смесь в перегонную колбу.
- Установите термометр.
- Разместите аппарат, как показано на рисунке.
- Медленно нагрейте смесь.
- Бензин испаряется первым, так как у него более низкая температура кипения. Он конденсируется в конденсаторе и собирается на выходе конденсатора.
- Керосин остался в перегонной колбе.
Вопрос 2. Назовите метод отделения
(i) сливочного масла от творога,
(ii) соли от морской воды,
(iii) камфоры от соли.
Ответ: (i) Центрифугирование,
(ii) Испарение,
(iii) Сублимация.
Вопрос 3. Какие виды смесей разделяются методом кристаллизации?
Ответ: Метод кристаллизации используется для очистки твердого вещества с некоторыми примесями. Пример: соль из морской воды.
Учебник NCERT Вопросы Стр. 24
Вопрос 2. Классифицируйте следующие изменения как химические или физические:
- рубка деревьев,
- растапливание сливочного масла на сковороде,
- ржавчина альмира,
- кипячение воды с образованием пара,
- прохождение электрического тока через воду и воду с разложением на газообразный водород и кислород,
- растворение поваренной соли в воде,
- приготовление фруктового салата из сырых фруктов и
- сжигание бумаги и дерева.
Ответ:
Вопрос 3. Попробуйте разделить вещи вокруг вас как чистые вещества или смеси
Ответ: Чистые вещества – вода, хлеб, сахар и золото.
Смеси – сталь, пластик, бумага, тальк, молоко и воздух.
Вопросы из учебника NCERT для естественных наук 9 класса
Вопрос 1. Какие методы разделения вы примените для разделения следующих элементов?
(а) Хлорид натрия из раствора в воде.
(b) Хлорид аммония из смеси, содержащей хлорид натрия и хлорид аммония.
(c) Небольшие кусочки металла в моторном масле автомобиля.
(г) Различные пигменты из экстракта лепестков цветов.
(д) Сливочное масло из творога.
(е) Нефть из воды.
(г) Заварка из чая.
(h) Штифты железные из песка.
(i) Зерна пшеницы из лузги.
(j) Мелкие частицы бурового раствора, взвешенные в воде.
Ответ: (a) Испарение
(b) Сублимация
(c) Фильтрация
(d) Хроматография
(e) Центрифугирование
(f) Делительная воронка
(g) Фильтрация
(h) Магнитное разделение
(i) ) Просеивание / осаждение
(j) Декантация и фильтрация
Вопрос 2. Напишите шаги, которые вы бы использовали для приготовления чая. Используйте слова, раствор, растворитель, растворенное вещество, растворять, растворимый, нерастворимый, фильтрат и остаток.
Ответ: 1.Возьмите чашку воды в емкость в качестве растворителя и нагрейте ее.
2. Добавьте в раствор растворенный сахар. Нагрейте, пока весь сахар не растворится.
3. Получается раствор воды и сахара.
4. Сахар полностью растворяется в воде.
5. Добавьте пол чайной ложки заварки, не растворим в воде.
6. Прокипятите содержимое, добавьте молоко, которое также растворяется в воде, снова вскипятите.
7. Отфильтруйте чай с помощью ситечка. Чай, собранный в чашке, представляет собой фильтрат, а чайные листья, собранные на ситечке, представляют собой остатки.
Вопрос 3. Pragya проверил растворимость трех различных веществ при разных температурах и собрал данные, как указано ниже (результаты представлены в следующей таблице в виде граммов вещества, растворенного в 100 граммах воды с образованием насыщенного раствора).
а) Какая масса нитрата калия потребуется для получения насыщенного раствора нитрата калия в 50 граммах воды при 313 К?
(b) Pragya создает насыщенный раствор хлорида калия в воде при температуре 353 К и оставляет раствор остывать! при комнатной температуре.Что бы она увидела, когда раствор остывает? Объяснять.
(c) Найдите растворимость каждой соли при 293 K. Какая соль имеет самую высокую растворимость при этой температуре?
(d) Как изменение температуры влияет на растворимость соли?
Ответ:
Вопрос 4. Объясните следующие примеры:
(а) Насыщенный раствор
(б) Чистое вещество
(в) Коллоид
(г) Суспензия
Ответ: (а ) Насыщенный раствор: В данном растворителе, когда растворенное вещество больше не может растворяться при данной температуре, называется насыщенным раствором.
(b) Чистое вещество: Чистое вещество состоит из частиц одного типа. Например, золото, серебро.
(c) Коллоид: Коллоид – это раствор, в котором размер частиц растворенного вещества больше, чем у истинного раствора. Эти частицы невозможно увидеть невооруженным глазом, они стабильны, например, чернила, кровь.
(d) Суспензия: Это гетерогенная смесь, в которой частицы растворенного вещества достаточно велики, чтобы осесть, например, мел, краски и т. Д.
Вопрос 5.Классифицируйте каждый из следующих компонентов как однородную или неоднородную смесь: газированная вода, древесина, воздух. грунт, уксус, фильтрованный чай.
Ответ: Однородный: Газированная вода, уксус, фильтрованный чай.
Неоднородный: Дерево, воздух, почва.
Вопрос 6. Каким образом вы подтвердите, что данная вам бесцветная жидкость является чистой водой?
Ответ: Путем определения точки кипения данной бесцветной жидкости. Если жидкость закипает при 100 ° C при атмосферном давлении, то это чистая вода.Это связано с тем, что чистые вещества имеют фиксированную температуру плавления и кипения.
Вопрос 7. Какие из следующих материалов относятся к категории «чистое вещество»?
(a) Лед (b) Молоко (c) Железо
(d) Соляная кислота (e) Оксид кальция (f) Ртуть
(g) Спинка (h) Древесина (i) Воздух.
Ответ: Чистые вещества: лед, железо, соляная кислота, оксид кальция и ртуть.
Вопрос 8. Определите решения среди следующих смесей.
(а) Почва (б) Морская вода
(в) Воздух (г) Уголь
(д) Газированная вода.
Ответ: Решения: Морская вода, газированная вода и воздух.
Вопрос 9. Что из следующего покажет «эффект Тиндаля»?
(а) Солевой раствор (б) Молоко
(в) Раствор сульфата меди (г) Раствор крахмала.
Ответ: Раствор молока и крахмала.
Вопрос 10. Классифицируйте следующие элементы на элементы, соединения и смеси.
(a) Натрий (b) Почва (c) Раствор сахара
(d) Серебро (e) Карбонат кальция (f) Олово
(g) Кремний (h) Уголь (i) Воздух
(j) Мыло (k) Метан (l) Двуокись углерода
(m) Кровь
Ответ: Элементы – Соединения – Смеси
Натрий – Карбонат кальция – Раствор сахара
Серебро – Метан – Почва
Олово – Двуокись углерода – Уголь
Кремний – Мыло – Воздух, Кровь
Вопрос 11.Что из следующего является химическими изменениями?
(a) Рост растений (b) Ржавчина железа
(c) Смешивание железной стружки и песка (d) Приготовление пищи
(e) Переваривание пищи (f) Замораживание воды
(г) Горение свечи.
Ответ: Химические изменения:
(a) Рост растений (b) Ржавчина железа
(c) Приготовление пищи (d) Переваривание пищи
(e) Горение свечи
Решения NCERT для науки класса 9 Глава 2 Is Matter Around Us Pure (на хинди)
РЕШЕНИЕ БОЛЬШЕ ВОПРОСОВ
Решения NCERT для науки класса 9 Глава 2 Вопросы с множественным выбором Выберите правильный вариант:
1.Туман, облака – пример
(а) аэрозоль (б) коллоид
(в) суспензия (г) эмульсия
2. Губка может сжиматься, это
(а) твердое тело ( б) жидкость
(в) газ (г) пена
3. Загрязненный образец калийных квасцов можно очистить
(а) испарением (б) кристаллизацией
(в) центрифугированием (г) фильтрация
4. Растворенный в воде мел – пример
(а) истинный раствор (б) коллоидный
(в) суспензия (г) насыщенный раствор
5.50 г сахара растворяют в стакане воды при 30 ° C. При нагревании этого раствора он будет
(а) кристаллизоваться (б) испаряться
(4 станут ненасыщенными (г) сахар обуглится
6. Что из следующего показывает эффекты Тиндаля?
(а) соль раствор (б) раствор сахара
(в) раствор крахмала (г) раствор сульфата меди
7. Уберите лишнее
(а) латунь ‘(б) воздух
(в) песок (г) графит
8.Что из следующего является жидко-жидким раствором?
(а) крем для лица (б) эмульсия
(в) молоко (г) все эти
9. Чтобы разделить две смешивающиеся жидкости фракционной перегонкой, необходимо выполнить одно из следующих условий:
(a) должен быть смешиваемым (b) должен быть несмешиваемым
(c) разница в температуре кипения должна быть менее 25 K
(d) ни один из этих
10. Для получения тонированного и двухтонального молоко из цельного молока мы можем
(а) фильтровать его (б) осадить его
(в) дистиллировать его – (г) центрифугировать его
11.Метод разделения, который включает различие в их плотностях:
(а) сублимация (б) разделение с помощью делительной воронки
(в) центрифугирование (г) как (б), так и (в)
Ответ: 1 – (а). 2– (а), 3– (б), 4– (в), 5– (в), 6– (в), 7– (г), 8– (г), 9– (в), 10– (г), 11- (г).
Вопрос 1. Определите растворитель.
Ответ: Компонент раствора, растворяющий в нем другой компонент, называется растворителем.
Вопрос 2. Определите растворенное вещество.
Ответ: Компонент раствора, растворенный в растворителе, называется растворенным веществом.
Вопрос 3. Что такое «настойка йода»?
Ответ: Раствор йода в спирте известен как настойка йода. Он содержит йод (твердый) в качестве растворенного вещества и спирт (жидкость) в качестве растворителя.
Вопрос 4. Что такое сплавы?
Ответ: Однородная смесь двух или более металлов или металла и неметалла называется сплавом.Например, сталь – это сплав железа и углерода.
Вопрос 5. Приведите один пример газа в жидком растворе.
Ответ: Холодные напитки, углекислый газ в качестве растворенного вещества смешивается с водой в качестве растворителя.
Вопрос 6. Как можно разбавить или сконцентрировать раствор?
Ответ: Количество растворенного вещества, растворяющегося в растворителе, определяет, будет ли раствор разбавленным или концентрированным.
Вопрос 7. Что такое «концентрация раствора»?
Ответ: Концентрация раствора – это количество растворенного вещества, присутствующего в данном количестве раствора, или количество растворенного вещества, растворенного в данной массе или объеме растворителя.
Вопрос 8. Укажите разницу между водным и неводным раствором.
Ответ: Водные растворы содержат воду в качестве растворителя, а неводные растворы не содержат воды в качестве растворителя.
Вопрос 9. Что такое «растворимость» растворенного вещества?
Ответ: Количество растворенного вещества, присутствующего в насыщенном растворе при данной температуре, называется его растворимостью.
Вопрос 10. Что такое насыщенный раствор?
Ответ: Максимальное количество растворенного вещества, растворенного в растворителе при данной температуре, называется насыщенным раствором, в котором растворенное вещество больше не может растворяться.
Вопрос 11. Что такое ненасыщенный раствор?
Ответ: Если количество растворенного вещества, содержащегося в растворе, меньше уровня насыщения, он называется ненасыщенным раствором.
Вопрос 12. Как преобразовать насыщенный раствор в ненасыщенный или наоборот?
Ответ: Насыщенный раствор при нагревании становится ненасыщенным, а ненасыщенный раствор при охлаждении становится насыщенным.
Вопрос 13.Почему воду называют универсальным растворителем?
Ответ: Вода может растворять в себе большое количество веществ.
Вопрос 14. Что такое эффект Тиндаля?
Ответ. Рассеяние света коллоидными частицами известно как эффект Тиндаля.
Вопрос 15. Как разделить коллоидные смеси?
Ответ: При центрифугировании в центрифужной машине коллоидный раствор хранится в пробирке, очень быстро вращается, и под действием центробежной силы коллоидные частицы отделяются.
Вопрос 16. Что такое эмульсия?
Ответ: Когда и дисперсная фаза, и диспергирующая среда жидкие, это называется эмульсией. Например, молоко, крем для лица.
Вопрос 17. Что такое аэрозоль?
Ответ. Когда твердое или жидкое вещество диспергировано в газе, оно называется аэрозолем. Например, дым, туман.
Вопрос 18. Каков принцип разделения несмешивающихся жидкостей?
Ответ: Принцип разделения несмешивающихся жидкостей на слои в зависимости от их плотности.Менее плотная жидкость собирается вверху, а более плотная жидкость – внизу. ‘
Вопрос 19. Что такое хроматография?
Ответ: Хроматография – это метод, используемый для разделения тех растворенных веществ, которые растворяются в одном и том же растворителе.
Вопрос 20. Что такое дистилляция?
Ответ: Дистилляция – это метод разделения двух смешивающихся жидкостей, которые кипят без разложения и имеют достаточную разницу в точках кипения.
Вопрос 21. Как можно разделить две жидкости с разницей точек кипения менее 25 К?
Ответ: Для разделения смеси двух и более смешивающихся жидкостей, у которых разница температур кипения менее 25 К, используется фракционная перегонка.
Вопрос 22. Что такое конденсатор?
Ответ: Это устройство, используемое для преобразования газа в жидкость путем ее охлаждения.
Вопрос 23. Что такое кристаллизация?
Ответ: Когда насыщенный раствор нагревают и дают ему медленно остыть, кристаллы растворенного вещества, растворенные в насыщенном растворе, отделяются от него.Он используется для очистки твердых веществ.
Вопрос 1. Почему смесь называется нечистым веществом?
Ответ: Смесь состоит из различных компонентов, которые сохраняют свои свойства и могут быть легко разделены физическими процессами, поэтому ее называют нечистым веществом.
Вопрос 2. Назовите различия между смесью и компаундом.
Ответ:
Вопрос 3.Различают физическое изменение и химическое изменение.
Ответ:
Вопрос 4. Укажите свойства решения.
Ответ: Свойства раствора:
- Раствор представляет собой однородную смесь.
- Частицы раствора меньше 1 нм и не видны невооруженным глазом.
- Не рассеивать луч света.
- Частицы растворенного вещества не могут быть отделены от смеси в процессе фильтрации, поэтому раствор является стабильным.
Вопрос 5. Укажите свойства суспензии.
Ответ: Свойства подвески
- Суспензия представляет собой гетерогенную смесь с размером частиц более 100 нм.
- Частицы суспензии можно увидеть невооруженным глазом.
- Частицы могут рассеивать луч света.
- Нестабильно.
Вопрос 6. Что такое коллоидный раствор?
Ответ: Это неоднородный раствор, который кажется однородным, размер частиц очень мал, поэтому его нельзя увидеть невооруженным глазом, но он стабилен.Например, молоко и кровь.
Вопрос 7. Укажите свойства коллоидного раствора.
Ответ: Свойства коллоидного раствора.
- Это гетерогенная смесь с размером частиц от 1 нм до 100 нм.
- Размер частиц очень мал, их не видно невооруженным глазом.
- Рассеивает луч света.
- Они стабильны, поскольку частицы не оседают, когда их не трогают.
Вопрос 8.Дайте приложения центрифугирования.
Ответ: Применение центрифугирования:
- Используется в диагностических лабораториях для анализа крови и мочи.
- Используется на молочных заводах и в домашних условиях для отделения сливочного масла от сливок.
- Используется в стиральных машинах для выжимания воды из мокрой одежды.
Вопрос 9. Приведите приложения хроматографии.
Ответ: Применения хроматографии
- Для разделения цветов в красителе.
- Для отделения пигментов от натуральных красок.
- Для отделения лекарств от крови.
Вопрос 10. Почему кристаллизация лучше испарения?
Ответ: Кристаллизация – это процесс, при котором чистое твердое вещество в форме кристаллов отделяется от раствора. Кристаллизация лучше испарения, потому что во время испарения
- Некоторые твердые вещества разлагаются, а некоторые, например сахар, могут обугливаться при нагревании до высыхания.
- Некоторые примеси могут оставаться растворенными в растворе даже после фильтрации, которые при испарении загрязняют твердое вещество.
Вопрос 11. Как вы разделите смесь масла и воды?
Ответ: Чтобы разделить смесь масла и воды, нам понадобится делительная воронка, так как оба являются несмешивающимися жидкостями. Перелейте смесь в делительную воронку и дайте ей постоять некоторое время в покое. Так образовался отдельный слой масла и воды. Откройте кран делительной воронки и осторожно слейте нижний слой воды.
Вопрос 12. Студенту дается смесь порошка нафталиновых шариков и поваренной соли.Ему нужно разделить эту смесь. Как он это сделает?
Ответ: Прежде чем выбирать метод разделения, необходимо знать свойства как нафталина, так и поваренной соли.
Нафталин – сублимат, который при нагревании непосредственно переходит в газообразное состояние. Следовательно, чтобы отделить летучее соединение (сублимат) от нелетучего соединения (не сублимат), используется процесс сублимации.
В китайской посуде смесь хранится и ставится на подставку. В китайской посуде над смесью ставят перевернутую воронку с закрытым стержнем.Сублимат при нагревании собирается на воронке, а поваренная соль остается в китайской посуде.
Вопрос 13. Как получить из воздуха разные газы?
Ответ: Воздух представляет собой однородную смесь, компоненты которой можно разделить путем фракционной перегонки.
Вопрос 14. Нарисуйте блок-схему, показывающую систему очистки воды на гидротехнических сооружениях.
Ответ:
В фильтрующем баке вода проходит через различные слои песка и гравия, как показано на рисунке выше, это для адсорбции примесей.
Чистая вода поступает в хлорированный резервуар, где вода смешивается с отбеливающим порошком / хлором для уничтожения бактерий, а затем подается в дома.
Вопрос 15. Почему воздух считается смесью, а не составом?
Ответ: Воздух считается смесью, поскольку обладает следующими свойствами:
- Каждый компонент, присутствующий в воздухе, сохраняет свои свойства.
- Каждый компонент можно разделить с помощью простых физических процессов.
- Компоненты не имеют фиксированной пропорции.Все газы присутствуют в разном количестве. Например, в более зеленой зоне – больше кислорода и водяного пара; вблизи промышленной зоны – воздух состоит из множества примесей и взвешенных в нем дыма.
Вопрос 16. Как доказать, что вода представляет собой соединение?
Ответ: Вода – это соединение, потому что если мы пропускаем через нее электричество, то на двух разных электродах мы получаем два разных газа, то есть кислород и водород во время электролиза воды. Соотношение кислород: водород составляет 1: 2 по количеству молекул.
- Свойства газов кислорода и водорода полностью отличаются от свойств жидкой воды.
- Соотношение кислород: водород всегда постоянно, т. Е. 1: 2 по объему.
- Для разделения компонентов воды нам нужна электролитическая ячейка, а это непростой процесс.
Вопрос 17. Как преобразовать насыщенный раствор в ненасыщенный путем нагревания?
Ответ: Говорят, что насыщенный раствор является насыщенным при данной температуре, когда больше нет количества растворенных частиц для растворения / диссоциации в воде.Это потому, что растворенная частица заняла все межмолекулярное пространство, присутствующее в растворителе.
При нагревании молекулы растворителя приобретают кинетическую энергию, начинают вибрировать и пытаются удаляться друг от друга, тем самым размещая в этом пространстве еще несколько частиц растворенного вещества, и, следовательно, он становится ненасыщенным раствором.
Вопрос 18. Чем отличается туман от дыма?
Ответ: Туман – это коллоидный раствор с жидкостью, диспергированной в газе.
Дым – коллоидный раствор, твердое вещество которого диспергировано в газе.
Вопрос 19. Если 20 г соли составляет 220 г раствора, рассчитайте концентрацию раствора:
Вопрос 1. Назовите разницу между истинным раствором, коллоидным раствором и суспензией.
Ответ: Разница между истинным раствором, коллоидным раствором и суспензией
Вопрос 2. Назовите различные типы коллоидов с примерами.
Ответ: Разные коллоиды образуются из-за разной дисперсной фазы и диспергирования
Вопрос 3. (a) Определите решение.
(б) Приведите разные типы решений, приведя каждый по одному примеру.
Ответ: (а) Раствор: Это однородная смесь двух или более веществ. Он состоит из растворенного вещества и растворителя.
(b) Различные типы растворов:
(i) На основе растворителя – водный и неводный водный раствор содержит воду в качестве растворителя (сахар + вода). В неводном растворе есть другой растворитель, но не вода.Пример, (сера + дисульфид углерода)
(ii) В зависимости от количества растворенного вещества, растворенного в растворителе – разбавленный раствор и концентрированный раствор
Разбавленный раствор – в растворителе присутствует меньшее количество частиц растворенного вещества.
Концентрированный раствор – Максимальное количество растворенного вещества в растворителе.
(iii) Количество растворенного вещества, присутствующее в максимальной емкости при данной температуре – насыщенный и ненасыщенный раствор.
Насыщенный раствор – это раствор, в котором растворенное вещество больше не может растворяться в данном растворителе при данной температуре.
Ненасыщенный раствор – это раствор, в котором некоторое количество растворенного вещества может растворяться в растворителе при заданной температуре.
(iv) В зависимости от размера частиц растворенного вещества
Вопрос 4. Как можно разделить следующие смеси?
(а) Песок + железо (б) Сливки из молока
(в) Соль + вода (г) Хлорид аммония + NaCl
(д) Сульфат меди + вода (е) Рис и дал (сырые)
(г) Газы из воздуха (з) Бензин и дизельное топливо из сырой нефти
(i) Лекарственные препараты из крови (j) Ацетон из воды
Ответ:
Вопрос 1.Сестра Анила случайно налила воды в бутылку с оливковым маслом и испугалась выговоров. Анил помог сестре и отделил воду от оливкового масла, используя бутылку как делительную воронку.
(а) Каков принцип использования делительной воронки?
(b) Предложите два метода разделения, используемых для разделения жидких смесей.
(c) Какая ценность анила видна в приведенном выше случае?
Ответ: (а) Принцип делительной воронки заключается в разнице плотностей двух жидкостей.
(b) Жидкие смеси можно разделить дистилляцией и фракционной перегонкой.
(c) Анил показал ценность помощи, заботы и ответственного поведения.
Вопрос 2. Прити увидела рабочего, входящего в канализационный люк сразу после снятия крышки. Она немедленно остановила проникновение родов в люк и сказала ему подождать некоторое время, прежде чем он войдет в люк.
(а) Что произойдет, если рабочие сразу войдут в люк для чистки) после снятия крышки?
(b) Назовите основные газы, выходящие из люка.
(c) Какая ценность Прити видна в вышеупомянутом законе?
Ответ: (a) Если рабочий сразу же войдет в люк после снятия его крышки, он умрет от удушья и вдыхания ядовитых газов, которые сжимаются и выделяются сточными водами.
(b) Газы, выбрасываемые из канализационного люка, – это метан, диоксид углерода и сероводород.
(c) Прити демонстрирует ценность морального ответственного поведения и сознательного гражданина.
Вопрос 3.Прасанна хотел купить в магазине дезодорант. При покупке флакона он почувствовал, что он немного тяжелее обычного флакона с дезодорантом, который он покупал каждый раз. Он прочитал вес, указанный на бутылке, и сказал продавцу, чтобы он весил столько же. Он обнаружил, что бутылка была тяжелой, и, открыв бутылку с дезодорантом, он обнаружил, что она наполовину заполнена водой. Он пожаловался на это в орган по защите прав потребителей.
(a) Определите плотность.
(б) Какие еще вещества, кроме воды, некоторые владельцы магазинов добавляют в дезодорант?
(c) Какая ценность Прасанны отражена в этом действии?
Ответ: (а) Плотность любого вещества определяется как масса вещества на единицу объема.
(b) В бутылки с дезодорантом можно добавить дешевые газы или сжатый воздух.
(c) Прасанна показал ценность лидерских качеств, законных, знающих и ответственных граждан.
Вопрос 4. Отец Риты всегда проверял свою машину на загрязнение. Он проверил его на наличие аэрозоля, выпущенного из его машины.Он также использует неэтилированный бензин и по возможности пользуется общественным транспортом. Он экономно использует свою машину.
(а) Что такое аэрозоль?
(b) Что происходит, когда дым, выходящий из транспортного средства, смешивается с туманом?
(c) Какие ценности отца Риты здесь отражены?
Ответ: (a) Когда твердое или жидкое вещество диспергировано в газе, оно называется аэрозолем, например дым.
(b) Когда дым смешивается с туманом, образуется смог.
(c) Отец Риты – сознательный гражданин, заботящийся об окружающей среде и послушный.
| Факт | |
|---|---|
| 1 | В 1989 году Барбара Лиминг издала автобиографическую книгу под названием «Если бы это было счастье: биография Риты Хейворт». В книге Лиминг утверждала, что Хейворт стала жертвой сексуального насилия со стороны собственного отца. Лиминг утверждает, что Хейворт доверил этот секрет Орсону Уэллсу, который сказал о своей бывшей жене: «Если это было счастье, представьте, какова была остальная часть ее жизни», которую Лиминг затем принял за название своей книги.Среди прочего, Лиминг считает, что последующие разрушительные браки Хейворт, любовные интриги, затянувшийся процесс опеки над Ясмин на фоне обвинений в пренебрежении детьми – которые, по всей видимости, были правдой – и ее битвы с Columbia Pictures были отчасти вызваны этими чувствами. предательства и вины, которые окрашивают жизнь жертв инцеста. |
| 2 | Рита Хейворт появилась в девяти фильмах в 1937 году. В трех из них она была объявлена как Рита Кансино, и в одном она не значилась в титрах. |
| 3 | Введен в Зал славы поклонников волос в 2013 году. |
| 4 | Во время Второй мировой войны журнал YANK еженедельно издавался армией США для всех видов вооруженных сил США. Сценаристы были военнослужащими, и они писали рассказы о Второй мировой войне и рисовали карикатуры, высмеивая жизнь службы, как, например, G.I Joe и Sad Sack. В качестве «подстилки» одним из самых популярных разделов журнала были фотографии девушки в стиле пин-ап, обычно одетой в купальный костюм или соблазнительную одежду.Фотография Риты Хейворт появилась в номере журнала от 7 июля 1944 года. |
| 5 | В 1960-х Хейворт сказал читателям испаноязычного журнала Cinemundo: «Мне нравились фильмы Долорес Дель Рио, а также Лупе Велес… Я не фантазировал, что когда-нибудь стану такой звездой, как они, но и не думал. «Не думаю, что я не смог бы сделать это с тем именем, с которым родился». |
| 6 | В 1923 году Кансино выступили в двухактном бродвейском мюзикле «Безумие Гринвич-Виллидж» в театре Winter Garden на Бродвее 1634 года в Нью-Йорке.В состав Кансино входили Эдуардо, его брат Ангел, его жена Волга и его 5-летняя дочь Рита. С 20 сентября 1923 года по январь 1924 года в мюзикле было представлено 140 представлений. |
| 7 | В октябре 1976 года Рита приняла приглашение выступить на телеканале Буэнос-Айреса, Аргентина, отдавая дань уважения ее долгой карьере. В это время в округе царили политические волнения, и посол США телеграфировал в Вашингтон, сообщая Госдепартаменту, что местные террористы устроят «гранату», когда Рита покинет свой отель.Находясь в Буэнос-Айресе, Риту окружили охранники. Подъехав к отелю из аэропорта, Рита открыла шторы на окне, и в парке через улицу взорвалась бомба. Несколько дней спустя офисное здание взорвалось примерно в 10 футах (3,048 м) от машины, в которой она ехала. К счастью, ни в том, ни в другом случае она не пострадала. |
| 8 | Фред Астер и Рита Хейворт снялись в фильме 1942 года «Вы никогда не были красивее» и репетировали танцевальные сцены в близлежащем похоронном бюро, потому что в Columbia Studios не было подходящего места.В своей биографии Астер написал: «Смеяться во время перерывов было частью дневной работы, и я всегда пытался придумать какую-нибудь шутку, чтобы поиграть с Ритой. В одном случае я крикнул: «Ну вот, я начинаю любить это место – оно меня больше не подводит, я к нему привык – готово, Рита?» Рита сразу вскочила. и пришел ко мне, чтобы начать наш первый совместный шаг. Когда я взял ее за руки, она испустила один крик и попятилась. Я только что окунул обе руки в ведро со льдом, которое мы использовали для бутылок с газировкой.Это прервало репетиции примерно на полчаса ». |
| 9 | За появление в фильме 1941 года «Земляничная блондинка» Рите Хейворт заплатили 6500 долларов (106 499,63 доллара в долларах 2016 года) из расчета 927,85 долларов в неделю (15 202,41 доллара в долларах 2016 года) за семь гарантированных недель работы. |
| 10 | В мае 1951 года Рита Хейворт переехала в Гленвью, штат Невада, на озере Тахо, чтобы получить законное место жительства, чтобы она могла развестись с Али Хан. (Закон Невады гласит, что вы должны иметь законное место жительства в течение шести месяцев.) Находясь в Неваде, Рита увлеклась гольфом и на всю жизнь увлеклась гольфом, а когда у нее было время, она играла в загородных клубах Калифорнии. Она сказала: «Я играла на полях по всему миру, включая Японию. Я встретил Боба Хоупа на ирландских и шотландских связях, а в Испании мы с Скипом Хэтэуэем немного поиграли ». |
| 11 | Во время Второй мировой войны Рита совершила единственный тур по USO и успела побывать в шести военных лагерях, раздав тысячи автографов, прежде чем вернуться из Техаса, где, как сообщалось, у нее случился нервный срыв, который был полноценным из-за чрезмерного энтузиазма.Она также участвовала в нескольких радиошоу с программами Боба Хоупа и Службы радио вооруженных сил, таких как «Command Performance» (не менее пяти шоу), «GI Journal» и «Mail Call». Рита также работала в Голливудской столовой, которая работала на бульваре Кауэнга 1451 в Голливуде с 3 октября 1942 года по 22 ноября 1945 года, в качестве клуба, предлагающего еду, танцы и развлечения для военнослужащих, обычно направляющихся за границу. Несмотря на то, что большинство посетителей были военнослужащими США, столовая была открыта для военнослужащих союзных стран, а также женщин всех родов войск.Входным билетом военнослужащего была его форма, а в столовой все было бесплатно. Рита была одной из самых красивых и постоянных волонтеров, которые пожертвовали свои услуги в Голливудской столовой, подавая еду и танцуя с военнослужащими. Она также стала активно собирать металлолом, а также продвигать облигации для военных нужд. Для Риты Хейворт, как и для других звездочек, выступавших перед американскими солдатами на различных должностях, эта задача временами была непосильной, заставляя их утомляться и ломаться. |
| 12 | Семья Кансино переехала из Нью-Йорка в Лос-Анджелес, Калифорния, когда Рите было девять лет. Она училась в школе Carthay в Лос-Анджелесе, где играла роли в нескольких школьных пьесах, и нашла свою первую актерскую роль, когда ей было 11 лет, в сценическом прологе к фильму «Бэк-стрит» в театре Carthay Circle. Затем она провела год в средней школе Александра Гамильтона, прежде чем в девятом классе ее учеба была остановлена, когда она стала партнершей своего отца по танцам. |
| 13 | В 1977 году Рита Хейворт поехала в Англию, а затем в Италию, где она приняла Премию Рудольфа Валентино в Бари. Марго Хаммонд написала в журнале «Variety»: «После драматического выступления в центральном проходе оперного театра среди мигающих прожекторов, звуков« Так говорил Заратустра »Рихарда Штрауса и громовых аплодисментов ошеломленная Рита приняла награду, сказав публике: Это самый счастливый момент в моей жизни ». |
| 14 | Рита Хейворт вышла замуж за Али Хана 17 мая 1949 года на гражданской церемонии и 28 мая 1949 года.Семья Хан была сильно вовлечена в скачки, владение и скачки лошадей. Хейворт не интересовалась спортом, но она стала членом Чистокровного клуба Дель Мар, расположенного в Дель Мар, Калифорния. Она купила кобылку по имени Double Rose, которая выиграла несколько гонок во Франции и заняла второе место на Prix de l’Arc de Triomphe в 1949 году на ипподроме Longchamp. Париж, Франция. |
| 15 | В 1987 году фестиваль американского кино в Довиле (Франция) почтил память Риты Хейворт, скончавшейся несколькими месяцами ранее и представленной в Довиле своей дочерью принцессой Ясмин Ага Хан. |
| 16 | Когда премьера «Гильды» состоялась на первом в истории Каннском кинофестивале в 1946 году, все гудели о стриптизе Риты Хейворт под названием «Положи всю вину на маму» в черном атласном платье-футляре без бретелек с длинным боковым разрезом и удлиненных перчатках. Художник по костюмам Жан Луи создал индивидуальное платье (для которого требовался корсет и индивидуальные ремни безопасности) и помог закрепить концепцию роковой женщины. |
| 17 | Клаудиа Кардинале и Рита Хейворт снялись в фильме 1964 года «Мир цирка.Г-жа Кардинале сказала: «Во время съемок« Мира цирка »я была в своем трейлере и делала перерыв, когда появилась Рита в слезах. Она посмотрела мне в глаза и всхлипнула: «Когда-то я тоже была красива». Она так тронула меня, что я тоже заплакал. Она была великолепна! В ней была та ностальгическая сторона, которая делала ее еще более очаровательной ». |
| 18 | Во время президентской кампании 1944 года Рита Хейворт была одной из почти 50 голливудских знаменитостей, поддержавших президента Франклина Д.Рузвельт. |
| 19 | К 1940 году в обращении находилось 3800 рассказов и 12000 изображений Риты Хейворт. |
| 20 | В 1977 году Рита Хейворт получила награду National Screen Heritage Award в отеле Shoreham в Вашингтоне, округ Колумбия. Перед церемонией Джин Келли пошел в номер Риты, но никто не заметил, как он спустился. |
| 21 | Джеймс Хилл в своей книге 1983 года «Рита Хейворт: воспоминания» указал, что их брак – ее пятый и последний, его единственный – распался, потому что он вынудил Хейворта продолжать сниматься в фильмах, когда она хотела, чтобы они оба ушли из Голливуда. шум, позволяющий ей рисовать, а ему писать. |
| 22 | Хореограф Джек Коул так сказал о Рите Хейворт: «Рита была одиноким человеком, ты всегда так чувствовал к ней. Во время репетиций она сидела с девочками, но в основном одна, а не в одиночестве, просто в одиночестве. Но всегда леди ». Он также сказал: «На самом деле она испанская девочка-подросток, которая почти никогда не повзрослеет. Если только она не попросит кого-нибудь сказать: «Не делай этого! Не делай этого / Ешь! Не ешь / Если тебе скучно, ложись спать, обмазывайся », она похожа на девочку-подростка, которая делает все, что ей нравится.Мне нравится Рита Хейворт, она очень милая женщина. Один из немногих, с кем приятно работать в кино ». |
| 23 | Джейн Уизерс сказала, что фильм 1935 года «Падди О’Дей» – один из моих любимых фильмов… [Создавая «Падди О’Дей»], я посетил съемочную площадку «Чарли Чан в Египте» по соседству. А на съемочной площадке была [16-летняя] красивая девушка, которая танцевала бальные танцы со своим партнером по фильму. Мне было всего восемь, но я так сильно относился к этой девушке – она была просто динамитом. Я попросила встретиться с ней, ее звали Рита Кансино.Она была мучительно застенчива. Она сказала: «Я просто люблю танцевать, и мне просто не терпится сниматься в кино». Я сказал: «Ты когда-нибудь играл?», А она сказала: «О нет, я никогда не играла, я танцор. «Я сказал:« Тебе не нужно учиться актерскому мастерству, это просто должно быть в твоем сердце »». Незадолго до начала съемок Джейн взяла Риту за руку и помолилась с ней, и этот небольшой добрый жест привел к дружбе на всю жизнь. Уизерс произнесла панегирик на похоронах Хейворта в 1987 году, и во время панегирика она вспомнила, что Рита Хейворт страдала от страха перед сценой в начале своей карьеры.Г-жа Уизерс также сказала, что «у нее всегда было столько энтузиазма в танцах, что, когда я узнал, насколько она застенчива, я был поражен. |
| 24 | В октябре 1996 года Ким Новак дал интервью репортеру газеты Washington Post. Играя вместе с Ритой Хейворт в фильме 1957 года «Приятель Джоуи», г-жа Новак сказала, что любит свою партнершу по фильму Риту Хейворт, но не Фрэнка Синатру, хотя, по общему мнению, у них с Новаком был роман несколькими годами ранее. Она сказала: «Я знала Риту Хейворт ровно настолько, чтобы понимать, что она всего лишь нежный, чувствительный и красивый человек.Прекрасный человек. Очень нежный. Она никогда не отстаивает свои права ». Комментируя Фрэнка Синатру, г-жа Новак сказала: «Я чувствовала, что он был не очень справедлив по отношению к Рите Хейворт. Он не приходил на репетиции танцев и не позволял ей пройти через все это, затем он пришел в последний день, и всю нашу работу пришлось сократить, потому что он не хотел этого или он не хотел сделай это. Это было так несправедливо, так жестоко, так неуместно ». Однако Синатра настоял на том, чтобы Рита Хейворт получила высший счет. Когда кто-то спросил, почему, Синатра сказал журналистам: «Для меня Хейворт – это Колумбия (изображения).Возможно, они сделали ее звездой, но она дала им класс ». |
| 25 | Фред Астер вспомнил, насколько одаренной и быстрой она была в изучении самых сложных процедур – часто разучивала шаги утром, обдумывала их во время обеда и после обеда исполняла танец без единой ошибки. |
| 26 | Монсеньор Питер Хили, проводивший похоронную мессу для Риты Хейворт в 1987 году, отметил, что ему звонили многие люди со всей страны, которые помнили милость и милосердие мисс Хейворт.«Рита в своих страданиях продолжала приносить в мир красоту и любовь», – сказал он. Он прочитал отрывок из «Пророка» Халила Джебрана, в котором мисс Хейворт подчеркнула слова «Я в сердце Бога». |
| 27 | Повар Риты Хейворт, Дороти Холмс, заявила, что «лучшей подругой Риты Хейворт была певица Дина Шор. Я любил Дину, потому что у нее был прекрасный характер. Дина Шор пришлет лимузин к дому Риты, и ее отвезут в личный ракетный или гольф-клуб Дины, где Дина разделит несколько дружеских напитков.». |
| 28 | Рита Хейворт поступила в больницу Силвер Хилл в Нью-Ханаане, штат Коннектикут, в апреле 1977 года, чтобы вылечить от чрезмерного употребления алкоголя и улучшить свое психическое здоровье. Ее друг, Мак Крим, заявила, что она успешно продолжала избегать употребления алкоголя после того, как вернулась домой, но, судя по ее поведению, вызванному болезнью Альцгеймера, люди все еще часто предполагали, что она была пьяна. |
| 29 | Персонаж, страдающий амнезией, на Малхолланд Драйв Дэвида Линча решает взять свое имя, увидев его на плакате. |
| 30 | Чарльтон Хестон написал о недолгом браке Риты Хейворт с Джеймсом Хиллом. Хестон и его жена Лидия присоединились к паре за ужином в ресторане в Испании с режиссером Джорджем Маршаллом и Рексом Харрисоном, партнером Хейворта по фильму «Счастливые воры». Хестон написал в своих мемуарах, что этот случай «превратился в самый неловкий вечер в моей жизни», описывая, как Хилл обрушила на Хейворт «непристойные оскорбления», пока она «не превратилась в беспомощный поток слез, уткнувшись лицом в руки». .Хестон пишет, как они все сидели ошеломленные, свидетели «супружеской резни», и хотя он «сильно искушал ударить его» (Хилла), вместо этого он просто отвел свою жену Лидию домой, когда она встала, почти в слезах. Хестон написал: «Мне стыдно уйти от унижения мисс Хейворт. Больше я ее никогда не видел ». |
| 31 | Похороны Риты Хейворт прошли 19 мая 1987 года в Римско-католической церкви Доброго Пастыря в Беверли-Хиллз, Калифорния. Несущие гроб Гленн Форд, Рикардо Монтальбан, Сезар Ромеро, Тони Франсиоза, Дон Амече, Гермес Пэн и агент Бадд Бертон Мосс подошли к алтарю перед деревянной шкатулкой, задрапированной белыми лилиями и тюльпанами.Фред Астер, сыгравший с мисс Хейворт в двух мюзиклах, отсутствовал и не мог занять свое место гроба из-за плохого состояния здоровья; он умер через 34 дня после похорон Риты. Более 500 скорбящих, включая великих киноактеров, фанатов, родственников и друзей, собрались в церкви, чтобы услышать, как Рита Хейворт восхваляется как «милая, добрая, нежная леди», которая на самом деле сторонилась камер. Это воспоминание о мисс Хейворт было дано Джейн Уизерс, детской актрисой 1930-х годов и подругой мисс Хейворт.Интернирование проходило на кладбище Святого Креста в Калвер-Сити, Калифорния. Дочери мисс Хейворт, Ребекка Уэллс и принцесса Ясмин, шли за гробом. |
| 32 | 15 мая 1987 года президент Рональд Рейган выступил со следующим заявлением о смерти Риты Хейворт: «Рита Хейворт была одной из самых любимых звезд нашей страны. Гламурная и талантливая, она подарила нам много замечательных моментов на сцене и на экране и восхищала публику с тех пор, как она была молодой девушкой.В более поздние годы Рита стала известна своей борьбой с болезнью Альцгеймера. Ее мужество и искренность, а также ее семья сыграли огромную роль в привлечении внимания всего мира к болезни, которая, как мы все надеемся, скоро будет излечена. Мы с Нэнси опечалены смертью Риты. Она была другом, по которому мы будем скучать. Мы выражаем глубокие соболезнования ее семье ». |
| 33 | В феврале 1987 года Рита Хейворт впала в полукому и умерла через три месяца в своей квартире в Центральном парке Вест на Манхэттене, Нью-Йорк. |
| 34 | В июле 1972 года она должна была заменить Лорен Бэколл в оригинальном бродвейском мюзикле «Аплодисменты», играемом в Palace Theater в Нью-Йорке. Она передумала, когда почувствовала, что у нее не хватит времени на репетицию перед открытием. Энн Бакстер заменила ее. |
| 35 | В 1962 году после трех недель репетиций она оставила главную роль в трехактной бродвейской сценической комедии «Шаг на трещину», потому что поняла, что пьесу еще нужно много переписать.Спектакль открылся в Театре Этель Бэрримор в Нью-Йорке 17 октября и закрылся на следующий день после одного спектакля. |
| 36 | Часто работал с Чарльзом Видором. Он снял ее в фильмах «Женщина в вопросе» (1940), «Девушка с обложки» (1944), «Гильда» (1946) и «Любовь Кармен» (1948). |
| 37 | Стал первым публичным лицом болезни Альцгеймера. В 1960-х она начала забывать свои реплики. Люди вокруг нее думали, что это из-за выпивки.Оглядываясь назад, можно предположить, что она была на ранней стадии болезни Альцгеймера. |
| 38 | В декабре 1949 года беременная 31-летняя Рита Хейворт жила в Швейцарии со своим третьим мужем, Али Саломоне Хан. Когда она должна была родить, они планировали направить полицейский эскорт в клинику Моншуази в Лозанне, но Рита уехала. у нее начались схватки в 3 часа ночи в среду, 28 декабря, и Али запаниковала и отвезла ее в клинику. Рита рожала семь часов и родила пятерку.5-фунтовая (2,49-килограммовая) девочка, которую звали Ясмин Ага Хан. |
| 39 | Беременная 26-летняя Рита Хейворт поступила в больницу Святого Иоанна в Санта-Монике, штат Калифорния, в пятницу, 15 декабря 1944 года. Она была выбрана потому, что эта больница была известна своей уединенностью, которую предоставляли знаменитостям. Двумя днями позже она родила своего первого ребенка с помощью кесарева сечения, здоровую девочку весом 7 фунтов (3,175 кг), которую назвали Ребеккой Уэллс. Отцом ребенка был ее второй, а затем бывший муж Орсон Уэллс, а крестным отцом ребенка был Фрэнк Синатра, который был хорошим другом пары. |
| 40 | Через год после «Крови и песка» (1941) Энтони Куинн объявил, что он и Хейворт вместе сделают картину боя быков, но это так и не было сделано. |
| 41 | Режиссер Рубен Мамулян сказал о ней «Vogue»: «На экране, если актер может двигаться, ему больше не нужно для успешной карьеры. Хейворт двигалась лучше, чем кто-либо еще, кого я когда-либо видел в кино. Камера отреагировала на ее движение так же, как и на интеллект Гарбо и мим Чаплина.». |
| 42 | Она упоминалась в видеоигре Medal of Honor: Rising Sun (2003). |
| 43 | В телесериале «Франклин и Баш» (2011) большой портрет Хейворта в шелковом неглиже часто можно увидеть в адвокатской конторе, где работают главные герои. |
| 44 | Наряду с Вероникой Лейк, Джули Лондон и Лорен Бэколл, она была одним из четырех вдохновителей, которые помогли создать персонажа Джессику Рэббит. |
| 45 | И она, и последний муж, Джеймс Хилл, умерли от осложнений, вызванных болезнью Альцгеймера. |
| 46 | Она была пожизненным либеральным демократом. |
| 47 | Был хорошим другом Гермеса Пэна. |
| 48 | Бывшая мачеха Кристофера Уэллса и Дика Хеймса-младшего. |
| 49 | Она была награждена звездой на Голливудской аллее славы на Вайн-стрит, 1645 в Голливуде, штат Калифорния, 8 февраля 1960 года. |
| 50 | Согласно книге Чарльза Кидда «Дебретт едет в Голливуд», Рита произошла по материнской линии от Аллина Хауорта, чья семья, как считалось, происходила из города Хауорт в Западном Йоркшире. Хаворт также известен как дом сестер Бронте. |
| 51 | Одна из немногих актрис, которые танцевали и с Фредом Астером, и с Джин Келли в фильмах, другие актрисы, которые также танцевали, это Джуди Гарланд, Сид Чарисс, Вера-Эллен, Дебби Рейнольдс и Лесли Кэрон. |
| 52 | Когда она умерла, ее бывший партнер по фильму Пэдди О’Дей (1936) Джейн Уизерс произнес панегирик на ее похоронах. |
| 53 | Двоюродный брат Джинджер Роджерс и племянница актера Винтона Хейворта. |
| 54 | Биография в: «Энциклопедия Скрибнера американских жизней». Том второй, 1986–1990, страницы 399–400. Нью-Йорк: сыновья Чарльза Скрибнера, 1999. | .
| 55 | В Италии все ее фильмы были дублированы либо Тиной Латтанци, в первую очередь Джильда (1946), а позже в ее карьере Лидией Симонески. |
| 56 | Под влиянием второго мужа Орсона Уэллса Рита начала читать классическую литературу. Во время беременности в 1944 году она была очень впечатлена произведением Вальтера Скотта «Айвенго» и назвала свою первенцу Ребеккой в честь героини романа. |
| 57 | ГлаваColumbia Pictures Гарри Кон начал интересоваться Хейворт как звездным материалом только после того, как она начала проходить болезненные процедуры электролиза (по настоянию мужа Эдди Джадсона), которые резко изменили ее линию волос и внешний вид. |
| 58 | Публицист Генри Роджерс, нанятый Эдди Джадсоном для продвижения своей жены, сказал о нем: «Мне казалось, что Эдди продал бы свою жену по самой высокой цене, если бы это продвинуло ее карьеру». |
| 59 | Вместе с Джеймсом Кэгни упоминается по имени в песне Тома Уэйтса «Invitation to the Blues». |
| 60 | Изображается Вероникой Уотт в Hollywoodland (2006). |
| 61 | Сюжет песни The White Stripes «Take, Take, Take» из альбома «Get Behind Me Satan». |
| 62 | Сыграла Линда Картер в «Рите Хейворт: Богиня любви» (1983). |
| 63 | Одна из многих кинозвезд, упомянутых в песне Мадонны «Vogue». |
| 64 | Была названа актрисой №19 по версии Американского института кино «50 величайших легенд экрана». |
| 65 | Журнал Premiere назвал ее 34-й величайшей кинозвездой всех времен. |
| 66 | По результатам голосования Entertainment Weekly, она была названа 65-й «величайшей кинозвездой» всех времен. |
| 67 | Она была первой бомбой, появившейся на одном из постеров в «Искуплении Шоушенка» (1994). (Двумя другими были Мэрилин Монро и Ракель Уэлч). |
| 68 | Персонаж Марии Варгас (которую играет Ава Гарднер) в фильме Джозефа Л. Манкевича 1954 года «Босоногая графиня» (1954)) был основан на ней. |
| 69 | Она была первым выбором продюсеров для фильма «Касабланка» (1942), но они не смогли получить ее, и им посчастливилось довольствоваться Ингрид Бергман. |
| 70 | 27 мая 1949 года она вышла замуж за принца Али-хана. Многие забывают, что Рита, а не Грейс Келли, была первой кинозвездой, ставшей принцессой. |
| 71 | В 1946 году экспедиция в пустыню неизведанной канадской долины Безголового наткнулась на заброшенную хижину охотника. В нем экспедиция нашла три вещи: свечу, банку с фасолью и фотографию Риты. |
| 72 | Выбил два зуба Гленну Форду во время их боя в Гильде (1946). |
| 73 | Джеймс Хилл, ее пятый муж, признал ее истинный талант комедийной актрисы. Он пытался побудить ее больше сниматься в комедии, но она почувствовала, что было слишком поздно, и вместо этого начала обижаться на него за то, что он подтолкнул ее к большему количеству работы. |
| 74 | Племянник: Ричард Кансино. |
| 75 | Сестра Эдуардо Кансино младшего и Вернона Кансино. |
| 76 | Знаменитые рыжие волосы не были ее естественного цвета (который был черным).Когда она была подписана, руководители студии решили, что ее линия волос на лбу была слишком низкой, и ей пришлось пройти годы болезненного электролиза, чтобы сделать его выше. |
| 77 | В начале 1940-х она заменила Жана Артура на посту главной женщины-звезды Columbia Pictures. По совпадению, у двух звезд один день рождения (17 октября). |
| 78 | В 1947 году основала собственную продюсерскую компанию «Beckworth Corporation» (образована из слогов имени ее дочери Ребекка и ее собственной фамилии).Она была распущена в 1954 году по совету ее четвертого мужа Дика Хеймса. |
| 79 | По матери она частично ирландка, а частично англичанка. |
| 80 | Отмечен журналом Empire как одна из «100 самых сексуальных звезд» в истории кино (№ 54). [1995] |
| 81 | Похоронен на кладбище Святого Креста в Калвер-Сити, Калифорния, США, в секции «Грот», L196, # 6 (справа от главного тротуара, у обочины). |
| 82 | Изображение ее лица было приклеено к атомной бомбе, сброшенной на атолл Бикини во время испытаний в 1946 году. |
| 83 | Она сыграла сестру Барбары Стэнвик в «Послании к Гарсии» (1936), но после пробного просмотра все ее сцены были вырезаны по просьбе Дэррила Ф. Занука. |
| 84 | Владелец производственной компании Hillworth Productions A.G. вместе со своим пятым мужем Джеймсом Хиллом. |
| 85 | Ее собственный певческий голос слышен во вступлении к ее песням (иначе названным Джо Энн Грир) в Pal Joey (1957). |
| 86 | Ее пение дублировали Нэн Винн (1941-1944), Марта Мирс (1945), Анита Эллис (1946-1948) и Джо Энн Грир (1952-1957). |
| 87 | Знаменитая фотография Риты Бобом Лэндри в «Жизни», 11 августа 1941 г., стр. 33, сделал ее солдатом номер 2 во Второй мировой войне. |
| 88 | Четыре раза появлялась на обложке журнала Life; 15.07.40, 11.08.41, 18.01.43 и 10.11.47. |
| 89 | Ее первое (в титрах) появление в фильме было с танцующей семьей Кансино в короткометражном фильме Vitaphone La Fiesta (1926). |
| 90 | Мать, танцовщица Волга Хейворт (иногда пишется как Хауорт), познакомилась с Эдуардо на Бродвее в 1916 году; они поженились в 1917 году. |
| 91 | Ее отец-танцор, Эдуардо Кансино, сам сын танцора, приехал в Нью-Йорк из Испании в 1913 году с сестрой Элисой. |
| 92 | Согласно некоторым легендам, коктейль «Маргарита» был назван в честь нее, когда она танцевала под своим настоящим именем в ночном клубе Тихуаны, Мексика. |
| 93 | Занял 98 место в списке 100 лучших кинозвезд всех времен по версии журнала Empire (Великобритания). |


