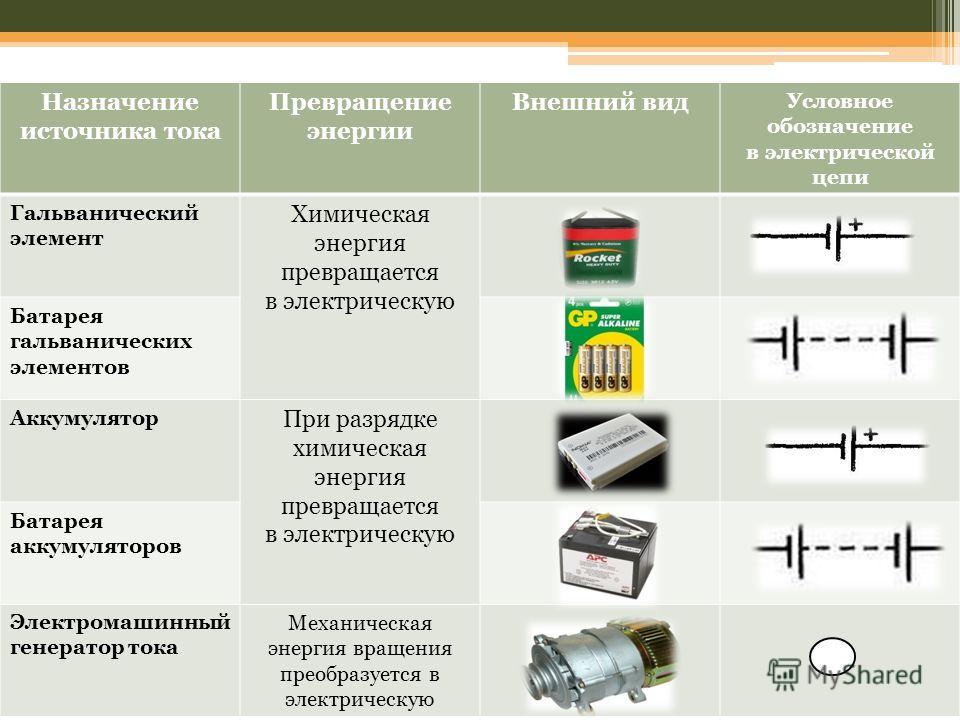
4.3. Гальванические элементы
Гальваническими элементами называют устройства, в которых энергия окислительно-восстановительных реакций преобразуется непосредственно в электрическую.
Методика рассмотрения работы гальванических элементов:
(–) Me1 / Me1n + // Me2 m+ / Me2 (+)
По уравнению Нернста находят потенциалы электродов.
Указывают движение электронов во внешней цепи: от электрода с меньшим потенциалом к электроду с более высоким потенциалом.
Записывают уравнения электродных процессов, определяют характер этих процессов.
Составляют суммарное уравнение окислительно-восстановительной реакции, протекающей в гальваническом элементе.
Рассчитывают величину ЭДС гальванического элемента как разность потенциалов положительного и отрицательного электродов.

Пример 1. Гальванический элемент с водородным электродом.
1 моль/л, 1 моль/л, Т = 298 К, P = 101,3 кПa .
= 0 В , = – 0,76 В (при 1 моль/л).
ē
(–) Zn / ZnSO 4 // H2SO4 , Н2 / Pt (+)
SO42 –
Zn (–): Zn – 2 ē = Zn 2+– процесс окисления;
Pt (+): 2Н ++ 2 ē = Н 2 – процесс восстановления.
Zn + 2Н + = Zn 2+ + Н 2 Zn + H2SO4 = ZnSO4 + Н 2
ЭДС = Е0Ox – Е 0Red = 0 – (– 0,76) = 0,76 В.
Пример 2. Концентрационный гальванический элемент
Оба электрода из одного металла, но
растворы солей, в которые погружены
электроды, разной концентрации.
Ni / NiSO 4( = 10-4 моль/л)// NiSO 4 (=1моль/л) / Ni
Стандартный электродный потенциал = – 0,25 В.
= + · lg = – 0,25 + ·lg 10 –4 = – 0,309 B.
= = – 0,25 B.
ē
(–) Ni1 / NiSO4 (10–4 М) // NiSO4 (1 М) / Ni 2 (+)
SO
Ni1 (–): Ni – 2 ē = Ni 2+ – процесс окисления;
Ni2 (+): Ni2+ + 2 ē = Ni – процесс восстановления.
ЭДС
= – = – 0,25 – (– 0,309) = 0,059 В.
Для предложенных гальванических элементов рассчитайте электродные потенциалы и ЭДС. Если концентрация раствора не указана, потенциал примите стандартным (табл.П.6). Напишите уравнения анодного и катодного процессов, молекулярное уравнение токообразующей реакции, составьте схему и укажите направления движения электронов и ионов.
Al / Al2(SO4)3, 0,005 M // NiSO 4, 0,01 М / Ni
Ni / NiSO4, 0,1 M // H2SO4 / H2 (Pt)
Sn / SnSO4 // Cr2(SO4)3, 0,05 M / Cr
(Pt) H2 / H2SO4 // Al2(SO4)3, 0,005 M / Al
Cu / CuSO4, 0,1 M // H2SO4 / H2 (Pt)
Ag / AgNO3, 0,01 M // H2SO4 / H2 (Pt)
Co / CoSO4, 0,01 M // CoSO4 / Co
Zn / ZnSO4, 0,1 M // FeSO4, 0,01 M / Fe
Ag / AgNO3, 0,01 M // Zn(NO3)2 / Zn
(Pt) H2 / H2SO4 // ZnSO4, 0,01 M / Zn
Cd / Cd(NO3)
Ni / NiSO4, 0,001 M // NiSO4 / Ni
Fe / FeCl2 // FeCl2, 0,01 M / Fe
Cr / Cr2(SO4)3, 0,005 M // ZnSO4 / Zn
Zn / Zn(NO3)2, 0,001 M // Zn(NO3)2 / Zn
Ag / AgNO3 // Cr(NO3)3, 0,005 M / Cr
Cd / CdCl2, 0,1 M // CuCl2, 0,1 M / Cu
Ti / Ti2(SO4)3, 0,5 M // CuSO4 / Cu
Sn / SnSO4, 0,01 M // Fe2(SO4)3 / Fe
Ag / AgNO3, 0,0001 M // Pb(NO3)2 , 0,1 M / Pb
Материалы для скачивания – Кафедра химии
- Главная
- Инженерно-технологический факультет
- Материалы для скачивания
- Кафедра химии
Лекция. Растворы неэлектролитов
Растворы неэлектролитов
Размер файла:
638.79 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Растворы неэлектролитов. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ , 2016. – 33 с.
Учебно-методическое пособие включает лекцию по теме «Растворы неэлектролитов» курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование пособия, в котором рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Окислительно-восстановительные реакции
Размер файла:
609.98 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Окислительно – восстановительные реакции. Лекция по курсу «Общая химия » для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 31 с.
– 31 с.
Учебно-методическое пособие включает лекцию по теме «Окислительно – восстановительные реакции» и предназначено для контролируемой самостоятельной работы студентов инженерно–технологического факультета. Использование такого пособия, в котором рассмотрены важнейшие вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Комплексные соединения
Размер файла:
531.46 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Лекция «Комплексные соединения» по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 26 с.
Учебно-методическое пособие включает лекцию по теме «Комплексные соединения» курса «Общая химия». Комплексные соединения играют важную роль в природе и технике, прежде всего, это ферментативные и фотохимические процессы, перенос кислорода в биологических системах, тонкая технология редких металлов, каталитические реакции и т. д. Координационные свойства проявляются всеми элементами периодической системы.
д. Координационные свойства проявляются всеми элементами периодической системы.
Скачать
Лекция. Кинетика химических реакций. Химическое равновесие
Размер файла:
768.32 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Кинетика химических реакций. Химическое равновесие. Лекции по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 44 с.
Учебно-методическое пособие включает лекции по отдельным темам курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование таких пособий, в которых рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Предэкзаменационные тесты по органической и биологической ХИМИИ
Размер файла:
1.30 MB
Автор:
Макарчиков А.Ф., Колос И.К.
Дата:
26. 12.2016 12:02
12.2016 12:02
Предэкзаменационные тесты по органической и биоло-гической химии для студентов биотехнологического факультета / А.Ф. Макарчиков, И.К. Колос – Гродно: ГГАУ, 2016. – 205 с.
В пособии приведен перечень вопросов для проведения предэкзаменационного тестирования студентов, обучающихся на биотехнологическом факультете, по предмету «Химия (органическая и биологическая)»
Скачать
Лекция. Электролиз. Коррозия металлов и методы защиты металлов от коррозии
Размер файла:
758.87 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:02
Электролиз. Коррозия металлов и методы защиты металлов от коррозии. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 31 с.
Учебно-методическое пособие включает лекции по отдельным темам курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование таких пособий, в которых рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Энергетика химических процессов.
Размер файла:
604.00 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:02
Энергетика химических процессов. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 25 с.
Учебно-методическое пособие включает лекцию по теме «Энергетика химических процессов» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование такого пособия, в котором рассмотрены важнейшие вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Строение атомов элементов
Размер файла:
789.90 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:02
Строение атомов элементов. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ , 2016. – 23 с.
– 23 с.
Учебно-методическое пособие включает лекцию по теме «Строение атомов элементов» курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование пособия, в котором рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Основные понятия и законы химии
Размер файла:
675.23 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Основные понятия и законы химии. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 30 с.
Учебно-методическое пособие включает лекцию по теме «Основные понятия и законы химии» курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование студентами распечатки лекционной темы значительно сэкономит время для понимания материала, излагаемого лектором, и конспектирования.
Скачать
Предэкзаменационные тесты по химии
Размер файла:
813.02 kB
Автор:
Макарчиков А.Ф., Колос И.К.
Дата:
14.11.2016 11:47
Предэкзаменационные тесты по химии для студентов, обучающихся на агробиологических специальностях / А.Ф. Макарчиков, И.К. Колос – Гродно: ГГАУ, 2016. – 201 с.
В пособии приведен перечень вопросов для проведения предэкзаменационного тестирования студентов, обучающихся на агробиологических специальностях, по предмету «Химия».
Скачать
Методическое пособие для лабораторных работ по аналитической химии
Размер файла:
544.41 kB
Автор:
Апанович З.В., Тараненко Т.В., Томашева Е.В., Кулеш И.В., Цветницкая Э.В.
Дата:
28.12.2015 12:22
В пособие излагается материал по аналитической химии в объеме соответствующих программ по специальностям: «Ветеринарная медицина», «Аграномия», «Биотехналогия». Содержатся методические указания по технике выполнения лабораторных работ по качественному и количественному анализу.
Скачать
Комментарии для работы с рабочими тетрадями по химии элементов
Размер файла:
655.75 kB
Дата:
28.12.2015 12:22
Комментарии для работы с рабочими тетрадями по химии элементов / З.В. Апанович, Ю.А. Лукашенко.
Учебно-методическое пособие включает лекции по отдельным темам курса «Неорганическая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета, для которых введен отдельный курс по химии элементов, а также может быть использовано студентами других факультетов.
Скачать
Практикум по физической химии
Размер файла:
1.03 MB
Дата:
01.04.2013 04:24
Учебно-методическое пособие (для проведения лабораторных занятий) для студентов инженерно-технического факультета
Практикум по физической химии: учеб.-мет. пособие / О. И. Валентюкевич.- Гродно: ГГАУ, 2008 – 88с.
Данное пособие предназначено для студентов технологических специальностей аграрного университета. Целью данного пособия является оказание помощи в изучении теоретического материала, а также выработка навыков экспериментальной работы.
Целью данного пособия является оказание помощи в изучении теоретического материала, а также выработка навыков экспериментальной работы.
Скачать
Коллоидная химия
Размер файла:
834.37 kB
Дата:
01.04.2013 04:09
Учебно-методическое пособие (для проведения лабораторных занятий) для студентов инженерно-технического факультета
К-60 Практикум по физической химии: учеб.-мет. пособие / И. В. Кулеш, О. И. Валентюкевич.- Гродно: ГГАУ, 2013 – 94с.
Данное пособие предназначено для студентов технологических специальностей аграрного университета. Целью данного пособия является оказание помощи в изучении теоретического материала, а также выработка навыков экспериментальной работы.
Скачать
Курс лекций по дисциплине «Неорганическая химия»
Размер файла:
1.33 MB
Дата:
28.12.2015 12:22
Лекции по курсу «Неорганическая химия »для студентов инженерно – технологического факультета / З.В. Апанович.
Скачать
Рабочая тетрадь и методические указания по неорганической химии
Размер файла:
701. 32 kB
32 kB
Дата:
28.12.2015 12:23
Рабочая тетрадь и методические указания по неорганической химии. Для студентов технологических специальностей / З.В. Апанович.
Скачать
Ионные равновесия и обменные реакции в растворах электролитов
Скачать
Лабораторные работы по химии элементов для студентов технологических специальностей
Скачать
Инженерно-технологический факультет
17.2: Гальванические элементы — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 38304
- OpenStax
- OpenStax
Цели обучения
- Используйте обозначения ячеек для описания гальванических элементов
- Описать основные компоненты гальванических элементов
Гальванические элементы, также известные как гальванические элементы, представляют собой электрохимические элементы, в которых спонтанные окислительно-восстановительные реакции производят электрическую энергию.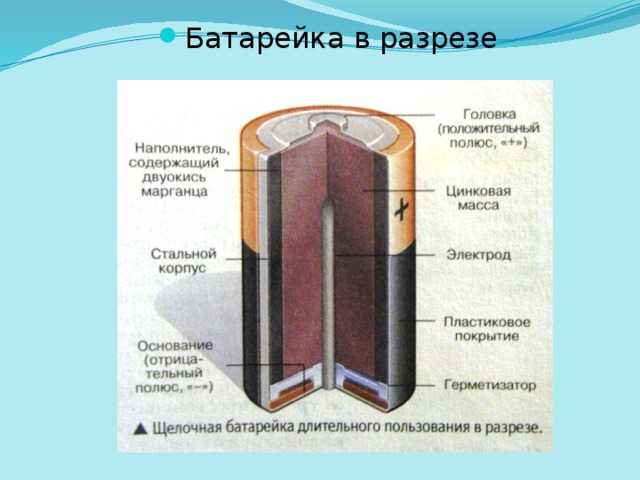 При написании уравнений часто бывает удобно разделить реакции окисления-восстановления на полуреакции, чтобы упростить балансировку общего уравнения и подчеркнуть фактические химические превращения.
При написании уравнений часто бывает удобно разделить реакции окисления-восстановления на полуреакции, чтобы упростить балансировку общего уравнения и подчеркнуть фактические химические превращения.
Посмотрите, что произойдет, если чистый кусок металлической меди поместить в раствор нитрата серебра (рис. \(\PageIndex{1}\)). Как только добавляется металлическая медь, начинает образовываться металлическое серебро, и ионы меди переходят в раствор. Синий цвет раствора справа указывает на присутствие ионов меди. Реакцию можно разделить на две полуреакции. Полуреакции отделяют окисление от восстановления, поэтому каждую можно рассматривать отдельно.
\[\begin{align} 92+}(aq)
\end{align} \nonumber \]
Уравнение полуреакции восстановления пришлось удвоить, чтобы число электронов, «приобретенных» в полуреакции восстановления, равнялось числу электронов, «потерянных» в полуреакции окисления.
Рисунок \(\PageIndex{1}\): Когда чистый кусок металлической меди помещают в прозрачный раствор нитрата серебра (a), происходит окислительно-восстановительная реакция, в результате которой происходит обмен Cu 2 + для ионов Ag + в растворе. По мере протекания реакции (b) раствор становится синим (c) из-за присутствия ионов меди, и металлическое серебро осаждается на медной полоске по мере удаления ионов серебра из раствора. (кредит: модификация работы Марка Отта)
По мере протекания реакции (b) раствор становится синим (c) из-за присутствия ионов меди, и металлическое серебро осаждается на медной полоске по мере удаления ионов серебра из раствора. (кредит: модификация работы Марка Отта) В гальванических или гальванических элементах происходят спонтанные электрохимические реакции, в которых полуреакции разделяются (Рисунок \(\PageIndex{2}\)) так, что ток может протекать по внешнему проводу. Стакан в левой части рисунка называется полукюветой и содержит 1 M раствора нитрата меди (II) [Cu(NO 3 ) 2 ] с частично погруженным в воду куском металлической меди. в растворе. Металлическая медь является электродом. Медь подвергается окислению; следовательно, медный электрод является анодом. Анод соединен проводом с вольтметром, а другой вывод вольтметра соединен проводом с серебряным электродом. Серебро восстанавливается; следовательно, серебряный электрод является катодом. Полуячейка в правой части рисунка состоит из серебряного электрода в 1  В этот момент ток не течет, то есть не происходит значительного движения электронов по проводу, потому что цепь разомкнута. Цепь замыкается с помощью солевого мостика, передающего ток с движущимися ионами. Солевой мостик состоит из концентрированного нереакционноспособного раствора электролита, такого как раствор нитрата натрия (NaNO 3 ), используемый в этом примере. Когда электроны текут слева направо через электрод и проволоку, ионы нитрата (анионы) проходят через пористую пробку слева в раствор нитрата меди (II). Это сохраняет химический стакан слева электрически нейтральным за счет нейтрализации заряда ионов меди (II), которые образуются в растворе при окислении металлической меди. При этом ионы нитрата движутся влево, ионы натрия (катионы) – вправо, через пористую пробку, и в раствор азотнокислого серебра справа. Эти добавленные катионы «заменяют» ионы серебра, которые удаляются из раствора, поскольку они восстанавливаются до металлического серебра, сохраняя химический стакан справа электрически нейтральным.
В этот момент ток не течет, то есть не происходит значительного движения электронов по проводу, потому что цепь разомкнута. Цепь замыкается с помощью солевого мостика, передающего ток с движущимися ионами. Солевой мостик состоит из концентрированного нереакционноспособного раствора электролита, такого как раствор нитрата натрия (NaNO 3 ), используемый в этом примере. Когда электроны текут слева направо через электрод и проволоку, ионы нитрата (анионы) проходят через пористую пробку слева в раствор нитрата меди (II). Это сохраняет химический стакан слева электрически нейтральным за счет нейтрализации заряда ионов меди (II), которые образуются в растворе при окислении металлической меди. При этом ионы нитрата движутся влево, ионы натрия (катионы) – вправо, через пористую пробку, и в раствор азотнокислого серебра справа. Эти добавленные катионы «заменяют» ионы серебра, которые удаляются из раствора, поскольку они восстанавливаются до металлического серебра, сохраняя химический стакан справа электрически нейтральным.
\[\mathrm{volt=\mathit{V}=\dfrac{J}{C}} \nonumber \]
В этом уравнении A — это ток в амперах, а C — заряд в кулонах. Обратите внимание, что вольты должны быть умножены на заряд в кулонах (Кл), чтобы получить энергию в джоулях (Дж).
Рисунок \(\PageIndex{2}\): В этом стандартном гальваническом элементе полуэлементы разделены; электроны могут течь по внешнему проводу и становятся доступными для выполнения электрической работы.
Когда электрохимическая ячейка сконструирована таким образом, положительный потенциал ячейки указывает на спонтанную реакцию и электроны текут слева направо. На рисунке \(\PageIndex{2}\) происходит много всего, поэтому полезно подвести итоги для этой системы:
- Электроны текут от анода к катоду: слева направо в стандартном гальваническом элементе на рисунке.
- Электрод в левой половине ячейки является анодом, потому что здесь происходит окисление. Название относится к потоку анионов в солевом мостике к нему.
- Электрод в правой половине ячейки является катодом, потому что здесь происходит восстановление. Название относится к потоку катионов в солевом мостике к нему.
- Окисление происходит на аноде (левая полуячейка на рисунке).
- Восстановление происходит на катоде (правая полуячейка на рисунке).
- Потенциал ячейки, +0,46 В, в данном случае является результатом врожденных различий в природе материалов, используемых для изготовления двух полуэлементов.

- Солевой мостик должен присутствовать, чтобы замкнуть (завершить) цепь, и для протекания тока должны происходить как окисление, так и восстановление.
Существует много возможных гальванических элементов, поэтому для их описания обычно используется сокращенное обозначение. Обозначение ячеек (иногда называемое диаграммой ячеек) предоставляет информацию о различных видах, участвующих в реакции. Это обозначение также работает для других типов ячеек. Вертикальная линия │ обозначает фазовую границу, а двойная линия ‖ — солевой мостик. Слева записывается информация об аноде, затем раствор анода, затем солевой мостик (если он есть), затем раствор катода и, наконец, информация о катоде справа. Тогда обозначение ячейки для гальванического элемента на рисунке \(\PageIndex{2}\) равно 9.2+}(aq,\: 1\:M)║\ce{Ag+}(aq,\: 1\:M)│\ce{Ag}(s) \nonumber \]
Обратите внимание, что ионы-спектаторы не включены и что использовалась простейшая форма каждой полуреакции. Когда известны, обычно включаются начальные концентрации различных ионов.
Одной из самых простых ячеек является ячейка Даниэля. Эту батарею можно построить, поместив медный электрод на дно банки и покрыв металл раствором медного купороса. Раствор сульфата цинка всплывает поверх раствора сульфата меди; затем в раствор сульфата цинка помещают цинковый электрод. Соединение медного электрода с цинковым электродом позволяет течь электрическому току. Это пример ячейки без солевого мостика, и ионы могут течь через границу между двумя растворами.
В некоторых окислительно-восстановительных реакциях участвуют соединения, плохо проводящие электричество, поэтому используется электрод, не участвующий в реакциях. Часто в качестве электрода используют платину, золото или графит, и все они инертны ко многим химическим реакциям. Одна из таких систем показана на рисунке \(\PageIndex{3}\). Магний подвергается окислению на аноде слева на рисунке, а ионы водорода восстанавливаются на катоде справа. Реакция может быть обобщена как 92+}(водн.)║\ce{H+}(водн.)│\ce{h3}(g)│\ce{Pt}(s) \nonumber \]
Магниевый электрод является активным электродом, поскольку он участвует в окислительно-восстановительной реакции. 3+}(aq)+\ce{6e-}\\ 92+}(aq)+\ce{4h3O}(l) \nonumber \]
3+}(aq)+\ce{6e-}\\ 92+}(aq)+\ce{4h3O}(l) \nonumber \]
Напишите полуреакции окисления и восстановления и запишите реакцию, используя обозначения ячеек. Какая реакция протекает на аноде? Катод?
Раствор
Согласно осмотру, Fe 2 + подвергается окислению, когда один электрон теряется с образованием Fe 3 + , а MnO 4 – восстанавливается до пяти электронов, образуя Mn 2 + . Балансировка заряда дает 92+}(водн.)│\ce{Cu}(s) \nonumber. \номер\]
Резюме
Электрохимические элементы обычно состоят из двух полуэлементов. Полуэлементы отделяют полуреакцию окисления от полуреакции восстановления и позволяют току течь по внешнему проводу. Одна полуячейка, обычно изображаемая слева на рисунке, содержит анод. Окисление происходит на аноде. Анод соединен с катодом в другой полуэлементе, часто показанном на рисунке справа. Восстановление происходит на катоде. Добавление соляного моста замыкает цепь, позволяя течь току. Анионы в солевом мостике текут к аноду, а катионы в солевом мостике текут к катоду. Движение этих ионов замыкает цепь и сохраняет электрическую нейтральность каждой полуклетки. Электрохимические ячейки можно описать с помощью обозначения ячеек. В этих обозначениях информация о реакции на аноде появляется слева, а информация о реакции на катоде — справа. Соляной мост представлен двойной линией ‖. Твердая, жидкая или водная фазы внутри полуячейки разделены одной линией │. Фаза и концентрация различных видов указаны после названия вида. Электроды, участвующие в окислительно-восстановительной реакции, называются активными электродами. Электроды, которые не участвуют в окислительно-восстановительной реакции, но предназначены для протекания тока, являются инертными электродами. Инертные электроды часто изготавливают из платины или золота, которые не изменяются в результате многих химических реакций.
Добавление соляного моста замыкает цепь, позволяя течь току. Анионы в солевом мостике текут к аноду, а катионы в солевом мостике текут к катоду. Движение этих ионов замыкает цепь и сохраняет электрическую нейтральность каждой полуклетки. Электрохимические ячейки можно описать с помощью обозначения ячеек. В этих обозначениях информация о реакции на аноде появляется слева, а информация о реакции на катоде — справа. Соляной мост представлен двойной линией ‖. Твердая, жидкая или водная фазы внутри полуячейки разделены одной линией │. Фаза и концентрация различных видов указаны после названия вида. Электроды, участвующие в окислительно-восстановительной реакции, называются активными электродами. Электроды, которые не участвуют в окислительно-восстановительной реакции, но предназначены для протекания тока, являются инертными электродами. Инертные электроды часто изготавливают из платины или золота, которые не изменяются в результате многих химических реакций.
Глоссарий
- активный электрод электрод
- , участвующий в окислительно-восстановительной реакции электрохимической ячейки; масса активного электрода изменяется при окислительно-восстановительной реакции
- анод
- электрод в электрохимической ячейке, на котором происходит окисление; информация об аноде записывается слева от солевого мостика в ячейке с обозначением
- катод
- электрод в электрохимической ячейке, на котором происходит восстановление; информация о катоде записывается справа от солевого мостика в ячейке с обозначением
- обозначение ячейки
- сокращенный способ представления реакций в электрохимической ячейке
- клеточный потенциал
- разность электрических потенциалов, возникающая при соединении разнородных металлов; движущая сила потока заряда (тока) в окислительно-восстановительных реакциях
- гальванический элемент
- электрохимический элемент, включающий самопроизвольную окислительно-восстановительную реакцию; электрохимические ячейки с положительным потенциалом ячейки; также называется гальваническим элементом
- инертный электрод
- электрод, пропускающий ток, но не участвующий в окислительно-восстановительной реакции в гальваническом элементе; масса инертного электрода в ходе окислительно-восстановительной реакции не изменяется; инертные электроды часто изготавливают из платины или золота, потому что эти металлы химически неактивны.

- гальванический элемент
- другое название гальванического элемента
Эта страница под названием 17.2: Galvanic Cells распространяется под лицензией CC BY 4.0 и была создана, изменена и/или курирована OpenStax с использованием исходного контента, который был отредактирован в соответствии со стилем и стандартами платформы LibreTexts; подробная история редактирования доступна по запросу.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- ОпенСтакс
- Лицензия
- СС BY
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.
- Теги
- активный электрод
- анод
- Тег автора:OpenStax
- катод
- Обозначение ячейки
- потенциал ячейки
- гальванический элемент
- инертный электрод
- источник@https://openstax.org/details/books/chemistry-2e
- гальванический элемент
16.2: Гальванические элементы и электроды
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 260
- Стивен Лоуэр
- Университет Саймона Фрейзера
Физически невозможно измерить разность потенциалов между куском металла и раствором, в который он погружен. Однако мы можем измерить разность между потенциалами двух электродов, погруженных в один и тот же раствор или, что более полезно, находящихся в двух разных растворах. В последнем случае каждая пара электрод-раствор представляет собой окислительно-восстановительный полуячейка , и мы измеряем сумму двух потенциалов полуячейки .
Однако мы можем измерить разность между потенциалами двух электродов, погруженных в один и тот же раствор или, что более полезно, находящихся в двух разных растворах. В последнем случае каждая пара электрод-раствор представляет собой окислительно-восстановительный полуячейка , и мы измеряем сумму двух потенциалов полуячейки .
Это устройство называется гальваническим элементом . Типичная ячейка может состоять из двух кусков металла, одного из цинка и другого из меди, каждый из которых погружен в раствор, содержащий растворенную соль соответствующего металла. Два раствора разделены пористым барьером, который предотвращает их быстрое смешивание, но позволяет ионам диффундировать.
Если мы соединим цинк и медь с помощью металлического проводника, избыточные электроны, которые останутся, когда Zn 9{2+} + Cu_{(s)}\]
, но на этот раз стадии окисления и восстановления (полуреакции) происходят в разных местах:
левый электрод: | Zn (s) → Zn 2 + + 2 e – | окисление |
Правый электрод: | Cu 2 + + 2 e – → Cu (s) | переходник |
Электрохимические элементы позволяют измерять и контролировать окислительно-восстановительную реакцию.

Реакцию можно запустить и остановить, подключив или отсоединив два электрода. Если мы поместим в цепь переменное сопротивление, мы сможем даже контролировать скорость общей реакции клетки, просто поворачивая ручку. Подключив к двум электродам батарею или другой источник тока, мы можем заставить реакцию протекать в ее несамопроизвольном или обратном направлении. Поместив амперметр во внешнюю цепь, мы можем измерить количество электрического заряда, прошедшего через электроды, и, таким образом, количество молей реагентов, которые превращаются в продукты реакции в клетке.
Электрический заряд q измеряется в кулонах. Количество заряда, переносимого одним молем электронов, известно как Фарадея , которое мы обозначаем как F . Тщательные эксперименты определили, что 1 F = 96467 C. Для большинства целей вы можете просто использовать 96 500 кулонов в качестве значения фарадея. Когда мы измеряем электрический ток, мы измеряем скорость, с которой электрический заряд переносится по цепи.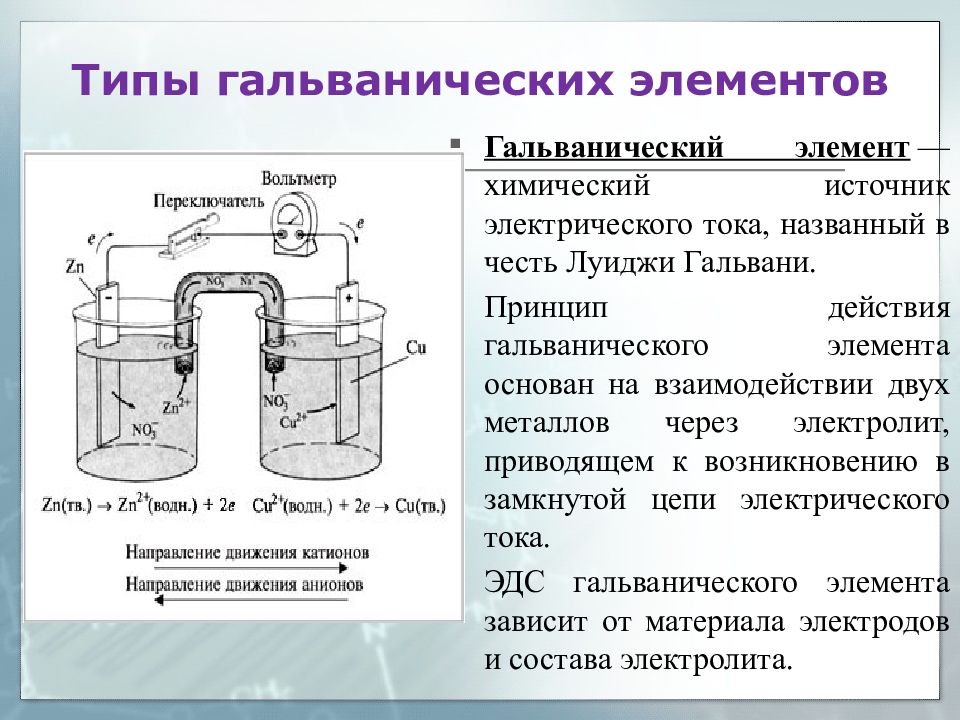 Ток в один ампер соответствует потоку в один кулон в секунду.
Ток в один ампер соответствует потоку в один кулон в секунду.
Перенос заряда внутри ячейки
Чтобы ячейка работала, не только должна быть внешняя электрическая цепь между двумя электродами, но и два электролита (растворы) должны находиться в контакте. Необходимость этого можно понять, если рассмотреть, что произошло бы, если бы два решения были физически разделены. Положительный заряд (в виде Zn 2 + ) добавляется к электролиту в левом отсеке и снимается (в виде Cu 2 + ) с правой стороны, в результате чего раствор, находящийся в контакте с цинком, приобретает суммарный положительный заряд, в то время как суммарный отрицательный заряд накапливается в растворе на медной стороне элемента. Эти нарушения электронейтральности затруднили бы (потребовали больше работы) введение дополнительных ионов Zn 2 + в положительно заряженный электролит или поток электронов в правый отсек, где они необходимы для восстановления Cu 2 + ионов, таким образом, эффективно останавливая реакцию после того, как произошло только химически незначительное количество.
Для поддержания клеточной реакции заряд, переносимый электронами по внешней цепи, должен сопровождаться компенсирующим переносом ионов между двумя клетками. Это означает, что мы должны предоставить путь для прямого перемещения ионов из одной клетки в другую. В этом ионном транспорте участвуют не только электроактивные частицы Cu 2 + и Zn 2 + , а также противоионы , которыми в данном примере являются нитраты, NO 3 – . Таким образом, избыток Cu 2 + в левом отсеке может быть уменьшен за счет дрейфа этих ионов в правую сторону или с таким же успехом за счет диффузии ионов нитрата влево. Более подробные исследования показывают, что происходят оба процесса и что относительное количество заряда, переносимого через раствор положительными и отрицательными ионами, зависит от их относительного подвижности , которые выражают скорость, с которой ионы могут проходить через раствор. Поскольку отрицательные ионы имеют тенденцию быть больше, чем положительные ионы, последние, как правило, имеют более высокую подвижность и несут большую долю заряда.
Поскольку отрицательные ионы имеют тенденцию быть больше, чем положительные ионы, последние, как правило, имеют более высокую подвижность и несут большую долю заряда.
В простейших ячейках барьером между двумя растворами может быть пористая мембрана, но для точных измерений используется более сложная конструкция, известная как солевой мостик . Солевой мост состоит из промежуточного отсека, заполненного концентрированным раствором KCl и снабженного пористыми барьерами на каждом конце. Цель соляного моста состоит в том, чтобы свести к минимуму естественную разность потенциалов, известную как 9.0385 потенциал соединения , который возникает (как упоминалось в предыдущем разделе), когда любые две фазы (например, два раствора) находятся в контакте. Эта разность потенциалов будет сочетаться с двумя потенциалами полуклеток, что внесет некоторую неопределенность в любое измерение потенциала клетки. С соляным мостом у нас есть два потенциала жидкостного соединения вместо одного, но они имеют тенденцию компенсировать друг друга.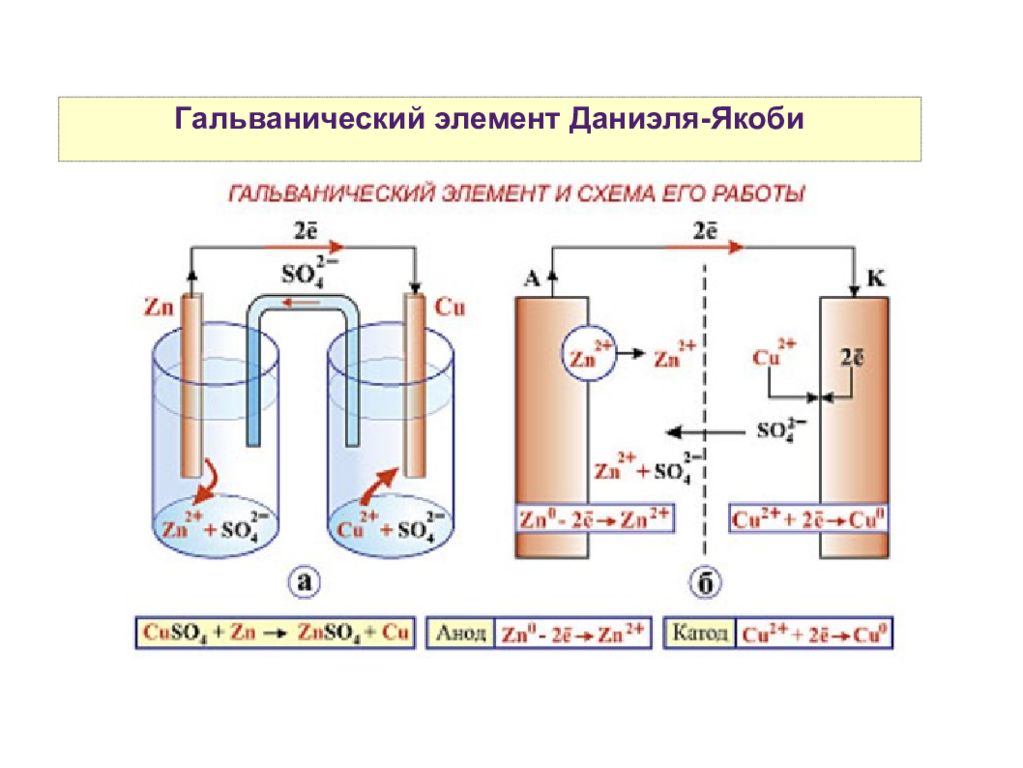
Условные обозначения для описания элементов
Чтобы облегчить описание данного электрохимического элемента, были приняты специальные символические обозначения. В этих обозначениях ячейка, которую мы описали выше, будет
Zn (с) | Zn 2 + (водн.) || Cu 2 + (водный) | Cu (s)
Существует несколько других условных обозначений и номенклатуры ячеек, которые вы должны знать:
- Анод — место, где происходит окисление, а катод — место восстановления. В реальной ячейке идентичность электродов зависит от направления, в котором протекает суммарная клеточная реакция.
- Если электроны текут от левого электрода к правому электроду (как показано в обозначении ячейки выше), когда ячейка работает в своем спонтанном направлении, потенциал правого электрода будет выше, чем у левого, и потенциал ячейки будет будь позитивным.

- «Условный поток тока» идет от положительного к отрицательному, что противоположно направлению потока электронов. Это означает, что если электроны текут от левого электрода к правому, гальванометр, помещенный во внешнюю цепь, покажет, что ток течет справа налево.
Электроды и электродные реакции
Электродная реакция относится к чистому процессу окисления или восстановления, происходящему на электроде. Эта реакция может происходить в виде одной стадии переноса электрона или в виде последовательности двух или более стадий. Вещества, которые принимают и теряют электроны, называются электроактивными частицами.
Рис. 4: Перенос электронов на аноде Этот процесс происходит в очень тонкой межфазной области на поверхности электрода и включает квантово-механическое туннелирование электронов между электродом и электроактивными частицами. Работа, необходимая для перемещения H 2 молекул O в гидратных сферах ионов составляет часть энергии активации процесса. {3+}\). Если ни один из электроактивных частиц не является металлом, какой-то другой металл должен служить проводником для доставки или удаления электронов из системы. Чтобы избежать осложнений, которые могут возникнуть при электродных реакциях с участием этого металла, обычно используют относительно инертное вещество, такое как платина. Такая полуячейка будет представлена как 9-\]
{3+}\). Если ни один из электроактивных частиц не является металлом, какой-то другой металл должен служить проводником для доставки или удаления электронов из системы. Чтобы избежать осложнений, которые могут возникнуть при электродных реакциях с участием этого металла, обычно используют относительно инертное вещество, такое как платина. Такая полуячейка будет представлена как 9-\]
Реакция происходит на поверхности электрода (рис. 4 выше). Электроактивный ион диффундирует к поверхности электрода и адсорбируется (прикрепляется) к ней за счет сил Ван-дер-Ваальса и Кулона. При этом гидратные воды, которые обычно связаны с любыми ионными частицами, должны быть вытеснены. Этот процесс всегда эндотермичен, иногда до такой степени, что только небольшая часть ионов может контактировать с поверхностью достаточно близко, чтобы осуществить перенос электрона, и реакция будет медленной. Фактический перенос электрона происходит посредством квантово-механического туннелирования. 9– (водный) | AgCl (с) | Ag (s)\]
Хотя полезность такого электрода может быть не очевидна сразу, этот тип электрода находит очень широкое применение в электрохимических измерениях, как мы увидим позже.
Электроды сравнения
В большинстве электрохимических экспериментов наш интерес сосредоточен только на одной из электродных реакций. Поскольку все измерения должны выполняться на полностью укомплектованной ячейке с использованием двух электродных систем, общепринятой практикой является использование электрода сравнения 9.0386 как другая половина ячейки. Основные требования к электроду сравнения заключаются в том, чтобы его было легко изготовить и обслуживать, а также чтобы его потенциал был стабильным. Последнее требование по существу означает, что концентрация любых ионных частиц, участвующих в электродной реакции, должна поддерживаться на фиксированном уровне. Наиболее распространенным способом достижения этого является использование электродной реакции с участием насыщенного раствора нерастворимой соли иона. Об одной такой системе, хлорсеребряном электроде, уже упоминалось: 9–\]
Этот электрод обычно представляет собой кусок серебряной проволоки, покрытой AgCl. Покрытие делается путем превращения серебра в анод в электролитической ячейке, содержащей HCl; ионы Ag + соединяются с ионами Cl – по мере их образования на поверхности серебра.
Покрытие делается путем превращения серебра в анод в электролитической ячейке, содержащей HCl; ионы Ag + соединяются с ионами Cl – по мере их образования на поверхности серебра.
Другим распространенным электродом сравнения является каломельный электрод ; каломель – это общее название хлорида ртути (I). Такая полуячейка будет представлена как 9–\]
Потенциалы обоих этих электродов были очень точно определены относительно водородного электрода. Последний редко используется в рутинных электрохимических измерениях, поскольку его сложнее приготовить; поверхность платины должна быть специально обработана предварительным электролизом. Кроме того, существует потребность в подаче газообразного водорода, что делает его несколько громоздким и опасным.
Резюме и дополнительные примечания
Убедитесь, что вы полностью поняли следующие важные идеи, которые были представлены выше. Особенно важно, чтобы вы знали точное значение всех выделенных терминов в контексте этой темы.
- Гальванический элемент (иногда более уместно называемый гальваническим элементом ) состоит из двух полуэлементов , соединенных солевым мостиком или некоторым другим путем, который позволяет ионам проходить между двумя сторонами для поддерживать электронейтральность .
- Обычный способ представления любого электрохимического элемента состоит в том, чтобы записать полуреакцию окисления слева и восстановление справа. Таким образом, для реакции
Zn (S) + CU 2 + → ZN 2 + + CU (S)
Мы записываем
ZN (S)
Мы записываем
ZN (S) (S) (S) (S) (S). Zn 2 + (водн.) || Cu 2 + (водный) | Cu (s)
, в котором одиночные вертикальные полосы представляют фазовых границ . Двойная черта обозначает границу жидкость-жидкость , которая в лабораторных ячейках состоит из солевого мостика или барьера, проницаемого для ионов. Если бы результирующая реакция ячейки была записана в обратном порядке, запись ячейки стала бы
Двойная черта обозначает границу жидкость-жидкость , которая в лабораторных ячейках состоит из солевого мостика или барьера, проницаемого для ионов. Если бы результирующая реакция ячейки была записана в обратном порядке, запись ячейки стала бы
Cu (с) | Cu 2 + (водн.) || Zn 2+ (водн.) | Zn (s)
Помните: процесс R eduction всегда отображается на R ight .
- на поверхности электрода. Энергия, необходимая для вытеснения молекул воды из гидратной оболочки иона при приближении к поверхности электрода, составляет энергии активации , что может замедлить процесс. Еще большие энергии активации (и более медленные реакции) возникают при образовании или потреблении такой молекулы, как O 2 .
Эта страница под названием 16.2: Гальванические элементы и электроды распространяется под лицензией CC BY 3.



