химический источник тока
химический источник тока сокр., ХИТ (англ. chemical current source или electrochemical cell) — устройство для прямого преобразования химической энергии окислительно-восстановительной реакции в электрическую энергию.
Описание
В зависимости от эксплуатационных особенностей и от используемой электрохимической системы (совокупности электродов и электролита), химические источники тока делятся на первичные (не перезаряжаемые; гальванические элементы; «батарейки»), которые, как правило, после полного разряда становятся неработоспособными, и вторичные (перезаряжаемые; аккумуляторы), в которых реагенты регенерируются при зарядке — пропускании тока от внешнего источника. Такое деление достаточно условно, так как некоторые гальванические элементы могут быть частично заряжены.
Химические источники тока состоят из двух электродов: катода, содержащего окислитель, и анода, содержащего восстановитель, которые контактируют с электролитом. Между электродами устанавливается разность потенциалов — электродвижущая сила, соответствующая свободной энергии окислительно-восстановительной реакции. Действие химических источников тока основано на протекании при замкнутой внешней цепи пространственно разделенных процессов: на катоде восстановитель окисляется, а образующиеся свободные электроны переходят, создавая разрядный ток, по внешней цепи к аноду, где они участвуют в реакции восстановления окислителя.
Между электродами устанавливается разность потенциалов — электродвижущая сила, соответствующая свободной энергии окислительно-восстановительной реакции. Действие химических источников тока основано на протекании при замкнутой внешней цепи пространственно разделенных процессов: на катоде восстановитель окисляется, а образующиеся свободные электроны переходят, создавая разрядный ток, по внешней цепи к аноду, где они участвуют в реакции восстановления окислителя.
В настоящее время существует большое количество типов аккумуляторов: литий-ионные (Li–ion), литий-полимерные (Li–pol), никель-металлогидридные (Ni–MH), никель-кадмиевые (Ni–Cd), свинцово-кислотные, металловоздушные и т. д., — а также первичных источников тока — «батареек», наиболее популярными среди которых являются солевые, щелочные и литиевые. К важным и перспективным химическим источникам тока относятся топливные элементы (электрохимические генераторы), способные к длительному непрерывному функционированию при постоянном подводе к электродам новых порций реагентов и удалении продуктов реакции.
Иллюстрации
Схема литий-ионного химического источника тока, в котором в качестве материала положительного электрода выступает LiMO2 (M = Co, Ni, Mn), а в качестве материала отрицательного электрода — графит. Во время процесса заряда ионы лития извлекаются из структуры LiMO2 и, проходя через электролит, внедряются в межслоевое пространство графита; в процессе разряда перенос ионов лития идет в обратном направлении. Количество сохраняемой энергии ограничено в основном свойствами материала положительного электрода. Так, например, для LiCoO2 характерны величины удельной электроемкости 130–150 мАч/г. |
Авторы
- Толкачев Николай Николаевич
- Гольдт Анастасия Евгеньевна
Источники
- Химический источник тока // Большая Советская энциклопедия. 3-е изд., 1969–1978.
- Дасоян М. А. Химические источники тока: справочное издание.
 2-е изд. — Л.: Энергия, 1969. — 587 с.
2-е изд. — Л.: Энергия, 1969. — 587 с. - Lithium batteries: science and technology. Edited by Gholam-Abbas Nazri, Gianfranco Pistoia. Boston- Kluwer Academic Publishers, 2004. — 708 p.
- Мощь альтернативы: литий—воздушные аккумуляторы—новое слово в хранении энергии // Нанометр. —www.nanometer.ru/2009/05/28/12434858982414_155668.html (дата обращения: 02.08.2010).
Напишите нам
- А
- Б
- В
- Г
- Д
- Ж
- З
- И
- К
- Л
- М
- Н
- О
- П
- Р
- С
- Т
- У
- Ф
- Х
- Ц
- Ч
- Ш
- Э
- Я
- A
- B
- C
- D
- E
- F
- G
- H
- I
- J
- K
- L
- M
- N
- O
- P
- Q
- R
- S
- T
- U
- V
- W
- X
- Z
Химические источники тока | это.
 .. Что такое Химические источники тока?
.. Что такое Химические источники тока?Химические источники тока
Хими́ческие исто́чники то́ка (аббр. ХИТ) — устройства, в которых энергия протекающих в них химических реакций непосредственно превращается в электрическую энергию.
Содержание
|
История создания
Вольтов столб
Первый химический источник тока был изобретён итальянским учёным Алессандро Вольта в 1800 году. Это был элемент Вольта — сосуд с солёной водой с опущенными в него цинковой и медной пластинками, соединенными проволокой. Затем учёный собрал батарею из этих элементов, которая впоследствии была названа Вольтовым столбом. Это изобретение впоследствии использовали другие учёные в своих исследованиях. Так, например, в 1802 году русский академик В. В. Петров сконструировал Вольтов столб из 2100 элементов для получения электрической дуги. В 1836 году английский химик Джон Дэниель усовершенствовал элемент Вольта, поместив цинковый и медный электроды в раствор серной кислоты. Эта конструкция стала называться «элементом Даниэля».
Так, например, в 1802 году русский академик В. В. Петров сконструировал Вольтов столб из 2100 элементов для получения электрической дуги. В 1836 году английский химик Джон Дэниель усовершенствовал элемент Вольта, поместив цинковый и медный электроды в раствор серной кислоты. Эта конструкция стала называться «элементом Даниэля».
В 1859 году французский физик Гастон Плантэ изобрёл свинцово-кислотный аккумулятор. Этот тип элемента и по сей день используется в автомобильных аккумуляторах.
В 1865 году французский химик Ж. Лекланше предложил свой гальванический элемент (элемент Лекланше), состоявший из цинкового стаканчика, заполненного водным раствором хлористого аммония или другой хлористой соли, в который был помещён агломерат из оксида марганца(IV) MnO2 с угольным токоотводом. Модификация этой конструкции используется до сих пор в солевых батарейках для различных бытовых устройств.
В 1890 году в Нью-Йорке Конрад Губерт, иммигрант из России, создаёт первый карманный электрический фонарик.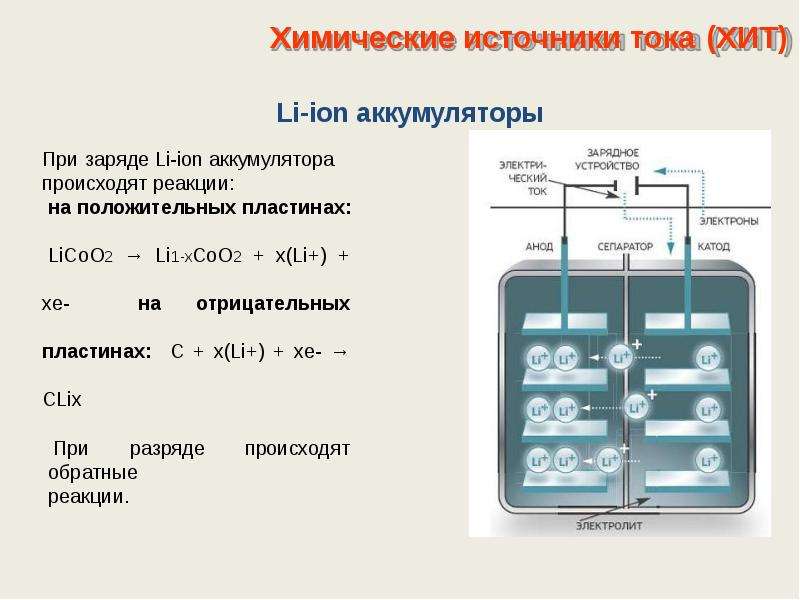 А уже в 1896 году компания National Carbon приступает к массовому производству первых в мире сухих элементов Лекланше «Columbia».
А уже в 1896 году компания National Carbon приступает к массовому производству первых в мире сухих элементов Лекланше «Columbia».
Принцип действия
Основу химических источников тока составляют два электрода (катод, содержащий окислитель и анод, содержащий восстановитель), контактирующих с электролитом. Между электродами устанавливается разность потенциалов — электродвижущая сила, соответствующая свободной энергии окислительно-восстановительной реакции. Действие химических источников тока основано на протекании при замкнутой внешней цепи пространственно разделённых процессов: на катоде восстановитель окисляется, образующиеся свободные электроны переходят, создавая разрядный ток, по внешней цепи к аноду, где они участвуют в реакции восстановления окислителя.
В современных химических источниках тока используются:
- в качестве восстановителя (на аноде) — свинец Pb, кадмий Cd, цинк Zn и другие металлы;
- в качестве окислителя (на катоде) — оксид свинца(IV) PbO2, гидроксооксид никеля NiOOH, оксид марганца(IV) MnO2 и другие;
- в качестве электролита — растворы щелочей, кислот или солей.

Классификация
По возможности или невозможности повторного использования химические источники тока делятся на:
- гальванические элементы (первичные ХИТ), которые из-за необратимости протекающих в них реакций, невозможно перезарядить;
- электрические аккумуляторы (вторичные ХИТ) — перезаряжаемые гальванические элементы, которые с помощью внешнего источника тока (зарядного устройства) можно перезарядить;
- топливные элементы (электрохимические генераторы) — устройства, подобные гальваническому элементу, но отличающееся от него тем, что вещества для электрохимической реакции подаются в него извне, а продукты реакций удаляются из него, что позволяет ему функционировать непрерывно.
Следует заметить, что деление элементов на гальванические и аккумуляторы до некоторой степени условное, так как некоторые гальванические элементы, например щелочные батарейки, поддаются подзарядке, но эффективность этого процесса крайне низка.
По типу используемого электролита химические источники тока делятся на кислотные (например свинцово-кислотный аккумулятор, свинцово-плавиковый элемент), щелочные (например ртутно-цинковый элемент, ртутно-кадмиевый элемент, никель-цинковый аккумулятор, никель-кадмиевый аккумулятор) и солевые (например, марганцево-магниевый элемент, цинк-хлорный аккумулятор).
Некоторые виды химических источников тока
Гальванические элементы
- Смотри также Категория:Гальванические элементы.
| Тип | Катод | Электролит | Анод | Напряжение, В |
|---|---|---|---|---|
| Марганцево-цинковый элемент | MnO2 | KOH | Zn | 1.56 |
| Марганцево-оловянный элемент | MnO2 | KOH | Sn | 1.65 |
| Марганцево-магниевый элемент | MnO2 | MgBr | Mg | 2.00 |
| Свинцово-цинковый элемент | PbO2 | H2SO4 | Zn | 2.55 |
| Свинцово-кадмиевый элемент | PbO2 | H2SO4 | Cd | 2.42 |
| Свинцово-хлорный элемент | PbO2 | HClO4 | Pb | 1.92 |
| Ртутно-цинковый элемент | HgO | KOH | Zn | 1. 36 36 |
| Ртутно-кадмиевый элемент | HgO2 | KOH | Cd | 1.92 |
| Окисно-ртутно-оловянный элемент | HgO2 | KOH | Sn | 1.30 |
| Хром-цинковый элемент | K2Cr2O7 | H2SO4 | Zn | 1.8—1.9 |
Другие типы:
- Свинцово-плавиковый элемент
- Медно-окисный гальванический элемент
- Висмутисто-магниевый элемент
- Ртутно-висмутисто-индиевый элемент
- Литий-хромсеребряный элемент
- Литий-висмутатный элемент
- Литий-окисномедный элемент
- Литий-йодсвинцовый элемент
- Литий-йодный элемент
- Литий-тионилхлоридный элемент
- Литий-оксидванадиевый элемент
- Литий-фторомедный элемент
- Литий-двуокисносерный элемент
- Диоксисульфатно-ртутный элемент
- Серно-магниевый элемент
- Хлористосвинцово-магниевый элемент
- Хлорсеребряно-магниевый элемент
- Хлористомедно-магниевый элемент
- Йодатно-цинковый элемент
- Магний-перхлоратный элемент
- Магний-м-ДНБ элемент
- Цинк-хлоросеребряный элемент
- Хлор-серебряный элемент
- Бром-серебряный элемент
- Йод-серебряный элемент
- Магний-ванадиевый элемент
- Кальций-хроматный элемент
Аккумуляторы
- Смотри также Категория:Аккумуляторы.

- Лантан-фторидный аккумулятор
- Литий-ионный аккумулятор
- Литий-полимерный аккумулятор
- Марганцево-оловянный элемент
- Никель-цинковый аккумулятор
- Никель-кадмиевый аккумулятор
- Никель-металл-гидридный аккумулятор
- Свинцово-кислотный аккумулятор
- Свинцово-оловянный аккумулятор
- Серебряно-цинковый аккумулятор
- Серебряно-кадмиевый аккумулятор
- Железо-никелевый аккумулятор
- Железо-воздушный аккумулятор
- Цинк-воздушный аккумулятор
- Цинк-хлорный аккумулятор
- Натрий-серный аккумулятор
- Литий-хлорный аккумулятор
- Свинцово-водородный аккумулятор
- Цинк-бромный аккумулятор
- Натрий-Никель-Хлоридный аккумулятор
- Литий-железо-сульфидный аккумулятор
- Литий-фторный аккумулятор
Топливные элементы
- Смотри также Категория:Топливные элементы.
- Прямой метанольный топливный элемент
- Твердооксидный топливный элемент
- Щелочной топливный элемент
Ссылки
- О химических источниках тока
Химические источники тока: основные характеристики
Уже более двух столетий человечество использует энергию химических реакций между различными веществами для получения постоянного тока.
Принцип действия
Окислительно-восстановительная реакция, протекающая между веществами со свойствами окислителя и восстановителя, сопровождается выделением электронов, движение которых образует электрический ток. Однако, чтобы использовать его энергию, необходимо создать условия для прохождения электронов по внешней цепи, иначе он выделяется во внешнюю среду простым смешением окислителя и восстановителя с теплотой.
Поэтому все химические источники тока имеют два электрода:
Электроды на расстоянии помещаются в сосуд с электролитом – веществом, проводящим электрический ток за счет процессов диссоциации среды на ионы.
Принцип преобразования химической энергии в электрическую
На рисунке видно, что электроды размещены в отдельных сосудах, соединенных солевым мостиком, посредством которого создается движение ионов по внутренней цепи. При разомкнутых внешней и внутренней цепях на электродах происходят два процесса: переход ионов из металла электрода в электролит и переход ионов из электролита в кристаллическую решетку электродов.
Скорости протекания этих процессов одинаковы и на каждом электроде накапливаются потенциалы напряжения противоположных знаков. Если их соединить через соляной мост и приложить нагрузку, произойдет электрическое замыкание. Внутренний ток генерируется движением ионов между электродами через электролит и солевой мостик. Движение электронов по внешней цепи в направлении от анода к катоду.
Почти все окислительно-восстановительные реакции сопровождаются образованием электричества. Но его значение зависит от многих факторов, в том числе от объемов и масс используемых химикатов, материалов, используемых для изготовления электродов, таких как электролит, концентрация ионов, конструкция.
В современных химических источниках тока наиболее широко используются:
для материала анода (восстановителя) – цинк (Zn), свинец (Pb), кадмий (Cd) и некоторые другие металлы;
на материал катода (окислителя) – оксид свинца PbO2, оксид марганца MnO2, гидроксид никеля NiOOH и другие;
электролиты на основе растворов кислот, щелочей или солей.

Методы классификации
Одну часть химических источников энергии можно использовать повторно, а другую нельзя. Этот принцип положен в основу их классификации.
Классификация химических элементов
Электродвижущая сила гальванических элементов в зависимости от конструкции достигает 1,2÷1,5 вольт. Для получения больших значений их объединяют в батареи, соединяя последовательно. При параллельном соединении аккумуляторов ток и мощность увеличиваются.
Общепринято, что первичные химические источники тока не поддерживают перезарядку, хотя точнее это положение можно сформулировать иначе: его реализация экономически нецелесообразна.
Резервные первичные химические источники тока хранятся в состоянии, при котором электролит изолирован от электродов. Это исключает возникновение окислительно-восстановительной реакции и обеспечивает готовность к вводу в эксплуатацию. Они не используются повторно. Срок годности химических резервных источников питания ограничен 10–15 годами.
Аккумуляторы успешно перезаряжаются с помощью внешней электрической энергии. Благодаря этой особенности их называют вторичными источниками тока. Они способны выдерживать сотни и тысячи циклов заряда-разряда. ЭДС аккумулятора может быть в пределах 1,0÷1,5 вольта. Они также объединены в батареи.
Электрохимические генераторы работают по принципу гальванических элементов, но для проведения электрохимической реакции поступают вещества извне, а все выделяющиеся продукты удаляются из электролита. Это позволяет организовать непрерывный процесс.
Основные характеристики химических источников тока
1. Напряжение на разомкнутых клеммах
В зависимости от конструкции один источник может создавать только определенную разность потенциалов. Для использования в электрических устройствах они объединяются в батареи.
2. Удельная мощность
В течение определенного времени (в часах) один химический источник тока может генерировать ограниченную величину тока (в амперах), приходящуюся на единицу веса или объема.
3. Плотность мощности
Характеризует способность единицы веса или объема химического источника тока генерировать мощность, генерируемую произведением напряжения на силу тока.
4. Продолжительность эксплуатации
Этот параметр также называется сроком годности.
5. Величина токов саморазряда
Эти побочные процессы электрохимических реакций приводят к расходу активной массы элементов, вызывают коррозию, снижают удельную емкость.
6. Цена изделия
Зависит от конструкции, используемых материалов и ряда других факторов.
Лучшими химическими источниками тока являются те, у которых высокие значения первых четырех параметров, а саморазряд и стоимость низкие.
Принципы заряда аккумуляторов
Среди вторичных химических источников тока большую популярность приобретают. литий-ионные модели, которые стали широко использоваться для питания электронных устройств. Они используют LiMO2 (M Co, Ni, Mn) в качестве материала положительного электрода и графита в качестве отрицательного электрода.
Они используют LiMO2 (M Co, Ni, Mn) в качестве материала положительного электрода и графита в качестве отрицательного электрода.
При заряде ионы лития от приложенной внешней энергии высвобождаются из металла катода, проходят через электролит и проникают в пространство между графитовыми слоями, накапливаясь там.
Когда зарядное устройство отсутствует, а нагрузка подключена к электродам, то ионы лития в электролите движутся в обратном направлении.
Если заряд и разряд не проводить, то энергия в аккумуляторе не расходуется, а запасается. Но его количество ограничено свойствами используемых материалов. Например, у литий-ионных аккумуляторов удельная электрическая емкость составляет 130÷150 мАч/г. Оно ограничено свойствами материала анода. У графита емкость примерно в два раза выше.
Ученые сейчас ищут способы увеличения емкости аккумуляторов, изучают возможность использования химической реакции между литием и кислородом в воздухе. Для этого разрабатываются конструкции с воздушным многоразовым катодом, применяемые в отдельных батареях. Этот метод может увеличить плотность энергии до 10 раз.
Этот метод может увеличить плотность энергии до 10 раз.
Эксплуатация химических источников тока требует знания основ электротехники, электрохимии, материаловедения и физики твердого тела.
Как сделать химический источник тока
Как зажечь рождественскую гирлянду с помощью химии
Как сделать химический источник тока? Узнайте с помощью нашего эксперимента.
Меры предосторожности
Внимание! Проводите эксперимент только под присмотром взрослых.
Реагенты и оборудование
- раствор сульфата меди(II);
- раствор сульфата цинка; электроды медные и цинковые
- ; зажимы типа «крокодил»
- ;
- пластиковых флаконов;
- держатель для флаконов;
- новогодние гирлянды;
- светодиод;
- шприцев;
- прямоугольных кусочков ткани.

Пошаговые инструкции
Вставьте медный и цинковый электроды в пластиковые флаконы и расположите их так, чтобы металлы чередовались. Соедините электроды зажимами типа «крокодил» так, чтобы электроды с обеих сторон имели свободный зажим. Соедините флаконы с медным и цинковым электродами кусочками ткани. Во флаконы с медными электродами налейте раствор сульфата меди(II), а во флаконы с цинковыми электродами – раствор сульфата цинка. Мы создали две соединенные ячейки Даниэля. Подсоедините свободные концы зажимов к светодиоду — он светится! Если вы подключите больше ячеек Daniell, вы сможете даже зажечь рождественские гирлянды!
Описание процесса
Принцип работы ячейки Даниэля основан на разнице между реакционной способностью меди и цинка. Его напряжение составляет примерно 1,1 вольта. Цинк — более активный металл. И каждый атом цинка легко отдает два электрона, образуя ионы цинка Zn²⁺, которые высвобождаются в раствор:
Zn – 2e → Zn²⁺
Эти электроны мигрируют к медному электроду, который приобретает отрицательный заряд и начинает притягивать положительно заряженные ионы меди Cu²⁺ в растворе сульфата меди(II).


