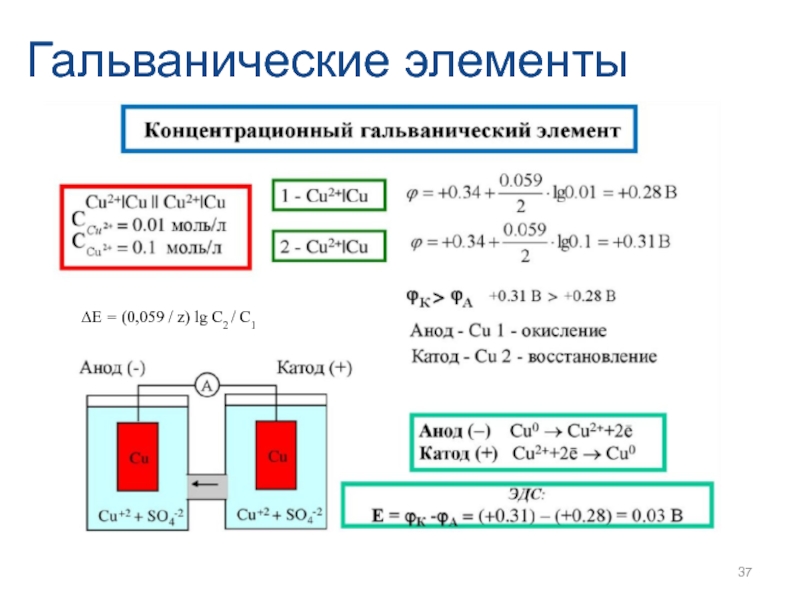
Схема гальванического элемента. Задачи 64
Задача 4.
Схема гальванического элемента : Al/Al2(SO4)3//AgNO3/Ag.
Указать анод и катод, написать электродные процессы, суммарное уравнение реакции и рассчитать электродвижущую силу элемента при 298К, если
[Al3+] = 0,0001 моль/л, [Аg+] = 0,1моль/л.
Решение:
Решение:
Серебро, потенциал которого (+0,80 В) более электроположительный, чем у алюминия (-1,66 В) – катод, т. е. электрод, на котором протекает восстановительный процесс:
Ag+ + 1 = Ag0
Алюминий имеет меньший потенциал (-1,66 В) является анодом, на котором протекает окислительный процесс:
Al0 – 3 = Al3+
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного и катодного процессов, получим:
Al0 + 3Ag+ = 3Ag0 + Al3+
Для расчета значения потенциалов, используем уравнение Нернста:
Е = Е0 + (0,059/n)lgC где
Е0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе.
Тогда
Е(Ag) = +0,80 + (0,059/1)lg0,1 = +0,74 B;
Е(Al) = -1,66 + (0,059/3)lg0,0001 = -1,74 B.
Для определения ЭДС гальванического элемента необходимо из потенциала катода вычесть потенциал анода, т е. при вычислении ЭДС элемента меньший электродный потенциал вычитается из большего (в алгебраическом смысле), получим:
ЭДС = +0,74 – (-1,74) = +2,48 B.
Задача 65.
Составить схему гальванического элемента, в котором алюминий будет катодом. Написать электродные процессы, суммарное уравнение процесса.
Решение:
Cхема гальванического элемента, в котором алюминий будет катодом может иметь вид:
Mg/Mg2+//Al3+/Al
Или
Mg/MgCl2//AlCl3/Al
Алюминий, потенциал которого (-1,66 В) более электроположительный, чем у магния (-2,38 В) – катод, т. е. электрод, на котором протекает восстановительный процесс:
Al3+ + 3 = Al0
Магний имеет меньший потенциал (-2,38 В) является анодом, на котором протекает окислительный процесс:
Mg0 – 2 = Mg2+
Cуммарное уравнение процесса:
3Mg0 + 2Al3+ = 3Mg2+ + 2Al0
Задача 66.
Составить схему гальванического элемента, в котором протекает реакция: Ag+ + Cl– = AgCl. Рассчитать стандартную ЭДС элемента при 25o C, G
Решение.
1. Схема гальванического элемента имеет вид:
Ag|AgCl|Cl–||Ag+|Ag
2. Электродные процессы:
Правый электрод: Ag+ +1 = Ag; Eo = +0,799 В;
Левый электрод: AgCl + 1 = Ag+ + Cl– ; Eo = +0,222 В;
Общая реакция: Ag+ + Cl– = AgCl; Eo = +0,557 В.
3. Рассчитаем энергию Гиббса процесса:
Для расчета Go используем формулу:
Go = –nFEo, где
n – количество электронов, участвующих в процессе, 1 электрон; F – универсальная газовая постоянная, 96485 Кл.моль-1; Eo – окислительно-восстановительный потенциал процесса, +0,557 В.
Тогда
Go = –nFEo = -(96485 Кл.моль-1) . (0,557 В) = -53,742 кДж. моль-1.
4. Расчет константы равновесия реакции:
Для расчета используем формулу:
К = exp–Go/RT = exp[ -53,742/(8,31 . 298,15)] = 2,6 . 109
Составить схему гальванического элемента, электродами в котором служат пластинки из олова и меди. — Спрашивалка
Константин
а) . Составить схему гальванического элемента, электродами в котором служат пластинки из олова и меди. Исходя из величин стандартных электродных потенциалов, рассчитать значения Е° и DG°. Определить направление протекания токообразующей реакции. (Ответ: 0,473 В; –91,3 кДж) .
б) . Какие из перечисленных металлов могут быть использованы для протекторной защиты железного изделия в присутствии электролита, содержащего растворенный кислород в нейтральной среде: алюминий, хром, серебро, кадмий? Привести уравнения анодного и катодного процессов атмосферной коррозии таких изделий.
- медь
- схема
- элемент
- пластинка
- олово
- электрод
МП
Марк Похилец
Первое задание
В гальваническом элементе анодом становится металл, обладающий меньшим значением электродного потенциала, а катодом – металл с большим значением электродного потенциала. Медь в электрохимическом ряду напряжений стоит правее, чем олово, следовательно, медь имеет большее значение электродного потенциала восстановления, чем олово.
Е°(Sn(2+)/Sn) = – 0,136 B
Е°(Cu(2+)/Cu) = + 0,338 B
Е°(Cu(2+)/Cu) > Eo(Sn(2+)/Sn)
На аноде протекает процесс окисления металла, а на катоде – процесс восстановления металла.
Процессы окисления-восстановления на электродах.

Анод (-) Sn(0) – 2е → Sn(2+) │1 – процесс окисления на аноде
Катод (+) Cu(2+) + 2е → Cu(0) │1 – процесс восстановления на катоде
Суммируя реакции на аноде и катоде, получаем уравнение токообразующей реакции, которое в ионной форме, выражает происходящую в элементе реакцию.
Sn + Cu(2+) → Cu↓ + Sn(2+)
Схема гальванического элемента
А (-) Sn | Sn(2+) || Cu(2+) | Cu К (+)
Стандартная ЭДС гальванического элемента.
Е° = Е°(катода) – Е°(анода) = Е°(Cu(2+)/Cu) – Е°(Sn(2+)/Sn) = + 0,338 – (– 0,136) = 0,474 В
Стандартная ЭДС гальванического элемента соответствует молярной концентрации ионов Cu(2+) и Sn(2+) в растворах электролитах равной 1 моль/л.
ΔG° = − zFЕ° = − 2*96500*0,474 = − 91482 Дж = − 91,482 кДж
z = 2 – число электронов, принявших участие в окислительно-восстановительной реакции.
F = 96500 Кл/моль – постоянная Фарадея
Е° = 0,474 В – ЭДС окислительно-восстановительной реакции, равная ЭДС гальванического элемента
Второе задание
Е°(Fe(2+)/Fe) = − 0,441 В
Е°(Al(3+)/Al) = − 1,70 В
Е°(Cr(3+)/Cr) = − 0,744 В
Е°(Cd(2+)/Cd) = − 0,404 B
Е°(Ag(+)/Ag) = + 0,799 В
В качестве протектора железа можно использовать только тот металл, который имеет меньший электродный потенциал восстановления, чем железо. Металл, стоящий в электрохимическом ряду напряжений левее железа, имеет меньший электродный потенциал восстановления, чем железо, поэтому может служить протектором железа. Протекторами могут быть алюминий и хром.
Металл, стоящий в электрохимическом ряду напряжений левее железа, имеет меньший электродный потенциал восстановления, чем железо, поэтому может служить протектором железа. Протекторами могут быть алюминий и хром.
Электрохимическая коррозии в гальванической паре Fe – Cr.
Хром как металл, имеющий меньший электродный потенциал, чем железо, в гальванической паре Fe – Cr будет анодом, а железо – катодом. Следовательно, в данной гальванической паре хром будет разрушаться (корродировать) .
Процессы окисления-восстановления на электродах.
Анод (-) Cr(0) – 3е → Cr(3+) │4 – процесс окисления на аноде
Катод (+) 2h3O + О2 + 4e → 4OH(-) │3 – процесс восстановления на катоде
Суммируя реакции на аноде и катоде, получаем уравнение, которое в ионной форме, выражает происходящую в гальванической паре реакцию.
4Cr(0) + 6h3O + 3О2 → 4Cr(3+) + 12OH(-)
Уравнение электрохимической коррозии в молекулярной форме.
4Cr + 6h3O + 3О2 → 4Cr(ОН) 3↓
Схема гальванической пары
А (–) Cr | h3O + О2 | Fe К (+)
Электрохимическая коррозия в гальванической паре Fe – Al.
Алюминий как металл, имеющий меньший электродный потенциал, чем железо, в гальванической паре Fe – Al будет анодом, а железо – катодом. Следовательно, в данной гальванической паре алюминий будет разрушаться (корродировать) .
Процессы окисления-восстановления на электродах.
Анод (-) Al(0) – 3е → Al(3+) │4 – процесс окисления на аноде
Катод (+) 2h3O + О2 + 4e → 4OH(-) │3 – процесс восстановления на катоде
Суммируя реакции на аноде и катоде, получаем уравнение, которое в ионной форме, выражает происходящую в гальванической паре реакцию.
4Al(0) + 6h3O + 3О2 → 4Al(3+) + 12OH(-)
Уравнение электрохимической коррозии в молекулярной форме.
4Al + 6h3O + 3О2 → 4Al(ОН) 3↓
Схема гальванической пары
А (–) Al | h3O + О2 | Fe К (+)
Валерия Николаичева
Небольшай поправочка для тех кто понимает:
не -0. 136 а -0.141 для станума (олова)
136 а -0.141 для станума (олова)
Похожие вопросы
составить схему гальванического элемента из меди и железа, погруженных в них нитраты
Определите, какой из электродов является катодом в гальваническом элементе, образованном стандартными электродами
Составьте схему гальванического элемента, электродами которого является стандартный водородный электрод и никилевый, опу
Помогите составить схемы работы гальванических элементов
Составьте схему гальванического элемента с свинцовым и оловянным электродами, напишите реакции, протекающие на электрод
Составить схему работы гальванического элемента,
а) . Составить схему гальванического элемента, электродами в котором служат пластинки из олова и меди. Исходя из величин
помогите составить схему гальванического элемента
Помогите составить схему гальванического элемента образованного Со и Ni электродами.
Составить схему и рассчитать ЭДС гальванического элемента
Схема гальванических элементов Учебное пособие по химии
Схема гальванических элементов Учебное пособие по химииКлючевые понятия
Диаграмма ячейки — это сокращение химии для представления гальванического элемента (гальванического элемента).
Обычное соглашение для написания клеточной диаграммы:
- Одиночные вертикальные линии, | , укажите фазовую границу или соединение
(например, твердый электрод, контактирующий с раствором) - Двойные вертикальные линии, || , укажите связь между двумя растворами электролита, например, солевой мостик
- Анод показан в левой части схемы.
(то есть реакция окисления показана слева). - Если диаграмму читать слева направо, она показывает направление потока электронов через гальванический элемент (гальванический элемент).
Для показанного справа гальванического элемента:
- Анодная реакция (окисление):
R (s) → R + (aq) + e –
- Катодная реакция (восстановление):
e – + S + (водн.) → S (s)
- Электронов, e – , текут от R (который производит R + ) к S + (который производит S), что мы можем представить как:
R (s) → R + (aq) + e – ↓ е – + S + (водн.  ) → S (s)
) → S (s) или
R (S) → R + (aq) + E – → E – + S + 9 (AQ) 333333333330 гг. )
- Если заменить стрелку ( →) в реакции окисления и в реакции восстановления с единственной вертикальной линией, представляющей границу фаз между электродом и раствором, мы получаем:
R (с) | R + (водн.) + e – → e – + S + (водн.) | С (с)
- Если затем заменить e – → e – с двойными вертикальными линиями, представляющими разделение двух полуклеток соляным мостиком, получаем:
R (с) | R + (водный) || S + (водный) | С (с)
, что является схемой ячейки для этого гальванического (гальванического) элемента.

Схема элемента также может быть написана с использованием химической формулы для каждого электролита.
Например, если электролитом в каждой полуячейке в приведенном выше примере был раствор нитрата, диаграмма ячейки может быть записана как:
R (с) | РНО 3(водн.) || SNO 3(водн.) | С (с)
Пожалуйста, не блокируйте рекламу на этом сайте.
Нет рекламы = нет денег для нас = нет бесплатных вещей для вас!
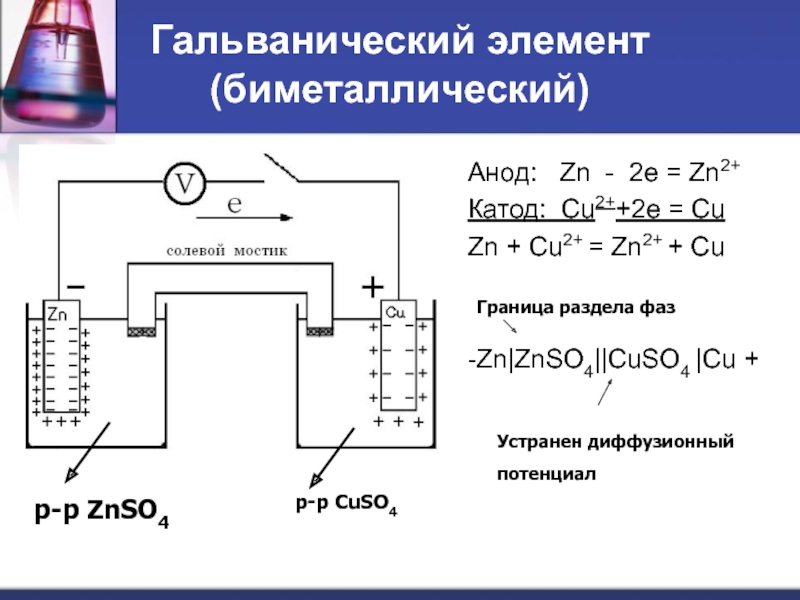
Рабочий пример: схема ячейки для ячейки Daniell
Стандартный элемент Daniell представляет собой гальванический элемент (или гальванический элемент), состоящий из двух полуэлементов.
В одной полукювете твердый медный электрод помещен в 1 моль л -1 водного раствора сульфата меди(II).
В другой половине ячейки твердый цинковый электрод помещают в 1 моль л -1 водного раствора сульфата цинка.
Два электрода соединены внешним проводом.
Два раствора соединены соляным мостом.
| Катодный полуэлемент (+) электрод: электролит: реакция восстановления: | Полуэлемент анода (-) электрод: электролит: реакция окисления: |
Выполните следующие действия, чтобы написать диаграмму ячейки для ячейки Даниэля:
- Запишите окислительно-восстановительную реакцию для ячейки Даниэля как поток электронов из анод (окисление) к катод (восстановление):
анод
(оксидирование)е –
→катод
(восстановление)Цинк (с) → Zn 2+ (водный) + 2е – → 2е – + Cu 2+ (водный) → Cu (с) - Замените стрелки ( → ), обозначающие границы фаз в реакции окисления и в реакции восстановления :
анод
(оксидирование)е –
→катод
(восстановление)Цинк (с) | Zn 2+ (водный) + 2е – → 2е – + Cu 2+ (водн.  )
) | Cu (с) - Замените 2e – → 2e – двойными вертикальными линиями ( || ), представляющими положение солевого мостика между двумя полуячейками:
анод
(оксидирование)е –
→катод
(восстановление)Цинк (с) | Zn 2+ (водный) || Cu 2+ (водный) | Cu (с) - Вы также можете представить ячейку Даниэля, используя формулу для каждого раствора сульфатного электролита, заменив ZnSO 4(aq) for Zn 2+ (aq) and CuSO 4(aq) for Cu 2+ (aq) :
Zn (с) | ZnSO 4(водн.
 ) || CuSO 4(водн.) | Cu (с)
) || CuSO 4(водн.) | Cu (с)
Рабочий пример: запись уравнений полуячейки с учетом схемы ячеек
Вопрос:
Напишите подходящее сбалансированное химическое уравнение для реакции, протекающей на катоде, используя приведенную ниже схему ячейки для гальванического элемента (гальванического элемента):
Mg (т) |Mg 2+ (водн.) ||Ag + |Ag (т)
Решение:
(На основе подхода StoPGoPS к решению проблем.)
- Что за вопрос?
Напишите сбалансированное уравнение реакции, протекающей на катоде.
- Какие данные (информация) были указаны в вопросе?
Извлечь данные из вопроса:
Диаграмма ячейки: Mg (s) |Mg 2+ (водн.) ||Ag + |Ag (s) - Какая связь между тем, что вы знаете, и тем, что вам нужно узнать?
По соглашению схема ячейки записывается с анодом слева.

анод е –
→катод Мг (с) | Мг 2+ (водн.) || Аг + | Ag (с) Окисление (потеря электронов) происходит на аноде .
Mg (s) теряет 2 электрона с образованием Mg 2+ на аноде.
Восстановление (присоединение электронов) происходит на катоде .
Ag + получает 1 электрон, образуя Ag (s) на катоде.
- Напишите уравнение восстановления Ag +
Ag + (водн.) + e – → Ag (s)
- Ваш ответ правдоподобен?
Магний — очень активный (реактивный) металл, гораздо более активный (реактивный), чем серебро.

Следовательно, металлический магний является более сильным восстановителем (восстановителем), чем металлическое серебро, то есть окислить металлический магний легче, чем окислить металлическое серебро.
Следовательно, окисление металлического магния с образованием ионов магния будет происходить самопроизвольно.
Окисление происходит на аноде, поэтому Mg (s) теряет электроны с образованием Mg 2+ на аноде.Что-то должно произойти с серебром на катоде.
Восстановление происходит на катоде.
Восстановление – это присоединение электронов.
Ионы серебра, Ag + , приобретают электроны с образованием металлического серебра, Ag (s) , на катоде.Уравнение, которое мы написали выше, описывает, как ионы серебра присоединяют электроны, образуя твердое серебро, поэтому мы достаточно уверены в правильности нашего ответа.
- Укажите свое решение проблемы:
Балансное уравнение реакции на катоде:
Ag + (водн. ) + e – → Ag (s)
) + e – → Ag (s)
www.ausetute.com.au
Диаграммы клеток – Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 47679
Цели обучения
- Вспомнить стандартные условия, принятые в электрохимической ячейке, если никакие условия не заданы
- Произвести соответствующее обозначение электрохимической ячейки для данной электрохимической реакции
Cell Notation (Cell Diagrams)
Напомним, что стандартные потенциалы клеток могут быть рассчитаны из потенциалов E 0 клеток как для реакций окисления, так и для восстановления. Положительный потенциал клетки указывает на то, что реакция протекает самопроизвольно в том направлении, в котором реакция записана. И наоборот, реакция с отрицательным потенциалом клетки протекает самопроизвольно в обратном направлении.
Положительный потенциал клетки указывает на то, что реакция протекает самопроизвольно в том направлении, в котором реакция записана. И наоборот, реакция с отрицательным потенциалом клетки протекает самопроизвольно в обратном направлении.
Обозначения элементов представляют собой сокращенное описание гальванических или гальванических (самопроизвольных) элементов. Условия реакции (давление, температура, концентрация и т. д.), анод, катод и компоненты электрода описаны в этой уникальной стенограмме.
Напомним, что окисление происходит на аноде, а восстановление — на катоде. Когда анод и катод соединены проводом, электроны текут от анода к катоду.
Типичное расположение полуэлементов, соединенных в гальванический элемент.
Используя расположение компонентов, давайте соберем ячейку.
Один химический стакан содержит 0,15 М Cd (NO 3 ) 2 и металлический Cd-электрод. Другой стакан содержит 0,20 М AgNO 3 и металлический электрод Ag. Итоговое ионное уравнение реакции имеет вид:
Итоговое ионное уравнение реакции имеет вид:
В ходе реакции ион серебра восстанавливается, приобретая электрон, а твердый Ag является катодом. Кадмий окисляется, теряя электроны, и твердый Cd является анодом.
Анодная реакция:
Катодная реакция:
Правила обозначения ячеек
- Сначала описывается анодная полуячейка; следует катодный полуэлемент. В пределах данной полуячейки первыми указываются реагенты, а последними – продукты. Описание реакции окисления идет первым, а реакция восстановления последним; когда вы читаете его, ваши глаза движутся в направлении потока электронов. Ионы зрителя не учитываются.
- Одна вертикальная линия ( | ) проведена между двумя химическими веществами, которые находятся в разных фазах, но находятся в физическом контакте друг с другом (например, твердый электрод | жидкость с электролитом). Двойная вертикальная линия ( || ) представляет солевой мостик или пористую мембрану, разделяющую отдельные полуклетки.
- Фаза каждого химического вещества (s, l, g, aq) указана в скобках. Если электролиты в ячейках не соответствуют стандартным условиям, концентрациям и/или давлению, они указаны в скобках с обозначением фаз. Если концентрация или давление не указаны, предполагается, что электролиты в ячейках находятся в стандартных условиях (1,00 М или 1,00 атм и 298 К).
Используя эти правила, обозначение для ячейки, которую мы составили, будет:
Cd (s) | CD 2+ (водн., 0,15 М) || Ag + (водн., 0,20 М) | Ag(s)
Дайте нам отзыв об этом содержании:
Назначьте чтение концепции
Назначьте только эту концепцию или целые главы вашему классу бесплатно.
Изменить это содержание
Prement Concept
Электролитические ячейки
Стандартные потенциалы снижения
Следующая концепция
Ссылка на 3 Вопросы Quiz
. Следующая информация. Предоставьте соответствующую электрохимическую нотацию для следующей реакции: znso4. (водн.) + Mn(т) Zn(т) + MnSO4(водн.) при условии, что все растворы имеют концентрацию 1,0 М, 1,0 атм и 298 К
(водн.) + Mn(т) Zn(т) + MnSO4(водн.) при условии, что все растворы имеют концентрацию 1,0 М, 1,0 атм и 298 К
Zn (с) | Zn 2+ || Мн 2+ | Mn (с), Mn (с) | Мн 2+ || Zn 2+ | Zn (т), Zn 2+ | Zn (с) || Мн (с) | Mn 2+ или Mn 2+ | Мн (с) || цинк (с) | Zn 2+
Какие из следующих условий считаются стандартными при написании обозначений электрохимических элементов? 1 литр объема раствораb. 1 атмосфера давленияc. 1,00 молярный раствор концентрированный. 298 кельвин температура
а, б и г, а, в и г, а. b и c или b, c и d
Какое обозначение ячейки для гальванического элемента со следующим уравнением? Pb2+(водн.) + Cd(s) → Pb(s) + Cd2+(водн.)
Pb | Pb2⁺|| Cd2⁺| Cd, Pb2⁺ | свинца || компакт-диск | Cd2⁺, Cd | Cd2⁺|| Pb2⁺ | Pb или Cd | Pb2⁺|| свинца | Cd2
Резюме
- Анод и катод ячейки (полуэлементы) разделены двумя полосами или косой чертой, которые представляют солевой мостик.



