Электроды материалы, используемые при электролизе
Графит применяется для производства грифелей карандашей и электродов (в промышленном электролизе). В смеси с техническими маслами используется в качестве смазочного материала его чешуйки устраняют неровности смазываемой поверхности. Поскольку он тугоплавок и хорошо переносит резкую смену температур, из смеси графита и глины изготовляют плавильные тигли для металлургии. Используется графит и в ядерных реакторах в качестве замедлителя нейтронов. [c.128]Электрофоретическое нанесение лакокрасочных материалов, растворимых в воде, представляет собой усовершенствованный способ погружения, недостатки которого устранены действием электростатического поля. Электрофорез основан на ориентированном перемещении коллоидных частиц в диэлектрической среде. При наложении электрического тока возникают два процесса. Первый — это электролиз, характеризующийся перемещением ионов, образовавшихся при диссоциации электролита.

 Линия, в которой использована такая технология, -в основном состоит из оборудования для предварительной подготовки поверхности, оборудования для непосредственно электрофоретического нанесения, включая соответствующую промывку, и оборудования для предварительной и окончательной сушки лакокрасочного покрытия при температуре 150—220° С в течение 5—30 мин. Способ нашел применение в автомобильной промышленности, на предприятиях по производству мебели, металлических конструкций для строительства и в других областях. [c.87]
Линия, в которой использована такая технология, -в основном состоит из оборудования для предварительной подготовки поверхности, оборудования для непосредственно электрофоретического нанесения, включая соответствующую промывку, и оборудования для предварительной и окончательной сушки лакокрасочного покрытия при температуре 150—220° С в течение 5—30 мин. Способ нашел применение в автомобильной промышленности, на предприятиях по производству мебели, металлических конструкций для строительства и в других областях. [c.87] Большое положительное значение перенапряжения можно показать на примере электрохимического выделения водорода. Электродные потенциалы цинка, кадмия, железа, никеля, хрома и многих других металлов в ряду напряжения имеют более отрицательную величину равновесного потенциала по сравнению с потенциалом водородного электрода. Благодаря перенапряжению водорода на указанных выше металлах при электролизе водных растворов их солей происходит перемещение водорода в ряду напряжений в область более отрицательных значений потенциала и – становится возможным выделение многих металлов на электродах совместно с водородом с большим выходом металла по току .
 269]
269] В косвенной кулонометрии определяемое вещество, как правило, не принимает участия в электрохимической реакции. Электролиз при постоянной силе тока используют для электрохимической генерации титранта или из вспомогательного реагента, или из материала рабочего электрода . Титрант быстро и количественно реагирует с определяемым веществом. Необходимо убедиться в достижении конечной точки титрования. Наиболее часто используемыми и чувствительными методами для определения конечной точки кулонометрического титрования являются потенциометрия и амперометрия. Кулонометрическое титрование можно автоматизировать.
Определение ртути внутренним электролизом. Внутренний электролиз используется для определения ртути при ее содержании от 0,1 до 0,01 мг/мл раствора. В работе [95] использовали внутренний электролиз для определения ртути в биологических материалах. Биологический материал (консервы, мука, фрукты, мясо) разрушали смесью концентрированной азотной и серной кислот. Раствор помещали в пробирку емкостью 20 мл. В качестве катода использовали графитовый стержень цинковая пластина служила анодом. Максимальная ошибка определения ртути равна 4,2%. Увеличение температуры до 80° С, перемешивание и постоянное вращение электродов увеличивает скорость осаждения ртути. Время полного осаждения ртути 1 час. [c.78]
Раствор помещали в пробирку емкостью 20 мл. В качестве катода использовали графитовый стержень цинковая пластина служила анодом. Максимальная ошибка определения ртути равна 4,2%. Увеличение температуры до 80° С, перемешивание и постоянное вращение электродов увеличивает скорость осаждения ртути. Время полного осаждения ртути 1 час. [c.78]
Выходы, а часто и характер продуктов электролиза, во многом зависят от материала электрода. В качестве катода могут быть использованы многие металлы, сплавы или неметаллы, обладающие металлической проводимостью. [c.8]
Анодный процесс. Большое влияние на выход по току может оказать анодный процесс. В зависимости от материала электрода и условий электролиза — плотности тока, концентрации хлорид-иона в анолите и pH может меняться выход по току хлора, а также состав анодного газа и доля тока, расходуемого на выделение кислорода. Как уже говорилось выше, в электролизерах с фильтрующей диафрагмой используют графитовые или титановые с электрокаталитическим покрытием аноды.
Для измерения электропроводности при кондуктометрическом титровании используют мост Кольрауша с переменным источником тока для предотвращения электролиза. Мост может быть 3-х и 4-х плечевым уравновешенным шш неуравновешенным. Электролитическая ячейка включает два жестко закрепленных электрода из инертного материала с высокой проводимостью ( напри.мер, РЬ ), [c.35]
Другой разновидностью ДСК-электродов, имеющей большое значение, являются вентильные электроды. Под ними понимают двухслойные электроды, мелкопористый запорный слой которых со стороны электролита вьшолняется из материала, характеризующегося при электролизе высоким перенапряжением, например из меди.
 Если на такой вентильный электрод, схематически представленный на фиг. 12г, наложить, используя любой противоэлектрод, катодную нагрузку при напряжении, несколько превышающем обратимую эд. с. Е = 1,23 в, то в равновесных порах рабочего слоя на газовой стороне электрода, обладающих благодаря каталитической активности стенок минимальным перенапряжением, начнется электролитическое выделение водорода. Водород не может улетучиваться в электролит, так как в узких порах запорного слоя создается слишком высокое капиллярное давление. Поэтому сухой водород поступает к тыльной стороне электрода под давлением, равным капиллярному давлению в запорном слое. Выделяющийся при эксперименте Нг имел давление до [c.96]
Если на такой вентильный электрод, схематически представленный на фиг. 12г, наложить, используя любой противоэлектрод, катодную нагрузку при напряжении, несколько превышающем обратимую эд. с. Е = 1,23 в, то в равновесных порах рабочего слоя на газовой стороне электрода, обладающих благодаря каталитической активности стенок минимальным перенапряжением, начнется электролитическое выделение водорода. Водород не может улетучиваться в электролит, так как в узких порах запорного слоя создается слишком высокое капиллярное давление. Поэтому сухой водород поступает к тыльной стороне электрода под давлением, равным капиллярному давлению в запорном слое. Выделяющийся при эксперименте Нг имел давление до [c.96] Материал катода не оказывает существенного влияния на процесс электролиза, и для изготовления катода можно использовать сталь, железо, медь, никель и другие металлы . Однако материал анода, на поверхности которого выделяется атомарный фтор, имеет большое значение. Принципиально электрохимическое фторирование можно проводить, пользуясь угольными и графитовыми анодами , но они не являются удобными вследствие большой хрупкости и малой компактности.
Электролизом называется разложение электролитов постоянным электрическим током, которое сопровождается образованием новых веществ. На электродах происходят реакции окисления— восстановления анионы на аноде отдают электроны и окисляются, а катионы восстанавливаются на катоде. Если анод растворим в электролите под действием тока, то чаще всего анионы на нем не разряжаются, а электроНейтральность раствора (или расплава) поддерживается образованием катионов из материала анода. Одно из преимуществ электролиза перед химическим восстановлением заключается в том, что при этом продукты восстановления не загрязняются остатками металла-восстановителя и примесями, первоначально присутствующими в нем. Кроме того, при электролизе возможна очистка от многих примесей исходного сырья.
При электролизе соляной кислоты используются графитовые электроды. Платина не применяется в качестве анодного материала из-за ее дефицитности и высокой стоимости. Однако в последнее [c.271]
Электролиз водных растворов часто используется с целью разделения элементов. Удобство этого метода разделения заключается в том, что, изменяя напряжение и силу тока, состав электролита, подвергающегося электролизу, и материал электродов, можно во многих случаях подобрать благоприятные условия для осаждения большого количества металлов и других соединений. Кроме того, при электролизе почти полностью устраняется соосаждение.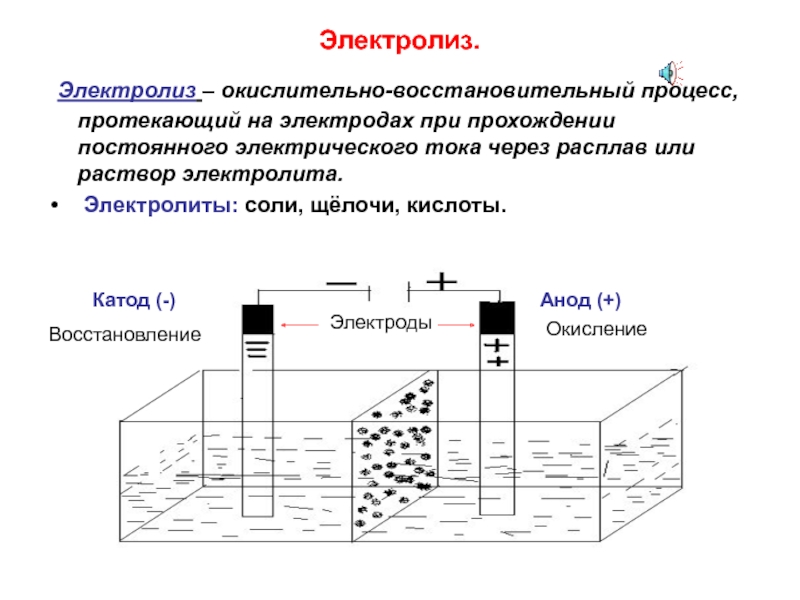 Осадок плотно держится на поверхности электродов, поэтому может быть взвешен вместе с электродами после их промывания и высушивания. [c.69]
Осадок плотно держится на поверхности электродов, поэтому может быть взвешен вместе с электродами после их промывания и высушивания. [c.69]
Электролизер Дженор имеет биполярную фильтрпрессную конструкцию. Рама ячейки служит одновременно емкостью для жидкости и носителем токоподводов для электродов. Конструкционный материал, разработанный фирмой “Дженерл электрик”, представляет собой пластичный состав из фторуглерода и графита. Кроме пластичности, материалы этого типа отличаются от обычного графита тем, что они абсолютно непористые. Электропроводность этого материала близка к электропроводности обычного графита, а коррозионная стойкость его выше. Герметизацию электролизера осуществляют с помощью специальных эластомеров на основе фторуглерода, которые показали чрезвычайно высокую стойкость к среде электролиза при испытаниях. Такой же материал используется в качестве электроизоляции в коллекторах для сведения до минимума утечек тока. [c.33]
Электролитические препаративные методы в области органической химии распространены не очень широко. Это объясняется прежде всего трудностью определения оптимальных условий электролиза обычными электрохимическими методами. Во многих случаях определение оптимального значения электродного потенциала для данной реакции вообще невозможно, ибо, как правило, окислительно-восстановительные реакции, к которым приложимы обычные потенциометрические методы, встречаются редко. Дело значительно упрощается, если использовать для определения оптимальных условий электролиза полярографический метод. Исследуя условия электролиза исходного вещества при различных температурах, pH и т. п., можно легко подобрать оптимальные условия для электролитического приготовления многих препаратов, независимо от того, будет ли реакция обратимой или нет. Заменяя ртутный капельный электрод твердыми микроэлектродами, можно подобрать наиболее удовлетворительный материал для электрода. Наконец, данные, полученные, при предварительном полярографическом исследовании, могут оказать помощь при подборе подходящего химического окислителя или восстановителя.
Это объясняется прежде всего трудностью определения оптимальных условий электролиза обычными электрохимическими методами. Во многих случаях определение оптимального значения электродного потенциала для данной реакции вообще невозможно, ибо, как правило, окислительно-восстановительные реакции, к которым приложимы обычные потенциометрические методы, встречаются редко. Дело значительно упрощается, если использовать для определения оптимальных условий электролиза полярографический метод. Исследуя условия электролиза исходного вещества при различных температурах, pH и т. п., можно легко подобрать оптимальные условия для электролитического приготовления многих препаратов, независимо от того, будет ли реакция обратимой или нет. Заменяя ртутный капельный электрод твердыми микроэлектродами, можно подобрать наиболее удовлетворительный материал для электрода. Наконец, данные, полученные, при предварительном полярографическом исследовании, могут оказать помощь при подборе подходящего химического окислителя или восстановителя. [c.74]
[c.74]
Задача подвода и распределения тока облегчается, если электрод выполнен из дешевого, хорошо проводящего материала, например стали. Если нкачестве активно работающей поверхности электрода используют такие материалы, как платина с хорошей электропроводностью, но очень высокой стоимостью, то для уменьшения затрат на изготовление электродов подвод тока к электроду и в большой стенепп разводку тока по всей работающей поверхности электрода осуществляют, прибегая к доступным и недорогим металлам — проводникам тока (медь, алюминий, сталь). Но при этом возникает проблема обеспечения надежного контакта между активно работающим материалом электрода и токоподводом, а также проблема защиты контактов и токоподводов от воздействия электролита и продуктов электролиза в условиях анодной поляризации. Это привело к созданию очень сложных, ювелирных конструкций электродов из платиновой или платиноиридиевой проволоки, сетки или фольги. Эти ко1[струкции электродов описаны в старых руководствах по прикладной электрохимии. [c.70]
Д.. 1я осу[цсствлепия электролиза к отрицательному полюсу внешнего исгочиика электричества присоединяют электрод, па котором будет происходить реакция восстановления (т. е. катод), а к положительному полюсу — электрод, на котором будет происходить реакция окисления (т. е. анод), и погружают нх в раствор (или расплав) электролита. Естественно, что материал катода и анода должен быть проводником, чаще всего применяют металлические электроды, но используют также электроды из графита, угля и других проводниковых материалов. [c.207]
Все рассмотренные выше в этом разделе примеры описывали процессы, происходящие при электролизе с использованием инертного электрода. Однако, если использовать металлические ше1а-роды, то сам материал электрода может принимать участие в окислительно-восстановительной реакции, Так, при электролизе сульфата меди с медным анодом происходят следующие процессы катод анод [c.178]
В аналитической химии широко используют электролиз на ртутном катоде, дающем возможность проводить выделение таких металлов, которые не выделяются на платиновых электродах, например Сг, Ре, Мо и др.
Про1гесс электролиза используется в работе аккумуляторов, являющихся вторичными химическими источииками электрической энергии. Аккумулятор — это электролит с погруженными в него специальными электродами. Сначала через это устройство пропускают постоянный электрический ток, причем происходит электролиз, в результате которого материал одного из электродов подвергается восстановлению, а другого — окислению. В этом заключается зарядка аккумулятора. Заряженный таким образом аккумулятор может работать как гальванический элемент, т. е. давать электрический ток. При этом происходит разрядка аккумулятора — процесс, обратный зарядке. В процессе разрядки электрод, бывший при зарядке катодом, становится анодом и его материал подвергается окислению наоборот, электрод, бывший при зарядке анодом, становится при разрядке катодом и его материал подвергается восстановлению. В результате разрядки аккумулятор приходит в первоначальное состояние и может быть снова заряжен. Зарядка и разрядка могут повторяться многократно, в связи с чем аккумуляторы могут находиться в эксплуатации продолжительное время. [c.211]
В результате разрядки аккумулятор приходит в первоначальное состояние и может быть снова заряжен. Зарядка и разрядка могут повторяться многократно, в связи с чем аккумуляторы могут находиться в эксплуатации продолжительное время. [c.211]
Электрохимическое производство химических продуктов составляет большую отрасль современной химической промышленности, Среди крупнотоннажных электрохимических производств на n piiOM месте стоит электролитическое получение хлора и щелочей, которое основано на электролизе водного раствора поваренной соли. Мировое электролитическое производство хлора составляет —30 млн, т в год. Хлорный электролиз принадлежит к числу наиболее старых электрохимических производств, начало ему было положено еще в 80-х годах прошлого века. В настоящее время используют два метода электролиза с ртутным катодом и с твердым катодом (диафрагменный метод). На ртутном катоде разряжаются ионы Na+ и образуется амальгама, которую выводят из электролизера, разлагают водой, получая водород и щелочь, и снова возвращают в электролизер. На твердом катоде, в качестве которого используют определенные марки стали с относительно низким водородным перенапряжением, выделяется водород, а электролит подщелачивается. Диафрагма служит для предотвращения соприкосновения выделяющегося на аноде хлора со щелочным раствором. На аноде обоих типов электролизеров выделяется хлор, а также возможен разряд ионов гидроксила и молекул воды с образованием кислорода. Материал анода должен обладать высокой химической стойкостью, В качестве анодов используют магнетит, диоксид марганца, уголь, графит, В последнее время разработаны новые малоизнашиваемые аноды из титана, покрытого активной массой на основе смеси оксидов рутения и титана. Эти электроды называются оксидными рутениевотитановыми анодами — ОРТА, [c.271]
На твердом катоде, в качестве которого используют определенные марки стали с относительно низким водородным перенапряжением, выделяется водород, а электролит подщелачивается. Диафрагма служит для предотвращения соприкосновения выделяющегося на аноде хлора со щелочным раствором. На аноде обоих типов электролизеров выделяется хлор, а также возможен разряд ионов гидроксила и молекул воды с образованием кислорода. Материал анода должен обладать высокой химической стойкостью, В качестве анодов используют магнетит, диоксид марганца, уголь, графит, В последнее время разработаны новые малоизнашиваемые аноды из титана, покрытого активной массой на основе смеси оксидов рутения и титана. Эти электроды называются оксидными рутениевотитановыми анодами — ОРТА, [c.271]
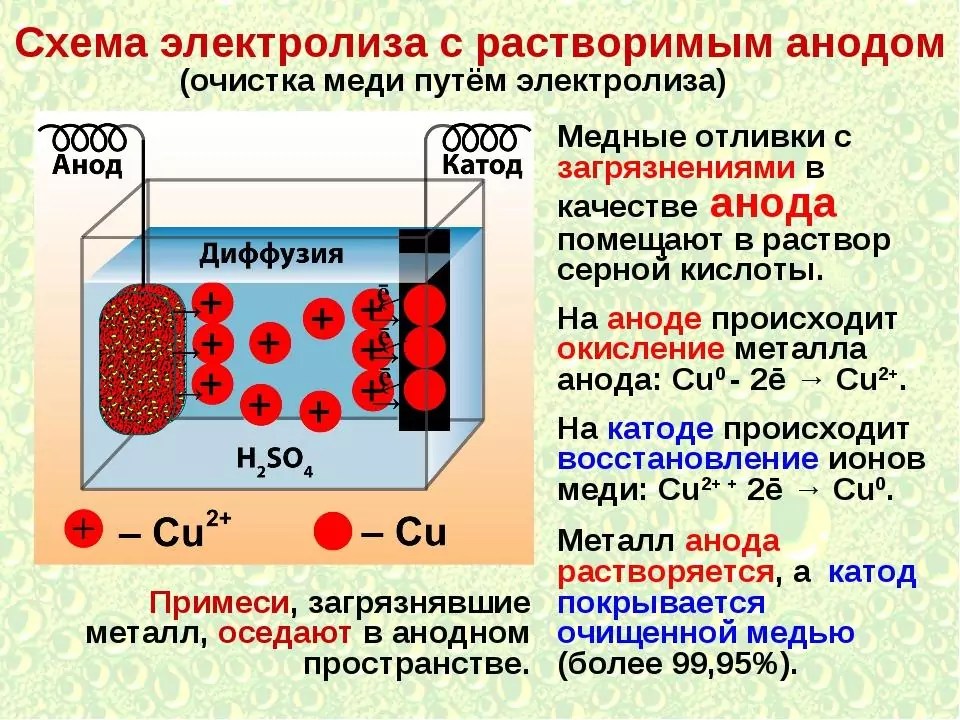
Распространен электролиз с применением растворимых (а к т и в н ы х) а н о д о в, подвергающихся окислению. Во внешнюю цепь посылает электроны сам анод, при этом смещается равновесие между электродом и раствором. Применение активных анодов позволяет провод[1ть электролитическую очистку (рафинирование) металлов. Подлежащий рафинированию исходный (черновой) металл используется в качестве анода, а на катоде (материал катода служит подложкой ) осаждается чистый (рафинированный) металл. Так, при рафинировании меди в качестве анода берут исходную (черновую) медь, проводят электролиз нейтрального водного раствора СнЗОа. На катоде разряжаются ионы и выделяется медь, так как стандартный потенциал меди си/сиг+=+0,34 В значительно превышает потенциал процесса восстановления молекул Н О ( °—0,83 В) [c.165]
Применение активных анодов позволяет провод[1ть электролитическую очистку (рафинирование) металлов. Подлежащий рафинированию исходный (черновой) металл используется в качестве анода, а на катоде (материал катода служит подложкой ) осаждается чистый (рафинированный) металл. Так, при рафинировании меди в качестве анода берут исходную (черновую) медь, проводят электролиз нейтрального водного раствора СнЗОа. На катоде разряжаются ионы и выделяется медь, так как стандартный потенциал меди си/сиг+=+0,34 В значительно превышает потенциал процесса восстановления молекул Н О ( °—0,83 В) [c.165]
Условия электролиза. Материал электродов. В качестве анодов в электролизерах с мембраной эбычно используют титан часто в виде просечной сетки, покрытой смесью оксидов рутения и других металлов (например, титана). Катодом служит стальная сетка. Обычно электроды биполярные. Электрический контакт между стальным катодом и титановым анодом осуществляется с помощью металлически шпилек, которые проходят сквозь пластмассовую перегород1су. В некоторых случаях в качестве биполярного электрода исгользуют биметалл из титана и стали, полученный из листов этих металлов с помощью взрывной технологии. [c.172]
В некоторых случаях в качестве биполярного электрода исгользуют биметалл из титана и стали, полученный из листов этих металлов с помощью взрывной технологии. [c.172]
Прир оксиды и гидроксиды Fe-сырье в произ-ве Fe, природные и синтетические-минер, пигменты (см. Железная слюдка. Железооксидные пигменты, Железный сурик. Мумия, Охры, Умбра), FeO – промежут. продукт в произ-ве Fe и ферритов, компонент керамики и термостойких эмалей a-F jOj-компонент футеровочной керамики, цемента, термита, поглотит, массы для очистки газов, полирующего материала (крокуса), используют для получения ферритов y-F iOj-рабочий слой магн. лент Гсз04-материал для электродов при электролизе хлоридов щелочных металлов, компонент активной массы щелочных аккумуляторов, цветного цемента, футеровочной керамики, термита Fe(OH)2-промежут. продукт при получении Ж. о. и активной массы железоникелевых аккумуляторов Fe(OH)j-компонент поглотительной массы для очистки газов, катализатор в орг. синтезе. [c.132]
[c.132]
Олово. Оловянные электроды используют в основном при восстановлении нитросоедипений, Замечено, что при электролизе меняется структура поверхности электрода. Это объясняют [103] химической реакцией материала электрода с восстанавливаемым веществом и последующим разрядом образующихся ионов двух- или четырехвалеитного оЛова. Отрицательный потенциал катода должен препятствовать растворению металлического олова, однако для окончательного выяснения этого до сих пор не были использованы современные электроаналитиче-ские методы. [c.185]
Десорбция. При электродных потенциалах, исключающих дальнейшее восстановление соединения (18), и в отсутствие катализатора реакции дегидратации фенилгидроксиламни образуется в результате четырехэлекэроиного восстановления нитробензола с последующей стадией десорбции продукта. Среда для Проведения такого процесса должна иметь pH 3—9 и ие содержать сильных нуклеофилов часто используют смесь аммиака и хлорида аммония [95] или ацетатные буферы [96].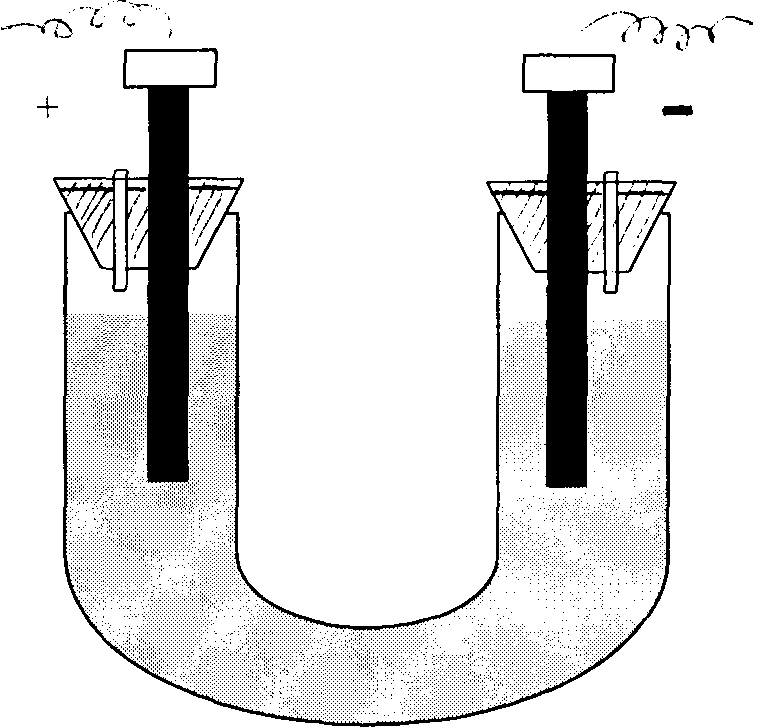 При электролизе с контролируемым потенциалом материал электрода не имеет большого значения значение pH ие должно быть слиш- [c.302]
При электролизе с контролируемым потенциалом материал электрода не имеет большого значения значение pH ие должно быть слиш- [c.302]
Технология изготовления одноразовых электродов довольно простая. На керамическую подложку наносят слой токопроводящего материала (например, алюминия) и с помощью эпоксидной смолы формируют на ней тонкий слой графита. Изготовленный таким образом электрод представляет собой чередование выступов из микрочастиц графита и впадин из диэлектрика, т.е. является УМЭ-ансамблем со случайным распределением токопроводящих частиц. Если с помощью электролиза выделить на электроде ртуть, то его можно использовать и для инверсионно-вольтамперомет-рических определений. Разработаны также одноразовые электроды на основе технологий, применяемых для изготовления толстопленочных микросхем. Однако стоимость этих электродов достаточно велика. [c.96]
При электролизе на аноде могут происходить различные процессы в зависимости от того, состоит ли анод из металла, переходящего в раствор, или из инертного материала. Для изготовления инертных анодов чаще всего используют платнву, реже иридий, золото или тантал. Весьма инертными являются угольные (графитовые) электроды, которые широко применяются в электрохимической технологии (они разрушаются только фтором и кислородом). [c.226]
Для изготовления инертных анодов чаще всего используют платнву, реже иридий, золото или тантал. Весьма инертными являются угольные (графитовые) электроды, которые широко применяются в электрохимической технологии (они разрушаются только фтором и кислородом). [c.226]
Для электролиза расплавов в лабораторном масштабе часто применяют простые тигли из фарфора, стекла, AI2O3 или графита, которые обогревают снаружи при этом можно использовать два стержнеобразных электрода из подходящего материала, которые погружают непосредственно в расплав [99]. Анод, на котором часто выделяются газы, такие, как I2, СО или соединения фтора, окружают отсасывающей воронкой, которая доходит почти до поверхности расплава. Солевую смесь лучше всего предварительно расплавить в особом тигле, быстро охладить выливанием на медную или алюминиевую пластинку и сохранять в виде крупного порошка, с тем чтобы эвтектическая температура смеси при начале электролиза существенно не превышалась. В том случае, когда в качестве анода используют уголь (лучше всего внизу заостренный), вначале его следует нагреть вне сосуда до температуры, превышающей температуру расплава, и затем по возможности быстро ввести в уже расплавленную смесь. Если выделяющийся на электроде металл легче расплава, его можно извлечь железной ложкой для тяжелых металлов ниже катода укрепляют тигель (как показано на рис. 335 [100]), в котором могут собираться капельки металла. В качестве анода часто служит сам графитовый тигель. Выделяющийся металл отнюдь не всегда получается чистым. Иногда он содержит небольшие количества растворенных галогенидов в таких случаях можно получить чистый металл после переплавки под Na l и т. п. [c.588]
Если выделяющийся на электроде металл легче расплава, его можно извлечь железной ложкой для тяжелых металлов ниже катода укрепляют тигель (как показано на рис. 335 [100]), в котором могут собираться капельки металла. В качестве анода часто служит сам графитовый тигель. Выделяющийся металл отнюдь не всегда получается чистым. Иногда он содержит небольшие количества растворенных галогенидов в таких случаях можно получить чистый металл после переплавки под Na l и т. п. [c.588]
При электролизе растворов, содержащих смесь ионов радиоактивных веществ, выделение каждого элемента происходит при потенциале электрода, равном или превышающем по величине критический потенциал выделения данного элемента. Таким образом, меняя напряжение на электродах заданным образом, можно последовательно выделять радиоактивные элементы — либо на катоде в виде металлов, либо на аноде в виде окислов или гидроокисей. Эффективность разделения зависит в первую очередь от соотношения потенциалов выделения разделяемых элементов, а также от плотности тока, температуры, состава электролита и материала электрода. Подбирая соответствующие условия, можно заметно увеличить величину интервала между потенциалами выделения разделяемых элементов, повысив тем самым чистоту разделения. Потенциал выделения можно также существенно менять, используя способность элементов к избирательному комплексооб-разованию. Так, радиоактивный изотоп С(1 может быть количественно отделен от радиоактивного изотопа 2п электролизом раствора, содержащего этилендиаминтетрауксусную кислоту (ЭДТУ) при pH = 3,5—4,0. В этом интервале pH 2п образует с ЭДТУ комплекс выделение 2п на электроде происходит только при значениях рН[c.197]
Подбирая соответствующие условия, можно заметно увеличить величину интервала между потенциалами выделения разделяемых элементов, повысив тем самым чистоту разделения. Потенциал выделения можно также существенно менять, используя способность элементов к избирательному комплексооб-разованию. Так, радиоактивный изотоп С(1 может быть количественно отделен от радиоактивного изотопа 2п электролизом раствора, содержащего этилендиаминтетрауксусную кислоту (ЭДТУ) при pH = 3,5—4,0. В этом интервале pH 2п образует с ЭДТУ комплекс выделение 2п на электроде происходит только при значениях рН[c.197]
Чистая вода обладает очень малой электропроводностью. Кольрауш и Гейдвейлер в 1894 г., в результате 42 последовательных перегонок и при соблюдении всех возможных предосторожностей определили минимальную электропроводность воды при 0°С—1,5.10 и при 25°С — 6,2.10 см -. Для промышленного электролиза воды в нее вводят электролиты. Наиболее электропроводные растворы дает серная кислота, однако тогда электроды и сами аппараты должны быть свинцовыми, что дорого, неудобно и ведет к высокому расходу энергии. В настоящее время повсеместно используют растворы щелочей, позволяющие применять железо в качестве материала для постройки электролизеров. [c.22]
В настоящее время повсеместно используют растворы щелочей, позволяющие применять железо в качестве материала для постройки электролизеров. [c.22]
В качестве материала для цинковых электродов использовался высокоактивный порошок цинка, полученный электролизом цинкатного электролита при плотности тока 50 а1дм [13—16]. [c.313]
Поэтому в воду следует вводить электролит, чтобы создать систему, достаточно хорошо проводяш ую ток. В качестве таких электролитов могут быть в принципе использованы сильные минеральные кислоты, основания, соли. Однако приходится думать не только о хорошей электропроводности системы, но и о материалах д.яя изготовления электродов и корпуса электролизера они должны быть дешевы и надежны. Платина, конечно, достаточно надежный материал при высоком положительном потенциале при электролизе и кислых и ш елочных электролитов. По платина —драгоценный и дефицитный мета.тл. [c.84]
Однако, кроме указанных ионов, в электролите находятся и ряд других катионов и анионов далее, в электролитических ваннах используются не нормальные водородные электроды, а электроды, выполненные из различных материалов и сплавов (графит, сталь, медь, никель и др. )- По этим причинам для выделения фтора необходимо создание высокого перенапряжения. Практически электролиз проводят при разности потенциалов 4—8 в. При таких разностях потенциалов выделяющиеся на лнодной поверхности радикалы фтора полностью используются в анодном пространстве электролитической ванны. Если разность потенциалов увеличить до 10 в и более, то выделяется элементарный фтор, что приводит к энергичной коррозии материала анода и к. сильному разложению фторируемого органического соединения кроме того, в отходящих газах будет содержаться некоторое количество элементарного фтора, что может привести, к взрыву. [c.349]
)- По этим причинам для выделения фтора необходимо создание высокого перенапряжения. Практически электролиз проводят при разности потенциалов 4—8 в. При таких разностях потенциалов выделяющиеся на лнодной поверхности радикалы фтора полностью используются в анодном пространстве электролитической ванны. Если разность потенциалов увеличить до 10 в и более, то выделяется элементарный фтор, что приводит к энергичной коррозии материала анода и к. сильному разложению фторируемого органического соединения кроме того, в отходящих газах будет содержаться некоторое количество элементарного фтора, что может привести, к взрыву. [c.349]
Новый электрод производит водород в 50 раз продуктивнее
Георгий ГоловановЭлектролиз может стать удобным способом хранения излишек энергии солнца или ветра. Полученный в ходе расщепления воды водород легко преобразовать обратно в энергию, когда солнце сядет, а ветер утихнет. Однако, для этого электролиз должен стать намного доступным и эффективным. Химики из США знают, как этого добиться.
Однако, для этого электролиз должен стать намного доступным и эффективным. Химики из США знают, как этого добиться.
14
Ученые из Университета Дьюка протестировали три новых материала, которые можно использовать в качестве пористого электрода для увеличения эффективности электролиза. Целью их исследования стало повышение площади поверхности электрода, который бы повышал производительность реакции и одновременно не давал бы пузырям газа мешать выработке водорода.
Каждый образец был изготовлен из напоминающего губку материла толщиной в миллиметр. Один был сделан из никелевой пены, другой — чем-то вроде «войлока» из никелевых микроволокон, третий — из никель-медной нанопроволоки, рассказывает Phys.org.
Пропустив через образцы ток, ученые поняли, что никель-медный материал вырабатывает водород эффективнее благодаря большей площади поверхности. Однако через 30 секунд его эффективность снизилась, потому что материал забили пузыри. Никелевая пена лучше всего справлялась с ними, но была наименее производительной из трех. Золотой серединой стал микроволокнистый никель, который в итоге добился лучшей производительности.
Золотой серединой стал микроволокнистый никель, который в итоге добился лучшей производительности.
В течение 100 часов тестов электрод из никелевых микроволокон вырабатывал водород при плотности тока 25 000 мА/см2. При таких показателях он будет в 50 раз продуктивнее, чем алкалиновые электролизеры, которые используют сейчас для электролиза воды, подсчитали разработчики.
Японские ученые использовали для производства водорода катализатор из ржавчины. Этот метод позволил им добиться в 25 раз большей производительности по сравнению с диоксидом титана.
FacebookВконтакте14WhatsAppTelegram
электролиз воды
МИНОБРНАУКИ РОССИИ
Федеральное государственное бюджетное образовательное
учреждение высшего образования
Нижегородский
государственный технический университет
им. Р.Е. Алексеева
Р.Е. Алексеева
(НГТУ)
Институт физико-химических технологий и материаловедения (ИФХТиМ)
Кафедра «Технология электрохимических производств
и химии органических веществ (ТЭПиХОВ)»
Дисциплина «Электрохимические технологии»
ДОКЛАД
по теме
«Электролиз воды»
Выполнила: Студентка гр. ____________ |
Принял: |
_________________________________________ |
Электролиз
воды –физико-химический процесс, при котором
под действием постоянного электрического
тока вода разлагается на кислород и
водород. Постоянное напряжение для
ячейки получается, как правило,
выпрямлением трехфазного переменного
тока. В электролитической ячейке
дистиллированная вода подвергается
электролизу, при этом химическая реакция
идет по следующей известной схеме:
Постоянное напряжение для
ячейки получается, как правило,
выпрямлением трехфазного переменного
тока. В электролитической ячейке
дистиллированная вода подвергается
электролизу, при этом химическая реакция
идет по следующей известной схеме:
Для раздельного получения газов используют электролизеры с диафрагмами или мембранами, разделяющими катодное и анодное пространство. Использование специальных электродов позволяет производить из воды озон и перекись водорода.
На аноде производится озон: 3H2O → O3 + 6e− + 6H+ (вода подкисляется).
На
катоде – перекись
водорода: O2 +
2H2O
+ 2e− → H2O2 +
2OH− (вода
подщелачивается). Удельная проводимость
очищенной воды незначительна: при 18°С
она составляет 4,41·10-6 Ом-1·м-1. Поэтому
электролитическое разложение воды
проводят в присутствии фонового
электролита. Ввиду существенных
коррозионных проблем, возникающих при
электролизе кислот, в настоящее время
почти все электролизеры используют
водные растворы на основе гидроксидов
калия и натрия с концентрацией 350-400
г./л. Растворы КОН имеют преимущества
перед NaOH в силу больше проводимости
иона К+ против иона Na+. Концентрация КОН
соответствует оптимальным значениям
плотностей тока. Небольшие примеси к
КОН не являются препятствием к его
использованию. Для предотвращения или
уменьшения коррозии деталей электролизеров
при приготовлении электролита применяют
только чистые КОН и NaOH.
Ввиду существенных
коррозионных проблем, возникающих при
электролизе кислот, в настоящее время
почти все электролизеры используют
водные растворы на основе гидроксидов
калия и натрия с концентрацией 350-400
г./л. Растворы КОН имеют преимущества
перед NaOH в силу больше проводимости
иона К+ против иона Na+. Концентрация КОН
соответствует оптимальным значениям
плотностей тока. Небольшие примеси к
КОН не являются препятствием к его
использованию. Для предотвращения или
уменьшения коррозии деталей электролизеров
при приготовлении электролита применяют
только чистые КОН и NaOH.
Раствор электролита, используемый в установках для электролиза воды, содержит 16-20% NaOH или 25-30% КОН.
Побочные
реакции: Естественная
пресная (не дистиллированная) вода
всегда содержит минеральные соли –
сульфаты, карбонаты, хлориды. В целях
получения хлора для пролонгированного
эффекта обеззараживания воды интересны
только хлориды. В воде они представлены
в основном хлоридом натрия (NaCl), хлоридом
кальция (CaCl) и хлоридом калия (KCl).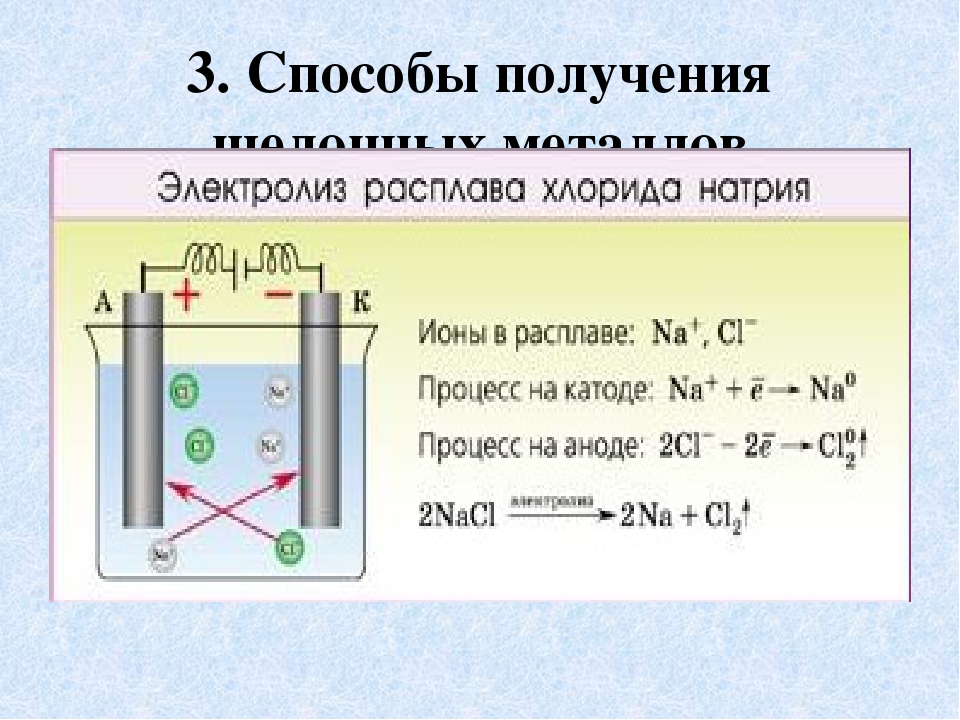
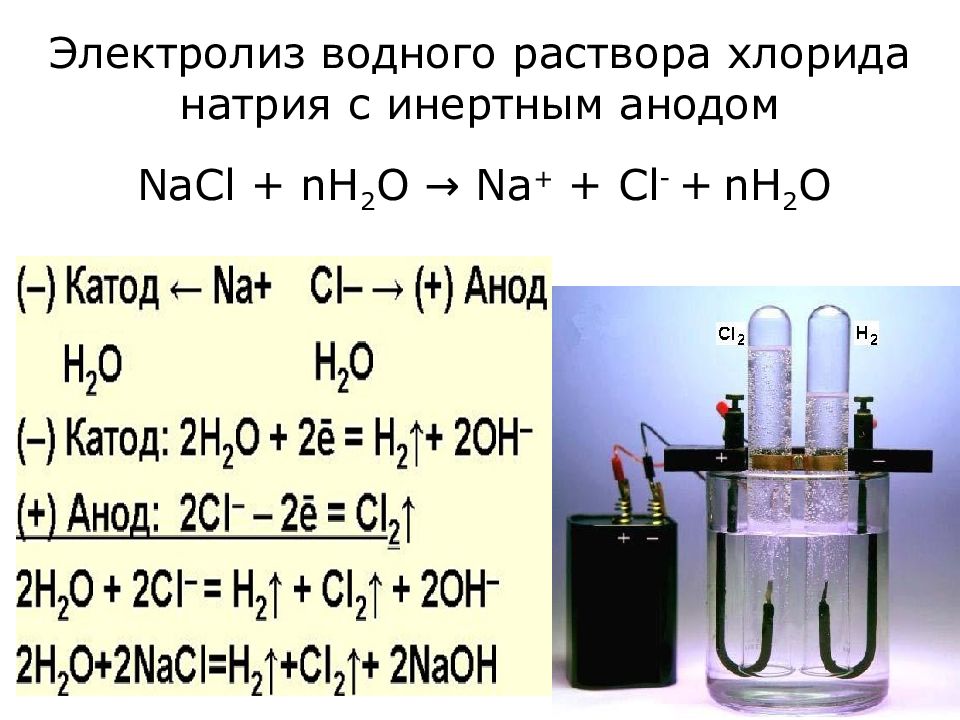
На примере с хлоридом натрия реакция образования хлора электролизом будет следующей.
Соль, растворенная в воде: 2NaCl + H2O → 2Na+ +2Cl– + 2H2O
Во время электролиза на аноде формируется хлор: 2Cl– → Cl2+2e– (вода подкисляется).
А у катода образуется гидроокись натрия: Na+ + OH– → NaOH (вода подщелачивается).
Эта реакция является недолгой, поскольку любой хлор, произведенный у анода, быстро потребляется для формирования гипохлорита натрия: Cl2 + 2NaOH → H2 + 2NaOCl.
Подобные реакции электролиза происходят и с хлоридами кальция и калия.
Материал электродов:
Для электролиза воды применяют нержавеющую сталь, часто покрытую никелем, с целью уменьшения перенапряжения водорода.
Конструкции электролизеров
Промышленные электролизеры для производства водорода бывают двух типов:
– монополярные – электроды питаются параллельно в одной и той же емкости;
– биполярные
– электроды питаются последовательно
(электрод с одной стороны поверхности
является анодом, а с другой – катодом) и
образуют укладку ячейки.
При монополярном включении электродов все электроды одного знака присоединены к шине, идущей от соответствующего полюса источника постоянного тока. При биполярном включении электродов ток подводится только к крайним электродам 1 и 2, которые являются монополярными электродами. Все остальные электроды подвода тока не имеют и работают биполярно.
Соотношение между током и напряжением в электролизерах
Чем
ниже напряжение на ячейке электролизера,
тем меньшую он потребляет мощность. С
ростом температуры электролита напряжение
электролизера снижается поэтому
энергетически выгодно было бы
эксплуатировать электролизеры при
повышенных температурах (при работе
под давлением – с температурой 100°С и
даже выше). Однако с ростом температуры
электролита усиливаются коррозионные
процессы и значительно ускоряется
старение прокладочного материала
паронита. Поэтому для небольших
электролизных установок на электростанциях
основное значение имеет надежность
оборудования и длительность работы
между ремонтами, температуру электролита
следует поддерживать 60-75°С, а в тех
случаях, когда не требуется работа
электролизера с полной нагрузкой,
желательно поддерживать 40-50°С. При
этом для сохранения нужной производительности
электролизера следует повышать
напряжение.
При
этом для сохранения нужной производительности
электролизера следует повышать
напряжение.
Для того чтобы ток проходил через электролизер с биполярным включением электродов, напряжение на электролизере (U) должно быть равно:
U= U1·n, (22)
где, U1 – напряжение на одной ячейке;
n – количество ячеек.
Напряжение на монополярном электролизере равно напряжению между парой электродов (на одной ячейке U= U1).
Ток (I), подводимый к монополярному электролизеру, разветвляется на все электроды в соответствии с законами параллельного соединения. Поэтому ток, идущий через пару электродов I1=I/n.
В биполярном электролизере ток, идущий через каждую пару электродов, равен току через весь электролизер (I1=I) – закон последовательного соединения.
Таким
образом, при одинаковой токовой нагрузке
на монополярный и биполярный электролизеры
количество полученного вещества в
биполярном электролизере в n раз больше. Поэтому для биполярного электролизера
существуют понятия линейной и эквивалентной
силы тока. Эквивалентная сила тока
равняется линейной силе тока, проходящего
через электролизер, умноженной на
количество ячеек:
Поэтому для биполярного электролизера
существуют понятия линейной и эквивалентной
силы тока. Эквивалентная сила тока
равняется линейной силе тока, проходящего
через электролизер, умноженной на
количество ячеек:
Iэкв=I·n.
Монополярные электролизеры не создаются на токовые нагрузки выше 200 – 300 кА, биполярные электролизеры работают при эквивалентной токовой нагрузке до 2000 кА. Следовательно, биполярные электролизеры более мощные и более производительные.
Другим достоинством биполярных электролизеров является снижение падения напряжения в ошиновке электролизера и в контактах за счет уменьшения их количества
Кроме того, уровень автоматизации биполярных электролизеров выше, чем монополярных, что уменьшает затраты рабочей силы на их обслуживание.
Все современные конструкции электролизеров для электролиза воды относятся к фильтр-прессному типу с биполярным включением электродов.
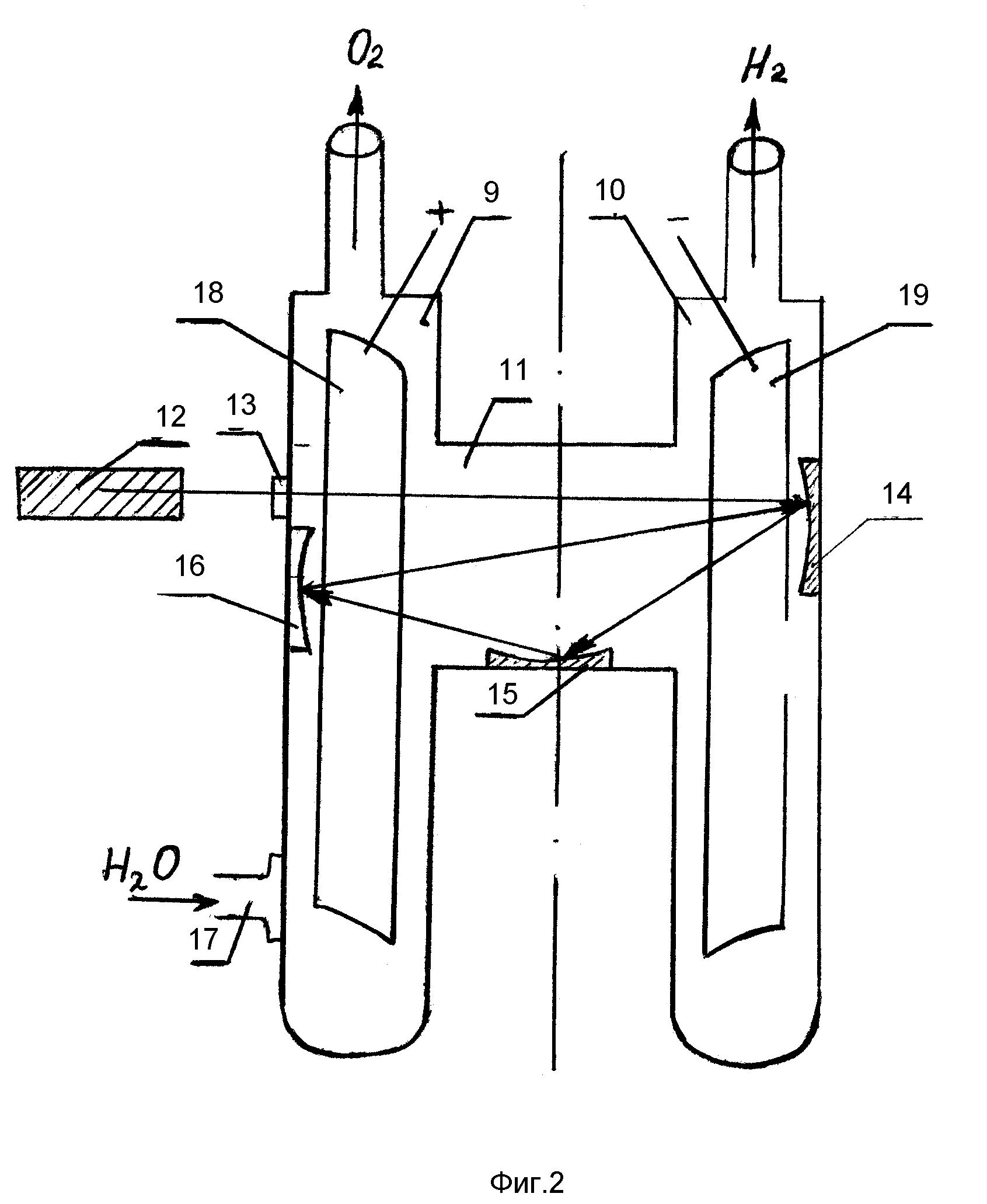
Схема фильтр-прессного электролизера
Увлажняющий
элемент (1) сборочного узла содержит
электролитную полость (2) и пористую
мембрану (3), пропускающую через себя
пары воды и не пропускающую жидкость. Пористая мембрана (3) отделяет увлажняющий
элемент (1) от электролизной ячейки (4),
которая включает в себя кислородную
(5) и паро-водородную (6) полости, пористый
катод (7), пористый анод (8) и пористую
электролитосодержащую матрицу (9).
Пористая мембрана (3) отделяет увлажняющий
элемент (1) от электролизной ячейки (4),
которая включает в себя кислородную
(5) и паро-водородную (6) полости, пористый
катод (7), пористый анод (8) и пористую
электролитосодержащую матрицу (9).
Схема биполярного фильтр-прессного электролизера
Как видно из фиг.1, электролизер состоит из блока дистанцированных друг от друга электродов 2 и охватывающего блок диэлектрического стакана 3, погруженных в электролит 4 в корпусе 5. Ток к концевым электродам блока 2 подведен изолированными снаружи проводниками 6, пропущенными в электролит 4 через гермовводы 7. Через патрубок 8 из корпуса 5 выходит водородно-кислородная смесь, а через патрубок 1 корпус пополняют электролитом.
Список литературы:
Якименко Л.Н. Получение водорода, кислорода, хлора и щелочей. – М.: Химия, 1981;
Фиошин М.Я., Павлов В. Н., Электролиз в неорганической химии, М., 1976;
Мазанко А.
 Ф., Камарьян Г.М., Помашин О.П., Промышленный
мембранный электролиз, М., 1989;
Ф., Камарьян Г.М., Помашин О.П., Промышленный
мембранный электролиз, М., 1989;А.И. Левин, Теоретические основы электрохимии, Гос. Научно-техн. Издат., Москва, 1963;
Л.М. Якименко и др., Электролиз воды, изд. «химия», Москва, 1970.
К вопросу о применении твердых электродов для электролиза криолитоглиноземных расплавов. Часть 1. | Горланов
1. Solheim A. Inert anodes – the blind alley to environmental friendliness? Light metals. 2018;1253–1260. http://doi.org/10.1007/978-3-319-72284-9_164
2. Gorlanov ES. Electrolysis of cryolite-alumina melts on solid cathodes. In: XI Mezhdunarodnyj kongress «Cvetnye metally i mineraly» i XXXVII Mezhdunarodnaya konferenciya «IKSOBA»: sbornik dokladov = XI International Congress “Non-ferrous Metals and Minerals” and XXXVII International Conference “IKSOBA”: Collected reports. 16–20 September 2019, Krasnoyarsk. Krasnoyarsk; 2019, р. 275–288. (In Russ.)
16–20 September 2019, Krasnoyarsk. Krasnoyarsk; 2019, р. 275–288. (In Russ.)
3. Gorlanov ES. Features of solid electrode application for cryolite-alumina melt electrolysis. Vestnik Irkutskogo gosudarstvennogo tehnicheskogo universiteta = Proceedings of Irkutsk State Technical University. 2019;23(2):356–366. (In Russ.) http://doi.org/10.21285/1814-3520-2019-2-356-366
4. Héroult PLT. Procédé électrolytique pour la préparation de l’aluminium. Patent FR, no. 175711; 1886.
5. Hall CM. Process of Reducing Aluminum by Electrolysis. Patent US, no. 400766; 1889.
6. Hall CM. Process of reducing aluminium from its fluoride salts by electrolysis. Patent US, no. 400664; 1889.
7. Hall CM. Manufacture of aluminium. Patent US, no. 400665; 1889.
Hall CM. Manufacture of aluminium. Patent US, no. 400665; 1889.
8. Hall CM. Process of electrolyzing crude salts of aluminium. Patent US, no. 400666; 1889.
9. Hall CM. Process of electrolyzing fused salts of aluminium. Patent US, no. 400667; 1889.
10. Minet A. The Production of Aluminium and its Industrial Uses. First edition. London: Chapman & Hall; 1905, 266 p.
11. Ibl N. Current Distribution. In: Comprehensive Treatise of Electrochemistry. Vol. 6. Electrodics: Transport. Eds. by E. Yeager J.O’M. Bockris, B.E. Conway, S. Sarangapani. New York: Plenum Press; 1983, р. 239–315. Available from: https://books.google.ru/books/about/Electrodics_transport.html?id=aN-FAAAAIAAJ&redir_esc=y [Accessed 9th August 2020].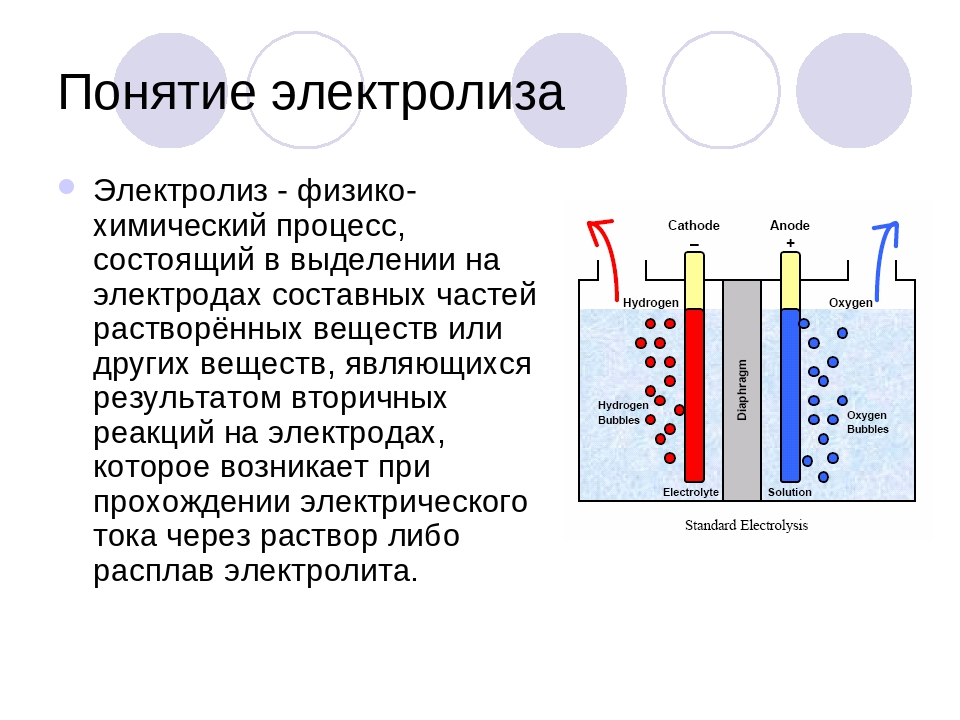
12. Newman J, Thomas-Alyea KE. Electrochemical systems. 3rd ed. John Newman and New Jersey. Hoboken: John Wiley & Sons; 2004, 647 p.
13. Gamburg YuD, Zangari G. Theory and Practice of Metal Electrodeposition, 2015. 441 р. (Russ. ed.: Teoriya i praktika elektroosazhdeniya metallov. Moscow, BINOM, Laboratoriya znanij, 2015, 441 р.)
14. Baraboshkin NA. Electrocrystallization of metals from molten electrolytes. Moscow: Nauka; 1976, 279 p. (In Russ.)
15. Richards JW. Aluminium: its history, occurrence, properties, metallurgy and applications, including its alloys. Third edition. London; 1896, 666 p.
16. Laparra M. The aluminium false twins. Сharles martin hall and paul héroult’s first experiments and technological options. Journal for the History of Aluminium. 2012;48:85–105.
Laparra M. The aluminium false twins. Сharles martin hall and paul héroult’s first experiments and technological options. Journal for the History of Aluminium. 2012;48:85–105.
17. Fedot’ev PP. The current state of the chemical and electrochemical industry on the continent of Europe: monograph. Sankt-Peterburg: Tipolitografiya Shredera; 1907, 229 p. (In Russ.)
18. Griswold T. Electrolytic cell. Patent US, no. 1070454; 1913.
19. Johnson AF. Method of producing aluminum. Patent US, no. 2480474; 1949.
20. Ransley CE. Improvements in or relating to Electrolytic Cells for the Production of Aluminium. Patent GB, no. 802905; 1958.
21. Ransley CE. Producing or Refining Aluminum. Patent US, no. 3028324; 1962.
Ransley CE. Producing or Refining Aluminum. Patent US, no. 3028324; 1962.
22. Ransley CE. The Application of the Refractory Carbides and Borides to Aluminum Reduction Cells. In: Extractive Metallurgy of Aluminum. Vol. 2. Aluminium. New York: Interscience; 1962, р. 487–506.
23. Lewis RA. Production of Aluminum. Patent US, no. 2915442; 1959.
24. Dewey JL. Refractory Lining for Alumina Reduction Cells. Patent US, no. 3093570; 1963.
25. Joo LA, Tucker KW, McCown FE. Titanium diboridegraphite composites. Patent US, no. 4376029; 1983.
26. Hudson TJ. Cathode technology for aluminum electrolysis cells. Light Metals. 1987;321–325.
Light Metals. 1987;321–325.
27. Gessing AJ, Wheeler DJ. Screening and avaluation methods of cathode materials for use in aluminum reduction cells in presence of molten aluminum and cryolite up to 1000°C. Light Metals. 1987;327–334.
28. McIntyre J, Mitchell DN, Simpson S. Performance testing of cathodic materials and designs in a 16 kA cell and a test bed. Light Metals. 1987;335–344.
29. Tucker KW, Gee JT, Shaner JR, Joo LA, Taberoux AT, Stewart DV, et al. Stable TiB2 – graphite cathode for aluminium production. Light Metals. 1987;345–349.
30. Van Leeuwen TM. An aluminum revolution. In: Equity Research, Credit Suisse First Boston. Boston; 2000, 110 p.
31. Brown CW. The wettability of TiB2-based cathodes in low-temperature slurry-electrolyte reduction cells. JOM. 1998;50(5):38–40.
Brown CW. The wettability of TiB2-based cathodes in low-temperature slurry-electrolyte reduction cells. JOM. 1998;50(5):38–40.
32. Christini RA, Dawless RK, Ray SP, Weirauch DA. Phase III advanced anodes and cathodes utilized in energy efficient aluminum production cells. In: Final Technical Progress Report for the Period 1998 August through 2001 July (Revised 2002 May 07). 92 p. Available from: https://www.osti.gov/servlets/purl/794978 [Accessed 9th August 2020].
33. Bradford DR. Inert Anode Metal Life in Low Temperature Reduction Process. Final Technical Report for September 17, 1998 through March 31, 2005. 101 p. National Technical Reports Library. Available from: https://ntrl.ntis.gov/NTRL/dashboard/searchResults/titleDetail/DE2006841153.xhtml [Accessed 9th August 2020].
34. Wang Jia-wei, Lai Yan-qing, Tian Zhong-liang, Liu Yexiang. Effect of electrolysis superheat degree on anticorrosion performance of 5Cu / (10NiO – NiFe2О4) cermet inert anode. Journal of Central South University of Technology. 2007:768. http://doi.org/10.1007/s11771-007-0146-5
Wang Jia-wei, Lai Yan-qing, Tian Zhong-liang, Liu Yexiang. Effect of electrolysis superheat degree on anticorrosion performance of 5Cu / (10NiO – NiFe2О4) cermet inert anode. Journal of Central South University of Technology. 2007:768. http://doi.org/10.1007/s11771-007-0146-5
35. Zaikov Yu, Khramov A, Kovrov V, Kryukovsky V, Apisarov A, Chemesov O, et al. Electrolysis of aluminum in the low melting electrolytes based on potassium cryolite. Light metals. 2008:505.
36. Hryn JN, Tkacheva OY, Spangenberger JS. UltraHigh-efficiency aluminum production cell. In: Report of Energy Systems Division, Argonne National Laboratory. Award Number: DE-AC02- 06Ch21357. April 2014. P. 86. Available from: https://www.energy.gov/eere/amo/downloads/ultrahighefficiency-aluminum-production-cells [Accessed 17th August 2020].
37. Bao Shengzhong, Chai Dengpeng, Shi Zhirong, Wang Junwei, Liang Guisheng, Zhang Guisheng. Effects of current density on current efficiency in low temperature electrolysis with vertical electrode structure. Light Metals. 2018:611–619. http://doi.org/10.1007/978-3-319-72284-9_79.
Bao Shengzhong, Chai Dengpeng, Shi Zhirong, Wang Junwei, Liang Guisheng, Zhang Guisheng. Effects of current density on current efficiency in low temperature electrolysis with vertical electrode structure. Light Metals. 2018:611–619. http://doi.org/10.1007/978-3-319-72284-9_79.
38. Wang Zhaohui, Friis J, Ratvik AP. Transport of Sodium in TiB2 materials investigated by a laboratory test and dft calculations. Light Metals. 2018;1321–1328.
Графитовые электроды для электролиза + Аноды, графит, припой… › Русский металл
Цена: договорная – от объёма, заполните заявку RUB
Графитовыми электродами являются формованные проводники тока из углерода.
Графитовые электроды для электролизаОни имеют широкую область применения. Их используют для строжки канавок и металла, воздушно-дуговой порезки, снятия фасок и т.д. Всё это благодаря тому, что графит электродный имеет определенные физико-химические свойства:
- Высокая электропроводимость;
- Высокая температура плавление;
- Слабая растворимость, благодаря чему рабочая среда не загрязняется;
- Инертность к многим химическим веществам, даже к высокоагрессивным.
Наиболее распространенные графитовые электроды:
- Графитовые электроды для сварки и строжки;
- Графитовые электроды для электролиза.
Из-за низкой растворимости в расплавах и жидкой среде, а также своей инертности все чаще используют именно отечественные графитовые стержни для электролиза, они дают стабильность процесса электролиза в целом и длительный срок работы электродов.
Использование графитовых электродов для электролиза приобретённых у нашей компании значительно уменьшает затраты на производстве. У нас высококачественная продукция по доступной цене.
Наша компания занимается производством изделий из графита самого разного назначения, мы предлагаем графитовый, угольный электрод только высшего качества. Мы гарантируем качество продукции и отвечаем за все технические характеристики, которые указаны. Вы всегда можете заказать у нас необходимую партию графитовых электродов по выгодным ценам.
На сайте представлены вся необходимая информация. Если же в каталоге отсутствуют товары с необходимыми вам параметрами, вы всегда можете связаться с нашими и договориться о создание индивидуальной продукции.
Если же в каталоге отсутствуют товары с необходимыми вам параметрами, вы всегда можете связаться с нашими и договориться о создание индивидуальной продукции.
Преимущества заказа графитовых электродов в нашей фирме:
- Мы изготовляем продукты на своем оборудовании, соответственно у нас отсутствует посредническая наценка.
- У нас самые низкие цены.
У нас есть возможность подобрать индивидуальные параметры материала под потребности вашего предприятия.
Бактерии помогли получить катализатор для электролиза воды
Китайские химики получили электроды для электролиза воды с помощью сульфатредуцирующих бактерий. Бактерии покрывают поверхность электрода сульфидом железа, который затем облегчает адсорбцию кислород-содержащих частиц. Полученные электроды показывают низкое значение анодного перенапряжение в 220 милливольт, а сам процесс их получения очень прост — его можно будет легко адаптировать для промышленности. Результаты исследования опубликованы в журнале Nature Communications.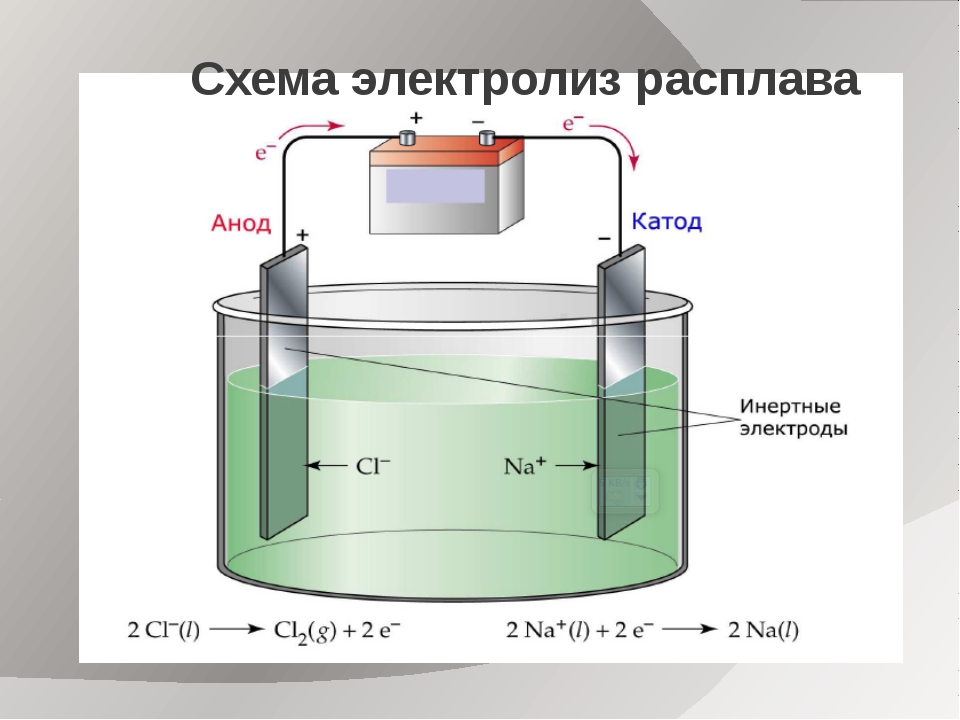
Один из наиболее экологичных способов получения водородного топлива — электролиз воды. Чтобы тратить на этот процесс меньше энергии, ученые покрывают поверхность электродов разными катализаторами. Для анода (на нем при электролизе выделяется кислород) очень эффективными оказались железно-никелевые катализаторы, которые дополнительно модифицируют разными анионными частицами: гидроксильными и сульфидными. Материалы для таких катализаторов стоят дешево, но процесс их синтеза пока что достаточно сложен: ученые используют методы гидротермального нанесения и электроосаждения.
Китайские химики под руководством Бао Юй Ся (Bao Yu Xia) из Хуачжунского университета наук и технологий попробовали модифицировать поверхность электродов с помощью сульфатредуцирующих бактерий. Известно, что коррозия стали в присутствии таких бактерий приводит к образованию сульфидов и оксогидроксидов железа — тех самых соединений, которые эффективно работают на поверхности электродов.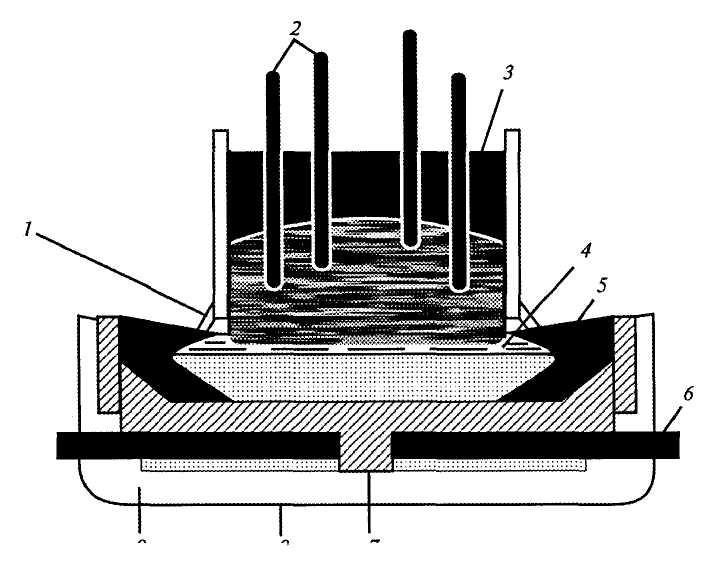
Процесс коррозии, который использовали Ся и его коллеги, очень прост. Никелевую пластину сначала обрабатывали соляной кислотой, для того, чтобы очистить никель от оксидной пленки, а затем помещали в щелочной раствор, в котором также содержался сульфат железа и сульфаторедуцирующие бактерии. Раствор выдерживали в бескислородной атмосфере при температуре 37 градусов в течение нескольких дней. За это время бактерии восстанавливали находящиеся в растворе сульфат-ионы до сульфида ионов, которые затем соединялись с железом и оседали на поверхности электрода. Авторы пробовали разную концентрацию бактерий а также разное время коррозии от 3 до 17 дней, оптимальным оказался промежуток в 10 дней.
Рамановская спектросокпия и рентгеновская спектросокпия показали, что обработанный бактериями материал представляет собой оксогидроксид никеля-железа со вкраплениями сульфида железа Ni(Fe)OOH—FeSx. Соотношение количества никеля к количеству кислорода, железа и серы на поверхности было равно 32:64:2:1.
Затем авторы протестировали новый материал в качестве электрода для выделения кислорода из щелочного раствора. Он показал очень низкое анодное перенапряжение оксиления гидроксид-ионов — всего 220 милливольт. Значение перенапряжения показывает, какое дополнительное напряжение нужно приложить к электроду, чтобы осуществить нужное оксиление или восстановление из-за различных затруднений протекания электродного процесса. Чем ниже этот параметр, тем меньше энергии надо потратить на электролиз. Авторам с первого раза удалось продемонстрировать очень хорошие значения перенапряжения — мало кому пока что удавалось добиться значений меньше 200 милливольт, а рекорд составляет 180 милливольт. Впрочем, авторы пока не проводили полной оптимизации условий коррозии, вполне возможно, в дальнейшем им удастся еще немного снизить перенапряжение. Тем не менее вклад бактерий в эффективную работу электрода очевиден уже сейчас: никелевый электрод без обработки в таких же условиях показывал перенапряжение в 400 милливольт, а электрод, обработанным только щелочным раствором железа без бактерий — 300 милливольт.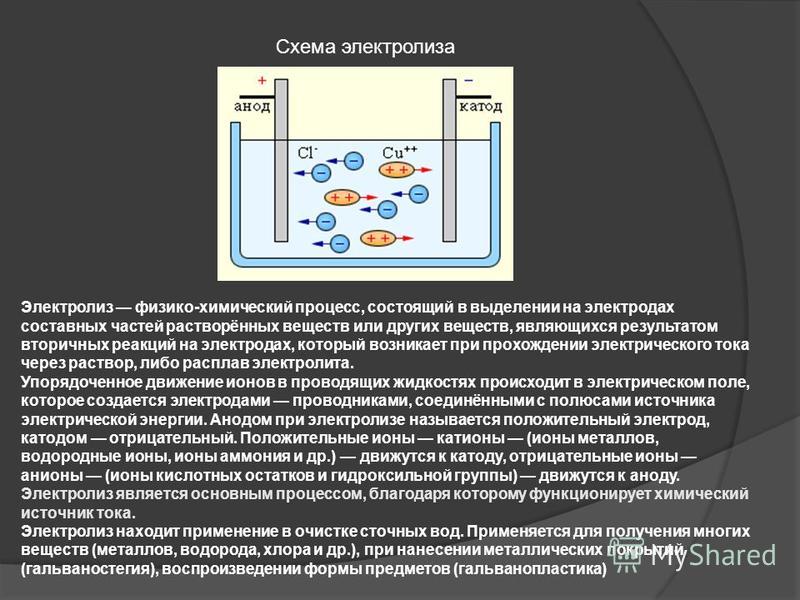
Авторы пришли к выводу, что такая высокая эффективность нового электрода — результат совместного действия оксогидроксильных OOH групп и сульфидных FeS групп на поверхности электрода. Лимитирующей (самой медленной) стадией электролиза, является адсорбция на электроде гидроксид-ионов, которые должны в дальнейшем превратиться в кислород. Теоретические расчеты показывают, что кислород легче образует связи с железом, а особенно легко — с железом, которое находится в составе сульфида железа FeS, так как на нем в данном случае сосредоточен больший положительный заряд. Поэтому в композите, богатом сульфидными группами FeS, адсорбция происходит легче и электролиз можно проводить при более низком потенциале.
Ся и его коллеги полагают, что предложенный ими метод бактериальной коррозии можно будет в дальнейшем адаптировать и для получения других материалов в том числе в промышленных масштабах.
В прошлом году американские и китайские химики показали, что похожие по составу железно-никелевые электроды с сульфидным покрытием устойчивы к хлоридной коррозии, поэтому их можно использовать и для электролиза морской воды.
Источник: N+1
Особенности применения твердых электродов для электролиза криолитоглиноземных расплавов Текст научной статьи по специальности «Нанотехнологии»
Оригинальная статья / Original article УДК 666.3-135
DOI: http://dx.doi.org/10.21285/1814-3520-2019-2-356-366
Особенности применения твердых электродов для электролиза криолитоглиноземных расплавов
© Е.С. Горланов
ООО «ЭКСПЕРТ-АЛ», г. Санкт-Петербург, Россия
Резюме: Цель – исследование процессов электроосаждения бора, титана и алюминия на углеграфитовых катодах; определение возможных путей преодоления существующих ограничений применения твердых катодов для электролиза криолитоглиноземных расплавов. Рентгенофазовый анализ проводился на автоматизированном рентгеновском дифрактометрическом оборудовании фирмы Shimadzu XRD-6000 (излучение CuKa, графитовый монохро-матор). Микроструктура поверхности образцов исследовалась на растровом электронном микроскопе JEOL JSM 7001F (Япония). Рентгеноспектральный микроанализ, энергодисперсионный микроанализ электродвижущей силы (SEM-EDS анализ) и ЭДС-картирование (EDS-mapping) выполнены на энергодисперсионном спектрометре Oxford Instruments (Великобритания). По результатам реализации электрохимического синтеза диборида титана TB при температуре ~975°С, плотности тока 0,82 А/см2 с последующим осаждением алюминия на углеродном катоде и исследованием поверхности методами рентгенофлуоресцентного анализа, а также электронной микроскопии предположены причины нестабильного течения процесса электролиза и неудовлетворительного качества покрытий. Такими причинами могут выступать химическая неоднородность и физическая микродефектность поверхности, которые инициируют концентрацию тока на микроплощадках дефектов с одновременным увеличением скорости процессов электролиза. Последующий дефицит электроактивных ионов в прикатодном пространстве приближает, а затем достигает плотности тока выше предельной диффузионной последовательно для разряда бора, титана и алюминия с возрастанием напряжения до потенциалов разложения фона – криолита, фтористых натрия и алюминия. Последствиями этих процессов являются: взаимодействие собственных и примесных агрессивных элементов с материалом поверхности, прогрессирующее развитие физической микродефектности и пассивация катода тугоплавкими осадками, а также составляющими электролита. В конечном итоге нормальный процесс электролиза нарушается с последующей необходимостью остановки. Одна из причин отсутствия прогресса в развитии технологии электролиза с применением «инертных» электродов заключается в специфических электрохимических процессах на твердой поверхности поликристаллических катодов. Установленная причинно-следственная связь между неоднородностью электродной поверхности, нестабильностью процесса электролиза и пассивацией катода позволяет определить условия применения твердых катодов. Для решения этих проблем предложено воспользоваться разработанными в лабораторных условиях технологиями борирования композитных катодов и низкотемпературного синтеза диборида титана.
Ключевые слова: электрохимичекий синтез, электроосаждение, твердый электрод, химическая неоднородность, физическая микродефектность, предельная диффузионная плотность тока
Информация о статье: Дата поступления 4 февраля 2019 г.; дата принятия к печати 12 марта 2019 г.; дата онлайн-размещения 30 апреля 2019 г.
Для цитирования: Горланов Е.С. Особенности применения твердых электродов для электролиза криолитоглиноземных расплавов. Вестник Иркутского государственного технического университета. 2019. Т.23. №2. С. 356-366. DOI: 10.21285/1814-3520-2019-2-356-366.
Features of solid electrode application for cryolite-alumina melt electrolysis
Evgeniy S. Gorlanov
EXPERT-AL LLC, Saint Petersburg, Russian Federation
Abstract: The purpose of the article is to study the processes of boron, titanium and aluminum electrodeposition on carbon graphite cathodes, identify the possible ways to overcome the existing restrictions on the use of solid cathodes for cryolite-alumina melt electrolysis. X-ray diffraction analysis (XRD) was carried out using Shimadzu XRD-6000 automated x-ray diffractometric equipment (CuKa radiation, graphite monochromator). The microstructure of the sample surface was exam-
0
ined with the use of the JEOL JSM 7001F scanning electron microscope (Japan). X-ray microanalysis and energy dispersive microanalysis (SEM-EDS analysis) as well as EDS-mapping were performed using the Oxford Instruments energy dispersive spectrometer (UK). The results of the electrochemical synthesis of titanium diboride TB at the temperature of ~ 975°C and current density of 0.82 A/cm2 with the subsequent deposition of aluminum on the carbon cathode and surface study by electron microscopy suggested the causes of the unstable electrolysis and poor quality of coatings. These causes can include chemical heterogeneity and physical microdefects of the surface, which initiate the concentration of current on the micro-sites of defects with simultaneous increase in the electrolysis rate. The subsequent shortage of electroactive ions in the cathode space approximates and then reaches the current density above the limiting diffusion one successively for the discharge of boron, titanium and aluminum with a subsequent increase in voltage to background decomposition potentials (cryolite, sodium and aluminum fluoride). These processes result in the interaction of intrinsic and impurity aggressive elements with the surface material, the progressive development of physical micro-defects as well as cathode passivation with refractory sediments and electrolyte components. Ultimately, the normal process of electrolysis is disrupted and followed by the need to stop. One of the reasons for the lack of progress in the development of electrolysis technology with the use of inert electrodes lies in the specific electrochemical processes on the solid surface of polycrys-talline cathodes. The established causal-and-effect relationship between the heterogeneity of the electrode surface, the instability of the process of electrolysis and cathode passivation makes it possible to determine the application conditions of solid cathodes. To solve these problems, it is proposed to use the technologies of composite cathode boronation and low-temperature synthesis of titanium diboride developed in laboratory conditions.
Keywords: electrochemical synthesis, electrodeposition, solid electrode, chemical heterogeneity, physical micro defects, limiting diffusion density of current
Information about the article: Received February 4, 2019; accepted for publication March 12, 2019; available online April 30, 2019.
For citation: Gorlanov E.S. Features of solid electrode application for cryolite-alumina melt electrolysis. Vestnik Irkutskogo gosudarstvennogo tehnicheskogo universiteta = Proceedings of Irkutsk State Technical University. 2019, vol. 23, pp. 356-366. (In Russ.) DOI: 10.21285/1814-3520-2019-2-356-366.
Введение
Применение электролизеров нового поколения с дренированными катодами и с вертикальным расположением электродов предполагают использование крупногабаритных прессованных или литых электродных изделий из материалов, инертных или малорасходуемых в агрессивной среде. В 2000 г. Credit Suisse First Boston Corporation публикует обзор наиболее значимых исследований в этой области мировыми производителями алюминия [5]. Анализируя состояние этих разработок, автор обзора объявляет неизбежной «Алюминиевую революцию» в течение 5-10 лет и предрекает модернизацию заводов с переходом на технологию, использующую электролизеры с инертными электродами. Революции не произошло до настоящего времени, ни одним из мировых алюминиевых производителей и научно-исследовательских центров эти вопросы не решены полностью и окончательно. Чтобы заполнить этот пробел, объявлена очередная алюминиевая «революция» – электронным изданием международного научного журнала «Nature» в мае
2018 г. анонсировано появление инновационной компании [2]. Алюминиевые гиганты Alcoa Corporation и Rio Tinto Aluminum объявили о создании в Монреале (Канада) совместного предприятия Elysis, которая планирует к 2024 г. на территории Канады внедрить революционную технологию электролиза с применением инертных электродов, называя ее «малоуглеродистой».
Принимая во внимание очередную «алюминиевую революцию», развитием которой компания Alcoa занимается около 35 лет, а ОК «РУСАЛ» находится у порога внедрения инертных анодов около 15 лет, сокращение сроков ее реализации и преодоление существующих проблем требует поддержки научным потенциалом и практическими наработками академических институтов. И, прежде всего, обратим внимание на то, что в отчете исследовательского центра Alcoa 2001-2002 годов об испытаниях электролизеров с вертикальными электродами основной проблемой развития этой конструкции ванн указывается не инертный анод, а горячепрессованный TiB2 катод [2].
Суть проблемы не раскрывается, но указывается и исследуется присутствие в плотных катодных изделиях оксидов, которые появляются на стадии их изготовления, в процессе обжига и пуска ванны. По-видимому, дело не только в высокой стоимости изделий из диборида титана, но в особенностях катодных процессов на твердых поликристаллических катодах при электролизе криолитоглиноземных расплавов. Например, в недавней работе [4] при испытаниях лабораторного электролизера с вертикальными электродами из диборидтитанового композита Т1В2-С приближение к промышленным плотностям тока приводило к пассивированию катода компонентами электролита, про-
цесс электролиза прекращался (рис. 1).
В этой связи, для понимания и решения проблемы, но эволюционным путем, необходимо изучить и понять некоторые аспекты и возможные направления создания смачиваемых объемных материалов или катодных покрытий. Проведены исследования особенностей электрохимического осаждения и синтеза смачиваемого покрытия на углеродном катоде с последующим электролизом криолитоглиноземных расплавов. Одновременно определялись ограничения на использование твердых катодов для электролитического производства алюминия и возможные технологические приемы для снятия этих ограничений.
Рис. 1. Катоды после электролиза при 0,31 /см2 (слева) и 0,65 А/см2 (справа) [4] Fig. 1. Cathodes after electrolysis at 0.31 A/cm2 (left) and 0.65 A/cm2 (right) [4]
Технология последовательного осаждения на катоде бора, титана и алюминия
Теоретически, формальные ограничения на восстановление титана, бора и алюминия на инертном или реактивном катоде отсутствуют. Напряжения разложения оксидов этих металлов, рассчитанные на основании термодинамической вероятности процессов на углеродном катоде, составляют:
B2O3 + 3/2С = 2B + 3/2 СО2 Е0 вз+/ в = -0,626 В;
TiO2 + C = Ti + CO2 Е0 Ti4+/ Ti = -0,807 В; AI2O3 + 3/2C = 2A1 + 3/2CO2 Е0 AI3+/ Ai = -1,154 В.
(1)
(2) (3)
Последовательное восстановление титана и бора предполагает их последующее взаимодействие с образованием смачиваемого алюминием слоя диборида титана:
Ti+2B = TiB2; AG01300 = -320 кДж/моль.
(4)
После его формирования на углеродной поверхности можно приступать к электролизу криолитоглиноземных расплавов по стандартной технологии с дренированным катодом или вертикальными электродами.
Эксперимент и обсуждение результатов
В попытках реализации этого процесса в лабораторных условиях было замечено, что стабильность электролиза зависит от начального качества поверхности угле-графитовых катодов, которые изготавливались фрезерованием до установленных размеров, т.е. макродефекты от инструмента в виде борозд, вскрытой пористости, задиров, наплывов влияли на динамику напряжения в течение всего эксперимента. Чтобы минимизировать это влияние, для экспериментов отбирались образцы катодов с визуально качественной, гладкой поверхностью.
Представим результаты одной из наших многочисленных попыток синтеза ди-борида титана на углеродном катоде с последующим электролизом криолитоглино-земных расплавов в течение 24 ч при расчетной геометрической плотности тока 0,82 А/см2 и температуре около 975°С. В качестве анода использовали графитовый ти-
гель, углеродный катод диаметром 30 и высотой 50 мм погружали в электролит на глубину 35-40 мм. В расплав на основе криолита технического на 1-м этапе добавляли буру, на втором – оксид титана и на финальной стадии в течение 2-х ч – оксид алюминия. В гальваностатических условиях динамика напряжения в течение эксперимента регистрировалась непрерывно автоматическим измерительным комплексом ИК 4-2 («НТЦ ЭЛТЕР»). Наличие алюминия на катоде в конце опыта являлось визуальным индикатором смачиваемой поверхности.
Через каждые 2 ч из расплава отбирали пробы для контроля состава электролита методом рентгенофлуоресцентного анализа (РФА). Как следует из результатов анализа, оксид бора В2О3 присутствует в расплаве, как в свободном виде, так и в комплексах с другими оксидами Саз(ВОз)2 и АЦВ2О9 с самого начала эксперимента (рис. 2).
Рис. 2. РФА состава электролита Fig. 2. Electrolyte composition XRD
Рис. 3. Динамика напряжения эксперимента Fig. 3. Experiment voltage dynamics
Учитывая результаты РФА и полученные ранее данные по уровням напряжения, при которых происходит разложение тех или иных соединений, предполагаем, что в начале эксперимента при напряжении около 2,900 В реализуются процессы восстановления бора и алюминия из образующихся комплексов (рис. 3).
Саз(ВОз)2 + 3/2С = ЗСаО + 2В + З/2СО2; ,,, Е°Меп+/ Ме= 1,040 В. (5)
А14В2О9 + 9/2С = 4А1 + 2В + 9/2СО2;
Е°Меп+/ Ме= 1,011 В. (6)
Получаем иЖп,= 2,900 В.
Но эти процессы (5) и (6) в чистом виде происходили в течение 60 мин начального участка, после чего взаимодействие восстанавливаемых компонентов между собой и с материалом катода вызвали устойчивый и усиливающийся деполяризующий эффект (ДЕйер) катодных процессов (табл. 1).
До 360 мин напряжение стабильно снижалось к 2,800 – 2,780 В на величину развивающейся деполяризации (рис. 3), т.е.
в конечном итоге на 2,900 – 2,780 = 0,120 В, что согласуется с теоретической деполяризацией (см. табл. 1).
Далее, после 360 мин, окончание 1 этапа и весь 2-й этап потенциал катода и напряжение ячейки (иэксп) резко сдвигается в электроотрицательную сторону до значений потенциалов разложения составляющих электролита (см. рис. 3, табл. 2).
Явление самопроизвольного повышения напряжения до разряда наиболее электроотрицательных компонентов обычно объясняется концентрационной поляризацией катода, хотя в данном случае содержание поставщиков электроактивных компонентов в объеме электролита существенно не изменялось в течение всего эксперимента (см. рис. 2).
Но существует другой механизм возникновения катодной концентрационной поляризации, связанный с качеством поверхности электрода. При исследовании углеродных катодов после экспериментов методами электронной микроскопии во всех случаях обнаруживалась высокая микродефектность поверхности (рис. 4).
Таблица 1
Процессы развивающейся катодной деполяризации
Table 1
Processes of developing cathodic depolarization_
Реакции AG°r, кДж/моль AEüep, В
Al+12B=AlBi2 -174,00 0,046
4B+C=B4C -58,1° 0,050
Al+2B=AlB2 -54,90 0,063
4Al + 3C = AUCs -131,64 0,114
СаО + 2/3AI = Са + 1/3AhOs -136,02 0,117
Таблица 2
Значения потенциалов разложения составляющих электролита
Table 2
Values of decomposition potentials of electroly te components
Реакции при jpac4. = 0,82 А/см2 |Е° Меп+/ Me |, В иэксп, В –
NaF + %С = Na + %CF4 2,702 5,030 (1)
NasAlFe+%C=Al+3NaF+%CF4 2,520 4,830 (2)
Разность потенциалов 0,182 0,200 –
Рис. 4. ЭДС-карты углеродной поверхности катода после электролиза (х55) Fig. 4. EDS-maps of cathode carbon surface after electrolysis (* 55)
Развивающаяся исходная физическая неоднородность катода, за счет неоднородности химических (или реакций с участием электродной поверхности, см. табл. 1), генерирует на микроплощадках микродефектов высокую флуктуирующую плотность тока (¡флукт.). По достижении некоторой критической концентрации микродефектов ¡флукт. трансформируется в действительную катодную плотность тока (¡действ.), резко увеличивающую скорость процессов (5) и (6) на катоде. и F.
Рис. 5. Внешний вид перевернутого катода после эксперимента и ЭДС-карты Al, C, Na и F
на выделенном участке между алюминием и поверхностью катода (x55) Fig. 5. External view of the inverted cathode after the experiment and an EDS map of Al, C, Na, and F in the specified area between the aluminum and the cathode surface (x 55)
Электролиз расплавленных солей с применением твердых углеродных катодов
Представленная динамика напряжения электролиза с применением вертикально расположенного углеродного катода и результаты экспериментов имеют хорошую воспроизводимость и во многом похожи на результаты, полученные авторами [4] при испытании лабораторных электролизеров с вертикальным ТВ-С катодом (см. рис. 1). В обоих случаях это связано с присутствием на поверхности поликристаллических катодных мономатериалов или композитов химической неоднородности и физической микродефектности, которые изначально приобретаются в технологическом цикле синтеза исходных порошковых материалов, при их прессовании и термической обработке. А1. (1°)
Присутствие на катоде чрезвычайно агрессивных субионов алюминия А/+ (по отношению к материалам электродов) многократно увеличивает разрушительное воздействие алюминия по механизмам, исследованным авторами [5, 6]. Причем в данном случае коррозионному воздействию будут подвергаться не только катоды, но и расположенные на минимальном расстоянии (2-3 см) аноды.
Постоянный ток концентрируется на узких гранях, ребрах, микротрещинах, точечных площадках выступающих микроне-однородностей (с возникновением высокой ¡действ). То есть действительная плотность тока может быть не только выше расчетной геометрической катодной, но и значительно превышать предельную диффузионную для
разряда алюминия. При таких высоких действительных плотностях тока в условиях концентрационной поляризации на катоде будут формироваться порошковые осадки из наиболее электроотрицательных примесных электроактивных компонентов, например:
СаО + C = Са + У2СО2; Е01200 = -1,657 В.
СаО = Са + У2О2; Е01200 = -2,639 В.
(11)
(12)
В свою очередь, эти элементы с высокой вероятностью могут взаимодействовать с материалом катода или его составляющими, формируя изолирующий слой:
Са + 2C = CaC2; kG0i300 =-6,25 кДж/моль.
Ca + 6B = СаВб; AG0i300 = -533,81 кДж/моль.
(13)
(14)
Кроме того, в условиях концентрационной поляризации и обогащении прикатод-ного объема электролита ионами натрия происходит их разряд на инертном катоде с последующим взаимодействием с материалом поверхности и его вторичными фазами:
TiBÖ3 + Na = NaBÖ2 + TiO; AG0i200 = -33,50 кДж/моль.
3TiB2 + Na = NaB6 + 3Ti.
(15)
(16)
Эти вероятные процессы также изменяют состав поверхности катода, пассивируют ее метаборатом натрия МэВ02 (Т плавл.= 966°С) или гексаборатом натрия №Вб, являющимся изолятором с удельным электросопротивлением около 4106 Омсм [8]. А частичное или полное растворение бората натрия МэВ02 в электролите будет прогрессивно увеличивать микродефектность катода. Этот процесс подтверждался результатами специальных исследований авторов [9].
Обобщая, макро- и микроучастки катодной поверхности мономатериалов или композитов имеют начальную физическую микродефектность (см. рис. 4), а также большую или меньшую реакционную активность по отношению к агрессивным компонентам рабочей среды. При продолжительной работе в такой среде, то есть с развитием физической микродефектности и сдвигом катодной поляризации в отрицательную сторону, на катоде возможно разложение компонентов электролита на реактивных катодах
AlF3+%C=Al+%CF4; Е01200 = -2,193 В.
Na3AlF6+%C=Al+3NaF+%CF4; Е01200 = -2,564 В.
NaF + 1/4С = Na +1/4CF4; Е01200 = -2,754 В или инертных катодах
AIF3 =M+%F2; Е01200 = -4,112 В.
NaAIF6 =Al+3NaF+%F2; Е01200 = -4,510 В.
NaF = Na +1/2F2; Е01200 = -4,673 В.
(17)
(18)
(19)
(20) (21) (22)
с соответствующими негативными последствиями для катодных процессов и состояния электродов. Эти последствия, в условиях пассивирования электрода примесными осадками и обогащения объема расплава и приэлектродного пространства фторидом натрия, будут выражаться во взаимодействии собственных и примесных элементов с материалом катода, а также локальным повышением температуры плавления расплава в прикатодном пространстве. В результате поверхность не только будет менять свой состав и физическое состояние, но и изолироваться намерзающим на электроде электролитом, тугоплавкими соединениями примесей. В конечном итоге нормальный процесс электролиза нарушается с последующей необходимостью остановки.
Таким образом, твердые поликристаллические катоды из индивидуальных соединений или их композиций не могут безусловно использоваться для электролиза криолитоглиноземных расплавов в любом исполнении, в горизонтальном и вертикальном. Логичным условием их применения является организация процессов непрерывного восстановления катодной поверхности, уменьшение ее химической неоднородности и микродефектности в течение всего периода электролиза. Например, для катодов на основе диборида титана технология электролиза криолитоглиноземных расплавов должна сопровождаться микродозированием бора в электролит, восстановлении его на катоде с последующим взаимодействием на поверхности и в объеме электрода между исходными и примесными компонентами:
Эти процессы будут не только восстанавливать исходный состав катода, но и устранять микродефектность его поверхности.
В лабораторных условиях подобная технология успешно реализована в способе непрерывного борирования углеродных ти-тансодержащих катодов [1°, 11]. Механизм формирования смачиваемого алюминием Т—В-С катодного слоя и непрерывное его восстановление реализуется через последовательно-параллельные стадии встречных твердо- и жидкофазных потоков бора и титана (в элементарном виде и в виде соединений), с последующим взаимодействием между ними (23)-(26) и с основой композита:
2В + ТЮ2 + 2С ^ ТВ + 2СО;
Авпоок = -67,0 кДж/моль. T1B2 + 3CO; AG13°°K = -41,0 кДж/моль.
(28)
Углерод-титан-содержащие катоды и борсодержащие аноды могут изготавливаться на электродном заводе и анодной фабрике с дозированием в их состав титан-и борсодержащих соединений. В качестве катодов могут быть использованы как дибо-ридтитановые, так композитные составы Т1Б2 – Св (диборид титана-углеграфит), полученные с применением низкотемпературного синтеза диборида титана [12, 13].
Заключение
1. Технология электрохимического осаждения бора, титана и алюминия на углеродном катоде из криолитоглиноземных расплавов при ~975°С и плотности тока 0,82 А/см2 обеспечивает визуальное смачивание электрода алюминием. Результаты процесса находятся в прямой зависимости от качества поверхности поликристаллического катода.
2. Многолетнее отсутствие прогресса коммерческого развития технологии электролиза криолитоглиноземных расплавов с применением инертных электродов
предложено объяснять специфическими электрохимическими процессами на катодной поверхности.
3. Химическая и физическая неоднородность поверхности катодов является причиной периодического возникновения концентрационной поляризации, нестабильности электрохимических процессов, последствия которых выражаются во взаимодействии примесных элементов с материалом катода и разложением составляющих электролита. В результате поверхность ка-
тода не только меняет свой состав и физическое состояние, но и пассивируется тугоплавкими соединениями примесей, намерзающим на электроде электролитом.
4. Установленная причинно-следственная связь между неоднородностью электродной поверхности и нестабильностью катодного процесса дает основания утверждать:
• твердые поликристаллические катоды из индивидуальных соединений или их композиций не могут безусловно использоваться для электролиза криолитоглинозем-ных расплавов в любом исполнении, в горизонтальном и вертикальном;
• логичным условием применения
твердых катодов является организация процессов электролиза с непрерывным восстановлением поверхности, уменьшением ее химической неоднородности и микродефектности в течение всего технологического периода.
5. Для технологического и конструктивного развития электролизеров нового поколения предложено использовать технологию непрерывного микроборирования поверхности индивидуальных Ш2 или композитных Ш2 – Св катодов, изготовленных с использованием технологии низкотемпературного синтеза диборида титана, формируя изолирующий слой.
Библиографический список
1. Leeuwen T.M. An Aluminum Revolution // Equity Research Report, Credit Suisse First Boston Corporation, June 22. 2000. 110 p.
2. Aluminium producers promise a cleaner smelting pot [Электронный ресурс]. Режим доступа: https://www. nature.com/articles/d41586-018-05158-1. (дата обращения: 20.01.2019).
3. Christini R. A., Dawless R. K., Ray S. P., Weirauch D. A. Advanced Anodes and Cathodes Utilized in Energy Efficient Aluminum Production Cells // Final Technical Progress Report for Phase III, Cooperative Agreement Number DE-FC07-98ID13666. 2001. No. 5. 92 p.
4. Bao Sh., Chai D., Shi Z., Wang J., Liang G., and Zhang Y. Effects of Current Density on Current Efficiency in Low Temperature Electrolysis with Vertical Electrode Structure // Light Metals. 2018. P. 611-619.
5. Jensen M. S., Pezzotta M., Zhang Z.L., Einarsrud M.-A., Grande T. Degradation of TiB2 ceramics in liquid aluminum // J. Eur. Ceram. Soc. 2008. Vol. 28. P. 31553164.
6. Saai A., Wang Z., Pezzotta M., Friis J., Ratvik A. P., and Vullum P. E. Multi-scale Modelling of Titanium Dibo-ride Degradation Using Crystal Elasticity Model and Density Functional Theory // Light Metals. 2018. P. 13291336.
7. Ветюков М.М., Цыплаков А.М., Школьников С.Н. Металлургия алюминия и магния. М.: Металлургия, 1987. 320 с.
8. Самсонов Г.В., Серебрякова Т.И., Неронов В.А. Бориды. М.: Атомиздат, 1975. 376 с.
9. Wang Z., Friis J., Ratvik A. P. Transport of Sodium in TiB2 Materials Investigated by a Laboratory Test and DFT Calculations // Light Metals. 2018. P. 1321-1328.
10. Gorlanov E.S., Bazhin V.Yu. Nano- and the Microdi-mensional Coats Polycrystal Titanium-Containing the Bases a Method of Electrochemical Boronizing // Smart Nanocomposites. USA, Nova Science Publishers, Inc. 2016. Vol. 7. № 1. P.75-88.
11. Пат. 2337184 Российская Федерация, МПК7 C25C 3/08. Способ получения и поддержания защитного смачиваемого покрытия на углеродистых блоках катодного устройства электролизёра для производства алюминия / Е.С. Горланов: Общество с ограниченной ответственностью «Эксперт-Ал». – № 2006142406/02; заявл. 30.11.2006; опубл. 27.10.2008 Бюл. №30. 11 с.
12. Пат. 2603407 РФ. МПК B22F 9/18, C01B 35/04, C01G 23/00. Способ получения порошка диборида титана / Е.С. Горланов, В.Ю. Бажин, А.В. Смань; заявитель и патентообладатель ООО “Эксперт-Ал” 2015107637/02; опубл. 30.04.2015. опубл. 27.11.2016. Бюл. № 33. 12 с.
13. Горланов Е.С., Бажин В.Ю., Федоров С.Н. Карбо-термический синтез диборида титана: апгрейд // Журнал СФУ. Техника и технология. 2018. № 11. № 2. С. 156-166.
References
1. Leeuwen T.M. An Aluminum Revolution. Equity Research Report, Credit Suisse First Boston Corporation, June 22, 2000, 110 p.
2. Aluminium producers promise a cleaner smelting pot [Electronic resource]. https://www.nature.com/arti-cles/d41586-018-05158-1. (accessed: 20 January 2019).
3. Christini R. A., Dawless R. K., Ray S. P., Weirauch D. A. Advanced Anodes and Cathodes Utilized in Energy Efficient Aluminum Production Cells // Final Technical Progress Report for Phase III, Cooperative Agreement Number DE-FC07-98ID13666, 2001, no. 5, 92 p.
4. Bao Sh., Chai D., Shi Z., Wang J., Liang G., and Zhang Y. Effects of Current Density on Current Efficiency in Low
Temperature Electrolysis with Vertical Electrode Structure. Light Metals, 2018, pp. 611-619.
5. Jensen M. S., Pezzotta M., Zhang Z.L., Einarsrud M.-A., Grande T. Degradation of TiB2 ceramics in liquid aluminum. J. Eur. Ceram. Soc, 2008, vol. 28, pp. 3155-3164.
6. Saai A., Wang Z., Pezzotta M., Friis J., Ratvik A. P., and Vullum P. E. Multi-scale Modelling of Titanium Dibo-ride Degradation Using Crystal Elasticity Model and Density Functional Theory. Light Metals, 2018, pp. 1329-1336.
7. Vetyukov M.M., Cyplakov A.M., Shkol’nikov S.N. Met-allurgiya alyuminiya i magniya [Metallurgy of aluminium and magnesium]. Moscow: Metallurgiya Publ., 1987, 320 p. (In Russ.).
8. Samsonov G.V., Serebryakova T.I., Neronov V.A. Boridy [Borides]. Moscow: Atomizdat Publ., 1975, 376 p. (In Russ.).
9. Wang Z., Friis J., Ratvik A.P. Transport of Sodium in TiB2 Materials Investigated by a Laboratory Test and
DFT Calculations. Light Metals. 2018. P. 1321-1328.
10. Gorlanov E.S., Bazhin V.Yu. Nano- and the Microdi-mensional Coats Polycrystal Titanium-Containing the Bases a Method of Electrochemical Boronizing. Smart Nanocomposites. USA, Nova Science Publishers, Inc, 2016, vol. 7, no. 1, pp.75-88.
11. Gorlanov E.S. Sposob polucheniya i podderzhaniya zashchitnogo smachivaemogo pokrytiya na uglerodistyh blokah katodnogo ustrojstva elektrolizyora dlya proizvod-stva alyuminiya [The method of obtaining and maintaining a protective wettable coating on cathode electrolyzer carbon blocks for aluminum production]. Patent RF, no. 2337184, 2008.
12. Gorlanov E.S., Bazhin V.Yu., Sman A.V. Sposob polucheniyaporoshka diborida titana [Method of titanium diboride powder production]. Patent RF, no. 2016.
13. Gorlanov E.S., Bazhin V.Yu., Fedorov S.N. Car-bothermic synthesis of titanium diboride: upgrade. Tekhnika i tekhnologiya, 2018, vol. 2, no. 11, pp. 156-166. (In Russ.).
Критерии авторства
Горланов Е.С. получил и оформил научные результаты, несет ответственность за плагиат.
Authorship criteria
Gorlanov E.S. has obtained, formalized the scientific results and bears the responsibility for plagiarism.
Конфликт интересов
Автор заявляет об отсутствии конфликта интересов.
Conflict of interests
The author declares that there is no conflict of interests regarding the publication of this article.
ИНФОРМАЦИЯ ОБ АВТОРЕ Горланов Евгений Сергеевич,
кандидат технических наук, заместитель генерального директора ООО «Эксперт-Ал»,
199106, г. Санкт-Петербург, просп. Средний 86/17/36;
e-mail: [email protected]
В.О.,
INFORMATION ABOUT THE AUTHOR Evgeniy S. Gorlanov,
Cand. Sci. (Eng.),
Deputy General Director of Expert-Al LLC, 86/17/36 Sredniy pr. V.O., Saint-Petersburg 199106, Russian Federation; e-mail: [email protected]
Электроды из нержавеющей стали| Демонстрация электролиза
Есть вопросы? Обратитесь в службу поддержки клиентов.406-256-0990 или же Живой чат в
- Возраст 8+
- На складе, готово к отправке
- Это нужно быстро? Смотрите варианты доставки в корзине.
Используйте эту пару изолированных электродов из нержавеющей стали, чтобы продемонстрировать электролиз воды на водород и кислород. Читать Более
участников My Science Perks зарабатывают не менее $ 0.15 обратно на этот товар. Войдите или создайте Бесплатный HST Аккаунт, чтобы начать зарабатывать сегодня
ОПИСАНИЕ
Используйте эту пару изолированных электродов из нержавеющей стали, чтобы продемонстрировать электролиз воды на водород и кислород.Не подвергается быстрой коррозии, как медь. Требуются некоторые дополнительные материалы. Включает инструкции.
БЛОК ДОПОЛНИТЕЛЬНОЙ ИНФОРМАЦИИ
ВКЛАДКА «СОДЕРЖАНИЕ»
ВКЛАДКА «ТЕХНИЧЕСКИЕ ХАРАКТЕРИСТИКИ»
- Описание
- ЭЛЬ-ЭЛЕКТРО
- Технические характеристики
- СОДЕРЖАНИЕ
Мы хотим, чтобы этот предмет был живым, когда вы его получите! Следовательно, нам необходимо знать, когда вы будете дома, чтобы получить его (минимизируя воздействие стихии).Укажите дату доставки, среда – Пятница, это минимум 7 дней с сегодняшнего дня.
Физика и инженерия / Электричество и электроника / Статическое электричество
/ физика-инженерия /, / физика-инженерия / электричество-электроника /, / физика-инженерия / электричество-электроника / электроды-статическое электричество /
Понятно. Наука может быть беспорядочной. Но продукты и услуги Home Science Tools справятся с этим.
Наша продукция долговечна, надежна и доступна по цене, позволяя вам перемещаться из поля в лабораторию и на кухню. Они не подведут, с чем бы они ни боролись. Будь то (чрезмерно) нетерпеливые молодые ученые из года в год или строгие требования, которые возникают раз в жизни.
И если ваш научный запрос идет не так, как ожидалось, вы можете рассчитывать на помощь нашей службы поддержки клиентов. Рассчитывайте на дружеские голоса на другом конце телефона и советы экспертов в вашем почтовом ящике.Они не будут счастливы, пока вы не станете счастливыми.
Итог? Мы гарантируем, что наши продукты и услуги не испортят ваше научное исследование, каким бы беспорядочным оно ни было.
Вопросы? Свяжитесь с нашей службой поддержки клиентов.
17.2: Электролиз – Химия LibreTexts
Типичная электролитическая ячейка может быть изготовлена, как показано на рисунке \ (\ PageIndex {1} \). Два электрических проводника (, электроды, ) погружены в жидкость, подлежащую электролизу.Эти электроды часто изготавливаются из инертного материала, такого как нержавеющая сталь, платина или графит. Жидкость, подлежащая электролизу, должна быть способна проводить электричество, поэтому обычно это водный раствор электролита или расплавленное ионное соединение. Электроды подключены проводами к батарее или другому источнику постоянного тока. Этот источник тока можно рассматривать как «электронный насос», который забирает электроны с одного электрода и выталкивает их на другой электрод. Электрод, с которого удаляются электроны, становится положительно заряженным, в то время как электрод, к которому они подводятся, имеет избыток электронов и отрицательный заряд.
Рисунок \ (\ PageIndex {1} \): электролитическая ячейка. Батарея откачивает электроны от анода (делая его положительным) в катод (делая его отрицательным). Положительный анод притягивает к себе анионы, а отрицательный катод притягивает к себе катионы. Электрический ток переносится электронами в проводе и электродах, но он переносится анионами и катионами, движущимися в противоположных направлениях в самой ячейке. Поскольку анод может принимать электроны, на этом электроде происходит окисление.Катод является донором электронов и может вызвать восстановление. из Википедии (кредит XXX).Отрицательно заряженный электрод притягивает к себе положительные ионы (катионы) из раствора. Он может отдавать часть своих избыточных электронов таким катионам или другим частицам в жидкости, подвергаемой электролизу. Следовательно, этот электрод фактически является восстановителем. В любом электрохимическом элементе (электролитическом или гальваническом) электрод, на котором происходит восстановление , называется катодом .
Положительный электрод, с другой стороны, притягивает к себе отрицательные ионы (анионы). Этот электрод может принимать электроны от этих отрицательных ионов или других частиц в растворе и, следовательно, ведет себя как окислитель. В любой электрохимической ячейке анод – это электрод, на котором происходит окисление . Простой способ запомнить, какой электрод – это то, что анод и окисление начинаются с гласных, в то время как катод и восстановление начинаются с согласных.
На следующем видео показан этот процесс в нейтральном водном растворе с некоторыми присутствующими электролитами.{-} (aq) \ rightarrow \ text {H} _2 (g) + \ text {Cl} _2 (g) + \ text {2H} _2 \ text {O} (l) \]
Чистая реакция [Уравнение \ (\ ref {3} \)] – это , обратная спонтанной комбинации H 2 ( г, ) с Cl 2 ( г, ) с образованием HCl ( водн ). {-} \]
Однако Li + – очень плохой акцептор электронов, и поэтому очень трудно заставить выполняться уравнение \ (\ ref {5} \).{-} \ label {8} \]
Общее уравнение можно получить, умножив уравнение \ (\ ref {7 } \ ) на 2, добавив его к уравнению \ (\ ref {8} \) и сложив H + с OH – , чтобы получить H 2 O:
\ [\ text {2H} _2 \ text {O} (l) \ rightarrow \ text {2H} _2 (g) + \ text {O} _2 (g) \]
На следующем видео показан процесс электролиза воды с использованием серной кислоты в качестве моста для передачи заряда. После завершения электролиза идентичность образующихся газов проверяется с помощью тестов на горючие шины.
Таким образом, этот электролиз обращает спонтанную комбинацию H 2 и O 2 с образованием H 2 O. При обсуждении окислительно-восстановительных реакций мы упоминаем несколько окислителей, например, которые достаточно сильны, чтобы окислять H 2 O. В то же время мы описываем восстановители, которые достаточно сильны для восстановления H 2 O, такие как щелочные металлы и более тяжелые щелочноземельные металлы. Как правило, такие вещества не могут быть получены электролизом водных растворов, потому что вместо этого окисляется или восстанавливается H 2 O.Вещества, которые подвергаются спонтанной окислительно-восстановительной реакции с H 2 O, обычно получают электролизом расплавов солей или в каком-либо другом растворителе. Однако из этого правила есть некоторые исключения, потому что некоторые электродные реакции протекают медленнее, чем другие. Например, используя таблицу 11.5, мы можем предсказать, что H 2 O является лучшим восстановителем, чем Cl –.
Следовательно, можно ожидать, что O 2 , а не Cl 2 , будет получен путем электролиза 1 M HCl, что противоречит уравнению \ (\ ref {1} \).Оказывается, что O 2 образуется более медленно , чем Cl 2 , и последний пузырится из раствора до того, как H 2 O может быть окислен. По этой причине Таблицу 1 из раздела Редокс-пары не всегда можно использовать для прогнозирования того, что произойдет при электролизе.
Введение в электролиз
Электролит – вещество, подвергающееся электролизу. Это будет ионное соединение либо в расплаве, либо в растворе.
Как вы увидите позже, электролиз включает движение ионов к электродам. Ионы не могут двигаться в твердом теле.
Положительные ионы движутся к отрицательному катоду во время электролиза. Положительные ионы известны как катионы .
Отрицательные ионы движутся к положительному аноду во время электролиза. Отрицательные ионы известны как анионы .
На ранних стадиях лучше понять, что такое анион и катион, чем помнить об этом.Например, очевидно, что положительный ион будет двигаться к отрицательному катоду – поэтому он называется катионом. Он назван в честь того, где он оказался.
Что происходит во время электролиза?
Большинство учителей и книг, вероятно, представят электролиз путем электролиза расплавленного бромида свинца (II), потому что это легко сделать и визуально очевидно, что происходит.
В целом при электролизе бромид свинца (II) расщепляется на свинец и бром.
PbBr 2 (л) Pb (л) + Br 2 (г)
Обратите внимание на государственную символику. Это делается очень горячим, так что бромид свинца (II) расплавляется, как и образующийся свинец. Бром выделяется в виде газа.
Аппарат будет выглядеть так:
Если мы подробно рассмотрим, что происходит на двух электродах:
Катод (отрицательный электрод) имеет большое количество электронов, накачиваемых на него источником питания.К нему притягиваются положительные ионы свинца (II).
Когда они попадают туда, 2 электрона отрываются от электрода и нейтрализуют заряд иона свинца (II). Образуется атом свинца.
Pb 2+ (л) + 2e – Pb (л)
Расплавленный свинец собирается под электродом.
Из анода (положительного электрода) откачиваются электроны, что делает его положительным. К нему будут притягиваться ионы бромида.
Когда они попадают туда, электрон отскакивает от каждого бромид-иона, оставляя атом брома.Но атомы брома образуют молекулы, Br 2 .
Таким образом, два атома брома, показанные на диаграмме, соединяются с образованием Br 2 , который выделяется как коричневый газ.
2Br – (л) Br 2 (г) + 2e –
Что происходит в цепи?
Каждая единица PbBr 2 , разряженная таким образом, помещает два новых электрона на анод и забирает два электрона с катода.
Источник питания качает новые электроны на аноде по цепи, чтобы заменить электроны, снятые с катода. Движение электронов – это электрический ток, поэтому теперь электричество течет во внешней цепи.
Если вы думаете о системе в целом, электричество переносится электронами во внешней цепи, но за счет движения и разряда ионов в электролите.
Это может работать, только если у вас есть ионы, которые могут свободно перемещаться. Вот почему электролит должен быть ионным соединением, расплавленным или находящимся в растворе.
Это довольно несложный для объяснения электролиз, но все реакции электролиза работают по одним и тем же принципам. Мы рассмотрим другие примеры на других страницах.
Окисление и восстановление при электролизе
Этот следующий бит предполагает, что вы понимаете окисление и восстановление с точки зрения переноса электронов. Если вас это не устраивает, перейдите по этой ссылке, прежде чем продолжить.
Посмотрите еще раз на электродные реакции, которые мы только что написали выше.
На катоде
Pb 2+ (л) + 2e – Pb (л)
Ионы свинца (II) набирают электроны. Прирост электронов снижается (OIL RIG).
На катоде происходит реакция восстановления. Неважно, что вы проводите электролизом – это всегда будет правдой.
Каждая катодная реакция включает в себя получение электронов.
На аноде
2Br – (л) Br 2 (г) + 2e –
Ионы бромида теряют электроны на аноде.Потеря электронов – это окисление (снова OIL RIG).
Опять же, это верно для любого электролиза. На аноде всегда происходит окисление.
Каждая анодная реакция включает потерю электронов.
типов электродов для электролиза | Мини-химия
На разряд ионов во время электролиза могут влиять типы используемых электродов. Некоторые электроды инертны (не участвуют в электролитической реакции), в то время как другие электроды являются реактивными (что может влиять на ионный разряд).Платиновые или угольные электроды являются примерами инертных электродов.
Одним из примеров реактивных электродов, изменяющих ионный разряд, будет электролиз сульфата меди (II) с использованием медных электродов.
Отзыв: Если электролиз сульфата меди (II) проводится с использованием угольных электродов, кислород выделяется на аноде, а медь откладывается на катоде. {2 +} $ притягиваются к катоду.{-} долларов США
Общая реакция:
- Концентрация сульфата меди (II) (электролита) не изменяется. $ \ rightarrow $ Раствор сульфата меди (II) остается синего цвета
- Медь с анода переходит с анода на катод.
Дополнительное использование:
- Этот метод можно использовать для очистки меди.
- В качестве анода используется нечистая медь, а в качестве катода – кусок чистой меди.
- Чистая медь из загрязненного медного анода растворяется в электролите, а затем чистая медь осаждается на медном катоде.{-} долларов США
Общая реакция:
- Нитрат серебра не разложился $ \ rightarrow $ Концентрация раствора нитрата серебра не изменилась.
- Серебро переносится с анода на катод.
Электролиз – Lenntech
Электролиз – это процесс, при котором электрическая энергия превращается в химическую. Процесс происходит в электролите, водном растворе или плавлении соли, что дает ионам возможность переноситься между двумя электродами.Электролит – это соединение между двумя электродами, которые также подключены к постоянному току. Это устройство называется электролизной ячейкой и показано на рисунке ниже:
Если вы подаете электрический ток, положительные ионы мигрируют к катоду, а отрицательные ионы – к аноду. Положительные ионы называются катионами, и все они являются металлами. Из-за своей валентности они потеряли электроны и могут захватывать электроны. Анионы – это отрицательные ионы. Они несут больше электронов, чем обычно, и имеют возможность отказаться от них.Если катионы контактируют с катодом, они возвращают потерянные электроны обратно в элементарное состояние. Анионы реагируют противоположным образом. Если они контактируют с анодом, они отдают свои лишние электроны и переходят в элементарное состояние. На электроде катионы восстанавливаются, а анионы окисляются.
Для управления реакциями в ячейке вы можете выбирать между различными материалами электродов. А также можно использовать различные электролиты для особых реакций и эффектов.Электролит содержит ионы, которые проводят ток.
Например, если вы хотите оцинковать кусок металла, используется в качестве катода. Ионы металла анода мигрируют к катоду и становятся тонким слоем на поверхности детали, которую необходимо оцинковать.
Для получения очень чистой меди необходимо выбрать загрязненный медный анод, который будет очищен электролизом. Медь получают в виде ионов Cu 2+ в растворе и осаждают на катоде более чистый слой меди, чем раньше.Загрязнения анода не будут реагировать так, как медь. Металлы с более благородным характером, чем медь, не вступят в реакцию. Они падают на землю и накапливают анодный шлам. Металлы со стандартным потенциалом больше, чем у меди, также будут подвергаться электролизу и мигрировать на катоде.
Этим способом очищается и серебро.
Для прогнозирования реакций электролиза используется «электрохимический электродвижущий ряд». В этой таблице (см. Фрагмент ниже) вы можете найти элементы, упорядоченные по их стандартным потенциалам (E 0 ).Стандартный потенциал показывает способность ионов водорода отдавать электроны. В этой таблице стандартный потенциал водорода равен 0. Другие элементы имеют положительный или отрицательный стандартный потенциал. Это означает, что элементы с отрицательным потенциалом было легче окислить, чем водород, а элементы с положительным потенциалом было труднее окислить, чем водород.
Li / Li + -3,04 мВ
K / K + -2,92 мВ
Ca / Ca 2+ -2,87 мВ
Na / Na + -2 , 71 мВ
Mg / Mg 2+ -2,37 мВ
Mn / Mn 2+ -1,18 мВ
2 H 2 O / H 2 + 2OH – – 0,83 мВ
Zn / Zn 2+ -0,76 мВ
Cr / Cr 3+ -0,74 мВ
Fe / Fe 2+ -0,56 мВ
Fe / Fe 3+ -0,44 мВ
Cd / Cd 2+ -0,40 мВ
Ti / Ti 2+ -0,34 мВ
Co / Co 2+ -0, 28 мВ
Ni / Ni 2+ -0,23 мВ
Sn / Sn 2+ -0,14 мВ
Pb / Pb 2+ -0,13 мВ
H 2 / 2H + ± 0,00 мВ
Cu / Cu + +0,34 мВ
2 Hg / Hg 2 2+ +0,79 мВ
Ag / Ag + +0,80 мВ
Hg / Hg 2+ +0,85 мВ
Pt / Pt 2+ +1,20 мВ
Cl 2 / 2Cl – +1, 36 мВ
Au / Au + +1,50 мВ
F 2 / 2F – +2,87 мВ
В приведенной выше таблице показана серия электрохимических электродвижущих элементов (стандартный потенциал при 25 ° C)
В целом «Положительные» металлы – благородная противоположность «отрицательным» металлам.За исключением нескольких элементов, которые вы можете предсказать с помощью стандартного потенциала, их присутствие в земной коре. Благородные металлы обычно находятся в состоянии чистого металла, тогда как неблагородные металлы обычно находятся в виде соединений.
Исходя из изложенного выше, возможность окисления, а также восстановления является функцией стандартного потенциала. Следующие сильные окислители (будут восстановлены) имеют отрицательный стандартный потенциал, а сильные восстановители имеют высокое положительное значение.
Процессы электролиза трудно контролировать.Процесс гальванической коррозии обычно является нежелательной реакцией, вызывающей повреждение трубопроводов, рам и многих других металлических предметов. Процесс представляет собой преобразование техники электролиза, которая основана на разности потенциалов различных используемых металлов. Чтобы уменьшить повреждение, вы можете использовать, например, другой анод, который будет окисляться легче, чем материал. Также вы можете использовать блок удаления ионов.
ЭЛЕКТРОЛИЗ
Электролиз – это процесс, который происходит в электрохимической ячейке, когда электроны проходят от анода к катоду через внешнюю цепь, соединяющую электроды.Для этого должен существовать механизм переноса заряда в электролите между электродами. Этот перенос заряда происходит из-за движения ионов в электролите. Эти ионы, приближаясь к электродам, подвергаются электролизу и либо принимают электроны с катода, либо выпускают электроны на анод. Таким образом, химические изменения происходят на обоих электродах.
В соответствии с законами электролиза Фарадея степень химического изменения зависит от прошедшего заряда.Скорость химического изменения зависит от плотности тока j = I / S (Am -2 ) на электроде и определяется выражением;
(1)где n – число электронов в реакции электрода, а F – постоянная Фарадея . Скорость химического изменения и, следовательно, плотность тока определяется кинетикой электродной реакции (реакций).
В условиях электролиза ячейка работает вне своих равновесных (обратимых) потенциалов, определенных термодинамикой.Некоторые электродные реакции очень быстрые и очень мало отклоняются от равновесного потенциала. Такие реакции часто называют обратимыми (см. Рисунок 1). Другие электродные реакции по своей природе медленны и требуют потенциала E, значительно превышающего по величине равновесный потенциал для достижения разумной плотности тока. Этот потенциал называется перенапряжением , η (= E – E e ), а электрод называется поляризованным . Такие реакции называют необратимыми (рис. 2).По мере увеличения перенапряжения (более отрицательного для катодных процессов, более положительного для анодных) плотность тока увеличивается, обычно экспоненциально при высоких перенапряжениях. Связь между плотностью тока и потенциалом электрода является предметом кинетики электрода.
Рис. 1. Кривая потенциала тока на поляризованном электроде.
Рис. 2. Электролиз раствора NaCl с образованием хлора и гидроксида натрия. Другие примеры электролиза или, более конкретно, «реакции полуэлементов» включают:
Простой перенос электрона, e.г., анодное окисление ионов Ce (TO)
Осаждение металла, например никелирование
Преобразование поверхностной пленки, например, в свинцово-кислотных аккумуляторах
Анодное растворение, например, железа
Восстановление газа, например, кислород в пористых газодиффузионных электродах, используемых в топливных элементах
На практике существует большое разнообразие электрохимических элементов: батареи, в которых электрическая энергия вырабатывается в результате электродных реакций, электролитические ячейки, в которых химические изменения происходят из приложенного потенциала, и топливные элементы, в которых электрическая энергия непрерывно вырабатывается за счет подачи топливо.Электролиз может включать в себя различные типы процессов, включая реакции в жидкой фазе, реакции в твердой фазе, расположенной на поверхности электродов, и реакции с участием газовой фазы. Важным примером газофазных процессов является электролитическое образование газа, например,
(2) (3) (4)Анодное производство хлора и катодное образование H 2 и, следовательно, гидроксид-иона, является основой для хлорщелочной промышленности , использующей электролит хлорида натрия.Для этого процесса анодная и катодная реакции в ячейках разделены диафрагмой или мембраной для предотвращения реакции газообразного хлора с гидроксидом (натрия). Этот метод разделения анодной и катодной реакций во время электролиза является обычным. Соответствующий сепаратор по необходимости должен обеспечивать транспортировку подходящих ионов через его структуру. При электролизе хлорида натрия для производства хлора сепаратор в идеале должен обеспечивать транспортировку одного иона натрия, как показано на рисунке 2, для образования гидроксида натрия с гидроксид-ионом, генерируемым на катоде (реакция 3).
Во всех ячейках электролиз включает реакции на обоих электродах, и общее движение ионов в растворах поддерживает нейтральность заряда электролита. Поэтому, как правило, процессы электролиза записываются как общие реакции двухэлектродных процессов, например, в хлорщелочном электролизе реакция
(5)представляет собой электролиз хлорида натрия в воде с образованием гидроксида натрия, газообразного хлора и водорода.
Для проведения электролиза требуется источник энергии для перемещения ионов в электролитах и преодоления перенапряжения на электродах.Эта энергия либо подается от внешнего источника питания, как в электролитических процессах (например, перезарядка свинцово-кислотных аккумуляторов), либо получается из доступной «химической» или свободной энергии реакции (например, разрядки аккумуляторов). Он по существу превращается в тепло в электролите и напрямую связан с внутренним сопротивлением ячейки R и приложенным током, то есть I 2 R (Джоуля с -1 ).
При электролизе эта потребность в энергии может быть уменьшена за счет факторов, которые снижают внутреннее сопротивление (небольшое расстояние между электродами, высокая проводимость электролита) и которые уменьшают перенапряжение, например.например, с использованием электрокатализаторов или альтернативных электродных материалов. Электрокатализаторы обеспечивают альтернативные пути реакции для изначально кинетической медленной стадии электродного процесса и позволяют проводить реакцию при более высоких плотностях тока, близких к равновесному потенциалу. Многие электролизы выиграли от использования электрокатализаторов. Например, в 1960-х годах конструкция анодов хлорных элементов была революционизирована за счет использования покрытых титановых электродов (так называемые стабильные аноды , или DSA) в качестве замены углерода.Покрытие на основе оксида рутения, вентильных металлов, драгоценных металлов и переходных металлов позволило значительно снизить перенапряжение (<50 мВ для образования хлора). Такие материалы широко используются для многих промышленных электролизов.
Электроды, наиболее подходящие для разделения воды
Образование, Алоха и большинство
весело вы можете получить в отделке
№1 в мире по отделочным материалам с 1989 года
Вход в систему не требуется: звоните прямо сейчас
Текущие вопросы и ответы:
12 апреля 2021 г.В.
апрель 2021
А. Привет, Алекс. С нашей нынешней технологией водород является механизмом хранения энергии, а не источником энергии. Вне зависимости от того, подается ли водород в двигатель в виде сжатого газа, в виде каких-то кирпичей / губок или производится на борту путем электролиза, для его производства требуется больше энергии, чем восстанавливается при сгорании.
Но хотя не существует такой вещи, как бесплатная энергия, определенно есть такая вещь, как не тратить ее зря. Например, основная причина, по которой гибридные автомобили расходуют намного больше топлива, чем автомобили, работающие только на бензине, заключается в том, что энергия не тратится зря на торможение.Когда вы нажимаете педаль тормоза на гибриде, на самом деле происходит (кроме аварийной ситуации или ниже 2 миль в час) то, что двигатель / генераторы, подключенные к колесам, заряжают аккумулятор. Когда вам нужно ускориться, энергия, накопленная в батарее, преобразуется в механическую энергию двигателями / генераторами; когда вам нужно замедлить скорость, механическая энергия (импульс) преобразуется обратно в электрическую энергию, подзаряжающую аккумулятор.
Смысл этого обсуждения гибридов состоит в том, чтобы отметить, что двигатели / генераторы могут заряжать аккумулятор только путем преобразования количества движения в электричество.В то время как ваш генератор может свободно вращаться, когда он не подключен к аккумулятору и не заряжает его, единственный способ зарядить аккумулятор – это приложить механическую нагрузку к двигателю. К сожалению, всякий раз, когда от этого генератора берется электроэнергия, это происходит за счет механической энергии двигателя или инерции автомобиля.
Итак, по крайней мере теоретически, автомобиль с водородным двигателем мог бы генерировать водород в результате электролиза во время периода торможения так же, как современные гибриды … но он не может генерировать водород бесплатно – только замедляя автомобиль или требуя от двигателя увеличения мощности.
апрель 2021
А. Привет, Алекс. Нет никаких сомнений в том, что существуют виды топлива, которые производят больше энергии, чем бензин.
2002 г.
А.
2002 г.
A. Углерод, вероятно, плохой выбор, так как в нем много цинка и следы неприятных металлов. Я бы пошел в дешевый кухонный магазин и купил сетку из нержавеющей стали или даже разобрал ситечко. Хотя он и не так хорош, как 316, нержавеющая сталь 18-8 или 304 стоит дешево и очень доступно. Даже 316 испортится, если в воде будут хлориды, просто не так быстро. Удерживайте напряжение ниже 4 вольт, по возможности ниже. Помните, что большая площадь поверхности даст большую силу тока без разрушительного воздействия высокого напряжения, которое несколько ограничено максимальным количеством ампер, которое вы можете пропустить через него.
Чтобы свести к минимуму усилия по поиску и предложить несколько точек зрения, мы объединили ранее отдельные темы на этой странице. Пожалуйста, простите за любое последующее повторение, несоблюдение хронологического порядка или то, что может выглядеть как неуважение читателей к предыдущим ответам – этих других ответов, возможно, не было на странице в то время 🙂
2006 г.
В. Я хочу разделить воду с помощью электричества. Какие электроды подойдут лучше всего. Ванна должна всегда оставаться чистой.
2007 г.
A. Ответ зависит от того, чего вы хотите достичь.
Для простых экспериментальных целей нержавеющая сталь дешевая и практичная.
Если вы рассматриваете серьезное коммерческое применение, вы обнаружите, что большинство коммерческих электролизеров работают в щелочных условиях (КОН) и используют либо стальные электроды, либо никелированную сталь. Чтобы быть коммерчески жизнеспособным, требуется низкое рабочее напряжение, то есть низкое перенапряжение разряда. Существует много информации в журнале «Современные аспекты электрохимии» № 15 Эдральф Уайт и др., Опубликованном издательством Plenum Press.
2007 – добавлено в эту ветку редактором вместо создания дублирующей ветки
Q. Привет,
Я занимаюсь получением водорода путем электролиза воды. Я читал о платиновых электродах, необходимых для этого. Если бы вы могли указать мне правильное направление для покупки этих деталей, я был бы очень признателен. Я хочу начать с малого, может быть, достаточно, чтобы запустить генератор, а затем, возможно, достаточно большого, чтобы запустить машину. Я думал, что сетка даст мне больше области касания воды.
2007 г.
A. Есть много сайтов на тему питания автомобилей от воды / водорода, Рэнди. Может быть, попробовать ввести в поисковую систему «водород из воды»? Но шарлатанских сайтов столько, сколько и полезных сайтов. Самый простой способ определить разницу состоит в том, что шарлатанские сайты будут утверждать или подразумевать, что заговор нефтяных компаний, автомобильных компаний и правительства «мешает вам использовать этот бесплатный источник энергии», тогда как действующие сайты будут объяснять термодинамические принципы и что для получения водорода из воды требуется больше энергии, чем вы получите от сжигания водорода.
Палладий над серебром для электролизных электродов?
2 декабря 2016 г.В. Мы пытаемся установить пластину на пару небольших металлических электродов, которые должны выжить в среде соленой воды с приложенным напряжением между ними. Внешняя поверхность должна оставаться проводящей без образования непроводящего оксида или слоя. Мы тестировали медный электрод, который содержит 150 микрон никеля, затем 60 микрон золота, а затем 20 микрон родия. Подаваемое напряжение меньше вольта и пульсирует каждые 15 минут.
декабрь 2016
А. Привет, Алан. Вы можете поместить свои электроды в соленую воду с отключенным током на пару недель в качестве теста, потому что я не думаю, что проблема связана с гальванической коррозией, а скорее с снятием гальванического покрытия, вызванным приложенным напряжением.
Если электроды не должны пропускать сильный ток, вы можете попробовать покрытый платиной титан, потому что они не снимаются с пластины в большинстве условий. Если титан не может проводить ток, вам, вероятно, придется использовать медные электроды с платиновой пластиной, но электроосаждение платины непросто.
5 декабря 2016
В. Я считаю, что облицовка тяжелее, чем металлизация? Как наносится облицовка?
Мне нравится идея тестирования без подачи питания, и я попробую. Мощность мала и используется только для определения электропроводности морской воды, но тестирование без питания устранит переменную.
У нас есть еще одно требование, которое я не упомянул в своем первоначальном вопросе. Материал должен иметь довольно высокую теплопроводность, поэтому мы использовали медь и ищем серебро в качестве сердечника.
декабрь 2016
А. Привет, Алан. Для снятия металлической пластины не требуется большого напряжения, поэтому я думаю, что эксперимент окажется информативным.
«Облицовка» требует достаточно толстого покрытия, чтобы оно было полностью непористым и без отверстий даже после некоторой эрозии и коррозии. Некоторые типы облицовки выполняются путем автоклавирования пленки из одного материала на другой материал, а затем прокатки их до более тонких толщин.
Несколько лет назад я принимал непосредственное участие в установке линии гальваники на заводе-изготовителе анодов со стабильными размерами, поэтому я знаю, что плакированные аноды можно изготавливать гальваническим способом.
26 апреля 2019 г. – эта запись добавлена в эту цепочку редактором вместо создания дублирующейся цепочки.
В. Привет, я использую SS 202 в качестве пары электродов в электрическом паровом ингаляторе. Электроды разделены на пару миллиметров и подвешены в воде. Прохождение электрического тока создает искры и нагревает воду. Но материал размывается и становится коричневым, а также делает воду в емкости грязно-коричневой. Я тоже пробовал 304 и 316. Но все эти марки становятся коричневыми (похоже на коррозию).
18.05.2019 глупо 🙂
A. Hi Kishor,
Любой ток, наведенный в воде, приведет к образованию коричневой воды. Это зависит от качества воды и ее минерального состава.
Ионная детоксикация стоп использует этот фундаментальный трюк как хитрый прием, чтобы продать эту штуковину для детоксикации стоп.
Наблюдая за тем, как становится коричневой, вода становится коричневой, и при этом полагая, что он прошел детоксикацию (включая ваш покорный слуга).20 мая 2019
В.
мая 2019
А. Привет Кишор. Я думаю, что Хозеим пытался добродушно сообщить вам, что вода, становящаяся коричневой, является неотъемлемой частью вашей идеи электролиза соленой воды с растворенными в ней минералами, особенно с использованием электродов на основе железа. Когда вы подаете электричество к соленой воде, положительные электроды на основе железа (даже 316SS) растворяют железо в воде, образуя ржавую воду. Вы можете попробовать угольные электроды, предложенные Джо; Титановые электроды с платиновым покрытием тоже должны работать, но они очень дороги и, вероятно, недоступны для паровых ингаляторов.Но даже все же предупреждение Хозима может быть применимо, потому что по мере того, как вода отгоняется, любые загрязнители в воде становятся более концентрированными и обесцвечивают ее.
Я не знаком с другими регионами мира, но мы использовали паровые ингаляторы в США, когда я был ребенком более 60 лет назад (и, вероятно, до этого), поэтому есть десятки патентов с истекшим сроком действия, которые вы можете прочитать на тема на uspto.


