Электролиз, подготовка к ЕГЭ по химии
Электролиз (греч. elektron – янтарь + lysis — разложение) – химическая реакция, происходящая при прохождении постоянного тока через электролит. Это разложение веществ на их составные части под действием электрического тока.
Процесс электролиза заключается в перемещении катионов (положительно заряженных ионов) к катоду (заряжен отрицательно), и отрицательно заряженных ионов (анионов) к аноду (заряжен положительно).
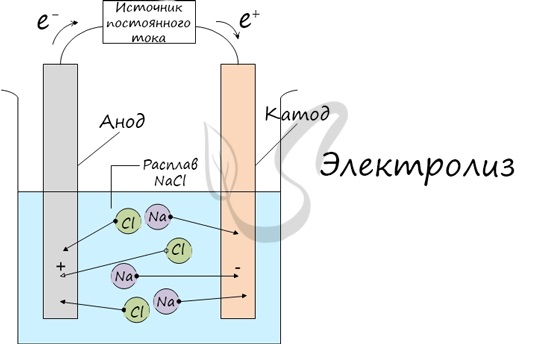
Итак, анионы и катионы устремляются соответственно к аноду и катоду. Здесь и происходит химическая реакция. Чтобы успешно решать задания по этой теме и писать реакции, необходимо разделять процессы на катоде и аноде. Именно так и будет построена эта статья.
Катод
Чтобы установить, какая реакция идет на катоде, прежде всего, нужно определиться с активностью металла: его положением в электрохимическом ряду напряжений металлов.
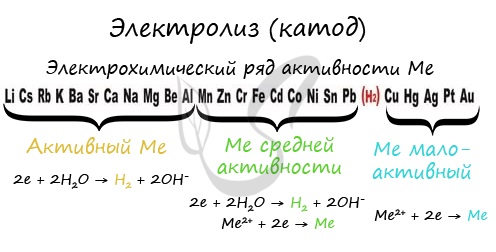
Если на катоде появился активный металл (Li, Na, K) то вместо него восстанавливаются молекулы воды, из которых выделяется водород. Если металл средней активности (Cr, Fe, Cd) – на катоде выделяется и водород, и сам металл. Малоактивные металлы выделяются на катоде в чистом виде (Cu, Ag).
Замечу, что границей между металлами активными и средней активности в ряду напряжений считается алюминий. При электролизе на катоде металлы до алюминия (включительно!) не восстанавливаются, вместо них восстанавливаются молекулы воды – выделяется водород.
В случае, если на катод поступают ионы водорода – H+ (например при электролизе кислот HCl, H2SO4) восстанавливается водород из молекул кислоты: 2H+ – 2e = H2
Анод
К аноду притягиваются анионы – отрицательно заряженные ионы: SO42-, PO43-, Cl–, Br–, I–, F–, S2-, CH3COO–.

При электролизе кислородсодержащих анионов: SO42-, PO43- – на аноде окисляются не анионы, а молекулы воды, из которых выделяется кислород.
Бескислородные анионы окисляются и выделяют соответствующие галогены. Сульфид-ион при оксилении окислении серу. Исключением является фтор – если он попадает анод, то разряжается молекула воды и выделяется кислород. Фтор – самый электроотрицательный элемент, поэтому и является исключением.
Анионы органических кислот окисляются особым образом: радикал, примыкающий к карбоксильной группе, удваивается, а сама карбоксильная группа (COO) превращается в углекислый газ – CO2.
Примеры решения
В процессе тренировки вам могут попадаться металлы, которые пропущены в ряду активности. На этапе обучения вы можете пользоваться расширенным рядом активности металлов.
Теперь вы точно будете знать, что выделяется на катоде ;-)
Итак, потренируемся. Выясним, что образуется на катоде и аноде при электролизе растворов AgCl, Cu(NO3)2, AlBr3, NaF, FeI2, CH3COOLi.
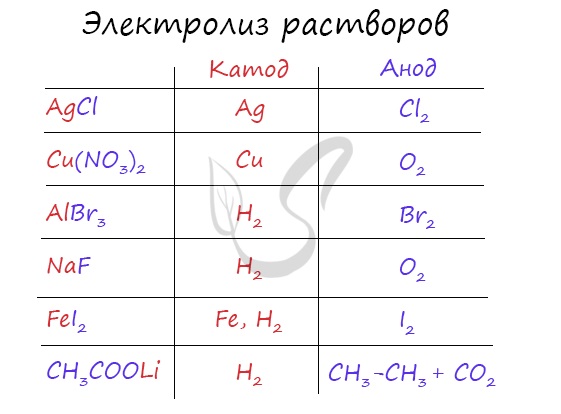
Иногда в заданиях требуется записать реакцию электролиза. Сообщаю: если вы понимаете, что образуется на катоде, а что на аноде, то написать реакцию не составляет никакого труда. Возьмем, например, электролиз NaCl и запишем реакцию:
NaCl + H2O → H2 + Cl2 + NaOH
Натрий – активный металл, поэтому на катоде выделяется водород. Анион не содержит кислорода, выделяется галоген – хлор. Мы пишем уравнение, так что не можем заставить натрий испариться бесследно 🙂 Натрий вступает в реакцию с водой, образуется NaOH.
Запишем реакцию электролиза для CuSO4:
CuSO4 + H2O → Cu + O2 + H2SO4
Медь относится к малоактивным металлам, поэтому сама в чистом виде выделяется на катоде. Анион кислородсодержащий, поэтому в реакции выделяется кислород. Сульфат-ион никуда не исчезает, он соединяется с водородом воды и превращается в серую кислоту.
Электролиз расплавов
Все, что мы обсуждали до этого момента, касалось электролиза растворов, где растворителем является вода.
Перед промышленной химией стоит важная задача – получить металлы (вещества) в чистом виде. Малоактивные металлы (Ag, Cu) можно легко получать методом электролиза растворов.
Но как быть с активными металлами: Na, K, Li? Ведь при электролизе их растворов они не выделяются на катоде в чистом виде, вместо них восстанавливаются молекулы воды и выделяется водород. Тут нам как раз пригодятся расплавы, которые не содержат воды.
В безводных расплавах реакции записываются еще проще: вещества распадаются на составные части:
AlCl3 → Al + Cl2
LiBr → Li + Br2
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к
Электролиз | CHEMEGE.RU
Химические реакции, сопровождающиеся переносом электронов (окислительно-восстановительные реакции) делятся на два типа: реакции, протекающие самопроизвольно и реакции, протекающие при прохождении тока через раствор или расплав электролита.
Раствор или расплав электролита помещают в специальную емкость — электролитическую ванну.
Электрический ток — это упорядоченное движение заряженных частиц — ионов, электронов и др. под действием внешнего электрического поля. Электрическое поле в растворе или расплаве электролита создают электроды.
Электроды — это, как правило, стержни из материала, проводящего электрический ток. Их помещают в раствор или расплав электролита, и подключают к электрической цепи с источником питания.
При этом отрицательно заряженный электрод катод — притягивает положительно заряженные ионы — катионы. Положительно заряженный электрод (анод) притягивает отрицательно заряженные частицы (анионы). Катод выступает в качестве восстановителя, а анод — в качестве окислителя.

Различают электролиз с активными и инертными электродами. Активные (растворимые) электроды подвергаются химическим превращениям в процессе электролиза. Обычно их изготавливают из меди, никеля и других металлов.
Электролиз растворов
Различают электролиз раствора или расплава химического вещества. В растворе присутствует дополнительное химическое вещество — вода, которая может принимать участие в окислительно-восстановительных реакциях.
Катодные процессы
В растворе солей катод притягивает катионы металлов. Катионы металлов могут выступать в качестве окислителей. Окислительные способности ионов металлов различаются. Для оценки окислительно-восстановительных способностей металлов применяют электро-химический ряд напряжений:

Также около катода находятся молекулы воды Н2О. В составе воды есть окислитель — ион H+.
При электролизе растворов солей на катоде наблюдаются следующие закономерности:
1. Если металл в соли — активный (до Al3+ включительно в ряду напряжений), то вместо металла на катоде восстанавливается (разряжается) водород, т.к. потенциал водорода намного больше. Протекает процесс восстановления молекулярного водорода из воды, при этом образуются ионы OH
2H2O +2ē → H2 + 2OH—
Например, при электролизе раствора хлорида натрия на катоде будет вос-станавливаться только водород из воды.
2. Если металл в соли – средней активности (между Al3+ и Н+), то на катоде восстанавливается (разряжается) и металл, и водород, так как потенциал таких металлов сравним с потенциалом водорода:
Men+ + nē → Me0
2H+2O +2ē → H20 + 2OH—
Например, при электролизе раствора сульфата железа (II) на катоде будет восстанавливаться (разряжаться) и железо, и водород:
Fe2+ + 2ē → Fe0
2H+2O +2ē → H20 + 2OH—
3. Если металл в соли — неактивный (после водорода в ряду стандартных электрохимических металлов), то ион такого металла является более сильным окислителем, чем ион водорода, и на катоде восстанавливается только металл:
Men+ + nē → Me0
Например, при электролизе раствора сульфата меди (II) на катоде будет восстанавливаться медь:
Cu2+ + 2ē → Cu0
4. Если на катод попадают катионы водорода H+, то они и восстанавливаются до молекулярного водорода:
2H+ + 2ē → H20
Анодные процессы
Положительно заряженный анод притягивает анионы и молекулы воды. Анод – окислитель. В качестве восстановителей выступаю либо анионы кислотных остаток, либо молекулы воды (за счет кислорода в степени окисления -2: H2O-2).
При электролизе растворов солей на аноде наблюдаются следующие закономерности:
1. Если на анод попадает бескислородный кислотный остаток, то он окисляется до свободного состояния (до степени окисления 0):
неМеn- – nē = неМе0
Например: при электролизе раствора хлорида натрия на аноде окисляют-ся хлорид-ионы:
2Cl— – 2ē = Cl20
Действительно, если вспомнить Периодический закон: при увеличении электроотрицательности неметалла его восстановительные свойства уменьшаются. А кислород – второй по величине электроотрицательности элемент. Таким образом, проще окислить практически любой неметалл, а не кислород. Правда, есть одно исключение. Наверное, вы уже догадались. Конечно же, это фтор. Ведь электроотрицательность фтора больше, чем у кислорода. Таким образом, при электролизе растворов фторидов окисляться будут именно молекулы воды, а не фторид-ионы:
2H2O-2 – 4ē → O20+ 4H+
2. Если на анод попадает кислородсодержащий кислотный остаток, либо фторид-ион, то окислению подвергается вода с выделением молекулярно-го кислорода:
2H2O-2 – 4ē → O20 + 4H+
3. Если на анод попадает гидроксид-ион, то он окисляется и происходит выделение молекулярного кислорода:
4O-2H– – 4ē → O20 + 2H2O
4. При электролизе растворов солей карбоновых кислот окислению под-вергается атом углерода карбоксильной группы, выделяется углекислый газ и соответствующий алкан.
Например, при электролизе растворов ацетатов выделяется углекислый газ и этан:
2CH3C+3OO– –2ē → 2C+4O2+ CH3-CH3
Суммарные процессы электролиза
Рассмотрим электролиз растворов различных солей.
Например, электролиз раствора сульфата меди. На катоде восстанавливаются ионы меди:
Катод (–): Cu2+ + 2ē → Cu0
На аноде окисляются молекулы воды:
Анод (+): 2H2O-2 – 4ē → O2 + 4H+
Сульфат-ионы в процессе не участвуют. Мы их запишем в итоговом уравнении с ионами водорода в виде серной кислоты:
2Cu2+SO4 + 2H2O-2 → 2Cu0 + 2H2SO4 + O20
Электролиз раствора хлорида натрия выглядит так:
На катоде восстанавливается водород:
Катод (–): 2H+2O +2ē → H20 + 2OH–
На аноде окисляются хлорид-ионы:
Анод (+): 2Cl– – 2ē → Cl20
Ионы натрия в процессе электролиза не участвуют. Мы записываем их с гидроксид-анионами в суммарном уравнении электролиза раствора хлорида натрия:
2H+2O +2NaCl– → H20 + 2NaOH + Cl20
Следующий пример: электролиз водного раствора карбоната калия.
На катоде восстанавливается водород из воды:
Катод (–): 2H+2O +2ē → H20 + 2OH–
На аноде окисляются молекулы воды до молекулярного кислорода:
Анод (+): 2H2O-2 – 4ē → O20 + 4H+
Таким образом, при электролизе раствора карбоната калия ионы калия и карбонат-ионы в процессе не участвуют. Происходит электролиз воды:
2H2+O-2 → 2H20 + O20
Еще один пример: электролиз водного раствора хлорида меди (II).
На катоде восстанавливается медь:
Катод (–): Cu2+ + 2ē → Cu0
На аноде окисляются хлорид-ионы до молекулярного хлора:
Анод (+): 2Cl– – 2ē → Cl20
Таким образом, при электролизе раствора карбоната калия происходит электролиз воды:
Cu2+Cl2– → Cu0 + Cl20
Еще несколько примеров: электролиз раствора гидроксида натрия.
На катоде восстанавливается водород из воды:
Катод (–): 2H+2O +2ē → H20 + 2OH–
На аноде окисляются гидроксид-ионы до молекулярного кислорода:
Анод (+): 4O-2H– – 4ē → O20 + 2H2O
Таким образом, при электролизе раствора гидроксида натрия происходит разложение воды, катионы натрия в процессе не участвуют:
2H2+O-2 → 2H20 + O20
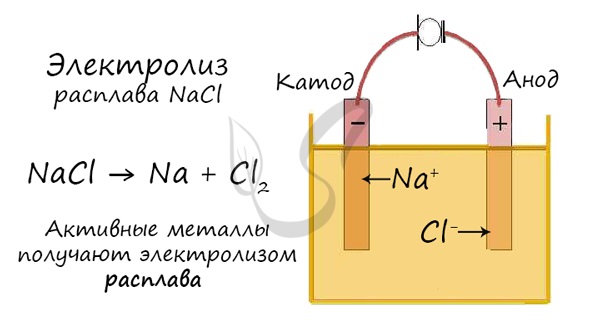
Электролиз расплавов
При электролизе расплава на аноде окисляются анионы кислотных остатков, а на катоде восстанавливаются катионы металлов. Молекул воды в системе нет.
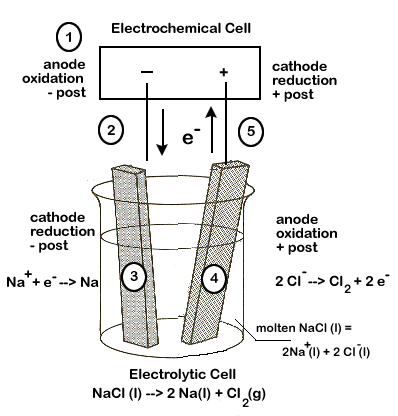
Например: электролиз расплава хлорида натрия. На катоде восстанавли-ваются катионы натрия:
Катод (–): Na+ + ē → Na0
На аноде окисляются анионы хлора:
Анод (+): 2Cl– – 2ē → Cl20
Суммарное уравнение электролиза расплава хлорида натрия:
2Na+Cl– → 2Na0 + Cl20

Еще один пример: электролиз расплава гидроксида натрия. На катоде восстанавливаются катионы натрия:
Катод (–): Na+ + ē → Na0
На аноде окисляются гидроксид-ионы:
Анод (+): 4OH– – 4ē → O20 + 2H2O
Суммарное уравнение электролиза расплава гидроксида натрия:
4Na+OH– → 4Na0 + O20 + 2H2O
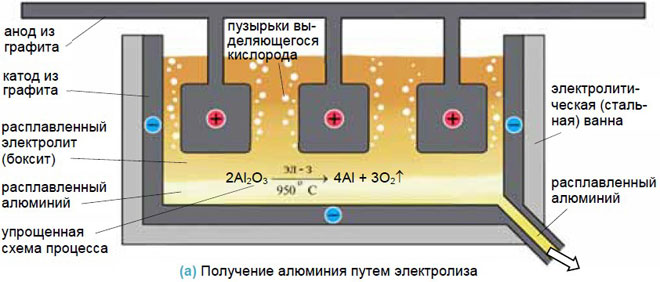
Многие металлы получают в промышленности электролизом расплавов.
Например, алюминий получают электролизом раствора оксида алюминия в расплаве криолита. Криолит – Na3[AlF6] плавится при более низкой температуре (1100оС), чем оксид алюминия (2050оС). А оксид алюминия отлично растворяется в расплавленном криолите.
В растворе криолите оксид алюминия диссоциирует на ионы:
Al2O3 = Al3+ + AlO33-
На катоде восстанавливаются катионы алюминия:
Катод (–): Al3+ + 3ē → Al0
На аноде окисляются алюминат-ионы:
Анод (+): 4AlO33– – 12ē → 2Al2O3 + 3O20
Общее уравнение электролиза раствора оксида алюминия в расплаве криолита:
2Al2О3 = 4Al0 + 3О20

В промышленности при электролизе оксида алюминия в качестве электродов используют графитовые стержни. При этом электроды частично окисляются (сгорают) в выделяющемся кислороде:
C0 + О20 = C+4O2-2
Электролиз с растворимыми электродами
Если материал электродов выполнен из того же металла, который присут-ствует в растворе в виде соли, или из более активного металла, то на аноде разряжаются не молекулы воды или анионы, а окисляются частицы самого металла в составе электрода.
Например, рассмотрим электролиз раствора сульфата меди (II) с медными электродами.
На катоде разряжаются ионы меди из раствора:
Катод (–): Cu2+ + 2ē → Cu0
На аноде окисляются частицы меди из электрода:
Анод (+): Cu0 – 2ē → Cu2+
Вопрос о том, что такое электролиз, рассматривается еще в школьном курсе физике, и для большинства людей не является секретом. Другое дело – его важность и практическое применение. Этот процесс с большой пользой используется в различных отраслях и может пригодиться для домашнего мастера.

Что такое электролиз?
Электролиз представляет собой комплекс специфических процессов в системе электродов и электролита при протекании по ней постоянного электрического тока. Его механизм основывается на возникновении ионного тока. Электролит – это проводник 2-го типа (ионная проводимость), в котором происходит электролитическая диссоциация. Она связана с разложением на ионы с положительным (катион) и отрицательным (анион) зарядом.
Электролизная система обязательно содержит положительный (анод) и отрицательный (катод) электрод. При подаче постоянного электрического тока катионы начинают двигаться к катоду, а анионы – к аноду. Катионами в основном являются ионы металлов и водород, а анионами – кислород, хлор. На катоде катионы присоединяют к себе избыточные электроны, что обеспечивает протекание восстановительной реакции Men+ + ne → Me (где n – валентность металла). На аноде, наоборот, электрон отдается из аниона с протеканием окислительной реакции.
Таким образом, в системе обеспечивается окислительно-восстановительный процесс. Важно учитывать, что для его протекания необходима соответствующая энергия. Ее должен обеспечить внешний источник тока.
Законы электролиза Фарадея
Великий физик М.Фарадей своими исследованиями позволил не только понять природу электролиза, но и производить необходимые расчеты для его осуществления. В 1832 г. появились его законы, связавшие основные параметры происходящих процессов.
Первый закон
Первый закон Фарадея гласит, что масса восстанавливающегося на аноде вещества прямо пропорциональна электрическому заряду, наведенному в электролите: m = kq = k*I*t, где q — заряд, k – коэффициент или электрохимический эквивалент вещества, I – сила тока, протекающего через электролит, t – время прохождения тока.


Второй закон
Второй закон Фарадея позволил определить коэффициент пропорциональности k. Он звучит следующим образом: электрохимический эквивалент любого вещества прямо пропорционален его молярной массе и обратно пропорционален валентности. Закон выражается в виде:


k = 1/F*A/z, где F – постоянная Фарадея, А- молярная масса вещества, z – его химическая валентность.
С учетом обоих законов можно вывести окончательную формулу для расчета массы, оседающего на электроде вещества: m = A*I*t/(n*F), где n – количество электронов, участвующих в электролизе. Обычно n соответствует заряду иона. С практической точки зрения важна связь массы вещества с подаваемым током, что позволяет контролировать процесс, изменяя его силу.
Электролиз расплавов
Один из вариантов электролиза – использование в качестве электролита расплав. В этом случае в электролизном процессе участвуют только ионы расплава. В качестве классического примера можно привести электролиз солевого расплава NaCl (поваренная соль). К аноду устремляются отрицательные ионы, а значит, выделяется газ (Cl). На катоде будет происходить восстановление металла, т.е. оседание чистого Na, образующегося из положительных ионов, притянувших избыточные электроны. Аналогично можно получать другие металлы (К, Са, Li и т.д.) из расправа соответствующих солей.

При электролизе в расплаве электроды не подвергаются растворению, а участвуют только в качестве источника тока. При их изготовлении можно использовать металл, графит, некоторые полупроводники. Важно, чтобы материал имел достаточную проводимость. Один из наиболее распространенных материалов – медь.
Особенности электролиза в растворах
Электролиз в водном растворе существенно отличается от расплава. Здесь имеют место 3 конкурирующих процесса: окисление воды с выделением кислорода, окисление аниона и анодное растворение металла. В процессе задействованы ионы воды, электролита и анода. Соответственно, на катоде может происходить восстановление водорода, катионов электролита и металла анода.
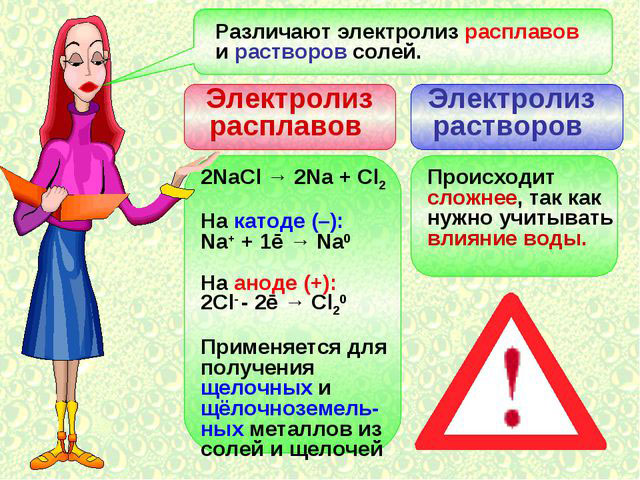

Возможность протекания указанных конкурирующих процессов зависит от величины электрических потенциалов системы. Протекать будет только тот процесс, который требует меньше внешней энергии. Следовательно, на катоде будут восстанавливаться катионы, имеющие максимальный электродный потенциал, а на аноде – окисляться анионы с наименьшим потенциалом. Электродный потенциал водорода принят за «0». Для примера, у калия он равен (-2,93 В), натрия – (-2,71 В), свинца (-0,13 В), а у серебра – (+0,8 В).
Электролиз в газах
Газ может исполнить роль электролита только при наличии ионизатора. В этом случае ток, проходя через ионизированную среду, вызывает необходимый процесс на электродах. При этом законы Фарадея не распространяются на газовый электролиз. Для его осуществления необходимы такие условия:
- Без искусственной ионизации газа не поможет ни высокое напряжение, ни большой ток.
- Для электролиза подходят лишь кислоты, не содержащие кислорода и находящиеся в газообразном состоянии, и некоторые газы.
Важно! При выполнении необходимых условий процесс протекает аналогично электролизу в жидком электролите.
Особенности процессов, происходящих на катоде и аноде
Для практического применения электролиза важно понимать, что происходит на обоих электродах при подаче электрического тока. Характерны такие процессы:
- Катод. К нему устремляются положительно заряженные ионы. Здесь происходит восстановление металлов или выделение водорода. Можно выделить несколько категорий металлов по катионной активности. Такие металлы, как Li, K, Ba, St, Ca, Na, Mg, Be, Al, хорошо восстанавливаются только из расплава солей. Если используется раствор, то выделяется водород за счет электролиза воды. Можно обеспечить восстановление в растворе, но при достаточной концентрации катионов, у следующих металлов — Mn, Cr, Zn, Fe, Cd, Ni, Ti, Co, Mo, Sn, Pb. Процесс протекает наиболее легко для Ag, Cu, Bi, Pt, Au, Hg.
- Анод. К этому электроду поступают отрицательно заряженные ионы. Окисляясь, они отбирают электроны у металла, что приводит к их анодному растворению, т.е. переходу в положительно заряженные ионы, которые направляются к катоду. Анионы также подразделяются по своей активности. Только из расплавов могут разряжаться такие анионы PO4, CO3, SO4, NO3, NO2, ClO4, F. В водных растворах электролизу подвергаются не они, а вода с выделением кислорода. Наиболее легко реагируют такие анионы, как ОН, Cl, I, S, Br.
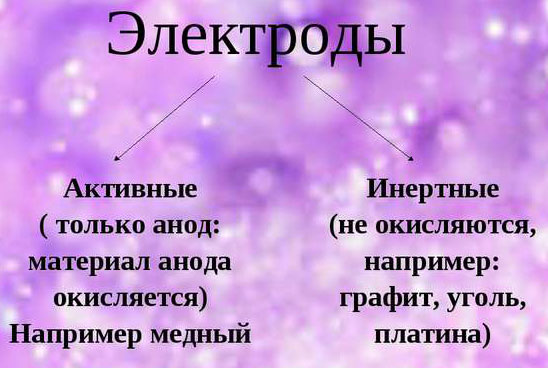

При обеспечении электролиза важно учитывать склонность материала электродов к окислению. В этом отношении выделяются инертные и активные аноды. Инертные электроды делаются из графита, угля или платины и не участвуют в снабжении ионами.
Факторы, влияющие на процесс электролиза
Процесс электролиза зависит от следующих факторов:
- Состав электролита. Значительное влияние оказывают различные примеси. Они подразделяются на 3 типа – катионы, анионы и органика. Вещества могут быть более или менее отрицательными, чем основной металл, что и мешает процессу. Среди органических примесей выделяются загрязнители (например масла) и ПАВ. Их концентрация имеет предельно допустимые значения.
- Плотность тока. В соответствии с законами Фарадея, масса осаждаемого вещества увеличивается с увеличением силы тока. Однако возникают неблагоприятные обстоятельства – концентрированная поляризация, повышенное напряжение, интенсивный разогрев электролита. С учетом этого существуют оптимальные значения плотности тока для каждого конкретного случая.
- рН электролита. Кислотность среды также выбирается с учетом металлов. Например оптимальное значение кислотности электролита для цинка – 140 г/куб.дм.
- Температура электролита. Она влияет неоднозначно. С увеличением температуры растет скорость электролиза, но повышается и активность примесей. Для каждого процесса есть оптимальная температура. Обычно она находится в пределах 38-45 градусов.
Важно! Электролиз можно ускорить или замедлить путем различных воздействий и выбора состава электролита. Для каждого варианта применения существует свой режим, который следует строго соблюдать.
Где применяется электролиз?
Электролиз применяется во многих сферах. Можно выделить несколько основных направлений использования для получения практических результатов.
Гальваническое покрытие
Тонкое, прочное гальваническое покрытие из металла можно наложить путем электролиза. Покрываемое изделие устанавливается в ванну в виде катода, а электролит содержит соль нужного металла. Так можно покрыть сталь цинком, хромом или оловом.


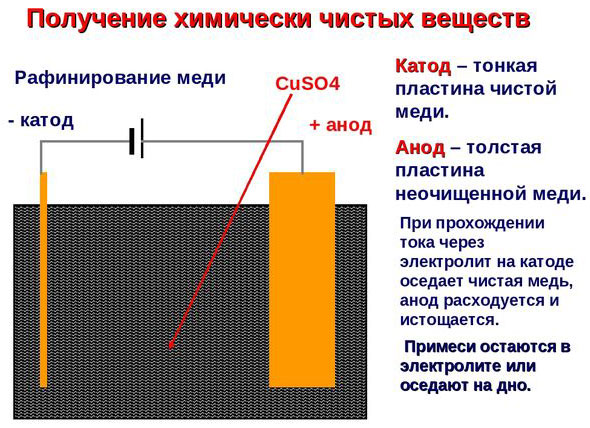
Электроочистка — рафинирование меди
Примером электроочистки может служить такой вариант: катод – чистая медь, анод – медь с примесями, электролит – водный раствор медного сульфата. Медь из анода переходит в ионы и оседает в катоде уже без примесей.

Добыча металлов
Для получения металлов из солей они переводятся в расплав, а затем обеспечивается электролиз в нем. Достаточно эффективен такой способ для получения алюминия из бокситов, натрия и калия.

Анодирование
При этом процессе покрытие выполняется из неметаллических соединений. Классический пример – анодирование алюминия. Алюминиевая деталь устанавливается, как анод. Электролит – раствор серной кислоты. В результате электролиза на аноде оседает слой из оксида алюминия, обладающего защитными и декоративными свойствами. Указанные технологии широко используются в различных отраслях промышленности. Можно осуществить процессы и своими руками с соблюдением техники безопасности.
Энергетические затраты
Электролиз требует больших энергетических затрат. Процесс будет иметь практическую ценность при достаточной величине анодного тока, а для этого необходимо приложить значительный постоянный ток от источника электроэнергии. Кроме того, при его проведении возникают побочные потери напряжения – анодное и катодное перенапряжение, потери в электролите за счет его сопротивления. Эффективность работы установки определяется путем отнесения мощности энергозатрат к единице полезной массы полученного вещества.
Электролиз давно и с высокой эффективностью используется в промышленности. Анодированные и гальванические покрытия стали обычным явлением в повседневной жизни, а добыча и обогащение материалов помогает добывать многие металлы из руды. Процесс можно запланировать и рассчитать, зная основные его закономерности.
Огромной популярностью в металлургии и химической промышленности имеет такой физико-химический процесс, как электролиз, происходящий с помощью электролизера. Чтобы понять принцип его действия, нужно изучить определение, нюансы и особенности явления.
Понятие электролиза
Электролиз – процесс, который возникает при воздействии электрического тока на электролит и заключается в выделении электродами составных частей.
Значение явления заключается в том, что путём воздействия электричества на ионы можно организовывать новые формы, структуры или даже сами вещества. Это позволяет человеку контролировать некоторые процессы, протекающие на молекулярном уровне. Законы данного явления в химии и физике открыл английский учёный Фарадей.
Явление происходит при участии электродов, которые делятся на катод и анод:
-
катод – электрод с отрицательным зарядом, на котором происходит восстановление катионов;
-
анод – электрод с положительным зарядом, где происходит окисление анионов.
Приборы чаще всего изготавливаются из материалов, пропускающих электрический ток, например, из графита или большинства металлов. Оба прибора подключаются к отрицательному и положительному полюсам соответственно.
Явление происходит в следующем порядке:
-
Диссоциация.
-
Электролиз.
Очень важно не путать такие близкие определения, как гидролиз и электролиз. Первым явлением считается разложение раствора вещества на ионы (заряженные частицы) в воде.
Первый закон Фарадея
Установленный Фарадеем первый закон говорит о прямой пропорциональности между массой вещества, выделившейся в ходе электролиза, и величиной заряда, который прошел через электролит.
Правило подкреплено формулой m = k * q, то есть произведение заряда вещества на его электрохимический эквивалент, что равняется его массе.
Проверка первого закона Фарадея происходит следующим образом:
-
нужно взять три любых электролита, например, А, Б и В и пропустить ток через каждый;
-
если вещества одни и те же, то массы выделившихся можно назвать Г, Г1 и Г2;
-
при этом будет верным следующее равенство: Г= Г1+Г2.
Второй закон Фарадея
Данное правило, установленное Фарадеем, указывает на зависимость между атомной массой вещества, количеством возможных химических связей и самим электрохимическим эквивалентом.
Таким образом, электрохимический эквивалент прямо пропорционален атомной массе вещества, но валентности вещества он обратно пропорционален.
Таблица изменения веществ с помощью электролиза
Усиление восстановительных способностей веществ:
|
Na+ |
Mg2+ |
Al3+ |
Zn2+ |
Fe3+ |
Ni2+ |
Sn2+ |
Pb2+ |
H+ |
Cu2 |
Ag+ |
|
Натрий |
Магний |
Алюминий |
Цинк |
Железо |
Никель |
Олово |
Свинец |
Водород |
Медь |
Серебро |
Усиление окислительных способностей веществ:
|
I- |
Br- |
Cl- |
OH- |
NO3- |
CO32- |
SO42-. |
|
Йодид (соли, образованные йодоводородной кислотой) |
Бромид (соли, образованные бромоводородной кислотой) |
Хлорид (соли, образованные соляной кислотой) |
Гидроксид |
Нитрат (соли, образованные азотной кислотой) |
Карбонат (соли, образованные угольной кислотой) |
Сульфат (соли, образованные серной кислотой) |
|
Катод (отрицательный) |
Анод (положительный) |
|
Восстановление катионов после водорода |
Окисление анионов кислот, не содержащих кислорода |
|
Восстановление катионов, имеющих среднюю активность |
Окисление анионов оксокислот |
|
Восстановление наиболее активных катионов |
Окисление анионов гидроксидов |
|
Восстановление катионов водорода |
|
Уравнения и схемы процессов электролиза, протекающих на катоде и аноде
Электролиз воды
Вода является слабым электролитом, из-за чего процесс будет протекать очень медленно.
Общее уравнение реакции: 2H2O => 2H2 + O2.
Схема водного электролиза:
|
Анод |
Катод |
|
2H2O => O2 + 4H+ + 4e– |
4H+ + 4e– => 2H2 |
|
3H2O => O3 + 6e– + 6H+ |
O2 + 2H2O + 2e– => H2O2 + 2OH– |
Электролиз расплавов солей
Данную разновидность реакции можно рассмотреть на примере расплава гидроксида натрия, то есть NaOH.
|
Диссоциация гидроксида |
NaOH => Na+ + OH- |
|
Окислительный и восстановительный процессы |
4OH- – 4ē => 2H2O + O2↑ (окисление) Na+ + 1ē => Na0 (восстановление) |
|
Электролиз |
4NaOH => 4Na + 2H2O + O2↑ |
Электролиз растворов солей
Явление можно рассмотреть на примере поваренной соли, имеющей формулу NaCl.
Схема с использованием инертных электродов:
|
Диссоциация соли |
NaCl => Na+ + Cl- |
|
Окислительный и восстановительный процессы |
2Cl- – 2ē => Cl2↑ 2H2O + 2ē => H2↑ + 2OH-. |
|
Электролиз |
2NaCl + 2H2O => H2↑ + Cl2↑ + 2NaOH. |
Таким образом, продуктом химической реакции было получение гидроксид натрия.
Также следует отметить такую особенность солей карбоновых кислот, как их способность к декарбоксилированию, как например реакция с ацетатом калия:
2CH3COOK + 2H2O => H2+ 2KOH + CH3-CH3 + 2CO2.
Электролиз веществ – одна из важнейших тем при изучении химии как неорганической, так и органической. Нужно научиться решать подобные задачи для полного понимания химических процессов и метаморфозов веществ.
ЕГЭ. Электролиз растворов. Примеры
Электролиз растворов электролитов с инертными электродами
Напомним, что на катоде протекают процессы восстановления, на аноде – процессы окисления.
Процессы, протекающие на катоде:
В растворе имеются несколько видов положительно заряженных частиц, способных восстанавливаться на катоде:
1) Катионы металла восстанавливаются до простого вещества, если металл находится в ряду напряжений правее алюминия (не включая сам Al). Например:
Zn2+ +2e → Zn0.
2) В случае раствора соли или щелочи: катионы водорода восстанавливаются до простого вещества, если металл находится в ряду напряжений металлов до H2:
2H2O + 2e → H20 + 2OH–.
Например, в случае электролиза растворов NaNO3 или KOH.
3) В случае электролиза раствора кислоты: катионы водорода восстанавливаются до простого вещества:
2H+ +2e → H2.
Например, в случае электролиза раствора H2SO4.
Процессы, протекающие на аноде:
На аноде легко окисляются кислотные остатки не содержащие кислород. Например, галогенид-ионы (кроме F–), сульфид-анионы, гидроксид-анионы и молекулы воды:
1) Галогенид-анионы окисляются до простых веществ:
2Cl– – 2e → Cl2.
2) В случае электролиза раствора щелочи в гидроксид-анионах кислород окисляется до простого вещества. Водород уже имеет степень окисления +1 и не может быть окислен дальше. Также будет выделение воды – почему? Потому что больше ничего написать и не получится: 1) H+ написать не можем, так как OH– и H+ не могут стоять по разные стороны одного уравнения; 2) H2 написать также не можем, так как это был бы процесс восстановления водорода (2H+ +2e → H2), а на аноде протекают только процессы окисления.
4OH– – 4e → O2 + 2H2O.
3) Если в растворе есть анионы фтора или любые кислородсодержащие анионы, то окислению будет подвергаться вода с подкислением прианодного пространства согласно следующему уравнению:
2H2O – 4e → O2 + 4H+.
Такая реакция идет в случае электролиза растворов кислородсодержащих солей или кислородсодержащих кислот. В случае электролиза раствора щелочи окисляться будут гидроксид-анионы согласно правилу 2) выше.
4) В случае электролиза раствора соли органической кислоты на аноде всегда происходит выделение CO2 и удвоение остатка углеродной цепи:
2R-COO– – 2e → R-R + 2CO2.
Примеры:
1. Раствор NaCl
Расписываем диссоциацию на ионы:
NaCl → Na+ + Cl–
Металл Na стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу выше, на катоде восстанавливается водород. Хлорид-анионы будут окисляться на аноде до простого вещества:
К: 2Na+ (в растворе)
2H2O + 2e → H20 + 2OH–
А: 2Cl– – 2e → Cl2
Коэффициент 2 перед Na+ появился из-за наличия аналогичного коэффициента перед хлорид-ионами, так как в соли NaCl их соотношение 1:1.
Проверяем, что количество принимаемых и отдаваемых электронов одинаковое, и суммируем левые и правые части катодных и анодных процессов:
2Na+ + 2Cl– + 2H2O → H20 + 2Na+ + 2OH– + Cl2. Соединяем катионы и анионы:
2NaCl + 2H2O → H20 + 2NaOH + Cl2.
2. Раствор Na2SO4
Расписываем диссоциацию на ионы:
Na2SO4 → 2Na+ + SO42–
Натрий стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу выше, на катоде восстанавливается только водород. Сульфат-анионы содержат кислород, поэтому окисляться не будут, также оставаясь в растворе. Согласно правилу выше, в этом случае окисляются молекулы воды:
К: 2H2O + 2e → H20 + 2OH–
А: 2H2O – 4e → O20 + 4H+.
Уравниваем число принимаемых и отдаваемых электронов на катоде и аноде. Для этого необходимо умножить все коэффициенты катодного процесса на 2:
К: 4H2O + 4e → 2H20 + 4OH–
А: 2H2O – 4e → O20 + 4H+.
Складываем левые и правые части катодных и анодных процессов:
6H2O → 2H20 + 4OH– + 4H+ + O20.
4OH- и 4H+ соединяем в 4 молекулы H2O:
6H2O → 2H20 + 4H2O + O20.
Сокращаем молекулы воды, находящиеся по обе стороны уравнения, т.е. вычитаем из каждой части уравнения 4H2O и получаем итоговое уравнение гидролиза:
2H2O → 2H20 + O20.
Таким образом, гидролиз растворов кислородсодержащих солей активных металлов (до Al включительно) сводится к гидролизу воды, так как ни катионы металлов, ни анионы кислотных остатков не принимают участие в окислительно-восстановительных процессах, протекающих на электродах.
3. Раствор CuCl2
Расписываем диссоциацию на ионы:
CuCl2 → Cu2+ + 2Cl–
Медь находится в ряду напряжений металлов после водорода, следовательно, только она будет восстанавливаться на катоде. На аноде будут окисляться только хлорид-а
Электролиз – это… Что такое Электролиз?
Электро́лиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор либо расплав электролита.
Упорядоченное движение ионов в проводящих жидкостях происходит в электрическом поле, которое создается электродами — проводниками, соединёнными с полюсами источника электрической энергии. Анодом при электролизе называется положительный электрод, катодом — отрицательный[1]. Положительные ионы — катионы — (ионы металлов, водородные ионы, ионы аммония и др.) — движутся к катоду, отрицательные ионы — анионы — (ионы кислотных остатков и гидроксильной группы) — движутся к аноду.
Явление электролиза широко применяется в современной промышленности. В частности, электролиз является одним из способов промышленного получения алюминия, водорода, а также гидроксида натрия, хлора, хлорорганических соединений[источник не указан 1318 дней], диоксида марганца[2], пероксида водорода. Большое количество металлов извлекаются из руд и подвергаются переработке с помощью электролиза (электроэкстракция, электрорафинирование). Также, электролиз является основным процессом, благодаря которому функционирует химический источник тока.
Электролиз находит применение в очистке сточных вод (процессы электрокоагуляции, электроэкстракции, электрофлотации).
Первый закон Фарадея
В 1832 году Фарадей установил, что масса m вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду q, прошедшему через электролит:
если через электролит пропускается в течение времени t постоянный ток с силой тока I. Коэффициент пропорциональности называется электрохимическим эквивалентом вещества. Он численно равен массе вещества, выделившегося при прохождении через электролит единичного электрического заряда, и зависит от химической природы вещества.
Вывод закона Фарадея
- (1)
- (2)
- (3)
- (4)
- , где z — валентность атома (иона) вещества, e — заряд электрона (5)
Подставляя (2)-(5) в (1), получим
где — постоянная Фарадея.
Второй закон Фарадея
Электрохимические эквиваленты различных веществ относятся, как их химические эквиваленты.
Химическим эквивалентом иона называется отношение молярной массы A иона к его валентности z. Поэтому электрохимический эквивалент
где — постоянная Фарадея.
Второй закон Фарадея записывается в следующем виде:
где — молярная масса данного вещества, образовавшегося (однако не обязательно выделившегося — оно могло и вступить в какую-либо реакцию сразу после образования) в результате электролиза, г/моль; — сила тока, пропущенного через вещество или смесь веществ (раствор, расплав), А; — время, в течение которого проводился электролиз, с; — постоянная Фарадея, Кл·моль−1; — число участвующих в процессе электронов, которое при достаточно больших значениях силы тока равно абсолютной величине заряда иона (и его противоиона), принявшего непосредственное участие в электролизе (окисленного или восстановленного). Однако это не всегда так; например, при электролизе раствора соли меди(II) может образовываться не только свободная медь, но и ионы меди(I) (при небольшой силе тока).
Изменение электролизом веществ
Не все вещества будут электролизироваться при пропускании электрического тока. Существуют некоторые закономерности и правила.
| Катионы активных металлов | Катионы менее активных металлов | Катионы неактивных металлов |
|---|---|---|
| Li+, Cs+, Rb+, K+, Ba2+, Sr2+, Ca2+, Na+, Mg2+, Be2+, Al3+ | Mn2+, Cr3+, Zn2+, Ga3+, Fe2+, Cd2+, In3+, Tl+, Co2+, Ni2+, Mo4+, Sn2+, Pb2+ | Bi3+, Cu2+, Ag+, Hg2+, Pd3+, Pt2+, Au3+ |
| Тяжело разряжаются (только из расплавов), в водном растворе электролизу подвергается вода с выделением водорода | В водном растворе восстанавливается металл (при малой концентрации катионов в растворе — металл и водород) | Легко разряжаются и восстанавливается только металл |
| Анионы кислородсодержащих кислот и фторид-ион | Гидроксид-ионы; анионы бескислородных кислот (кроме F−) |
|---|---|
| PO43−, CO32−, SO42−, NO3−, NO2−, ClO4−, F− | OH−, Cl−, Br−, I−, S2− |
| Тяжело разряжаются (только из расплавов), в водном растворе электролизу подвергается вода с выделением кислорода | Легко разряжаются |
Примеры
Расплавы
1) Активные металлы
1.Соль активного металла и бескислородной кислоты
NaCl ↔ Na+ + Cl−
K”катод”(-): Na+ + 1e = Na0
A”анод”(+): Cl− — 1e = Cl0; Cl0+Cl0=Cl2
Вывод: 2NaCl → (электролиз) 2Na + Cl2
2.Соль активного металла и кислородосодержащей кислоты
Na2SO4↔2Na++SO42−
K(-): 2Na+ +2e =2Na0
A(+): 2SO42− −4e =2SO3+O2
Вывод: 2Na2SO4 → (электролиз) 4Na + 2SO3 + O2
3. Гидроксид: активный металл и гидроксид-ион
NaOH ↔ Na+ + OH−
K(-): Na+ +1e =Na0
A(+): 4OH− −4e =2H2O + O2
Вывод: 4NaOH → (электролиз) 4Na + 2H2O + O2
2) Менее активные металлы
Точно так же
3) Неактивные металлы
Точно так же
Растворы
1) Активные металлы
1.Соль активного металла и бескислородной кислоты
NaCl ↔ Na+ + Cl−
K”катод”(-): 2H2O + 2e = H2 + 2OH−
A”анод”(+): Cl− — 1e = Cl0; Cl0+Cl0=Cl2
Вывод: 2NaCl + 2H2O(электролиз) → H2 + Cl2 +2NaOH
2.Соль активного металла и кислородсодержащей кислоты
Na2SO4↔2Na++SO42−
K(-): 2H2O + 2e = H2 + 2OH−
A(+): 2H2O — 4e = O2 + 4H+
Вывод: 2H2O (электролиз) → 2H2 + O2
3. Гидроксид: активный металл и гидроксид-ион
NaOH ↔ Na+ + OH−
K(-): 2H2O + 2e = H2 + 2OH−
A(+): 2H2O — 4e = O2 + 4Н+
Вывод: 2H2O (электролиз) → 2H2 + O2
2) Менее активные металлы
1.Соль менее активного металла и бескислородной кислоты
ZnCl2 ↔ Zn2+ + 2Cl−
K”катод”(-): Zn2+ + 2e = Zn0
A”анод”(+): 2Cl− — 2e = 2Cl0
Вывод: ZnCl2 (электролиз) → Zn + Cl2
2.Соль менее активного металла и кислородсодержащей кислоты
ZnSO4 ↔ Zn2++SO42−
K(-): Zn2+ + 2e = Zn0
A(+): 2H2O — 4e = O2 + 4Н+
Вывод: 2ZnSO4 + 2H2O(электролиз) → 2Zn + 2H2SO4 + O2
3. Гидроксид: невозможно (нерастворим)
3) Неактивные металлы
Точно так же
Мнемоническое правило
Для запоминания катодных и анодных процессов в электрохимии существует следующее мнемоническое правило:
- У анода анионы окисляются.
- На катоде катионы восстанавливаются.
В первой строке все слова начинаются с гласной буквы, во второй — с согласной.
Или проще:
- КАТод — КАТионы (ионы у катода)
- АНод — АНионы (ионы у анода)
Электролиз в газах
 | В этом разделе не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники. Эта отметка установлена 11 мая 2011. |
Электролиз в газах, при наличии ионизатора, объясняется тем, что при прохождении через них постоянного электрического тока, наблюдается выделение веществ на электродах. Законы Фарадея в газах не действительны, но существуют несколько закономерностей;
1) При отсутствии ионизатора электролиз проводиться не будет даже при высоком напряжении.
2) Электролизу подвергаются только бескислородные кислоты в газообразном состоянии и некоторые газы.
3) Уравнения электролиза как в электролитах, так и в газах всегда остаются постоянными.
См. также
Примечания
Ссылки
Электролиз — Википедия с видео // WIKI 2

Электро́лиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор, либо расплав электролита.
Электролиз является одним из лучших способов золочения или покрытия металла медью, золотом.
Упорядоченное движение ионов в проводящих жидкостях происходит в электрическом поле, которое создаётся электродами — проводниками, соединёнными с полюсами источника электрической энергии. Катодом при электролизе называется отрицательный электрод, анодом — положительный[1]. Положительные ионы — катионы (ионы металлов, водородные ионы, ионы аммония и др.) — движутся к катоду, отрицательные ионы — анионы (ионы кислотных остатков и гидроксильной группы) — движутся к аноду.
Реакции, происходящие при электролизе на электродах, называются вторичными. Первичными являются реакции диссоциации в электролите. Разделение реакций на первичные и вторичные помогло Майклу Фарадею установить законы электролиза.
Энциклопедичный YouTube
1/5
Просмотров:11 173
82 468
3 786
932
26 246
✪ Урок 298. Электрический ток в жидкостях. Закон Фарадея для электролиза
✪ Электролиз воды
✪ Электрический ток в жидкостях. Закон электролиза. Урок 70
✪ Электролиз. Электрический ток в различных средах. Учебный фильм
✪ Гальванические элементы
Содержание
Применение


Электролиз широко применяется в современной промышленности. В частности, электролиз является одним из способов промышленного получения алюминия, меди, водорода, диоксида марганца[2], пероксида водорода. Большое количество металлов извлекается из руд и подвергается переработке с помощью электролиза (электроэкстракция, электрорафинирование). Также электролиз является основным процессом, благодаря которому функционирует химический источник тока.
Электролиз находит применение в очистке сточных вод (процессы электрокоагуляции, электроэкстракции, электрофлотации).
Применяется для получения многих веществ (металлов, водорода, хлора и др.), при нанесении металлических покрытий (гальваностегия), воспроизведении формы предметов (гальванопластика).
Первый закон Фарадея
В 1832 году Фарадей установил, что масса m вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду q, прошедшему через электролит:
m = k ⋅ q = k ⋅ I ⋅ t {\displaystyle m=k\cdot q=k\cdot I\cdot t} , если через электролит пропускается в течение времени t постоянный ток с силой тока I.
Коэффициент пропорциональности k {\displaystyle k} называется электрохимическим эквивалентом вещества. Он численно равен массе вещества, выделившегося при прохождении через электролит единичного электрического заряда, и зависит от химической природы вещества.
Вывод закона Фарадея
- m = m i N i {\displaystyle m=m_{i}N_{i}} (1)
- m i = M / N a {\displaystyle m_{i}=M/N_{a}} (2)
- N i = Δ q q i {\displaystyle N_{i}={\frac {\Delta q}{q_{i}}}} (3)
- Δ q = I Δ t {\displaystyle \Delta q=I\Delta t} (4)
- q i = e z {\displaystyle q_{i}=ez} , (5)
- где z — валентность атома (иона) вещества,
- e — заряд электрона
- Подставляя (2)-(5) в (1), получим
- m = M z e N A I Δ t {\displaystyle m={\frac {M}{zeN_{A}}}I\Delta t}
- m = M z F I Δ t {\displaystyle m={\frac {M}{zF}}I\Delta t} ,
где F = e N A {\displaystyle F=eN_{A}} — постоянная Фарадея.
- k = M F z {\displaystyle k={\frac {M}{Fz}}}
- m = k I Δ t {\displaystyle m=kI\Delta t}
Второй закон Фарадея
Электрохимические эквиваленты различных веществ пропорциональны их молярным массам и обратно пропорциональны числам, выражающим их химическую валентность.
Химическим эквивалентом иона называется отношение молярной массы A {\displaystyle A} иона к его валентности z {\displaystyle z} . Поэтому электрохимический эквивалент
- k = 1 F ⋅ A z {\displaystyle k\ =\ {1 \over F}\cdot {A \over z}} ,
где F {\displaystyle F} — постоянная Фарадея.
Второй закон Фарадея записывается в следующем виде:
- m = M ⋅ I ⋅ Δ t n ⋅ F {\displaystyle m={\frac {M{\cdot }I{\cdot }{\Delta }t}{n{\cdot }F}}} ,
- где M {\displaystyle M} — молярная масса данного вещества, образовавшегося (однако не обязательно выделившегося — оно могло и вступить в какую-либо реакцию сразу после образования) в результате электролиза, г/моль
- I {\displaystyle I} — сила тока, пропущенного через вещество или смесь веществ (раствор, расплав), А
- Δ t {\displaystyle {\Delta }t} — время, в течение которого проводился электролиз, с
- F {\displaystyle F} — постоянная Фарадея, Кл·моль−1
- n {\displaystyle n} — число участвующих в процессе электронов, которое при достаточно больших значениях силы тока равно абсолютной величине заряда иона (и его противоиона), принявшего непосредственное участие в электролизе (окисленного или восстановленного)
- Однако это не всегда так; например, при электролизе раствора соли меди(II) может образовываться не только свободная медь, но и ионы меди(I) (при небольшой силе тока).
Изменение электролизом веществ
Не все вещества будут электролизироваться при пропускании электрического тока. Существуют некоторые закономерности и правила.
| Катионы активных металлов | Катионы менее активных металлов | Катионы неактивных металлов |
|---|---|---|
| Li+, Cs+, Rb+, K+, Ba2+, Sr2+, Ca2+, Na+, Mg2+, Be2+, Al3+ | Mn2+, Cr3+, Zn2+, Ga3+, Fe2+, Cd2+, In3+, Tl+, Co2+, Ni2+, Mo4+, Sn2+, Pb2+ | Bi3+, Cu2+, Ag+, Hg2+, Pd3+, Pt2+, Au3+ |
| Тяжело разряжаются (только из расплавов), в водном растворе электролизу подвергается вода с выделением водорода | В водном растворе восстанавливается металл (при малой концентрации катионов в растворе — металл и водород) | Легко разряжаются, и восстанавливается только металл |
| Анионы кислородсодержащих кислот и фторид-ион | Гидроксид-ионы; анионы бескислородных кислот (кроме F−) |
|---|---|
| PO43−, CO32−, SO42−, NO3−, NO2−, ClO4−, F− | OH−, Cl−, Br−, I−, S2− |
| Тяжело разряжаются (только из расплавов), в водном растворе электролизу подвергается вода с выделением кислорода | Легко разряжаются |
Примеры
Расплавы
Активные металлы, менее активные металлы и неактивные металлы в расплавах ведут себя одинаково.
Растворы
Активные металлы
Менее активные металлы и неактивные металлы
Мнемоническое правило
Для запоминания катодных и анодных процессов в электрохимии существует следующее мнемоническое правило:
- У анода анионы окисляются.
- На катоде катионы восстанавливаются.
В первой строке все слова начинаются с гласной буквы, во второй — с согласной.
Или проще:
- КАТод — КАТионы (ионы у катода)
- АНод — АНионы (ионы у анода)
Электролиз в газах
Электролиз в газах, при наличии ионизатора, объясняется тем, что при прохождении через них постоянного электрического тока наблюдается выделение веществ на электродах. Законы Фарадея в газах не действительны, но существуют несколько закономерностей:
- при отсутствии ионизатора электролиз проводиться не будет, даже при высоком напряжении;
- электролизу подвергаются только бескислородные кислоты в газообразном состоянии и некоторые газы;
- уравнения электролиза, как в электролитах, так и в газах, всегда остаются постоянными.
См. также
Примечания
- ↑ Обратное обозначение знака катода и анода встречается в литературе при описании гальванических элементов
- ↑ [www.xumuk.ru/encyklopedia/2/5329.html Электросинтез — Химическая энциклопедия]
Ссылки
| |||
 Эта страница в последний раз была отредактирована 28 июня 2020 в 01:01.
Эта страница в последний раз была отредактирована 28 июня 2020 в 01:01.электролитических ячеек – химия LibreTexts
Вольтовые ячейки приводятся в действие спонтанной химической реакцией , которая производит электрический ток через внешнюю цепь. Эти элементы важны, потому что они являются основой для батарей, которые питают современное общество. Но они не единственный вид электрохимической ячейки. Обратная реакция в каждом случае не является спонтанной и требует электрической энергии для возникновения.
Введение
Общая форма реакции может быть записана как:
\ [\ underset {\ longleftarrow \ text {Non спонтанный}} {\ overset {\ text {Spontaneous} \ longrightarrow} {\ text {Reactants} \ rightleftharpoons \ text {Products} + \ text {Electrical Energy}}} \ ]
Можно построить ячейку, которая работает в химической системе, пропуская электрический ток через систему.Эти ячейки называются электролитическими ячейками. Электролитические ячейки, как и гальванические элементы, состоят из двух полуэлементов – одна представляет собой восстановительную, а другая – окислительную. Направление потока электронов в электролитических ячейках, однако, может быть изменено от направления спонтанного потока электронов в гальванических элементах, но определение как катода, так и анода остается неизменным, где восстановление происходит на катоде, а окисление происходит на аноде. , Поскольку направления обеих полуреакций были изменены на противоположные, знак, но не величина клеточного потенциала, был изменен на противоположный.
Электролизеры очень похожи на гальванические (гальванические) элементы в том смысле, что оба требуют солевой мостик, оба имеют катодную и анодную стороны, и оба имеют постоянный поток электронов от анода к катоду. Тем не менее, есть также разительные различия между двумя ячейками. Основные отличия изложены ниже:
Рисунок \ (\ PageIndex {1} \): Электрохимические ячейки. Гальваническая ячейка (слева) преобразует энергию, выделяемую спонтанной окислительно-восстановительной реакцией, в электрическую энергию, которую можно использовать для выполнения работы.Окислительные и восстановительные полуреакции обычно происходят в отдельных отсеках, которые связаны внешней электрической цепью; кроме того, для поддержания электрической нейтральности необходимо второе соединение, которое позволяет ионам течь между отсеками (показано здесь как вертикальная пунктирная линия для представления пористого барьера). Разница потенциалов между электродами (напряжение) заставляет электроны течь от восстановителя к окислителю через внешнюю цепь, генерируя электрический ток.В электролитической ячейке (справа) внешний источник электрической энергии используется для генерации разности потенциалов между электродами, которая заставляет электроны течь, вызывая непредвиденную окислительно-восстановительную реакцию; в большинстве случаев используется только один отсек. В обоих типах электрохимических ячеек анод является электродом, на котором происходит полуреакция окисления, а катод является электродом, на котором происходит полуреакция восстановления.
| Электрохимическая ячейка (гальваническая ячейка) | электролизер |
|---|---|
| Гальваническая ячейка преобразует химическую энергию в электрическую энергию. | Электролизер преобразует электрическую энергию в химическую энергию. |
| Здесь окислительно-восстановительная реакция является спонтанной и отвечает за выработку электрической энергии. | Окислительно-восстановительная реакция не является самопроизвольной, и для ее инициирования требуется подача электрической энергии. |
| Две полуклетки установлены в разных контейнерах, соединенных через солевой мостик или пористую перегородку. | Оба электрода помещены в один контейнер в растворе расплавленного электролита. |
| Здесь анод отрицательный, а катод положительный электрод. Реакция на аноде – это окисление, а на катоде – восстановление. | Здесь анод положительный, а катод отрицательный электрод. Реакция на аноде – это окисление, а на катоде – восстановление. |
| Электроны поставляются окисленными видами.Они перемещаются от анода к катоду во внешней цепи. | Внешняя батарея поставляет электроны. Они входят через катод и выходят через анод. |
электролитических ячеек
Чтобы объяснить, что происходит в электролизере, рассмотрим разложение расплавленного хлорида натрия на металлический натрий и газообразный хлор. Реакция написана ниже.
———> Non спонтанный (электролизер) | ||||
2 Na Cl (л) | 2 Na (s) | + | Cl 2 (г) | |
<--------- Самопроизвольно (электрохимическая ячейка) | ||||
Если расплавленный \ (NaCl _ {(l)} \) поместить в контейнер и вставить инертные электроды \ (C _ {(s)} \), прикрепленные к положительным и отрицательным клеммам батареи, электролитическая реакция будет происходят.- \]
Прогнозирование реакции электролиза
Существует четыре основных фактора, которые определяют, будет ли происходить электролиз, даже если внешнее напряжение превысит расчетную величину:
- Избыточный потенциал или избыточное напряжение иногда требуется для преодоления взаимодействий на поверхности электрода.Этот случай чаще случается с газами. Например. H 2 (г) требует перенапряжения 1,5 В, в то время как Pt (s) требует перенапряжения 0 В
- Может иметь место более одной электродной реакции, что означает, что может быть более одной полуреакции, оставляя две или более возможностей для клеточной реакции.
- Реагенты могут находиться в нестандартных условиях, что означает, что напряжение для полуэлементов может быть меньше или больше, чем величина стандартного условия.Например:
- Концентрация хлорид-иона = 5,5М, а не единичная активность 1М. Это означает, что снижение хлорида = 1,31 В не 1,36 В
- Стандартным условием является наличие рН 4 в полуэлементе анода, но иногда во время нестандартных состояний рН может быть выше или ниже при изменении напряжения.
- Способность инертного электрода к электролизу зависит от реагентов в растворе электролита, в то время как активный электрод может работать сам по себе, чтобы выполнить половинную реакцию окисления или восстановления.
Если учесть все четыре из этих факторов, мы можем успешно предсказать электродные полуреакции и общие реакции в электролизе.
Упражнение \ (\ PageIndex {1} \)
Предсказать реакции электродов и общую реакцию, когда анод сделан из (а) меди и (б) платины.
Количественные аспекты электролиза
Майкл Фарадей открыл в 1833 году, что всегда существует простая связь между количеством вещества, произведенного или потребленного на электроде во время электролиза, и количеством электрического заряда Q , который проходит через элемент.- \ rightarrow Ag \]
говорит нам, что когда 1 моль Ag + наносится как 1 моль Ag, 1 моль e – должен подаваться с катода. Поскольку известно, что отрицательный заряд на одном электроне равен 1,6022 × 10 –19 C, мы можем умножить его на постоянную Авогадро, чтобы получить заряд на моль электронов. Эта величина называется константой Фарадея , символ F :
.F = 1,6022 × 10 –19 C × 6,0221 × 10 23 моль –1 = 9.-} \) и \ (Q \).
Часто электрический ток, а не количество электрического заряда измеряется в эксперименте электролиза. Поскольку кулон определяется как количество заряда, которое проходит неподвижную точку в электрической цепи, когда ток в один ампер течет в течение одной секунды, заряд в кулонах можно рассчитать путем умножения измеренного тока (в амперах) на время (в секундах), в течение которого оно течет:
\ [Q = Это \]
В этом уравнении I представляет ток, а t представляет время.Если вы помните, что
кулонов = 1 ампер × 1 секунда 1 C = 1 А с
вы можете настроить единицы времени, чтобы получить правильный результат. Теперь, когда мы можем предсказать полуреакции электродов и общие реакции при электролизе, важно также иметь возможность рассчитывать количество потребляемых реагентов и произведенных продуктов. Для этих расчетов мы будем использовать постоянную Фарадея:
1 моль электрона = 96,485 C
Заряд ( C ) = ток ( C / с ) x время (с)
( C / s ) = 1 кулон заряда в секунду = 1 ампер ( A )
Простое преобразование для любого типа проблемы:
- Конвертировать любое заданное время в секунды
- Возьмите текущий ток ( A ) за секунды, [1 c = (A) / (s)]
- Наконец, используйте стехиометрическое преобразование 1 моль электрона = 96,485 C (Константа Фарадея)
Пример \ (\ PageIndex {1} \)
Электролиз образца растворенного брома может быть использован для определения количества содержания брома в образце.- \]. Какая масса брома может быть нанесена в течение 3 часов при токе 1,18 А?
РЕШЕНИЕ :
3.00 часа x 60 мин / час x 60 сек / 1 мин x 1.18 C (A) /1 сек x 1 моль e – /96 485 C
= 0,132 моль е –
Задачи
1) Прогнозировать продукты электролиза, заполнив график:
Cl – , Br – , I – , H + , OH – , Cu 2+ , Pb 2+ , Ag +, K + , Na + ,
2) Рассчитайте количество электрического заряда, необходимого для пластины 1.386 моль Cr из кислого раствора K 2 Cr 2 O 7 в соответствии с полу-уравнением
H 2 Cr 2 O 7 ( aq ) + 12H + ( aq ) + 12 e – → 2Cr ( s ) + 7 H 2 901 ( л )
3) Перекись водорода, H 2 O 2 , может быть получена электролизом холодной концентрированной серной кислоты. Реакция на аноде составляет
2H 2 SO 4 → H 2 S 2 O 8 + 2H + + 2 e –
Когда полученная пероксидисерная кислота, H 2 S 2 O 8 , кипятится при пониженном давлении, она разлагается:
2H 2 O + H 2 S 2 O 8 → 2H 2 SO 4 + H 2 O 2
Рассчитайте массу произведенной перекиси водорода при токе 0.893 течет за 1 час.
4) Электролиз образца растворенного холрида можно использовать для определения количества хлорида в образце. На катоде полуреакция восстановления представляет собой Cl 2 + (aq) + 2 e – -> 2 Cl – . Какая масса хлорида может быть нанесена в течение 6,25 часов при токе 1,11 А?
5) В электролизере электрод, на котором электроны попадают в раствор, называется ______; химическое изменение, которое происходит на этом электроде, называется _______.
- анод, окисление
- анод, редукция
- катод, окисление Катод
- , редукция
- не может сказать, если мы не знаем, какие виды окисляются и восстанавливаются.
6) Как долго (в часах) должен поддерживаться ток в 5,0 ампер для гальванизации 60 г кальция из расплавленного CaCl 2 ?
- 27 часов
- 8,3 часа
- 11 часов
- 16 часов
- 5.9 часов
- 7) Сколько времени в часах потребуется для гальваники 78 г платины из раствора [PtCl 6 ] 2 – , используя средний ток 10 ампер при 80% эффективность электрода?
- 8,4
- 5,4
- 16,8
- 11,2
- 12,4
8) Сколько фарадеев требуется для уменьшения 1.00 г алюминия (III) до металлического алюминия?
- 1,00
- 1,50
- 3,00
- 0,111
- 0,250
9) Найдите стандартный потенциал ячейки для электрохимической ячейки со следующей реакцией ячейки.
Zn (s) + Cu 2+ (aq) → Zn 2+ (aq) + Cu (s)
ответов
1) . Cl – хлор Н + водород
Cl – хлор Cu 2+ медь
I – йод H + водород
2) 12 моль e – требуется для пластины 2 моль Cr, что дает нам стехиометрическое соотношение S ( e – / Cr).Тогда постоянная Фарадея может быть использована для определения количества заряда.
n Cr n e – Q
Q = 1,386 моль Cr × × = 8,024 × 10 5 C
3) Произведение тока и времени дает нам количество электричества, Q . Зная это, мы легко вычисляем количество электронов, n e -. Из первой половины уравнения мы можем затем найти количество пероксидисерной кислоты, а вторая приводит к n h3O2 и, наконец, к m h3O2 .
= 05666 × г H 2 O 2 = 0,5666 г H 2 O 2
4) 0,259 моль е –
5) d
6) d
7) b
8) d
9) Запишите полуреакции для каждого процесса.
Zn (s) → Zn 2+ (aq) + 2 e –
Cu 2+ (aq) + 2 e – → Cu (s)
Посмотрите стандартные потенциалы для восстановительной полуреакции.
E o восстановление Cu2 + = + 0,339 В
E o снижение Zn2 + = – 0,762 В
Определите общий стандартный потенциал ячейки.
E o , ячейка = + 1,101 В
Список литературы
- Petrucci, et al. Общая химия: принципы и современные приложения. 9-е изд. Аппер-Седл-Ривер, Нью-Джерси: Пирсон / Прентис Холл, 2007.
- Колбе, Герман.Электролиз органических соединений. Эдинбург: Э. и С. Ливингстон, 1947.
- Стюарт, А.Т. «Электролиз воды». Производство водорода 2001 13 мая
- Все перечисленные «Внешние ссылки».
участников
- Жасмин Брионес, UC Davis 2012
- Объясните следующие законы в рамках Закона об идеальном газе
До сих пор мы обсуждали, как можно производить электричество в результате химических реакций в батареях. Некоторые реакции, вместо этого, используют электричества, чтобы вызвать реакцию. В этих реакциях электрическая энергия отдается реагентам, заставляя их реагировать с образованием продуктов. Эти реакции имеют много применений.Например, лектролиз представляет собой процесс, который включает в себя проталкивание электричества через жидкость или раствор, чтобы вызвать реакцию. Реакции электролиза не будут проходить, если энергия не поступит в систему извне. В случае реакций электролиза энергия обеспечивается аккумулятором. Представьте, что электролиз и электролизеры – это противоположность электрохимическим элементам:
Электрохимические ячейки | электролитических ячеек | |
|---|---|---|
| Преобразование энергии | Химическая → Электрика | Электротехника → Химическая |
| Спонтанная химическая реакция? | Да | № |
| Значение E ° | Положительный | Отрицательный |
В электрохимической ячейке спонтанная окислительно-восстановительная реакция используется для создания электрического тока; в электролизере будет происходить обратное – потребуется электрический ток, чтобы вызвать спонтанную химическую реакцию.Мы рассмотрим три примера электролитического процесса, продолжая наше обсуждение на самом базовом уровне – электролиз расплавленного хлорида натрия, электролиз воды и гальваника.
Рисунок 16.7.1: Электрический ток пропускается через воду, разделяя воду на водород и кислород.Если электроды, подключенные к клеммам батареи, помещены в жидкий хлорид натрия, ионы натрия будут мигрировать к отрицательному электроду и уменьшаться, в то время как ионы хлорида мигрируют к положительному электроду и окисляются.-} \ rightarrow 2 \ ce {Na} + \ ce {Cl_2} \]
При соответствующей обработке от аккумулятора можно добиться восстановления металла в процессе электролиза, чтобы он прочно прилипал к электроду. Использование электролиза для покрытия одного материала слоем металла называется гальваническим покрытием . Обычно гальваническое покрытие используется для покрытия дешевого металла слоем более дорогого и более привлекательного металла. Многие девушки покупают украшения, покрытые золотом. Иногда гальваника используется для получения поверхностного металла, который является лучшим проводником электричества.Если вы хотите иметь поверхностные свойства золота (привлекательный, устойчивый к коррозии или хороший проводник), но не хотите больших затрат на изготовление всего объекта из чистого золота, ответ может заключаться в использовании дешевого металла для сделать объект, а затем гальванизировать тонкий слой золота на поверхности.
Рисунок 16.7.2: Серебряная посуда.Для серебряной пластины предмет, подобный ложке (посеребренная посуда дешевле, чем чистое серебро), ложка помещается в положение катода в электролизе, настроенном раствором нитрата серебра.Когда ток включен, ионы серебра мигрируют через раствор, касаются катода (ложки) и прилипают к нему. При достаточном времени и заботе слой серебра можно покрыть по всей ложке. Анодом для этой операции часто был бы большой кусок серебра, из которого ионы серебра будут окисляться, и эти ионы попадут в раствор. Это способ обеспечить постоянную подачу ионов серебра для процесса нанесения покрытия.
- Полуреакция на катоде:
\ [\ ce {Ag ^ +} + \ ce {e ^ -} \ rightarrow \ ce {Ag} \]
- Половинная реакция на аноде:
\ [\ ce {Ag} \ rightarrow \ ce {Ag ^ +} + \ ce {e ^ -} \]
Некоторая доля продаваемых золотых и серебряных украшений гальванизирована.Точки подключения в электрических выключателях часто позолочены для улучшения электропроводности, а большинство хромированных деталей в автомобилях хромировано.
Электролиз расплавленного хлорида натрия
Если мы посмотрим на латинские корни слова «электролиз», мы узнаем, что это означает, по сути, «распасться» ( лизис ) с помощью электричества. Наш первый пример электролизера рассмотрит, как электрический ток может быть использован для разделения ионного соединения на его элементы.Следующее уравнение представляет собой разрыв NaCl ( l ) :
2NaCl ( л ) → 2Na ( л ) + Cl 2 (г)
Половинные реакции, вовлеченные в этот процесс:
E ° | |||
| сокращение | 2Na + (l) + 2e – → Na (s) | -2.71 В | |
| Cl – (л) → Cl 2 (г) + 2 e – | -1,36 В | ||
Требуемое сетевое напряжение | – 4.07В | ||
Обратите внимание, что отрицательное напряжение (-4,07 В) возникает, когда мы складываем полуреакции. Это говорит нам о том, что общая реакция будет , а не спонтанной, и для этой реакции потребуется минимум 4,07 вольта.
Как мы увидим, наша установка будет иметь много общего с нашими электрохимическими ячейками. Нам понадобятся электроды и электролит для переноса электрического тока.
В нашем примере с NaCl электроды будут просто переносить ток, но в противном случае не будут напрямую участвовать в реакции.Электролит будет фактически расплавленным (расплавленным) NaCl. Электроды и электролит необходимы для переноса электрического тока. Необходимо использовать расплавленный NaCl, поскольку твердые ионные соединения не несут электрический заряд.
Некоторые ключевые отличия в настройке электрохимической ячейки:
- две полуреакции не разделены солевым мостиком
- потребуется электрохимическая ячейка (или другой источник электрического тока)
Другие важные пункты для заметки:
- Анод электролизера – это место окисления, а катод – это место восстановления, как и в электрохимической ячейке.
- В электрохимической ячейке анод отрицательный, а катод положительный, но в электролитической ячейке все наоборот: анод положительный, а катод отрицательный.
Тщательно изучите схему нашей установки, уделяя особое внимание отслеживанию пути электронов. Пока электроны не совершат полный цикл, реакция не произойдет.
- Электроны “производятся” в батарее на аноде, месте окисления.
- Электроны покидают электрохимическую ячейку через внешнюю цепь.
- Эти отрицательные электроны создают отрицательный электрод в электролизере, который притягивает положительные ионы Na + в электролите. Ионы Na + соединяются со свободными электронами и становятся восстановленными (2Na + + 2e – → Na)
- Между тем отрицательный Cl – притягивается к положительному электроду электролитической ячейки.На этом электроде хлор окисляется, выделяя электроны (Cl – → Cl 2 + 2 e – )
- Эти электроны проходят через внешнюю цепь, возвращаясь в электрохимическую ячейку.
Электролиз Воды
Наш второй пример электролизеров и электролизеров связан с разрушением воды. Мы найдем ситуацию, очень похожую на электролиз расплавленного NaCl.Следующее уравнение представляет собой разделение H 2 O ( l ) :
2H 2 O ( л ) → 2H 2 ( г ) + O 2 (г)
Может быть более трудно предсказать вовлеченные полуреакции, но они:
Установка будет очень похожа на наш последний пример с некоторыми небольшими отличиями. Вода плохо переносит заряд, поэтому в воду добавляется электролит.Уксус, слабая кислота (уксусная кислота) может быть использована. Чтобы собрать произведенные газы водорода и кислорода, часто добавляют перевернутые пробирки, как показано на нашей диаграмме ниже.
Опять же, будьте особенно внимательны, чтобы проследить путь электронов. Пока электроны не совершат полный цикл, реакция не произойдет.
2H 2 O ( l ) + 2e – → H 2 ( г ) + 2 OH – (вод)
2H 2 O ( л ) → O 2 (г) + 4H + (вод) + 4e –
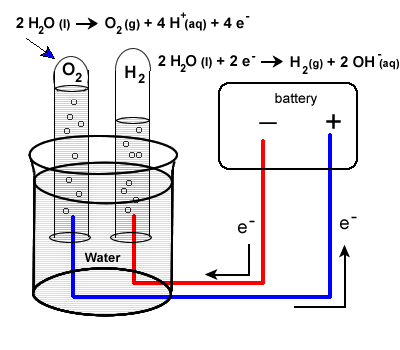
- Электроны “производятся” в батарее на аноде, месте окисления.
- Электроны покидают электрохимическую ячейку через внешнюю цепь.
- Эти отрицательные электроны создают отрицательный электрод в электролитической ячейке, который вызывает сокращение воды.
Обратите внимание, что область вокруг этого электрода станет основной по мере образования ионов OH – .
- Между тем вода положительного электрода будет подвергаться окислению:
- Электроны, произведенные во время этого процесса окисления, вернутся в электрохимическую ячейку.
- Электроны “производятся” в батарее на аноде, месте окисления.
Примечание о сбалансированном уравнении для электролиза воды:
Вы можете заметить из полуреакций, что сложение уравнений изначально не дает нам нашего чистого уравнения
2H 2 O ( л ) → 2H 2 ( г ) + O 2 (г)
,Электролиз – Викиверситет
Электролиз – это самый первый электрохимический метод, который когда-либо использовался. Слово происходит от греческих слов «электрон» и «лизис», первое в его современном смысле означает обращение к электричеству, второе – к разложению, а значит: разложение с помощью электричества.
Пример [править]
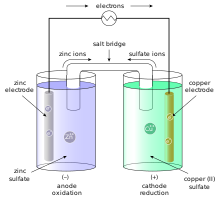
ячейка Даниэля состоит из цинкового анода (сборщика электронов), окисляется при растворении в растворе сульфата цинка, растворяющийся цинк остается после его электронов в электроде в соответствии с реакцией окисления ( с = твердый электрод; вод119 = водный раствор):
- Z N ( s ) → Z N ( Q ) 2 + + 2 е – {\ displaystyle \ mathrm {Zn _ {(s)} \ rightarrow Zn _ {(aq)} ^ {2 +} + 2e ^ {-} \}}
Сульфат цинка является электролитом в этой половине элемента.{2 -} \} с обвинениями, которые балансируют до нуля.
В другой половине ячейки катионы меди в медно-сульфатном электролите притягиваются к медному катоду, к которому они присоединяются, поскольку они принимают электроны от медного электрода по реакции восстановления:
- С U ( Q ) 2 + + 2 е – → С U ( s ) {\ displaystyle \ mathrm {Cu _ {(aq)} ^ {2 +} + 2e ^ {-} \ rightarrow Cu _ {(s)} \}}
Предпосылки [править]
Предполагается базовое понимание следующих тем:
- Атом
- Восстановление и окисление или окислительно-восстановительная реакция
- Электрический потенциал
Краткая история [править]
Электролиз восходит к рубежу 18 в 19 века.В то время сэр Хэмфри Дэви применил только что обнаруженную вольтовую кучу к расплавленному гидроксиду калия, выпустив металл из его соединения. Хотя источник электрического тока со временем изменился, принципалы не изменились.
Принципалов [править]
На его основе во время электролиза проводится окислительно-восстановительная реакция. Разница между простой окислительно-восстановительной реакцией между двумя химическими соединениями и электролизом обнаруживается в пути, по которому электрон перемещается от одного атома к другому.В обычных окислительно-восстановительных реакциях электрон непосредственно передается между атомами. При электролизе электроны движутся по электрической схеме.
Техника [править]
Основной аппарат, используемый в электролизе, показан справа. Он состоит из источника напряжения, проводов, двух электродов и контейнера с веществом, которое должно быть электролизировано, в данном случае – стаканом с водой. Стекло для стакана с его содержанием называется: электрохимический чел. [1] .Часть проводов, погруженных в раствор, называют «электродами». При электролизе воды эти электроды изготавливаются из платины. Источник напряжения в целом настроен на несколько вольт.
Наименования электродов:
- Анод, электрод, на котором происходит реакция окисления.
- Катод, электрод, на котором происходит реакция восстановления.
Наименование двух электродов не зависит от использования электрохимической ячейки.
Реакция [править]
Происходящие реакции обрабатываются отдельно, так как они пространственно разделены.
Реакция анодирования или окисления [править]
На аноде происходит реакция окисления. Анод становится положительным благодаря его соединению с положительным выводом источника напряжения. Обладает большой окислительной способностью. Электроны «хотят» туда попасть. Поскольку в этом примере вода является единственным компонентом в ячейке, она должна быть окислена в соответствии с:
2 H 2 O  O 2 + 4 H + + 4 e – [2]
O 2 + 4 H + + 4 e – [2]
Образующийся кислород поднимается в виде пузырьков и может попасть в пробирку и проверить, в противном случае он улетучивается в воздух.Ионы водорода просто растворяются в оставшейся воде. Электроны принимаются анодом.
Анод, однако, подключен к положительной клемме источника напряжения. Падение потенциала из-за прихода электронов на анод приводит к переносу этих электронов на отрицательный вывод: потенциал анода не изменяется.
Катодная или редукционная реакция [править]
На катоде происходит реакция восстановления. Катод очень богат электронами, так как он подключен к отрицательной клемме источника напряжения.Обладает большой редукционной способностью. Поскольку в этом примере вода является единственным компонентом в ячейке, ее следует уменьшить в соответствии с:
2 H 2 O + 2 e –  H 2 + 2 OH –
H 2 + 2 OH –
Образующийся водород поднимается в виде пузырьков и может попасть в пробирку и проверить, в противном случае он улетучится в воздух. Ионы гидроксида просто растворяются в оставшейся воде и, конечно, будут реагировать с ионами водорода, образующимися на аноде. Электроны принимаются анодом.
Анод, однако, подключен к положительной клемме источника напряжения. Падение потенциала из-за прихода электронов на анод приводит к переносу этих электронов на отрицательный вывод: потенциал анода не изменяется.
Полная реакция [править]
Как видно из уравнений реакции, образуются водород и кислород. Хотя уравнения сами по себе сбалансированы, общая реакция требует некоторой корректировки, так как четыре электрона поглощаются на аноде, и только два высвобождаются на катоде.Чтобы уравновесить всю реакцию, катодную следует прочитать дважды, так что:
2 H 2 O  2 H 2 + O 2
2 H 2 + O 2
Более сложный электролиз [править]
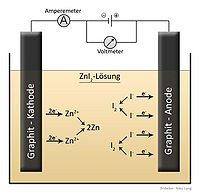 |
| Изображение электрохимической ячейки, содержащей йодид цинка. Текст на немецком языке: Lösung = решение Graphit = углерод |
Пример электролизируемой воды прямолинеен. Более сложная ситуация возникает при добавлении растворенного вещества.Теперь на обоих электродах возможно несколько реакций, но будет протекать только одна. В качестве примера используется раствор йодида цинка. Для прогнозирования реакций на каждом электроде поможет следующая процедура:
Определите компоненты, присутствующие на аноде. Компоненты и их соответствующие окислительно-восстановительные потенциалы для окисления:
| Компонент | E o | Для углерода никакого значения не найдено, так как углерод является материалом инертного электрода, он просто не реагирует.Для Zn 2+ значение не найдено из-за невозможности окисления этого иона. На аноде произойдет окисление. Самый сильный восстановитель доставит электроны. Проверка таблицы стандартных электродных потенциалов приводит к цифрам во втором ряду таблицы. До настоящего времени йодид является более сильным восстановителем (имеет более низкое значение Е o ), поэтому йодид будет окисляться до йода. | |
|---|---|---|---|
| C o | ? | ||
| H 2 O | +1.23 | ||
| Zn 2+ | – | ||
| I – | +0.53 |
Определить компоненты, присутствующие на катоде. Компоненты и их соответствующие окислительно-восстановительные потенциалы для восстановления:
| Компонент | E o | Опять же, для углерода никакого значения не найдено, поскольку углерод является материалом инертного электрода, он просто не реагирует. Но в настоящее время для йодида тоже не найдено никакого значения, поскольку дальнейшее уменьшение йодида невозможно. На катоде произойдет сокращение. Самый сильный окислитель примет электроны. Проверка таблицы стандартных электродных потенциалов приводит к числам во втором ряду таблицы, что затем приводит к выводу, что ион Zn 2+ будет принимать электроны и превращаться в свое металлическое состояние. | |
|---|---|---|---|
| C o | ? | ||
| H 2 O | -0,8277 | ||
| Zn 2+ | -0.7618 | ||
| I – | – |
Ссылка [править]
- ↑ Электрохимические элементы обсуждаются более широко в тексте по потенциометрии.
- ↑ Для явного уравновешивания уравнения здесь записан заряд электронов.
17.2: Электролиз – химия LibreTexts
Типичный электролизер может быть изготовлен, как показано на рисунке \ (\ PageIndex {1} \). Два электрических проводника ( электрода ) погружены в жидкость для электролиза. Эти электроды часто изготавливаются из инертного материала, такого как нержавеющая сталь, платина или графит. Жидкость, подлежащая электролизу, должна быть способна проводить электричество, поэтому обычно она представляет собой водный раствор электролита или расплавленного ионного соединения.Электроды соединены проводами с аккумулятором или другим источником постоянного тока. Этот источник тока может рассматриваться как «электронная накачка», которая забирает электроны из одного электрода и выталкивает их в другой электрод. Электрод, с которого удаляются электроны, становится положительно заряженным, в то время как электрод, на который они подаются, имеет избыток электронов и отрицательный заряд.
Рисунок \ (\ PageIndex {1} \) : Электролизер. Батарея качает электроны от анода (делая его положительным) и в катод (делая его отрицательным).Положительный анод притягивает к себе анионы, а отрицательный катод – катионы. Электрический ток переносится электронами в проводе и электродах, но он переносится анионами и катионами, движущимися в противоположных направлениях в самой ячейке. Поскольку анод может принимать электроны, на этом электроде происходит окисление. Катод является донором электронов и может вызвать восстановление. Изображение использовано с разрешения Википедии (кредит XXX).Отрицательно заряженный электрод будет притягивать к нему положительные ионы (катионы) из раствора.Он может пожертвовать часть своих избыточных электронов таким катионам или другим веществам в электролизуемой жидкости. Следовательно, этот электрод фактически является восстановителем. В любой электрохимической ячейке (электролитической или гальванической) электрод, на котором происходит восстановление , называется катодом .
Положительный электрод, с другой стороны, будет притягивать к себе отрицательные ионы (анионы). Этот электрод может принимать электроны от этих отрицательных ионов или других частиц в растворе и, следовательно, ведет себя как окислитель.В любой электрохимической ячейке анод представляет собой электрод, на котором происходит окисление . Простой способ запомнить, какой электрод является тем, что анод и окисление начинаются с гласных, а катод и восстановление начинаются с согласных.
На следующем видео показано, как этот процесс происходит в нейтральном растворе воды с присутствием некоторых электролитов.
В качестве примера того, как электролиз может вызвать химическую реакцию, предположим, что мы пропускаем постоянный электрический ток через 1 М HCl.{-} (aq) \ rightarrow \ text {H} _2 (g) + \ text {Cl} _2 (g) + \ text {2H} _2 \ text {O} (l) \]
Чистая реакция [Уравнение \ (\ ref {3} \)] – это обратная спонтанной комбинации H 2 ( г ) с Cl 2 ( г ) с образованием HCl ( Aq ). Такой результат в целом относится к электролизу: электрический ток , подаваемый извне системы, вызывает неконтролируемую химическую реакцию.
Хотя электролиз всегда обращает вспять самопроизвольную окислительно-восстановительную реакцию, результатом данного электролиза не всегда может быть та реакция, которую мы хотим.Например, в водном растворе всегда имеется множество молекул воды вблизи анода и катода. Эти молекулы воды могут отдавать электроны аноду или принимать электроны от катода так же, как это могут делать анионы или катионы. Следовательно, электролиз может окислять и / или восстанавливать воду вместо того, чтобы вызывать реакцию растворенного электролита. Примером этой проблемы является электролиз фторида лития, LiF. Можно ожидать снижения Li + на катоде и окисления F – на аноде, согласно полукравнениям
\ [\ text {Li} ^ {+} (aq) + \ text {e} ^ {-} \ rightarrow \ text {Li} (s) \ label {5} \]
\ [\ text {2F} ^ {-} (aq) \ rightarrow \ text {F} _2 (g) + \ text {2e} ^ {-} \]
Однако Li + является очень плохим акцептором электронов, и поэтому очень трудно заставить уравнение \ (\ ref {5} \) произойти.{-} \ label {8} \]
Полное уравнение можно получить, умножив уравнение \ (\ ref {7 } \ ) на 2, добавив его в уравнение \ (\ ref {8} \) и объединив H + с OH – в форму Н 2 О:
\ [\ text {2H} _2 \ text {O} (l) \ rightarrow \ text {2H} _2 (g) + \ text {O} _2 (g) \]
На следующем видео показан электролиз воды с использованием серной кислоты в качестве мостика для передачи заряда. После того, как электролиз завершен, идентичность образовавшихся газов проверяется с использованием испытаний на горение.
Таким образом, этот электролиз обращает вспять самопроизвольную комбинацию H 2 и O 2 с образованием H 2 О. При обсуждении окислительно-восстановительных реакций мы упоминаем несколько окислителей, например, достаточно сильных для окисления H 2 О. В то же время мы описываем восстановители, которые являются достаточно сильными для восстановления H 2 O, таких как щелочные металлы и более тяжелые щелочные земли. Как правило, такие вещества не могут быть получены электролизом водных растворов, поскольку Н 2 О вместо этого окисляется или восстанавливается.Вещества, которые подвергаются самопроизвольной окислительно-восстановительной реакции с Н 2 О, обычно получают электролизом расплавленных солей или в каком-либо другом растворителе. Однако из этого правила есть некоторые исключения, поскольку некоторые электродные реакции протекают медленнее, чем другие. Используя таблицу 11.5, например, мы прогнозируем, что H 2 О является лучшим восстановителем, чем Cl – .
Следовательно, мы ожидаем, что O 2 , а не Cl 2 , будет получен электролизом 1 М HCl, в противоречие с уравнением \ (\ ref {1} \).Оказывается, что O 2 получается более медленнее , чем Cl 2 , и последний выпадает из раствора до того, как H 2 O может быть окислен. По этой причине таблица 1 в разделе «Редокс-пары» не всегда может быть использована для прогнозирования того, что произойдет при электролизе.
,

