3.6. Электролиз органических соединений
В течение последних лет все более широкое применение получает электрохимический метод в синтезе органических соединений. Здесь используется важное преимущество электрохимического метода, возможность точного дозирования и быстрого регулирования окислительно-восстановительных процессов, что обеспечивает получение чистых продуктов и их высокий выход.
Впервые электролиз органического вещества был осуществлен Кольбе в 1951 году. Он погрузил два платиновых электрода в щелочной раствор валериановой кислоты (C4H9COOH) и в результате пропускания тока получил жидкое вещество, состоящее только их водорода и углерода. Кольбе предполагал, что получил бутил:
.
Позднее выяснилось, что это не бутил, а октан C8H18и схему реакции нужно дополнить уравнением завершающей стадии сдваивания
.
Как правило, вещества, подвергающиеся электролизу, до пропускания электрического тока не реагирует между собой, а для того чтобы прекратить идущую реакцию, нужно отключить ток. Поэтому один из способов сделать реакцию управляемой – это проводить ее с помощью электросинтеза.
Хлор и бром часто реагируют с органическими соединениями очень бурно, даже если их подают в зону реакции очень осторожно. А если хлор и бром не подавать извне, а получать в реакторе с помощью электролиза, то тогда их концентрация будет определяться величиной подаваемого тока.
Если, например, в реактор загрузить водный раствор NaClи пропускать через него этилен, который ни сNaCl, ни сH2Oне взаимодействует, затем включить ток (в реакторе есть пара графитовых электродов), то на аноде начинает выделяться хлор.
Дальнейший ход реакции зависит от величины тока. Если ток достаточный, то образуется дихлорэтан – широко применяемый растворитель:
CH2=CH2 + 2Cl– – 2ē → Cl–CH2–CH2–Cl.
При других условиях в реакцию вступает вода и образуется другой продукт реакции – этиленхлоргидрин – важный полупродукт химического синтеза:
CH2=CH2 + Cl– +H2O Cl–CH2–CH2–OH + H+.
На катоде одновременно происходит восстановление ионов водорода
2H+
По мере убывания концентрации ионов водорода среда становится более щелочной, при этом этиленхлоргидрин превращается в окись этилена:
Cl–CH2–CH2–OH + NaOH → + H2O + NaCl.
С помощью электросинтеза получают окись
пропилена. Реакция происходит в
электролизере с диафрагмой. Электролизу
подвергается раствор хлорида натрия.
В анодное пространство электролизера
подается пропилен, который, взаимодействия
с образовавшимся на аноде хлором,
превращается в пропиленхлоргидрин.
Последний фильтруется через диафрагму
в катодное пространство электролизера,
где омыляется образовавшейся на катоде
щелочью и превращается в окись пропилена.
Электролизу
подвергается раствор хлорида натрия.
В анодное пространство электролизера
подается пропилен, который, взаимодействия
с образовавшимся на аноде хлором,
превращается в пропиленхлоргидрин.
Последний фильтруется через диафрагму
в катодное пространство электролизера,
где омыляется образовавшейся на катоде
щелочью и превращается в окись пропилена.
Электросинтез является основным промышленным способом получения фторорганических соединений, применяемых в качестве диэлектриков и поверхностно-активных веществ.
С помощью электролизера можно осуществить реакцию алкилирования.
При проведения электролиза раствора уксусной кислоты (CH3COOH) под давлением насыщенным этиленом наряду с этаном – обычным продуктом электролиза уксусной кислоты – был получен бутан.
CH3COO– – ē → [CH3COO]
2 → CH3–CH3
2 + CH2=CH2 → CH3–CH2–CH2–CH3.
Метильные радикалы присоединяются к двойной связи молекулы этилена. При проведении этой реакции нужно поддерживать определенное соотношение между молекулами этилена и метильными радикалами – это осуществляется с помощью электрического тока.
Электрохимия позволяет также изменять потенциал электрода, на котором происходит изучаемая реакция, или поддерживать его строго постоянным. Такой электрод с управляемым потенциалом можно использовать взамен целого набора реагентов.
Если, например, восстановление ацетона происходит на цинковом катоде, то при низком потенциале в присутствии ацетата натрия образуется изопропиловый спирт , в щелочной среде ацетон на 60% превращается в цинакон
,
а при высоком потенциале основным продуктом становится пропан.
Электролиз неорганических и органических веществ. | Материал для подготовки к ЕГЭ (ГИА) по химии (11 класс) по теме:
По теме: методические разработки, презентации и конспекты
Методическая разработка урока на тему “Взаимосвязь неорганических и органических веществ”Методическая разработка урока с разновозрастной группой учащихся. Данный урокВ условиях профильного обучения учителя химии используют нетрадиционные методики. Среди них урок для разновозрастной гру…
Данный урокВ условиях профильного обучения учителя химии используют нетрадиционные методики. Среди них урок для разновозрастной гру…
Материал содержит конспект занятия, репортаж с урока и презентацию учителя к уроку и одну из презентаций обучающихся….
Электронная презентация к уроку в 11 классе “Электролиз растворов и расплавов неорганических и органических электролитов”Презентация содержит материал по электролизу растворов и расплавов электролитов, механизмы протекания процессов и правила разрядки катионов и анионов….
Электонная презентация к уроку химии в 11 классе “Электролиз растворов и расплавов неорганических и органических электролитов”Презентация содержит материал по электролизу расплавов и растворов веществ, алгоритм составления уравнений электролиза, порядок разрядки катионов и анионов….
Сценарий урока: Химический состав клетки: неорганические и органические веществаДорогие коллеги. Я хочу поделиться с вами разработкой урока.В связи с достаточно быстрым темпом жизни в последние десятилетие, с быстро меняющейся обстановкой в стране и мире, в настоящее время на сме…
Я хочу поделиться с вами разработкой урока.В связи с достаточно быстрым темпом жизни в последние десятилетие, с быстро меняющейся обстановкой в стране и мире, в настоящее время на сме…
Данный урок проводится в 11 классе химико-биологического профиля (2 урока по 45 минут). Тип – обобщающий. Цель – изучить химический состав и практическое применение лекарств органического и неорганиче…
Тест по теме “Неорганические и органические вещества клетки”-…
Электролиз расплавов и растворов | ЕГЭ по химии
Электролиз расплавов и растворов (солей, щелочей)
Если в раствор или расплав электролита опустить электроды и пропустить постоянный электрический ток, то ионы будут двигаться направленно: катионы к катоду (отрицательно заряженному электроду), анионы к аноду (положительно заряженному электроду).
или
$2NaCl{→}↖{\text”электролиз”}2Na+Cl_2↑$
На катоде образуется металлический натрий, на аноде — газообразный хлор.
Главное, что вы должны помнить: в процессе электролиза за счет электрической энергии осуществляется химическая реакция, которая самопроизвольно идти не может.
Электролиз водных растворов электролитов
Более сложный случай — электролиз растворов электролитов.
В растворе соли, кроме ионов металла и кислотного остатка, присутствуют молекулы воды. Поэтому при рассмотрении процессов на электродах необходимо учитывать их участие в электролизе.
Для определения продуктов электролиза водных растворов электролитов существуют следующие правила:
1. Процесс на катоде зависит не от материала, из которого сделан катод, а от положения металла (катиона электролита) в электрохимическом ряду напряжений, при этом если:
1.1. Катион электролита расположен в ряду напряжений в начале ряда по $Al$ включительно, то на катоде идет процесс восстановления воды (выделяется водород $Н_2↑$). {+}$
{+}$
2.1. Если анод растворяется (железо, цинк, медь, серебро и все металлы, которые окисляются в процессе электролиза), то окисляется металл анода, несмотря на природу аниона.
2.2. Если анод не растворяется (его называют инертным — графит, золото, платина), то:
а) при электролизе растворов солей бескислородных кислот (кроме фторидов) на аноде идет процесс окисления аниона;
б) при электролизе растворов солей кислородсодержащих кислот и фторидов на аноде идет процесс окисления воды (выделяется $О_2↑$). Анионы не окисляются, они остаются в растворе;
в) анионы по их способности окисляться располагаются в следующем порядке:
Попробуем применить эти правила в конкретных ситуациях.
Рассмотрим электролиз раствора хлорида натрия в случае, если анод нерастворимый и если анод растворимый.
1) Анод нерастворимый (например, графитовый).
В растворе идет процесс электролитической диссоциации:
Суммарное уравнение:
$2H_2O+2Cl^{-}=H_2↑+Cl_2↑+2OH^{-}$. {-}+O_2↑+2H_2O$
{-}+O_2↑+2H_2O$
Суммарное молекулярное уравнение:
$2H_2O{→}↖{\text”электролиз”}2H_2↑+O_2↑$
В данном случае, оказывается, идет только электролиз воды. Аналогичный результат получим и в случае электролиза растворов $H_2SO_4, NaNO_3, K_2SO_4$ и др.
Электролиз расплавов и растворов веществ широко используется в промышленности:
- Для получения металлов (алюминий, магний, натрий, кадмий получают только электролизом).
- Для получения водорода, галогенов, щелочей.
- Для очистки металлов — рафинирования (очистку меди, никеля, свинца проводят электрохимическим методом).
- Для защиты металлов от коррозии (хрома, никеля, меди, серебра, золота) — гальваностегия.
- Для получения металлических копий, пластинок — гальванопластика.
Секции
К обсуждению на секции №5 принимаются научно-исследовательские работы, посвященные разработке и созданию новых видов неметаллических и силикатных материалов, включая наноматериалы, функциональные материалы и композиционные материалы, исследованию их структуры и свойств, развитию физикохимии процессов, лежащих в основе их технологии, повышению энерго- и ресурсоэффективности материалов и технологий.
Основные направления работы секции:
· Современные технологии тугоплавких неметаллических и силикатных материалов;
· Перспективные неорганические и силикатные материалы строительного и технического назначения;
· Неорганические конструкционные материалы и покрытия;
· Новые материалы и технологии для применения в авиационной и ракетно-космической промышленности;
· Материалы для медицины (имплантология, стоматология, косметология, ядерная медицина, хирургия и т.д.)
· Наноструктурированные материалы на основе стеклообразных и керамических матриц;
· Взаимодействие лазерного излучения с веществом и лазерные технологии;
· Перспективные материалы для микроэлектроники, оптики, фотоники, микрофлюидики, солнечной энергетики, функциональные материалы и наноматериалы;
· Рациональное использование природного и техногенного минерального сырья;
· Экологобезопасные и ресурсосберегающие технологии и материалы;
· Аддитивные материалы и технологии;
· Неорганические композиционные материалы и покрытия с повышенными функциональными характеристиками;
· Исследование физико-химических процессов высокотемпературного превращения сырьевых материалов и клинкерообразования;
· Синтез, изучение морфологии и свойств кристаллогидратов цементного камня;
· Физико-химические основы управления процессами гидратации и твердения композиционных и вяжущих материалов;
· Новые виды вяжущих материалов и изделий из них на основе;
· Цементполимерные композиционные материалы и сухие строительные смеси
Electrolysis | Protocol (Translated to Russian)
18.
 10: Электролиз
10: ЭлектролизВ гальванической ячейке электрическая работа осуществляется системой ОВП на её окрестности, поскольку электроны, производимые спонтанными окислительно-восстановительных реакциями, передаются через внешнюю цепь. В качестве альтернативы, внешняя цепь работает на ОВП-системе, устанавливая напряжение, достаточное для того, чтобы в процессе, известном как электролиз, в противном случае спонтанная реакция. Например, перезарядка аккумулятора предполагает использование внешнего источника питания для спонтанной (разряженной) реакции ячейки в обратном направлении, восстанавливая в некоторой степени состав полуячеек и напряжение батареи. К другим примерам относится использование электролиза в утончении металлических руд, производстве товарных химических веществ, а также гальваническое покрытие металлических покрытий на утварь, украшения и т.д.
Прогнозирование продукта электролиза
Электролиз расплавленного хлорида натрия, NaCl (l), используется для промышленного производства металлического натрия, Na и хлора, Cl2. Ионы натрия (Na+) уменьшаются до атомов на катоде, а ионы хлорида окисляются до хлора, Cl2, на аноде. Окислительно-восстановительные реакции:
Ионы натрия (Na+) уменьшаются до атомов на катоде, а ионы хлорида окисляются до хлора, Cl2, на аноде. Окислительно-восстановительные реакции:
Отрицательный клеточный потенциал указывает на неспонтанную реакцию, которая должна быть проведена путем наложения положительного потенциала величиной более -12 4.07 В. Электролиз расплавленного хлорида натрия осуществляется при высокой температуре 801 °C, так как ионные твердые вещества расплавляются при высоких температурах.
Электролиз воды производит стехиометрические количества кислорода на аноде и водорода на катоде. Для улучшения электропроводности концентрация ионов водорода в воде увеличивается за счет добавления сильной кислоты. Связанные с ними окислительно-восстановительные реакции:
Электролиз растворов ионных соединений, таких как водный хлорид натрия, может включать электролиз как водных видов (h3O, H+, OH–), так и видов растворённое вещество (катионов и анионов соединения) на аноде и катоде.
Электролиз водного хлорида натрия может включать одну из двух реакций анода:
Термодинамически вода будет легче окисляться; однако на практике образуется хлор. Для окисления воды потребуется значительно большее напряжение. Для преодоления этого перенапряжения выбираются электмоль и тщательно отслеживается потенциал ячейки, чтобы гарантировать окисление ионов хлорида на аноде.
Аналогично, возможные реакции снижения на катоде:
Сравнение этих стандартных потенциалов половинной реакции позволяет предположить, что снижение воды термодинамически предпочтется. В этом случае реакция ячейки сети будет следующей:
Количественные аспекты электролиза
Электрический ток — это скорость потока электронов и измеряется в амперах, один кулон в секунду (A = 1 C/s). Переданный заряд, Q, по проходу постоянного тока, I, за указанный временной интервал, t, дается
Когда электроны передаются в процессе ОВП, стехиометрия реакции может использоваться для получения общего количества (электронного) заряда. Например, общий процесс сокращения,
Например, общий процесс сокращения,
включает передачу n моль электронов. Таким образом, передаваемый сбор
Где F – постоянная Фарадея, заряд кулонов для одного моль электронов. Для электрохимической ячейки измеряется ток, который можно использовать в стехиометрических расчетах, связанных с реакционной реакцией клетки.
Этот текст был адаптирован к OpenStax, Химия 2е изд., раздел 17.7: Электролиз.
Информация для участников олимпиады
Уважаемые участники олимпиады по химии!
Для достижения успешного результата вы должны знать:
- особенности строения атомов элементов;
- природу химической связи, ее характеристики и свойства, особенности поведения органических соединений с различными типами ковалентной связи (амидной, гликозидной, сложноэфирной и др.)
- классификацию неорганических и органических соединений; взаимосвязь между классами
- механизмы органических реакций;
- тривиальные названия широко используемых органических и неорганических соединений;
- области применения органических и неорганических соединений;
- влияние условий проведения реакций на природу продуктов;
- влияние одновременного изменения нескольких факторов на скорость химической реакции; знать количественные характеристики скорости реакции, динамического равновесия;
- понятие кислотности, основности и амфотерности согласно теориям Аррениуса и протолитической теории Бренстеда – Лоури; количественные характеристики этих свойств; водородный и гидроксильный показатели;
- физический смысл и количественные характеристики ОВР (в том числе электролиза) с участием органических и неорганических веществ;
- физические свойства органических и неорганических соединений; качественные реакции на органические и неорганические соединения, уметь провести мысленный эксперимент по описанию процессов;
- именные реакции, правила, реактивы (названные по фамилиям ученых, открывших или объяснивших реакции, например, реакция Мак-Мурри, правило Голлемана; предложивших использование реактива для анализа или в органическом синтезе, например, реактив Толленса, реактив Гриньяра).
Вы должны уметь:
- производить расчеты для решения задач;
- подбирать недостающие реагенты для записи уравнений реакций согласно логике протекания процессов;
- планировать цепочку органического синтеза, предполагающего несколько стадий.
Вы должны быть аккуратными и внимательными – проявить качества, необходимые врачу! – а именно: после формирования стратегии ответа не забыть про «мелочи»: коэффициенты в уравнениях, указание условий, побочные продукты и т.д.
Обратите внимание, что аналогичные по структуре вещества проявляют аналогичные свойства, например, амид бария реагирует аналогично известному амиду натрия; реакция «медного зеркала» аналогична реакции «серебряного зеркала» и т.д.
Примеры олимпиадных заданий
Обратите внимание, что олимпиадные задачи не являются типовыми! Решение задач требует творческого подхода и знания программы профильного уровня, а также интереса к химической науке.
Кафедра общей и биоорганической химии желает всем участникам успехов!
Электролиз, подготовка к ЕГЭ по химии
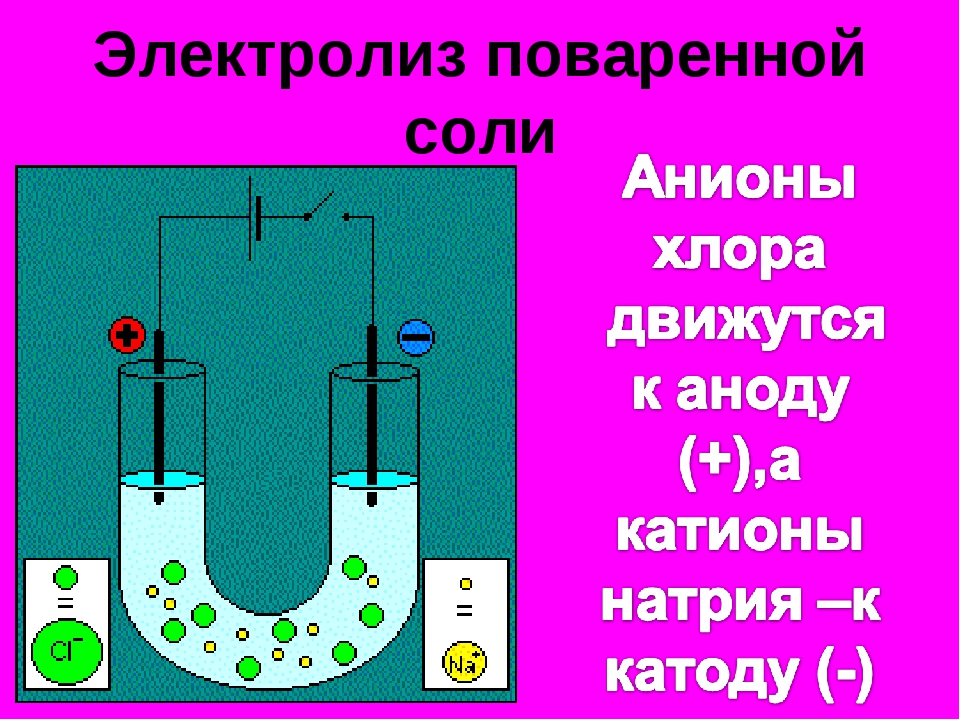
Электролиз (греч. elektron – янтарь + lysis — разложение) – химическая реакция, происходящая при прохождении постоянного тока через электролит. Это разложение веществ на их составные части под действием электрического тока.
Процесс электролиза заключается в перемещении катионов (положительно заряженных ионов) к катоду (заряжен отрицательно), и отрицательно заряженных ионов (анионов) к аноду (заряжен положительно).
Итак, анионы и катионы устремляются соответственно к аноду и катоду. Здесь и происходит химическая реакция. Чтобы успешно решать задания по этой теме и писать реакции, необходимо разделять процессы на катоде и аноде. Именно так и будет построена эта статья.
Катод
К катоду притягиваются катионы – положительно заряженные ионы: Na+, K+, Cu2+, Fe3+,
Ag+ и т. д.
д.
Чтобы установить, какая реакция идет на катоде, прежде всего, нужно определиться с активностью металла: его положением в электрохимическом ряду напряжений металлов.
Если на катоде появился активный металл (Li, Na, K) то вместо него восстанавливаются молекулы воды, из которых выделяется водород. Если металл средней активности (Cr, Fe, Cd) – на катоде выделяется и водород, и сам металл. Малоактивные металлы выделяются на катоде в чистом виде (Cu, Ag).
Замечу, что границей между металлами активными и средней активности в ряду напряжений считается алюминий. При электролизе на катоде металлы до алюминия (включительно!) не восстанавливаются, вместо них восстанавливаются молекулы воды – выделяется водород.
В случае, если на катод поступают ионы водорода – H+ (например при электролизе кислот HCl, H2SO4) восстанавливается водород из молекул кислоты: 2H+ – 2e = H2
Анод
К аноду притягиваются анионы – отрицательно заряженные ионы: SO42-, PO43-, Cl–, Br–,
I–, F–, S2-, CH3COO–.
При электролизе кислородсодержащих анионов: SO42-, PO43- – на аноде окисляются не анионы, а молекулы воды, из которых выделяется кислород.
Бескислородные анионы окисляются и выделяют соответствующие галогены. Сульфид-ион при оксилении окислении серу. Исключением является фтор – если он попадает анод, то разряжается молекула воды и выделяется кислород. Фтор – самый электроотрицательный элемент, поэтому и является исключением.
Анионы органических кислот окисляются особым образом: радикал, примыкающий к карбоксильной группе, удваивается, а сама карбоксильная группа (COO) превращается в углекислый газ – CO2.
Примеры решения
В процессе тренировки вам могут попадаться металлы, которые пропущены в ряду активности. На этапе обучения вы можете пользоваться расширенным рядом
активности металлов.
На этапе обучения вы можете пользоваться расширенным рядом
активности металлов.
Теперь вы точно будете знать, что выделяется на катоде ;-)
Итак, потренируемся. Выясним, что образуется на катоде и аноде при электролизе растворов AgCl, Cu(NO3)2, AlBr3, NaF, FeI2, CH3COOLi.
Иногда в заданиях требуется записать реакцию электролиза. Сообщаю: если вы понимаете, что образуется на катоде, а что на аноде, то написать реакцию не составляет никакого труда. Возьмем, например, электролиз NaCl и запишем реакцию:
NaCl + H2O → H2 + Cl2 + NaOH (обычно в продуктах оставляют именно запись “NaOH”, не подвергая его дальнейшему электролизу)
Натрий – активный металл, поэтому на катоде выделяется водород. Анион не содержит кислорода, выделяется галоген – хлор. Мы пишем уравнение, так
что не можем заставить натрий испариться бесследно 🙂 Натрий вступает в реакцию с водой, образуется NaOH.
Анион не содержит кислорода, выделяется галоген – хлор. Мы пишем уравнение, так
что не можем заставить натрий испариться бесследно 🙂 Натрий вступает в реакцию с водой, образуется NaOH.
Запишем реакцию электролиза для CuSO4:
CuSO4 + H2O → Cu + O2 + H2SO4
Медь относится к малоактивным металлам, поэтому сама в чистом виде выделяется на катоде. Анион кислородсодержащий, поэтому в реакции выделяется кислород. Сульфат-ион никуда не исчезает, он соединяется с водородом воды и превращается в серую кислоту.
Электролиз расплавов
Все, что мы обсуждали до этого момента, касалось электролиза растворов, где растворителем является вода.
Перед промышленной химией стоит важная задача – получить металлы (вещества) в чистом виде.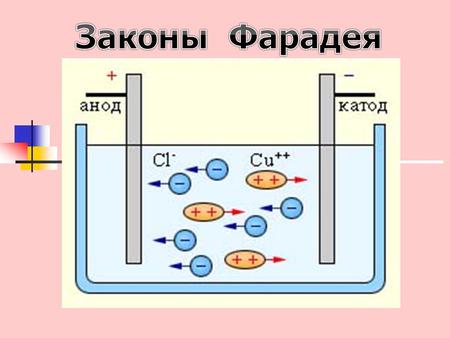 Малоактивные металлы (Ag, Cu) можно легко получать
методом электролиза растворов.
Малоактивные металлы (Ag, Cu) можно легко получать
методом электролиза растворов.
Но как быть с активными металлами: Na, K, Li? Ведь при электролизе их растворов они не выделяются на катоде в чистом виде, вместо них восстанавливаются молекулы воды и выделяется водород. Тут нам как раз пригодятся расплавы, которые не содержат воды.
В безводных расплавах реакции записываются еще проще: вещества распадаются на составные части:
AlCl3 → Al + Cl2
LiBr → Li + Br2
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Электрохимический синтез – обзор
24.4 Практическое применение
Очень важную часть области электрополимеризации составляют электрохимические методы, которые могут быть адаптированы для практических промышленных применений. 52 Одним из них является ранее упомянутый электросинтез перхлората периленового катионного радикала-инициатора, образующегося на аноде в твердом состоянии; возможность его раздельного взаимодействия с мономером позволяет избежать недостатков образования «до» и « in situ, ». 29 Другое применение – использование электролиза для изменения структуры электроактивных макромолекул. Анодный электролиз солей высокомолекулярных карбоновых кислот может образовывать в результате реакции Кольбе радикальные участки в цепи, способные инициировать привитую сополимеризацию. 53,54 При проведении той же реакции в присутствии воды на цепях поли (акриловой кислоты) и поли (метакриловой кислоты) были образованы гидропероксидные боковые группы, которые после разложения инициировали прививочную сополимеризацию. с более высокими урожаями, чем прямая прививка. 53,55 В присутствии N -ацетиламинокапроновой и цианоуксусной кислот пентилацетамино- и цианометиленовые группы были привиты к метакриловой кислоте перекрестным синтезом Кольбе. 56,57 Сополимеры акриловой и метакриловой кислоты с различными сомономерами были сшиты, внутренне модифицированы и прореагировали с различными соединениями электролизом Кольбе. 53 Поли (стирол- co -винилбензофенон) катодно электролизовали с образованием анион-радикальных центров на бензофеноновых группах, которые добавляют акрилонитрил или метилметакрилат, что приводит к привитым сополимерам, вероятно, по анионному механизму. 58 Что касается электрохимической модификации природных макромолекул, происходит электрохимическая прививка метилметакрилата к целлюлозе 59 и анодная электрополимеризация фибриногена с белками крови дает волокна, напоминающие волокна несшитого фибрина, 60,61 , как показано с помощью электронной микроскопии .
Другой важный аспект – это электрополимеризация, протекающая в водной среде. Он включает в себя большинство самых ранних исследований электроинициированной полимеризации, 1–4 , и касается полимеризации, распространяющейся по радикальному механизму, так что избегается обычное снижение скорости иона и молекулярной массы, присутствующее при ионной электрополимеризации.Что касается методов электроинициирования, радикальное получение электролизом Кольбе использовалось для полимеризации винилацетата, 62 метилметакрилата, 62 акриловой кислоты 63,64 и акриламида. 64–68 При полимеризации акриламида, проводимой с использованием винной кислоты в качестве электролита, особая природа электроактивной кислоты вызывает образование инициирующих частиц, отличных от тех, которые образуются при традиционной электрополимеризации Кольбе. 69 Необычным применением реакции Кольбе является электрополимеризация дикарбоновых кислот, полимеризация не только «инициированная электроэнергией», но также «электрораспространение». 70–73 Анодная электрополимеризация акрилонитрила в водной среде электрогенерированными радикалами HSO • 4, 74 метилметакрилата окислением мономера в присутствии ионов Fe 2+ 75 и акриламида электрогенерированными оксидами иридия 76 было сообщено. Были получены катодные электрополимеризации метакриловой кислоты в водной среде путем восстановления соли байпиридилия в присутствии небольших количеств кислорода 77 и метилметакрилата 2–4,25,78–81 .Что касается последнего мономера, первоначально предполагаемое инициирование катодно образованными радикалами H • 2–4 было позже исключено, а роль пероксидов мономеров 78–80 и добавленных ионов Fe 3+ 79 была указана. вне; более поздние исследования, по-видимому, исключают гипотезу перекиси и связывают инициацию с восстановлением мономера; присутствие ионов Fe 2+ или Fe 3+ , в зависимости от природы катодных материалов, уменьшает период ингибирования. 25,81
Другие способы электроинициированной полимеризации имеют практическое применение из-за структуры получаемых полимеров. К ним относятся электрополимеризация алкиновых производных; 82,83 электрохимическая сополимеризация SO 2 и сопряженных диенов с образованием полисульфонов; 84 электрополимеризация акрилонитрила с образованием полимеров, содержащих кольцевые структуры; 85–87 электроинициированная «трехмерная» полимеризация олигоэфиракрилатов, проводимая украинскими рабочими; 88–91 и электрохимическая поликонденсация, полученная Phillips et al., 92–94 , которые также тщательно исследовали электрополимеризацию донорно-акцепторных комплексов. 95–97
Электропокрытие с помощью in situ Электрополимеризация , пожалуй, наиболее важное применение электроинициированной полимеризации, о чем свидетельствует большое количество патентов, существующих в этой области. 98–104 Хотя электродное покрытие также часто получали в обычных экспериментах по электрополимеризации, 105–108 наиболее интересные исследования в этой области проводятся с целью получения поверхностей, покрытых полимерными пленками для специальных целей.Трифонов и др. полимеризованный акрилонитрил на катодно поляризованной германиевой оптической призме для отслеживания реакции с помощью спектроскопии внутреннего отражения. 86,87,109–111 Электрополимеризация на графитовых волокнах дает материал, используемый в армированных полимерных композитах, с улучшенной адгезией между волокнами и матричным полимером, 112–114 и огнезащитной пленкой вокруг волокон. 115 Эта работа была выполнена в основном Субраманианом, который также рассмотрел электрополимеризацию этого и других электродных материалов. 112
Еще одним очень важным применением электрополимеризации in situ является ее использование для защиты металлов от коррозии. Помимо ранних новаторских работ, таких как анионная полимеризация капролактама, полученная Гилчем и Майклом на железном катоде при 160 ° C в расплаве, результаты 116 , представляющие возможный технологический интерес, могут быть достигнуты только с in situ электрополимеризацией. место в водной среде, что значительно ограничивает выбор мономеров и процессов полимеризации. 117 Mengoli et al. получила коррозионно-стойкие пленки электрополимеризацией фенольных соединений 117–120 и других мономеров 121,122 на анодах из железа, меди и цинка; защитные покрытия из поли (оксифенилена) были нанесены на низкоуглеродистую сталь Otero et al. посредством электрополимеризации фенилсалицилата путем циклической развертки потенциала в растворе метанола. 123 и Lucchesi et al. электрополимеризацией различных фенольных соединений на анодах из меди и железа в водном растворе. 124–126
Методика электрополимеризации in situ также широко использовалась для получения «химически модифицированных» электродов; это электроды, покрытые слоем электроактивного полимера, что придает особые свойства самому электроду. 127 Такие электроды, первоначально изготовленные только путем химического прикрепления реактивного слоя к поверхности электрода, 128 в настоящее время увеличиваются в количестве, и область их применения расширяется благодаря использованию соответствующих методов электрополимеризации. 129 Здесь приведены некоторые примеры возможных применений электродов, модифицированных полимером. Аккумуляторы энергии были разработаны с электродами, сделанными из политиофена, 130,131 полиазулена, 131 полианилина, 132 133 поли (4-винилпиридиний гидробромид пербромид) 134 и полипиррола. 135 Органические сопряженные полимеры были привиты к полупроводникам путем электрополимеризации, чтобы защитить их от фотодеградации и получить новые электронные устройства типа «органическое на неорганическом», представляющие потенциальный интерес. 136 Электроды, покрытые полианилинами, классом электроактивных полимеров, показывающих большую разницу в проводимости между их окисленной и восстановленной формами, 137 использовались в электрохромных дисплеях и в электрокатализе. 137–144 Аналогичные применения были найдены для гомо- и сополимеров тиофенов 145–149 и пирролов 150–154 , электросинтезированных на электродах.
Можно сделать вывод, что электрохимическое инициирование очень важно как с теоретической, так и с практической точки зрения.В частности, его использование для получения материалов специального назначения открыло двери для широкого распространения этого метода полимеризации.
20.8: Промышленные процессы электролиза – Chemistry LibreTexts
Цели обучения
- Определение электрорафинирования и электросинтеза
- Объясните основы промышленного электролиза соленой воды для получения газообразного хлора.
Реакции электролиза – это фундамент современной промышленности.Существуют различные элементы, химические соединения и органические соединения, которые производятся только путем электролиза, включая алюминий, хлор и NaOH. Электролиз – это процесс, при котором электрический ток вызывает в противном случае несамопроизвольную реакцию.
Электролитическое рафинирование
Процесс электролитического рафинирования позволяет рафинировать металлы или соединения высокой чистоты по низкой цене. Чистый металл может покрыть ничего не стоящий предмет. Давайте рассмотрим процесс электролитического рафинирования меди: на аноде есть нечистый кусок меди, содержащий другие металлы, такие как Ag, Au, Pt, Sn, Bi, Sb, As, Fe, Ni, Co и Zn.Медь в этой нечистой руде окисляется с образованием Cu 2 + на аноде и проходит через водный раствор серной кислоты и сульфата меди (II) на катод. Когда он достигает катода, Cu 2 + восстанавливается до Cu. Весь этот процесс происходит при довольно низком напряжении (примерно от 0,15 до 0,30 В), поэтому Ag, Au и Pt не окисляются на аноде, так как их стандартные электродные потенциалы окисления составляют -800, -1,36 и -1,20. соответственно; эти неокисленные примеси превращаются в смесь, называемую анодным шламом, шлам на дне резервуара.Этот осадок может быть восстановлен и использован в различных процессах. В отличие от Ag, Au и Pt, примеси Sb, Bi и Sn в руде действительно окисляются на аноде, но они осаждаются, поскольку образуют гидроксиды и оксиды. Наконец, окисляются Fe, Ni, Co и Zn, но они растворяются в воде. Таким образом, единственное твердое вещество, которое у нас осталось, – это пластина из чистой твердой меди на катоде, уровень чистоты которой составляет около 99,999%. Изображение ниже дает представление о судьбе основных компонентов загрязненной железной руды.
Электросинтез
Электросинтез – это метод получения веществ посредством реакций электролиза. Это полезно, когда необходимо тщательно контролировать условия реакции. Одним из примеров электросинтеза является MnO 2 , диоксид марганца. MnO 2 встречается в природе в форме минерала пиролюзита, но этот минерал нелегко использовать из-за природы его размера и структуры решетки. Однако MnO 2 может быть получен другим способом, путем электролиза MnSO 4 в растворе серной кислоты.-} \\
& \ textrm {Катод:}
&& \ ce {2Ch3 = CHCN + 2h3O + 2e- \ rightarrow NC (Ch3) CN + 2OH -} \\
& \ textrm {Всего:}
&& \ underset {\ textrm {акрилонитрил}} {\ ce {2Ch3 = CHCN}} + H_2O \ rightarrow \ dfrac {1} {2} O_2 + \ underset {\ textrm {adiponitrile}} {\ ce {NC (Ch3) 4CN}} \ end {align} \)
Важность адипонитрила заключается в том, что он легко превращается в другие полезные соединения.
Хлор-щелочной процесс
Этот процесс представляет собой электролиз хлорида натрия (NaCl) на промышленном уровне.Мы начнем с обсуждения уравнения хлорщелочного процесса, а затем обсудим три различных типа процесса: мембранный элемент, ртутный элемент и мембранный элемент. Мы начнем объяснение хлорщелочного процесса с определения реакций, протекающих при электролизе NaCl. Поскольку NaCl находится в водном растворе, мы также должны учитывать электролиз воды как на аноде, так и на катоде. Следовательно, есть два возможных уравнения восстановления и две возможные реакции окисления.0_ {O_2 / H_2O} = -1.23 \: V \ label {4}}
\ end {align} \)
Как мы видим, из-за гораздо более высокого потенциала отрицательного электрода восстановление ионов натрия гораздо менее вероятно, чем восстановление воды, поэтому мы можем предположить, что при электролизе NaCl происходящее восстановление определяется уравнением \ (\ ref {2} \). Следовательно, мы должны попытаться определить, что собой представляет реакция окисления.
Допустим, у нас есть уравнение \ (\ ref {2} \) в качестве восстановления и уравнение \ (\ ref {3} \) в качестве окисления.0_ {O_2 / H_20} \ label {6b}} \\
& && && \ mathrm {\ hspace {22px} = -0,83 \: V – (1,23 \: V) = -2,06}
\ end {align} \ )
На первый взгляд может показаться, что уравнение \ (\ ref {6b} \) возникнет из-за меньшего (менее отрицательного) потенциала электрода. Однако O 2 на самом деле имеет довольно большое перенапряжение, поэтому вместо этого более вероятно образование Cl 2 , что делает уравнение \ (\ ref {5a} \) наиболее вероятным результатом для электролиза NaCl. -_ {\ large {(aq)}}}
&& \ mathrm {E_ {H_2O / H_2O} = -0.-}} \\
& && && \ hspace {12px} \ mathrm {= -0,83 \: V- (-1,36 \: V) = -2,19 \: V}
\ end {align} \)
** Хлорно-щелочной процесс часто происходит в аппарате, называемом мембранной ячейкой, что показано на рисунке \ (\ PageIndex {1} \).
Рисунок \ (\ PageIndex {1} \): Базовая мембранная ячейка, используемая при электролизе рассола. На аноде ( A ) хлорид (Cl – ) окисляется до хлора. Ионоселективная мембрана ( B ) позволяет противоиону Na + свободно проходить через нее, но предотвращает диффузию анионов, таких как гидроксид (OH – ) и хлорид.На катоде ( C ) вода восстанавливается до гидроксида и газообразного водорода. Чистый процесс представляет собой электролиз водного раствора NaCl на промышленно полезные продукты – гидроксид натрия (NaOH) и газообразный хлор. из Википедии (Jkwchui)Обратите внимание на следующие аспекты ячейки диаграммы:
Анод
- Хлорид натрия помещается в анодное отделение в водной форме.
- Фактический физический анод изготовлен из графита или титана.
- В анодном отсеке образуется газ Cl 2 , поскольку Cl – окисляется.
Катод
- На катодной стороне по мере восстановления воды образуются газ OH – (водный) и H 2 .
- Вы можете спросить, а почему на катодной стороне находятся ионы натрия и хлорида, если мы помещаем хлорид натрия в анодный отсек? Чтобы ответить на этот вопрос, мы можем рассмотреть разницу в уровнях раствора между анодом и катодом.Это вызывает постепенный поток NaCl на катод и предотвращает обратный поток NaOH на анод. При контакте Cl 2 и NaOH, Cl 2 превращается в ионы ClO –, ClO 3 –, Cl –. Разница уровней воды предотвращает этот контакт, а также способствует потоку NaCl на катодную сторону, поэтому может образовываться NaOH (водный).
- Теперь вы можете заметить, что раствор с NaOH на катоде также будет содержать водный раствор NaCl, смешанный с ним из-за потока NaCl от анода к катоду.Следовательно, если нам нужен очень чистый NaOH для таких целей, как производство вискозы, нам нужно как-то очистить соль от NaOH. Обычно перед очисткой раствор содержит примерно 14-16% NaCl (водн.) И 10-12% NaOH (водн.). Однако NaOH (водный) можно сконцентрировать, а NaCl (ы) можно кристаллизовать с образованием раствора с 50% NaOH (водн.) И примерно 1% NaCl (водн.).
Примечание
Если хлор вступает в контакт с водородом, образуется смесь, которая сильно взрывается под воздействием солнечного света или тепла.Будет производиться газообразный хлористый водород. Очевидно, эти два газа нужно держать отдельно.
Хлорно-щелочной процесс в ртутной ячейке
Чтобы еще больше повысить чистоту NaOH, вместо диафрагменной ячейки можно использовать ртутную ячейку для электролиза. В процессе с использованием ртутных элементов, также известном как процесс Кастнера – Келлнера, насыщенный солевой раствор плавает поверх тонкого слоя ртути. Ртуть является катодом, на котором вырабатывается натрий, который образует с ртутью натриево-ртутную амальгаму.Амальгама непрерывно вытягивается из ячейки и вступает в реакцию с водой, которая разлагает амальгаму на гидроксид натрия и ртуть. Ртуть возвращается в электролитическую ячейку. Хлор образуется на аноде и испаряется из электролизера. Производство ртутных элементов прекращается из-за опасений по поводу отравления ртутью из-за загрязнения ртутными элементами
Рисунок \ (\ PageIndex {2} \): Ртутная ячейка хлористого щелочного процесса. Изображение является общественным достояниемСторона анода
- Аноды помещают в водный раствор NaCl над жидкой ртутью.
- Восстановление Cl – происходит с образованием газообразного хлора, Cl 2 (г).
Катодная сторона
- Слой Hg (l) на дне резервуара служит катодом.
- При использовании ртутного катода реакция H 2 O (l) с H 2 имеет довольно высокий перенапряжение, поэтому вместо этого происходит восстановление Na + до Na. Na растворяется в Hg (l), и эти два соединения образуют амальгаму сплава Na-Hg.Эту амальгаму можно удалить, а затем смешать с водой, чтобы вызвать следующую реакцию:
- \ (\ ce {2Na \ 🙁 in \: Hg) + 2h3O \ rightarrow 2 Na + + 2 OH- + H_ {2 \ large {(g)}} + Hg _ {\ large {(l)}}} \)
- Образующаяся Hg (l) возвращается обратно в жидкость на дне резервуара, которая действует как катод.
- H 2 газ выпущен.
- NaOH остается в очень чистой водной форме.
** Некоторые из основных проблем с ртутным элементом следующие:
- Для реакции требуется более высокое напряжение, чем у диафрагменной ячейки: 4.5 В в ртутной ячейке по сравнению с 3,5 в диафрагменной ячейке.
- Требует довольно много электроэнергии, так как ему требуется 3400 кВтч / т Cl 2 , а не 2500 в мембранной ячейке.
- Возможный ущерб окружающей среде из-за отложений ртути. К счастью, объем отложений достигал 200 г ртути на тонну газообразного хлора, но теперь они никогда не превышают 0,25 г на тонну газообразного хлора.
Мембранно-клеточный процесс
Третий способ сделать NaOH еще более чистым – использовать мембранную ячейку.Он предпочтительнее метода с диафрагменным или ртутным элементом, поскольку он использует наименьшее количество электроэнергии и производит NaOH высочайшего качества. Например, он может производить NaOH со степенью загрязнения ионами хлора всего 50 ppm. Ионопроницаемая мембрана используется для разделения анода и катода.
Рисунок \ (\ PageIndex {3} \): это упрощенная реальная ячейка для отображения основных функций. Вы найдете другие схемы с входами и выходами в разных местах или более подробно.- \ rightarrow H_ {2 (g)} \]- H 2 O восстанавливается с образованием газа OH – и H 2 .
- \ (\ ce {2h3O \ rightarrow H_2 + 2OH-} \)
Ионы - Na + , которые протекли, и ионы OH –, полученные в результате восстановления воды, вступают в реакцию с образованием водного NaOH.
- H 2 газ также образуется как побочный продукт.
Мембрана изготовлена из полимера, который пропускает через нее только положительные ионы.Это означает, что через мембрану могут проходить только ионы натрия из раствора хлорида натрия, а не ионы хлорида. Преимущество этого заключается в том, что раствор гидроксида натрия, образующийся в правом отсеке, никогда не загрязняется каким-либо раствором хлорида натрия. Используемый раствор хлорида натрия должен быть чистым. Если бы он содержал ионы других металлов, они также прошли бы через мембрану и таким образом загрязнили бы раствор гидроксида натрия.
Список литературы
- Общая химия, принципы и современные приложения, Петруччи, 2007, 2002, 1997
Авторы и авторство
Электролиз органических соединений: статьи Германа Кольбе
Адольф Вильгельм Герман Кольбе (27 сентября 1818 – 25 ноября 1884) был немецким химиком.Он никогда не использовал первые два имени, предпочитая называться Герман Кольбе.Кольбе родился в Эллихаузене, недалеко от Геттингена, Королевство Ганновер (Германия), как старший сын протестантского пастора. В 13 лет он поступил в Геттингенскую гимназию, где жил в доме одного из профессоров. Он
Адольф Вильгельм Герман Кольбе (27 сентября 1818 – 25 ноября 1884) был немецким химиком. Он никогда не использовал первые два имени, предпочитая называться Герман Кольбе.Кольбе родился в Эллихаузене, недалеко от Геттингена, Королевство Ганновер (Германия), как старший сын протестантского пастора. В 13 лет он поступил в Геттингенскую гимназию, где жил в доме одного из профессоров. Шесть лет спустя он получил аттестат зрелости (Abitur). Он увлекся изучением химии, поступив в Геттингенский университет весной 1838 года, чтобы учиться у известного химика Фридриха Велера.
В 1842 году он стал ассистентом Роберта Бунзена в Марбургском университете; там он защитил докторскую диссертацию в 1843 году.Новая возможность появилась в 1845 году, когда он стал помощником Лионского плейфэра в новом Музее экономической геологии в Лондоне, где он стал близким другом Эдварда Франкленда. С 1847 года он занимался редактированием Handwörterbuch der reinen und angewandten Chemie (Словарь чистой и прикладной химии) под редакцией Юстуса фон Либиха, Велера и Иоганна Кристиана Поггендорфа, а также написал важный учебник. В 1851 году Кольбе сменил Бунзена на посту профессора химии в Марбурге, а в 1865 году его призвали в Лейпцигский университет.В 1864 году он был избран иностранным членом Шведской королевской академии наук.
В 1853 году он женился на Шарлотте, дочери генерал-майора Вильгельма фон Барделебена. Его жена умерла в 1876 году после 23 лет счастливого брака. У них было четверо детей.
Еще в 1840-х годах, несмотря на синтез мочевины Фридрихом Велером в 1828 году, некоторые химики все еще верили в доктрину витализма, согласно которой для создания органических соединений требовалась особая жизненная сила. Кольбе разработал идею о том, что органические соединения могут быть получены из неорганических, прямо или косвенно, с помощью процессов замещения.Он подтвердил свою теорию, превратив сероуглерод в уксусную кислоту в несколько этапов (1843–45). Представив модифицированное представление о структурных радикалах, он внес вклад в создание структурной теории. Одним из наиболее значительных успехов его теории было его предсказание существования вторичных и третичных спиртов, предположение, которое вскоре было подтверждено синтезом этих веществ.
Он работал над электролизом солей жирных и других кислот (электролиз Кольбе) и получил салициловую кислоту, строительный блок аспирина, в процессе, называемом синтезом Кольбе или реакцией Кольбе-Шмитта.Определенный метод синтеза нитрилов называется синтезом нитрила Кольбе.
Герман Кольбе был первым, кто использовал слово синтез в современном значении.
Вместе с Эдвардом Франкландом он обнаружил, что нитрилы можно гидролизовать до соответствующих кислот.
Герман Кольбе | Немецкий химик
Герман Кольбе , полностью Адольф Вильгельм Герман Кольбе , (родился 27 сентября 1818 года, Эллихаузен, недалеко от Геттингена, Ганновер [нем.] – умер в ноябре.25, 1884, Лейпциг, Германия), немецкий химик, осуществивший первый общепринятый синтез органического соединения из неорганических материалов.
Кольбе изучал химию у Фридриха Велера в Геттингенском университете и получил докторскую степень в 1843 году у Роберта Бунзена в Марбургском университете (Гессен). После работы в качестве помощника Бунзена Кольбе принял в 1845 году постдокторантуру в Лондоне в качестве помощника химика и члена британского парламента Лиона Плейфэра.Два года спустя Кольбе начал работать научным редактором и писателем в издательстве Vieweg в Брауншвейге. В 1851 году он, наконец, получил звание профессора, став преемником Бунзена в Марбурге. Обстоятельства были очень необычными, так как он был назначен профессором, не имея формальной квалификации для преподавания в университете. Но он добился там больших успехов как в обучении, так и в исследованиях. После 14 лет в Марбурге Кольбе получил должность в Лейпцигском университете, где для него был построен новый роскошный лабораторный институт.Он оставался в Лейпциге до конца своей жизни.
Кольбе был лидером в области органической химии как раз тогда, когда эта область входила в период бурного роста. Еще в 1844–1845 годах он опубликовал метод синтеза уксусной кислоты, первый пример полного синтеза важного органического соединения; в заключительной статье этой серии он впервые использовал слово синтез в химическом контексте. В течение следующих десяти или двух лет было синтезировано множество органических веществ, и Кольбе сыграл важную роль в этой истории.
Что еще более важно в долгосрочной перспективе, Кольбе попытался понять внутреннюю природу веществ, которыми он манипулировал. Под сильным влиянием таких химиков, как Велер, Бунзен, Юстус Либих и Йенс Якоб Берцелиус, Кольбе развил теории молекулярного состава, разработанные этими химиками. Большинство химиков 1840-х годов придерживались теорий органических радикалов, согласно которым органические молекулы, как полагали, были построены из субкомпонентных частей («радикалов»), которые также могли существовать независимо, и поэтому могли быть разделены на них.Исследования Кольбе этих радикалов постепенно предоставили средства для определения детального строения органических веществ. Например, он исследовал электролиз органических кислот, которые давали новые углеводороды, и вместе со своим английским другом Эдвардом Франкландом он разработал реакцию, которая увеличила размер тех же кислот (посредством образования нитрила с последующим гидролизом).
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчасПодобные усилия привели к развитию теории химического строения немецким химиком Августом Кекуле и другими, которая возникла незадолго до 1860 года.К сожалению, Кольбе категорически отверг молекулярные структурные диаграммы, нарисованные Кекуле, с его валентными связями между атомами и его углеродными цепями. Кольбе считал классическую теорию радикалов, в которой группы атомов удерживаются вместе предполагаемыми электростатическими силами, совершенно достаточной для описания даже самых сложных органических молекул, и считал новые структурные формулы излишне умозрительными. Однако практически все химики того же возраста, что и Кольбе, не соглашались с ним, и примерно к 1870 году структурная теория стала прочно обоснованной.
Когда бывший ученик Кекуле Якобус Хенрикус ван’т Хофф распространил структурные формулы на три измерения, чтобы создать новую специальную область стереохимии (1874), Кольбе взорвался гневом. В качестве главного редактора ведущего журнала – Journal für praktische Chemie – он часто публиковал едкие передовые статьи, а в 1877 году он жестоко критиковал молодого и до сих пор неизвестного Вант Хоффа. Он также вел все более непопулярную борьбу против развития теории ароматических соединений Кекуле (то есть соединений на основе молекулы бензола).К несчастью для Кольбе, стереохимия, ароматическая химия и структурная химия в целом стали еще более полезными с научной точки зрения и более широко признанными; соответственно, к концу жизни Кольбе вообще стал считаться неприятным чудаком.
Кольбе сражался с более молодыми химиками-строителями не из-за амбиций, тщеславия или злобы, а скорее потому, что он был привержен высоким стандартам доказательств и аргументов в науке, которые, по его мнению, систематически нарушались его оппонентами.Химия – тонкая наука, требующая сложных цепочек умозаключений, чтобы делать надежные выводы о невидимых мелких деталях молекулярной архитектуры. Кольбе был мастером таких отдаленных выводов; он считал методологический стиль своих оппонентов одновременно наивным и безрассудным. Он никогда не колебался, защищая свою науку от того, что он считал ошибкой. К несчастью для него, его объектами презрения были одни из лучших молодых химиков того времени.
В течение своей карьеры у Кольбе было около 2000 студентов в его лабораторных классах и десятки докторантов или приглашенных рабочих.Хотя он жестко обращался в печати с теми, с кем не был согласен, его ученики были преданы ему. Он был одним из лучших экспериментаторов XIX века, настоящим мастером химической лаборатории. Он также был, несмотря на свои крайние и старомодные взгляды, одним из самых важных теоретиков классического периода в истории органической химии.
Электролиз трихлорметилированных органических соединений в аэробных условиях, катализируемый модельным комплексом B12 для образования сложного эфира и амида
TY – JOUR
T1 – Электролиз трихлорметилированных органических соединений в аэробных условиях, катализируемый модельным комплексом B12 для образования сложного эфира и амида
AU – Shimakoshi, Hisashi
AU – Luo, Zhongli
AU – Inaba, Takuya
AU – Hisaeda, Yoshio
N1 – Информация о финансировании: Это исследование было частично поддержано грантом на научные исследования (C) (No.26410122) от Японского общества содействия науке (JSPS), исследований в инновационных областях (№ 15H00952) Министерства образования, культуры, спорта, науки и технологий (MEXT) Японии, Научного фонда Токуяма 2014 года и Программа Matching Planner 2015 от Японского агентства по науке и технологиям (JST). Авторские права издателя: © Королевское химическое общество, 2016.
PY – 2016
Y1 – 2016
N2 – Электролиз бензотрихлорида при -0.9 V по сравнению с Ag / AgCl в присутствии модельного комплекса B12, гептаметилкобирината перхлората, в этаноле в аэробных условиях с использованием неразделенной ячейки, снабженной катодом с платиновой сеткой и анодом из цинковой пластины, дает этилбензоат с выходом 56% при селективности 92% . Соответствующие сложные эфиры были получены при проведении электролиза в различных спиртах, таких как метанол, н-пропанол и изопропанол. Бензоилхлорид был обнаружен с помощью ГХ-МС во время электролиза как промежуточный продукт для образования сложного эфира.При проведении электролиза в анаэробных условиях вместо сложного эфира были получены частично дехлорированные продукты, 1,1,2,2-тетрахлор-1,2-дифенилэтан и 1,2-дихлорстилибены (формы E и Z). Эксперименты по захвату спиновых ловушек ЭПР с использованием N-оксида 5,5, -диметилпирролина (DMPO) показали, что соответствующий кислород-центрированный радикал и углерод-центрированный радикал постоянно генерируются во время электролиза в аэробных и анаэробных условиях соответственно. Описаны применения аэробного электролиза для различных органических галогенидов, таких как замещенные бензотрихлориды.Кроме того, сообщается об образовании амидов с умеренными выходами в результате аэробного электролиза бензотрихлорида, катализируемого модельным комплексом B12, в присутствии аминов в ацетонитриле.
AB – Электролиз бензотрихлорида при -0,9 В по сравнению с Ag / AgCl в присутствии модельного комплекса B12, гептаметилкобирината перхлората, в этаноле в аэробных условиях с использованием неразделенной ячейки, снабженной катодом из платиновой сетки и анодом из цинковой пластины произвел этилбензоат с выходом 56% при селективности 92%.Соответствующие сложные эфиры были получены при проведении электролиза в различных спиртах, таких как метанол, н-пропанол и изопропанол. Бензоилхлорид был обнаружен с помощью ГХ-МС во время электролиза как промежуточный продукт для образования сложного эфира. При проведении электролиза в анаэробных условиях вместо сложного эфира были получены частично дехлорированные продукты, 1,1,2,2-тетрахлор-1,2-дифенилэтан и 1,2-дихлорстилибены (формы E и Z). Эксперименты по захвату спиновых ловушек ЭПР с использованием N-оксида 5,5, -диметилпирролина (DMPO) показали, что соответствующий кислород-центрированный радикал и углерод-центрированный радикал постоянно генерируются во время электролиза в аэробных и анаэробных условиях соответственно.Описаны применения аэробного электролиза для различных органических галогенидов, таких как замещенные бензотрихлориды. Кроме того, сообщается об образовании амидов с умеренными выходами в результате аэробного электролиза бензотрихлорида, катализируемого модельным комплексом B12, в присутствии аминов в ацетонитриле.
UR – http://www.scopus.com/inward/record.url?scp=84975882074&partnerID=8YFLogxK
UR – http://www.scopus.com/inward/citedby.url?scp=84975882074&partnerID=8YFL
У2 – 10.1039 / c6dt00556j
DO – 10.1039 / c6dt00556j
M3 – Артикул
AN – SCOPUS: 84975882074
VL – 45
SP – 10173
EP – 10180
Dalton Транзакции
СН – 1477-9226
ИС – 25
ЭР –
.

