Электролиз расплавов и растворов — схема, правила и уравнения
Поможем понять и полюбить химию
Начать учиться
Электролиз расплавов и растворов встречается в заданиях на ЕГЭ, а значит, если вы планируете сдавать экзамен по химии, эту тему нужно знать на отлично. Наша статья поможет узнать или повторить, что такое электролиз, его правила и схема протекания.
Электролиз — это окислительно-восстановительная реакция, которая протекает на электродах и основана на пропускании электрического тока через раствор или расплав.
Не менее важными участниками электролиза являются электроды: катод и анод. Если вы вдруг забыли, что такое катод и анод в химии, напомним.
Катод — это отрицательно заряженный электрод, который притягивает положительно заряженные ионы (катионы). А анод — это положительно заряженный электрод, который притягивает к себе отрицательно заряженные ионы (анионы). Таким образом, на катоде всегда происходит процесс восстановления, а на аноде всегда происходит процесс окисления.
Таким образом, на катоде всегда происходит процесс восстановления, а на аноде всегда происходит процесс окисления.
Электроды бывают растворимые и инертные. Растворимые изготавливаются из металлов, например, меди и подвергаются химическим превращениям в ходе электролиза. А вот инертные или нерастворимые электроды не подвергаются химическим превращениям и остаются в неизменном виде как до реакции, так и после нее. Как правило, такие электроды изготавливают из графита или платины.
Виды электролиза
Различают два вида электролиза:
Электролиз расплава.
Электролиз водного раствора.
Прежде чем мы рассмотрим каждый процесс отдельно, давай познакомимся с общими для двух видов процессами на электродах.
Процесс на катоде K (−) Катион принимает электроны и восстанавливается: Me+n + ne− → Me0 (восстановление). Процесс на аноде A (+) Анион отдает электроны и окисляется: неMe−n − ne− → неMe0 (окисление). Процессы, протекающие при электролизе в общем случае: К− : Ме+n + ne− → Ме0; А+ : неМе−n − ne− → неМе0. Суммарное уравнение электролиза: |
|---|
Полезные подарки для родителей
В колесе фортуны — гарантированные призы, которые помогут наладить учебный процесс и выстроить отношения с ребёнком!
Электролиз расплава
Рассмотрим электролиз расплава пищевой соли — хлорида натрия. При сильном нагревании кристаллический твердый хлорид натрия плавится. Полученный расплав содержит подвижные ионы хлора и натрия, освободившиеся из кристаллической решетки, и проводит электрический ток.
К−: 2Na + + 2e− = 2Na0
А+: 2Cl− − 2e− = Cl2
Суммарное уравнение электролиза:
При опускании в расплав угольных (инертных) электродов, присоединенных к источнику тока, ионы приобретают направленное движение: катионы движутся к отрицательно заряженному электроду (катоду), анионы — к положительно заряженному электроду (аноду) и отдают электроны.
Теперь давайте рассмотрим электролиз расплава гидроксида калия.
На катоде происходит восстановление калия за счет принятия электронов. А на аноде протекает более сложная реакция. Гидроксогруппы отдают свой электрон и становятся нейтральными, но такое состояние для них крайне невыгодно, так как неустойчиво, и они объединяются в группы, чтобы потом разложиться с выделением газообразного кислорода и воды
Итог электролиза расплава — металлический калий на катоде, газообразный кислород и пары воды на аноде.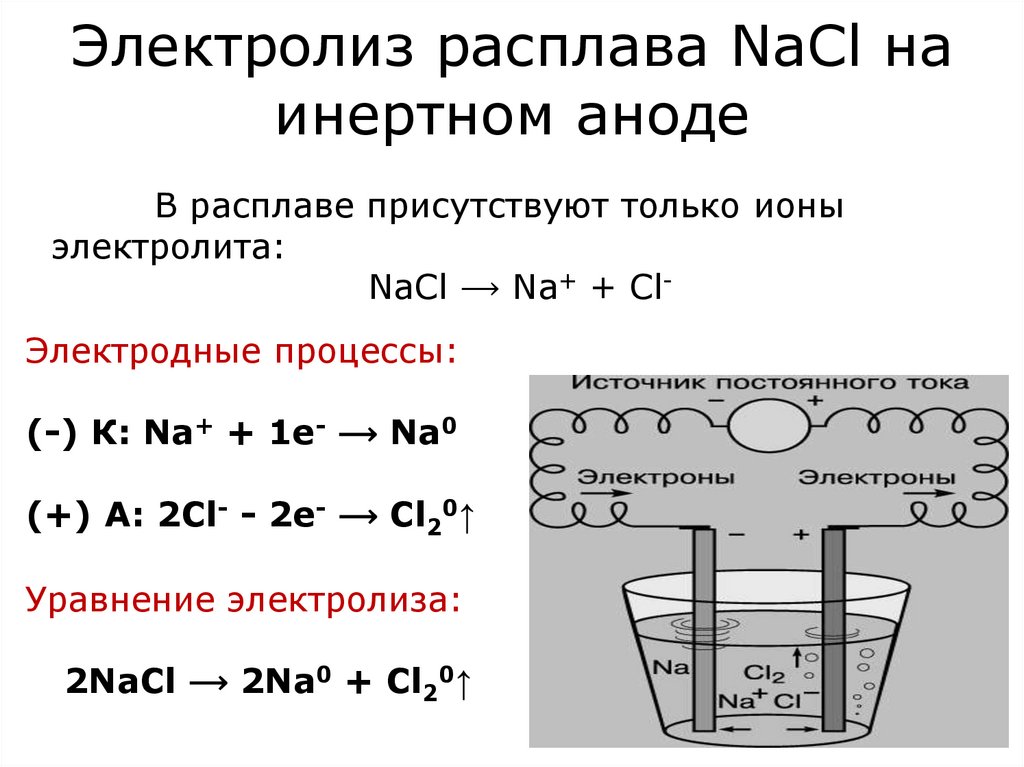
Электролиз раствора
Основным отличием водного раствора от расплава является присутствие молекул воды и ионов H+ и OH– как продуктов диссоциации воды. В связи с этим возле катода и анода скапливаются ионы, которые конкурируют как друг с другом, так и с молекулами воды. Рассмотрим электролиз на примере водного раствора KF:
К−: 4H2O + 4e− = 2H20 + 4OH−
А+: 2H2O − 4e− = O2 + 4H+
Суммарное уравнение электролиза:
Как видно, ни калий, ни фтор не фигурируют в продуктах электролиза. Почему так происходит?
Наиболее активные металлы — сильные восстановители. Калий — как раз такой металл, поэтому обратный процесс восстановления активных металлов из соединений осуществить сложно. При электролизе водных растворов солей активных металлов на катоде протекает восстановление не катионов этих металлов, а воды с образованием водорода.
Разберем порядок восстановления катионов металлов на катоде в зависимости от их активности.
Последовательность разрядки катионов зависит от положения металла в электрохимическом ряду напряжения.
Если у катода накапливаются молекулы воды и катионы металла, который находится в ряду напряжения после водорода, то восстанавливаются ионы металла.
Если у катода накапливаются молекулы воды и катионы металла, который стоит в начале ряда напряжения от лития до алюминия включительно, то восстанавливаются ионы водорода из молекул воды. Катионы металла
Если у катода накапливаются молекулы воды и катионы металла, который расположен в ряду напряжения между алюминием и водородом, то восстанавливаются и ионы металла, и частично ионы водорода из молекул воды.

Если в растворе находится смесь катионов разных металлов, то сначала восстанавливаются катионы менее активного металла.
При электролизе раствора кислоты на катоде восстанавливаются катионы водорода до газообразного водорода.
Для удобства мы собрали информацию об электролизе в таблице:
Теперь разберемся, что происходит с анионами в водных растворах при электролизе. Для начала познакомимся с последовательностью восстановления анионов на аноде:
Чем меньше выражена восстановительная активность, тем хуже анионы могут окисляться на аноде. К тому же процесс на аноде зависит от материала анода и от природы аниона.
Если анод инертный или нерастворимый, то на нем протекают следующие реакции:
При электролизе растворов солей бескислородных кислот (кроме фторидов!), на аноде происходит процесс окисления аниона.

При электролизе растворов солей кислородсодержащих кислот и фторидов на аноде выделяется газообразный кислород вследствие окисления молекул воды. Анион при этом не окисляется, оставаясь в растворе.
При электролизе растворов щелочей происходит окисление гидроксид-ионов.
Если анод растворимый, то на нем всегда происходит окисление металла анода — независимо от природы аниона.
Исключением является электролиз солей карбоновых кислот. Таблица выше не описывает происходящее на аноде. Давайте рассмотрим, что же там происходит.
В результате электролиза водных растворов солей щелочных металлов карбоновых кислот происходит образование углеводородов вследствие рекомбинации углеводородных радикалов.
В общем виде электролиз солей карбоновых кислот можно записать так:
На катоде образуется газообразный водород, а на аноде — углекислый газ, углеводород, полученный удвоением радикала.
В случае разделения катодного и анодного пространства углекислый газ реагирует со щелочью с образованием гидрокарбоната.
Применение электролиза
А теперь самое главное: зачем вообще нужен электролиз? Рассмотрим применение этого вида ОВР:
С помощью электролиза расплавов природных соединений в металлургической промышленности получают активные металлы (калий, натрий, бериллий, кальций, барий). С помощью электролиза растворов солей — цинк, кадмий, кобальт и другие.
В химической промышленности электролиз используют для получения фтора, хлора, водорода, кислорода, щелочей, бертолетовой соли и других веществ.
Электролиз с растворимым анодом используют для нанесения металлических покрытий (из хрома, золота, никеля, серебра), что предохраняет металлические изделия от коррозии и придает им декоративный вид.

Вопросы для самопроверки
1. Выберите верное продолжение фразы «катод — это…»:
Положительно заряженный электрод, к которому притягиваются положительно заряженные ионы.
Положительно заряженный электрод, к которому притягиваются отрицательно заряженные ионы.
Отрицательно заряженный электрод, к которому притягиваются положительно заряженные ионы.
Отрицательно заряженный электрод, к которому притягиваются отрицательно заряженные ионы.
2. Продолжите фразу «электролиз — это…»:
- ОВР с применением тока.
Реакция без изменения степеней окисления с применением тока.
ОВР с применением катализаторов.

Обменная реакция.
3. Как заряжен анион?
Положительно.
Отрицательно.
Нейтрально.
Не имеет заряда.
4. Чем отличается электролиз раствора от электролиза расплава?
Ничем.
В расплаве плавится твердое.
Присутствием молекул воды и продуктов ее диссоциации.
5. Если металл стоит в ряду активности металлов между алюминием и водородом, что выделится на катоде?
Этот металл.
Водород.
Металл и водород.

Оксид металла.
При электролиза водного раствора фторида лития что на аноде выделится?
Фтор.
Водород.
Кислород.
Вода.
Ответы
c
a
b
c
c
с
Ксения Боброва
К предыдущей статье
Азот
К следующей статье
Изомеры
Получите план обучения, который поможет понять и полюбить химию
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
Электролиз – схема, продукты, суть процесса (химия, 11 класс)
4. 6
6
Средняя оценка: 4.6
Всего получено оценок: 1031.
4.6
Средняя оценка: 4.6
Всего получено оценок: 1031.
Электролиз – процесс, при котором электрическая энергия преобразуется в химическую. Этот процесс протекает на электродах под действием постоянного тока. Каковы продукты электролиза расплавов и растворов, и что входит в понятие «электролиз».
Электролиз расплавов солей
Электролиз – это окислительно-восстановительные реакции протекающие на электродах при пропускании постоянного электрического тока через раствор или расплав электролита.
Рис. 1. Понятие электролиза.Хаотическое движение ионов под действием тока делается упорядоченным. Анионы движутся к положительному электроду (аноду) и окисляются на нем, отдавая электроны. Катионы движутся к отрицательному полюсу (катоду) и восстанавливаются на нем, принимая электроны.
Электроды могут быть инертными (металлическими из платины или золота или неметаллическими из угля или графита) или активными. Анод в этом случае растворяется в процессе электролиза (растворимый анод). Его изготавливают из таких металлов, как хром, никель, цинк, серебро, медь и т. д.
Анод в этом случае растворяется в процессе электролиза (растворимый анод). Его изготавливают из таких металлов, как хром, никель, цинк, серебро, медь и т. д.
При электролизе расплавов солей, щелочей, оксидов катионы металлов разряжаются на катоде с образованием простых веществ. Электролиз расплавов является промышленным способом получения таких металлов, как натрий, калий, кальций (электролиз расплавов солей) и алюминий (электролиз расплава оксида алюминия Al2O3 в криолите Na3AlF6, используемом для облегчения переведения оксида в расплав). Например, схема электролиза расплава поваренной соли NaCl происходит так:
NaCl Na+ + Cl–
Катод (–) (Na+): Na+ + е = Na0
Анод (–) (Cl–): Cl– – е = Cl0, 2Cl0 = Cl2
Суммарный процесс:
2Na+ +2Cl- = электролиз 2Na + 2Cl2
или
2NaCl = электролиз 2Na + Cl2
Одновременно с получением щелочного металла натрия при электролизе соли получают хлор.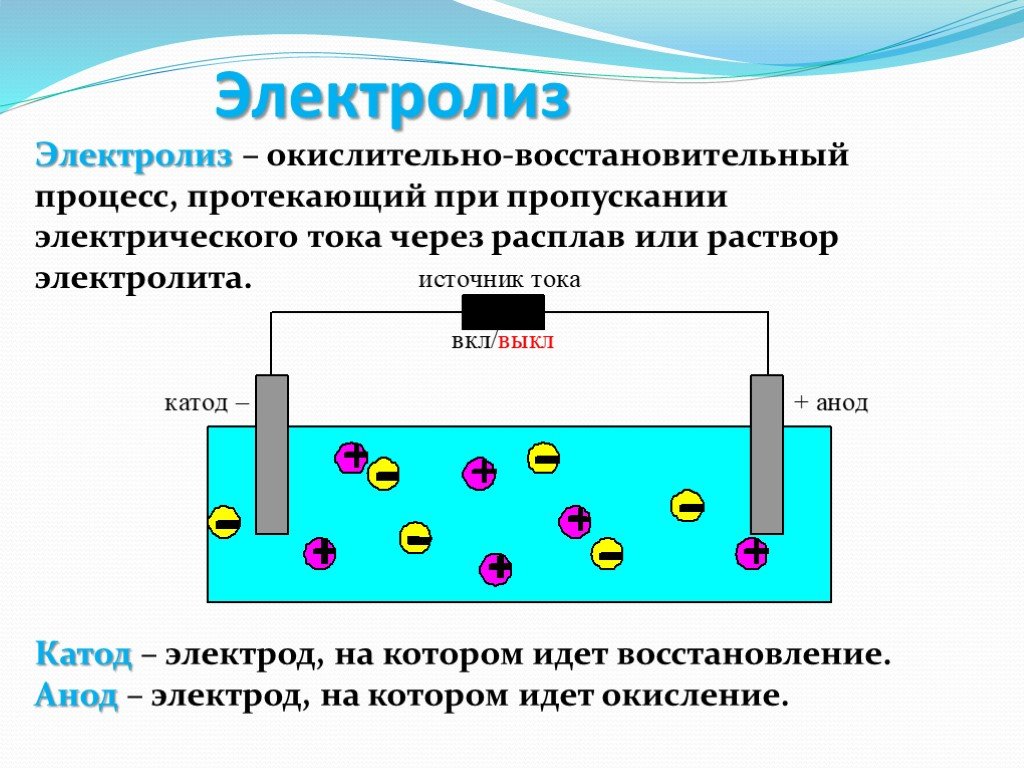
Электролиз растворов солей
Если электролизу подвергаются растворы солей, то, наряду с ионами, образующимися при диссоциации соли, окисляться или восстанавливаться на электродах может и вода.
Существует определенная последовательность разряжения ионов на электродах в водных растворах.
1. Чем выше стандартный электродный потенциал металла, тем легче он восстанавливается. Иначе говоря, чем правее стоит металл в электрохимическом ряду напряжений, тем легче его ионы будут восстанавливаться на катоде. При электролизе растворов солей металлов от лития до алюминия включительно на катоде всегда восстанавливаются молекулы воды:
2H2O+2e=H2+2OH-
Если электролизу подвергаются растворы солей металлов, начиная с меди и правее меди, на катоде восстанавливаются только катионы металлов. При электролизе солей металлов от марганца MN до свинца Pb могут восстанавливаться как катионы металлов, так, в некоторых случаях, и вода.
2. На аноде окисляются анионы кислотных остатков (кроме F-). Если электролизу подвергаются соли кислородосодержащих кислот, то анионы кислотных остатков остаются в растворе, окисляется вода:
Если электролизу подвергаются соли кислородосодержащих кислот, то анионы кислотных остатков остаются в растворе, окисляется вода:
2H2O-4e=O2+4H+
3. Если анод растворимый, то происходит окисление и растворение самого анода:
Cu-2e=Cu2+
Пример: электролиз водного раствора сульфата натрия Na2SO4:
Рис. 2. Электролиз водного раствора сульфата натрия.Так происходит электролиз, если катодное и анодное пространства разделены. Если же они не разделены происходит электролиз воды:
2H2O=(Na2SO4)= 2H2+O2
Электролиз используют для покрытия металла медью и золотом
Что мы узнали?
По химии 11 класса обязательной является тема «Электролиз». Суть процесса заключается в том, что беспорядочное движение ионов в электролите под действием электрического поля превращается в направленное.
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
Larisa Loginova
10/10
Максим Шахбанов
9/10
Екатерина Давыдова
7/10
Никита Кузнецов
9/10
Елена Се
9/10
Оксана Колесникова
10/10
Оценка доклада
4.6
Средняя оценка: 4.6
Всего получено оценок: 1031.
А какая ваша оценка?
Электролиз | Определение, использование и факты
- Развлечения и поп-культура
- География и путешествия
- Здоровье и медицина
- Образ жизни и социальные вопросы
- Литература
- Философия и религия
- Политика, право и правительство
- Наука
- Спорт и отдых
- Технология
- Изобразительное искусство
- Всемирная история
- Этот день в истории
- Викторины
- Подкасты
- Словарь
- Биографии
- Резюме
- Популярные вопросы
- Инфографика
- Демистификация
- Списки
- #WTFact
- Товарищи
- Галереи изображений
- Прожектор
- Форум
- Один хороший факт
- Развлечения и поп-культура
- География и путешествия
- Здоровье и медицина
- Образ жизни и социальные вопросы
- Литература
- Философия и религия
- Политика, право и правительство
- Наука
- Спорт и отдых
- Технология
- Изобразительное искусство
- Всемирная история
- Britannica объясняет
В этих видеороликах Britannica объясняет различные темы и отвечает на часто задаваемые вопросы.
- Britannica Classics
Посмотрите эти ретро-видео из архивов Encyclopedia Britannica. - Demystified Videos
В Demystified у Britannica есть все ответы на ваши животрепещущие вопросы. - #WTFact Видео
В #WTFact Britannica делится некоторыми из самых странных фактов, которые мы можем найти. - На этот раз в истории
В этих видеороликах узнайте, что произошло в этом месяце (или любом другом месяце!) в истории.
- Студенческий портал
Britannica — это главный ресурс для учащихся по ключевым школьным предметам, таким как история, государственное управление, литература и т. д. - Портал COVID-19
Хотя этот глобальный кризис в области здравоохранения продолжает развиваться, может быть полезно обратиться к прошлым пандемиям, чтобы лучше понять, как реагировать сегодня. - 100 женщин
Britannica празднует столетие Девятнадцатой поправки, выделяя суфражисток и политиков, творящих историю.
- Спасение Земли
Британника представляет список дел Земли на 21 век. Узнайте об основных экологических проблемах, стоящих перед нашей планетой, и о том, что с ними можно сделать! - SpaceNext50
Britannica представляет SpaceNext50. От полета на Луну до управления космосом — мы изучаем широкий спектр тем, которые питают наше любопытство к космосу!
Содержание
- Введение
Краткие факты
- Связанный контент
Викторины
- Электричество: короткое замыкание и постоянный ток
- Типы химических реакций
Определение, процесс, уравнения, примеры и приложения
- Что такое электролиз
- Как работает электролиз
- Примеры электролиза [1-4]
- Законы электролиза [1]
- Применение электролиза [6]
Что такое электролиз
Электролиз разделяет химически связанные ионные вещества и соединения, пропуская через них электрический ток. Он использует постоянный ток (DC) для управления неспонтанной реакцией, происходящей во время процесса [1-4] .
Он использует постоянный ток (DC) для управления неспонтанной реакцией, происходящей во время процесса [1-4] .
Английский физик Майкл Фарадей популяризировал электролиз в 19 веке.
Как работает электролиз
Электролиз проводится в электролитической ячейке, состоящей из положительно заряженного анода и отрицательно заряженного катода. Чтобы произошел электролиз, соединение должно содержать ионы. Наличие электролита необходимо, так как он состоит из ионных соединений со свободными ионами. Внешний источник питания, такой как батарея, также требуется для питания угольных электродов и работы ячейки. Затем электрическая энергия преобразуется в химическую энергию, и клетка совершает электрическую работу 9.0159 [1-4] .
Ионный обмен
Основным механизмом электролиза является обмен ионами и атомами, приводящий к окислительно-восстановительной реакции. Химическое изменение происходит, когда атомы и ионы теряют или приобретают электроны. Положительно заряженные ионы или катионы движутся к отрицательно заряженному катоду. Они принимают электроны и нейтрализуют. Этот процесс известен как восстановление, и говорят, что катионы восстанавливаются.
Положительно заряженные ионы или катионы движутся к отрицательно заряженному катоду. Они принимают электроны и нейтрализуют. Этот процесс известен как восстановление, и говорят, что катионы восстанавливаются.
С другой стороны, отрицательно заряженные ионы движутся к положительно заряженному аноду. Они теряют электроны и окисляются, процесс, известный как окисление. Образование нейтральных атомов из ионов на электродах называется разрядкой.
Ионные полууравнения
Ионные полууравнения представляют собой процесс окисления и восстановления. Предположим, что M + — это ион металла, который получает электроны (e — ) на катоде, образуя нейтральный атом (M). Тогда полуреакция определяется выражением
M + + e – → M
Предположим, что X – представляет собой отрицательно заряженный неметалл, который теряет электроны на аноде и превращается в нейтральный атом (X). . Тогда полууравнение задается выражением
X – → X + e –
ЭлектролизПрогнозирование продуктов электролиза
На электродах ионы приобретают или теряют электроны, становятся нейтральными и отделяются от раствора. Обычно легко предсказать продукты при электролизе расплавленных электролитов, потому что соединения расщепляются на свои элементы. Металлическая часть осаждается как твердый металл. Неметаллическая часть выделяется в виде газа. Электролиз водных ионных соединений сложен. Вода производит ионы водорода (H + ) и ионов гидроксида (ОН – ) и конкурирует с первичным соединением. Следовательно, газы водорода (H 2 ) и кислорода (O 2 ) также могут выделять [5] .
Обычно легко предсказать продукты при электролизе расплавленных электролитов, потому что соединения расщепляются на свои элементы. Металлическая часть осаждается как твердый металл. Неметаллическая часть выделяется в виде газа. Электролиз водных ионных соединений сложен. Вода производит ионы водорода (H + ) и ионов гидроксида (ОН – ) и конкурирует с первичным соединением. Следовательно, газы водорода (H 2 ) и кислорода (O 2 ) также могут выделять [5] .
Примеры электролиза
[1-4]1. Вода (H
2 O) Вода может подвергаться электролизу в присутствии электролита, такого как кислота или основание. Присутствие кислоты улучшает электропроводность за счет увеличения количества ионов водорода (H + ) концентрация. Примерами таких электролитов являются серная кислота (H 2 SO 4 ) и соль азотнокислого натрия (NaNO 3 ). Полуреакции приведены ниже.
На катоде:
2 H + (водн.) + 2 e – → H 2 (g)
Газообразный водород (H 2 ) будет выделяться на катоде.
На аноде:
2 H 2 O (л) → O 2 (г) + 4 H + (водн.) + 4 e –
Газообразный кислород (O 2 ) будет выделяться на аноде.
Общая химическая реакция:
2 H 2 O (ж) → 2 H 2 (г) + O моль кислорода выделяется. Количество образующихся молей водорода в два раза превышает количество кислорода. Также заряды передаются между электродами и электролитом. На каждый моль водорода с катода в электролит переносится 2 электрона. На каждый моль кислорода из электролита на анод переносится 4 электрона.
2. Водный раствор хлорида натрия (NaCl)
При электролизе водного раствора хлорида натрия необходимо учитывать электролиз воды. Поскольку вода может как окисляться, так и восстанавливаться, она будет конкурировать с хлоридом натрия. Однако, поскольку натрий более реакционноспособен, чем водород, на катоде будет выделяться газообразный водород.
Однако, поскольку натрий более реакционноспособен, чем водород, на катоде будет выделяться газообразный водород.
На катоде:
2 H 2 O (ж) + 2 e – → H 2 (г) + 2 OH – (водн.)
На аноде13:
2 Cl – (водн.) → Cl 2 (г) + 2 e –
Общая химическая реакция может быть записана как
2 H 2 O (л) + 2 Cl – (водн.) → H 2 (г) + Cl 2 (г) + 2 OH – (водн.)
Следовательно, электролиз водного раствора хлорида натрия дает гидроксид натрия, водород, и хлор.
3. Расплавленный хлорид натрия (NaCl)
Хлорид натрия расплавляют до расплавленного состояния при температуре выше 800 ˚C перед проведением электролиза.
Положительно заряженные ионы натрия (Na + ) мигрируют к отрицательно заряженному катоду и восстанавливаются до атомов натрия (Na), образуя металлический натрий.
Na + (ж) + e – → Na (ж)
Отрицательно заряженные ионы хлора (Cl – ) мигрируют в обратном направлении к аноду и образуют газообразный хлор (Cl 2 ).
2 Cl – (л) → Cl 2 (г) + 2e –
Общая химическая реакция представлена в виде,
2 NaCl (ж) → 2 Na (т) + Cl 2 (г)
Таким образом, электролиз расплавленного хлорида натрия дает металлический натрий и газообразный хлор.
Законы электролиза
[1]Во время электролиза заряды переносятся между электродами и электролитом и протекают через электролит. Количество заряда, протекающего в единицу времени, называется током. На основании своих опытов Фарадей предложил два закона, регулирующих силу тока и массу продуктов, образующихся на электродах.
- Масса продуктов, образующихся при электролизе, пропорциональна току, проходящему через электролит.
- Если ток остается фиксированным, вес образующихся продуктов пропорционален эквивалентному весу каждого продукта.
Эквивалентный вес каждого продукта определяется как молярная масса, деленная на количество электронов, необходимых для его нейтрализации.
Применение электролиза
[6]1. Извлечение, очистка или очистка металлов : Анод представляет собой нечистый металл или руду, а электролит представляет собой соль извлекаемого металла. Чистый металл осаждается на катоде. Таким способом извлекают алюминий. Медь можно очистить, взяв в качестве электролита разбавленный водный раствор сульфата меди и серной кислоты.
2. Производство чистых химических веществ : Многие химические вещества, такие как гидроксид натрия, каустическая сода, перманганат калия и хлорат калия, а также газы, такие как кислород и хлор, производятся в промышленности.
3. Гальваническое покрытие : Это процесс украшения дешевых металлов, таких как железо, драгоценными металлами, такими как никель, хром, золото или серебро. Он используется для изготовления украшений, посуды и автозапчастей.
4. Гальванопластика : Воспроизведение таких предметов, как монеты и медали, путем электроосаждения на форму.



