Электролиз. Базовое представление
Электролиз — это процесс разложения вещества под действием электрического тока (electric current).
История открытия электролиза
Слово электролиз происходит от греческого (ἤλεκτρον) [ɛ̌ːlektron] “янтарь” и λύσις [lýsis] “растворение”.
Небольшая хронология истории электролиза:
- 1785 г. – Мартинуса ван Марум использовал электростатический генератор, чтобы осадить (извлечь) олово, цинк и сурьму из их солей с использованием электролиза (Энциклопедия Британника 3-е издание (1797), том 1, стр 225).
- 1800 г. — Уильям Николсон и Энтони Карлайл (при участии Иоганн Риттер) разложили воду на водород и кислород.
- 1807 г. — такие химические элементы как: калия, натрия, бария, кальция и магния были обнаружены сэром Хамфри Дэви с помощью электролиза.
- 1833 г. — Майкл Фарадей открывает свои два закона электролиза, и даёт их математическую формулировку и объяснение.
- 1875 г. — Поль Эмиль Лекок де Буабодран обнаружили галлий с помощью электролиза.
- 1886 г. — был обнаружен Фтор Анри Муассаном с помощью электролиза.
- 1886 г. — Разработан процесс Холла-Эру для получения алюминия из глинозёма.
- 1890 г. — Разработан Castner–Kellner процесс получения гидроксида натрия.
Краткое описание электролиза
Электролиз происходит при прохождении постоянного (прямого) электрического тока через ионизированное вещество, которое может быть или расплавом, или раствором, в котором это самое вещество распадается на ионы (электролитическая диссоциация молекул) и представляет собой электролит. При прохождении электрического тока через такое состояние вещества, когда оно представлено ионами, происходит электрохимическая реакция окисления и восстановления.
На одном электроде ионы одного вида будут окислятся, а на другом восстанавливаться, что весьма часто проявляется в виде выделения газов, или выпадением вещества в виде нерастворимого химического осадка. При электролизе ионы, называемые анионами получают недостающие им электроны и перестают быть ионами, а ионы другого вида — катионы, отдают лишние электроны и также перестают после этого быть ионами.
Электролиз не может происходить там, где отсутствуют ионы, например в кристалле соли, или в твёрдых полимерах (смолы, пластмассы). Если кристалл соли растворить в подходящем растворителе, в котором он распадётся на ионы, то в такой жидкой среде возможен процесс электролиза, так как раствор представляет собой электролит. Все электролиты являются проводниками второго рода, в которых может существовать электрический ток.
Для процесса электролиза необходимо как минимум два электрода, которые представляют собой источник тока. Между этими двумя электродами через электролит или расплав протекает электрический ток, а наличие только одного электрода не обеспечивает замкнутую электрическую цепь, и потому ток протекать не может.
В качестве электродов могут быть использованы любые материалы обеспечивающие достаточную проводимость. Это могут быть металлы и их сплавы, графит, полупроводниковые материалы. Электрохимические свойства электродов имеют решающее значение в коммерческом (промышленном) использовании электролиза, так как могут существенно снизить стоимость производства, улучшить качество и скорость электрохимического процесса, которым и является электролиз.
Процесс электролиза
Вся суть процесса электролиза заключается в превращении ионов раствора (расплава) в атомы через добавление или отнятие электронов. Такое изменение происходит благодаря внешней электрической цепи, в которой существует электрический ток. В такой цепи обязательно имеется источник электричества, который является поставщиком электронов на одном электроде — катоде, и своеобразным насосом выкачивающем электроны на другом электроде — аноде. На катоде всегда избыток электронов и в его сторону движутся катионы (+), чтобы получить недостающие электроны и стать атомами, а на аноде — недостаток электронов и в его сторону движутся анионы (-), которые имеют лишние электроны на своей орбите, с тем, чтобы отдать их и стать нейтральными атомами.
В результате электрический ток в жидкости приводит к химическим превращениям веществ, то есть происходит химическая реакция. Любая химическая реакция связана с электричеством. Атомы и молекулы меняют свои заряды (валентность), окисляются и восстанавливаются, если говорить языком химии.
Очень часто процесс электролиза сопровождается физическим явлением газообразования. Например, при электролизе раствора поваренной соли в воде образуются газообразные хлор и водород. Во всяком случае, когда используются водные растворы (электролиты), будет на катоде выделятся водород. При использовании в качестве электролита раствора медного купороса CuSO4 (сульфат меди II) на катоде будет осаждаться кристаллическая медь.
Процесс электролиза является обратным тому процессу, который происходит в гальванических элементах при их использовании. Если при электролизе восстанавливается цинк, то в гальваническом элементе он окисляется.
Энергетические затраты
Процесс электролиза — это в основном энергозатратный процесс, при котором тратится энергия на окислительно восстановительные реакции химических элементов. Так, например, при электролизе воды будет восстанавливаться водород и окислятся кислород. Если весь полученный водород и кислород в результате электролиза сжечь, то будет выделена теплота (энергия), которая была затрачена при электролизе.
Электролиз как технический процесс имеет сопутствующие затраты энергии, которые могут быть уменьшены. Эти затраты являются паразитными, к таким относится нагрев электролита при прохождении через него электрического тока. Все побочные затраты теоретически могут быть сведены к нулю. Однако, как и любой другой технический процесс, электролиз не может иметь КПД более 100%.
В некоторых случаях, например при электролизе водяного пара при высокой температуре, тепловая энергия поглощается извне, и поэтому при сгорании полученного водорода выделяется больше тепла, чем было затрачено на электролиз.
Законы Фарадея
В 1832 году Майкл Фарадей объявил всему научному миру свои два закона электролиза.
Первый закон электролиза:
Масса вещества, образующегося на электроде прямо пропорциональна количеству электричества прошедшему через расплав (электролит).
Второй закон электролиза:
Электрохимические эквиваленты различных веществ пропорциональны их молярным массам и обратно пропорциональны числам, выражающим их химическую валентность.
Эти два закона позволяют определить количество электричества (в кулонах), которое необходимо пропустить через расплав (электролит), чтобы получить определённое количество вещества так или иначе выделенного на электроде.
Одинаковое количество электричества в электролизе приведёт к восстановлению или окислению различной массы вещества в зависимости от малярной массы и валентности. Чем меньше валентность и чем больше молярная масса вещества, тем меньшее количество электричества требуется для восстановления (окисления) одного грамма этого вещества.
Дата: 17.06.2015
© Valentin Grigoryev (Валентин Григорьев)
Электролиз — Большая советская энциклопедия
Электро́лиз
(от Электро… и греч. lysis — разложение, растворение, распад)
совокупность процессов электрохимического окисления-восстановления (См. Окисление-восстановление) на погруженных в электролит (См. Электролиты) электродах при прохождении через него электрического тока. Э. лежит в основе электрохимического метода лабораторного и промышленного получения различных веществ — как простых (Э. в узком смысле слова), так и сложных (Электросинтез).
Изучение и применение Э. началось в конце 18 — начале 19 вв., в период становления электрохимии (См. Электрохимия). Для разработки теоретических основ Э. большое значение имело установление М. Фарадеем (См. Фарадей) в 1833—34 точных соотношений между количеством электричества, прошедшего при Э., и количеством вещества, выделившегося на электродах (см. Фарадея законы) . Промышленное применение Э. стало возможным после появления в 70-х гг. 19 в. мощных генераторов постоянного тока.
Особенность Э. — пространственное разделение процессов окисления и восстановления: электрохимическое окисление происходит на аноде, восстановление — на катоде. Э. осуществляется в специальных аппаратах — электролизёрах (См. Электролизёры).
Э. происходит за счёт подводимой энергии постоянного тока и энергии, выделяющейся при химических превращениях на электродах. Энергия при Э. расходуется на повышение гиббсовой энергии (См. Гиббсова энергия) системы в процессе образования целевых продуктов и частично рассеивается в виде теплоты при преодолении сопротивлений в электролизёре и в других участках электрической цепи.
На катоде в результате Э. происходит восстановление ионов или молекул электролита с образованием новых продуктов. Катионы принимают электроны и превращаются в ионы более низкой степени окисления или в атомы, например при восстановлении ионов железа (F
Скорости электродных реакций зависят от состава и концентрации электролита, от материала электрода, электродного потенциала, температуры и ряда других факторов. Скорость каждой электродной реакции определяется скоростью переноса электрических зарядов через единицу поверхности электрода в единицу времени; мерой скорости, следовательно, служит плотность тока.
Количество образующихся при Э. продуктов определяется законами Фарадея. Если на каждом из электродов одновременно образуется ряд продуктов в результате нескольких электрохимических реакций, доля тока (в %), идущая на образование продукта одной из них, называется выходом данного продукта по току.
Преимущества Э. перед химическим методами получения целевых продуктов заключаются в возможности сравнительно просто (регулируя ток) управлять скоростью и селективной направленностью реакций. Условия Э. легко контролировать, благодаря чему можно осуществлять процессы как в самых «мягких», так и в наиболее «жёстких» условиях окисления или восстановления, получать сильнейшие окислители и восстановители, используемые в науке и технике. Э. — основной метод промышленного производства алюминия, хлора и едкого натра, важнейший способ получения фтора, щелочных и щелочноземельных металлов, эффективный метод рафинирования металлов. Путём Э. воды производят водород и кислород. Электрохимический метод используется для синтеза органических соединений различных классов и многих окислителей (персульфатов, перманганатов, перхлоратов, перфторорганических соединений и др.). Применение Э. для обработки поверхностей включает как катодные процессы гальванотехники (См. Гальванотехника) (в машиностроении, приборостроении, авиационной, электротехнической, электронной промышленности), так и анодные процессы полировки, травления, размерной анодно-механической обработки (См. Анодно-механическая обработка), оксидирования (анодирования (См. Анодирование)) металлических изделий (см. также Электрофизические и электрохимические методы обработки). Путём Э. в контролируемых условиях осуществляют защиту от коррозии металлических сооружений и конструкций (анодная и катодная защита).
Лит. см. при ст. Электрохимия.
Э. В. Касаткин.
Источник: Большая советская энциклопедия на Gufo.me
Значения в других словарях
- электролиз — ЭЛЕКТРОЛИЗ, а, м. (спец.). Разложение (растворение, распад) вещества на составные части при прохождении через него электрического тока. | прил. электролизный, ая, ое и электролитический, ая, ое. Толковый словарь Ожегова
- электролиз — Электр/о́/лиз/. Морфемно-орфографический словарь
- электролиз — -а, м. Химические процессы, протекающие в электролитах и на погруженных в них электродах при прохождении через электролиты постоянного электрического тока. [От греч. ’ήλεκτρον — янтарь и λύσις — разложение] Малый академический словарь
- электролиз — Электролиз, электролизы, электролиза, электролизов, электролизу, электролизам, электролиз, электролизы, электролизом, электролизами, электролизе, электролизах Грамматический словарь Зализняка
- ЭЛЕКТРОЛИЗ — Совокупность электрохим. процессов, проходящих на электродах, погружённых в электролит, при прохождении по нему электрич. тока. В результате этих процессов в-ва, входящие в состав электролита, выделяются в свободном виде. Физический энциклопедический словарь
- ЭЛЕКТРОЛИЗ — ЭЛЕКТРОЛИЗ, ХИМИЧЕСКАЯ РЕАКЦИЯ, происходящая при прохождении постоянного тока через ЭЛЕКТРОЛИТ. Процесс заключается в перемещении положительных ионов к отрицательному ЭЛЕКТРОДУ (КАТОДУ) и отрицательных ионов к положительному электроду (АНОДУ). Научно-технический словарь
- электролиз — ЭЛЕКТР’ОЛИЗ, электролиза, мн. нет, ·муж. (от слова электрический и ·греч. lysis — растворение) (физ.). Разложение вещества на составные части при прохождении через его раствор электрического тока. Толковый словарь Ушакова
- электролиз — ЭЛЕКТРОЛИЗ -а; м. [от сл. электрический и lysis — разложение, отделение] Спец. Химические процессы (разложение, распад вещества), протекающие на погружённых в электролит электродах при прохождении электрического тока. ◁ Электролитический (см.). Толковый словарь Кузнецова
- ЭЛЕКТРОЛИЗ — ЭЛЕКТРОЛИЗ (от электро… и…лиз) — совокупность процессов электрохимического окисления — восстановления, происходящих на погруженных в электролит электродах при прохождении электрического тока. Большой энциклопедический словарь
- электролиз — ЭЛЕКТРОЛИЗ совокупность электрохим. окислительно-восстановит. процессов, происходящих при прохождении электрич. тока через электролит с погруженными в него электродами. Химическая энциклопедия
- электролиз — сущ., кол-во синонимов: 1 гальванолиз 1 Словарь синонимов русского языка
- электролиз — орф. электролиз, -а Орфографический словарь Лопатина
- электролиз — электролиз м. Химический процесс разложения вещества на составные части при прохождении через него электрического тока. Толковый словарь Ефремовой
- электролиз — Электролиза, мн. нет, м. [от слова электрический и греч. lysis – растворение] (физ.). Разложение вещества на составные части при прохождении через его раствор электрического тока. Большой словарь иностранных слов
- Электролиз — См. Электролитическая диссоциация и Электрохимия. Энциклопедический словарь Брокгауза и Ефрона
- электролиз — ЭЛЕКТРОЛИЗ а, м. électrolyse f., > нем. Elektrolyse. Разложение веществ при помощи электрического тока на составные элементы (напр. воды на кислород и водород). Павленков 1911. Словарь галлицизмов русского языка

Электролиз Википедия
 | Эта страница требует существенной переработки. |
Электро́лиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор, либо расплав электролита.
Электролиз является одним из лучших способов золочения или покрытия металла медью, золотом.
Упорядоченное движение ионов в проводящих жидкостях происходит в электрическом поле, которое создаётся электродами — проводниками, соединёнными с полюсами источника электрической энергии. Катодом при электролизе называется отрицательный электрод, анодом — положительный[1]. Положительные ионы — катионы (ионы металлов, водородные ионы, ионы аммония и др.) — движутся к катоду, отрицательные ионы — анионы (ионы кислотных остатков и гидроксильной группы) — движутся к аноду.
Реакции, происходящие при электролизе на электродах, называются вторичными. Первичными являются реакции диссоциации в электролите. Разделение реакций на первичные и вторичные помогло Майклу Фарадею установить законы электролиза.
Применение[ | ]


Электролиз Википедия
Электро́лиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор, либо расплав электролита.
Электролиз является одним из лучших способов золочения или покрытия металла медью, золотом.
Упорядоченное движение ионов в проводящих жидкостях происходит в электрическом поле, которое создаётся электродами — проводниками, соединёнными с полюсами источника электрической энергии. Катодом при электролизе называется отрицательный электрод, анодом — положительный[1]. Положительные ионы — катионы (ионы металлов, водородные ионы, ионы аммония и др.) — движутся к катоду, отрицательные ионы — анионы (ионы кислотных остатков и гидроксильной группы) — движутся к аноду.
Реакции, происходящие при электролизе на электродах, называются вторичными. Первичными являются реакции диссоциации в электролите. Разделение реакций на первичные и вторичные помогло Майклу Фарадею установить законы электролиза.
Применение
Электролиз широко применяется в современной промышленности. В частности, электролиз является одним из способов промышленного получения алюминия, меди, водорода, диоксида марганца[2], пероксида водорода. Большое количество металлов извлекается из руд и подвергается переработке с помощью электролиза (электроэкстракция, электрорафинирование). Также электролиз является основным процессом, благодаря которому функционирует химический источник тока.
Электролиз находит применение в очистке сточных вод (процессы электрокоагуляции, электроэкстракции, электрофлотации).
Применяется для получения многих веществ (металлов, водорода, хлора и др.), при нанесении металлических покрытий (гальваностегия), воспроизведении формы предметов (гальванопластика).
Первый закон Фарадея
В 1832 году Фарадей установил, что масса m вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду q, прошедшему через электролит:
m = k ⋅ q = k ⋅ I ⋅ t {\displaystyle m=k\cdot q=k\cdot I\cdot t} , если через электролит пропускается в течение времени t постоянный ток с силой тока I.
Коэффициент пропорциональности k {\displaystyle k} называется электрохимическим эквивалентом вещества. Он численно равен массе вещества, выделившегося при прохождении через электролит единичного электрического заряда, и зависит от химической природы вещества.
Вывод закона Фарадея
- m = m i N i {\displaystyle m=m_{i}N_{i}} (1)
- m i = M / N a {\displaystyle m_{i}=M/N_{a}} (2)
- N i = Δ q q i {\displaystyle N_{i}={\frac {\Delta q}{q_{i}}}} (3)
- Δ q = I Δ t {\displaystyle \Delta q=I\Delta t} (4)
- q i = e z {\displaystyle q_{i}=ez} , (5)
- где z — валентность атома (иона) вещества,
- e — заряд электрона
- Подставляя (2)-(5) в (1), получим
- m = M z e N A I Δ t {\displaystyle m={\frac {M}{zeN_{A}}}I\Delta t}
- m = M z F I Δ t {\displaystyle m={\frac {M}{zF}}I\Delta t} ,
где F = e N A {\displaystyle F=eN_{A}} — постоянная Фарадея.
- k = M F z {\displaystyle k={\frac {M}{Fz}}}
- m = k I Δ t {\displaystyle m=kI\Delta t}
Второй закон Фарадея
Электрохимические эквиваленты различных веществ пропорциональны их молярным массам и обратно пропорциональны числам, выражающим их химическую валентность.
Химическим эквивалентом иона называется отношение молярной массы A {\displaystyle A} иона к его валентности z {\displaystyle z} . Поэтому электрохимический эквивалент
- k = 1 F ⋅ A z {\displaystyle k\ =\ {1 \over F}\cdot {A \over z}} ,
где F {\displaystyle F} — постоянная Фарадея.
Второй закон Фарадея записывается в следующем виде:
- m = M ⋅ I ⋅ Δ t n ⋅ F {\displaystyle m={\frac {M{\cdot }I{\cdot }{\Delta }t}{n{\cdot }F}}} ,
- где M {\displaystyle M} — молярная масса данного вещества, образовавшегося (однако не обязательно выделившегося — оно могло и вступить в какую-либо реакцию сразу после образования) в результате электролиза, г/моль
- I {\displaystyle I} — сила тока, пропущенного через вещество или смесь веществ (раствор, расплав), А
- Δ t {\displaystyle {\Delta }t} — время, в течение которого проводился электролиз, с
- F {\displaystyle F} — постоянная Фарадея, Кл·моль−1
- n {\displaystyle n} — число участвующих в процессе электронов, которое при достаточно больших значениях силы тока равно абсолютной величине заряда иона (и его противоиона), принявшего непосредственное участие в электролизе (окисленного или восстановленного)
- Однако это не всегда так; например, при электролизе раствора соли меди(II) может образовываться не только свободная медь, но и ионы меди(I) (при небольшой силе тока).
Изменение электролизом веществ
Не все вещества будут электролизироваться при пропускании электрического тока. Существуют некоторые закономерности и правила.
| Катионы активных металлов | Катионы менее активных металлов | Катионы неактивных металлов |
|---|---|---|
| Li+, Cs+, Rb+, K+, Ba2+, Sr2+, Ca2+, Na+, Mg2+, Be2+, Al3+ | Mn2+, Cr3+, Zn2+, Ga3+, Fe2+, Cd2+, In3+, Tl+, Co2+, Ni2+, Mo4+, Sn2+, Pb2+ | Bi3+, Cu2+, Ag+, Hg2+, Pd3+, Pt2+, Au3+ |
| Тяжело разряжаются (только из расплавов), в водном растворе электролизу подвергается вода с выделением водорода | В водном растворе восстанавливается металл (при малой концентрации катионов в растворе — металл и водород) | Легко разряжаются, и восстанавливается только металл |
| Анионы кислородсодержащих кислот и фторид-ион | Гидроксид-ионы; анионы бескислородных кислот (кроме F−) |
|---|---|
| PO43−, CO32−, SO42−, NO3−, NO2−, ClO4−, F− | OH−, Cl−, Br−, I−, S2− |
| Тяжело разряжаются (только из расплавов), в водном растворе электролизу подвергается вода с выделением кислорода | Легко разряжаются |
Примеры
Расплавы
Активные металлы, менее активные металлы и неактивные металлы в расплавах ведут себя одинаково.
Растворы
Активные металлы
Менее активные металлы и неактивные металлы
Мнемоническое правило
Для запоминания катодных и анодных процессов в электрохимии существует следующее мнемоническое правило:
- У анода анионы окисляются.
- На катоде катионы восстанавливаются.
В первой строке все слова начинаются с гласной буквы, во второй — с согласной.
Или проще:
- КАТод — КАТионы (ионы у катода)
- АНод — АНионы (ионы у анода)
Электролиз в газах
Электролиз в газах, при наличии ионизатора, объясняется тем, что при прохождении через них постоянного электрического тока наблюдается выделение веществ на электродах. Законы Фарадея в газах не действительны, но существуют несколько закономерностей:
- при отсутствии ионизатора электролиз проводиться не будет, даже при высоком напряжении;
- электролизу подвергаются только бескислородные кислоты в газообразном состоянии и некоторые газы;
- уравнения электролиза, как в электролитах, так и в газах, всегда остаются постоянными.
См. также
Примечания
- ↑ Обратное обозначение знака катода и анода встречается в литературе при описании гальванических элементов
- ↑ [www.xumuk.ru/encyklopedia/2/5329.html Электросинтез — Химическая энциклопедия]
Ссылки
| |||
| Некоторые внешние ссылки в этой статье ведут на сайты, занесённые в спам-лист.Эти сайты могут нарушать авторские права, быть признаны неавторитетными источниками или по другим причинам быть запрещены в Википедии. Редакторам следует заменить такие ссылки ссылками на соответствующие правилам сайты или библиографическими ссылками на печатные источники либо удалить их (возможно, вместе с подтверждаемым ими содержимым). Список проблемных ссылок
|
Электролиз солей
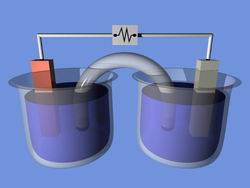
Самопроизвольные окислительно-восстановительные реакции дают возможность создания гальванических элементов, в которых вырабатывается электрическая энергия. Если же реакция несамопроизвольна, то ее осуществление возможно при помощи электрической энергии. Подобные процессы осуществляют в электролизерах и называются они реакциями электролиза.
Как видно на рисунке ниже, электролизер состоит из двух электродов, погруженных в расплав соли или ее водный раствор. Источник электрического тока передает электроны в один из электродов и удаляет их с другого. При отдаче электронов электрод заряжается положительно, а при получении электронов – отрицательно.
ЭлектролизерПри электролизе расплава NaCl на отрицательном электроде, происходит присоединение электронов ионом натрия Na+ и его восстановление. При этом вблизи электрода концентрация ионов Na+ уменьшается и, вследствие этого, к электроду перемещается дополнительное количество ионов Na+. Аналогично происходит миграция ионов Cl— к положительному электроду, где в результате отдачи электронов протекает процесс окисления. Таким образом, на электродах идет накопление продуктов окисления и восстановления.
Как и в гальваническом элементе, процесс восстановления протекает на катоде, а процесс окисления – на аноде.
При электролизе расплава NaCl протекают следующие реакции:
| Анод | 2Cl— -2e— → Cl20 |
| Катод | 2Na+ + 2e— → 2Na0 |
| 2Na+ + 2Cl— → 2Na0 + Cl20 |
В промышленности таким образом получают натрий, используя электролизер Даунса, представленный на рисунке ниже.
электролизер Даунса
Сложнее протекает электролиз водных растворов электролитов.
Так, например, при электролизе водного раствора хлорида натрия, происходят иные процессы, нежели при электролизе его расплава. На катоде происходит восстановление воды, а не натрия; на аноде происходит окисление хлорид-ионов:
| Анод | 2Cl— -2e— → Cl20 |
| Катод | 2H2O + 2e— → H20 +2OH— |
| 2H2O + 2Cl— → H20 + Cl20 |
Таким образом, получить натрий путем электролиза водного раствора его соли не удастся: на катоде выделяется водород, а на аноде хлор.
При электролизе водных растворов солей окислительно-восстановительные процессы, протекающие на катоде и аноде зависят от природы катионов металлов и характера аниона соли.
Процесс на катоде
Предсказать результат восстановительного процесса на катоде можно с помощью таблицы стандартных электродных потенциалов металлов:
- Катионы металлов, имеющие большую величину стандартного потенциала и расположенные в ряду после водорода полностью восстанавливаются на катоде и выделяются в виде металлов: Cu2+, Hg22+, Ag+, Hg2+, Pt2+ до Pt4+
- Катионы металлов, имеющие малую величину стандартного потенциала не восстанавливаются на катоде, вместо этого происходит восстановление воды: от Li+, Na+ … до Al3+ включительно.
- Катионы металлов, имеющие среднюю величину стандартного потенциала будут восстанавливаться на катоде вместе с молекулами воды: от Mn2+, Zn2+ … до H
Если имеется смесь катионов, то легче всего на катоде будут восстанавливаться катионы металла с наиболее положительным потенциалом, например, из смеси Cu2+, Ag+, Zn2+ сначала восстановится Ag+ (E = +0,79 В), затем Cu2+ (E = +0,337 В) и только потом Zn2+ (E = +0,76 В).
Процесс на аноде
Какие процессы будут протекать на аноде зависит от материала анода и самого электролита. Нерастворимые аноды в процессе электролиза не окисляются, тогда как растворимые аноды разрушаются и в виде ионов переходят в раствор.
Рассмотрим процессы, происходящие на инертном (нерастворимом) аноде:
- При электролизе бескислородных кислот и их солей (исключение HF и фториды) на аноде окисляются их анионы.
2Cl— -2e— = Cl2
- При электролизе кислородсодержащих кислот и их солей c максимальной степенью окисления на аноде происходит окисление воды, в связи с тем, что потенциал окисления воды меньше, чем для таких анионов.
2H2O -4e— = O2 + 4H+
- При электролизе кислородсодержащих кислот и их солей c промежуточной степенью окисления на аноде происходит окисление анионов кислот
SO32- + H2O -2e— = SO42- + 2H+
Ниже представлены наиболее типичные случаи электролиза с химической точки зрения
| Водный раствор соли малоактивного металла и бескислородной кислоты с инертным анодом | CuBr2 + H2O = Cu + Br2 + H2O K: Cu2+ + 2e— = Cu A: 2Br— -2e— = Br2 |
| Водный раствор соли активного металла и кислородсодержащей кислоты с инертным анодом | K2SO4 + 2H2O = K2SO4 + 2H2 + O2 K: 2H2O +2e— = H2 + 2OH— A: 2H2O -4e— = O2 + 4H+ Т.е. происходит разложение воды |
| Водный раствор соли активного металла и бескислородной кислоты с инертным анодом | KI + H2O = 2KOH + H2 + I2 K: 2H2O +2e— = H2 + 2OH— A: 2I— -2e— = I2 |
| Водный раствор соли малоактивного металла с анодом из того же металла | CuSO4 K: Cu2+ + 2e— = Cu A: Cu — 2e— = Cu2+ |
Количественные аспекты электролиза
Связь между количеством вещества, выделившегося при электролизе и количеством прошедшего через него электричества отражена в законах Фарадея.
I закон Фарадея Массы веществ (m), выделившихся на катоде или аноде (или образовавшиеся в катодном и анодном пространстве), пропорциональны количеству прошедшего через раствор или расплав электричества (Q):
m=kQ
где k – коэффициент пропорциональности или электрохимический эквивалент, численно равный массе вещества, которое выделяется при прохождении 1 кулона электричества.
II закон Фарадея Равные количества электричества в процессе электролиза выделяют эквивалентные количества различных веществ. Т.е. чтобы выделился один химический эквивалент любого соединения необходимо приложить одинаковое количество электричества, которое равно 96484,56 Кл/моль. Это величина называется постоянной Фарадея.
m = ЭIt/F = ЭIt/96484,56, где
m – масса вещества,
Э – электрохимический эквивалент,
I – сила тока,
t – время электролиза.
Законы Фарадея имеют большое значение при проведении расчетов, связанных с электролизом.
Каковы применения электролиза
Каковы применения электролиза
Использование электролиза
Процесс электролиза имеет множество важных промышленных применений. Вот некоторые из них:
- Электролиз используется в промышленности для производства многих металлов и неметаллов (например, алюминия, магния, хлора и фтора).
- Электролиз обычно используется для покрытия одного металла другим.Метод покрытия одного металла другим с помощью электрического тока называется гальваникой. Общая установка, используемая для нанесения гальванического покрытия на объект, показана на рисунке.
Гальваника используется следующим образом:
Гальваника используется для многих целей. Вот несколько примеров.
- Металлы, которые легко подвержены коррозии, защищены покрытием из металла, который не подвержен коррозии. Никель и хром широко используются в автомобильной промышленности для нанесения покрытий.
Применение гальваники
- Гальваника используется для украшения. Например, столовые приборы, статуи и украшения из более дешевых металлов покрываются дорогими металлами, такими как золото и серебро, чтобы улучшить их внешний вид.
- Гальваника используется при производстве печатных плат (небольшие схемы с компонентами, обычно печатаемыми на пластиковой плате), которые используются в телевизорах, компьютерах и т. Д.
Деятельность
Цель: Наблюдать за гальваникой меди по нержавеющей стали.
Необходимые материалы: 20 г сульфата меди, растворенного в 100 мл воды, медная полоска или медный стержень, два провода, батарея (3-5 вольт), химический стакан и объект для гальваники (ложка из нержавеющей стали или монета) ,
Метод:
1. В стакан возьмите раствор медного купороса.
2. Подключите медную полоску (действует как анод) к положительной клемме аккумулятора с помощью соединительного провода.
3. Аналогичным образом подключите объект, на который будет нанесено гальваническое покрытие (действует как катод), к отрицательной клемме аккумулятора с помощью соединительного провода.
4. Окуните медную полоску и объект, на который необходимо наносить гальваническое покрытие, в раствор сульфата меди.
5. Гальванировать 20-25 минут или до образования однородного коричневого налета металлической меди на объекте.
Электролиз используется при рафинировании нечистых металлов. Этот метод, называемый электрорафинированием, можно использовать для очистки металлов, таких как медь, золото и серебро. Вот как проводится очистка меди.
Деятельность
Цель: Наблюдать за осаждением меди с использованием медных электродов и раствора сульфата меди.
Необходимые материалы: Аккумулятор, электрические провода, толстая медная полоса, тонкая медная проволока (без оболочки), раствор медного купороса и стеклянный стакан.Стеклянный стакан следует выбросить после эксперимента.
Метод: Проведите эксперимент, как показано на рисунке. Подождите некоторое время и посмотрите, что произойдет с катодом.
Наблюдение: Вы заметите, что катод из чистой меди покрывается медным покрытием.
Электролиз и гальваника – детская химия
Что такое электролиз?
Вы, наверное, слышали, что такие металлы, как железо и медь, добываются из железных и медных руд. Электролиз – это процесс отделения или извлечения металла из руды. Электрический ток проходит через электролит / раствор руды, что приводит к химическим изменениям.
Это химическое изменение таково, что вещество теряет или приобретает электрон. Этот процесс известен как электролиз.
Что такое гальваника?
Гальваника – это практическое применение электролитических ячеек. При этом тонкий слой металла наносится на электропроводящую поверхность. В гальванике идея состоит в том, чтобы использовать электричество для покрытия или покрытия относительно расточного металла тонким слоем другого драгоценного металла, чтобы он выглядел дорого.
Расточный металл, такой как медь, можно покрыть тонким слоем золота или серебра, и это гальваника. Даже при гальванике требуется пропускать электрический ток через раствор, называемый электролитом, и покрываемый металл погружается в электролит.
Процесс электролиза
Электролиз требует двух противоположно заряженных полюсов. Катод заряжен отрицательно; это место восстановления положительных ионов. Анод заряжен положительно; это место окисления отрицательных ионов. В электролитической ячейке эти два полюса подключены к внешнему источнику питания. Цепь обычно замыкается солевым раствором, называемым электролитом. При производстве металла электролизом на катоде образуется слой металла.
Газообразный водород и газообразный кислород отделяются от воды аналогичным образом.
Процесс гальваники
Гальваника заключается в пропускании электрического тока через раствор, называемый электролитом. Это делается путем погружения двух электродов в электролит и подключения его к постоянному току.
Если мы покрываем медью немного латуни, нам понадобится медный электрод, латунный электрод и раствор соединения на основе меди, например, раствор сульфата меди.
Мы окунаем два электрода в раствор и соединяем их в цепь, так что медь становится положительным электродом (или анодом), а латунь – отрицательным электродом (или катодом).Когда мы включаем питание, раствор сульфата меди расщепляется на ионы. Положительно заряженные ионы меди притягиваются к отрицательно заряженному латунному электроду и медленно осаждаются на нем, создавая тонкую медную пластину на латунном предмете, на который нужно нанести покрытие.
Для чего нужен электролиз?
- Электролиз используется в производстве таких металлов, как алюминий, натрий, кальций, магний; или даже очистка металлов, таких как медь, золото и серебро.
- В наши дни электролиз воды используется для производства водорода для топлива или выработки электроэнергии с использованием топливных элементов.
- Наша повседневная жизнь была бы очень сложной без электролиза. Пример: щелочь, используемая для изготовления мыла, получается в процессе электролиза.
- Знаете ли вы, что космонавты и люди, которые живут на подводных лодках, получают кислород в процессе электролиза?
Каковы применения гальваники?
- Металлы, такие как золото и серебро, покрываются гальваническим покрытием для украшения.Более дешевые украшения из золота или серебра, а не из чистого золота или серебра.
- Затем у нас есть металлы, такие как олово или цинк, на которые наносят защитный слой. Это делает такие металлы устойчивыми к коррозии.
- Гальваника также используется для увеличения толщины слоя в металлах. Гальваника металла обеспечивает защиту от коррозии, износостойкость и смазывающую способность.
: Промышленный электролиз – Химия LibreTexts
Реакции электролиза – это фундамент современной промышленности. Существуют различные элементы, химические соединения и органические соединения, которые производятся только путем электролиза, включая алюминий, хлор и NaOH. Электролиз – это процесс, при котором электрический ток стимулирует реакцию, которая в противном случае не является спонтанной.
Электролитическое рафинирование: как это работает
Процесс электрорафинирования позволяет рафинировать металлы или соединения высокой чистоты по низкой цене.Чистый металл может покрыть ничего не стоящий предмет.
Давайте рассмотрим процесс электролитического рафинирования меди: на аноде есть нечистый кусок меди, содержащий другие металлы, такие как Ag, Au, Pt, Sn, Bi, Sb, As, Fe, Ni, Co и Zn. Медь в этой нечистой руде окисляется с образованием Cu 2 + на аноде и проходит через водный раствор серной кислоты и сульфата меди (II) в катод. Когда он достигает катода, Cu 2 + восстанавливается до Cu.Весь этот процесс происходит при довольно низком напряжении (от 0,15 до 0,30 В), поэтому Ag, Au и Pt не окисляются на аноде, так как их стандартные электродные потенциалы окисления составляют -800, -1,36 и -1,20. соответственно; эти неокисленные примеси превращаются в смесь, называемую анодным шламом, шлам на дне резервуара. Этот осадок может быть восстановлен и использован в различных процессах. В отличие от Ag, Au и Pt, примеси Sb, Bi и Sn в руде действительно окисляются на аноде, но они осаждаются, поскольку образуют гидроксиды и оксиды.Наконец, Fe, Ni, Co и Zn тоже окисляются, но они растворяются в воде. Следовательно, единственное твердое вещество, которое у нас осталось, – это пластина из чистой твердой меди на катоде, уровень чистоты которой составляет около 99,999%. Изображение ниже дает представление о судьбе основных компонентов нечистой железной руды.
Электросинтез
Электросинтез – это метод получения веществ посредством реакций электролиза. Это полезно, когда необходимо тщательно контролировать условия реакции.-} \\
& \ textrm {Катод:}
&& \ ce {2Ch3 = CHCN + 2h3O + 2e- \ rightarrow NC (Ch3) CN + 2OH -} \\
& \ textrm {Всего:}
&& \ textrm {(акрилонитрил)} \ ce {2Ch3 = CHCN + h3O \ rightarrow \ dfrac {1} {2} O2 + NC (Ch3) 4CN} \: \ textrm {(адипонитрил)}
\ end {align} \)
Важность адипонитрила состоит в том, что он легко превращается в другие полезные соединения.
Хлорно-щелочной процесс
Этот процесс представляет собой электролиз хлорида натрия (NaCl) на промышленном уровне.Мы начнем с обсуждения уравнения хлорщелочного процесса, а затем обсудим три различных типа процесса: диафрагменный элемент, ртутный элемент и мембранный элемент.
Какое уравнение для электролиза NaCl?
Мы начнем объяснение хлорщелочного процесса с определения реакций, которые происходят во время электролиза NaCl. Поскольку NaCl находится в водном растворе, мы также должны учитывать электролиз воды как на аноде, так и на катоде.0_ {O_2 / H_2O} = – (1.23 \: V) \ tag {4}}
\ end {align} \)
Как мы видим, из-за гораздо более высокого потенциала отрицательного электрода уменьшение ионов натрия происходит гораздо реже, чем восстановление воды, поэтому можно предположить, что при электролизе NaCl происходящее восстановление является реакцией (2). Следовательно, мы должны попытаться определить, что такое реакция окисления. Допустим, у нас есть реакция (2) как восстановление и реакция (3) как окисление . Мы получим:
\ (\ begin {align}
& \ textrm {Reduction:}
&& \ mathrm {2 H_2O _ {\ large {(l)}} + 2e ^ – \ rightarrow H_ {2 \ large {( g)}} + 2OH ^ -_ {\ large {(aq)}}}
&& \ mathrm {\ hspace {12px} E ^ 0_ {H_20 / H_2} = -.0_ {O_2 / H_20} \ tag {6}} \\
& && && \ mathrm {\ hspace {22px} = -.83 \: V – (1.23 \: V) = -2.06}
\ end {align} \)
На первый взгляд может показаться, что реакция (6) происходит из-за меньшего (менее отрицательного) потенциала электрода. Однако O 2 на самом деле имеет довольно большое перенапряжение, поэтому вместо этого более вероятно образование Cl 2 , что делает реакцию (5) наиболее вероятным результатом электролиза NaCl.
Хлорно-щелочной процесс в диафрагменной ячейке
В зависимости от используемого метода в хлорщелочном процессе могут быть получены несколько различных продуктов.Ценность этих продуктов – вот что делает хлорщелочной процесс таким важным. Название происходит от двух основных продуктов процесса, хлора и щелочи, гидроксида натрия (NaOH). Следовательно, одним из основных применений хлорщелочного процесса является производство NaOH. Как описано ранее, уравнение для хлорщелочного процесса, то есть электролиза NaCl, выглядит следующим образом:
\ (\ begin {align}
& \ textrm {Reduction:}
&& \ mathrm {2 H_2O_ { \ large {(l)}} + 2e ^ – \ rightarrow H_ {2 \ large {(g)}} + 2OH ^ -_ {\ large {(aq)}}}
&& \ mathrm {E_ {H_2O / H_2O знак равно-}} \\
& && && \ hspace {12px} \ mathrm {= -83 \: V- (-1,36 \: V) = -2,19 \: V}
\ end {align} \)
** Хлорно-щелочной процесс часто происходит в аппарате, называемом диафрагменным элементом, который показан ниже.
Рис. 1:
Когда вы посмотрите на ячейку, обратите внимание на следующее:
Анод
- Хлорид натрия помещается в анодное отделение в водной форме.
- Фактический физический анод изготовлен из графита или титана.
- В анодном отсеке образуется газ Cl 2 , поскольку Cl – окисляется.
Катод
- На катодной стороне при восстановлении воды образуются газы OH – (водный) и H 2 .
- Вы можете спросить, а почему на катодной стороне находятся ионы натрия и хлорида, если мы помещаем хлорид натрия в анодный отсек? Чтобы ответить на этот вопрос, мы можем рассмотреть разницу в уровнях раствора между анодом и катодом.Это вызывает постепенный поток NaCl на катод и предотвращает обратный поток NaOH на анод. При контакте Cl 2 и NaOH, Cl 2 превращается в ионы ClO – , ClO 3 – , Cl – . Разница уровней воды предотвращает этот контакт, а также способствует потоку NaCl на катодную сторону, поэтому может образовываться NaOH (водный).
- Теперь вы можете заметить, что раствор с NaOH на катоде также будет содержать водный раствор NaCl, смешанный с ним из-за потока NaCl от анода к катоду.Следовательно, если нам нужен очень чистый NaOH для таких целей, как производство вискозы, нам нужно каким-то образом очистить соль от NaOH. Как правило, перед очисткой раствор содержит примерно 14-16% NaCl (водн.) И 10-12% NaOH (водн.). Однако NaOH (водный) можно сконцентрировать, а NaCl (ы) можно кристаллизовать с образованием раствора с 50% NaOH (водн.) И примерно 1% NaCl (водн.).
Хлорно-щелочной процесс в ртутной ячейке
Чтобы еще больше повысить чистоту NaOH, для проведения электролиза можно использовать ртутную ячейку, а не диафрагменную ячейку.
Рисунок 2:
Сторона анода
- Аноды помещаются в водный раствор NaCl над жидкой ртутью.
- Восстановление Cl – происходит с образованием газообразного хлора, Cl 2 (г).
Катодная сторона
- Слой Hg (l) на дне резервуара служит катодом.
- При использовании ртутного катода реакция H 2 O (l) на H 2 имеет довольно высокий перенапряжение, поэтому вместо этого происходит восстановление Na + до Na.Na растворяется в Hg (l), и эти два соединения образуют амальгаму сплава Na-Hg. Эту амальгаму можно удалить, а затем смешать с водой, чтобы вызвать следующую реакцию:
- \ (\ ce {2Na \ 🙁 in \: Hg) + 2h3O \ rightarrow 2 Na + + 2 OH- + H_ {2 \ large {( g)}} + Hg _ {\ large {(l)}}} \)
- Образующаяся Hg (l) возвращается обратно в жидкость на дне резервуара, который действует как катод.
- H 2 газ выпущен.
- NaOH остается в очень чистой водной форме.
** Некоторые из основных проблем с ртутным элементом следующие:
- Для реакции требуется более высокое напряжение, чем у диафрагменной ячейки: 4,5 В в ртутной ячейке по сравнению с 3,5 В в диафрагменной ячейке.
- Требуется довольно много электроэнергии, так как для этого требуется 3400 кВтч / т Cl 2 в отличие от 2500 в мембранной ячейке.
- Возможный ущерб окружающей среде из-за отложений ртути. К счастью, количество отложений достигало 200 г ртути на тонну газообразного хлора, но сейчас они никогда не превышают 0.25 г на тонну газообразного хлора.
Процесс мембранной ячейки
Последний способ получить еще более чистый NaOH – использовать мембранную ячейку. Он предпочтительнее метода с диафрагменным или ртутным элементом, поскольку он использует наименьшее количество электроэнергии и производит NaOH самого высокого качества. Например, он может производить NaOH со степенью загрязнения ионами хлора всего 50 частей на миллион. Ионопроницаемая мембрана используется для разделения анода и катода.
Анод
- Насыщенный рассол подается в отсек.
- Ток, пропущенный через элемент, разделяет хлорид натрия на составляющие компоненты: Na + и Cl – .
- Хлорид-ионы окисляются до газообразного хлора на аноде.
- Мембрана пропускает ионы Na + в катодное отделение.
Катод
- H 2 O восстанавливается с образованием газа OH – и H 2 .
- \ (\ ce {2h3O \ rightarrow h3 + 2OH-} \)
- Ионы Na + , которые протекли, и OH – , образовавшиеся в результате восстановления воды, реагируют с образованием водного NaOH.
- H 2 Газ также образуется как побочный продукт.
Проверьте свое понимание
Верно или неверно :
- Основным продуктом хлорно-щелочного процесса является NaCl.
- Мембранная ячейка дает самую чистую концентрацию NaOH.
- В ячейке с диафрагмой окисление ионов Cl – происходит на аноде, а восстановление Na + происходит на катоде.
- H 2 Газ является побочным продуктом хлорно-щелочного процесса.
- Электролитическое рафинирование меди эффективно, поскольку из всех металлов в руде только медь окисляется на аноде при низких напряжениях.
- В ртутном элементе в качестве катода используется жидкая ртуть.
- Хлорно-щелочной процесс самопроизвольный.
- Ртутный элемент требует более высокого напряжения и больше энергии, чем диафрагменный элемент.
- В мембранной ячейке все ионы могут свободно обмениваться между мембранами.
- Реакция между NaOH и газообразным Cl 2 необходима для хлорщелочного процесса.
Внешние ссылки
- Электролиз: промышленное использование (Википедия)
- Промышленный электролиз и электрохимическая инженерия (electrochem.org pdf)
- Вагенкнехт, Джон Х. «Промышленный органический электросинтез (SOA-Electrochemistry)». J. Chem. Образа. 1983 , 60 , 271.
Проверьте свое понимание: ответы
- Неверно – хлорно-щелочной процесс – это электролиз NaCl, а не электросинтез.NaCl является одним из основных реагентов хлорщелочного процесса
- Ложно – мембранная ячейка дает наиболее загрязненный NaOH. Ртутный элемент дает более чистый NaOH, а затем мембранный элемент с самым чистым.
- False – Из-за высокого напряжения, необходимого для восстановления ионов Na (что означает большой отрицательный стандартный потенциал восстановления электрода натрия), вместо этого происходит восстановление воды.
- Верно – Да, газ H 2 образуется на катоде, а газ Cl 2 образуется на аноде.
- Неверно – Хотя Au, Ag и Pt не окисляются, Sb, Bi и Sn окисляются, но осаждаются, так как образуют гидроксиды и оксиды. Fe, Ni, Co и Zn тоже окисляются, но растворяются в воде. Таким образом, хотя медь – единственный твердый твердый металл, который у нас остался, другие примеси также окисляются.
- True – жидкая ртуть на дне резервуара действует как катод. Еще больше ртути постоянно возвращается в резервуар, поскольку амальгама обрабатывается водой.
- Ложь – электросинтез требует энергии.
- Верно – ртутной ячейке требуется 3400 кВтч / т Cl 2 по сравнению с 2500 в диафрагменной ячейке.
- Неверно – в мембранной ячейке только катионы могут проходить через мембрану в катод. Это объясняет, почему в NaOH на катодной стороне так мало примесей ионов хлора.
- False – Если Cl 2 и NaOH вступают в контакт, Cl 2 превращается в ClO – , ClO 3 – , ионы Cl. Это нежелательно, поэтому разница в уровнях раствора используется для предотвращения обратного потока NaOH на анодную сторону.
Список литературы
Общая химия, принципы и современные приложения, Петруччи, 2007, 2002, 1997
Объясните процесс электролиза и его использование
Презентация на тему: «Объяснение процесса электролиза и его использования» – стенограмма презентации:
1 Объясните процесс электролиза и его использование 
2
Электролиз Процесс, при котором электрическая энергия преобразуется в химическую энергию. Он не является спонтанным, для протекания реакции необходимо подавать электроэнергию. Он имеет важные применения, такие как: Гальваника. Извлечение химически активных металлов, таких как Na, Al, из металлической руды. Промышленное производство NaOH. , Cl2, h3 Зарядка автомобильных аккумуляторов и других аккумуляторных батарей Рафинирование медных металлов 
3 Процесс, происходящий в электролитической ячейке
Внешний источник питания Источник электронов, которые могут течь.(Ток переносится в растворе ионами). 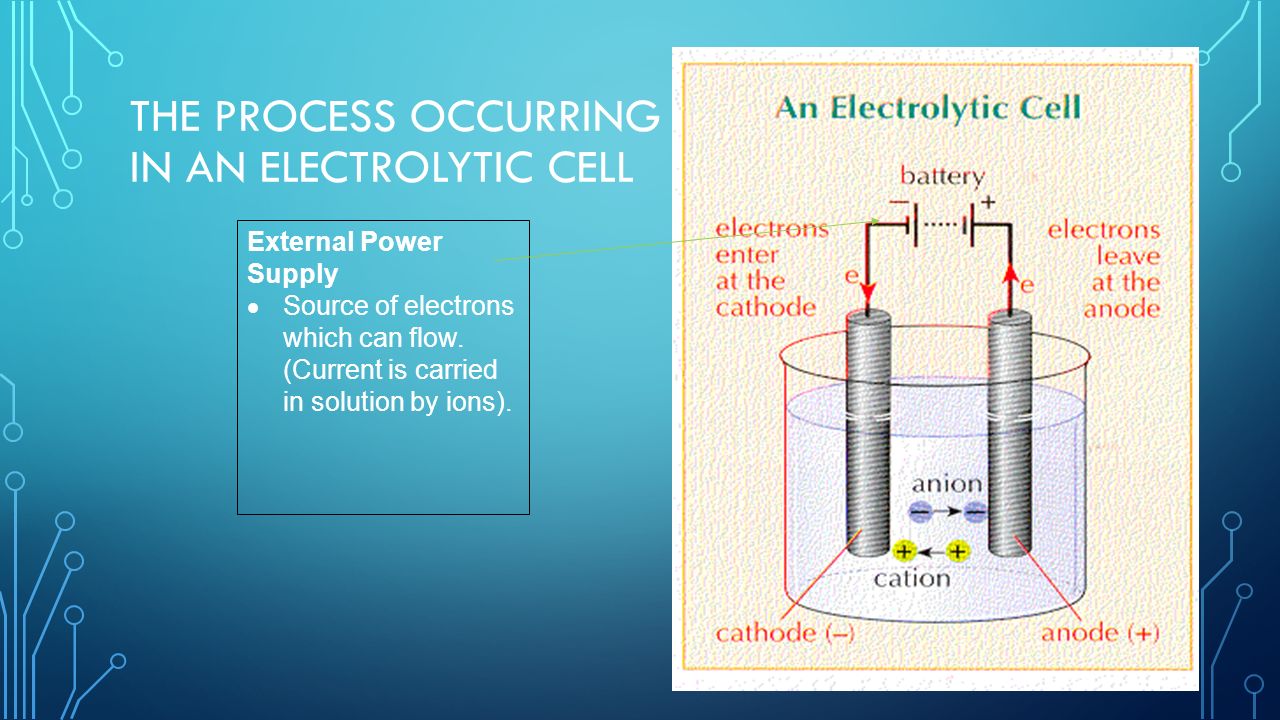
4 Процесс, происходящий в электролитической ячейке
Два электрода, погруженные в раствор расплавленного реагента (должен быть электролит – раствор, который проводит электричество потоком ионов) 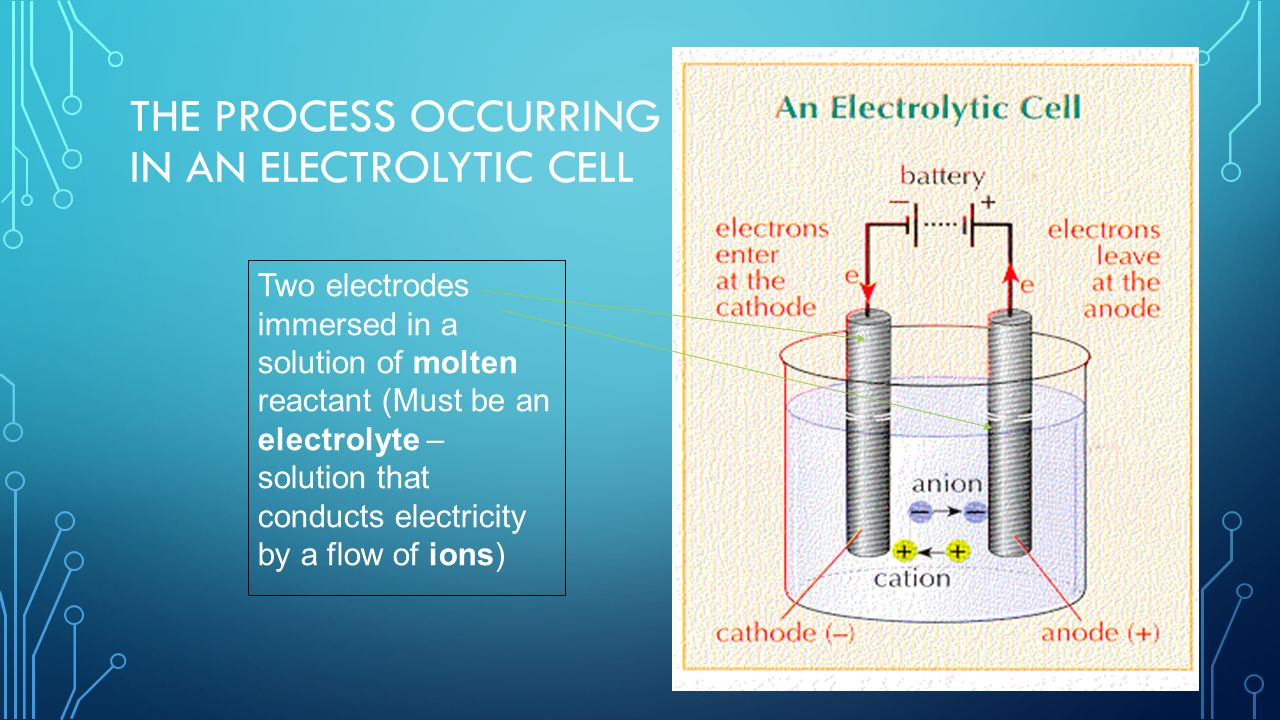
5 Процесс, происходящий в электролитической ячейке
Анионы будут течь в том же направлении, что и электроны.Их привлекает положительный анод. Анионы теряют электроны и окисляются. 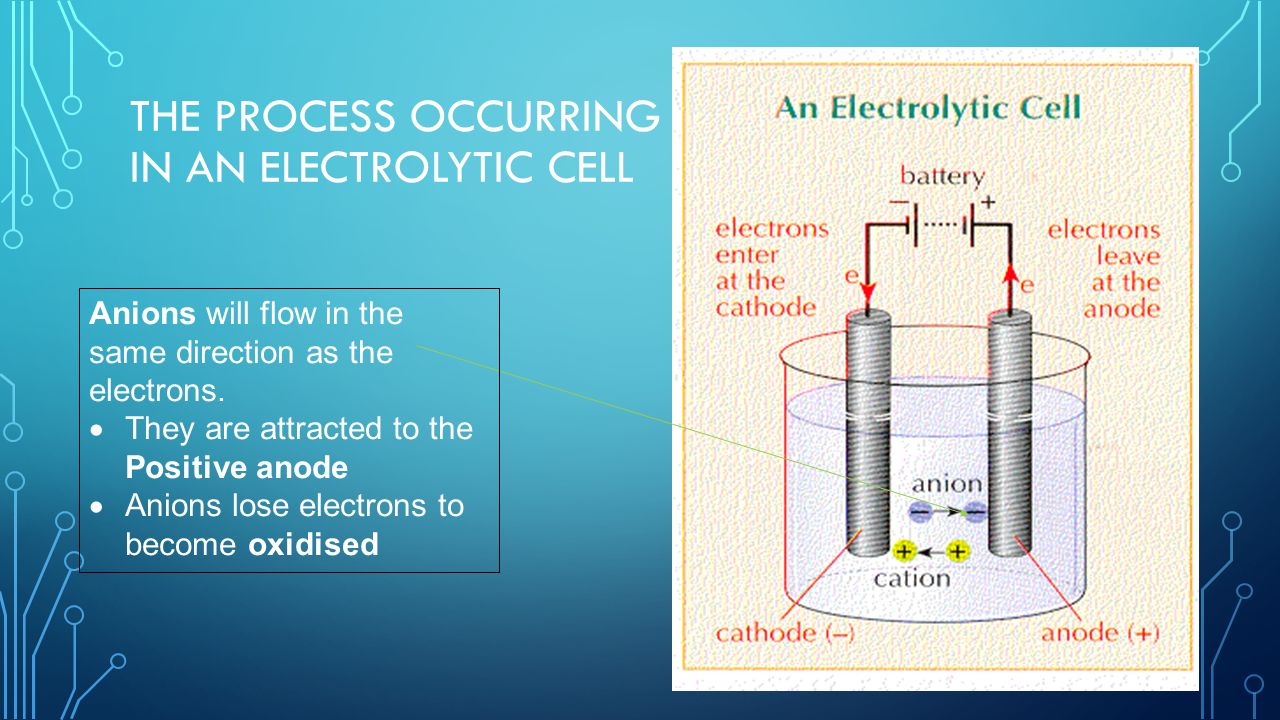
6 Процесс, происходящий в электролитической ячейке
Катионы текут в направлении, противоположном электронам Они притягиваются к отрицательному катоду Катионы приобретают электроны, чтобы стать восстановленными 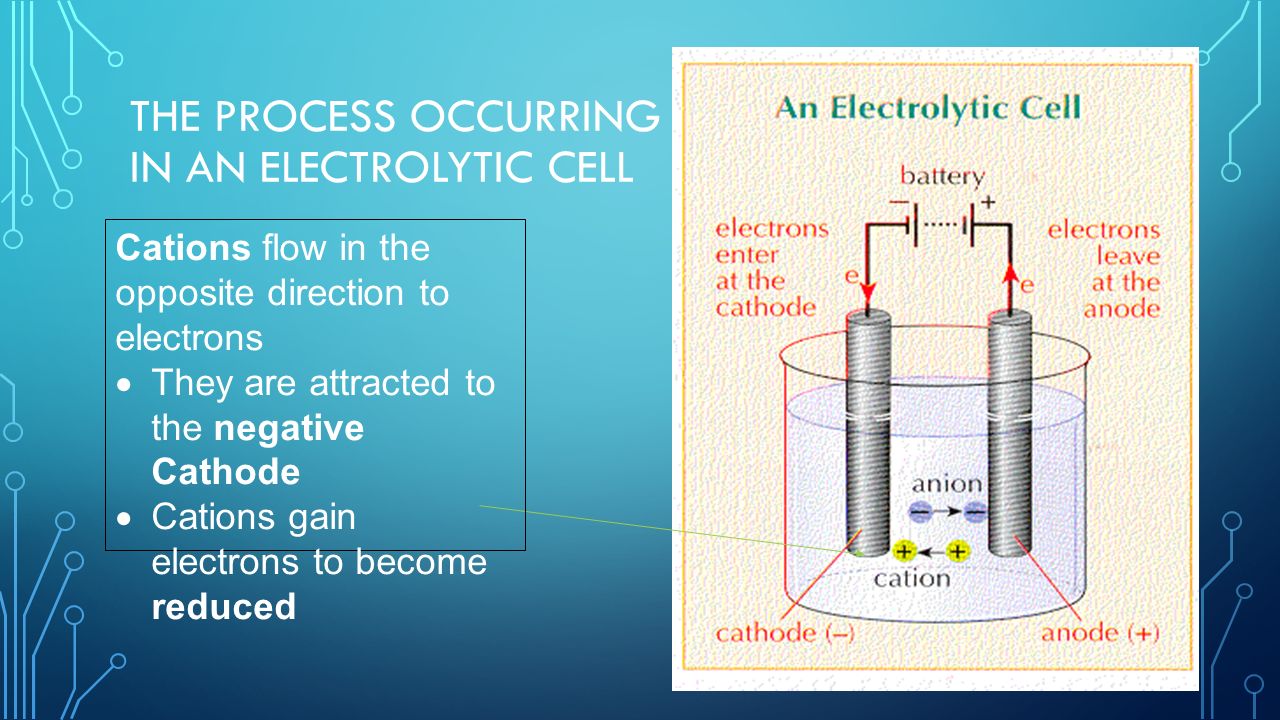
8 Пример – Электролиз воды
Вольтаметр Хоффмана используется для электролиза воды и состоит из платиновых электродов.Вода – это молекулярное соединение. Чистая или дистиллированная вода не является электролитом (она не содержит заряженных частиц, которые могут проводить ток). Поэтому несколько кристаллов ионного соединения (например, хлорида натрия – для образования ионов) или несколько капель сильной кислоты (соляная кислота, серная кислота – они полностью диссоциируют на ионы) необходимо добавить в воду, чтобы она стала электролит. Анод и катод подключены к батарее. Ячейка вырабатывает небольшой ток порядка нескольких миллиампер, и вы увидите пузырьки, появляющиеся в двух плечах вольтаметра.Анод собирает кислород (анион притягивается к положительному аноду), а плечо катода собирает газообразный водород (катион притягивается к отрицательному катоду)
10 Извлечение алюминия
твердое тело. Алюминиевая руда называется бокситовой. Бокситы содержат оксид алюминия, воду, оксид железа и другие примеси. Очищенная сухая руда, называемая глиноземом, представляет собой оксид алюминия – Al2O3.Для работы электролиза оксид алюминия должен быть расплавлен, поскольку ионы не могут свободно перемещаться в твердом состоянии. 
11 Напишите уравнения протекающих реакций… ..
Стальной контейнер покрыт углеродом (графитом), который используется в качестве отрицательного электрода (катода). Оксид алюминия (Al2O3) – ионное соединение. Когда он расплавлен, ионы Al3 + и O2- могут свободно перемещаться и проводить электричество.Электролиз раствора оксида алюминия / криолита дает алюминий на отрицательном катоде и кислород на положительном аноде.


