Какой процесс называют электролизом. Что такое электролиз. Особенности процессов, происходящих на катоде и аноде
Вопрос о том, что такое электролиз, рассматривается еще в школьном курсе физике, и для большинства людей не является секретом. Другое дело – его важность и практическое применение. Этот процесс с большой пользой используется в различных отраслях и может пригодиться для домашнего мастера.
Электролиз представляет собой комплекс специфических процессов в системе электродов и электролита при протекании по ней постоянного электрического тока. Его механизм основывается на возникновении ионного тока. Электролит – это проводник 2-го типа (ионная проводимость ), в котором происходит электролитическая диссоциация. Она связана с разложением на ионы с положительным (катион ) и отрицательным (анион ) зарядом.
Электролизная система обязательно содержит положительный (анод ) и отрицательный (катод ) электрод.
Таким образом, в системе обеспечивается окислительно-восстановительный процесс. Важно учитывать, что для его протекания необходима соответствующая энергия. Ее должен обеспечить внешний источник тока.
Законы электролиза Фарадея
Великий физик М.Фарадей своими исследованиями позволил не только понять природу электролиза, но и производить необходимые расчеты для его осуществления. В 1832 г. появились его законы, связавшие основные параметры происходящих процессов.
Первый закон
Первый закон Фарадея гласит, что масса восстанавливающегося на аноде вещества прямо пропорциональна электрическому заряду, наведенному в электролите: m = kq = k*I*t, где q — заряд, k – коэффициент или электрохимический эквивалент вещества, I – сила тока, протекающего через электролит, t – время прохождения тока.
Второй закон
Второй закон Фарадея позволил определить коэффициент пропорциональности k. Он звучит следующим образом: электрохимический эквивалент любого вещества прямо пропорционален его молярной массе и обратно пропорционален валентности. Закон выражается в виде:
k = 1/F*A/z , где F – постоянная Фарадея, А- молярная масса вещества, z – его химическая валентность.
С учетом обоих законов можно вывести окончательную формулу для расчета массы, оседающего на электроде вещества: m = A*I*t/(n*F) , где n – количество электронов, участвующих в электролизе. Обычно n соответствует заряду иона. С практической точки зрения важна связь массы вещества с подаваемым током, что позволяет контролировать процесс, изменяя его силу.
Электролиз расплавов
Один из вариантов электролиза – использование в качестве электролита расплав. В этом случае в электролизном процессе участвуют только ионы расплава. В качестве классического примера можно привести электролиз солевого расплава NaCl (поваренная соль ). К аноду устремляются отрицательные ионы, а значит, выделяется газ (Cl ). На катоде будет происходить восстановление металла, т.е. оседание чистого Na, образующегося из положительных ионов, притянувших избыточные электроны. Аналогично можно получать другие металлы (К, Са, Li и т.д. ) из расправа соответствующих солей.
К аноду устремляются отрицательные ионы, а значит, выделяется газ (Cl ). На катоде будет происходить восстановление металла, т.е. оседание чистого Na, образующегося из положительных ионов, притянувших избыточные электроны. Аналогично можно получать другие металлы (К, Са, Li и т.д. ) из расправа соответствующих солей.
При электролизе в расплаве электроды не подвергаются растворению, а участвуют только в качестве источника тока. При их изготовлении можно использовать металл, графит, некоторые полупроводники. Важно, чтобы материал имел достаточную проводимость. Один из наиболее распространенных материалов – медь.
Особенности электролиза в растворах
Электролиз в водном растворе существенно отличается от расплава. Здесь имеют место 3 конкурирующих процесса: окисление воды с выделением кислорода, окисление аниона и анодное растворение металла. В процессе задействованы ионы воды, электролита и анода. Соответственно, на катоде может происходить восстановление водорода, катионов электролита и металла анода.
Возможность протекания указанных конкурирующих процессов зависит от величины электрических потенциалов системы. Протекать будет только тот процесс, который требует меньше внешней энергии. Следовательно, на катоде будут восстанавливаться катионы, имеющие максимальный электродный потенциал, а на аноде – окисляться анионы с наименьшим потенциалом. Электродный потенциал водорода принят за «0». Для примера, у калия он равен (
Электролиз в газах
Газ может исполнить роль электролита только при наличии ионизатора. В этом случае ток, проходя через ионизированную среду, вызывает необходимый процесс на электродах. При этом законы Фарадея не распространяются на газовый электролиз. Для его осуществления необходимы такие условия:
- Без искусственной ионизации газа не поможет ни высокое напряжение, ни большой ток.
- Для электролиза подходят лишь кислоты, не содержащие кислорода и находящиеся в газообразном состоянии, и некоторые газы.

Важно! При выполнении необходимых условий процесс протекает аналогично электролизу в жидком электролите.
Особенности процессов, происходящих на катоде и аноде
Для практического применения электролиза важно понимать, что происходит на обоих электродах при подаче электрического тока. Характерны такие процессы:
- Катод. К нему устремляются положительно заряженные ионы. Здесь происходит восстановление металлов или выделение водорода. Можно выделить несколько категорий металлов по катионной активности. Такие металлы, как Li, K, Ba, St, Ca, Na, Mg, Be, Al, хорошо восстанавливаются только из расплава солей. Если используется раствор, то выделяется водород за счет электролиза воды. Можно обеспечить восстановление в растворе, но при достаточной концентрации катионов, у следующих металлов — Mn, Cr, Zn, Fe, Cd, Ni, Ti, Co, Mo, Sn, Pb. Процесс протекает наиболее легко для Ag, Cu, Bi, Pt, Au, Hg.
- Анод. К этому электроду поступают отрицательно заряженные ионы.

При обеспечении электролиза важно учитывать склонность материала электродов к окислению. В этом отношении выделяются инертные и активные аноды. Инертные электроды делаются из графита, угля или платины и не участвуют в снабжении ионами.
Факторы, влияющие на процесс электролиза
Процесс электролиза зависит от следующих факторов:
- Состав электролита
. Значительное влияние оказывают различные примеси. Они подразделяются на 3 типа – катионы, анионы и органика. Вещества могут быть более или менее отрицательными, чем основной металл, что и мешает процессу.
 Среди органических примесей выделяются загрязнители (например масла) и ПАВ. Их концентрация имеет предельно допустимые значения.
Среди органических примесей выделяются загрязнители (например масла) и ПАВ. Их концентрация имеет предельно допустимые значения. - Плотность тока . В соответствии с законами Фарадея, масса осаждаемого вещества увеличивается с увеличением силы тока. Однако возникают неблагоприятные обстоятельства – концентрированная поляризация, повышенное напряжение, интенсивный разогрев электролита. С учетом этого существуют оптимальные значения плотности тока для каждого конкретного случая.
- рН электролита . Кислотность среды также выбирается с учетом металлов. Например оптимальное значение кислотности электролита для цинка – 140 г/куб.дм.
- Температура электролита . Она влияет неоднозначно. С увеличением температуры растет скорость электролиза, но повышается и активность примесей. Для каждого процесса есть оптимальная температура. Обычно она находится в пределах 38-45 градусов.
Важно! Электролиз можно ускорить или замедлить путем различных воздействий и выбора состава электролита.
Для каждого варианта применения существует свой режим, который следует строго соблюдать.
Где применяется электролиз?
Электролиз применяется во многих сферах. Можно выделить несколько основных направлений использования для получения практических результатов.
Гальваническое покрытие
Тонкое, прочное гальваническое покрытие из металла можно наложить путем электролиза. Покрываемое изделие устанавливается в ванну в виде катода, а электролит содержит соль нужного металла. Так можно покрыть сталь цинком, хромом или оловом.
Электроочистка — рафинирование меди
Примером электроочистки может служить такой вариант: катод – чистая медь, анод – медь с примесями, электролит – водный раствор медного сульфата. Медь из анода переходит в ионы и оседает в катоде уже без примесей.
Добыча металлов
Для получения металлов из солей они переводятся в расплав, а затем обеспечивается электролиз в нем. Достаточно эффективен такой способ для получения алюминия из бокситов, натрия и калия.
Анодирование
При этом процессе покрытие выполняется из неметаллических соединений. Классический пример – анодирование алюминия. Алюминиевая деталь устанавливается, как анод. Электролит – раствор серной кислоты. В результате электролиза на аноде оседает слой из оксида алюминия, обладающего защитными и декоративными свойствами. Указанные технологии широко используются в различных отраслях промышленности. Можно осуществить процессы и своими руками с соблюдением техники безопасности.
Энергетические затраты
Электролиз требует больших энергетических затрат. Процесс будет иметь практическую ценность при достаточной величине анодного тока, а для этого необходимо приложить значительный постоянный ток от источника электроэнергии. Кроме того, при его проведении возникают побочные потери напряжения – анодное и катодное перенапряжение, потери в электролите за счет его сопротивления. Эффективность работы установки определяется путем отнесения мощности энергозатрат к единице полезной массы полученного вещества.
Электролиз давно и с высокой эффективностью используется в промышленности. Анодированные и гальванические покрытия стали обычным явлением в повседневной жизни, а добыча и обогащение материалов помогает добывать многие металлы из руды. Процесс можно запланировать и рассчитать, зная основные его закономерности.
При прохождении через раствор или расплав электролита электрического тока, на электродах происходит выделение растворенных веществ или иных веществ, являющихся продуктами вторичных реакций на электродах. Этот физико-химический процесс и называется электролизом.
Суть электролиза
В создаваемом электродами электрическом поле, ионы в проводящей жидкости приходят в упорядоченное движение. Отрицательный электрод — это катод, положительный — анод.
К аноду устремляются отрицательные ионы, называемые анионами (ионы гидроксильной группы и кислотные остатки), а к катоду — положительные ионы, называемые катионами (ионы водорода, металлов, аммония и т. д.)
д.)
На электродах протекает окислительно-восстановительный процесс: на катоде происходит электрохимическое восстановление частиц (атомов, молекул, катионов), а на аноде — электрохимическое окисление частиц (атомов, молекул, анионов). Реакции диссоциации в электролите — это первичные реакции, а реакции, которые протекают непосредственно на электродах, называются вторичными.
Разделение реакций электролиза на первичные и вторичные помогло Майклу Фарадею установить законы электролиза:
Первый закон электролиза Фарадея: масса вещества, осаждённого на электроде при электролизе, прямо пропорциональна количеству электричества, переданного на этот электрод. Под количеством электричества имеется в виду электрический заряд, измеряемый, как правило, в кулонах.
Второй закон электролиза Фарадея: для данного количества электричества (электрического заряда) масса химического элемента, осаждённого на электроде, прямо пропорциональна эквивалентной массе элемента. Эквивалентной массой вещества является его молярная масса, делённая на целое число, зависящее от химической реакции, в которой участвует вещество.
m — масса осаждённого на электроде вещества, Q — полный электрический заряд, прошедший через вещество F = 96 485,33(83) Кл·моль−1 — постоянная Фарадея, M — молярная масса вещества (Например, молярная масса воды h3O = 18 г/моль), z — валентное число ионов вещества (число электронов на один ион).
Заметим, что M/z — это эквивалентная масса осаждённого вещества. Для первого закона Фарадея M, F и z являются константами, так что чем больше величина Q, тем больше будет величина m. Для второго закона Фарадея Q, F и z являются константами, так что чем больше величина M/z (эквивалентная масса), тем больше будет величина m.
Электролиз широко применяется сегодня в промышленности и в технике. Например, именно электролиз служит одним из эффективнейших способов промышленного получения водорода, пероксида водорода, диоксида марганца, алюминия, натрия, магния, кальция и прочих веществ. Применяется электролиз для очистки сточных вод, в гальваностегии, в гальванопластике, наконец — в химических источниках тока. Но обо всем по порядку.
Но обо всем по порядку.
Благодаря электролизу многие металлы извлекается из руд и подвергается дальнейшей переработке. Так, когда руду или обогащенную руду — концентрат — подвергают обработке реагентами, металл переходит в раствор, затем путем электроэкстракции металл выделяют из раствора. Чистый металл выделяется при этом на катоде. Таким путем получают цинк, медь, кадмий.
Электрорафинированию металлы подвергают для устранения примесей и чтобы перевести содержащиеся примеси в удобную для дальнейшей переработки форму. Металл, подлежащий очистке, отливают в виде пластин, и применяют эти пластины в качестве анодов при электролизе.
Когда ток проходит, металл анода растворяется, переходит в виде катионов в раствор, затем катионы разряжаются на катоде, и образуют осадок чистого металла. Примеси анода не растворяются – выпадают анодным шламом, или переходят в электролит, откуда непрерывно или периодически удаляются.
Рассмотрим в качестве примера электрорафинирование меди .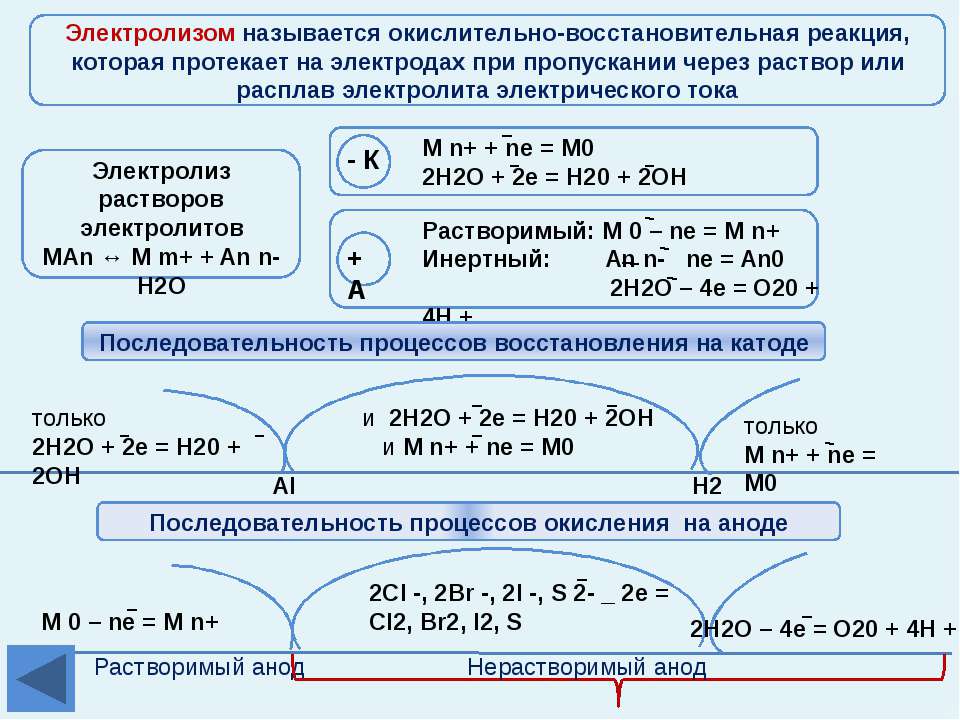 Главный компонент раствора – сульфат меди — наиболее распространенная и дешевая соль этого металла. Раствор обладает низкой электрической проводимостью. Для ее увеличения в электролит добавляют серную кислоту.
Главный компонент раствора – сульфат меди — наиболее распространенная и дешевая соль этого металла. Раствор обладает низкой электрической проводимостью. Для ее увеличения в электролит добавляют серную кислоту.
Кроме того, в раствор вводят небольшие количества добавок, способствующих получению компактного осадка металла. Вообще, электролитическому рафинированию подвергают медь, никель, свинец, олово, серебро, золото.
Электролиз находит применение в очистке сточных вод (процессы электрокоагуляции, электроэкстракции и электрофлотации). Электрохимический метод очистки — один из наиболее часто применяемых. Для электролиза используют нерастворимые аноды (магнетит, оксид свинца, графит, марганец, которые наносят на титановую основу), или растворимые (алюминий, железо).
Такой метод применяют для выделения из воды токсичных органических и неорганических веществ. К примеру, медные трубы очищают от окалины раствором серной кислоты, и промышленные сточные воды приходится затем очищать путем электролиза с нерастворимым анодом.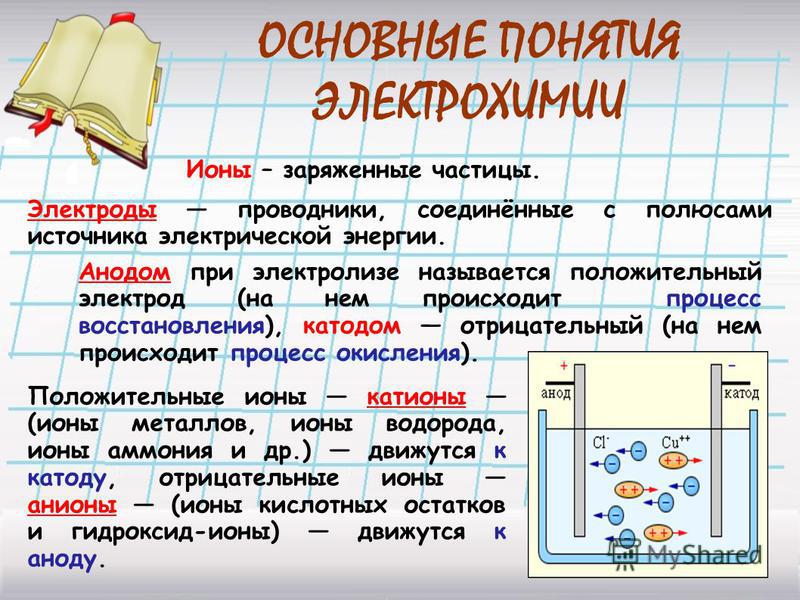 На катоде выделяется медь, которая снова может использоваться на том же предприятии.
На катоде выделяется медь, которая снова может использоваться на том же предприятии.
Щелочные сточные воды очищают электролизом от цианистых соединений. С целью ускорения окисления цианидов, повышения электропроводности и экономии электроэнергии, к водам применяют добавку в виде хлорида натрия.
Электролиз проводят с графитовым анодом и стальным катодом. Цианиды разрушаются в ходе электрохимического окисления и хлором, который выделяется на аноде. Результативность такой очистки близка к 100%.
Кроме непосредственно электохимической очистки можно включить в процесс электролиза коагуляцию . Исключив добавки солей, электролиз проводят с растворимыми алюминиевыми или железными анодами. Тогда не только разрушаются загрязнители на аноде, но и растворяется сам анод. Образуются активные дисперсные соединения, которые коагулируют (сгущают) коллоидно-дисперсные загрязнения.
Этот метод эффективен при очистке сточных вод от жиров, нефтепродуктов, красителей, масел, радиоактивных веществ и т. д. Он называется электрокоагуляцией.
д. Он называется электрокоагуляцией.
Гальваностегия — это электролитическое нанесение определенных металлов с целью защиты изделий от коррозии и для придания им соответствующего эстетического оформления (покрытие производят хромом, никелем, серебром, золотом, платиной и т. п.). Вещь тщательно очищают, обезжиривают, и используют как катод в электролитической ванне, в которую налит раствор соли того металла, которым необходимо покрыть изделие.
В качестве анода применяют пластину из этого же металла. Как правило применяют пару анодных пластин, а подлежащий гальваностегии предмет располагают между ними.
Гальванопластика – осаждение металла на поверхности разных тел для воспроизведения их формы: формы для отливки деталей, скульптур, печатных клише и т.д.
Гальваническое осаждение металла на поверхности предмета возможно лишь тогда, когда поверхность эта или весь предмет являются проводниками электрического тока, поэтому для изготовления моделей или форм желательно использовать металлы. Наиболее подходят для этой цели легкоплавкие металлы: свинец, олово, припои, сплав Вуда.
Наиболее подходят для этой цели легкоплавкие металлы: свинец, олово, припои, сплав Вуда.
Эти металлы мягки, легко обрабатываются слесарным инструментом, хорошо гравируются и отливаются. После наращивания гальванического слоя и отделки металл формы выплавляют из готового изделия.
Однако наибольшие возможности для изготовления моделей все же представляют диэлектрические материалы. Чтобы металлизировать такие модели, нужно придать их поверхности электропроводность. Успех или неудача в конечном итоге зависят в основном от качества токопроводящего слоя. Слой этот может быть нанесен одним из трех способов.
Самый распространенный способ — графитирование , он пригоден для моделей из пластилина и других материалов, допускающих растирание графита по поверхности.
Следующий прием — бронзирование , способ хорош для моделей относительно сложной формы, для разных материалов, однако за счет толщины бронзового слоя несколько искажается передача мелких деталей.
И, наконец, серебрение , пригодное во всех случаях, но особенно незаменимое для хрупких моделей с очень сложной формой — растений, насекомых и т. п.
п.
Химические источники тока
Также электролиз является основным процессом, благодаря которому функционируют самые современные химические источники тока, например батарейки и аккумуляторы. Здесь присутствуют два электрода, контактирующие с электролитом.
Лимонная батарейка (для увеличения нажмите нажмите на картинку)
Действие химических источников тока основано на протекании при замкнутой внешней цепи пространственно-разделённых процессов: на отрицательном аноде восстановитель окисляется, образующиеся свободные электроны переходят по внешней цепи к положительному катоду, создавая разрядный ток, где они участвуют в реакции восстановления окислителя. Таким образом, поток отрицательно заряженных электронов по внешней цепи идет от анода к катоду, то есть от отрицательного электрода к положительному.
Процессы, протекающие при электролизе
Электролиз получил широкое распространение в металлургии цветных металлов и в ряде химических производств. Такие металлы, как алюминий, цинк, магний, получают главным образом путем электролиза. Кроме того, электролиз используется для рафинирования (очистки) меди, никеля, свинца, а также для получения водорода, кислорода, хлора и ряда других химических веществ.
Такие металлы, как алюминий, цинк, магний, получают главным образом путем электролиза. Кроме того, электролиз используется для рафинирования (очистки) меди, никеля, свинца, а также для получения водорода, кислорода, хлора и ряда других химических веществ.
Сущность электролиза заключается в выделении из электролита при протекании через электролитическую ванну постоянного тока частиц вещества и осаждении их на погруженных в ванну электродах (электроэкстракция) или в переносе веществ с одного электрода через электролит на другой (электролитическое рафинирование). В обоих случаях цель процессов – получение возможно более чистых незагрязненных примесями веществ.
В отличие от металлов в электролитах (растворах солей, кислот и оснований в воде и в некоторых других растворителях, а также в расплавленных соединениях) наблюдается ионная электропроводность.
Электролиты являются проводниками второго рода. В этих растворах и расплавах имеет место электролитическая диссоциация – распад на положительно и отрицательно заряженные ионы.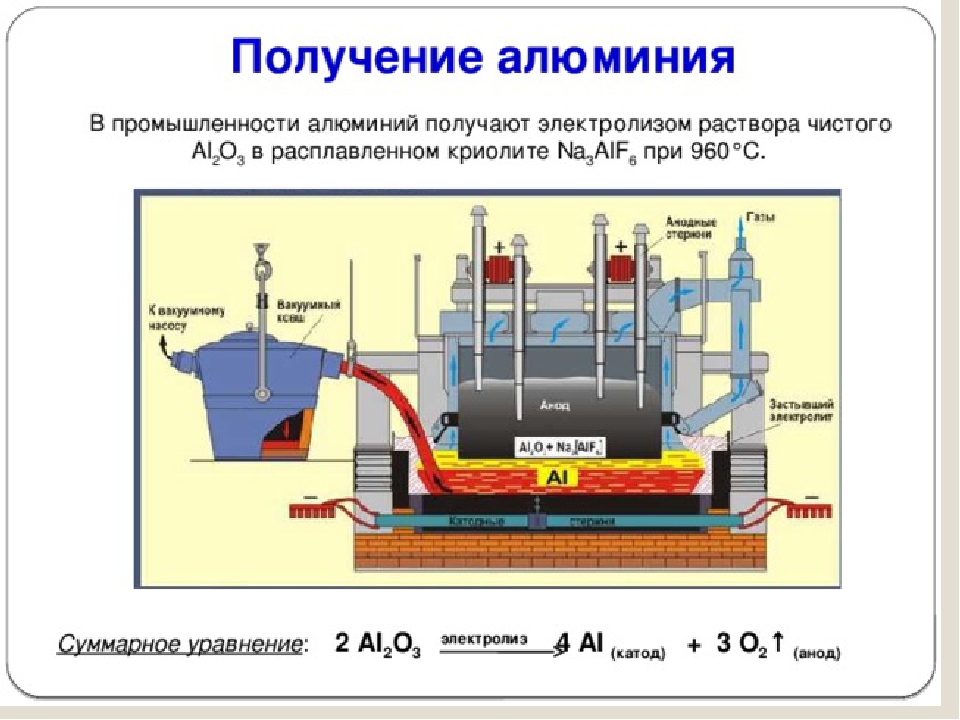
Если в сосуд с электролитом – электролизер поместить электроды, присоединенные к электрическому источнику энергии, то в нем начнет протекать ионный ток, причем положительно заряженные ионы – катионы будут двигаться к катоду (это в основном металлы и водород), а отрицательно заряженные ионы – анионы (хлор, кислород) – к аноду.
У анода анионы отдают свой заряд и превращаются в нейтральные частицы, оседающие на электроде. У катода катионы отбирают электроны у электрода и также нейтрализуются, оседая на нем, причем выделяющиеся на электродах газы в виде пузырьков поднимаются кверху.
Рис. 1. Процессы, протекающие при электролизе. Схема электролизной ванны: 1 – ванна, 2 – электролит, 3 – анод, 4 – катод, 5 – источник питания
Электрический ток во внешней цепи представляет собой движение электронов от анода к катоду (рис. 1). При этом раствор обедняется, и для поддержания непрерывности процесса электролиза приходится его обогащать. Так осуществляют извлечение тех или иных веществ из электролита (электроэкстракцию).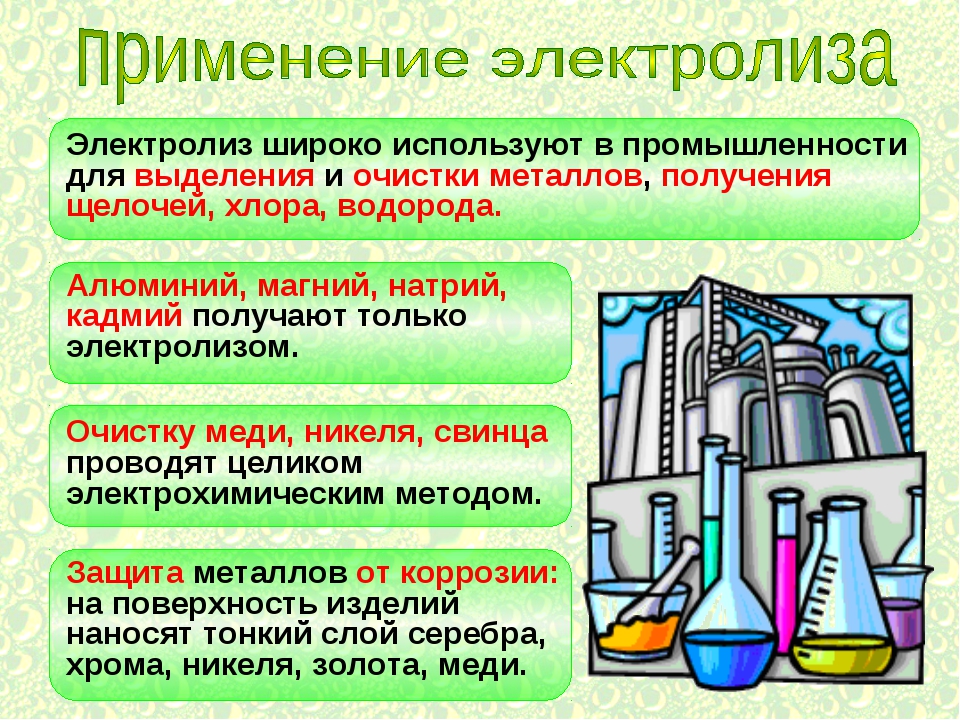
Если же анод может растворяться в электролите по мере обеднения последнего, то частицы его, растворяясь в электролите, приобретают положительный заряд и направляются к катоду, на котором осаждаются, тем самым осуществляется перенос материала с анода на катод. Так как при этом процесс ведут так, чтобы содержащиеся в металле анода примеси не переносились на катод, такой процесс называется электролитическим рафинированием.
Если электрод поместить в раствор с ионами того же вещества, из которого он изготовлен, то при некотором потенциале между электродом и раствором не происходит ни растворения электрода, ни осаждения на нем вещества из раствора.
Такой потенциал называется нормальным потенциалом вещества. Если на электрод подать более отрицательный потенциал, то на нем начнется выделение вещества (катодный процесс), если же более положительный, то начнется его растворение (анодный процесс).
Значение нормальных потенциалов зависит от концентрации ионов и температуры. Принято считать нормальный потенциал водорода за нуль. В табл. 1 даны нормальные электродные потенциалы некоторых водных растворов веществ при +25° С.
Принято считать нормальный потенциал водорода за нуль. В табл. 1 даны нормальные электродные потенциалы некоторых водных растворов веществ при +25° С.
Таблица 1. Нормальные электродные потенциалы при +25° С
Если в электролите имеются ионы разных металлов, то первыми на катоде выделяются ионы, имеющие меньший отрицательный нормальный потенциал (медь, серебро, свинец, никель), щелочноземельные металлы выделить труднее всего. Кроме того, в водных растворах всегда имеются ионы водорода, которые будут выделяться ранее, чем все металлы, имеющие отрицательный нормальный потенциал, поэтому при электролизе последних значительная или даже большая часть энергии затрачивается на выделение водорода.
Путем специальных мер можно воспрепятствовать в известных пределах выделению водорода, однако металлы с нормальным потенциалом меньше 1 В (например, магний, алюминий, щелочноземельные металлы) получить электролизом из водного раствора не удается. Их получают разложением расплавленных солей этих металлов.
Нормальные электродные потенциалы веществ, указанные в табл. 1, являются минимальными, при них начинается процесс электролиза, практически требуются большие значения потенциала для развития процесса.
Разность между действительным потенциалом электрода при электролизе и нормальным для него потенциалом называют перенапряжением. Оно увеличивает потери энергии при электролизе.
С другой стороны, увеличивая перенапряжение для ионов водорода, можно затруднить его выделение на катоде, что позволяет получить электролизом из водных растворов ряд таких более отрицательных по сравнению с водородом металлов, как свинец, олово, никель, кобальт, хром и даже цинк. Это достигается ведением процесса при повышенных плотностях тока на электродах, а также введением в электролит некоторых веществ.
Течение катодных и анодных реакций при электролизе определяется следующими двумя законами Фарадея.
1. Масса вещества m
э, выделившегося при электролизе на катоде или перешедшего с анода в электролит, пропорциональна количеству прошедшего через электролит электричества Iτ : m
э = α
/τ
,здесь а – электрохимический эквивалент вещества, г/Кл.
2. Масса выделенного при электролизе вещества одним и тем же количеством электричества прямо пропорциональна атомной массе вещества А и обратно пропорциональна его валентности n : m э = А / 96480n , здесь 96480 – число Фарадея, Кл х моль -1 .
Таким образом, электрохимический эквивалент вещества α = А / 96480n представляет собой массу вещества в граммах, выделяемую единицей проходящего через электролитическую ванну количества электричества – кулоном (ампер-секундой).
Для меди А = 63,54, n =2, α =63,54/96480 -2 = 0,000329 г/Кл, для никеля α =0,000304 г/Кл, для цинка α =0,00034 г/Кл.
В действительности масса выделившегося вещества всегда меньше указанной, что объясняется рядом побочных процессов, проходящих в ванне (например, выделением водорода на катоде), утечками тока и короткими замыканиями между электродами.
Отношение массы фактически выделившегося вещества к массе его, которая должна была бы выделиться по закону Фарадея, носит название выхода вещества по току η1.
Следовательно, для реального процесса m э = η1 х ( А / 96480n) х It
Естественно, всегда η1
Выход по току существенно зависит от плотности тока на электроде. С увеличением плотности тока на электроде выход по току растет и повышается эффективность процесса.
Напряжение U эл, которое необходимо подвести к электролизеру, состоит из: напряжения разложения Ер (разность потенциалов анодной и катодной реакций), суммы анодного и катодного перенапряжений падения напряжения в электролите Еп, падения напряжения в электролите U э = IR эп (R эп – сопротивление электролита), падения напряжения в шинах, контактах, электродах U с = I (R ш+R к+R э). Получаем: U эл = Ер + Еп + U э + U с.
Мощность, потребляемая при электролизе, равна: Рэл = IU эл = I (Ер + Еп + U э + U с)
Из этой мощности только первая составляющая расходуется на проведение реакций, остальные являются тепловыми потерями процесса. Лишь при электролизе расплавленных солей часть теплоты, выделяющейся в электролите IU
э, используется полезно, так как расходуется на расплавление загружаемых в электролизер солей.
Эффективность работы электролизной ванны, может быть оценена массой вещества в граммах, выделяемого на 1 Дж затраченной электроэнергии. Эта величина носит название выхода вещества по энергии. Ее можно найти по выражению q э = (αη1)/U эл100, здесь α – электрохимический эквивалент вещества, г/Кл, η1 – выход по току, U эл – напряжение на электролизере, В.
Для электролиза, т.е. осуществления электрохимических процессов путем пропускания постоянного тока от внешнего источника. Электролизер состоит из корпуса (ванны), двух или нескольких электродов (катодов и анодов), иногда разделенных диафрагмой, и заполненного электролитом. По способу в электрическую цепь электролизер разделяют на моно- и биполярные. Монополярный электролизер состоит из одной электролитической ячейки с электродами одной полярности, каждый из которых может состоять из нескольких элементов, включенных в цепь тока параллельно.
Биполярный электролизер имеет большое ячеек (до 100-160), включенных в цепь тока последовательно, причем каждый , за исключением двух крайних, работает одной стороной как , а другой как . Для изготолвения анодов применяется , углеграфитовые , Pb и его Ti и др. Для катодов в большинстве электролизеров используется . Для регулирания процессов массо- и теплопереноса в электролизере используются мешалки или проток электролита, встроенные или выносные теплообменники. Одна из важных характеристик электролизера – рассеивающая , зависящая от конструкции электролизера и от состава электролита. Современные крупные электролизеры имеют высокую нагрузку: монополярные до 400-500 кА, биполярные – эквивалентную 1600кА.
Для изготолвения анодов применяется , углеграфитовые , Pb и его Ti и др. Для катодов в большинстве электролизеров используется . Для регулирания процессов массо- и теплопереноса в электролизере используются мешалки или проток электролита, встроенные или выносные теплообменники. Одна из важных характеристик электролизера – рассеивающая , зависящая от конструкции электролизера и от состава электролита. Современные крупные электролизеры имеют высокую нагрузку: монополярные до 400-500 кА, биполярные – эквивалентную 1600кА.
Энциклопедический словарь по металлургии. – М.: Интермет Инжиниринг . Главный редактор Н.П. Лякишев . 2000 .
Синонимы :Смотреть что такое “Электролизер” в других словарях:
электролизер – электролизер … Орфографический словарь-справочник
электролизер – сущ., кол во синонимов: 2 электролизатор (1) электролизёр (1) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
Электролизер Официальная терминология
электролизер – — [Я.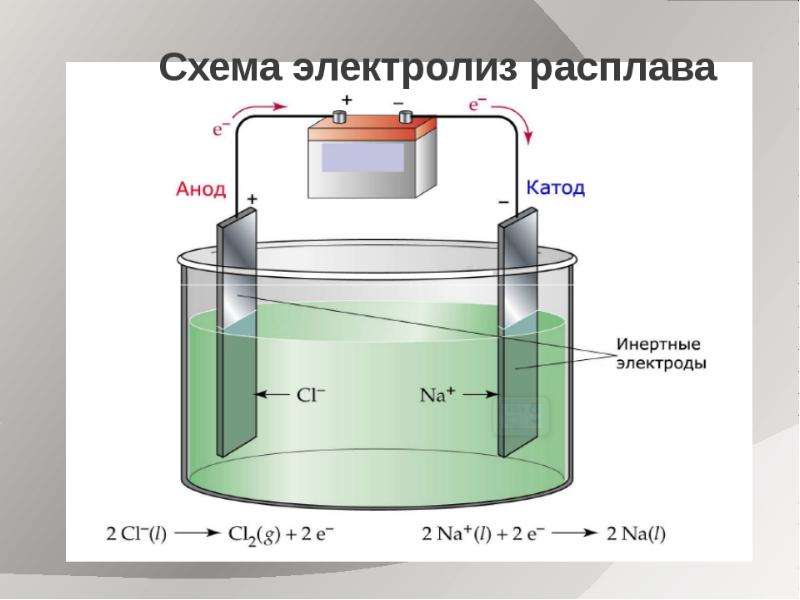 Н.Лугинский, М.С.Фези Жилинская, Ю.С.Кабиров. Англо русский словарь по электротехнике и электроэнергетике, Москва, 1999 г.] Тематики электротехника, основные понятия EN electrolyte pot …
Н.Лугинский, М.С.Фези Жилинская, Ю.С.Кабиров. Англо русский словарь по электротехнике и электроэнергетике, Москва, 1999 г.] Тематики электротехника, основные понятия EN electrolyte pot …
Электролизер – сборный аппарат, как правило, фильтр прессного типа, работающий под давлением, состоящий из сжатых между собой концевыми плитами и отделенных изолирующими прокладками биполярных электродов, при прохождении через которые постоянного тока… … Словарь-справочник терминов нормативно-технической документации
электролизер – elektrolizeris statusas T sritis chemija apibrėžtis Elektrolizės įrenginys. atitikmenys: angl. electrolyser rus. электролизер … Chemijos terminų aiškinamasis žodynas
Электролизер – электролизёр м. Аппарат для электролиза, состоящий из наполненного электролитом сосуда и расположенных в нём электродов. Толковый словарь Ефремовой. Т. Ф. Ефремова. 2000 … Современный толковый словарь русского языка Ефремовой
Ртутный электролизер — [Я. Н.Лугинский, М.С.Фези Жилинская, Ю.С.Кабиров. Англо русский словарь по электротехнике и электроэнергетике, Москва, 1999 г.] Тематики электротехника, основные понятия Синонимы ртутный электролизер EN mercury cell … Справочник технического переводчика
Н.Лугинский, М.С.Фези Жилинская, Ю.С.Кабиров. Англо русский словарь по электротехнике и электроэнергетике, Москва, 1999 г.] Тематики электротехника, основные понятия Синонимы ртутный электролизер EN mercury cell … Справочник технического переводчика
электролизер для получения кислорода и водорода – — [Я.Н.Лугинский, М.С.Фези Жилинская, Ю.С.Кабиров. Англо русский словарь по электротехнике и электроэнергетике, Москва, 1999 г.] Тематики электротехника, основные понятия EN oxygen hydrogen celloxyhydrogen cell … Справочник технического переводчика
печь-электролизер с индукционным обогревом – — [Я.Н.Лугинский, М.С.Фези Жилинская, Ю.С.Кабиров. Англо русский словарь по электротехнике и электроэнергетике, Москва, 1999 г.] Тематики электротехника, основные понятия EN double current furnace … Справочник технического переводчика
Электролиз. Процесс электролиза | Химическая энциклопедия
В результате многих химических реакций происходит переход электронов от одних атомов к другим. Такие реакции сопровождаются изменением степени окисления атомов и называются окислительно-восстановительными.
Такие реакции сопровождаются изменением степени окисления атомов и называются окислительно-восстановительными.
Очень важное практическое значение имеют такие окислительно-восстанови- тельные процессы, в которых переход электронов осуществляется не при непосредственном контакте частиц восстановителя и окислителя между собой, а в разных частях системы (на электродах, пространственно разделенных). Существуют два варианта проведения таких процессов.
В первом варианте реакция, которая не может протекать самопроизвольно, протекает под действием внешнего источника электрического тока, и такой процесс называется электролизом.
Электролиз — это окислительно-восстановительная реакция, протекающая под действием электрического тока.
На практике широко применяются процессы электролиза солей металлов (расплавов и водных растворов), оснований и кислот.
Процесс электролиза
Процесс электролиза протекает при пропускании электрического тока через расплав или раствор электролита. Для проведения электролиза необходимо два электрода погрузить в расплав или раствор электролита и подключить к внешнему источнику тока. Электродами могут служить либо обычные металлические проводники, либо неметаллические электропроводящие материалы (например, графит). На одном электроде протекает процесс окисления, а на другом — процесс восстановления.
Для проведения электролиза необходимо два электрода погрузить в расплав или раствор электролита и подключить к внешнему источнику тока. Электродами могут служить либо обычные металлические проводники, либо неметаллические электропроводящие материалы (например, графит). На одном электроде протекает процесс окисления, а на другом — процесс восстановления.
Электрод, на котором протекает процесс окисления, называется анодом, а электрод, на котором протекает процесс восстановления, — катодом.
При проведении процесса электролиза электрод, который подключен к положительному полюсу внешнего источника тока, является анодом, а к отрицательному — катодом.
[table “” not found /]
Вам необходимо включить JavaScript, чтобы проголосовать
Основы электролиза: Что такое электрохимическое извлечение?
Электрохимическое извлечение широко используется в современной промышленности при переработке металла, его добыче, аффинаже и очистке сточных вод.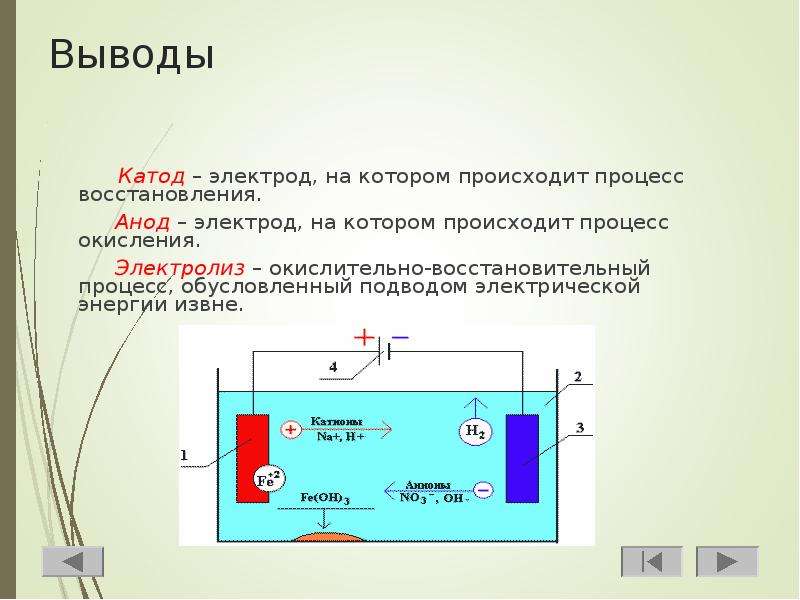 Электрохимическое извлечение – один из самых первых открытых методов электролиза, оно было предложено английским химиком Гемфри Дэви (Humphry Davy) в 1807. Спустя 66 долгих лет Аффинажная и плавильная компания Бальбаха и сыновей (Balbach and Sons Refining and Smelting Company) использовала его в первом коммерческом аффинажном заводе, вскоре после чего стала второй по величине металлоперерабатывающей компанией в Соединенных штатах.
Электрохимическое извлечение – один из самых первых открытых методов электролиза, оно было предложено английским химиком Гемфри Дэви (Humphry Davy) в 1807. Спустя 66 долгих лет Аффинажная и плавильная компания Бальбаха и сыновей (Balbach and Sons Refining and Smelting Company) использовала его в первом коммерческом аффинажном заводе, вскоре после чего стала второй по величине металлоперерабатывающей компанией в Соединенных штатах.
Современные технологии должны извиниться перед экологией.”
-Уэнделл Берри
Но прежде, чем мы углубимся в понимание электрохимического извлечения, давайте более подробно рассмотрим, что такое процесс электролиза, так как электрохимическое извлечение является электролитическим процессом.
Электролиты это растворы, содержащие большую концентрацию ионов, обеспечивающих прохождение электрического тока.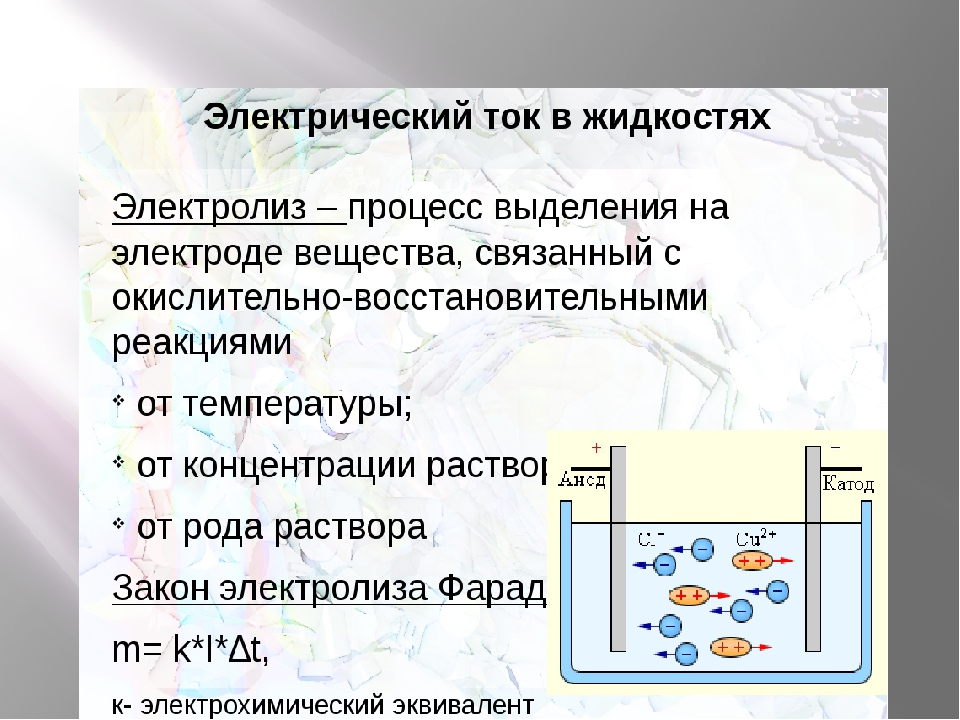 Электролитические процессы основаны на явлении электролиза, т. е. окислительно-восстановительных процессах, происходящих в электролите и на электродах при прохождении через электролит постоянного тока. Электролит состоит из положительно и отрицательно заряженных ионов (катионов и анионов). При пропускании через раствор постоянного тока положительно заряженные ионы (катионы) притягиваются к катоду, а отрицательно заряженные ионы (анионы) – к аноду. Подобные процессы называют электролитическими; электрохимическое извлечение основано на том же принципе.
Электролитические процессы основаны на явлении электролиза, т. е. окислительно-восстановительных процессах, происходящих в электролите и на электродах при прохождении через электролит постоянного тока. Электролит состоит из положительно и отрицательно заряженных ионов (катионов и анионов). При пропускании через раствор постоянного тока положительно заряженные ионы (катионы) притягиваются к катоду, а отрицательно заряженные ионы (анионы) – к аноду. Подобные процессы называют электролитическими; электрохимическое извлечение основано на том же принципе.
В электролите для электрохимического извлечения содержатся растворенные металлы, которые и должны быть извлечены. Процесс электролитической очистки, используемый для повышения чистоты металлов очень похож на процесс электролитического извлечения. Оба метода применяются для получения цветных металлов (например, меди и серебра) и в обоих методах используется гальваническое осаждение целевого металла.
Типовая установка для электрохимического извлечения состоит из бака, выпрямителя и насоса. Катоды и аноды смонтированы в баке. Насос заполняет бак раствором электролита. С выпрямителя на катоды и аноды подается постоянное напряжение, вследствие чего из-за разности электрических потенциалов начинается перемещение катионов к катоду. В процессе работы установки положительно заряженные ионы осаждаются на катодах. Важно отметить, что по мере осаждения целевого металла на катоде его концентрация в растворе падает и темпы осаждения снижаются. При снижении темпов осаждения ниже границы практической применимости катоды с осажденным на них чистым металлом извлекаются из установки. В случае переработки жидких отходов раствор (сточные воды) очищается или концентрация цветных металлов в нем значительно снижается, так что он может в дальнейшем использоваться для химического осаждения или быть вторично использован в производственном процессе.
Катоды и аноды смонтированы в баке. Насос заполняет бак раствором электролита. С выпрямителя на катоды и аноды подается постоянное напряжение, вследствие чего из-за разности электрических потенциалов начинается перемещение катионов к катоду. В процессе работы установки положительно заряженные ионы осаждаются на катодах. Важно отметить, что по мере осаждения целевого металла на катоде его концентрация в растворе падает и темпы осаждения снижаются. При снижении темпов осаждения ниже границы практической применимости катоды с осажденным на них чистым металлом извлекаются из установки. В случае переработки жидких отходов раствор (сточные воды) очищается или концентрация цветных металлов в нем значительно снижается, так что он может в дальнейшем использоваться для химического осаждения или быть вторично использован в производственном процессе.
Электрохимическое извлечение практически не изменялось, но 20 лет назад появились передовые технологии электролиза, основанные на использовании цилиндрических ячеек с высокой скоростью протока, повышающей объемы массопереноса. Ячейки способны работать при низкой концентрации и обеспечивают выпуск продукции высокой степени чистоты даже в присутствии примесей. Первая цилиндрическая электролизная ячейка была разработана и выпущена на рынок компанией Electrometals под названием emew, что означает Electrometals electrowinning (электрохимическое извлечение по методу Electrometals). Преимущества цилиндрических ячеек расширили область применения электрохимического извлечения за пределы простой очистки металлов, позволив использовать его для переработки, утилизации твердых отходов, очистки сточных вод и даже в таких высокотехнологичных областях как производство полупроводников.
Ячейки способны работать при низкой концентрации и обеспечивают выпуск продукции высокой степени чистоты даже в присутствии примесей. Первая цилиндрическая электролизная ячейка была разработана и выпущена на рынок компанией Electrometals под названием emew, что означает Electrometals electrowinning (электрохимическое извлечение по методу Electrometals). Преимущества цилиндрических ячеек расширили область применения электрохимического извлечения за пределы простой очистки металлов, позволив использовать его для переработки, утилизации твердых отходов, очистки сточных вод и даже в таких высокотехнологичных областях как производство полупроводников.
Несмотря на то, что электрохимическое извлечение в основном используется для получения цветных металлов, таких как медь, никель, олово, кадмий или благородных металлов вроде золота, серебра и платины, также оно может использоваться и в отраслях производства, требующих очистки сточных вод. Электролизный цех может работать 24 часа в сутки 7 дней в неделю и предоставляет следующие преимущества:
- Сокращение объема отходов и использования воды
- Повышение качества управления производственным процессом
- Соответствие экологическим требованиям
- Извлеченные металлы могут быть проданы с целью получения прибыли
- Технология сертифицирована и обеспечивает стабильный результат
Учитывая все это технология электрохимического извлечения остается основой технологического процесса в горнодобывающей, металлоперерабатывающей и металлообрабатывающей промышленностях, предоставляя значительные экономические и экологические преимущества.
Химические процессы, протекающие при электролизе
Электролизом называют совокупность химических процессов, которые протекают под действием электрического тока на электродах, погруженных в раствор или расплав электролита. [c.210]Понятие об электролизе и электрохимических процессах. Электрохимическими процессами называют химические процессы, протекаю-шие в водных растворах или расплавах под действием постоянного электрического тока. [c.122]
Составьте схему электролиза воды. Какие химические процессы протекают при этом Как практически осуществить этот процесс [c.81]
Общие понятия. Электролизом называются процессы, происходящие на электродах под действием электрического тока, подаваемого от внешнего источника. При электролизе происходит превращение электрической энергии в химическую. Ячейка для электролиза, называемая электролизером, состоит из двух электродов и электролита между ними. Электрод, на котором идет реакция восстановления (катод), у электролизера подключен к отрицательному полюсу внешнего источника тока. Электрод, на котором протекает реакция окисления (анод), подключен к положительному полюсу источника тока. [c.200]
Электрод, на котором идет реакция восстановления (катод), у электролизера подключен к отрицательному полюсу внешнего источника тока. Электрод, на котором протекает реакция окисления (анод), подключен к положительному полюсу источника тока. [c.200]
Какие химические процессы протекают на угольных электродах при электролизе водных растворов хлорида меди (И), сульфата натрия, сульфата меди(И) [c.123]
Из этого примера видно, что при электролизе, как и при работе химического источника тока, на аноде происходят процессы окисления, а на катоде — восстановления. При этом анод заряжен положительно ( + ), а катод — отрицательно ( —). Отметим, что при работе химического источника тока, напротив, анод заряжается отрицательно, а катод — положительно, поскольку в этом случае протекают процессы, обратные электролизу. [c.84]
Какие химические процессы протекают при электролизе растворов СиЗО и КаКОз, если взяты электроды а) угольные б) медные Составьте соответствующие схемы электролиза. [c.125]
[c.125]
Электрохимическими называются производства, в которых химические процессы протекают под действием постоянного электрического тока. В промышленности широкое распространение получил электролиз водных растворов и расплавов. Электрохимические методы производства в ряде случаев имеют преимущества перед химическими упрощается технологический процесс, более полно используется сырье и энергия, одновременно может производиться несколько ценных продуктов, продукты получаются высокой степени чистоты, недостижимой при химических способах производства. Благодаря указанным достоинствам электрохимические процессы используют при производстве важнейших продуктов хлора, щелочей, водорода, кислорода, неорганических окислителей (перманганаты, персульфаты, перекись водорода и др.), при получении и рафинировании металлов (алюминия, магния, цинка, натрия, меди и др.), декоративных и защитных (от коррозии) покрытий металлов. [c.129]
Применительно к химическим процессам второй закон термодинамики можно сформулировать так всякое химическое взаимодействие при неизменных давлении или объеме и постоянстве температуры протекает в направлении уменьшения свободной энергии системы.
 Пределом протекания химических реакций (т. е. условием равновесия) является достижение некоторого минимального для данных условий значения свободной энергии системы О или Р. Процессы протекают самопроизвольно и дают некоторую полезную работу, если Р0 и ДС>0 процессы не могут при заданных условиях (у, Т или р, Т) протекать самопроизвольно и возможны лишь при получении работы извне (например, реакции при электролизе, фотохимические реакции и др.). Изменение термодинамических функций А[1, АР, А/, АО и А5 для любых реакций рассчитывают по закону Гесса аналогично вычислению тепловых эффектов реакций. Значения термодинамических функций при стандартных условиях / = 25°С и р=101 325 Па приводятся в справочных таблицах. [c.61]
Пределом протекания химических реакций (т. е. условием равновесия) является достижение некоторого минимального для данных условий значения свободной энергии системы О или Р. Процессы протекают самопроизвольно и дают некоторую полезную работу, если Р0 и ДС>0 процессы не могут при заданных условиях (у, Т или р, Т) протекать самопроизвольно и возможны лишь при получении работы извне (например, реакции при электролизе, фотохимические реакции и др.). Изменение термодинамических функций А[1, АР, А/, АО и А5 для любых реакций рассчитывают по закону Гесса аналогично вычислению тепловых эффектов реакций. Значения термодинамических функций при стандартных условиях / = 25°С и р=101 325 Па приводятся в справочных таблицах. [c.61] Электрокоагуляционный метод очистки сточных вод используется в отечественной практике для выделения хрома. Кроме того, в некоторых случаях он может быть применен и для очистки стоков от ионов тяжелых металлов. При реализации этого метода протекают следующие физико-химические процессы электролиз воды, поляризация частиц, электрофорез, окислительно-восстановительные процессы, взаимодействие продуктов электролиза друг с другом.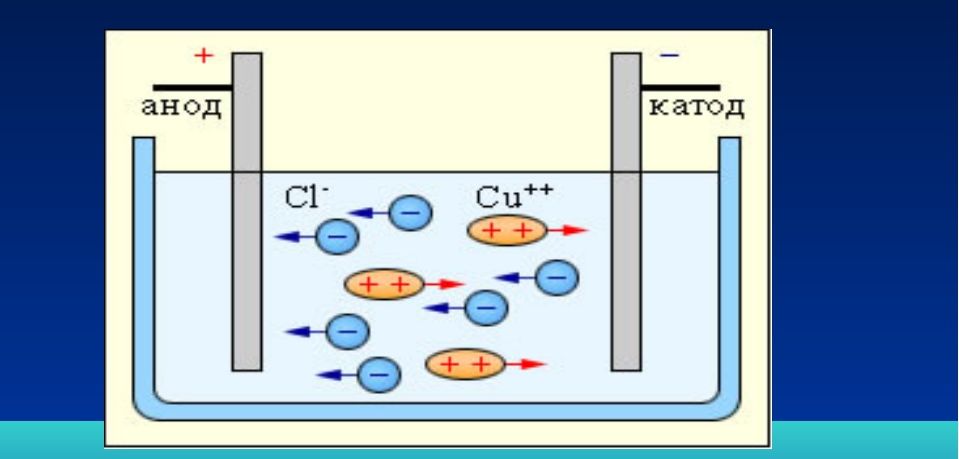 [c.210]
[c.210]
Электролизом называется электронный химический процесс, наблюдаемый при прохождении постоянного электрического тока через электролиты. При электролизе на электродах непрерывно протекают окислительно-восстановительные процессы на катоде — процесс восстановления, на аноде — окисления. Продукты этих реакций или откладываются на электродах, или вступают во вторичные реакции (взаимодействуют между собой, с молекулами растворителя или с веществом электрода), или накапливаются в растворе у электродов. Протекание первичных анодных и катодных процессов подчиняется законам, установленным английским ученым М. Фарадеем (1834). [c.134]
Электрохимия — раздел физической химии, изучающий процессы превращения энергии химической реакции в электрическую и, наоборот, электрической энергии в химическую. Первый процесс протекает в гальванических элементах, второй при электролизе. [c.359]
Электронно-ионный метод составления лучше отражает процесс окисления — восстановления и позволяет легко писать эти уравнения в ионной и молекулярной формах. К тому же при этом методе не требуется знание валентности элементов, а написание отдельных уравнений окисления и восстановления в общей реакции необходимо для понимания химических процессов (у анода и катода) в гальванических элементах и при электролизе, Метод применим ко всем реакциям, которые протекают в водных растворах. [c.134]
К тому же при этом методе не требуется знание валентности элементов, а написание отдельных уравнений окисления и восстановления в общей реакции необходимо для понимания химических процессов (у анода и катода) в гальванических элементах и при электролизе, Метод применим ко всем реакциям, которые протекают в водных растворах. [c.134]
Опыты по электролизу весьма наглядны и протекают быстро. Использование этого прибора сокращает время для подготовки к демонстрации, способствует научной организации труда, оптимизации процесса обучения. Вмонтированные электрические часы позволяют использовать данный прибор в качестве секундомера для измерения скорости протекания химических процессов и для определения количества грамм-эквивалентов веществ, выделенных на электродах. При помощи сменных электродов можно проводить электролиз разных веществ, применять один и тот же прибор на различных этапах обучения. [c.155]
Электролизом называют совокупность процессов, в которых химические реакции протекают на электродах при пропускании постоянного электрического тока через расплавы или растворы электролитов. [c.161]
Бромирование анилина протекает медленно, поэтому предварительно электрогенерируют избыток Вгг из бромида калия и после завершения химической реакции образования триброманилина, реверсируя ток электролиза, титруют избыток Вгг катодно генерированными Си+-ионами. Этот процесс протекает с большой скоростью, так как Вгг восстанавливается как непосредственно на Pt-электроде, так и химически электрогенерированными Си+-ионами. [c.221]
Как известно, при электролизе на катоде идет химический процесс восстановления, на аноде — окисления. В этих процессах могут участвовать не только ионы растворенных веществ, но и ионы, образующиеся вследствие процессов автоионизации растворителя (см. с. И). Так, если в воде растворен, например, хлористый цинк, то на катоде протекает процесс 2п + 2 = 2п, [c.73]
Электролизом называется окислительно-восстанови-тельный процесс, протекающий на электродах при прохождении постоянного электрического тока через раствор или расплав электролита. Химические реакции протекают на электродах за счет электрической энергии. При электролизе катод является восстановителем, так как он отдает электроны, а анод — окислителем, так как он принимает электроны от анионов. [c.178]
Химические реакции протекают на электродах за счет электрической энергии. При электролизе катод является восстановителем, так как он отдает электроны, а анод — окислителем, так как он принимает электроны от анионов. [c.178]
В качестве примера электровосстановления органических веществ рассмотрим процесс восстановления нитробензола, подробно изученный Габером (см. работы ) и имеющий промышленное значение. Восстановление нитробензола протекает через ряд промежуточных стадий—как электрохимических, так и химических. Варьируя условия электролиза, можно направить процесс по желаемому пути и получать различные продукты восстановления. [c.121]
Проводниками второго рода являются электролиты, т. е. водные растворы солей, кислот и оснований, а также расплавленные соли и основания. Электропроводность проводников второго рода обусловлена движением ионов — заряженных частиц электролита. При прохождении электрического тока через электролиты протекает химический процесс разложения вещества, называемый электролизом. [c.188]
[c.188]
Первый случай реализуется тогда, когда основной компонент менее благороден, чем его примеси, которые имеют более положительные потенциалы. В этом случае основной металл при определенных условиях не выделяется электролитически, а остается в растворе. Электролитическое выделение веществ, находящихся в малых количествах, имеет существенные особенности выделяющиеся в результате электрохимического процесса атомы примесей могут занимать только очень небольшую долю поверхности электрода, вследствие чего электродные процессы протекают здесь на поверхности, в химическом и физическом смысле чужеродной, что существенным образом сказывается на характере протекания электролиза. [c.135]
Первая заключается в том, что многие электрохимические процессы протекают ступенчато с образованием ряда промежуточных продуктов, соответствующих различным ступеням окисления или восстановления. Каждая из этих стадий протекает при вполне определенном потенциале. Это позволяет, используя электролиз при контролируемом потенциале, осуществлять процесс с высокой селективностью, направляя его в сторону преимущественного образования одного продукта, что выгодно отличает электрохимические методы от многих химических методов окисления или восстановления органических соединений. [c.575]
Это позволяет, используя электролиз при контролируемом потенциале, осуществлять процесс с высокой селективностью, направляя его в сторону преимущественного образования одного продукта, что выгодно отличает электрохимические методы от многих химических методов окисления или восстановления органических соединений. [c.575]
Электролиз. Через проводники первого рода электричество переносится электронами, а через проводники второго рода — ионами. В тех местах электрической цепи, где проводник первого рода граничит с проводником второго рода, электроны вступают во взаимодействие с ионами—происходят электрохимические процессы. Если эти процессы протекают самопроизвольно, то система-называется химическим источником электрической энергии. Если же их протекание обусловлено подводом электрической энергии извне, то происходит электролиз. [c.290]
В расплавленных электролитах возможно создание тех же типов гальванических цепей, как и в водных растворах. Последовательность разряда ионов при электролизе расплавов сохраняет зависимость, сходную с таковой для водных растворов. Из-за отсутствия воды процессы при электролизе расплавов протекают гораздо проще. Однако электролиз расплавленных соединений сопровождается рядом специфических явлений. Причиной их является высокая температура процесса, которая вызывает резкое возрастание скорости химических реакций. Электролит и продукты электролиза могут реагировать между собой и с.воздухом, а также с материалами электродов и электролизера. Возникающие при этом новые соединения и имеющиеся в солях примеси также увеличивают количество возможных химических и электрохимических реакций. [c.226]
Последовательность разряда ионов при электролизе расплавов сохраняет зависимость, сходную с таковой для водных растворов. Из-за отсутствия воды процессы при электролизе расплавов протекают гораздо проще. Однако электролиз расплавленных соединений сопровождается рядом специфических явлений. Причиной их является высокая температура процесса, которая вызывает резкое возрастание скорости химических реакций. Электролит и продукты электролиза могут реагировать между собой и с.воздухом, а также с материалами электродов и электролизера. Возникающие при этом новые соединения и имеющиеся в солях примеси также увеличивают количество возможных химических и электрохимических реакций. [c.226]
Таким образом, при электролизе сточных вод протекает ряд различных физико-химических процессов, обусловливающих эффект очистки сточных вод от растворенных н диспергированных примесей. [c.94]
Процессы электролиза, как правило, необратимы и протекают во времени с конечными скоростями. Законы протекания электродных реакций во времени и их механизм изучаются методами электрохимической кинетики. В электрохимической кинетике используются положения химической кинетики, но учитывается специфика электрохимических превращений, в частности то, что электрохимический процесс протекает на поверхности электрода, т. е. является гетерогенным. [c.301]
Законы протекания электродных реакций во времени и их механизм изучаются методами электрохимической кинетики. В электрохимической кинетике используются положения химической кинетики, но учитывается специфика электрохимических превращений, в частности то, что электрохимический процесс протекает на поверхности электрода, т. е. является гетерогенным. [c.301]
Электрохимические (кулоно-, кондукто-, потенциометрические, полярографические) методы могут быть успешно применены для определения содержания воды. Наиболее распространены кулонометрические и меньше кондуктометрические. Кулонометрические методы основаны на способности чувствительного к воде реагента образовываться на электроде ячейки, а также на измерении продуктов реакции при электролизе. В этом случае массу воды определяют по количеству тока, пошедшего на электрохимические процессы в соответствии с законом Фарадея. Реально применяют метод кулонометрии, основанный на взаимодействии воды с тонкой пленкой пятиокиси фосфора. Механизм процесса заключается в электрохимическом разложении образовавшейся метафосфорной кислоты. При электролизе опять образуется исходная пятиокись фосфора, поэтому химический и электрохимический процессы протекают совместно и воду можно определять непрерывно с высокой разрешающей способностью и чувствительностью (до 0,001 %). Основным недостатком метода является необходимость применения для экстракции воды предварительно осущенного инертного газа. [c.305]
Механизм процесса заключается в электрохимическом разложении образовавшейся метафосфорной кислоты. При электролизе опять образуется исходная пятиокись фосфора, поэтому химический и электрохимический процессы протекают совместно и воду можно определять непрерывно с высокой разрешающей способностью и чувствительностью (до 0,001 %). Основным недостатком метода является необходимость применения для экстракции воды предварительно осущенного инертного газа. [c.305]
Химические процессы, происходящие при разряжении на электродах ионов Н+, ОН и т. д., из которых затем образуются молекулы Нд и Ог, являются сложными процессами, состоящими из нескольких стадий. Перенапряжение указывает на то, что одна из этих стадий должна быть медленной, т. е. протекает не мгновенно, как обычные ионные реакции. При таких реакциях образуются или разрываются ковалентные связи. При описании некоторых реакций, протекающих в процессе электролиза, с целью упрощения допускалось (стр. 201), что на электродах сначала образуются свободные атомы. Однако возможны и другие объяснения этих реакций, ход которых еще не совсем ясен. [c.237]
Однако возможны и другие объяснения этих реакций, ход которых еще не совсем ясен. [c.237]
Процессы электролиза, как правило, необратимы и протекают во времени с конечными скоростями. Законы протекания электродных реакций во времени и их механизм изучаются методами электрохимической кинетики. В электрохимической кинетике используются положения химической кинетИки, но учитывается специфика электрохимических превращений, в частности то, что электрохимический процесс протекает на поверхности электрода, т. е. является гетерогенным. Электродные превращения отличаются от гетерогенных химических процессов прежде всего наличием собственно электрохимической стадии — реакции переноса заряда, называемой также стадией перехода. Поэтому и в состьетствии с законами Фарадея скорость электродной реакции [c.301]
В дальнейшем круг вопросов, изучаемых термодинамикой, значительно расширился. В настоящее время термодинамика рассматривает большое количество физических и химических явлений, сопровождающихся энергетическими эффектами. На основе законов термодинамики изучаются, например, работа холодильных машин, процессы в компрессорах, в двигателях внутреннего сгорания, в реактивных двигателях, процессы при электролизе, работе гальванических элементов, при проведении различных химических реакций. Исследования методами термодинамики по.чволяют не только подводить энергетические балансы, но также определять, в каком направлении и до какого предела могут протекать процессы при заданных условиях. Термодинамика, таким образом, дает” возможность сознательно управлять различными физико-химическими процессами производств. [c.71]
На основе законов термодинамики изучаются, например, работа холодильных машин, процессы в компрессорах, в двигателях внутреннего сгорания, в реактивных двигателях, процессы при электролизе, работе гальванических элементов, при проведении различных химических реакций. Исследования методами термодинамики по.чволяют не только подводить энергетические балансы, но также определять, в каком направлении и до какого предела могут протекать процессы при заданных условиях. Термодинамика, таким образом, дает” возможность сознательно управлять различными физико-химическими процессами производств. [c.71]
Окислительные и восстановительные процессы, происходящие на электродах при пропускании постоянного электрического тока через систему, включающую электролит, называются электролизом. Химические реакции, протекающие прн электролизе, осуществляются при помощи энергии электрического тока, подведенного извне. Следовательно, при электролизе происходит преобразование электрической энергии в химическую. Процесс , окисления и восстановления в этом случае протекают раздельно, т.е. на различных электродах. Электрод, на коттэром происходит восстановление, называется катодом, а электрод, на котором происходит окисление, — анодом. Катод подключен к отрицательному полюсу, и поэтому к нему движутся катионы, анод — к положИ тельному полюсу, и к нему движутся анионы. Вследствие этих процессов осуществляется перемещение электронов по внешней цепи. [c.239]
Процесс , окисления и восстановления в этом случае протекают раздельно, т.е. на различных электродах. Электрод, на коттэром происходит восстановление, называется катодом, а электрод, на котором происходит окисление, — анодом. Катод подключен к отрицательному полюсу, и поэтому к нему движутся катионы, анод — к положИ тельному полюсу, и к нему движутся анионы. Вследствие этих процессов осуществляется перемещение электронов по внешней цепи. [c.239]
В процессе электролиза химическая реакция протекает в иадравлении, противоположном самопроизвольному, при иаложеЕШИ на ячейку постоянного па пряжения от внешнего источника. Ячейка состоят из двух электродов, контактирующие с раствором. Если рщ, общее напряжение, наложенкое на ячейку, распределяется следующим образом [c.384]
На протяжении почти 20 лет после возникновения полярографии (1922 г.) основное внимание сосредоточивалось на объяснении кривых зависимости силы тока от напряжения (потенциала электрода), полученных при электролизе с применением ртутного капельного электрода. Позднее на ртутном капельном электроде исследовались и другие зависимости (например, аависимость производной от тока по потенциалу от потенциала, зависимость тока от времени, зависимость потенциала капельного электрода от времени, зависимость производной от потенциала по времени от времени и др.). Успехи, достигнутые при работе с ртутным капельным электродом, дали толчок к исследованиям с помощью других электродов, например со струйчатым электродом, висящей ртутной каплей, с вращающимся и вибрирующим ртутными электродами и др. Благодаря этому содержание понятия полярография значительно расщирилось. Оно не охватывает исследования, проведенные на твердых электродах, но включает исследование физико-химических процессов и явлений, наблюдаемых на ртутных капиллярных электродах при их поляризации заданным напряжением или заданной силой тока. Под выражением капиллярный электрод мы понимаем прежде всего ртутный капельный электрод, с которым было проведено наибольшее количество исследований, ртутный струйчатый электрод и висящую ртутную каплю.
Позднее на ртутном капельном электроде исследовались и другие зависимости (например, аависимость производной от тока по потенциалу от потенциала, зависимость тока от времени, зависимость потенциала капельного электрода от времени, зависимость производной от потенциала по времени от времени и др.). Успехи, достигнутые при работе с ртутным капельным электродом, дали толчок к исследованиям с помощью других электродов, например со струйчатым электродом, висящей ртутной каплей, с вращающимся и вибрирующим ртутными электродами и др. Благодаря этому содержание понятия полярография значительно расщирилось. Оно не охватывает исследования, проведенные на твердых электродах, но включает исследование физико-химических процессов и явлений, наблюдаемых на ртутных капиллярных электродах при их поляризации заданным напряжением или заданной силой тока. Под выражением капиллярный электрод мы понимаем прежде всего ртутный капельный электрод, с которым было проведено наибольшее количество исследований, ртутный струйчатый электрод и висящую ртутную каплю. Наиболее важным свойством этих электродов является то, что результаты, полученные с их помощью, очень хорошо воспроизводятся. Еще со времен Фарадея ртуть в электрохимии применяется как наилучший материал для электродов. Это обусловлено ее сравнительно высокой химической стойкостью, большим перенапряжением водорода на ртути, а также тем, что ее можно сравнительно легко получить в очень чистом виде. К тому же применяемые в полярографии электроды (капельные и струйчатые) непрерывно обновляют поверхность, вследствие чего изучаемые процессы протекают в достаточно строго определенных условиях и не подвергаются влиянию предшествующих процессов. [c.11]
Наиболее важным свойством этих электродов является то, что результаты, полученные с их помощью, очень хорошо воспроизводятся. Еще со времен Фарадея ртуть в электрохимии применяется как наилучший материал для электродов. Это обусловлено ее сравнительно высокой химической стойкостью, большим перенапряжением водорода на ртути, а также тем, что ее можно сравнительно легко получить в очень чистом виде. К тому же применяемые в полярографии электроды (капельные и струйчатые) непрерывно обновляют поверхность, вследствие чего изучаемые процессы протекают в достаточно строго определенных условиях и не подвергаются влиянию предшествующих процессов. [c.11]
Исходным продуктом при синтезе о-арсаниловой кислоты является о-нитрофениларсоновая кислота, которая получается в результате диазотирования о-нитроанилина. Диазотирование происходит при обработке о-нитроанилина нитритом натрия и арсенитом натрия в присутствии катализатора — сульфата меди [82]. При этом указывается на эффективность проведения реакции диазотирования с помощью электролиза.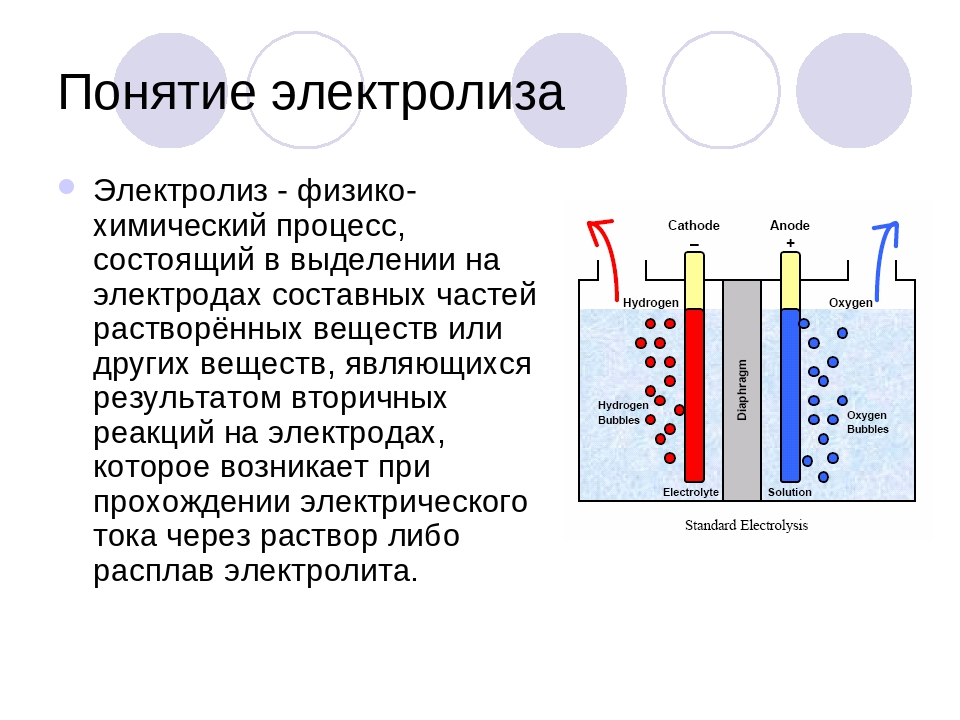 Отмечается, что при электрохимическом диазотировании процесс протекает в одну стадию, в отличие от химического диазотирования, и при низких температурах (30—35°). Выход по току о-нитрофениларсоновой кислоты на платиновом аноде составляет 72,9%, а на графитовом — 69%. При этом продукт получается более высокого качества. Можно предположить, что роль электролиза при диазотировании заключается в создании у поверхности анода высоких концентраций азотной кислоты вследствие электропереноса ионов МОг” [48]. [c.265]
Отмечается, что при электрохимическом диазотировании процесс протекает в одну стадию, в отличие от химического диазотирования, и при низких температурах (30—35°). Выход по току о-нитрофениларсоновой кислоты на платиновом аноде составляет 72,9%, а на графитовом — 69%. При этом продукт получается более высокого качества. Можно предположить, что роль электролиза при диазотировании заключается в создании у поверхности анода высоких концентраций азотной кислоты вследствие электропереноса ионов МОг” [48]. [c.265]
Элeкtpoxимичe кaя очистка основана на электролизе промышленных вод, т. е. на пропускании через погруженные в них электроды постоянного электрического тока. На катоде выделяется газообразный водород. В процессе электролиза растворенные в воде ионы металлов разряжаются с образованием катодных осадков соответствующих металлов, и происходит восстановление некоторых присутствующих в воде ионов и органических веществ с образованием новых веществ и ионов. На анодах из материалов, не подвергающихся электролитическому растворению, выделяются кислород и галогены, окисляются некоторые присутствующие в воде ионы и органические вещества с образованием из них новых веществ и ионов. Таким образом, при электролизе сточных вод протекает ряд различных физико-химических процессов, [c.17]
Таким образом, при электролизе сточных вод протекает ряд различных физико-химических процессов, [c.17]
В электрохимии хорошо известно явление электролитического переноса металлов с анода на катод. Этот процесс сопровождается анодным растворением и катодным осаждением металлов. Противоположный процесс при электролизе водных растворов никогда не наблюдался. Однако при электролизе ионных расплавов такой процесс может иногда протекать. Это явление наблюдается при электролизе ионного расплава, содержащего ионы щелочных или щелочноземельных металлов, в случае, если в качестве катодов применять металлы, которые характеризуются сравнительно высокой химической электроотрицательностью (не менее 1,5 единиц по Полингу). Например, если составить электрохилпь [c.124]
Электролиз расплавов и растворов (солей, щелочей, кислот) / Справочник :: Бингоскул
Сильнейшим окислительно – восстановительным действием обладает электрический ток. С помощью воздействия электрического тока на вещество можно получить чистый металл. Этот метод называется электролизом.
Этот метод называется электролизом.
Электролиз – процесс, при котором происходит разложение вещества электрическим током.
Процесс электролиза может протекать только в веществах, проводящих электрический ток, то есть электролитах. К электролитам относят представителей основных классов неорганических соединений – кислоты, соли, щелочи.
Для протекания процесса требуется устройство, называемое электролизером.
Данное устройство работает от внешнего источника питания, который подает электрический ток. Представляет собой емкость, в которую опущены два электрода (катод и анод), заполнена емкость электролитом. При подаче электрического тока происходит разложение вещества. Для того чтобы узнать протекает электролиз или нет, в цепь включают лампочку, если лампочка загорается, значит в системе есть ток, если при замыкании цепи, лампочка не горит, то электролиз не протекает – вещество является не электролитом.
Катод (-) – является отрицательно заряженным электродом, катионы ( + ) перемещаются к нему и происходит процесс восстановления.
Анод (+) – положительно заряженный электрод, к нему перемещаются анионы (-) и происходит процесс окисления.
Можно выделить два типа электролиза для расплавов и растворов. Ход этих двух процессов происходит по-разному. Зависит по большей части это от содержания воды в растворе, которая тоже принимает участие в процессе. В расплаве происходит разложение только вещества.
Особенности электролиза расплавов
В расплаве электролит непосредственно подвергается воздействию электрического тока. Металл всегда образуется на катоде, а продукт анода зависит от природы вещества.
При разложении расплава оснований на катоде образуется металл, а на аноде окисляется кислород. (расплав соли – это чистое вещество без примесей в основном твердые вещества)
Разложение расплавов солей происходит по-разному у бескислородных и кислородосодержащих. У бескислородной соли на аноде окисляется анион – кислотный остаток, а у кислородосодержащей – окисляется кислород.
Рассмотрим пример электролиза расплава бескислородной соли – хлорида калия. Под действием постоянного электрического тока соль разлагается на катионы калия и анионы хлора.
Катионы K+ перемещаются к катоду и принимают электроны, происходит восстановление металлического калия.
- Катодный процесс: K+ + e– → K0
Анионы Cl– движутся к аноду, отдавая электроны, происходит образование газообразного хлора.
- Анодный процесс: 2Cl– — 2e– → Cl20↑
Суммарное уравнение процесса электролиза расплава хлористого калия можно представить следующим образом:
- 2KCl (эл.ток) 2K0 + Cl20↑
Особенности электролиза растворов
В растворах электролитов, помимо самого вещества, присутствует вода. Под действием электрического тока водный раствор электролита разлагается.
Процессы, происходящие на катоде и аноде, различаются.
1. Процесс на катоде не зависит от материала, из которого он изготовлен. Однако, зависит от положения металлов в электрохимическом ряду напряжений.
2. Процесс на аноде зависит от материала, из которого состоит анод и от его природы.
а) Растворимый анод (Cu, Ag, Ni, Cd) подвергается Me => Men+ + ne
б) На не растворимом аноде (графит, платина) обычно окисляются анионы S–, J–, Br–, Cl–, OH– и молекулы H2O:
- 2J– => J20 + 2e;
- 4OH– => O2 + 2H2O + 4e;
- 2H2O => O2 + 4H+ + 4e
Рассмотрим примеры различных вариантов электролиза растворов:
1. Разложение бескислородной соли на нерастворимом электроде
Чтобы ознакомиться с этим вариантом электролиза, возьмем йодистый калий. Под действием тока ионы калия устремляются к катоду, а ионы йода к аноду.
Под действием тока ионы калия устремляются к катоду, а ионы йода к аноду.
Калий находится в диапазоне активности слева от алюминия, поэтому на катоде восстанавливаются молекулы воды и образуется атомарный водород.
- Катод: 2H2O + 2e– → H2 + 2OH–
Процесс протекает на нерастворимом аноде и в состав соли входит бескислородный остаток, поэтому на аноде образуется йод.
- Анод: 2I–— 2e– → I20
В результате можно создать общее уравнение электролиза:
- 2KI + 2H2O (эл.ток) 2KOH + I2 + H2↑
2. Разложение бескислородной соли на растворимом электроде (медь)
Рассмотрим на примере хлорида натрия. Данная соль разлагается на ионы натрия и хлора, но следует учитывать материал анода. Медный анод сам подвергается окислению. На аноде выделяется чистая медь, и ионы меди переходят с анода на катод, где также осаждается медь. В итоге процесс можно представить следующими уравнениями реакций.
В итоге процесс можно представить следующими уравнениями реакций.
- NaCl → Na+ + Cl–
- Катод: Cu2+ + 2e– → Cu0
- Анод: Cu0 — 2e– → Cu2+
В растворе концентрация хлорида натрия остается неизменной, поэтому составить общее уравнение реакции процесса не представляется возможным.
3. Разложение кислородосодержащей соли на нерастворимом (инертном) электроде
Возьмем для примера раствор нитрата калия. В процессе электролиза происходит распад на ионы калия и кислотного остатка.
В ряду активности металлов калий находится левее алюминия, поэтому на катоде восстанавливаются молекулы воды и образуется газообразный водород.
- Катод: 2H2O + 2e– → H2 + 2OH–
Молекулы воды окисляются на аноде и выделяется кислород.
- Анод: 2H2O — 4e– → O2 + 4H+
В результате получаем общее уравнение электролиза:
4. Электролиз раствора щелочи на инертном электроде
Электролиз раствора щелочи на инертном электроде
В случае разложения щелочи в процесс электролиза включаются молекулы воды и гидроксид-ионы.
Барий находится левее алюминия, поэтому на катоде происходит восстановление воды и выделение водорода.
- Катод: 2H2O + 2e– → H2 + 2OH–
На аноде откладываются молекулы кислорода.
- Анод: 4OH– — 4e– → O2 + 4H+
Получаем суммарное уравнение электролиза:
5. Электролиз раствора кислоты на инертном электроде
При разложении азотной кислоты под действием электрического тока в процесс вступают катионы водорода и молекула воды.
- HNO3 → H+ + NO3–
- Катод: 2H+ + 2e– → H2
- Анод: 2H2O — 4e– → O2 + 4H+
На катоде выделяется водород, на аноде – кислород. Получаем суммарное уравнение процесса:
Получаем суммарное уравнение процесса:
Применение электролиза
Процессы электролиза нашли свое применение в промышленности в первую очередь для получения чистых металлов электрохимическим путем. Побочными продуктами этого процесса являются кислород и водород, поэтому он является промышленным способом получения этих газов. Очень часто применяют для очистки металлов от примесей и защиты от коррозии.
Смотри также:
Тема: Электролиз как окислительно-восстановительный процесс
Электролизом называют окислительно-восстановительный процесс, протекающий на электродах под действием постоянного электрического тока, подаваемого от внешнего источника, проходящего через раствор или расплав электролита. При электролизе происходит превращение электрической энергии в химическую.
Процесс
электролиза производится в электролизере,
куда заливают электролит и устанавливают
два электрода. Электрод, на котором
происходит реакция восстановления,
называется катодом, подключается к
отрицательному полюсу внешнего источника
тока. Электрод, на котором происходит
реакция окисления, называется анодом,
подключается к положительному полюсу
внешнего источника тока.
Электрод, на котором
происходит реакция восстановления,
называется катодом, подключается к
отрицательному полюсу внешнего источника
тока. Электрод, на котором происходит
реакция окисления, называется анодом,
подключается к положительному полюсу
внешнего источника тока.
Схема электролиза
е– е–
анод + – катод
Электролиз водных растворов
Характер химических реакций в водных растворах на катоде определяется положением металла в ряду стандартных электродных потенциалов. Чем меньше значение электродного потенциала металла, тем труднее восстанавливаются его ионы на катоде. По этому признаку их разделяют на три группы.
К
первой группе относятся катионы металлов,
находящиеся в ряду напряжений левее
алюминия.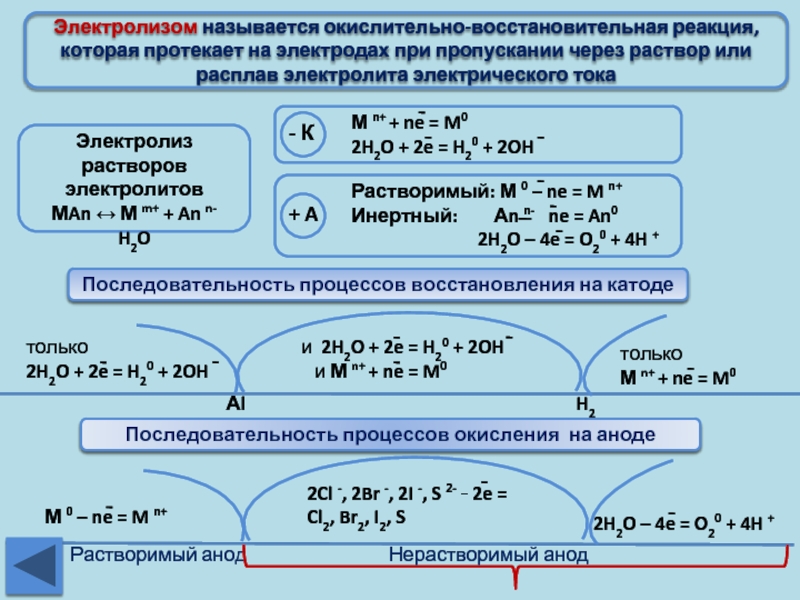 Они не восстанавливаются на
катоде из водных растворов, вместо них
происходит восстановление ионов водорода
(молекул воды): 2Н++2е=Н2.
Они не восстанавливаются на
катоде из водных растворов, вместо них
происходит восстановление ионов водорода
(молекул воды): 2Н++2е=Н2.
Ко второй группе относятся катионы металлов, расположенных в ряду напряжений между алюминием и водородом. Они восстанавливаются одновременно с водородом: Zn2++2е= Zn; 2Н++2е=Н2.
К третьей группе относятся катионы металлов, находящиеся в ряду напряжений после водорода. Они восстанавливаются на катоде: Cu2++2е= Cu.
Окисление
на аноде имеет свои закономерности.
Анионы бескислородных кислот и их солей
(Cl–,
Br–,
J–,
S2-,
CN– и т.п.) удерживают свои электроны слабее
молекул воды, поэтому при электролизе
окисляются в первую очередь. В то же
время анионы кислородсодержащих кислот
(NO3–,
SO42-,
PO43- и т. п.) удерживают свои электроны прочнее,
чем молекулы воды, поэтому на аноде
происходит окисление гидроксил-анионов:
4ОН– – 4е = 2Н2О
+ О2.
п.) удерживают свои электроны прочнее,
чем молекулы воды, поэтому на аноде
происходит окисление гидроксил-анионов:
4ОН– – 4е = 2Н2О
+ О2.
Характер реакций, протекающих на аноде, зависит также от природы вещества анода. Различают растворимые и нерастворимые аноды. нерастворимые аноды изготавливают из углерода (графита), платины, а растворимые – из меди, цинка, никеля, железа, свинца и их сплавов. Нерастворимый анод сам не претерпевает изменений, а лишь является передатчиком электронов. При применении растворимого анода происходит не окисление анионов из раствора, а растворение металла, то есть переход ионов металла, из которого изготовлен анод, в раствор. Этот метод используется для получения чистых металлов (электрорафинирование), а также для получения покрытий (гальваностегия).
Рассмотрим несколько примеров электролиза с нерастворимым анодом водных растворов солей.
1.
Раствор
сульфата
натрия
Na2SO4,
a(Na+)=1M,
a(SO42-)=1M. В растворе
имеются ионы Na+,
SO42-,
Н+,
ОН–.
В растворе
имеются ионы Na+,
SO42-,
Н+,
ОН–.
Na2SO4 ↔ 2 Na+ + SO42- ; Н2О ↔ Н+ + ОН–.
Так как φ0(Na+/ Na)=-2,7В<φ0(Н+/ Н2), то на катоде будет восстанавливаться водород, а на аноде – кислород: в растворе 2Н2О ↔ 2Н+ + 2ОН–. На катоде 2Н++2е=Н2. На аноде 2ОН– – 2е = Н2О + 1/2 О2. Суммарной является реакция разложения воды: Н2О=Н2+1/2О2.
2. Раствор хлорида натрия NaCl, a(Na+)=1M, a(Cl–)=1M. В растворе имеются ионы Na+, Cl–, Н+, ОН–. NaСl ↔ Na+ + Cl–; Н2О ↔ Н+ + ОН–.
На
катоде пойдет восстановление водорода:
2Н++2е=Н2. На аноде идет окисление ионов хлора:
2Cl– – 2е = Cl2.
На аноде идет окисление ионов хлора:
2Cl– – 2е = Cl2.
Электролиз расплавов
Рассмотрим электролиз расплавов на примере электролиза расплава хлорида натрия. В расплаве хлорида натрия имеются ионы натрия и хлора: NaСl ↔ Na+ + Cl–; если погрузить в расплавленную соль два графитовых электрода и подключить их к полюсам внешнего источника тока, то в электролите начнется направленное движение ионов и на электродах будут протекать следующие реакции:
1) Катодный процесс – восстановление ионов натрия до металлического натрия (на отрицательном электроде) Na+ + е = Na+.
2) Анодный процесс – окисление ионов хлора на положительном электроде (с которого электроны идут во внешнюю цепь) 2Cl– – 2е = Cl2. Суммарная реакция 2NaCl = 2Na + Cl2.
Перенапряжение и поляризация
В
процессе электролиза происходит
изменение состава электродов с поверхности
из-за образования на них продуктов
электролиза. При этом образуется
гальванический элемент, сила тока
которого направлена обратно течению
процесса электролиза. Это явление
называется химической поляризацией.
Для протекания электролиза необходимо
приложить к электродам напряжение,
большее, чем ЭДС образованного
гальванического элемента. Наименьшая
разность потенциалов, при которой
протекает электролиз, называется
потенциалом разложения Еразл..
Разность между потенциалом разложения
и ЭДС гальванического элемента называется
перенапряжением η.
При этом образуется
гальванический элемент, сила тока
которого направлена обратно течению
процесса электролиза. Это явление
называется химической поляризацией.
Для протекания электролиза необходимо
приложить к электродам напряжение,
большее, чем ЭДС образованного
гальванического элемента. Наименьшая
разность потенциалов, при которой
протекает электролиз, называется
потенциалом разложения Еразл..
Разность между потенциалом разложения
и ЭДС гальванического элемента называется
перенапряжением η.
Перенапряжение – это величина, которая показывает, насколько смещается электродный потенциал от равновесного значения.
Как катодное, так и анодное перенапряжение зависят от материала электродов, состояния их поверхности, от природы разряжающихся ионов и плотности тока.
Перенапряжение
при электролизе может достигать
значительной величины, что приводит к
добавочному расходу электроэнергии.
Поэтому стремятся создать такие условия,
при которых величина η становится по
возможности минимальной. Это достигается
путем создания невысокой плотности
тока.
Это достигается
путем создания невысокой плотности
тока.
Законы Фарадея
Электрохимические процессы на электродах подчиняются законам М. Фарадея.
1 закон Фарадея: массы веществ m, выделившихся на электродах при электролизе, прямо пропорциональны количеству электричества q, прошедшему через электролит: m=kq. Масса вещества, выделяющегося при прохождении одного кулона, называется электрохимическим эквивалентом k.
2 закон Фарадея: одинаковые количества электричества выделяют при электролизе на электродах эквивалентные массы веществ. Для выделения на электроде одного грамм-эквивалента любого вещества необходимо затратить одно и то же количества электричества, а именно 96500 Кл (называемого числом Фарадея).
Масса металла при электролизе на катоде, согласно законам Фарадея, может быть вычислена по формуле:
.
Здесь
m
– масса металла, г; Э – химический
эквивалент металла, г/моль; t
– продолжительность электролиза, с.
При электролизе во многих случаях выделяется веществ меньше, чем должно получиться по законам Фарадея. Это объясняется тем, что наряду с основными электродными процессами окисления и восстановления протекают побочные, параллельные процессы (в результате химической поляризации). Поэтому вводится понятие выхода по току χ, %. Оно представляет собой отношение массы полученного вещества в данных условиях электролиза mпр к массе, теоретически вычисленной на основании закона Фарадея mтеор:
Применение электролиза
Электролиз широко используется в различных областях промышленности. Практически нет ни одной области техники, где бы он не применялся.
Электролиз
в металлургии. Электролизом растворов
солей получают медь, цинк, кадмий, никель,
кобальт, марганец и другие металлы. На
катоде происходит разряд ионов металла
из раствора Mn+ + ne
= M.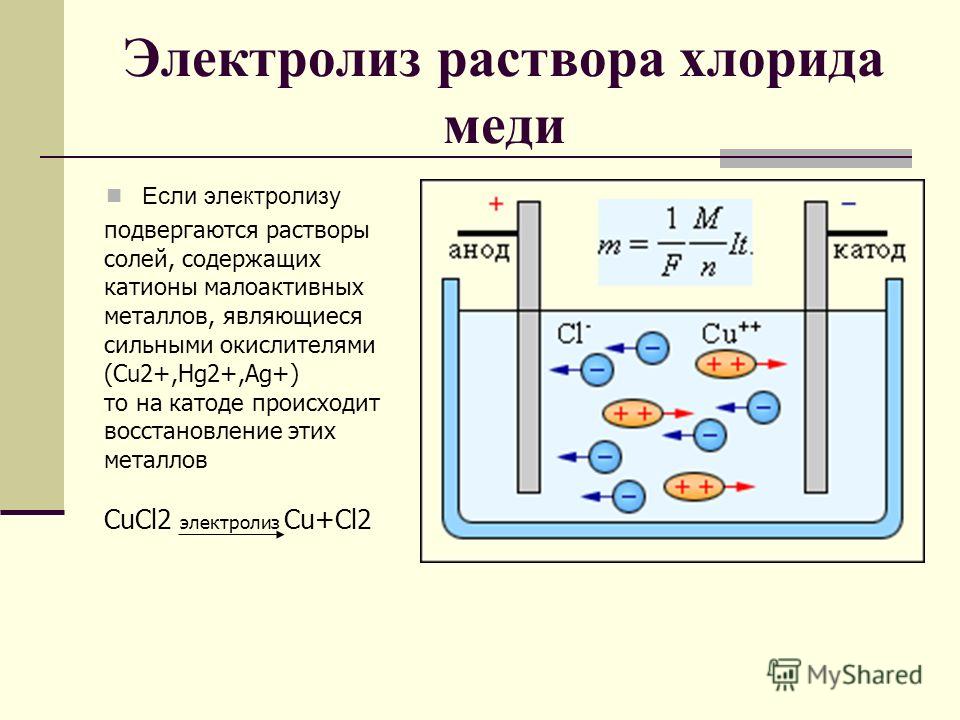 В этих процессах используют нерастворимые
аноды, на которых выделяется кислород:
2Н2О
+ 4е = О2 + 4Н+.
В этих процессах используют нерастворимые
аноды, на которых выделяется кислород:
2Н2О
+ 4е = О2 + 4Н+.
Метод электролиза используют для рафинирования металлов – меди, серебра, золота, свинца, олова и других. Анодом при рафинировании служит очищаемый металл. На аноде происходит растворение основного металла и примесей, потенциал которых отрицательнее потенциала основного металла. На катоде выделяется металл, имеющий более положительный потенциал. Так как потенциалы меди, серебра, свинца и олова положительнее, чем потенциалы других основных металлов ,то каждый из этих металлов в первую очередь выделяется на катоде, а примеси остаются в растворе.
Электролиз
в химической промышленности. К наиболее
крупномасштабному электролитическому
процессу в химической промышленности
относится электролиз раствора хлорида
натрия с получением газообразных
водорода и хлора на электродах и щелочи
в электролизере. Кроме этого, электролизом
получают фтор из расплава смеси плавиковой
кислоты и фторида натрия, водород и
кислород из воды, диоксид марганца из
раствора сульфата марганца.
Получение гальванопокрытий. Гальваническими называются металлические покрытия, наносимые на поверхность какого-либо изделия методом электролиза. Гальваническим способом можно получить покрытия для всех металлов и сплавов. Наиболее распространены никелирование, хромирование, меднение и цинкование.
Нанесение гальванических покрытий проводится в электролизере, называемом гальванической ванной. Катодом служит изделие, на которое наносится покрытие. На катоде идёт процесс восстановления находящихся в растворе электролита ионов металла Mn+ + ne = M. Анодом обычно служит тот же металл, что и металл-покрытие. Процесс на аноде противоположен процессу на катоде: M – ne = Mn+
Электрохимическая
анодная обработка металлов и сплавов.
Анодная обработка изделий для придания
им требуемой формы получила название
электрохимической обработки металлов
(ЭХОМ). Этот способ обработки металлов
имеет важные достоинства, так как
позволяет обрабатывать детали сложной
конфигурации. Как и при обычном электролизе
с растворимыми анодами, при ЭХОМ
происходит анодное растворение металла
M
– ne
= Mn+.
На катоде, который называют инструментом,
обычно выделяется водород 2Н++2е=Н2.
Особенностью ЭХОМ по сравнению с другими
методами электролиза является высокая
скорость растворения металлов. В
настоящее время ЭХОМ используется для
обработки лопаток турбин, штампов и
пресс-форм, твёрдых и тугоплавких
металлов.
Как и при обычном электролизе
с растворимыми анодами, при ЭХОМ
происходит анодное растворение металла
M
– ne
= Mn+.
На катоде, который называют инструментом,
обычно выделяется водород 2Н++2е=Н2.
Особенностью ЭХОМ по сравнению с другими
методами электролиза является высокая
скорость растворения металлов. В
настоящее время ЭХОМ используется для
обработки лопаток турбин, штампов и
пресс-форм, твёрдых и тугоплавких
металлов.
Промышленное применение процесса электролиза | Видеоурок
«Свердловская киностудия», 1963
Электролиз имеет ряд важных промышленных применений. Они включают извлечение и очистку металлов, нанесение гальванических покрытий, а также анодирование и получение различных химических веществ.
Очистка металлов
Очистка таких металлов, как медь и цинк, может осуществляться с помощью электролиза. Очистка металлов называется рафинированием. Неочищенная медь играет в этом процессе роль анода, а очищенная медь-роль катода; в качестве электролита может использоваться раствор сульфата меди(II). На аноде протекает полуреакция
Сu(тв.) =Cu2+(водн.) + 2е-
Примеси, высвобождаемые при растворении неочищенной меди на аноде, опускаются на дно электролизера, образуя так называемый анодный ил. Этот ил может содержать драгоценные металлы, например золото и серебро. Переходящие в раствор ионы меди разряжаются и осаждаются на чистом медном катоде. Эта полуреакция описывается уравнением
Cu2 +(водн.) = Сu(тв.) + 2е-
Примеси (анодный ил)
Нанесение гальванических покрытий
В этом процессе нанесение покрытия (электроосаждение) осуществляется на катоде. Катод погружают в электролит, который содержит ионы электроосаждаемого металла. В качестве анода используется пластина или стержень из того металла, которым наносят покрытие. Для успешного проведения электроосаждения следует тщательно контролировать силу электрического тока, концентрацию электролита и температуру. Кроме того, необходимо предварительно подвергнуть очистке катод.
Нанесение гальванического покрытия может включать целый ряд стадий. Например, покрытие железа хромом включает четыре стадии:
1. Очистка железного предмета, играющего роль катода, при помощи серной кислоты с последующей промывкой деионизированной водой.
2. Покрытие железного катода медью.
3. Последующее покрытие катода никелем с целью предотвращения коррозии.
4. Окончательное покрытие предмета хромом.
Анодирование
Так называется процесс покрытия алюминиевых предметов оксидом алюминия. В этом процессе покрываемый предмет играет роль анода, а в качестве электролита используется разбавленная серная кислота. Покрытие из оксида алюминия предохраняет предмет от коррозии.
Получение химических веществ
Важнейшим примером подобного применения электролиза является получение гидроксида натрия, водорода и хлора в электролизере с ртутным катодом.
Электрофорез
На поверхности коллоидных частиц, взвешенных в растворе, часто имеются электрические заряды из-за адсорбции ионов или электронов. Например, частицы золота в водном золе золота адсорбируют на своей поверхности гидроксидные ионы. При пропускании электрического тока через золь отрицательно заряженные частицы золя мигрируют к аноду. Миграция заряженных коллоидных частиц к какому-либо электроду называется электрофорез. (Другое название электрофореза-катафорез.)
Электролиз | Химия [Магистр]
Прогнозирование продуктов электролиза
Электролиз – это способ разделения соединения путем пропускания через него электрического тока; продукты представляют собой ионы компонентов соединения.
Цели обучения
Предсказать продукты реакции электролиза
Основные выводы
Ключевые моменты
- Основными компонентами электролитической ячейки являются электролит, постоянный ток и два электрода.
- Ключевой процесс электролиза – это обмен атомами и ионами путем удаления или добавления электронов во внешнюю цепь.
- Окисление ионов или нейтральных молекул происходит на аноде, а восстановление ионов или нейтральных молекул происходит на катоде.
Ключевые термины
- электролит : Вещество, которое в растворе или в расплавленном состоянии ионизирует и проводит электричество.
- электролиз : химическое изменение, возникающее при пропускании электрического тока через проводящий раствор или расплав соли.
Что такое электролиз?
Чтобы предсказать продукты электролиза, нам сначала нужно понять, что такое электролиз и как он работает. Электролиз – это метод разделения связанных элементов и соединений путем пропускания через них электрического тока. Он использует постоянный электрический ток (DC), чтобы запустить в противном случае несамопроизвольную химическую реакцию. Электролиз очень важен с коммерческой точки зрения как стадия отделения элементов из природных источников, таких как руды, с использованием электролитической ячейки.
Основные компоненты, необходимые для проведения электролиза:
- Электролит: вещество, содержащее свободные ионы, являющиеся переносчиками электрического тока в электролите. Если ионы неподвижны, как в твердой соли, то электролиз не может происходить.
- Источник постоянного тока (DC): обеспечивает энергию, необходимую для создания или разряда ионов в электролите. Электрический ток переносится электронами во внешней цепи.
- Два электрода: электрический проводник, который обеспечивает физический интерфейс между электрической цепью, обеспечивающей энергию, и электролитом.
Взаимодействие атомов и ионов
Ключевой процесс электролиза – это обмен атомами и ионами путем удаления или добавления электронов во внешнюю цепь. Необходимые продукты электролиза находятся в физическом состоянии, отличном от состояния электролита, и могут быть удалены некоторыми физическими процессами.
Каждый электрод притягивает ионы противоположного заряда. Положительно заряженные ионы или катионы движутся к катоду, обеспечивающему электроны, который является отрицательным; отрицательно заряженные ионы или анионы движутся к положительному аноду.Вы могли заметить, что это противоположность гальванического элемента, где анод отрицательный, а катод положительный.
На электродах электроны поглощаются или высвобождаются атомами и ионами. Те атомы, которые приобретают или теряют электроны, становятся заряженными ионами, которые переходят в электролит. Те ионы, которые приобретают или теряют электроны, становятся незаряженными атомами , отделяются от электролита. Образование незаряженных атомов из ионов называется разрядкой. Энергия, необходимая для миграции ионов к электродам, и энергия, вызывающая изменение ионного состояния, обеспечивается внешним источником.{4 -} _ 6 [/ латекс]
Нейтральные молекулы также могут реагировать на любом электроде. Реакции электролиза с участием ионов H + довольно распространены в кислых растворах. В щелочных водных растворах часто встречаются реакции с участием гидроксид-ионов (OH – ). Окисленные или восстановленные вещества также могут быть растворителем, которым обычно является вода, или электродами. Возможен электролиз с участием газов.
Прогнозирование продуктов электролиза
Давайте посмотрим, как прогнозировать продукты.Например, на какие два иона распадется CuSO 4 ? Ответ: Cu 2+ и SO 4 2- . Давайте посмотрим на эту реакцию подробнее.
Электролиз сульфата меди : два медных электрода помещают в раствор синего сульфата меди и подключают к источнику электрического тока. Ток включен на некоторое время.
Берем два медных электрода и помещаем их в раствор синего сульфата меди (CuSO 4 ) и включаем ток.- [/ латекс]
Мы только что видели электрический ток, используемый для расщепления CuSO 4 на составляющие ионы. Это все, что нужно для прогнозирования продуктов электролиза; все, что вам нужно сделать, это разбить соединение на составляющие ионы.
Электролиз хлорида натрия
Два обычно используемых метода электролиза включают расплав хлорида натрия и водный раствор хлорида натрия, которые дают разные продукты.
Цели обучения
Предсказать продукты электролиза хлорида натрия в расплавленных и водных условиях
Основные выводы
Ключевые моменты
- Металлический натрий и газообразный хлор могут быть получены электролизом расплавленного хлорида натрия.
- Электролиз водного раствора хлорида натрия дает водород и хлор, при этом водный гидроксид натрия остается в растворе.
- Причина различия в том, что восстановление Na + (E ° = –2,7 v) энергетически сложнее, чем восстановление воды (–1,23 v).
Ключевые термины
- анод : Электрод электрохимической ячейки, на которой происходит окисление.
- катод : электрод электрохимической ячейки, на котором происходит восстановление.
Электролиз NaCl
Как мы уже говорили, электролиз – это прохождение постоянного электрического тока через ионное вещество, которое либо расплавлено, либо растворено в подходящем растворителе. Это приводит к химическим реакциям на электродах и разделению материалов. Два обычно используемых метода электролиза включают расплав хлорида натрия и водный раствор хлорида натрия. Вы можете подумать, что оба метода дадут вам одинаковые продукты, но это не так. Давайте рассмотрим каждый из методов, чтобы понять различные процессы.
Электролиз расплавленного NaCl
Если хлорид натрия расплавляется (выше 801 ° C), два электрода вставляются в расплав и через расплав соли пропускается электрический ток, после чего на электродах протекают химические реакции.
Электролизная ячейка для расплавленного хлорида натрия : Промышленная электролизная ячейка для производства металлического натрия и газообразного хлора из расплавленного NaCl. Жидкий натрий всплывает в верхнюю часть расплава над катодом и сливается в резервуар для хранения.{-} [/ латекс]
Общая реакция – это разложение хлорида натрия на элементы:
[латекс] 2 \ text {NaCl} \ rightarrow 2 \ text {Na} (\ text {s}) + {\ text {Cl}} _ {2} (\ text {g}) [/ latex]
Электролиз водного NaCl
Что происходит, когда у нас есть водный раствор хлорида натрия? Что ж, мы не можем забыть, что мы должны учитывать воду в уравнении. Поскольку вода может быть как окисленной, так и восстановленной, она конкурирует с растворенными ионами Na + и Cl – .Вместо производства натрия производится водород.
Электролиз водного раствора хлорида натрия : Электролиз водного раствора NaCl приводит к образованию водорода и хлорида. На аноде (A) хлорид (Cl-) окисляется до хлора. Ионоселективная мембрана (B) позволяет противоиону Na + свободно проходить через нее, но предотвращает диффузию анионов, таких как гидроксид (OH-) и хлорид. На катоде (C) вода восстанавливается до гидроксида и газообразного водорода. Чистый процесс представляет собой электролиз водного раствора NaCl на промышленно полезные продукты – гидроксид натрия (NaOH) и газообразный хлор.{-} (\ text {aq}) + {\ text {H}} _ {2} (\ text {g}) + \ frac {1} {2} {\ text {Cl}} _ {2} ( \ text {g}) [/ latex]
Восстановление Na + (E ° = –2,7 об.) Энергетически сложнее, чем восстановление воды (–1,23 об.), Поэтому в водном растворе будет преобладать последнее.
Вывести продукты электролиза расплава соли. : Электролиз расплава соли дает элементы из соли. Итак, электролиз WCl4 дает W и Cl2.Ионы металлов получают электроны на отрицательном электроде, а неметаллы теряют их на положительном электроде.
Электролиз воды
Чистая вода не может подвергаться значительному электролизу без электролита, такого как кислота или основание.
Цели обучения
Вспомните свойства электролита, которые позволяют проводить электролиз воды
Основные выводы
Ключевые моменты
- Электролиз раствора серной кислоты или соли, такой как NaNO 3 , приводит к разложению воды на обоих электродах.
- Водород появится на катоде, а кислород появится на аноде.
- Количество образующегося водорода в два раза превышает количество молей кислорода, и оба они пропорциональны общему электрическому заряду, проводимому раствором.
Ключевые термины
- электролиз : химическое изменение, возникающее при пропускании электрического тока через проводящий раствор или расплав соли.
Чистая вода не может подвергаться значительному электролизу без добавления электролита.{-} [/ латекс]
E ° = -1,23 В
Умножение катодной реакции на 2, чтобы соответствовать количеству перенесенных электронов, дает это чистое уравнение после объединения ионов OH – и H + с образованием воды:
Сеть: [латекс] 2 {\ text {H}} _ {2} \ text {O} (\ text {l}) \ rightarrow 2 {\ text {H}} _ {2} (\ text {g} ) + {\ text {O}} _ {2} (\ text {g}) [/ latex]
E = -1,23 v
Водород появится на катоде, отрицательно заряженном электроде, где электроны входят в воду, и кислород появится на аноде, положительно заряженном электроде.Количество образовавшихся молей водорода в два раза больше количества молей кислорода, и оба они пропорциональны общему электрическому заряду, проводимому раствором. Количество электронов, проталкиваемых через воду, вдвое превышает количество образованных молекул водорода и в четыре раза больше количества образованных молекул кислорода.
Иоганн Риттер, который изобрел первый электрохимический элемент, был одним из первых, кто открыл разложение воды электричеством.
Электролиз воды : Устройство, изобретенное Иоганном Вильгельмом Риттером для проведения электролиза воды.
Стехиометрия электролиза
Количество химического изменения, которое происходит при электролизе, стехиометрически связано с количеством электронов, которые проходят через элемент.
Цели обучения
Предсказать, сколько кулонов потребуется для данной электрохимической реакции
Основные выводы
Ключевые моменты
- С точки зрения источника напряжения и цепи за пределами электродов, поток электронов обычно описывается в терминах электрического тока с использованием единиц СИ – кулонов и ампер.
- Требуется 96 485 кулонов, чтобы составить моль электронов, единицу, известную как фарадей (F).
- Эквивалентный вес вещества определяется как молярная масса, деленная на количество электронов, необходимых для окисления или восстановления каждой единицы вещества.
Ключевые термины
- кулонов : В Международной системе единиц производная единица электрического заряда; количество электрического заряда, переносимого током в 1 ампер, протекающим в течение 1 секунды.Символ: C.
- Фарадей : количество электричества, необходимое для депонирования или высвобождения 1 грамма эквивалентного веса вещества во время электролиза; приблизительно 96 487 кулонов.
Стехиометрия электролитической ячейки
Степень химического изменения, происходящего в электролитической ячейке, стехиометрически зависит от количества молей электронов, проходящих через ячейку. С точки зрения источника напряжения и цепи за пределами электродов, поток электронов обычно описывается в терминах электрического тока с использованием единиц СИ – кулонов и ампер.Для образования моля электронов требуется 96 485 кулонов – единица, известная как фарадей (F).
Это соотношение было впервые сформулировано Майклом Фарадеем в 1832 году в форме двух законов электролиза:
- Вес веществ, образующихся на электроде во время электролиза, прямо пропорционален количеству электричества, которое проходит через электролит.
- Вес различных веществ, образованных в результате прохождения одного и того же количества электричества, пропорционален эквивалентному весу каждого вещества.- \ rightarrow \ text {V} [/ latex]).
Большинство стехиометрических задач, связанных с электролизом, могут быть решены без явного использования законов Фарадея. «Химия» в этих задачах обычно очень элементарна; основные трудности обычно возникают из-за незнания основных электрических устройств:
- ток (в амперах) – это скорость переноса заряда: 1 ампер = 1 [латекс] \ frac {\ text {Coulombs}} {\ text {second}} [/ latex]. Мощность
- (в ваттах) – это скорость производства или потребления энергии: 1 Вт = 1 [латекс] \ frac {\ text {Джоуль}} {\ text {second}} [/ latex]. -} = 1184 \ \ text {Coulombs} [/ latex]
1.5 часов эквивалентны 5400 секундам:
[латекс] \ frac {1184 \ \ text {Coulombs}} {5400 \ \ text {seconds}} = 0,22 \ \ text {Amps} [/ latex]
Электролиз | Encyclopedia.com
Электролиз воды
Производство натрия и хлора
Производство магния
Производство гидроксида натрия, хлора и водорода
Производство алюминия
Рафинирование меди
Гальваника
Ресурсы
Электролиз процесс, вызывающий химическую реакцию при прохождении электрического тока через вещество или смесь веществ, чаще всего в жидкой форме.Электролиз часто приводит к разложению соединения на элементы. Для проведения электролиза два электрода, положительный электрод (анод) и отрицательный электрод (катод) погружаются в материал, подлежащий электролизу, и подключаются к источнику постоянного (постоянного) электрического тока.
Аппарат, в котором проводится электролиз, называется электролитической ячейкой . Корни -lys и -lyt происходят от греческих lysis и lytos , что означает разрезать или разлагать; электролиз в электролизере – это процесс, при котором вещество может разлагаться.
Электролизующееся вещество должно быть электролитом, жидкостью, содержащей положительные и отрицательные ионы и, следовательно, способной проводить электричество. Есть два вида электролитов. Один вид – это раствор ионного соединения любого соединения, которое производит ионы при растворении в воде, например неорганической кислоты, основания или соли. Другой вид представляет собой сжиженное ионное соединение, такое как расплавленная соль.
В любом типе электролита жидкость проводит электричество, потому что ее положительные и отрицательные ионы могут свободно перемещаться к электродам с противоположным зарядом – положительные ионы к катоду, а отрицательные ионы к аноду.Эта передача положительного заряда в одном направлении и отрицательного заряда в противоположном направлении составляет электрический ток, потому что электрический ток, в конце концов, всего лишь поток заряда, и не имеет значения, являются ли носители заряда ионами или электронами. В ионном твердом веществе, таком как хлорид натрия, например, обычно фиксированные ионы становятся свободными для движения, как только твердое вещество растворяется в воде или как только оно плавится.
Во время электролиза ионы движутся к электродам с противоположным зарядом.Когда они достигают своих электродов, они подвергаются химическим окислительно-восстановительным реакциям. На катоде, который накачивает электроны в электролит, происходит химическое восстановление – захват электронов положительными ионами. На аноде, удаляющем электроны из электролита, происходит химическое окисление – потеря электронов отрицательными ионами.
При электролизе существует прямая зависимость между количеством электричества, протекающего через элемент, и количеством протекающей химической реакции.Чем больше электронов перекачивается через электролит аккумулятором, тем больше ионов будет вынуждено отдать или принять электроны, тем самым окисляясь или восстанавливаясь. Чтобы произвести химическую реакцию на один моль, один моль электронов должен пройти через ячейку. Моль электронов, то есть 6,02 ← × 10 23 электронов, называется фарадеев . Устройство названо в честь Майкла Фарадея (1791–1867), английского химика и физика, открывшего связь между электричеством и химическими изменениями.Ему также приписывают первое использование слов анод , катод , электрод , электролит и электролиз .
Для решения конкретных химических задач могут быть разработаны различные типы электролитических ячеек.
Возможно, наиболее известным примером электролиза является электролитическое разложение воды с образованием водорода и кислорода:
Поскольку вода является таким стабильным соединением, ученые могут осуществить эту реакцию, только закачивая в нее энергию – в данном случае в форма электрического тока.Чистая вода, которая плохо проводит электричество, должна, во-первых, превратиться в электролит путем растворения в ней кислоты, основания или соли. Затем анод и катод, обычно сделанные из графита или какого-либо нереагирующего металла, такого как платина, могут быть вставлены и подключены к батарее или другому источнику постоянного тока.
На катоде, где электроны закачиваются в воду аккумулятором, они захватываются молекулами воды с образованием газообразного водорода:
На аноде электроны удаляются из молекул воды:
Чистый результат эти две электродные реакции, сложенные вместе, составляют
(обратите внимание, что когда эти два уравнения складываются вместе, четыре иона H + и четыре иона OH – с правой стороны объединяются, чтобы сформировать четыре иона H 2 O молекулы, которые затем нейтрализуют четыре из молекул H 2 O в левой части.Таким образом, каждые две молекулы воды разложились на две молекулы водорода и одну молекулу кислорода.
Кислота, основание или соль, превратившие воду в электролит, были выбраны таким образом, чтобы ее отдельные ионы не могли окисляться или восстанавливаться (по крайней мере, при напряжении батареи), поэтому они не вступают в химическую реакцию и служат только для проведения течение через воду. Обычно используется серная кислота, H 2 SO 4 .
Путем электролиза поваренная соль, хлорид натрия, NaCl, может быть разбита на элементы, натрий и хлор.Это важный метод производства натрия. Он также используется для производства других щелочных и щелочноземельных металлов из их солей.
Чтобы получить натрий электролизом, ученые сначала расплавят немного хлорида натрия, нагревая его выше точки плавления 1,474 ° F (801 ° C). Затем в расплавленную соль вставят два инертных (не реагирующих) электрода. Хлорид натрия должен быть расплавлен, чтобы ионы Na + и Cl – могли свободно перемещаться между электродами; в твердом хлориде натрия ионы замораживаются.Наконец, ученые пропустят постоянный электрический ток (DC) через расплавленную соль.
Отрицательный электрод (катод) будет притягивать ионы Na + , а положительный электрод (анод) будет притягивать ионы Cl – , после чего протекают следующие химические реакции.
На катоде, куда закачиваются электроны, они захватываются положительными ионами натрия:
На аноде, где выкачиваются электроны, они отрываются от ионов хлора:
(Хлор атомы немедленно объединяются в двухатомные молекулы, Cl 2 .) В результате поваренная соль была разложена на элементы под действием электричества.
Еще одно важное применение электролиза – производство магния из морской воды. Морская вода является основным источником этого металла, поскольку она содержит больше ионов магния, чем любого другого металла, кроме натрия. Во-первых, хлорид магния, MgCl 2 , получают путем осаждения гидроксида магния из морской воды и растворения его в соляной кислоте. Затем хлорид магния плавится и электролизуется.Подобно получению натрия из расплавленного хлорида натрия, описанному выше, расплавленный магний осаждается на катоде, а газообразный хлор выделяется на аноде. Общая реакция: MgCl 2 → Mg + Cl 2 .
Гидроксид натрия, NaOH, также известный как щелочь и каустическая сода, является одним из наиболее важных промышленных химикатов. По состоянию на 2004 год только в Соединенных Штатах его ежегодно производили более 25 миллиардов фунтов (11 миллиардов килограммов). Мировое производство в том же году превысило 100 миллиардов фунтов (44 миллиарда килограммов).Основным методом его получения является электролиз рассола или соленой воды, раствора поваренной соли, хлорида натрия в воде. Хлор и водород образуются как ценные побочные продукты.
Когда электрический ток проходит через соленую воду, отрицательные ионы хлора, Cl – , мигрируют к положительному аноду и теряют свои электроны, превращаясь в газообразный хлор.
(Затем атомы хлора объединяются в пары, образуя молекулы Cl 2 ). Между тем ионы натрия Na + притягиваются к отрицательному катоду.Однако они не собирают электроны, чтобы стать атомами металлического натрия, как в расплаве соли. Это связано с тем, что в водном растворе сами молекулы воды улавливают электроны легче, чем ионы натрия. Таким образом, на катоде происходит
. Ионы гидроксида вместе с ионами натрия, которые уже находятся в растворе, составляют гидроксид натрия, который можно восстановить путем испарения.
Этот так называемый процесс хлористого щелочного металла является основой отрасли, которая существует уже более ста лет.С помощью электричества он превращает дешевую соль в ценный хлор, водород и гидроксид натрия. Среди прочего, хлор используется для очистки воды, водород используется для гидрогенизации масел, а щелок используется для производства мыла, промышленных стоков и очистителей для духовок, а также бумаги.
Производство алюминия методом Холла было одним из первых применений электролиза в больших масштабах и до сих пор остается основным методом получения этого очень полезного металла. Чарльз М.Холл, 21-летний студент колледжа Оберлин в Огайо, который искал способ восстановить оксид алюминия до металла, открыл этот процесс в 1886 году. Алюминий был редкой и дорогой роскошью в то время, потому что металл очень реакционноспособен, и поэтому его трудно восстановить химическими средствами. С другой стороны, электролиз расплавленной соли или оксида алюминия затруднен, потому что соли трудно получить в безводной (сухой) форме, а оксид Al 2 O 3 не плавится до температуры 3762 ° F. (2,072 ° С).
Холл обнаружил, что Al 2 O 3 в форме минерального боксита растворяется в другом минерале алюминия, называемом криолитом, Na 3 AlF 6 , и что полученная смесь может быть легко расплавлена. Когда через эту расплавленную смесь проходит электрический ток, ионы алюминия мигрируют к катоду, где они восстанавливаются до металла:
На аноде ионы оксида окисляются до газообразного кислорода:
Расплавленный металлический алюминий опускается на дно. ячейки и может быть снята.
Обратите внимание, что для производства каждого моля алюминия необходимы три моля электронов (три фарада электричества), потому что на каждом ионе алюминия есть три положительных заряда, которые должны нейтрализоваться электронами. Таким образом, производство алюминия по процессу Холла требует огромного количества электроэнергии. Переработка банок для напитков и других алюминиевых предметов стала важной мерой энергосбережения.
В отличие от алюминия, металлическую медь довольно легко получить химическим способом из руды.Но с помощью электролиза его можно очистить и сделать очень чистым – до 99,999%. Чистая медь важна для изготовления электрического провода, поскольку ее электропроводность снижается из-за примесей. Эти примеси включают такие ценные металлы, как серебро, золото и платина; когда они удаляются электролизом и восстанавливаются, они имеют большое значение для оплаты счетов за электроэнергию.
При электролитическом рафинировании меди нечистая медь образуется из анода в ванне электролита из сульфата меди, CuSO 4 и серной кислоты H 2 SO 4 .Катод представляет собой лист чистой меди. По мере прохождения тока через раствор положительные ионы меди, Cu 2+ , в растворе притягиваются к отрицательному катоду, где они захватывают электроны и осаждаются в виде нейтральных атомов меди, тем самым создавая все больше и больше чистой меди на катод. Между тем, атомы меди в положительном аноде отдают электроны и растворяются в растворе электролита в виде ионов меди. Однако примеси в аноде не переходят в раствор, потому что атомы серебра, золота и платины не так легко окисляются (превращаются в положительные ионы), как окисляется медь.Таким образом, серебро, золото и платина просто падают с анода на дно резервуара, где их можно соскрести.
Еще одно важное применение электролитических ячеек – это гальваника серебра, золота, хрома и никеля. Гальваника производит тонкое покрытие из этих дорогих металлов на поверхности более дешевых металлов, чтобы придать им внешний вид и химическую стойкость, как у дорогих.
При серебряном покрытии покрываемый предмет (например, ложка) изготавливается из катода электролитической ячейки.Анод представляет собой стержень из металлического серебра, а электролит (жидкость между электродами) представляет собой раствор цианида серебра AgCN в воде. Когда через элемент проходит постоянный ток, положительные ионы серебра (Ag + ) из цианида серебра мигрируют к отрицательному аноду (ложке), где они нейтрализуются электронами и прилипают к ложке как металлическое серебро:
Между тем серебряный анодный стержень отдает электроны, превращаясь в ионы серебра:
Таким образом, анодный стержень постепенно растворяется, чтобы пополнить запасы ионов серебра в растворе.В результате металлическое серебро переместилось с анода на катод, в данном случае – на ложку. Этот процесс продолжается до тех пор, пока на ложке не будет достигнута желаемая толщина покрытия – обычно всего несколько тысячных дюйма – или пока серебряный слиток полностью не растворится.
При гальванике с серебром цианид серебра используется в электролите, а не другие соединения серебра, такие как нитрат серебра, AgNO 3 , потому что ион цианида, CN –, реагирует с ионом серебра, Ag + , с образованием комплексного иона Ag (CN) 2 – .Это ограничивает поступление свободных ионов Ag + в раствор, поэтому они могут осаждаться на катоде только постепенно. Это обеспечивает более блестящее и прочное серебряное покрытие. Золотое покрытие
КЛЮЧЕВЫЕ ТЕРМИНЫ
Комплексный ион – Большой ион, состоящий из более мелких ионов, объединенных друг с другом или с другими атомами или молекулами
Фарадея – Единица электрического заряда, равная заряд несет один моль электронов. Один фарадей равен 96 485 кулонам.
Окисление – Процесс, при котором степень окисления атома увеличивается за счет потери одного или нескольких электронов.
Восстановление – Процесс, при котором степень окисления атома снижается за счет получения одного или нескольких электронов.
выполняется почти так же, с использованием золотого анода и электролита, содержащего цианид золота, AuCN.
КНИГИ
Чанг, Раймонд. Химия . Бостон, Массачусетс: McGraw-Hill, 2002.
Муг, Ричард Сэмюэл. Химия: справочник . Нью-Йорк: Wiley, 2005.
Tro, Nivaldo J. Introduct Chemistry . Верхний Сэдл-Ривер, Нью-Джерси: Pearson Education, 2006.
Роберт Л. Уолке
Что такое процесс электролиза
Что такое процесс электролиза ЭлектролизПолучение химической реакции путем попутного электрический ток через электролит называется электролизом.
Мы знаем, что электролит содержит заряженные ионы.Положительно заряженные ионы называются катионами, потому что они притягиваются к катоду, а отрицательно заряженные – анионами, потому что они притягиваются к аноду. Мы знаем, что разные заряды притягиваются, а похожие – отталкиваются. Катионы, будучи положительно заряженными, притягиваются к отрицательно заряженному катоду и движутся к нему. Анионы, будучи отрицательно заряженными, притягиваются к положительно заряженному аноду и движутся к нему. Это объясняет, как ионы движутся в электролитической ячейке и, таким образом, «проводят» электрический ток.
На аноде и катоде протекает химическая реакция. Это может наблюдаться как образование пузырей (из-за образования газов) или осаждение металла на электродах, или как изменение цвета электролита. Реакция варьируется в зависимости от металлов, используемых для электродов, и выбранного электролита. Электролиз раствора хлорида натрия (NaCl) дает газообразный водород (H 2 ), газообразный хлор (Cl 2 ) и гидроксид натрия (NaOFI).
Деятельность
Цель: Показать, что газы образуются при пропускании электрического тока через раствор поваренной соли.
Необходимые материалы: Элемент на 9 В, два электрических провода (примерно 10 см каждый), стакан / стеклянный стакан (если используется стеклянный стакан, его следует выбросить после эксперимента), изоляционная лента, лезвие, кран вода и поваренная соль.
Метод:
1. Возьмите два провода и снимите оболочку с каждого конца, используя лезвие.
2. Подключите один конец каждого из двух проводов к положительной и отрицательной клеммам ячейки.
3. Наполните стакан водопроводной водой и растворите в ней поваренную соль.
4. Опустите два свободных конца проводов в воду, следя за тем, чтобы они не касались друг друга.
Наблюдение: Вы увидите крошечные пузырьки на проводе, подключенном к отрицательной клемме (катоду) ячейки. Эти пузырьки образуются из-за образования газообразного водорода. Газообразный хлор выделяется в проводе, подключенном к положительному выводу (аноду), но реакция протекает намного медленнее и ее нелегко наблюдать.Чтобы проверить, действительно ли пузырьки образуются при пропускании электрического тока через раствор, удалите анодную проволоку из солевого раствора. Вы заметите, что теперь на катоде не образуются пузырьки. Опустите проволоку обратно в раствор, и пузыри снова начнутся.
Заключение: Газы образуются при пропускании электрического тока через раствор поваренной соли.Примечание: Требуется наблюдение взрослых.
Описание процесса электролиза при производстве металлов
Электролиз – это процесс использования электрического тока для инициирования химической реакции.Рассматриваемая химическая реакция обычно представляет собой реакцию восстановления-окисления, в которой атомы обмениваются электронами и меняют степени окисления. Этот процесс может быть использован для производства металлических твердых частиц, которые используются для гальваники и очистки различных металлов.
Базовая установка электролиза
Электролиз требует двух противоположно заряженных полюсов, называемых катодом и анодом. Катод заряжен отрицательно; это место восстановления положительных ионов. Анод заряжен положительно; это место окисления отрицательных ионов.В электролитической ячейке эти два полюса подключены к внешнему источнику питания. Цепь обычно замыкается солевым раствором, называемым электролитом. При производстве металла электролизом на катоде образуется слой металла.
Природа реакции
В окислительно-восстановительной – или окислительно-восстановительной – реакции два разных элемента обмениваются электронами. В процессе электролиза твердый или расплавленный металл появляется, когда положительно заряженный ион металла приобретает электроны, так что он имеет нейтральный заряд.Положительные ионы металлов присутствуют в растворе электролита. Они могут образовывать твердый или расплавленный металл на катоде при подаче электрического тока на устройство. Например, при электролитической очистке алюминия ионы алюминия из электролита будут восстанавливаться на катоде с образованием очень чистого алюминия.
Применение электричества
Для производства металла должен быть приложен электрический потенциал. В процессе электролиза этот поток электронов обычно исходит от внешнего постоянного тока.После подачи электрического тока электроны будут перемещаться по внешней цепи, а положительные ионы будут перемещаться в электролите. Затем катод может подвергнуться восстановлению этими электронами и ионами с образованием металла.
Конечная точка гальваники
Процесс гальваники ограничен количеством положительных ионов металла в растворе электролита. Как только все эти ионы будут израсходованы, реакция не сможет продолжаться. Следовательно, металл больше не образуется.Чтобы продолжить образование большего количества металла, вы должны добавить больше положительных ионов металла в раствор электролита.
Определение электролиза на Dictionary.com
[ih-lek-trol-uh-sis, ee-lek-] SHOW IPA
/ ɪ lɛkˈtrɒl ə sɪs, ˌi lɛk- / PHONETIC RESPELLING
noun Химия. прохождение электрического тока через электролит с последующей миграцией положительно и отрицательно заряженных ионов к отрицательному и положительному электродам.
уничтожение корней волос, опухолей и т. Д. Электрическим током.
ВИКТОРИНЫ
ГОТОВИТЕСЬ К СТАРШЕЙ ШКОЛЕ С ЭТОЙ ВИКТОРИНОЙ VOCAB ДЛЯ 9 КЛАССА
Готов ли ваш ребенок к старшей школе? Предложите им пройти этот подготовленный учителями практический тест для 9-х классов, чтобы проверить, соответствует ли их словарный запас.
Вопрос 1 из 10
актив
Слова рядом электролиз
электрокимограф, химическое покрытие, электролог, электролюминесценция, электролиз, электролиз, электролит, баланс электролита, электролит, электролитический конденсатор, электролизерСловарь.com Несокращенный На основе Несокращенного словаря Random House, © Random House, Inc. 2021
Примеры предложений из Интернета для электролиза
Электролиз также используется как средство хранения электрической энергии в химической форме (см. Вторичный элемент).
Согласно современной теории электролиза, все электролиты содержат большее или меньшее количество свободных ионов.
Британский словарь определений для электролиза
электролиз
/ (ɪlɛkˈtrɒlɪsɪs) /
раствор по расплаву использование этого процесса для индуцирования химических изменений
разрушение живой ткани, такой как корни волос, электрическим током, обычно по косметическим причинам
Слово Origin для электролиза
C19: от электро- + -лиза
Коллинза Английский словарь – полное и несокращенное цифровое издание 2012 г. © William Collins Sons & Co.Ltd. 1979, 1986 © HarperCollins Издательство 1998, 2000, 2003, 2005, 2006, 2007, 2009, 2012
Медицинские определения для электролиза
Электролиз
[-lĕk-trŏlĭ-sĭs, ē′lĕk-]
n.
Химическое изменение, особенно разложение, которое происходит в электролите под действием электрического тока.
Разрушение живой ткани, особенно ткани корней волос, под действием электрического тока с помощью игольчатого электрода.
Медицинский словарь American Heritage® Стедмана Авторское право © 2002, 2001, 1995 компанией Houghton Mifflin.Опубликовано компанией Houghton Mifflin.
Научные определения для электролиза
Электролиз
[ĭ-lĕk-trŏl’ĭ-sĭs]
Процесс, в котором химические изменения, особенно разложение, вызываются пропусканием электрического тока через раствор электролиты, так что ионы электролита движутся к отрицательному и положительному электродам и реагируют с ними. Если отрицательные ионы движутся к аноду, они теряют электроны и становятся нейтральными, что приводит к реакции окисления.Это также происходит, если атомы анода теряют электроны и переходят в раствор электролита в виде положительных ионов. Если положительные ионы движутся к катоду и набирают электроны, становясь нейтральными, происходит реакция восстановления. Электролиз используется для многих целей, включая извлечение металлов из руд, очистку археологических артефактов и покрытие материалов тонкими слоями металла (гальваника).
Научный словарь американского наследия® Авторские права © 2011. Издано издательской компанией Houghton Mifflin Harcourt Publishing Company.Все права защищены.
Культурные определения электролиза
Примечания к электролизу
Наиболее распространенной формой электролиза является гальваника, при которой тонкий слой металла наносится на твердый объект.Новый словарь культурной грамотности, третье издание Авторские права © 2005 издательской компании Houghton Mifflin Harcourt. Опубликовано Houghton Mifflin Harcourt Publishing Company. Все права защищены.
Электролитический процесс – обзор
6.1 Введение
Анодирование – это электролитический процесс для получения толстой, стабильной оксидной пленки на металлах и сплавах, которая может уменьшить коррозию подложки или использоваться в качестве основы для адгезии краски или окрашивания. Это хорошо известная промышленная технология защиты поверхностей легких металлов, особенно алюминия, успешно применяемая на протяжении многих десятилетий. Однако на анодное поведение магния и магниевых сплавов сильно влияет приложенное напряжение. Как правило, обнаруживаются различные пассивные и активные состояния, влияющие на формирование покрытия, в зависимости от приложенного напряжения и состава сплава и электролита.Однако из-за специфических характеристик магниевых сплавов (см. Главу 1) анодирование этих сплавов при низком напряжении никогда не было достаточно успешным, чтобы обеспечить достаточную стойкость к износу и коррозии. В настоящее время в большинстве процессов анодирования используются искровые разряды для преобразования поверхности магния в оксид керамики.
Основной частью процесса анодирования является формирование твердого, плотного, электрически изолирующего и износостойкого анодированного слоя, который обычно имеет толщину около 5–30 мкм.Слои содержат поры, размеры и распределение которых зависят от свойств электролита, температуры, плотности тока анодирования и напряжения. В зависимости от агрессивности окружающей среды анодированное покрытие также может быть дополнительно герметизировано и / или окрашено для оптимальной защиты. Хотя первоначальные затраты на анодирование относительно невелики, текущие затраты на процессы анодирования довольно высоки. Следовательно, использование этого метода для защиты поверхности сплавов Mg ограничено по сравнению с конверсионными покрытиями, например.грамм. для применения в автомобильной промышленности (Hillis, 2001). Тем не менее, применительно ко многим нишевым продуктам покрытия уже доказали, насколько полезны они в условиях износа и коррозии. Текущие исследования, скорее всего, приведут к более дешевым процессам и, таким образом, предоставят более конкурентоспособные решения по анодированию.
Если рассматривать способы электрохимической конверсии, доступные для сплавов Mg, можно выделить две различные группы, которые можно выделить по рабочему напряжению как движущей силе процесса преобразования поверхности.Первая группа работает при напряжении ниже напряжения пробоя – то есть при обычном анодировании (см. Главу 4), используя напряжение в основном для ускорения и усиления естественного образования пассивной пленки в определенных электролитах. Вторая группа работает при напряжениях выше пробивных, используя в основном разряды на границе раздела электролит / металл для улучшения образования пленки и изменения состава, фаз и плотности толстых оксидных пленок. Высокая энергия разряда способна расплавить подложку и пассивные пленки и преобразовать их в твердые керамические покрытия за счет включения компонентов из электролита.Границы между процессами не фиксированы, так как начало появления микроразрядов, часто обозначаемых как потенциал пробоя, зависит от типа и состава сплава подложки, концентрации и состава электролита и, что наиболее важно, от типа мощности ( импульсный, переменный, постоянный). Типичный потенциал пробоя для обработки магниевых сплавов ПЭО находится в диапазоне от 100 до 200 В, а конечные рабочие напряжения находятся в диапазоне от 300 до 600 В; поэтому обычно используются гораздо более высокие напряжения, чем при традиционном анодировании.
Электролиз – электролиз воды, производство натрия и хлора, производство магния, производство гидроксида натрия, хлора и водорода
Электролиз – это процесс, вызывающий химическую реакцию при пропускании электрического тока через вещество или смесь веществ, чаще всего в жидкой форме. Электролиз часто приводит к разложению соединения на его элементы. Для проведения электролиза два электрода, положительный электрод ( анод ) и отрицательный электрод (катод ) погружаются в материал, подлежащий электролизу, и подключаются к источнику постоянного (постоянного) электрического тока.
Аппарат, в котором проводится электролиз, называется электролитической ячейкой . Корни -lys и -lyt происходят от греческих lysis и lytos , что означает разрезать или разлагать; электролиз в электролизере – это процесс, при котором вещество может разлагаться.
Электролизуемое вещество должно быть электролитом , жидкостью, содержащей положительные и отрицательные ионы и, следовательно, способной проводить электричество .Есть два вида электролитов. Один из видов – это ионное соединение , раствор любого соединения, которое производит ионы при растворении в воде , такое как неорганическая кислота, основание или соль . Другой вид представляет собой сжиженное ионное соединение, такое как расплавленная соль.
В любом виде электролита жидкость проводит электричество, потому что ее положительные и отрицательные ионы могут свободно перемещаться к электродам с противоположным зарядом – положительные ионы к катоду, а отрицательные ионы к аноду.Этот перенос положительного заряда в одном направлении и отрицательного заряда в противоположном направлении составляет электрический ток, потому что электрический ток, в конце концов, всего лишь поток заряда, и не имеет значения, являются ли носители заряда ионами или электронами. . В ионном твердом веществе, таком как хлорид натрия , например, обычно закрепленные на месте ионы становятся свободными для движения, как только твердое вещество растворяется в воде или как только оно плавится.
Во время электролиза ионы движутся к электродам с противоположным зарядом.Когда они достигают своих электродов, они подвергаются химическим окислительно-восстановительным реакциям. На катоде, который накачивает электроны в электролит, происходит химическое восстановление – захват электронов положительными ионами. На аноде, который отсасывает электроны из электролита, происходит химическое окисление – потеря электронов отрицательными ионами.
В электролизе существует прямая зависимость между количеством электричества, протекающего через элемент, и количеством протекающей химической реакции.Чем больше электронов прокачивается через электролит батареей , тем больше ионов будет вынуждено отдавать или принимать электроны, тем самым окисляясь или восстанавливаясь.


