| Этот раздел не завершён. Гальванические элементы характеризуются: э.д.с., емкостью, энергией, которую он может отдать во внешнюю цепь, сохраняемостью.
Классификация гальванических элементовГальванические первичные элементы – это устройства для прямого преобразования химической энергии, заключенных в них реагентов (окислителя и восстановителя), в электрическую. Реагенты, входящие в состав источника, расходуются в процессе его работы, и действие прекращается после расхода реагентов. Примером гальванического элемента является элемент Даниэля –Якоби. Широкое распространение получили марганцево-цинковые элементы, не содержащие раствора электролита (сухие элементы, батарейки). Так, в солевых элементах Лекланше цинковый электрод служит анодом, электрод из смеси диоксида марганца с графитом служит катодом, графит служит токоотводом. Щелочные марганцево-цинковые элементы, в которых в качестве электролита используется паста на основе гидроксида калия, обладают целом рядом преимуществ, в частности существенно большей ёмкостью, лучшей работой при низких температурах и при больших токах нагрузки. Солевые и щелочные элементы широко применяются для питания радиоаппаратуры и различных электронных устройств. Вторичные источники тока (аккумуляторы) – это устройства, в которых электрическая энергия внешнего источника тока превращается в химическую энергию и накапливается, а химическая – снова превращается в электрическую. Одним из наиболее распространенных аккумуляторов является свинцовый (или кислотный). Электролитом является 25-30 % раствор серной кислоты. Электродами кислотного аккумулятора являются свинцовые решетки, заполненные оксидом свинца, который при взаимодействии с электролитом превращается в PbSO4. Также существуют щелочные аккумуляторы. Наибольшее применение получили никель-кадмиевые и никель-металлгидридные аккумуляторы, в которых электролитом служит KOH. В различных электронных устройствах (мобильные телефоны, планшеты, ноутбуки), в основном, применяются литий-ионные и литий-полимерные аккумуляторы, характеризующиеся высокой ёмкостью и отсутствием эффекта памяти. Электрохимические генераторы (топливные элементы) – это элементы, в которых происходит превращение химической энергии в электрическую. Окислитель и восстановитель хранятся вне элемента, в процессе работы непрерывно и раздельно подаются к электродам. В процессе работы топливного элемента электродые не расходуются. Восстановителем является водород (H2), метанол (CH3OH), метан (CH4) в жидком или газообразном состоянии. Окислителем обычно является кислород воздуха или чистый. В кислородно-водородном топливном элементе со щелочным электролитом происходит превращение химической энергии в электрическую. Применение
См. такжеЛитература
Ссылки | Этот раздел статьи ещё не написан. |
| Химические источники тока | |
|---|---|
| Гальванический элемент | Гальванический элемент Даниеля | Щелочной элемент | Ртутно-цинковый элемент | Сухой элемент | Концентрационный элемент | Воздушно-цинковый элемент | Нормальный элемент Вестона |
| Электрические аккумуляторы | Свинцово-кислотный | Серебряно-цинковый | Никель-кадмиевый | Никель-металл-гидридный | Никель-цинковый аккумулятор | Литий-ионный | Литий-полимерный | Литий-железо-сульфидный | Литий-железо-фосфатный | Литий-титанатный | Ванадиевый | Железо-никелевый |
| Топливные элементы | Прямой метанольный | Твердооксидный | Щелочной |
| Модели | Батарея | Электрический аккумулятор | Топливный элемент |
| Устройство | Анод | Катод | Электролит |
Wikimedia Foundation . 2010 .
2010 .
Смотреть что такое “Гальванический элемент” в других словарях:
ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ — химический источник тока, в котором электрическая энергия вырабатывается в результате прямого преобразования химической энергии окислительно восстановительной реакцией. В состав гальванического элемента входят два разнородных электрода (один… … Большой Энциклопедический словарь
ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ — источник тока, в котором электрическая энергия возникает за счёт химической реакции. Гальванический элемент состоит из 2 электродов, помещённых в электропроводную жидкость (электролит). Применяются почти исключительно «сухие» элементы, в которых… … Краткая энциклопедия домашнего хозяйства
Гальванический элемент — ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ, химический источник тока; вырабатывает электроэнергию в результате прямого преобразования химической энергии окислительно восстановительной реакций. Различают гальванический элемент одноразового (первичные элементы),… … Иллюстрированный энциклопедический словарь
гальванический элемент — элемент Химический источник тока, состоящий из электродов и электролита, заключенных в один сосуд, предназначенный для разового или многократного разряда. [ГОСТ 15596 82] EN cell basic functional unit, consisting of an assembly of electrodes,… … Справочник технического переводчика
[ГОСТ 15596 82] EN cell basic functional unit, consisting of an assembly of electrodes,… … Справочник технического переводчика
ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ — первичный источник постоянного электр. тока, в к ром хим. энергия, освобождающаяся при хим. процессах, превращается в электрическую. Технический железнодорожный словарь. М.: Государственное транспортное железнодорожное издательство. Н. Н.… … Технический железнодорожный словарь
гальванический элемент — – система, в которой химическая энергия окислительно восстановительного процесса превращается в электрическую. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ — устройство, в котором электрическая энергия получается за счёт самопроизвольной хим. реакции. Простой хим. источник тока состоит из двух электродов отрицательного (напр. цинк) и положительного (напр. медь, оксиды металлов, уголь), погружённых в… … Большая политехническая энциклопедия
гальванический элемент — химический источник тока, в котором электрическая энергия вырабатывается в результате прямого преобразования химической энергии окислительно восстановительной реакции. В состав гальванического элемента входят два разнородных электрода (один … … Энциклопедический словарь
В состав гальванического элемента входят два разнородных электрода (один … … Энциклопедический словарь
гальванический элемент — elektrocheminis elementas statusas T sritis chemija apibrėžtis Cheminis elektros energijos šaltinis, kuriame elektrocheminių reakcijų energija verčiama elektros energija. atitikmenys: angl. electrochemical cell; element; galvanic cell; voltaic… … Chemijos terminų aiškinamasis žodynas
Гальванический элемент — 2. Гальванический элемент Элемент Galvanisches Element Химический источник тока, состоящий из электродов и электролита, заключенных в один сосуд, предназначенный для разового или многократного разряда Источник: ГОСТ 15596 82: Источники тока… … Словарь-справочник терминов нормативно-технической документации
Эта музыка будет вечной
если я заменю батарейки
Слово «батарея», происходящее от французского слова «batterie», настолько давно вошло в русский язык, что точный словарный перевод по степени очевидности вызывает в памяти бессмертные строчки из Чехова: – «Волга впадает в Каспийское море, лошади кушают овес и сено».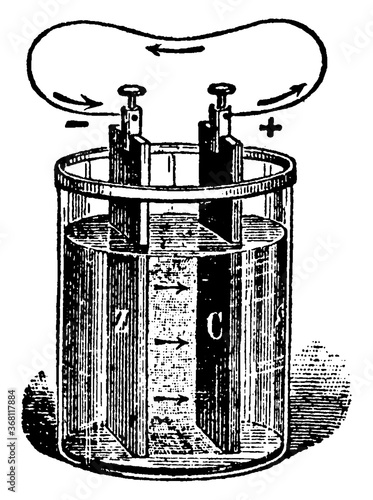 Вот сами посудите, это строчка из русско-французского разговорника:
Вот сами посудите, это строчка из русско-французского разговорника:
фр. batterie (сущ.) – батарея.
Только серьезно задавшись целью выяснить этимологию этого слова, через некоторое время можно добраться до объяснения, что batterie – это battre «бить» – соединение нескольких однотипных приборов, устройств в единую систему или установку для эффективного совместного действия. Название происходит от артиллерийской батареи, как исторически первого типа батарей. Впоследствии название стало употребляться для обозначения соединения однотипных предметов вообще.
Кстати, отсюда вытекает то, что в быту мы в общем-то неправильно называем батареями пальчиковые элементы питания, потому что они – сюрприз – одиночные гальванические элементы.
Итак, наш пост про гальванические элементы, иначе именуемые батарейками.
Быстренько пробежимся по истории. Хотя в последнее время археологи стали утверждать, что что-то похожее на химические источники тока появились в Мессопотамии за 100 лет до н. э. (так называемая Багдадская батарейка), но это все на уровне гипотезы, а официальное рождение батареи относят к 1800г, когда итальянский физик Алессандро Вольта, основываясь на опытах итальянского врача и анатома Луиджи Гальвани, сделал устройство, получившее впоследствии название «вольтов столб». Сложив стопку высотой полметра из пластинок цинка, меди и войлока, смоченного раствором серной кислоты, Вольта, приложив руки к концам стопки, получил весьма чувствительный удар током. Так началась электрическая эра.
э. (так называемая Багдадская батарейка), но это все на уровне гипотезы, а официальное рождение батареи относят к 1800г, когда итальянский физик Алессандро Вольта, основываясь на опытах итальянского врача и анатома Луиджи Гальвани, сделал устройство, получившее впоследствии название «вольтов столб». Сложив стопку высотой полметра из пластинок цинка, меди и войлока, смоченного раствором серной кислоты, Вольта, приложив руки к концам стопки, получил весьма чувствительный удар током. Так началась электрическая эра.
Изобретение Алессандро Вольта произвело фурор в обществе, Вольта осыпали почестями и наградами, его именем назвали единицу электрического напряжения. Свою долю славы получил и Луиджи Гальвани – в честь его электрохимический элемент, изобретенный Вольта, называется гальваническим (несколько парадоксально, конечно).
Для легкости понимания давайте вспомним немного сведений из школьной программы про гальванический элемент. Я, естественно, не помнил, поэтому пришлось читать. Прочел, осмыслил длинную нудную фразу и пересказываю более простыми словами: гальванический элемент – это источник электрического тока, основанный на химической реакции двух металлов (или их оксидов для удешевления/простоты использования), один из металлов, именуемый анодом, всегда более активный, чем второй, называемый катодом, эти металлы помещены в токопроводящую среду, именуемую электролитом, при соединении этих металлов проводником образуется электрическая цепь и начинает вырабатываться ток, который бежит от анода (-) к катоду (+).
Прочел, осмыслил длинную нудную фразу и пересказываю более простыми словами: гальванический элемент – это источник электрического тока, основанный на химической реакции двух металлов (или их оксидов для удешевления/простоты использования), один из металлов, именуемый анодом, всегда более активный, чем второй, называемый катодом, эти металлы помещены в токопроводящую среду, именуемую электролитом, при соединении этих металлов проводником образуется электрическая цепь и начинает вырабатываться ток, который бежит от анода (-) к катоду (+).
(Перечитав) Ну, тоже длинно, но хоть более-менее понятно.
Гальванические элементы делятся на два типа – первичные и вторичные. Первичные напрямую преобразуют химическую энергию, содержащуюся в реагентах гальванического элемента, в электрическую энергию. Этот процесс идет до полного расхода реагентов, после чего выработка электричества прекращается. Проще говоря, это одноразовые элементы. Все батарейки являются первичными гальваническими элементами.
Вторичные гальванические элементы – элементы, в которых электрическая энергия от внешнего источника тока превращается в химическую энергию и накапливается, а затем, при необходимости, химическая энергия снова превращается в электрическую. Эти вторичные элементы называются аккумуляторами. Про аккумуляторы мы опустим, эта обширная тема достойна отдельной большой статьи.
Одним из первых гальванических элементов, которым можно было пользоваться вне лабораторий, был изобретен Жоржем Лекланше в 1866 году. Конструкция имени Лекланше проста – цинковый анод, катод из диоксида марганца с углем, размещенные в электролите из хлорида аммония, т.е. соли аммония. В течении некоторого времени элемент Лекланше претерпел изменения: цинковый анод стал делаться в виде цинкового стаканчика, в стаканчике размещен катод из смеси диоксида марганца и графита, в центре катода находится угольный стержень, являющийся токосъемником (в некоторых источниках именно он неправильно называется катодом), катод окружен электролитом из хлорида аммония с добавкой хлорида цинка, только не в жидком виде, как у Лекланше, а в загущенном, в виде геля, из-за добавления крахмала и муки. Это необходимо для того, чтобы электролит не мог вытечь или высохнуть при хранении и эксплуатации элемента. Элементы с загущенным электролитом получили название «сухие батареи».
Это необходимо для того, чтобы электролит не мог вытечь или высохнуть при хранении и эксплуатации элемента. Элементы с загущенным электролитом получили название «сухие батареи».
А вот сейчас, между прочим, вы прочли описание классической конструкции солевого гальванического элемента, по такой технологии он производится уже 150 лет без особого изменения. Получается как-то не очень хорошо с темпами развития науки в смежных областях – в отличие от бурного, взрывного роста возможностей электроники, за 60 лет уменьшившее компьютер MARK-1 весом 5 тонн и площадью 60 кв.м до микросхемы весом в доли грамма и площадью с булавочную головку, причем с намного большими возможностями, и этот хайтек питает энергией древняя двухсотлетняя технология. Печально. А что еще грустно, фирмы, выпускающие элементы питания, не испытывают никаких иллюзий в появлении прорывных, революционных технологий производства портативных источников тока и откровенно говорят, что в ближайшем и даже не очень ближайшем будущем нас ожидает только постепенное улучшение характеристик батарей. Понемногу, по проценту – по полпроцента в год.
Понемногу, по проценту – по полпроцента в год.
Разумеется, какие-то всплески на плавном растущем графике улучшения характеристик были. И одним из всплесков было появление щелочных батарей.
Щелочная, она же алкалайновая (алкалиновая) батарея.
Впервые щелочные батарейки выпустила компания Eveready (ныне Energizer) в 1959г. Принцип ее работы практически идентичен принципу работы солевой батареи – анод из цинка, катод из диоксида марганца, единственное отличие в составе электролита – он не из соли аммония, как в солевой, а из раствора щёлочи, обычно гидроксида калия. И конструкция элемента отличается – она, так сказать, вывернута наизнанку по сравнению с конструкцией солевого элемента. У солевого элемента анод в виде цинкового стаканчика, заполненный катодом в виде диоксида марганца, разделенным электролитом из соли аммония, а у щелочной батареи анод в виде пасты из цинкового порошка в смеси с электролитом находится внутри катода из смеси диоксида марганца с графитом.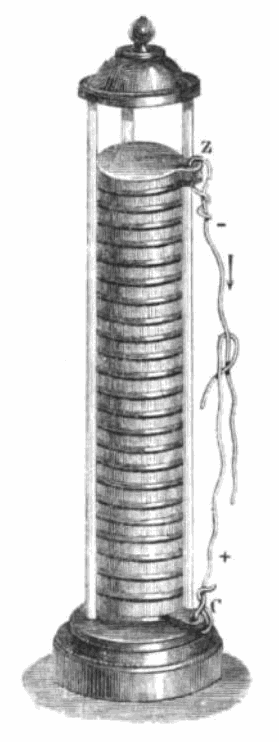 Анод и катод разделены тонким сепаратором, пропитанным электролитом, и все это располагается в стальном корпусе. Получается, что если у солевого элемента корпус (-), а центральный токоотвод (+), то у щелочного элемента все наоборот, корпус (+), а центральный токоотвод (-).
Анод и катод разделены тонким сепаратором, пропитанным электролитом, и все это располагается в стальном корпусе. Получается, что если у солевого элемента корпус (-), а центральный токоотвод (+), то у щелочного элемента все наоборот, корпус (+), а центральный токоотвод (-).
Такая конструкция, разумеется, сделана не просто так. Выше упоминалось, что первичные гальванические элементы преобразуют химическую энергию, содержащуюся в реагентах элемента. В солевых элементах при химической реакции расходуются все реагенты, составляющие этот элемент – анод, катод, электролит. А в щелочном элементе при химической реакции расходуется только анод и катод, электролит не расходуется. Поэтому электролита там совсем мало, и освободившееся место электролита заполнено увеличенным количеством анода и катода, что значительно увеличивает электроемкость щелочного элемента. И здесь мы плавно переходим к рассмотрению преимуществ и недостатков солевых и щелочных источников питания.
Форм-фактор распространенных гальванических элементов
Преимущества и недостатки солевых и щелочных элементов.
У солевых сейчас осталось только одно преимущество – цена. Технология производства проста и вылизана до идеала уже давным-давно, стоимость реагентов и материалов низка, поэтому себестоимость очень маленькая. Но на этом преимущества кончаются и начинаются недостатки, а именно:
Маленькая емкость. В среднем емкость солевого элемента в 3-5 меньше, чем у щелочного. К тому же это при малой и средней нагрузке, при высокой нагрузке (мощные фонари, фотоаппараты и видеокамеры) разница в емкости еще больше увеличивается и достигает 10. Т.е., к примеру, солевая батарейка питает маломощный прибор, скажем, 10 дней, а щелочная 10*3=30 дней; такая же солевая батарейка обеспечит энергий фотоаппарат со вспышкой в течение 10 минут, а такая же щелочная 10*10=100 минут.
Маленький срок хранения. У солевого элемента – 2 года, у щелочного – 7-10 лет. Срок хранения солевой батареи можно увеличить, если держать ее в холодильнике, при низкой температуре химические реакции, при которой происходит саморазряд, замедляются.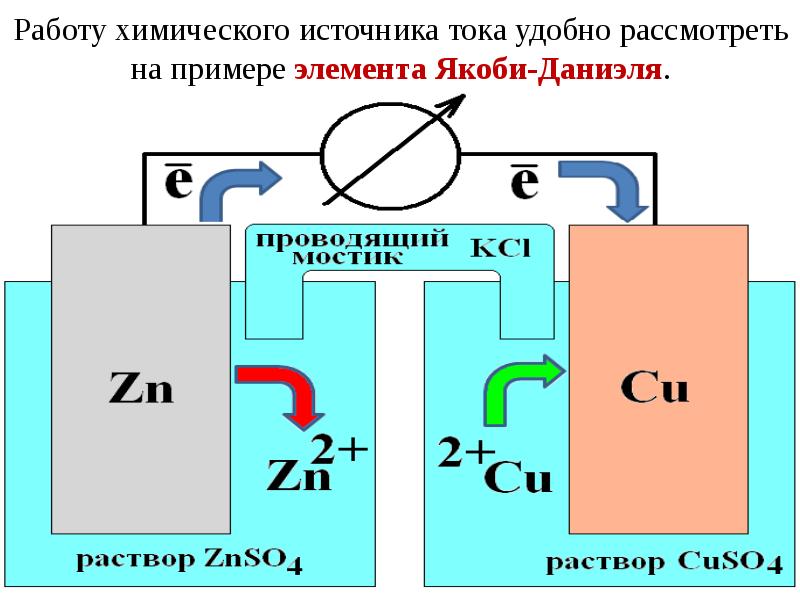 Для щелочных элементов температура хранения некритична.
Для щелочных элементов температура хранения некритична.
Узкий температурный диапазон эксплуатации. Солевые батареи вообще не могут работать при отрицательных температурах, а щелочная при -20 °С отдает такую же емкость, как солевая в режиме беспрерывного разряда при комнатной температуре.
В последние несколько лет в продаже появились новый тип элементов – литиевый. Принцип действия все так же похож на принцип солевого и щелочного элемента, но анод изготовлен из лития или его соединения. Из химии известно, что литий имеет наивысший отрицательный потенциал по отношению к остальным металлам, соответственно, он имеет наибольшее номинальное напряжение при минимальных размерах. И другие параметры тоже превосходные –очень большое время хранения (до 15 лет), исключительно малые токи саморазряда и высокая степень герметичности, хранение и работа в широком диапазоне отрицательных и положительных температур. Но цена, цена.
Некоторые советы от опытных пользователей касательно батареек.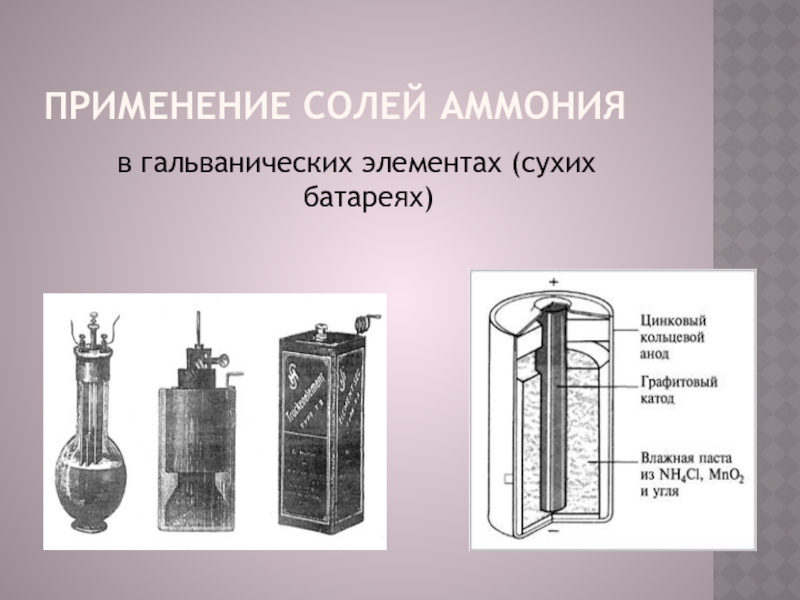
Не надо стремиться покупать элементы известных фирм, которые на слуху благодаря навязчивой рекламе. Ведь рекламный бюджет надо отбивать, и расходы на рекламу включаются в цену товара. Да, высокотехнологичная батарейка может оказаться самой долгоиграющей, но ее цена взлетает в небеса; две же обычные батарейки по емкости спокойно перекрывают одну супербатарейку, и к тому же стоимость двух обычных оказывается дешевле, чем одной именитой. На одном сайте был проведен большой тест батареек различных фирм, там посчитали комплексный параметр цена/емкость, и в результате тестов лидером отказалась безымянная батарейка, продающаяся в гипермаркете Ашан, ее ватт мощности оказался самым дешевым, оставив далеко позади именитые фирмы. А известная история с батарейками фирмы «Космос», появившиеся в продаже несколько лет назад, покупатели, которые купили эти батарейки, с удивлением и даже некоторым шоком отмечали, что эти батарейки ничуть не хуже, а зачастую и существенно лучше грандов, при цене на порядок ниже.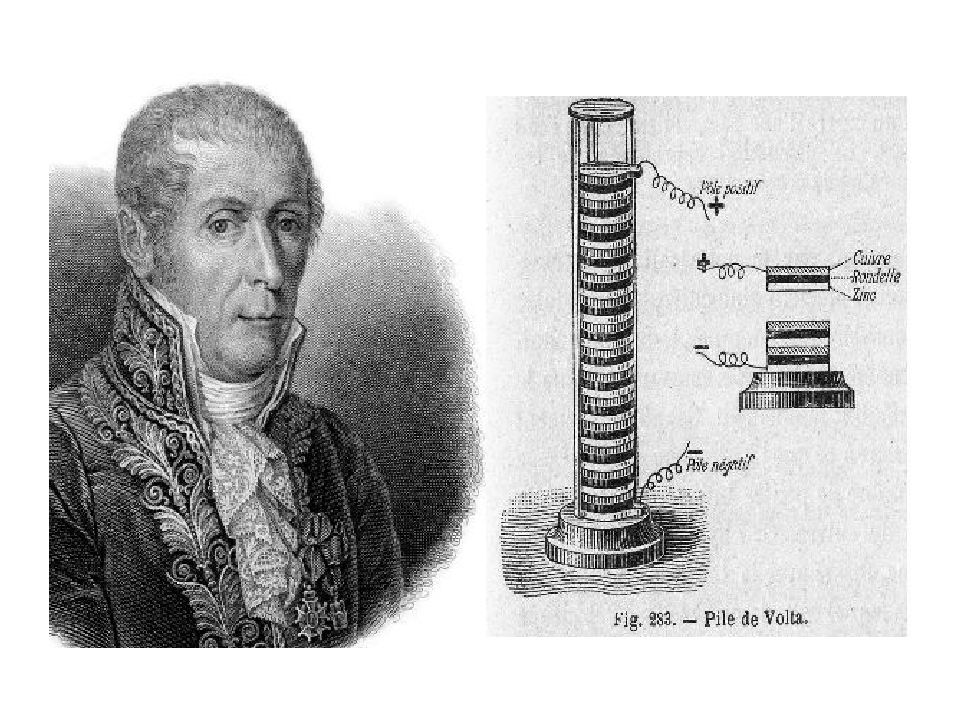
Севшие солевые батарейки можно восстановить. Делается это двумя способами – обстукиванием корпуса батарейки и зарядкой (да, солевые перезаряжаются) током специальной формы. Обстукивание – самый простой способ восстановления. Суть – под ударной нагрузкой с цинкового анода стряхиваются продукты реакции, налипшие на анод и препятствующие дальнейшей реакции. Стучать надо без особого фанатизма, иначе рискуешь повредить корпус, и электролит вытечет. Перезаряжать – сложнее, здесь требуется «умная» зарядка, которая стоит дорого и не везде продается, и тоже существует риск повреждения элементов.
За пределами поста осталось много интересных элементов (воздушно-цинковые, ртутные, серебряные и т.д.), описание их категорически не влезает в отведенный объем. Но все это перепевы классического гальванического элемента, изобретенного почти 200 лет назад. Выше упоминалось, что фирмы, производящие источники тока, особых прорывов не ожидают. Но интересно же заглянуть за горизонт? И ученые уже предлагают совсем иные принципы работы источников питания для все увеличивающихся в размере и количеству носимых нами гаджетов. Перечислю некоторые научные проекты: преобразование тепла человека в электричество с помощью стеклоткани, канализирование света с помощью фотоэлектрических органических ячеек, преобразование лактатов из человеческого пота в электричество с помощью «биотатуировки». Интересно, что же из этого выстрелит?
Перечислю некоторые научные проекты: преобразование тепла человека в электричество с помощью стеклоткани, канализирование света с помощью фотоэлектрических органических ячеек, преобразование лактатов из человеческого пота в электричество с помощью «биотатуировки». Интересно, что же из этого выстрелит?
Гальванические элементы. Виды и устройство. Работа и особенности
В первых опытах ученых в емкость с кислотой опускали две металлические пластины: медную и цинковую. Пластины соединяли проводником, после чего на медной пластине появлялись газовые пузырьки, а цинковая пластина стала растворяться. Было доказано, что по проводнику проходит электрический ток. Это исследование начинал итальянский ученый Гальвани, от него и получили название гальванические элементы.
После этого ученый Вольта разработал цилиндрическую форму этого элемента в виде вертикального столбика, включающего в себя набор колец меди, цинка и сукна, соединенных друг с другом, и пропитанных кислотой. Разработанный Вольтом вертикальный элемент полуметровой высоты вырабатывал напряжение, которое мог почувствовать человек.
Разработанный Вольтом вертикальный элемент полуметровой высоты вырабатывал напряжение, которое мог почувствовать человек.
Гальванические элементы — это источники электрической энергии, вырабатывающие электрический ток методом химического взаимодействия двух металлов в электролите. Химическая энергия в гальванических элементах преобразуется в электрический ток.
Виды и особенности устройстваБатарейки широко используются для питания разных электронных устройств, приборов, цифровой техники и делятся на три основных вида:
- Солевые.
- Щелочные.
- Литиевые.
Солевые гальванические элементы
Такие батарейки относятся к марганцево-цинковым элементам питания, и являются наиболее применяемыми в настоящее время.
Достоинствами солевых батареек являются:
- Приемлемые электрические параметры для многих областей использования.
- Удобство применения.
- Малая цена ввиду небольших расходов на изготовление.

- Простая технология изготовления.
- Дешевое и доступное сырье.
Длительное время этот вид батареек является наиболее популярным, благодаря соотношению качества и цены. Однако в последние годы заводы изготовители уменьшают производство солевых гальванических элементов, и даже отказываются от выпуска, так как требования к источникам питания повышаются производителями электронной техники.
Недостатками солевых батареек являются:
- Малый срок хранения, не более 2-х лет.
- Резкое падение свойств при снижении температуры.
- Резкое уменьшение емкости при повышении рабочего тока до эксплуатационных значений современных потребителей.
- Быстрое уменьшение напряжения во время работы.
Солевые гальванические элементы в конце своего разряда могут потечь, что связано с вытеканием электролита из-за увеличения объема положительного электрода, который выдавливает электролит. Активная масса плюсового электрода состоит из диоксида марганца и электролита. Сажа и графит, добавленный в активную смесь, повышают электропроводность активной смеси. Их доля равна от 8 до 20% в зависимости от марки батарейки. Для увеличения срока работы окислителя активную смесь насыщают электролитом.
Сажа и графит, добавленный в активную смесь, повышают электропроводность активной смеси. Их доля равна от 8 до 20% в зависимости от марки батарейки. Для увеличения срока работы окислителя активную смесь насыщают электролитом.
Минусовой электрод изготавливают из очищенного цинка, устойчивого к коррозии. В нем остается небольшая доля кадмия или свинца, являющегося ингибиторами коррозии. Раньше в батарейках в качестве электролита использовали хлорид аммония. Он участвует в реакции образования тока, создает проходимость ионов. Но такой электролит не показал хороших результатов, и его заменили хлоридом цинка с примесями хлорида кальция. Марганцево-кислые элементы работают дольше, и показывают лучшие результаты при пониженных температурах.
В солевых гальванических элементах отрицательным полюсом является цинковый корпус 7. Плюсовой электрод 6 изготовлен из активной прессованной массы, пропитанной электролитом. По центру этой массы находится угольный стержень 5, обработанный парафином для удержания влаги в электролите.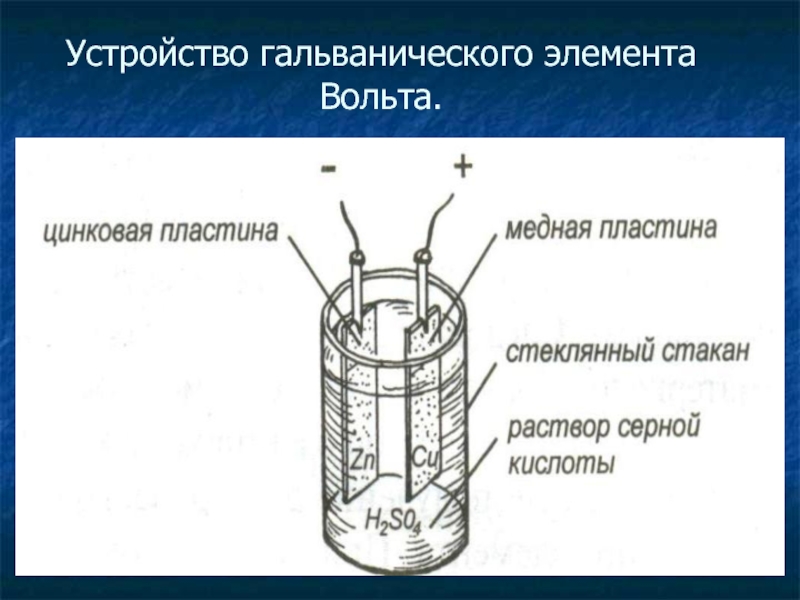 Верхняя часть стержня закрыта металлическим колпаком. В сепараторе 4 находится густой электролит. В газовую камеру 1 поступают газы, образованные при работе батарейки. Сверху батарейку закрывают прокладкой 3. Весь гальванический элемент заключают в футляр 2, выполненный из картона или фольги.
Верхняя часть стержня закрыта металлическим колпаком. В сепараторе 4 находится густой электролит. В газовую камеру 1 поступают газы, образованные при работе батарейки. Сверху батарейку закрывают прокладкой 3. Весь гальванический элемент заключают в футляр 2, выполненный из картона или фольги.
Щелочные элементы питания появились в середине прошлого века. В них в качестве окислителя выступает диоксид марганца, а в качестве восстановителя порошковый цинк. Это дает возможность увеличить поверхность. Для предохранения от коррозии раньше применялось амальгамирование. Но после запрета на ртуть используют очищенные цинковые порошки с добавлением других металлов и ингибиторов коррозии.
Активным веществом анода щелочной (алкалиновой) батарейки стал очищенный цинк в виде порошка с добавлением алюминия, индия или свинца. Активная смесь катода включает в себя диоксид марганца, ацетиленовую сажу или графит. Электролит алкалиновых батареек состоит из едкого натра или калия с добавлением оксида цинка.
Порошковый анод позволяет значительно повысить использование активной смеси, в отличие от солевых батареек. Алкалиновые батарейки обладают значительно большей емкостью, чем солевые, при равных габаритных размерах. Они хорошо себя показали в работе на морозе.
Особенностью устройства алкалиновых элементов является порошковый цинк, поэтому вместо цинкового стакана используют стальной корпус для положительного вывода. Активная смесь положительного электрода находится возле внутренней стенки стального корпуса. В алкалиновой батарейке есть возможность разместить больше активной смеси положительного электрода, в отличие от солевой.
В активную смесь вставляется целлофановый сепаратор, смоченный электролитом. По центру батарейки проходит латунный отрицательный электрод. Остальной объем между сепаратором и отрицательным токоотводом заполняется анодной пастой в виде порошкового цинка, пропитанного густым электролитом. Обычно в качестве электролита используют щелочь, насыщенную специальными соединениями цинка. Это дает возможность предотвратить потребление щелочи в начале работы элемента, и снизить коррозию. Масса щелочных батареек выше солевых из-за стального корпуса и большей плотности активной смеси.
Это дает возможность предотвратить потребление щелочи в начале работы элемента, и снизить коррозию. Масса щелочных батареек выше солевых из-за стального корпуса и большей плотности активной смеси.
По многим основным параметрам алкалиновые гальванические элементы превосходят солевые элементы. Поэтому в настоящее время увеличивается объем производства щелочных батареек.
Литиевые элементы питанияЛитиевые гальванические элементы применяются в различных современных устройствах. Они выпускаются различных типоразмеров и видов.
Существуют литиевые батарейки и литиевые аккумуляторы, имеющие между собой большие отличия. Батарейки имеют в составе твердый органический электролит, в отличие от других видов элементов. Литиевые элементы используются в местах, где требуются средние и малые токи разряда, стабильное рабочее напряжение. Литиевый аккумулятор можно перезаряжать определенное количество раз, а батарейки не предназначены для этого, и используются только один раз. Их запрещается вскрывать или перезаряжать.
Их запрещается вскрывать или перезаряжать.
- Надежная герметизация корпуса. Нельзя допускать утечки электролита и проникновения внутрь других веществ из внешней среды. Нарушение герметичности приводит к их возгоранию, так как литий является высоко активным элементом. Гальванические элементы с нарушенной герметичностью не годятся для эксплуатации.
- Изготовление должно проходить в герметичных помещениях с аргоновой атмосферой и контролем влажности.
Форма литиевых аккумуляторов бывает цилиндрической, дисковой или призматической. Габариты практически не отличаются от других видов батареек.
Область использованияЛитиевые гальванические элементы обладают более длительным сроком работы, по сравнению с другими элементами. Область применения очень широка:
- Космическая промышленность.
- Авиационное производство.
- Оборонная промышленность.
- Детские игрушки.

- Медицинская техника.
- Компьютеры.
- Фото- и видеокамеры.
Преимущества
- Широкий интервал рабочих температур.
- Компактные размеры и масса.
- Длительная эксплуатация.
- Стабильные параметры в различных условиях.
- Большая емкость.
Недостатки
- Возможность внезапного возгорания при несоблюдении правил пользования.
- Высокая цена, по сравнению с другими видами батареек.
Действие гальванических элементов основано на том, что два разных металла в среде электролита взаимодействуют между собой, в результате чего во внешней цепи образуется электрический ток.
Такие химические элементы сегодня называют батарейками. Величина напряжения батарейки зависит от применяемых видов металлов и от числа элементов, находящихся в ней. Все устройство батарейки расположено в металлическом цилиндре. Электроды представляют собой металлические сетки с напылением восстановителя и окислителя.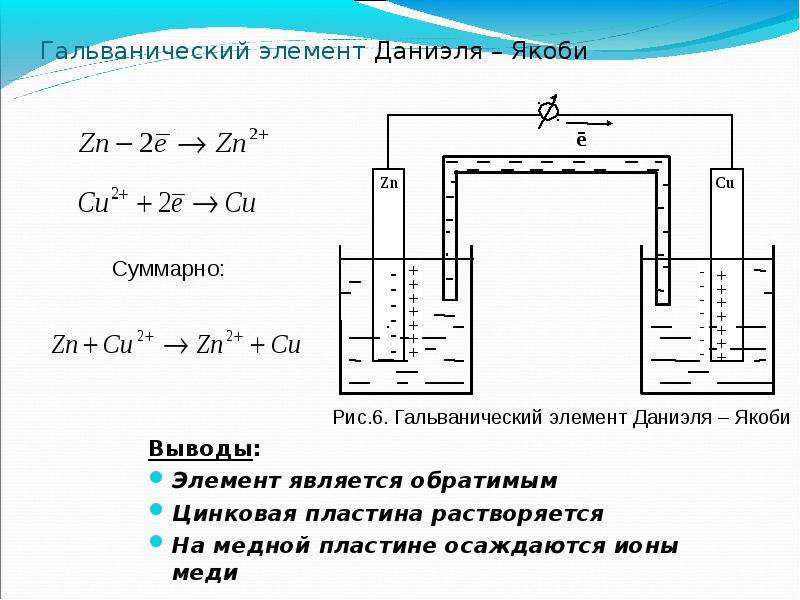
Батарейки не могут восстанавливать утраченные свойства, так как в них осуществляется прямое преобразование химической энергии окислителя и восстановителя в электрическую. Химические реагенты при функционировании батарейки постепенно расходуются, а электрический ток уменьшается.
Отрицательный вывод батарейки выполнен из цинка или лития, он теряет электроны и является восстановителем. Другой положительный вывод играет роль окислителя, его изготавливают из оксида магния или солей металлов. Состав электролита в обычных условиях не пропускает через себя электрический ток. При замыкании электрической цепи начинается распад электролита на ионы, что обуславливает появление его электрической проводимости. Электролит состоит чаще всего из раствора кислоты или солей натрия и калия.
Похожие темы:
Первый гальванический элемент – Большая Энциклопедия Нефти и Газа, статья, страница 1
Первый гальванический элемент
Cтраница 1
Первый гальванический элемент был построен А. Элемент состоял из медных и цинковых пластинок, между которыми помещались смоченные в уксусной кислоте прокладки из сукна. Возникновение электрического тока в нем сопровождается химическими превращениями на электродах.
[1]
Элемент состоял из медных и цинковых пластинок, между которыми помещались смоченные в уксусной кислоте прокладки из сукна. Возникновение электрического тока в нем сопровождается химическими превращениями на электродах.
[1]
Первый гальванический элемент был построен Вольтером в конце XVIII в. [2]
Первым гальваническим элементом был вольтов столб, а затем батарея Петрова. [3]
Задолго до того, как был построен первый гальванический элемент, и даже, пожалуй, раньше, чем были осознаны какие-либо электрические явления, человечество познакомилось с постоянными магнитами природного происхождения и, соответственно, с магнитными явлениями. [4]
Первые шаги экспериментальной электрохимии были связаны с открытием Гальвани и Вольта примитивных источников тока – первых гальванических элементов. Сочетание анодного растворения с последующим катодным электроосаждением лежит в основе рафинирования металлов электролизом.
[5]
Сочетание анодного растворения с последующим катодным электроосаждением лежит в основе рафинирования металлов электролизом.
[5]
В тридцатых годах нашего века немецкий археолог Ке-ииг нашел в районе Багдада керамический сосуд с остатками меди и железа и высказал предположение, что это не что иное, как первый гальванический элемент. В 1962 г. в районе древнего города Селевкия, расположенного южнее Багдада на высоком берегу Тигра, американские археологи вновь обнаружили загадочные конусообразные керамические сосуды с разъединенными медными цилиндрами и железными брусками внутри. Неподалеку раскопали серебряные украшения, на которых хорошо сохранилась позолота. Вручную нанести тонкий слой золота поверх серебра невозможно. В наши дни для этого пользуются электролизом. [6]
Гальванические элементы ( или, как их часто называют, электрохимические преобразователи энергии) стали использоваться еще на самых ранних этапах развития теории электричества и химии, В учебниках обычно утверждается, что первый гальванический элемент был собран профессором университета в Павии Вольта в 1800 г. Столб Вольта представлял собой колонку из цинковых и медных дисков, разделенных пропитанными разбавленной серной кислотой войлочными прокладками. Однако, по-видимому, первый элемент был построен тремя годами раньше Гумбольдтом.
[7]
Столб Вольта представлял собой колонку из цинковых и медных дисков, разделенных пропитанными разбавленной серной кислотой войлочными прокладками. Однако, по-видимому, первый элемент был построен тремя годами раньше Гумбольдтом.
[7]
Первый гальванический элемент был создан в 1799 г. итальянским физиком А. Элемент Вольта, состоящий из цинкового и медного электродов, погруженных в разбавленный раствор серной кислоты, работает крайне непродолжительное время. Объясняется это тем, что потенциал катода уменьшается, следовательно, уменьшается и разность потенциалов гальванического элемента. [8]
Вольта Александро ( 1745 – 1827) – выдающийся итальянский физик, один из основателей учения об электричестве. Создал первый гальванический элемент и батарею гальванических элементов ( знаменитый вольтов столб), изобрел электроскоп, электрофор и другие приборы.
[9]
Создал первый гальванический элемент и батарею гальванических элементов ( знаменитый вольтов столб), изобрел электроскоп, электрофор и другие приборы. [10]
Часто в гальванических элементах используют металлические электроды, погруженные в растворы солей. Таков, например, первый гальванический элемент, изобретенный Вольта, состоящий из цинковых и серебряных дисков. [11]
Рождение электрохимии может быть отнесено к прошлому веку, ко времени создания первых гальванических элементов. В наши дни в связи с развитием подводного флота, ракетной техники и радиотехники роль химических источников тока снова сильно возросла. Так, окисно-ртутные элементы применяются как источник питания в аппаратуре космических кораблей, а элементы, содержащие индий, используются в ручных электрочасах. [12]
Страницы: 1
Вольта гальванический элемент – Справочник химика 21
Зарождение электрохимии связано с именами Л. Гальвани и А. Вольта. В 1791 г., изучая мышечную деятельность лягушки, Гальвани случайно получил электрохимическую цепь, которая состояла из двух металлов и лапки лягушки. Гальвани считал, что возникновение электричества возможно только в живых системах. В 1799 г. Вольта создал первую в истории науки батарею гальванических элементов — так называемый вольтов столб, чем опроверг гипотезу животного электричества. Элементы батареи состояли из медных и цинковых пластинок, разделенных сукном, пропитанным раствором электролита. [c.175]
Первый гальванический элемент был построен А. Вольта. Элемент состоял из медных и цинковых пластинок, между которыми помещались смоченные в уксусной кислоте прокладки из сукна. Возникновение электрического тока в нем сопровождается химическими превращениями на электродах. Так как электродный потенциал цинка [c.81]
Естественно, что и до этого времени был получен целый ряд выдающихся результатов, на базе которых развивались те или иные разделы физической химии. Можно перечислить некоторые из них открытие адсорбции газов (К. Шееле — в Швеции, 1773 г., Ф. Фонтана — во Франции, 1777 г.), адсорбции из растворов (Т. Е. Ловиц — в России, 1785 г.) открытие каталитических реакций и установление представлений о катализе (Г. Дэви и Л. Тенар — в Англии, И. Берцелиус — в Швеции, начало XIX в.) открытие гальванических элементов и исследование переноса тока в электролитах, открытие электролиза (Л. Гальвани, А. Вольта — в Италии, В. В. Петров, К. Грот-гус — в России, Г. Дэви, М. Фарадей — в Англии, конец XVIII в. — начало XIX в.) исследование теплоты химических реакций (А. Лавуазье, П. Лаплас — во Франции, 1779—1784 гг., Г. Гесс — в России, 1836—1840 гг.) открытие первого и второго законов термодинамики (С. Карно — во Франции, Р. Майер, Г. Гельмгольц, Р. Клаузиус — в Германии, Дж. Джоуль, В. Томсон— в Англии, середина XIX в.) и последующее развитие тер-модинамического учения о химическом равновесии (К. Гуль-берг и П. Вааге —в Норвегии, Гиббс —в США). [c.7]
Вольта установил (1800), что на границе соприкосновения двух металлов возникает разность потенциалов она получила название контактной разности потенциалов. До недавнего времени контактная разность потенциалов между металлами считалась очень малой и при рассмотрении гальванических элементов обычно не учитывалась. Однако развитие методов эксперимента привело к получению новых данных, показавших, что она отнюдь не так мала и может достигать нескольких волы. [c.414]
Возникновение электрохимии как науки связано с именами Гальвани, Вольта и Петрова, которые на рубеже XVHI и XIX веков открыли и исследовали электрохимические (гальванические) элементы. Деви и Фарадей в первые десятилетия XIX века изучали электролиз. Быстрое развитие электрохимии в конце XIX века связано с появлением теории электролитической диссоциации Аррениуса (1887) и с работами Нернста по термодинамике электродных процессов. Теория Аррениуса развита Дебаем и Гюккелем (1923), которые разработали электростатическую теорию. [c.384]
Второй вопрос, возникший при создании вольтова столба, — это вопрос о причинах возникновения электрического тока и источнике электрической энергии. Согласно представлениям А. Вольта, электрическая энергия в гальваническом элементе возникает в результате контакта двух различных металлов (так называемая контактная теория э. д. с.). Основанием этой теории послужило следующее явление. Если два различных металла привести в соприкосновение, а затем раздвинуть, то при помощи электроскопа можно обнаружить, что один металл приобрел положительный, а другой — отрицательный заряд. Ряд металлов, в котором каждый предшествующий металл заряжается положительно после контакта с последующим (ряд Вольта), оказался до некоторой степени аналогичным ряду напряжений. Отсюда А. Вольта сделал вывод, что э. д. с. гальванического элемента обусловлена только контактной разностью потенциалов. Однако теория Вольта не объясняла полностью явлений возникновения электрической энергии при работе гальванического элемента, так как даже при длительном протекании тока граница соприкосновения двух металлов не изменялась. А. Вольта считал, что гальванические элементы представляют собой вечные двигатели.. Экспериментальная проверка не подтвердила этого предположения, и после установления закона сохранения энергии для объяснения э. д. с. гальванических элементов была выдвинута химическая теория, согласно которой источником электрической энергии является энергия химической реакции, протекающей в гальваническом элементе. [c.10]
Ранее считали, что ЭДС гальванического элемента содержит лишь электродные скачки потенциалов 1 3 и г зз (химическая теория происхождения ЭДС гальванического элемента Нернста и Оствальда) или только контактную разность потенциалов г1 12 (физическая теория Вольта и Ленгмюра). Уравнение (12.2), впервые полученное А. Н. Фрумкиным, показывает, что ЭДС складывается из трех частей. [c.233]
В 1792 году А. Вольта разработал первую гальваническую батарею (Вольтов столб) и показал, что для отвода тока может быть использован древесный уголь. Его практическое применение относится к 1830 году. В 1800 году X. Дэви и в 1802 году В. В. Петров между двумя электродами из древесного угля получили электрическую дугу с электропитанием от батареи, разработанной А. Вольта. В 1841 году Р. Бунзен применил в гальванических элементах токоотвоцы (элементные угли) из натурального графита и ретортного угля. В своей работе [В-1], опубликованной в 1842 году, он дал описание технологической схемы получения токоотводов, состоящей из прокаливания порошковых материалов, их измельчения, рассева, смешения с каменноугольной смолой, обжига в ретортах в засыпке из углеродных порошков, пропитки смолой, обжига, механической обработки и последующей пропитки смолами для предотвращения вытекания электролита. В дальнейшем (1877 г.) эта технология была описана Ф. Карре [В-2]. [c.10]
Анализ основан на зависимости вольт-амперной характеристики гальванического элемента (электрохимической ячейки) от концентрации определяемого компонента в газовой смеси, находящейся в динамическом равновесии с электрохимической системой ячейки и определяющей значение окислительно-восстановн-тельного потенциала раствора электролита и течение электродных процессов. На этой зависимости базируются две группы методов определения концентрации компонентов смесей газов и паров 1) с приложением внешнего поляризующего напряжения к электродам ячейки и 2) без него (с внутренним электролизом). [c.612]
Своим возникновением и развитием электрохимия обязана таким ученым, как Гальвани, Вольта, Петров, Дэви, Фарадей. Галь-вани и Вольта открыли и исследовали гальванические элементы. Петров проводил опыты по электролизу воды и растворов солей, используя вольтов столб из 4200 медных и цинковых пластинок. Дэви пропускал электрический ток через кусок едкой щелочи, смоченной водой, и у отрицательного электрода обнаружил шарик щелочного металла. Основные законы электролиза установил Фарадей. [c.360]
Основы электрохимии были заломсены исследованиями по гальваническим элементам, электролизу и переносу тока в электролитах. Гальвани и Вольта в Италии создали в 1799 г. гальванический элемент. В. В. Петров в России (1802) открыл явление электрической дуги. Т. Гротгус в России в 1805 г. заложил основы теории электролиза. В 1800 г. Дэви выдвинул электрохимическую теорию взаимодействия веществ он широко применил электролиз для химических исследований. М. Фарадей, ученик Дэви, в 1833—1834 гг. сформулировал количественные законы электролиза. Б. С. Якоби в России, решая вопросы практического использования процесса электролиза, открыл в 1836 г. гальванопластику. [c.7]
Если металлы погружены не в нулевые растворы, то на границах электродов с раствором возникают, кроме того, ионные двойные электрические слои. Таким образом, измеряемая э.д.с. гальванического элемента с двумя электродами и без диффузионных потенциалов между жидкими растворами складывается из контактного (вольта) потенциала металлов в воде как изоляторе и разностей потенциалов в ионных двойных слоях ф1 и ф2, возникающих в результате обмена ионами между металлами и раствором [c.536]
Для решения проблемы Вольта, т. е. вопроса о соотношении между контактными потенциалами и э. д. с. гальванических элементов, акад. А. Н. Фрумкин поставил задачу выяснения роли двойных слоев в создании э. д. с. Очевидно, что если выбрать такие концентрации электролитов, при которых не будет перехода ионов металла в раствор или в обратном направлении, то э. д. с. должна быть близка к контактной разности потенциалов. Такая концентрация электролита, при которой на электроде отсутствует заряд, обусловленный переходом ионов, носит название нулевой концентрации. Потенциал электрода, находящегося в растворе такой концентрации, называется нулевой точкой данного металла или потенциалом нулевого заряда. Существование контактной разности потенциалов вовсе не означает неправильность уравнения (IX.8), полученного из представлений, развивавшихся Нернстом. [c.191]
В 1792—1800 гг. итальянский физик А. Вольта обнаружил появление электрического тока при погружении в раствор двух различных металлов, соединенных проводником. Эта система явилась прообразом современных гальванических элементов. [c.35]
Возникновение электрохимии связано с именем итальянского врача Луиджи Гальвани, который в 1790 г., изучая биологический объект (препарированную лягушку), случайно соорудил устройство, получившее в дальнейшем название гальванический элемент , состоявший из мышц лягушки и двух разных металлов. В 1799 г. итальянский физик А. Вольта сконструировал первый химический источник электрической энергии — батарею гальванических элементов из медных и цинковых дисков, разделенных суконными прокладками, смоченными кислотой. Такая батарея получила название вольтов столб . Благодаря изобретению А. Вольта химики получили удобный источник электрической энергии. В 1801 г. выдающийся русский физик В. В. Петров создал батарею большой мощности, с помощью которой впервые выделил ряд металлов (свинец, олово, ртуть). [c.312]
Второй вопрос, возникший при создании вольтова столба,— это вопрос о причинах возникновения электрического тока и источнике электрической энергии. Согласно представлениям Вольта электрическая энергия в гальваническом элементе возникает в результате контакта двух различных металлов (так называемая контактная теория [c.8]
Легко видеть, что схема измерения вольта-потенциала, когда между двумя пластинками из металлов обеспечена проводимость, а э. д. с. измеряется каким-либо прибором, подобна схеме измерения э. д. с. в гальваническом элементе. Эта аналогия станет еще большей, если представить, что два куска металла опущены в диэлектрик и в диэлектрике измерен потенциал одного металла против другого. [c.384]
Уравнения (Х.2.6) и (Х.2.7) позволяют вычислять ЭДС гальванического элемента по данным о константе равновесия и концентрациям всех участников реакции. Эти же уравнения позволяют вычислять константу равновесия по измеренной величине ЭДС. Величину Е выражают в вольтах или милливольтах. [c.317]
Любой гальванический элемент принципиально может быть источником постоянного тока. Но лишь немногие из них удовлетворяют требованиям, делающим возможным их техническое использование. В свое время широко применялись и сыграли большую роль в электрохимии элементы Вольта и Даниэля — Якоби. [c.220]
Поток электронов во внешней цепи при работе гальванического элемента направлен от отрицательного электрода к положительному (внизу указаны электродные потенциалы в вольтах) [c.132]
Рассмотренный гальванический элемент состоит из двух полу-элементов. На схеме полуэлементы отделены друг от друга двумя вертикальными линиями, окисленная и восстановленная формы в каждом из полуэлементов разделены одной вертикальной линией. При 25°С и концентрациях окисленной и восстановленной форм 1 моль/дм результатом измерения является стандартный окислительно-восстановительный потенциал Е°, который выражают в вольтах или милливольтах. [c.74]
Цинк в паре с медью образует гальванический элемент, э. д. с. которого в стандартных условиях немногим больше вольта, если же медь заменить серебром, то э. д.с. составит около полутора вольт. Электродвижущая сила элемента, составленного из магниевого и серебряного электродов, в этих условиях должна давать э. д. с. порядка 3 в. [c.84]
После изобретения первого гальванического элемента Вольта более полувека элементы оставались единственным источником получения электрического тока В их развитии можно отметить следующие основные этапы применение в 1833 г деполяризаторов, что позволило сделать напряжение элементов более устойчи йым, использование в 1836 г. нейтрального электролита, повысившее сохран ность источников тока, разработка в 1865 г. элементов с твердым деполяризато ром, что обеспечило увеличение коэффициента полезного действия элемента, изо бретение в 1888 г. сухих элементов и, наконец, применение а 1914 г. в качестве деполяризатора кислорода воздуха. [c.13]
Количество электрической работы, приходящееся на единицу заряда, затраченное на передвижение бесконечно малого положительного заряда из одной точки в другую, определяется разностью электрических потенциалов между этими двумя точками. Если заряд выразить в кулонах, электрическую работу в джоулях, то разность потенциалов выразится в вольтах. Знак э. д. с. гальванического элемента положителен, если правый электрод его — положительный полюс, например в гальваническом элементе, соответствующем схеме 2п” 2п ЦСи Си . Э. д. с. по величине и знаку равна электродному потенциалу правого электрода. Реакция, происходящая в элементе, записывается по направлению перехода положительных зарядов слева направо внутри элемента, например [c.107]
Большой интерес представляет также возникновение элемен-гои, образованных из двух одинаковых электродов, погруженных в растворы одного и того же электролита, одной и той же концентрации и при одной и той же температуре, но один из которых находится в покое, а другой — в движении. Величии ) э. д. с и03 икающих при этом гальванических элементов достнга От сотых доле вольта. Знак электродов в этом случае завис1 т от лри]Я)ди электролита 1 металла, [c.29]
К началу нащего столетия природа электродвижущей силы гальванического элемента рассматривалась с двух точек зрения. Согласно первой, контактной теории Вольта, источником э. д. с. считали контакт между двумя металлами. По второй, химической, теории скачок потенциала целиком связывали с явлениями, протекающими на границе между металлом и раствором. По этой теории, при отсутствии иоппого двойного слоя на поверхно- [c.10]
В некомпенсационном методе применяют измерительные приборы, имеющие очень высокое электрическое сопротивление. Для этой цели пригодны электронные лампы, сопротивление между сеткой и катодом которых огромно (порядка 10 Ом). Если между сеткой и катодом подключить гальванический элемент, сила тока в цепи ничтожна (порядка 10 — 10 А). Это значит, что электрохимические равновесия практически не нарушаются. В то же время анодный ток электронной лампы пропорционален ЭДС гальванического элемента. В случае необходимости этот ток можно еще усилить и потом измерить. Шкалу измерительного прибора при этом не обязательно градуировать в вольтах, — можно также пользоваться единицами pH, рМе и т.п., которые пропорциональны ЭДС гальванического элемента. [c.269]
Современные аккумуляторы родились из исследований многих экспериментаторов, работавших в области электрохимии на заре ее развития. Началом научной линии развития электрохимии явилось изобретение Вольтой гальванического элемента. Двумя годами позднее Госеро открыл явление поляризации платиновой проволоки, вызванное прохождением электрического тока через сосуд, [c.3]
Когда два металла с разной электроотрицательиостью объединяются в ячейку, между ними возникает электрический потенциал. Этот потенциал (измеряемый в вольтах) подобен давлению воды в трубке. Он и есть тот насос , который толкает электроны по проволоке, соединяющей металлы. Чем больше разница в активности металлов, тем больше давление электронов, или электрический потенциал, ячейки. Для создания электрической проводимости внутри ячейки, т. е. для обеспечения переноса электронов, покидающих проволоку или внешний контур, гальванический элемент приготавливают внесением каждого металла в раствор своей соли. [c.527]
Можно представить себе, что у гальванического элемента существует движущая сила (или электрическое давление ), которая перемещает электроны по- внещней цепи элемента. Эта движущая сила называется электродвижущей силой (сокращенно э.д.с.) элемента э.д.с. измеряется в единицах электрического напряжения (вольтах) и иначе называется напряжением, или потенциалом, гальванического элемента. Один вольт представляет собой э.д.с., необходимую для того, чтобы заряд в 1 кулон приобрел энфгию в 1 Дж [c.207]
Гальванический элемент можно рассматривать как источник движущей силы , перемещающей электроны по внещней цепи от анода к катоду. Эта движущая сила называется электродвижущей силой (э.д.с.) и измеряется в вольтах (В). Э.д.с. гальванического элемента можно мысленно разделить на две части одну, обусловленную окислением на аноде, а другую – восстановлением на катоде элемента =-Еокисл + [c.234]
Учение об электродвижущих силах гальванических элементов является одним из основных разделов электрохимии. Начало изучению электродвижущих сил положено опытами Гальвани (1780). Вольта (1800) изобрел первый химический источник тока, так азываемый вольтов столб, который [c.250]
За единицу количества электричества обычно принимается кулон (к), равный 6,25 10 заряда электрона. При силе тока в один ампер (а) по проводу за секунду проходит один кулон (т. е. 1 а = 1 к/сек, или 1 к = 1 а-сек). Единицей мощности является ватт (вт), определяемый как джоуль в секунду (вт = = 1 дж1сек). Мощность электрического тока равна напряжению этого тока в вольтах (а), помноженному на его силу, т. е. 1 в 1 а = 1 ет. Показанный на рис. У-29 гальванический элемент дает напряжение около 1,1 в, а в осветительной сети оно обычно составляет 127 или 220 в. Следует отметить, что в электротехнике принято указывать движение тока от плюса к минусу (т. е. обратно действительному перемещению электронов). Это сохранилось от тех времен, когда природа электрического тока еще не была известна. [c.208]
Исследовательская работа по физике “Гальванический элемент”
Муниципальное бюджетное образовательное учреждение
«Иракиндинская средняя общеобразовательная школа»
Гальванический элемент
Секция: математика, физика, информационные технологии
Работу выполнил: Муратов Александр, 9 класс
Руководитель: Булкина Елена Ивановна –
учитель физики и математики
2018 г.
Гальванический элемент
Описание работы
Чтобы познать истину, надо
это сделать самому.
Любой гальванический элемент состоит из двух электродов различной природы, помещенных в электролит. Электродами являются электронные проводники, электрически связанные с одним из выходов (полюсов) элемента и контактирующие с электролитом. На границе раздела между электродом и электролитом протекают окислительно-восстановительные электрохимические реакции, приводящие к пространственному разделению положительных и отрицательных зарядов.
Меня заинтересовал опыт, показанный учителем на уроке, и я решил исследовать источники тока, созданные разными фруктами, овощами и разнородными проводниками.
Актуальность: практически все устройства, называемые мобильными на самом деле очень зависят от розетки и особенно это важно в многодневных туристических походах.
Цели исследования:
1. Экспериментально получить гальванический элемент из различных материалов в лабораторных условиях.
2. Изучить историю открытия гальванического элемента и этапы его усовершенствования.
Задачи теоретические:
Определить, что собой представляет гальванический элемент.
Изучить историю открытия гальванических элементов их развитие и усовершенствование.
Задачи исследовательские:
1
Провести опыты с различными кислыми средами в фруктах и овощах по определению наличия и величины электрического напряжения.
Какие источники можно использовать в быту?
Объект исследования: гальванический элемент.
Предмет исследования: фрукты и овощи, соль как среда для создания источника тока.
Методы исследования:
Теоретические – изучение литературы и информации Интернет.
Практические – проведение экспериментов.
Предполагаемый результат: расширить и обобщить знания о простейшем гальваническом элементе, истории его открытия.
Введение
Для проведения исследований была выбрана эта тема, потому что в современном мире гальванический элемент применяется буквально во всех сферах нашей жизни, и занял прочное место среди необходимых нам предметов. Бытовое применение гальванического элемента (батарейки): настенные и наручные часы, фотоаппарат, электробритва, фонарик, транзистор, плейер, пульты управления, разнообразные игрушки и т. д.
Ход исследования
Из дополнительной литературы по физике, из периодической печати и интернета мы узнали об истории создания гальванического элемента, о необходимых условиях возникновения электрического тока в таком устройстве.
По описаниям занимательных опытов мы поставили эксперименты с соленой водой, лимоном, апельсином, мандарином, яблоком, картофелем и луком, грунтом политым солёной водой. В качестве электродов мы брали железный гвоздь и медный электрод из набора, универсальный прибор для определения
2
электрического напряжения. (Приложение 1)
Было проделано несколько опытов.
1 опыт: Лимон, электроды (гвоздь, медный электрод). Напряжение 0,937В. (Приложение 2)
2 опыт: Лимон, электроды (гвоздь, медный электрод). Зависимость напряжения от времени.
Так же выяснили, чем больше площадь погружения электродов в кислую среду, тем больше напряжение и чем больше расстояние между электродами в пределах лимона, тем больше напряжение.
3 опыт: апельсин, электроды (гвоздь, медный электрод). Напряжение 1,047В.
(Приложение 3)
4 опыт: мандарин, электроды (гвоздь, медный электрод). Напряжение 1,047В. (Приложение 4)
5 опыт: яблоко, электроды (гвоздь, медный электрод). Напряжение 0,928В.
(Приложение 5)
6 опыт: лук репчатый, электроды (гвоздь, медный электрод). Напряжение 0,863В. (Приложение 6)
7 опыт: картофель, электроды (гвоздь, медный электрод). Напряжение 0,518В. (Приложение 7)
8 опыт: солёная вода, электроды (гвоздь, медный электрод). Напряжение 0,165В. (Приложение 8), грунт, политый солёной водой, электроды (гвозди, куски медной проволоки). Напряжение 0,934В.
В ходе исследования мы нашли описание истории открытия гальванического элемента. Гальванический элемент – это источник электрической энергии,
3
принцип действия, которого основан на химических реакциях. Большинство современных батареек и аккумуляторов подпадает под это определение и относится к рассматриваемой категории. Физически гальванический элемент состоит из проводящих электродов, погруженных в одну или две жидкости (электролиты). В походных условиях такой источник энергии можно также получить полив землю (грунт) солёной водой и воткнуть гвозди и медные провода. Соединив такие источники последовательно можно получить нужную величину напряжения, например, для работы мобильного телефона.
История открытия гальванического элемента
Опыты итальянского анатома Луиджи Гальвани (Приложение 9) способствовали созданию первого источника тока. Работая в лаборатории, где проводились опыты с электричеством, Гальвани наблюдал явление, которое было известно многим еще до него. Оно заключалось в том, что если через нерв лягушачьей ножки, соединённой проволочкой с землей, разряжать кондуктор электрической машины, то наблюдались судорожные сокращения её мышц. Но однажды Гальвани заметил, что лапка пришла в движение, когда с ее нервом соприкасался только стальной скальпель. Удивительнее всего было то, что между электрической машиной и скальпелем не было никакого контакта. Это поразительное открытие заставило Гальвани поставить ряд опытов для обнаружения причины наблюдаемого явления. В один из осенних дней 1780 года Гальвани провел эксперимент с целью выяснить, вызывает ли такие же движения в лапке электричество молнии. Для этого Гальвани подвесил на латунных крючках несколько лягушачьих лапок в окне, закрытом железной решеткой. И он обнаружил в противоположность своим ожиданиям, что сокращения лапок происходят в любое время, вне всякой зависимости от состояния погоды. Присутствие рядом электрической машины или другого источника электричества оказалось ненужным. Гальвани установил далее, что вместо железа и латуни можно использовать любые два разнородных металла, причем комбинация
4
меди и цинка вызывала явление в наиболее отчетливом виде. К сожалению,
Гальвани пришел к заключению, что в тканях тела лягушки заключается «животное электричество». Поэтому при соединении проводниками (медь, железо) нерва с мускулами происходит разряд. В результате его современникам понятие «животного электричества» стало казаться гораздо более реальным, чем электричество какого-либо другого происхождения. Обнаружение электрического тока все еще оставалось тайной. Свою теорию Гальвани подтверждал ссылкой на известные случаи разрядов, которые способны производить некоторые живые существа, например, «электрические рыбы». Тем не менее, сделанное им открытие навсегда сохранило в науке его имя – до сих пор в названиях многих приборов и процессов используется термин гальванический.
Велика заслуга соотечественника Гальвани – итальянского физика Алессандро Вольта (Приложение 10), увидевшего в открытии Гальвани совершенно новое явление – создание потока электрических зарядов (по терминологии Вольта, электрических флюидов). Вольта утверждал, что никакого «животного» электричества не существует. Роль источника электричества в опытах Гальвани выполняет контакт двух разнородных металлов. Чтобы исключить физиологический объект, Вольта заменяет лапку лягушки электрометром и отмечает, что «всё действие возникает первоначально вследствие прикосновения металлов к какому-либо влажному телу или самой воде. При установлении непрерывного сообщения между соответствующими проводниками этот флюид совершает постоянный круговорот». Из этих слов видно, что Вольта правильно понял механизм разделения электрических зарядов, основанный на растворении металлов и переходе в электролит их ионов. Более того, Вольта заметил, что движение зарядов тем сильнее, «чем дальше отстоят друг от друга примененные два металла в том ряду, в каком они поставлены здесь: цинк, оловянная фольга, свинец, железо, латунь и бронза, медь, платина, золото, серебро, ртуть, графит». 5
«Вольтов столб». (Приложение 11) Вольта брал две монеты – обязательно из разных металлов и клал их себе в рот – одну на язык, другую – под язык. Если после этого Вольта соединял монеты проволочкой, он чувствовал солоноватый вкус. Наконец в конце 1799 г. Вольта описывает так «я взял несколько дюжин круглых медных пластинок, а еще лучше, серебряных, диаметром примерно в один дюйм, и такое же количество оловянных или лучше цинковых пластинок. Затем из пористого материала, который может впитывать и удерживать много влаги, я вырезал достаточное число кружков. Все эти пластинки я расположил таким образом, что металлы накладывались друг на друга всегда в одном и том же порядке и что каждая пара пластинок отделялась от следующей влажным кружком из картона». 20 марта 1800 года он представил Лондонскому королевскому обществу. Вот с этого дня Вольтов столб и батарея – стали известны многим физикам и нашли широкое применение.
В 1802 году академик из России Петров собрал батарею — «Вольтов столб» из 2,1 тыс. элементов, которая обеспечивала электрическую дугу.
В дальнейшем, в 1836 году, химик Дж. Дэниель английского происхождения модернизировал элемент Вольта за счет того, что поместил электроды из цинка и меди в раствор из серной кислоты.
Б.С.Якоби – русский физик в 1836 году использовал сосуд с пористой перегородкой. В одном медный электрод находился в растворе медного купороса, в другом цинковый – в растворе сульфата цинка. Элемент Даниеля-
Якоби давал постоянное напряжение – почти ровно один вольт. Затем в 1859 году во Франции исследователь физических явлений Гастон Планте изобрёл другой тип аккумулятора — свинцово-кислотный. Он до сих пор используется в автомобильных аккумуляторах. Но уже в 1865 году Ж. Лекланше изобрел свой гальванический элемент, который назвали элемент Лекланше. Он состоял из цинкового стакана, который был заполнен раствором водного хлористого аммония или другой соли хлора.
6
Заключение
Таким образом, изучив физическую литературу и информацию из Интернета об открытии гальванического элемента, проделав опыты по созданию гальванических элементов из разных фруктов и овощей, можно сделать выводы: существует довольно простой способ получить электрический ток достаточный для работы простейших маломощных устройств; в качестве электродов можно использовать любые медные (латунные, свинцовые) и железные (цинковые) отрезки проволоки, воду, соль и грунт, а если есть картофель или лук или другой источник фруктовых или ягодных кислот, то изготовить источник тока совсем просто. Из проделанных опытов мы видим следующую сравнительную таблицу.
Выяснили, чем больше площадь погружения электродов в кислую среду, тем больше напряжение и чем больше расстояние между электродами, тем больше напряжение.
В каких-то непредвиденных обстоятельствах знания о том, что можно создать такой источник электрической энергии, например, для подзарядки простейшего низковольтного устройства очень пригодятся.
7
Литература
ДыбинаО.В. Неизведанное рядом: занимательные опыты и эксперименты для школьников –М., 2005. (192)
Сеницкий В.П. Самодельные гальванические элементы – Госэнергоиздат., 1950. (65)
Перельман Я.И. Занимательные задачи и опыты. – Екатеринбург, 1995. (641)
Ресурсы Интернета.
8
Приложение 1
Приложение 2 Приложение3
9
Приложение 4 Приложение 5
Приложение 6 Приложение 7
10
Приложение 8
Приложение 9
Луиджи Гальвани (1737 – 1798) – итальянский врач, физиолог и анатом, один из основателей электрофизиологии. Образование получил в Болонском университете, там же преподавал медицину.
11
Приложение 10
Алессандро Вольта (1745–1827) – итальянский физик и физиолог, один из основоположников учения об электричестве. Установил связь между количеством электричества, емкостью и напряжением, изобрел первый химический источник тока на медно-цинковой паре («вольтов столб», или «батарея Вольта»). В апреле 1800 г. в Париже Вольта был принят Первым консулом Франции – Наполеоном. Наполеон интересовался науками, справедливо полагая, что сила государства в новом веке немыслима без процветания просвещения. Продемонстрировав восхищенному Наполеону свои опыты, Вольта стал рыцарем Почетного легиона, получил звание сенатора и графа.
Приложение 11 Приложение 12
«Вольтов столб»Гальванические элементы Лекланше и Даниэля
12
История аккумулятора
Открытие аккумулирующего эффекта относится к числу важнейших и значительнейших изобретений в области электротехники.
Еще в 1800 году Алесандро Вольта (Alessandro Giuseppe Antonio Anastasio Volta) (1745–1827) – итальянский физик и физиолог, один из основоположников учения об электричестве поместил пластины из цинка и меди в кислоту, чтобы получить непрерывный электрический ток. Вольта назвал свое изобретение «электрический орган». Это был первый химический источник тока на медно-цинковой паре электродов («вольтов столб» или «батарея Вольта»). В 1802 г. немецкий физик Джоан Вильгельм Риттер (Johann Wilhelm Ritter) (1776–1810) изобрел сухой гальванический элемент, а в 1803 электрическую аккумуляторную батарею.
В 1854 году немецкий военный врач Вильгельм Зинстеден наблюдал следующий эффект: при пропускании тока через свинцовые электроды, погруженные в разведенную серную кислоту, положительный электрод покрывался двуокисью свинца PbO2, в то время как отрицательный электрод не подвергался никаким изменениям. Если такой элемент замыкали потом накоротко, прекратив пропускание через него тока от постоянного источника, то в нем появлялся постоянный ток, который обнаруживался до тех пор, пока вся двуокись свинца не растворялась в кислоте. Таким образом, Зинстеден вплотную приблизился к созданию аккумулятора, однако он не сделал никаких практических выводов из своего наблюдения.
Только пять лет спустя, в 1859 году, французский инженер Гастон Планте случайно сделал то же самое открытие и построил первый в истории свинцовый аккумулятор. Этим было положено начало аккумуляторной техники.
Аккумулятор Планте состоял из двух одинаковых свинцовых пластин, навитых на деревянный цилиндр. Друг от друга они отделялись тканевой прокладкой. Устроенный таким образом прибор помещали в сосуд с подкисленной водой и соединяли с электрической батареей. Спустя несколько часов, отключив батарею, можно было снимать с аккумулятора достаточно сильный ток, который сохранял в течение некоторого времени свое постоянное значение.
Существенным недостатком аккумулятора Планте была его небольшая емкость – он слишком быстро разряжался. Вскоре Планте заметил, что емкость можно увеличить специальной подготовкой поверхности свинцовых пластин, которые должны быть по возможности более пористыми. Чтобы добиться этого, Планте разряжал заряженный аккумулятор, а затем опять пропускал через него ток, но в противоположном направлении. Этот процесс формовки пластин повторялся многократно в течение приблизительно 500 часов и имел целью увеличить на обоих пластинках слой окиси свинца.
До тех пор, пока не была изобретена динамо-машина, аккумуляторы представляли для электротехников мало интереса, но когда появилась возможность легко и быстро заряжать их с помощью генератора, аккумуляторы получили широчайшее распространение.
В 1882 году Камилл Фор значительно усовершенствовал технику изготовления аккумуляторных пластин. В аккумуляторе Фора формирование пластин происходило гораздо быстрее. Суть усовершенствования Фора заключалась в том, что он придумал покрывать каждую пластинку суриком или другим окислом свинца. При заряжении слой этого вещества на одной из пластин превращался в перекись, тогда как на другой пластинке вследствие реакции получалась низкая степень окисла. Во время этих процессов на обеих пластинах образовывался слой окислов с пористым строением, что способствовало скоплению выделяющихся газов на электродах.
В начале XX века усовершенствованием аккумулятора занялся Томас Эдисон, который хотел сделать его более приспособленным для нужд транспорта. В результате были созданы железно-никелевые аккумуляторы с электролитом в виде едкого калия. В 1903 году начинается производство новых портативных аккумуляторов, которые получили широкое распространение в транспорте, на электростанциях и в небольших судах.
Сначала корпуса аккумуляторов были деревянными, потом эбонитовыми. Аккумуляторные батареи формировались из нескольких элементов, каждый из которых имел рабочее напряжение около 2,2 вольт. Для шестивольтовых аккумуляторов в одном корпусе последовательно соединялись три элемента, для 12-вольтовых – шесть, для 24-вольтовых – двенадцать.
Для легковых автомобилей 6-вольтовая электросистема была общепринятой почти полвека, и только в 50-х годах произошел массовый переход на 12 вольт. Эбонитовые корпуса батарей с торчащими наружу или залитыми мастикой перемычками между элементами постепенно уступили место более легким и прочным полипропиленовым. Пионером в применении синтетических материалов для корпусов аккумуляторов выступила в 1941 году австрийская фирма Baren, а полипропилен начала использовать американская фирма Johnson Controls в середине 60-х. Произошли в конструкции свинцово-кислотных аккумуляторов и другие изменения, повлиявшие на их параметры и срок службы.
Открытое занятие «Гальванический элемент»
«Электричество в руках химика – это мощное средство тончайшего и направленного воздействия на вещество»
I. Объявление темы урока
Перед вами весьма несложный прибор. Я опускаю
его в раствор поваренной соли и происходит
чудо – лампочка горит.
Вопрос: почему горит лампочка? (Т.к.
есть электрический ток)
Вопрос: основное условие горения
лампочки? (Наличие электрического тока)
Вопрос: откуда электрический ток в
растворе? (Наличие ионов натрия и хлора)
Электрический ток – направленное движение
заряженных частиц.
Вопрос: начиная с этого занятия, мы с
вами, что будем изучать? (Связь химии и
электричества)
Вопрос: каким одним понятием можно
объединить химию и электричество? (Электрохимия)
Электрохимия изучает свойства систем,
содержащих подвижные ионы (растворов, расплавов,
твердых электролитов), и явления, возникающие на
границе раздела фаз вследствие переноса
заряженных частиц.
| ЗНАЮ | ХОЧУ ЗНАТЬ | УЗНАЛ |
(таблица на доске).
При заполнении таблицы необходимо выйти на тему занятия «Гальванический элемент»
II. Сообщение целей и задач (формулируют сами обучающиеся)
Цель занятия – изучить принцип действия гальванического элемента.
Задачи:
– познакомиться с краткой историей создания
ГЭ;
– изучить устройство и химические реакции,
лежащие в основе работы ГЭ;
– научиться составлять схему ГЭ.
Обучающиеся также планируют способы достижения
намеченной цели.
III. Практическая деятельность учащихся
Для дальнейшей работы формируются две команды, распределяются роли в команде, выбирается капитан(модератор).
1. Работа с текстом (с литературой)
Историческая справка
При раскопках парфянского поселения,
существовавшего в Месопотамии 2200 лет назад, была
обнаружена древняя «батарея». С технической
точки зрения она представляет собой
электрохимический источник тока типа
гальванического элемента одноразового действия
и состоит из железного стержня и медного листа,
свернутого в цилиндр вокруг этого стержня; оба
они помещены в керамический горшок из-под
виноградного сока. По-видимому, это устройство
выполняло роль таинственного источника энергии
в процессе нанесения гальванических покрытий из
золота или серебра на поверхность металлических
предметов.
Первый химический источник тока был изобретён
итальянским учёным Алессандро Вольта в
1800 году. Это был элемент Вольта — сосуд
с солёной водой с опущенными в него цинковой и
медной пластинками, соединенными проволокой. В 1836
году английский химик Джон Дэниель
усовершенствовал элемент Вольта, поместив
цинковый и медный электроды в раствор серной
кислоты. Эта конструкция стала называться «элементом
Даниэля». В 1859 году французский
физик Гастон Плантэ изобрёл
свинцово-кислотный аккумулятор. Этот тип
элемента и по сей день используется в
автомобильных аккумуляторах. В 1865 году
французский химик Ж. Лекланше предложил свой
гальванический элемент (элемент Лекланше),
состоявший из цинкового стаканчика,
заполненного водным раствором хлористого
аммония или другой хлористой соли, в который был
помещён агломерат из оксида марганца(IV) MnO2 с
угольным токоотводом. Модификация этой
конструкции используется до сих пор в солевых
батарейках для различных бытовых устройств. В
1890 году в Нью-Йорке Конрад Губерт, иммигрант
из России, создаёт первый карманный
электрический фонарик. А уже в 1896 году
компания National Carbon приступает к массовому
производству первых в мире сухих элементов
Лекланше «Columbia».
Задание: составьте хронологическую таблицу от открытия и до массового производства гальванических элементов.
2. Практическая работа. Изготовление гальванического элемента
Опыт 1. Погрузите железный гвоздь в раствор медного купороса. Опишите свои наблюдения. Напишите уравнение реакции. Составьте электронный баланс.
Опыт 2. В пробирку с раствором ZnSO4 поместите цинковую пластину. В пробирку с раствором CuSO4 поместите медную пластину. Пробирки соедините солевым мостиком. Пластинки с помощью проводов соедините с гальванометром. Опишите свои наблюдения. Почему стрелка гальванометра отклонилась? Запишите химические реакции, происходящие в пробирках. Отсоедините провода от гальванометра.
Рисунок 1. Гальванический элемент Даниэля.
Вы собрали простейший гальванический элемент, который носит название элемента Даниэля в честь Джона Фредерика Даниэля, который изобрел его в 1836г (рисунок 1)
3. Работа с текстом (теоретические выкладки)
Основные составляющие гальванического элемента
Гальванический элемент представляет собой замкнутую систему, состоящую из двух электродов, соединённых между собой внешней цепью – электронный проводник (металл) и внутренний цепью – ионный проводник (растворы электролита, соединённые солевым мостиком). Назван в честь Луиджи Гальвани. В этом элементе химическая энергия превращается в электрическую энергию. В основе работы любого ГЭ лежит разница в активности металлов.
Ряд активности металлов
Li ––> Rb ––> K ––> Ba ––> Sr ––> Ca ––> Na ––> Mg ––> Al ––> Mn ––> Zn ––> Cr ––> Fe ––> Cd ––> Co ––>Ni ––> Sn ––> Pb ––> H ––> Sb ––> Bi ––> Cu ––> Hg ––> Ag ––> Pd ––> Pt ––>Au
Любой гальванический элемент состоит из двух
частей: в первой части происходит полуреакция
окисления (Zn0 – 2е = Zn2+), в другой
– полуреакция восстановления (Cu2+ + 2е = Cu0).
Металлические пластины (могут быть угольные
стержни) называются электродами.
Анодом в электрохимии называется электрод, на котором протекает реакция окисления, т.е. отдача электронов.
В гальванической цепи анод заряжен отрицательно, и он посылает электроны во внешнюю цепь.
Катодом в электрохимии называется электрод, на котором протекает реакция восстановления, т.е. присоединение электронов.
В гальванической цепи катод заряжен положительно, и он получает электроны из внешней цепи.
Для гальванического элемента принята следующая форма записи (на примере элемента Даниэля): А(–) Zn | ZnSO4 || CuSO4 | Cu (+)К,
где вертикальная линия | обозначает границу раздела фаз, а двойная вертикальная линия || – солевой мостик.
Задание: напишите схему гальванического элемента для Fe/Cu электродов, погруженных в растворы солей этих металлов. По содержанию текста составьте 5-6 вопросов для другой команды. На выполнение задания – 10 минут.
4. Решение проблемы
Проблема: если поменять местами электроды, то ГЭ работать не будет. Почему?
IV. Осуществление контроля
«Перекрёстный опрос». Модераторы задают вопросы. Представитель команды отвечает.
Заполнение третьей графы таблицы «Знаю. Хочу знать. Узнал»
Вопрос: пользуемся ли мы в быту гальваническими элементами? (Батарейка)
V.Учебное действие. «Работа с текстом»
Батарейка – источник опасности
Гальванические элементы являются источниками электрической энергии одноразового действия. Реагенты (окислитель и восстановитель) входят непосредственно в состав гальванического элемента и расходуются в процессе его работы.
Рисунок 2. Устройство сухого элемента.
Устройство батарейки
Батарейка (сухой элемент, рисунок 2) состоит из
цинкового корпуса, который играет роль анода.
Другой электрод, катод, представляет собой
графитовый стержень, находящийся в середине
элемента. Этот стержень окружен
слоем оксида
марганца и угольной сажи.
В качестве электролита используется толстый
слой хлорида аммония и хлорида цинка. Рассмотрим
реакции, которые происходят в элементе.
А «–»: Zn0 – 2е = Zn2+.
К «+»: MnO2(т) + 2NH4+ + 2e– ––>
Mn2O2(т) + 2NH3(p-p) + H2O(ж)
Внимание! Одним из электродов фактически служит корпус, расходуемый в ходе реакции. Таким образом, если толщина корпуса не одинакова, то на месте самого тонкого участка со временем может образоваться отверстие, через которое будет высыпаться едкое содержимое элемента.
Задание. Назовите химически опасные соединения, которые могут быть угрозой человеку и окружающей среде в случае повреждения корпуса батарейки.
Информация к размышлению.
- При высоких концентрациях цинк – мутаген и онкоген. Вызывает заболевания костно-мышечной системы.
- Марганец действует на организм через органы дыхания. Поражает центральную нервную систему, почки, органы кровообращения и легкие.
- Аммиак — Nh4, нитрид водорода, при нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта). При соприкосновении аммиака и его растворов с кожей возникает жжение, возможен химический ожог с пузырями.
Продолжить заполнение графы «УЗНАЛ» в таблице «ЗНАЮ. ХОЧУ ЗНАТЬ. УЗНАЛ»
VI. Рефлексия
Оценочный лист. Тема «Гальванический элемент»
Критерии оценки |
Отметка (+ , –) |
|
|
|
|
|
|
|
|
|
– Спасибо за внимание!
– Жду вас на следующее занятие.
гальванических элементов | Блестящая вики по математике и науке
Первичные элементы одноразовые. Реакция в электроде необратима.
Сухой элемент – наиболее распространенный тип батарей, используемых для питания небольших бытовых устройств, таких как фонарики, радиоприемники и калькуляторы. Несмотря на свое название, эти ячейки состоят из пасты на водной основе, содержащей MnO2MnO_ {2} MnO2 и ZnZnZn. Химические реакции, используемые в сухом элементе, могут быть изменены для работы в кислых или щелочных растворах.Щелочные батареи чаще доступны в продаже.
Ртутные элементы обычно меньше по размеру и построены на основе другой химической реакции, чем сухие батареи. Эти батарейки используются в фотоаппаратах, слуховых аппаратах и подобных устройствах, для которых требуются небольшие и надежные батарейки. Батареи с ртутными элементами часто дороже, чем щелочные батареи, и, поскольку они содержат тяжелые металлы, они могут представлять опасность для окружающей среды при вскрытии или неправильной утилизации.
Общая реакция для ртутного элемента выглядит следующим образом: Zn (s) + HgO (s) → Hg (l) + ZnO (s) Zn (s) + HgO (s) \ to Hg (l) + ZnO (s) Zn (s) + HgO (s) → Hg (л) + ZnO (т)
Какова катодная полуреакция для этой ячейки?
Совет: подумайте о добавлении жидкой воды, электронов, протонов или гидроксида, чтобы сбалансировать ваши окислительно-восстановительные полуреакции.
ПОКАЖИ ОТВЕТ
Катод состоит из ионов ртути, которые приобретают электроны, образуя элементарную ртуть.{-} (водн.) HgO (s) + h3 O (l) + 2e− → Hg (l) + 2OH− (водн.)
Вторичные элементы перезаряжаемые. Реакцию в электроде можно обратить вспять, приложив к ячейке электрический потенциал. В процессе перезарядки гальванический элемент временно преобразуется в электролитический элемент. Примеры включают никель-кадмиевые батареи в перезаряжаемых электроинструментах и свинцовые аккумуляторные батареи в автомобилях.
От Вольты до Эдисона
История электрохимии: от Вольта до Фарадея
История электрохимии наполнена значительными достижениями в понимании и технологиях, которые помогли определить как промышленное производство, так и повседневную жизнь в двадцать первом веке.
Алессандро Вольта, изобретатель электрической батареи.
Первая батарея
История электрохимии начинается с Алессандро Вольта, который объявил о своем изобретении гальванической батареи, первой современной электрической батареи, в 1800 году. Эта батарея захватила воображение даже правителя Франции Наполеона Бонапарта, который дошел до служения. в качестве лаборанта Вольта в ноябре 1801 года. Когда Вольта описал свои недавние открытия, касающиеся электричества, Французскому национальному институту, восхищенный Наполеон продемонстрировал их на гальванической батарее.
ПредшественникиВольта, включая Бенджамина Франклина, изучали то, что сейчас называется статическим электричеством. Гальваническая батарея вырабатывала непрерывный ток и, таким образом, открыла две новые области исследований: химическое производство электричества и влияние электричества на химические вещества.
«Контактная» теория электричества Вольта
Volta построила гальваническую батарею, чтобы опровергнуть утверждение Луиджи Гальвани о том, что животные производят электричество. По словам Вольта, результаты Главани были получены в результате использования двух разнородных металлов, соединенных влажным проводником (лягушачьей лапой).Вольта воспроизвел эту конфигурацию в своем новом изобретении, которое состояло из пар цинковых и серебряных дисков, соединенных пропитанным рассолом картоном.
В ходе объяснения своей «контактной» теории электричества Вольта опубликовал одну из самых ранних серий электродвижущих сил, в которой металлы и другие вещества классифицировались по силе их электрического воздействия. Он разместил те материалы как можно дальше друг от друга, которые при контакте производили самые сильные эффекты. Рейтинг Вольта поразительно напоминал таблицы сродства, которые химики составляли в течение многих лет, таблицы, показывающие, какие вещества вытеснят другие в соединениях.Несколько лет спустя Хамфри Дэви в своей электрической теории химического сродства утверждал, что это сходство не было случайным.
Майкл Фарадей, считается одним из величайших ученых в истории.
Дэви линкс электричество и химия
Сэр Хамфри Дэви из Королевского института в Лондоне был одним из самых важных экспериментаторов с новой гальванической батареей. Он понял, что производство электричества гальванической батареей зависит от протекания химических реакций, а не только от различных контактов. металлов, как думал Вольта.Дэви использовал ток, подаваемый от сваи, чтобы разделить соединения на части, обнаружив несколько новых элементов. Его эксперименты привели к тому, что в 1806 году он предложил электрическую теорию химического сродства: поскольку электрический ток преодолевает нормальную силу, которая удерживает элементы вместе в соединениях, утверждал он, эта сила должна иметь электрическую природу.
Магнитоэлектричество и электролиз Фарадея
Ученик и преемник Дэви, Майкл Фарадей, исследовал связь между электричеством и магнетизмом.В ходе своих исследований он изобрел первый электродвигатель (в 1821 г.) и первую динамо-машину (в 1831 г.). Главным электрохимическим достижением Фарадея было показать, что «магнитоэлектричество» имеет те же химические эффекты, что и электричество, генерируемое другими способами. Его два закона электрохимии, опубликованные в 1834 году, предсказывают, сколько продукта образуется в результате прохождения определенного количества тока через химическое соединение или его раствор, процесс, который он назвал «электролизом». Эти законы по-прежнему имеют фундаментальное значение для промышленного электролитического производства металлов и других химикатов.
Гальванический элемент и Луиджи Гальвани
В юности в Боланьи, Италия, Луиджи Гальвани размышлял о религиозном призвании, но родители направили его изучать медицину. Он получил степень в области медицины и философии Университета Боланьи. Тогда, в 1700-х годах, медицинское образование основывалось на учениях Гиппократа, Галена и Авиценны, но Гальвани использовал более просвещенный экспериментальный подход. Случайная находка, касающаяся электрической энергии и тел животных, вызвала огромный интерес у его современников и вдохновила Алессандро Вольта на разработку первой в мире аккумуляторной батареи.
Дело в том, что Гальвани снимал шкуру с лягушки в месте, где он ранее натирал кожу лягушки с целью генерирования статического электричества. Лаборант, вооруженный металлическим скальпелем, на котором был электрический заряд, коснулся нерва ноги мертвой лягушки, и та мгновенно отреагировала сильным ударом. Неоднократные эксперименты привели Гальвани к выводу, что наблюдаемое событие было вызвано электрической жидкостью, передаваемой в мышцу по нервам.
Алессандро Вольта из соседнего Университета Падуи скопировал и подтвердил эксперименты Гальвани. Но он пришел к другому выводу о механизме. Точнее, он пришел к выводу, что наблюдаемые мышечные сокращения были вызваны не электрической энергией, исходящей от тела лягушки, а, скорее, металлической проволокой, соединяющей нервы и мышцы в экспериментах Гальвани.
Два исследователя участвовали в интенсивном публичном обсуждении результатов.Но, несмотря на их твердые убеждения, есть признаки того, что они не питали большой взаимной неприязни. Помимо биологических последствий, важно то, что Вольте удалось разработать вольтовую батарею, первую в мире аккумуляторную батарею. (Гальванический элемент – это то же самое, что и гальванический элемент. Имена названы в честь Гальвани и Вольта соответственно, хотя Гальвани не участвовал в изобретении этого устройства накопления энергии. Электрохимический элемент получает электрическую энергию от спонтанных окислительно-восстановительных реакций, происходящих внутри него.)
Вместо того, чтобы хранить заряд, как в банке Ледена, которая на самом деле была большим конденсатором, вольтовская куча представляла собой химическую батарею, которая накапливала электрическую энергию и высвобождала ее при подключении к нагрузке, при этом заключенные в ней химические вещества переходили из более высокого в более низкое энергетическое состояние. . Это устройство сделало возможным двигатель постоянного тока, предложило генератор постоянного тока и сделало электроэнергию легко доступной в последующие годы. Таким образом, Гальвани и Вольта открыли обширные области человеческих знаний и усилий, которых никто не ожидал.
Позже, отказавшись присягнуть на верность новому наполеоновскому режиму, наложенному военной силой на Папские земли, Гальвани был лишен своего академического поста. Без дохода, собственного дома и общения с женой, которая умерла преждевременно, Гальвани скончался в нищете и отчаянии в 1798 году в доме своего брата, который принял его.
ХИМИЯ: ГАЛЬВАНИЧЕСКАЯ ЯЧЕЙКА
Гальванический элемент или Гальванический элемент , названный в честь Луиджи Гальвани или Алессандро Вольта соответственно, представляет собой электрохимический элемент, который получает электрическую энергию в результате химических реакций, происходящих внутри элемента.Обычно он состоит из двух разных металлов, соединенных солевым мостиком, или отдельных полуячейек, разделенных пористой мембраной.
Вольта был изобретателем гальванической батареи, первой электрической батареи. В обычном использовании слово «батарея» стало включать в себя один гальванический элемент, но батарея должным образом состоит из нескольких элементов. [1] [2]
История
В 1780 году Луиджи Гальвани обнаружил, что когда два разных металла (например, медь и цинк) соединяются вместе, а затем оба соприкасаются с разными частями нерва лягушачьей ноги в то же время они заключили контракт ноги. [3] Он назвал это «животным электричеством». Гальваническая батарея, изобретенная Алессандро Вольта в 1800-х годах, похожа на гальванический элемент. Эти открытия проложили путь для электрических батарей.
|
Описание Схема гальванического элемента Zn-Cu
Гальванический элемент состоит из двух полуэлементов. В простейшей форме каждая полуячейка состоит из металла и раствора соли металла. Солевой раствор содержит катион металла и анион, чтобы сбалансировать заряд катиона.По сути, полуячейка содержит металл в двух степенях окисления, а химическая реакция в полуячейке представляет собой окислительно-восстановительную (окислительно-восстановительную) реакцию, обозначенную символически в направлении восстановления как
- M n + (окисленный частиц) + n e – M (восстановленные частицы)
В гальваническом элементе один металл способен восстанавливать катион другого и, наоборот, другой катион может окислять первый металл. Две полуячейки должны быть физически разделены, чтобы растворы не смешивались друг с другом.Солевой мостик или пористая пластина используются для разделения двух растворов, но при этом не позволяют разделиться соответствующим зарядам растворов, что остановило бы химические реакции.
Число электронов, переносимых в обоих направлениях, должно быть одинаковым, поэтому две полуячейки объединяются, чтобы дать электрохимическую реакцию всей клетки. Для двух металлов A и B:
- A n + + n e – A
- B m + + m e – B
- m A + n B m + n B + m A n +
Это еще не все, поскольку анионы также должны переноситься из одной половины ячейки в другую.Когда металл в одной полуячейке окисляется, анионы должны быть перенесены в эту полуячейку, чтобы сбалансировать электрический заряд производимого катиона. Анионы высвобождаются из другой полуячейки, где катион восстанавливается до металлического состояния. Таким образом, солевой мостик или пористая мембрана служат как для разделения растворов, так и для обеспечения потока анионов в направлении, противоположном потоку электронов в проводе, соединяющем электроды.
Напряжение гальванического элемента – это сумма напряжений двух полуэлементов.Он измеряется подключением вольтметра к двум электродам. Вольтметр имеет очень высокое сопротивление, поэтому ток практически ничтожен. Когда к электродам присоединяется такое устройство, как электродвигатель, протекает ток, и в обеих полуячейках происходят окислительно-восстановительные реакции. Это будет продолжаться до тех пор, пока концентрация восстанавливаемых катионов не упадет до нуля.
Для ячейки Даниэля, изображенной на рисунке, два металла – это цинк и медь, а две соли – сульфаты соответствующего металла.Цинк – это окисленный металл, поэтому, когда устройство подключено к электродам, происходит электрохимическая реакция
- Zn + Cu 2+ → Zn 2+ + Cu
Цинковый электрод растворяется, и медь осаждается на медный электрод (когда ионы меди восстанавливаются до металлической меди). По определению, катод – это электрод, на котором происходит восстановление (усиление электронов), поэтому медный электрод является катодом. cat hode притягивает ионы cat , поэтому имеет отрицательный заряд при разрядке.В этом случае катодом является медь, а анодом – цинк.
Гальванические элементы обычно используются в качестве источника электроэнергии. По своей природе они производят постоянный ток. Например, свинцово-кислотная батарея содержит несколько гальванических элементов. Два электрода – это, по сути, свинец и оксид свинца.
Элемент Вестона был принят в качестве международного стандарта напряжения в 1911 году. Анод представляет собой амальгаму кадмия и ртути, катод изготовлен из чистой ртути, электролит представляет собой (насыщенный) раствор сульфата кадмия, а деполяризатор представляет собой пасту из сульфат ртути.Когда раствор электролита насыщен, напряжение ячейки очень воспроизводимо, поэтому его используют в качестве стандарта.
Напряжение ячейки
Стандартный электрический потенциал ячейки может быть определен с помощью стандартной таблицы потенциалов для двух задействованных половинных ячеек. Первый шаг – идентифицировать два металла, вступающих в реакцию в ячейке. Затем ищется стандартный потенциал электрода E 0 в вольтах для каждой из двух половинных реакций. Стандартный потенциал ячейки равен более положительному значению E 0 минус более отрицательное значение E 0 .
Например, на рисунке выше решениями являются CuSO 4 и ZnSO 4 . В каждом растворе есть соответствующая металлическая полоска и солевой мостик или пористый диск, соединяющий два раствора и позволяющий ионам SO 4 2- свободно перемещаться между растворами меди и цинка. Чтобы вычислить стандартный потенциал, ищем полуреакции меди и цинка и находим:
- Cu 2+ + 2 e−
Cu: E 0 = +0.34 V - Zn 2+ + 2 e-
Zn: E 0 = −0,76 V
Таким образом, общая реакция:
- Cu 2+ + Zn Cu + Zn 2+
Стандартный потенциал для реакции равен +0,34 В – (-0,76 В) = 1,10 В. Полярность ячейки определяется следующим образом. Металлический цинк восстанавливает сильнее, чем металлическая медь, о чем свидетельствует тот факт, что стандартный (восстановительный) потенциал цинка более отрицательный, чем у меди.Таким образом, металлический цинк теряет электроны на ионы меди и развивает положительный электрический заряд. Константа равновесия, K , для ячейки определяется выражением
, где F – постоянная Фарадея, R – газовая постоянная и T – температура в кельвинах. Для ячейки Даниэля K примерно равно 1,5 × 10 37 . Таким образом, в состоянии равновесия переносится несколько электронов, которых достаточно, чтобы зарядить электроды. [4]
Фактические потенциалы полуэлементов должны быть рассчитаны с использованием уравнения Нернста, поскольку растворенные вещества вряд ли будут находиться в своих стандартных состояниях,
, где Q – коэффициент реакции. Это упрощается до
, где { M n + } – активность иона металла в растворе. Металлический электрод находится в стандартном состоянии, поэтому по определению имеет единичную активность.На практике вместо активности используется концентрация. Потенциал всей клетки получается путем объединения потенциалов двух полуэлементов, поэтому он зависит от концентраций обоих растворенных ионов металлов.
Значение 2,303 R / F составляет 0,19845 × 10 -3 В / К, поэтому при 25 ° C (298,15 К) потенциал полуэлемента изменится на 0,05918 В / n если концентрация иона металла увеличивается или уменьшается в 10 раз.
Эти расчеты основаны на предположении, что все химические реакции находятся в равновесии. Когда в цепи протекает ток, условия равновесия не достигаются, и потенциал ячейки обычно снижается с помощью различных механизмов, таких как развитие перенапряжения. [5] Кроме того, поскольку химические реакции происходят, когда элемент вырабатывает энергию, концентрация электролита изменяется, а напряжение элемента снижается. Следствием температурной зависимости стандартных потенциалов является то, что напряжение, создаваемое гальваническим элементом, также зависит от температуры.
Гальванический элемент – Academic Kids
От академических детей
Гальванический элемент , названный в честь Луиджи Гальвани, состоит из двух металлов, соединенных электролитом, который образует солевой мостик между металлами. Он также известен как гальванический элемент и электрохимический элемент. В 1780 году Луиджи Гальвани обнаружил, что когда два разных металла (например, медь и цинк) были соединены вместе, а затем оба одновременно касались разных частей нерва лягушачьей лапы, они заставляли ногу сокращаться.Он назвал это «животным электричеством». Вольтовская свая, изобретенная Алессандро Вольта в 1800-х годах, представляет собой аналогичную концепцию. Эти открытия проложили путь для всех электрических батарей.
Описание
Изображение отсутствуетGalvanic_cell.png
Схема гальванического элемента
Металлы гальванического элемента растворяются в электролите с разной скоростью, оставляя некоторые электроны в остальном металле, который заряжает его. Таким образом, разная скорость растворения вызывает неодинаковое количество электронов в двух металлах.Это приводит к электрическому потенциалу между двумя металлами. Если между ними образуется электрическое соединение, такое как провод или прямой контакт, электрический ток течет. В то же время ионы более активного металла, образующего анод, переносятся через электролит к менее активному металлу, катоду, и осаждаются там в виде покрытия. Таким образом, анод сгорает или подвергается коррозии. Аналогичный процесс используется при гальванике.
Происходит поток электронов от окисленного иона на аноде к восстановленному атому (ранее иону) на катоде.Именно этот поток из-за этой окислительно-восстановительной реакции и составляет ток.
Электрический потенциал гальванического элемента
Электрический потенциал ячейки можно легко определить с помощью стандартной таблицы восстановительного потенциала. Также можно использовать таблицу потенциала окисления, но таблица восстановления является более распространенной. Первый шаг – идентифицировать два металла, вступающих в реакцию в ячейке. Затем ищем E o (стандартный электродный потенциал в вольтах) для каждой из двух половинных реакций.Электрический потенциал элемента равен более положительному значению E o плюс противоположность более отрицательному значению E o . Причина, по которой вы добавляете противоположность более отрицательного значения E o , заключается в том, что эта реакция будет не реакцией восстановления, а реакцией окисления.
Например, на картинке выше решениями являются CuSO 4 и ZnSO 4 . В каждом растворе есть соответствующая металлическая полоска и солевой мостик, соединяющий два раствора и позволяющий ионам SO 4 2- свободно перемещаться между растворами меди и цинка.Чтобы рассчитать электрический потенциал, ищем полуреакции меди и цинка и обнаруживаем, что:
Cu 2+ + 2e – → Cu E = 0,34 В
Zn 2+ + 2e – → Zn E = -,76 В
Таким образом, происходящая реакция действительно
Cu 2+ + Zn + 2e – → Cu + Zn 2+ + 2e –
Тогда электрический потенциал равен 0,34 В + – (-,76 В) = 1,10 В
Самый простой способ определить напряжение, производимое элементом, – это использовать вольтметр.Более подробное объяснение причин и причин можно найти в разделе «Электродный потенциал».
Гальваническая коррозия
Нежелательные гальванические элементы образуются всякий раз, когда два металла контактируют в присутствии электролита, такого как соленая вода, что приводит к гальванической коррозии более активного металла. Есть два распространенных способа предотвратить это. Один из них – изоляция двух металлов друг от друга, например, пластиковые или фибровые шайбы используются для отделения стальных водопроводных труб от фитингов на основе меди.Другой – использование расходуемых анодов.
См. Также
Внешние ссылки
de: Galvanische_Zelle nl: Galvanische cel pl: Ogniwo galwaniczne
Электрохимия: шокирующая история – Институт развития науки
| Одной из самых эпических визуализаций в литературе должен быть момент, когда доктор Франкенштейн реанимирует мертвое тело, которое должно стать его монстром. Спустя более столетия после Мэри Шелли связь между электричеством, химией и биологией все еще увлекает нас.Некоторые из загадок с тех пор были раскрыты, другие еще предстоит. Но нам не потребуется много времени, чтобы изучить основы того, как Франкенштейн дал жизнь своему монстру … |
«Химия – это игра, в которую играют электроны».
Джозеф Дж. У. Макдуалл. Вычислительная квантовая химия (2013)
Эдисон и Тесла, держу пари, вы все слышали об этих блестящих ученых и изобретателях, известных своим вкладом в область электрохимии.Эта статья приписывается не им, а всем ученым, сыгравшим роль в развитии электрохимии, какой мы ее знаем.
Я хотел бы начать с давних времен, когда в 1786 году итальянский ученый по имени Луиджи Гальвани заметил, что у рассеченной лягушки подергивалась лапа, когда она лежала на столе рядом с электростатическим генератором. Чтобы лучше понять это явление, он больше экспериментировал. Он подвесил ногу к железным перилам с помощью медного крюка и заметил, что как в присутствии, так и в отсутствие грозы нога сокращалась, когда она касалась какой-либо другой части перил.Он построил первую батарею, даже не осознавая этого. Он пришел к выводу, что через ногу проходит какое-то электричество, которое он назвал «животным электричеством». Но в 1800 году другой итальянский ученый Алессандро Вольта доказал, что Гальвани ошибался. Он обнаружил, что движение ноги было вызвано не «животным электричеством», а разницей потенциалов между двумя разнородными (железо и латунь) металлами, связанными с тканями животных. В то же время Volta разработала первую батарею – Voltaic Pile.
Луиджи Гальвани и его лягушки | Алессандро Вольта и его вольтовская куча |
В том же году в Англии Николсон и Карлайл открыли процесс электролиза, пропуская постоянный электрический ток через воду. В этих условиях вода разлагалась на составные элементы. Это было обнаружено по образованию пузырьков кислорода и дигидрогена на электродах.Тем временем в Германии электролиз изучал Иоганн Вильгельм Риттер. Он измерил произведенное количество кислорода и водорода, что способствовало количественному анализу процесса. В 1802 году гальваническая батарея привлекла его внимание, что привело к разработке его первой электрохимической ячейки и открытию процесса гальваники. Гальваника была великим изобретением, поскольку впоследствии она была применена в массовом производстве батарей.
В начале 1800-х годов Хамфри Дэви, ученый из Лондона, сделавший себя сам, улучшил конструкцию гальванической батареи и открыл элементы K, Na, Sr, Ba, Ca и Mg.Хотя его величайшим достижением, вероятно, было знакомство его ученика Майкла Фарадея с электролизом. Фарадей считается одним из самых блестящих ученых в истории. В 1833-1836 годах Фарадей открыл законы электролиза, включая пропорциональность между массой продукта, осажденного во время электролиза, и пропускаемым током.
Электролиз Риттера обеспечивает первое прямое применение электричества в химии. | Применение Дэви электрохимии приводит к открытию новых элементов. |
Британский химик Джон Фредерик Даниэлл открыл в 1836 году элемент Даниэля, который представляет собой батарею с двумя отсеками и является основным эталонным примером электрохимической батареи во многих учебных книгах.Он попытался устранить проблему производства газообразного водорода из вольтова котла, и по этой причине он разработал электрохимическую ячейку, которая состояла из медного котла, заполненного раствором сульфата меди (II), в который он погрузил неглазурованный на землю контейнер, наполненный серной кислотой. кислота и цинковый электрод.
Шесть лет спустя в Королевском институте Лондона Уильям Роберт Гроув заложил основы первого топливного элемента. Первыми, кто увидел его изобретение, были Фарадей и его научный редактор.Гроуву удалось произвести электрическую энергию, объединив водород и кислород, открыв обратимость реакций электролиза воды. Эта ячейка оставалась неизменной до 1960-х годов по программе НАСА.
В 1859 году французский физик Гастон Планте изобрел свинцово-кислотную батарею, которая является старейшим типом аккумуляторных батарей. После некоторых улучшений он по-прежнему широко используется в настоящее время, поскольку может производить высокий уровень энергии при низких затратах. Это был первый коммерческий продукт электрохимии.В то время эти батареи использовались для питания фонарей в вагонах поездов. Благодаря своим привлекательным характеристикам они в настоящее время используются в автомобилях.
Между 1859 и 1886 годами развитие электрохимии сделало много шагов вперед. В 1886 году Шарль Мартен Холл и француз Поль Эру одновременно разработали процесс электролитического производства алюминия, который в настоящее время является основным промышленным процессом выплавки алюминия.
В последующие годы электрохимия изучалась более глубоко, и многие улучшения в понимании ее явлений были выполнены такими учеными, как Аррениус и Нерст, которые в 1889 году описали с помощью уравнения зависимость скорости реакции от температуры и разработали общая интерпретация термодинамики электрохимического процесса.Несколькими годами позже американский химик Фредерик Гарднер Коттрелл представил уравнение Коттрелла, которое регулирует связь между кинетикой электрода и массопереносом посредством диффузии, проливая свет на многие важные электрохимические процессы, такие как, например, хроноамперометрия.
Электрохимия не останавливалась и считается одной из самых быстроразвивающихся областей науки. Одна вещь, которую мы узнали из этой краткой истории, – это то, что наука должна распространяться, а изобретения должны обсуждаться, чтобы позволить развитие свежих идей и объяснений текущим результатам.Без наблюдений Гальвани, вольтовская свая, возможно, не была бы произведена, и наша повседневная жизнь была бы совершенно иной.
Какие еще области пересечения химии и физики?
Электромагнетизм – одна из четырех фундаментальных сил природы. Какую роль в химии играют три другие фундаментальные силы? Они применимы?
Обсудите хронологию электрохимии. Рассмотрим прогресс от открытия биоэлектричества до его применения в промышленности.Почему потребовалось так много времени, чтобы раскрыть потенциал такой важной технологии, которую мы сейчас используем ежедневно? Есть ли ему параллели в наше время?
– конструкция, типы, принцип работы, применение, преимущества
Вольтаическая ячейкав основном используется для производства электроэнергии посредством химических реакций. Его также называют гальваническим элементом. В этом посте мы подробно обсудим, что такое гальванический элемент или гальванический элемент, его конструкция и типы, как он работает, приложения и преимущества.
Что такое гальванический элемент или гальванический элементГальванический элемент (гальванический элемент) – это электрохимический элемент, который получает электрическую энергию от спонтанных окислительно-восстановительных реакций, происходящих в элементе. Энергия используется, отделяя реагенты от прямого контакта друг с другом, обеспечивая при этом канал для прохождения электронов через них.
Рис. 1. Введение в гальваническую ячейку
Вольтовую ячейку назвали в честь своего изобретателя, известного итальянского физика Алессандро Вольта, в 1799 году.Основываясь на феномене электрохимического изменения Луиджи Гальвани, он изобрел «Вольтовую батарею», которая представляет собой классический гальванический элемент, который был первой электрической батареей, которая могла постоянно подавать электрический ток в цепь. Ранее эти ячейки использовались для изучения термодинамических свойств плавленых солей.
Рис. 2 – (a) Гальваническая батарея (b) Алессандро Вольта
Конструкция гальванической ячейки ( гальванической ячейки)Полная гальваническая ячейка состоит из двух полуэлементов, обычно соединенных между собой полупроницаемая мембрана или солевой мостик, который предотвращает осаждение ионов более благородного металла на другом электроде.Электроды сначала погружают в растворы электролита.
Затем они подключаются через электрическую нагрузку. Это электрохимическая ячейка с двумя проводящими электродами. Электрод – это твердый электрический проводник, который подает электрический ток в неметаллические твердые тела, жидкости или газы и т. Д.
Рис. 3 – Конструкция гальванического элемента
В гальваническом элементе используются два отдельных металлических электрода в растворе. электролитов. Два типа электродов – анодные и катодные.Анод описывается как электрод, на котором происходит окисление, а катод определяется как электрод, на котором происходит восстановление. Раствор электролита содержит катионы (+) электродного металла и анионы (-) для балансировки зарядов катионов.
Полуэлементы – это не что иное, как отдельные слоты, в которых происходит восстановление и окисление. Внешняя цепь обеспечивает путь для потока электронов, как показано на рис. 3. Если оба электрода погружены в один и тот же электролит, то солевой мостик не требуется.
Типы гальванических элементовВ основном они бывают двух типов. Это:
- Первичная ячейка
- Вторичная ячейка
Ячейка, которая действует как источник электричества без предварительной зарядки электрическим током от внешнего источника, называется первичной ячейкой. В ячейках этого типа электрическая энергия получается исключительно за счет химической активности, пока присутствуют активные материалы.Типы первичных элементов:
- Сухой элемент
- Ртутный элемент
- Щелочной элемент
Сухой элемент – это тип электрических батарей, обычно используемых в портативных электрических устройствах. Он был изобретен немецким ученым Карлом Гасснером в 1886 году после изобретения влажных углеродно-цинковых батарей французским инженером Жоржем Лекланше в 1866 году. Стандартный сухой элемент состоит из цинкового анода, который обычно представляет собой цилиндрический бак, и углеродный катод в виде центрального стержня.
Рис. 4 – Принципиальная схема сухого элемента
Электролитом является хлорид аммония рядом с цинковым анодом в виде пасты. Другой состав хлорида аммония и диоксида марганца занимает оставшееся пространство между электролитом и углеродным катодом, последний служит деполяризатором. Напряжение сухой батареи составляет 1,5 В.
Ртутный элементРтутный элемент вызывает реакцию между электродами из оксида ртути и цинка в щелочном электролите с образованием электричества.Ртутные элементы используются в качестве кнопочных элементов для часов, слуховых аппаратов, фотоаппаратов и калькуляторов.
Рис. 5 – Принципиальная схема ртутного элемента
Щелочной элементЩелочные элементы получают свою энергию, вызывая реакцию между металлическим цинком и диоксидом магния. Щелочные элементы названы так потому, что они имеют щелочной электролит гидроксида калия, в отличие от кислотных электролитов, используемых во многих других элементах.
Щелочные элементы имеют такое же напряжение, что и сухие элементы, но имеют более высокую плотность энергии и более долговечны, чем сухие элементы.Щелочные элементы используются в MP3- или CD-плеерах, фотоаппаратах, фонариках и игрушках.
Рис. 6 – Принципиальная схема щелочного элемента
Вторичный элементВторичный гальванический элемент (электрическая батарея), однажды использованный, может заряжаться, пропуская через него ток, и поэтому и снова. Химические изменения происходят, когда ячейка заряжается электричеством. Эти изменения отменяются во время разряда.
Вторичные батареи классифицируются в зависимости от материала, из которого они изготовлены.Это:
- Никель-кадмиевый элемент
- Свинцово-кислотный элемент
- Литий-ионный элемент
Рис.7 – Типы вторичных элементов (a) Никель-кадмиевый элемент (b) Свинцово-кислотный элемент (c) Литий-ионный элемент
Никель-кадмиевый элементВ элементах этого типа используются электроды из оксида оксида никеля и металлического кадмия. Следовательно, их также называют никель-кадмиевыми или никель-кадмиевыми батареями.
Свинцово-кислотный элементГальванический элемент свинцово-кислотного типа обычно используется в автомобилях.Когда элемент полностью заряжен, отрицательная пластина содержит свинец, а положительная пластина – диоксид свинца. Раствор электролита, который в основном представляет собой водную серную кислоту с более высокой концентрацией, хранит большую часть химической энергии.
Во время разряда как положительная, так и отрицательная пластины преобразуются в сульфат свинца. Электролит теряет большую часть растворенной серной кислоты и превращается в воду.
Литий-ионный элементЛитий-ионный элемент используется в мобильных телефонах.Во время разряда литий-ионы перемещаются от отрицательного электрода через электролит к положительному электроду и наоборот во время зарядки.
Как работает гальванический элементОбычно в гальваническом элементе анод изготавливается из цинка (Zn), а катод – из меди. Анод погружают в раствор сульфата цинка, а катод – в раствор сульфата меди. Для замыкания электрической цепи здесь требуется соляной мостик.
Если медный и цинковый электроды соединены внешним электрическим проводником, цинк из цинкового электрода растворяется в растворе в виде ионов Zn2 + (окисление), высвобождая электроны, которые входят во внешний проводник.
Рис. 8 – Работа гальванического элемента
Чтобы догнать повышенную концентрацию ионов цинка, через солевой мостик ионы цинка уходят, а анионы попадают в полуячейку цинка. Внутри медной полуячейки пластина с ионами меди на медном электроде (восстановление) поглощает электроны, покидающие внешний проводник. Электрохимическая реакция:
Zn + Cu2 + → Zn2 + + Cu
Во время реакции будет использоваться цинковый электрод, и металл уменьшится в размерах, но медный электрод станет больше из-за осажденная Cu, которая производится.Чтобы заряд не проходил через ячейку, необходим солевой мостик.
Без солевого мостика электроны, образующиеся на аноде, будут оседать на катоде, и реакция остановится. Электродвижущая сила гальванического элемента – это разность потенциалов полуэлемента, мера относительной легкости растворения двух электродов в электролите.
Приложения Voltaic CellПриложения включают:
- Они используются в часах, пультах дистанционного управления, калькуляторах и т. Д.
- Также используются в сотовых телефонах, фотоаппаратах, ноутбуках.
- Они используются в качестве топливных элементов для двигателей.
- Также используются в игрушках.
Преимущества:
- Вторичные элементы производят большое и стабильное количество электроэнергии в течение длительного времени.
- Вторичные элементы перезаряжаемые.
- Первичные элементы легкие и, следовательно, портативные.
- Первичные элементы обеспечивают постоянный ток и напряжение.
Недостатки:
- Вторичные элементы дороги.
- Свинцово-кислотные клетки тяжелые, из них может пролиться кислота.
- Первичные клетки недолговечны.
- Первичные элементы не заряжаются.
Также читают: Что такое суперконденсатор (ультраконденсатор) - характеристики, работа, типы и применение Преобразователь - характеристики, тип, применение, факторы, влияющие на выбор Термистор - классификация, принцип работы, применение и преимущества
Chakrasthitha относится к категории B.




 Иначе обстояло дело с Луиджи Гальвани, с 1775 года работающим на кафедре анатомии в Болонье. Его специализаций считались раздражители нервной системы, но светило оставил значимый след не в области физиологии. Ученик Беккарии активно занимался электричеством. Во второй половине 1780 года, как следует из воспоминаний учёного (1791, De Viribus Electricitatis in Motu Muscylary: Commentarii Bononiensi, том 7, стр. 363), в очередной раз производилось препарирование лягушки (опыты и потом длились долгие годы).
Иначе обстояло дело с Луиджи Гальвани, с 1775 года работающим на кафедре анатомии в Болонье. Его специализаций считались раздражители нервной системы, но светило оставил значимый след не в области физиологии. Ученик Беккарии активно занимался электричеством. Во второй половине 1780 года, как следует из воспоминаний учёного (1791, De Viribus Electricitatis in Motu Muscylary: Commentarii Bononiensi, том 7, стр. 363), в очередной раз производилось препарирование лягушки (опыты и потом длились долгие годы).
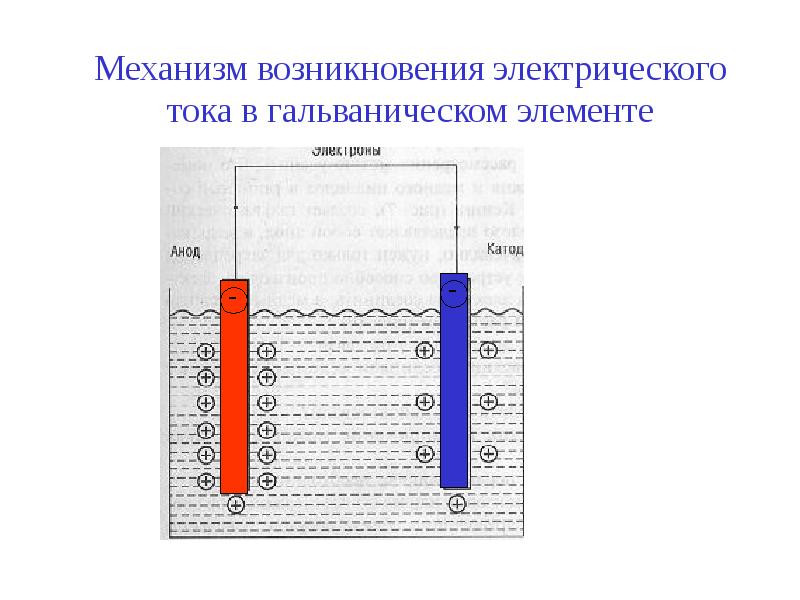 Алессандро Вольта не принял объяснения. Внимательно изучив описание экспериментов, Вольта выдвинул объяснение, что ток возникает при объединении двух металлов, непосредственно или через электролит тела биологического существа. Причина возникновения тока кроется в материалах, а лягушка служит простым индикатором явления. Цитата Вольты из письма, адресованного редактору научного журнала:
Алессандро Вольта не принял объяснения. Внимательно изучив описание экспериментов, Вольта выдвинул объяснение, что ток возникает при объединении двух металлов, непосредственно или через электролит тела биологического существа. Причина возникновения тока кроется в материалах, а лягушка служит простым индикатором явления. Цитата Вольты из письма, адресованного редактору научного журнала: Учёный постоянно искал способы усиления действия гальванических пар, но не находил. В ходе опытов создана конструкция вольтова столба:
Учёный постоянно искал способы усиления действия гальванических пар, но не находил. В ходе опытов создана конструкция вольтова столба: К тому времени уже стал известен закон Кулона, выясняется, что цинк зарядился положительно, а медь – отрицательно. Первый материал отдал электроны второму. По указанной причине цинковая пластина вольтова столба постепенно разрушается. Для изучение работы назначили комиссию, которой представили доводы Алессандро. Уже тогда путём умозаключений исследователь установил, что напряжение отдельных пар складывается.
К тому времени уже стал известен закон Кулона, выясняется, что цинк зарядился положительно, а медь – отрицательно. Первый материал отдал электроны второму. По указанной причине цинковая пластина вольтова столба постепенно разрушается. Для изучение работы назначили комиссию, которой представили доводы Алессандро. Уже тогда путём умозаключений исследователь установил, что напряжение отдельных пар складывается.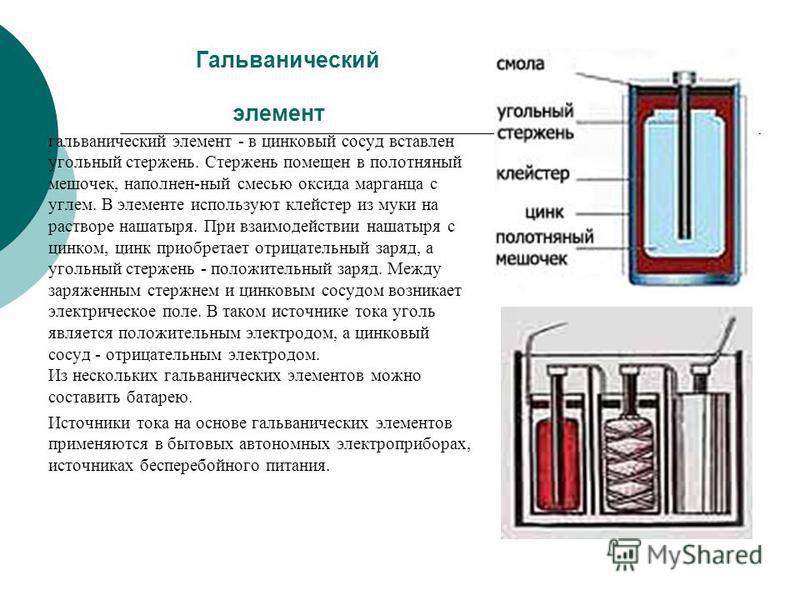
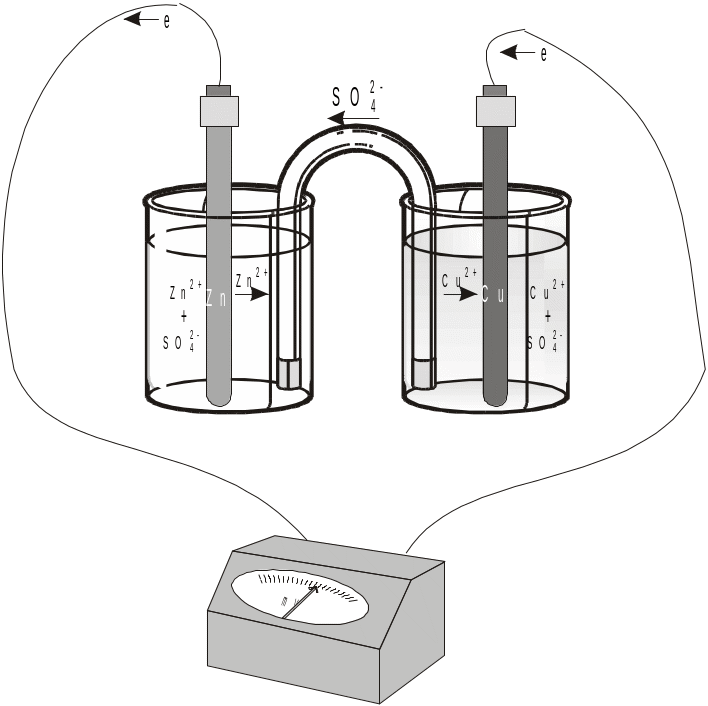
 С увеличением количества вещества реагентов в элементе и до определенного предела, с увеличением температуры, энергия возрастает. Энергию уменьшает увеличение разрядного тока.
С увеличением количества вещества реагентов в элементе и до определенного предела, с увеличением температуры, энергия возрастает. Энергию уменьшает увеличение разрядного тока.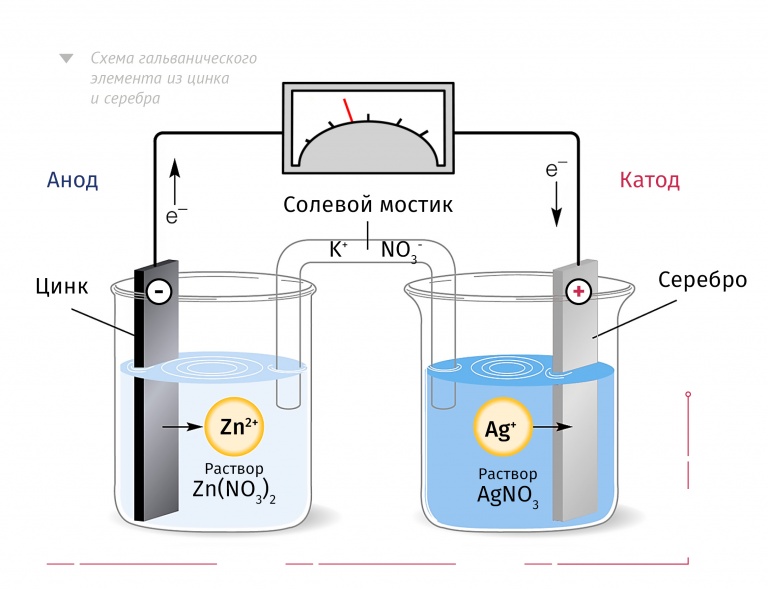 Электролитом является паста из раствора хлорида аммония с добавкой муки или крахмала в качестве загустителя.
Электролитом является паста из раствора хлорида аммония с добавкой муки или крахмала в качестве загустителя.
 Энергоустановки применяются на космических кораблях, они обеспечивают энергией космический корабль и космонавтов.
Энергоустановки применяются на космических кораблях, они обеспечивают энергией космический корабль и космонавтов.