Отдельные примеры электролиза растворов и расплавов солей.
Рассмотрим несколько случаев электролиза водных растворов:
1. Электролиз растворов CuCl2 с инертным анодом.
Медь в ряду стандартных потенциалов расположена после водорода (φ Cu+/Cu2+ = 0,34B), поэтому у катода будет разряжаться ионы Cu2+ и выделяется свободная медь.
У анода будет разряжаться хлорид-иона.
Схема электролиза:
Катод(-) Cu2+ + 2ē → Cu °
Анод(+) 2Cl– – 2ē → Cl2
Cu2+ + 2Cl– → Cu + Cl2
Установлено,
что электролиз проходит только при
некоторой определенной величине
электрического напряжения. Минимальное
напряжение, необходимое для разложения
электролита, называемое потенциалом разложения,
вычисляется теоретическим путем
вычитания из электродного потенциала
анода электродного потенциала катода
(Е разл(теор.)).
В данном
случае (φ Cu+/Cu2+ =
0,34B, φ Cl2/2Cl– =
1,36B),
Минимальное
напряжение, необходимое для разложения
электролита, называемое потенциалом разложения,
вычисляется теоретическим путем
вычитания из электродного потенциала
анода электродного потенциала катода
(Е разл(теор.)).
В данном
случае (φ Cu+/Cu2+ =
0,34B, φ Cl2/2Cl– =
1,36B),
Е разл. = 1,36-0,34 = 1,02В.
2. Электролиз раствора К2SO4 c инертным анодом.
Поскольку калий имеет очень малую величину электродного потенциала (φ К/К + =-2,9В), то у катода будет происходить выделение водорода и накопление ОН–. У анода будет идти выделение кислорода и накопление Н+ .
В целом раствор во всех частях будет электронейтральным, однако в катодном пространстве будет накапливаться щелочь, а в анодном – кислота.
Схема электролиза:
Как
видно из записи схемы электролиза
раствора K2SO4 ,
происходит электролиз воды, а количество
растворенной соли останется неизменным,
ее роль сведется лишь к созданию
электропроводящий среды.
3. Электролиз раствора NiSO4 c растворимым анодом из никеля.
Стандартный потенциал никеля (φ Ni/Ni2+ = -0,25B) несколько больше, чем у водорода в нейтральной среде (рН=7), где он равен -0,41В. Расчет потенциала водорода в нейтральной среде проводят по уравнению:
φ = -0,059 ∙ 7=-0,41В
Поэтому
при электролизе нейтрального
раствора NiSO4 на
катоде в основном происходит разряд
ионов Ni2+ и
выделение металла. На аноде происходит
противоположенный процесс- окисление
металла, т.к. потенциал никеля намного
меньше потенциала окисления воды, а тем
более потенциала окисления
иона SO42-(φ Ni/Ni2+ =
-0,25B; φ SO42-/ S2O82- =
2,01B, φН2О/О2 =
1,22В). Таким образом, в данном случае
электролиз сводится к растворению
металла анода и выделению его на катоде
(перенос материала анода на катод).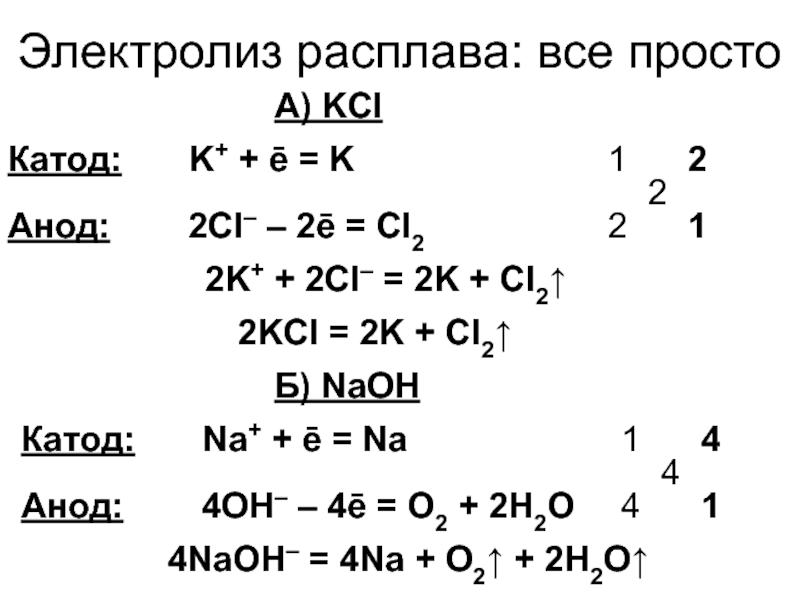
Схема электролиза:
Этот процесс применяется для очистки никеля (так называемое электролитическое рафинирование).
4. Электролиз раствора NaCl с инертным анодам.
Натрий имеет очень малую величину электродного потенциала (φ Nа/Nа+ = -2,7B). У катода будет происходить восстановление водорода и накопление ионов ОН– . У анода происходит окисление Cl– до свободного состояния.
Схема электролиза:
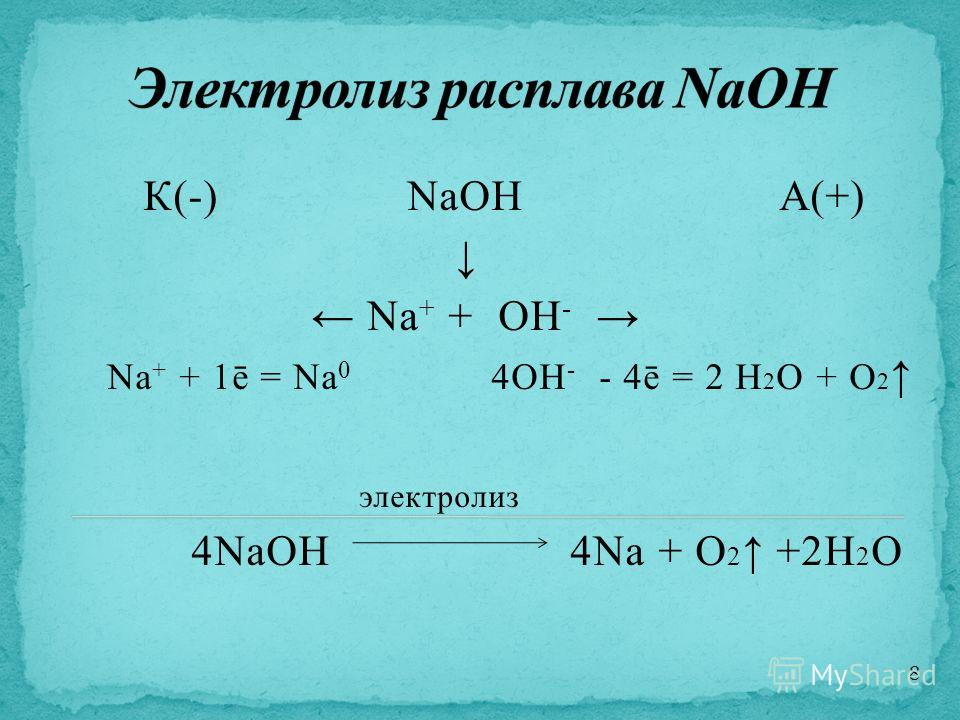
5. Электролиз расплава NaCl с инертным анодом.
При
плавлении хлорида натрия происходит
термохимическая диссоциация
соли: Na+Cl– . На
катоде идет восстановление
ионов Na+ до
металлического натрия, на аноде –
окисления ионов Cl
Схема электролиза:
Сравнивая электролиз раствора и расплава NaCl, можно сделать вывод: очень активные металлы (Li, Na, K, Ba, Mg, Sr, Ca) можно получить только электролизом расплавов их солей.
Как показали исследования, довольно часто электролиз (разряд ионов) начинается при напряжении, значительно превышающем теоретическивычисленное.
Например, согласно теоретическому подсчету, электролиз 1м раствора NaOH должен проходить при напряжении 1,22В. Практически же он проходит при 1,67В. Разность между потенциалом разложения, фактически необходимого для протекания электролиза, и теоретического найденного, носит название перенапряжения. Рассчитаем для нашего примера:
Е перен =Е разл (опр) – Е разл (теор) = 1,67 – 1,22 = 0,45В.
Перенапряжение
вызывает непроизводительный
добавочный расход энергии, поэтому на
практике стараются создать такие
условия, при каторыхвеличина
перенапряжения становится минимальной
(применяет по возможности невысокие
плотности тока).
в начало
Репетитор-онлайн — подготовка к ЦТ
Электролиз водных растворов электролитовЭлектролиз водных растворов электролитов — процесс более сложный, чем электролиз расплавов, поскольку в этом случае на электродах могут окисляться или восстанавливаться молекулы воды. Какие именно электрохимические процессы будут протекать на электродах, зависит от природы катиона и аниона электролита. Из нескольких возможных процессов первым будет протекать тот, осуществление которого связано с наименьшей затратой энергии. Иными словами, в первую очередь на катоде будут восстанавливаться более сильные окислители, а на аноде окисляться более сильные восстановители.
На практике для описания процессов, протекающих на катоде в нейтральных средах, можно руководствоваться следующими правилами.
1. Ионы металлов, расположенных в ряду активности от Li+ до Al3+ (включительно), в водных растворах на катоде не восстанавливаются. При электролизе растворов таких электролитов на катоде восстанавливаются молекулы воды:
При электролизе растворов таких электролитов на катоде восстанавливаются молекулы воды:
2Н2О + 2е Н2↑ + 2ОН−
Таким образом, щелочные, щелочноземельные металлы, магний и алюминий не могут быть получены электролизом водных растворов своих соединений. Перечисленные металлы в промышленности получают электролизом расплавов.
2. Катионы металлов, расположенных в ряду активности после Al3+ до Н +, восстанавливаются на катоде совместно с молекулами воды.
3. Ионы металлов, расположенных в ряду активности после водорода, восстанавливаются на катоде без участия воды в электрохимическом процессе.
4. Если водный раствор содержит катионы разных металлов, то при электролизе они выделяются на катоде в порядке ослабления их окислительных свойств, т.е. справа налево по ряду активности металлов. Так, из смеси катионов Ag+, Cu2+ и Fe2+ сначала будут восстанавливаться катионы серебра, затем — катионы меди и последними — катионы Fe2+.
Характер процессов на аноде зависит как от природы анионов, так и от материала анода. Различают нерастворимые (инертные) и растворимые аноды.
Нерастворимые аноды изготавливают из угля, графита, платины, золота; такие электроды сами не посылают электроны во внешнюю цепь, а лишь участвуют в их передаче.
При описании процессов на инертных анодах можно руководствоваться следующими правилами:
1. В первую очередь окисляются простые, не содержащие кислород анионы, в порядке ослабления их восстановительных свойств:
S2− → I− → Br− → Cl−
Иными словами, если раствор содержит ионы S2− и Cl−, то сначала на аноде будут окисляться анионы S2−.
2. При электролизе водных растворов, содержащих ионы F−, а также оксоанионы (CO32−, NO3−, SO42−, PO43− и др.), на аноде окисляются молекулы воды:
2Н2О − 4е О2 + 4Н+
В щелочных средах на аноде в первую очередь окисляются гидроксид-ионы:
4ОН− − 4е О2↑ + 2Н2О
а в кислых растворах на катоде в первую очередь восстанавливаются катионы водорода:
2Н+ + 2е
Н2↑.
Рассмотрим примеры электролиза водных растворов различных соединений металлов с инертным анодом ( — символ постоянного электрического тока).
Пример 8.14. Раствор NaCl
Молекулярное уравнение электролиза получили, связав Cl−-ионы в левой части и OH−-ионы в правой с ионами Na+, которые в электролизе не участвуют.
Таким образом, при электролизе водного раствора NaCl, наряду с выделением водорода и хлора, в катодном пространстве накапливается щелочь (NaОН).
Пример 8.15. Раствор Na2SO4
Следовательно, электролиз водного раствора Na2SO4 сводится к разложению воды.
Пример 8.16. Раствор CuSO4В этом случае, наряду с выделением меди и кислорода, в анодном пространстве образуется серная кислота.
Пример 8.17. Раствор NaOHДля сравнения приведем схему электролиза расплава NaOH:
 19. Раствор Н2SO4
19. Раствор Н2SO4Рассмотрим примеры электролиза растворов солей, катион которых восстанавливается вместе с молекулами воды.
Пример 8.20. Раствор ZnSO4
На катоде принято всего четыре электрона — столько же, сколько отдано на аноде, поэтому дополнительные коэффициенты равны единице. В правой части суммарного ионного уравнения две группы OH− и два иона H+ образуют две молекулы воды. Сократив обе части равенства на это число молекул воды, получим:
Zn2+ + 2H2O = Zn + H2 + O2 + 2H+
ZnSO4 + 2H2O Zn + Н2↑ + О2↑ + Н2SO4
Пример 8.21. Раствор ZnCl2
При электролизе с растворимым анодом (анод из меди, никеля, цинка, серебра, железа и других металлов, кроме платины и золота), всегда, независимо от природы аниона, происходит окисление атомов металла, из которого сделан анод. Это объясняется тем, что все металлы (кроме Pt и Au) окисляются легче, чем молекулы воды и анионы кислотных остатков:
Это объясняется тем, что все металлы (кроме Pt и Au) окисляются легче, чем молекулы воды и анионы кислотных остатков:
Me − ne = Men+.
При этом катионы Men+ переходят в раствор и масса анода уменьшается. Электролиз с растворимым анодом используется для очистки (рафинирования) металлов (меди, никеля и др.). В этом случае анодом является кусок неочищенного металла, а катодом — чистый металл. В процессе электролиза анод растворяется, а перешедшие в раствор катионы металла восстанавливаются на катоде. Пример электролиза водного раствора сульфата меди CuSO4 с медным анодом:
анод (+): Cu0 − 2e = Cu2+ (растворение анода),
катод (−): Cu2+ + 2e = Cu0 (осаждение меди на катоде).
Таким образом, в результате электролиза на катоде выделяется чистая медь.
Как решать 34 задание ЕГЭ по химии, примеры и алгоритмы решения заданий 34 по химии (Ростов-на-Дону)
Решение расчётных задач по химии подчиняется логике и проводится по определенным алгоритмам. Прежде всего, нужно внимательно прочитать и проанализировать условие задачи, написать необходимые уравнения химических реакций. Важно осознать ключевой (главный) вопрос в задаче и понять, количество какого вещества следует найти и по количеству какого вещества будет производиться расчёт. На основе анализа условия определить причинно-следственные связи и составить план последовательности решения задачи.
Почему мы главным вопросом задачи считаем нахождение количества вещества? По количеству вещества всегда можно найти его массу, объём и массу раствора (массу и объём газа) и ответить на возможные дополнительные вопросы, содержащиеся в задаче.
Прежде всего, нужно внимательно прочитать и проанализировать условие задачи, написать необходимые уравнения химических реакций. Важно осознать ключевой (главный) вопрос в задаче и понять, количество какого вещества следует найти и по количеству какого вещества будет производиться расчёт. На основе анализа условия определить причинно-следственные связи и составить план последовательности решения задачи.
Почему мы главным вопросом задачи считаем нахождение количества вещества? По количеству вещества всегда можно найти его массу, объём и массу раствора (массу и объём газа) и ответить на возможные дополнительные вопросы, содержащиеся в задаче.
В рассматриваемых примерах мы не будем пояснять выполнение формальных расчётов, предполагая, что вы проводите их без затруднений.
Пример 1. Электролиз 470 г 5%-ного раствора нитрата меди(II) прекратили после того, как масса раствора уменьшилась на 8 г. Из полученного раствора отобрали порцию массой 92,4 г. Вычислите массу 11,2 %-ного раствора едкого кали, необходимого для полного осаждения меди из отобранной порции раствора.
| Дано: | Анализ и решение: |
А) Проводим анализ условия
(составляем уравнения химических реакций, о которых упоминается в условии задачи).
1-й фрагмент.
«Электролиз 470 г 5%-ного раствора нитрата меди(II) прекратили… ».
При проведении этого этапа стараемся не обращать внимания на численные значения, а выделяем только химическую часть условия – она выделена в тексте фрагмента полужирным шрифтом.
2-й фрагмент.
«…Из полученного раствора отобрали порцию массой 92,4 г. Вычислите массу 11,2 %-ного раствора едкого кали, необходимого для полного осаждения меди из отобранной порции раствора».
Необходимо понять: в смеси после реакции находятся продукты реакции (Cu, O2, HNO3) и исходные вещества, которые не прореагировали, были «в избытке» (Cu(NO3)2, h3O), и следует рассматривать возможность взаимодействия каждого из этих веществ с добавляемым реагентом.
Б) Устанавливаем логические связи (формулируем главный вопрос задачи, т.е. находим вещество, количество которого необходимо рассчитать, и логическую цепочку, связывающую количество этого вещества с веществами, количество которых мы знаем или можем вычислить).
Главный вопрос – найти количество KOH (прореагировавшего с HNO3 и Cu(NO3)2, находящимися в отобранной части раствора).
Выводы (логическая цепочка):
При проведении расчётов будем использовать уменьшение массы раствора на 8 г (единственная количественная величина, относящаяся к протеканию реакции), которое происходит за счёт осаждения меди и выделения кислорода.
1) Количество KOH связано с количеством Cu(NO3)2 и HNO3 в порции раствора (уравнения (2) и (3)).
2) Количество HNO3 связано с количеством Cu и O2, которые образовались в процессе электролиза (уравнение (1)).
3) Количество Cu(NO3)2 в растворе после электролиза (избыток Cu(NO3)2) связано с количеством выделившихся Cu и O2.
В) План решения задачи.
1) Найти количество Cu(NO3)2 до электролиза.
2) Найти количество образовавшейся HNO3 по количеству выделившихся Cu и O2 (уравнение 1).
3) По уменьшению массы (т.е. по количеству выделившихся Cu и O2) найти количество прореагировавшего Cu(NO3)2 по уравнению (1).
4) Найти количество непрореагировавшего Cu(NO3)2.
5) Найти количество Cu(NO3)2 и HNO3в отобранной порции раствора.
6) По количеству Cu(NO3)2 и HNO3 в порции найти количество прореагировавшего KOH.
7) Вычислить массу раствора KOH.
Г) Решение.
1) Находим количество вещества Cu(NO3)2 до электролиза.
2) По уравнению (1) находим количество прореагировавшего Cu(NO3)2:
Пусть прореагировало x моль Cu(NO3)2, тогда
г)
3) По уравнению (1) находим количество прореагировавшего HNO3:
г)
4) Находим количество вещества Cu(NO3)2 и HNO3 в отобранной порции раствора.
а)
б) находим количество вещества Cu(NO3)2 с помощью пропорции – концентрация вещества одинакова как во всём растворе, так и в любой его части
а)
в) находим количество вещества HNO3 в отобранной порции:
а)
5) Находим количество KOH и массу добавленного раствора KOH.
а) По уравнению (2).
б) По уравнению (3).
в)
Пример 2. Насыщенный раствор нитрата алюминия получили, растворив кристаллогидрат Al(NO3)3·12h3O (растворимость 241 г в 100 г воды при 25 ºС) в 250 г воды. Полученный раствор разделили на две части. В первую добавили раствор Na2CO3 (избыток), во вторую 400 г раствора аммиака (избыток). Во второй колбе осадок в 4 раза тяжелее, чем в первой. Найдите концентрацию соли во второй колбе.
В ответе приведите уравнения реакций, которые указаны в условии задачи, и все необходимые вычисления (указывайте единицы измерения искомых физических величин).
| Дано: | Анализ и решение: |
А) Проводим анализ условия
Разбиваем условие на смысловые фрагменты, выделяем ключевые слова
и понятия и составляем уравнения реакций (химическая часть задачи).
1-й фрагмент:
«Насыщенный раствор нитрата алюминия получили, растворив кристаллогидрат Al(NO3)3·12h3O (растворимость 241 г в 100 г воды при 25 ºС) в 250 г воды. Полученный раствор разделили на две части».
2-й фрагмент:
« В первую добавили раствор Na2CO3 (избыток), …»
3-й фрагмент:
«во вторую 200 г раствора аммиака (избыток)»
4-й фрагмент:
«Во второй колбе осадок в 4 раза тяжелее, чем в первой. Найдите концентрацию соли во второй колбе».
Химических превращений нет.
Б) Устанавливаем логические связи (формулируем главный вопрос задачи, т.е. находим вещество, количество которого необходимо рассчитать, и логическую цепочку, связывающую количество этого вещества с веществами, количество которых мы знаем или можем вычислить).
Главный вопрос – найти количество Nh5NO3.
Выводы (логическая цепочка):
Единственная цифра, которую можно использовать при проведении расчётов, это «4» – отношение масс Al(OH)3, образовавшихся во 2-й и 1-й колбах.
В) План решения задачи.
1) Найти количество Al(NO3)3(общее).
2) Найти количество Al(NO3)3 в 1-й части (уравнение (1) по Al(OH)3.
3) Найти количество Al(NO3)3 во 2-й части (уравнение 2) по Al(OH)3.
4) Найти количество Nh5NO3 (по уравнению (3)) по количеству AlCl3 (2-я часть)).
5) Найти ω(Nh5NO3) по уравнению (3).
Г) Решение
1) Находим количество Al(NO3)3 в исходном растворе.
а) находим количество Al(NO3)3·12h3O, которое растворилось в 250 г воды:
Используя данные по растворимости (растворимость 241 г в 100 г воды при 25 ºС), составляем пропорцию,
б)
2) Находим количество Al(NO3)3, прореагировавшего по уравнениям (2) и (3):
Пусть по уравнению (1) прореагировало x моль Al(NO3)3, по уравнению (2) – y моль Al(NO3)3, тогда
а) x + y = 1,4
б) по уравнению (2):
в) по уравнению (3):
г)
3) По уравнению (3) находим количество Nh5NO3:
а)
4) По уравнению (3) находим количество образовавшегося Al(OH)3:
5) Находим массу 2-й части раствора Al(NO3)3.
Концентрация вещества в растворе и в любой его части одинакова, следовательно
6) Находим массовую долю Nh5NO3 в растворе:
а)
б)
Задания С1 ЕГЭ по химии (2004-2005 г)
Подробнее он представлен в таблице:
Исходные частицы | Процесс | Продукты |
Металл | M – nē = Mn+ | Ионы металла |
Анионы бескислородных кислот. | S2– > I– > Br – > Cl– 2Hal– –2ē = Hal2 | Свободные неметаллы |
Анионы кислот с промежуточной степенью окисления элемента | SO32–,
NO2–, и т. SO32– + H2O –2ē = SO42–+2H+ | Анионы кислот с высшей степенью окисления элемента |
Анионы карбоновых кислот | 2RCOO––2ē= R-R +2CO2 | Углеводороды и оксид углерода(IV) |
Гидроксид-ион | 4OH– – 4ē = O2+ 2H2O | Кислород |
Вода | 2H2O – 4ē = O2+ 4H+ | Кислород |
Анионы кислот с высшей степенью окисления элемента | SO42–, NO3–, и т.п. SO42– –2ē = S2O82– | Перекисные соединения |
Фторид-ион | 2F– –2ē = F2 | Фтор |
Если речь идет об электролизе с инертными электродами (уголь, золото, платина, платиновые металлы), – первый процесс (окисление материала анода) отпадает.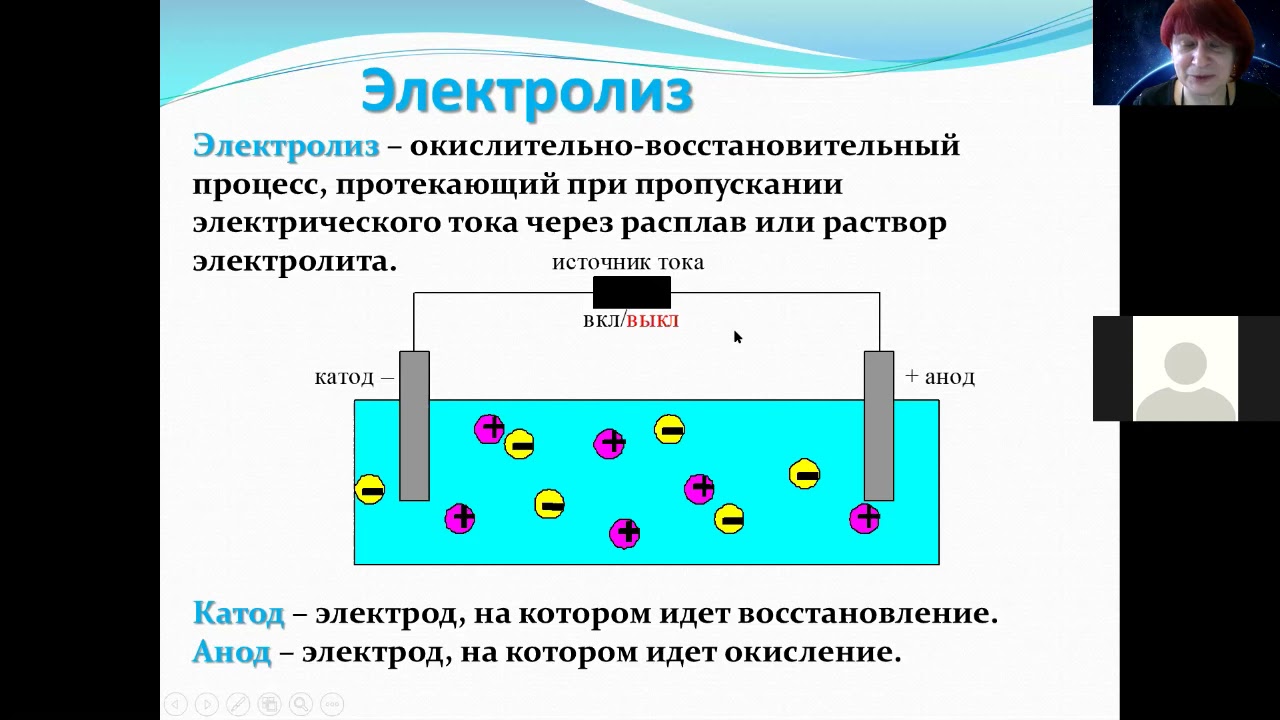 Если соль содержит бескислородный анион (кроме фторид-ионов) – идет окисление
аниона. Если анион – фторид, или отвечает высшей степени окисления элемента, тогда протекает окисление молекул воды.
Если соль содержит бескислородный анион (кроме фторид-ионов) – идет окисление
аниона. Если анион – фторид, или отвечает высшей степени окисления элемента, тогда протекает окисление молекул воды.
Рассмотрим примеры:
С1 (2004, 7%). Запишите уравнения реакций, протекающих на катоде и аноде, и общее уравнение электролиза водного раствора фторида калия на инертных электродах.
В данном задании (электролиз раствора фторида калия):
K(-) (K+) – ион калия не восстанавливается, щелочной металл
2H2O + 2ē = H2+ 2OH– |2
А(+) 2H2O – 4ē = O2+ 4H+ | 1
(F–)– не окисляется, в ряду способности к окислению расположен после молекул воды.
Для получения общего уравнения суммируем уравнения катодного и анодного процессов с учетом коэффициентов электронного баланса:
6H2O = 2H2+ 4OH –+ O2+ 4H+
Катионы водорода и гидроксид-анионы в
одном растворе в значительных количествах сосуществовать не могут: они взаимодействуют, образуя воду. После сокращения получаем окончательное уравнение:
После сокращения получаем окончательное уравнение:
2H2O = 2H2 + O2
(Правильный ответ, включающий все три уравнения реакции, оценивался в 3 балла.)
В качестве второго примера рассмотрим электролиз раствора ацетата калия (подобные реакции включались в задания С3 некоторых вариантов ЕГЭ-2005):
K(-) (K+) – не восстанавливается, щелочной металл
2H2O + 2ē = H2+ 2OH– | 1
А(+) 2CH3COO––2ē = CH3-CH3 + 2CO2 | 1
Суммарное уравнение:
2CH3COO– + 2H2O = H2+ 2OH– + CH3-CH3 + 2CO2
Или 2CH3COOK + 2H2O = H2+ 2KOH + CH3-CH3 + 2CO2
В том случае, когда металл расположен в средней части ряда напряжения (от цинка до водорода) на катоде одновременно протекают два процесса: восстановление катиона металла и восстановление молекул воды. Рассмотрим электролиз водного раствора сульфата никеля с инертными электродами.
Рассмотрим электролиз водного раствора сульфата никеля с инертными электродами.
В растворе: NiSO4 = Ni2+ + SO42–;
На катоде:
K(-) Ni2+ + 2ē = Ni
2H2O + 2ē = H2 + 2OH–
Эти реакции никак не связаны между собой и суммировать их нельзя! Никакого простого соотношения между количеством никеля и водорода нет, оно зависит от концентрации, температуры, материала катода и прочих факторов.
На аноде:
А(+) (SO42– – не окисляются )
2H2O – 4ē = O2 + 4H+
Общих уравнений (катод + анод) в этом случае тоже будет два. Чтобы получить общее уравнение основной реакции, мы должны сложить уравнение основного процесса на катоде и уравнение анодного процесса, с учетом коэффициентов электронного баланса:
K(-) Ni2+ + 2ē = Ni |2
А(+) 2H2O – 4ē = O2 + 4H+|1
——————————————————–
2Ni2+ + 2H2O = 2Ni + O2 + 4H+ – ионное,
2NiSO4 + 2H2O = 2Ni + O2 + 2H2SO4 – молекулярное уравнение основной реакции.
Аналогично получаем общее уравнение побочной реакции:
K(-) 2H2O + 2ē = H2 + 2OH–|2
А(+) 2H2O – 4ē = O2 + 4H+|1
——————————————————–
6H2O = 2H2 + 4OH– + O2 + 4H+
2H2O = 2H2 + O2
Опять же, суммировать общие уравнения основной и побочной реакций нельзя! (а это встречается в некоторых пособиях).
В заданиях ЕГЭ вряд ли потребуется составлять общие уравнения реакций для таких случаев, как правило, требуется только написать уравнения отдельных процессов на электродах. Остальное скорее пригодится на олимпиадах.
Немного о расчетах. Если в некоторой задаче дано количество вещества никеля, полученного при электролизе, можно рассчитать, сколько соли подверглось электролизу, сколько серной кислоты образовалось. Нельзя рассчитать, сколько всего выделилось кислорода (он образуется и во второй реакции!). Или этой реакцией придется пренебречь.
Тем более (без дополнительных данных), нельзя рассчитать, сколько выделилось водорода.
Нельзя рассчитать, сколько всего выделилось кислорода (он образуется и во второй реакции!). Или этой реакцией придется пренебречь.
Тем более (без дополнительных данных), нельзя рассчитать, сколько выделилось водорода.
Если сказано, сколько выделилось кислорода – нельзя рассчитать ничего, кроме общего количества вступившей в реакцию воды.
Вот если сказано, сколько выделилось никеля и сколько кислорода – тогда можно рассчитать все.
Электролиз
Электролиз – окислительно-восстановительный процесс, протекающий на электродах через расплав или раствор электролита.
Не путать с окислительно-восстановительными реакциями, где восстановителем или окислителем является то или иное вещество. В данном типе ОВ процессов восстановителем и окислителем являются электроды:
Катод – электрод , на котором происходит восстановление катионов (катод отдаёт электроны, катион принимает).
Анод – электрод , на котором происходит окисление анионов (анод принимает электроны, анион отдаёт электроны).
Анод бывает инертным (не влияет на протекание реакции), а бывает растворимый (переходит в среду реакции).
Как говорилось выше, электролиз может проходить как в растворах, так и в расплавах. Если в расплаве зачастую в электролизе участвует одно вещество, то в растворе их может быть несколько (если в воде растворяли несколько веществ), включая воду.
Разберём уравнения электролиза на примере NaCl (расплав, раствор):
Алгоритм:
1. Пишем уравнение электролитической диссоциации
2. Обозначаем, какие вещества будут участвовать в восстановлении или окислении на электродах.
3. Описываем процесс восстановления и окисления.
4. Пишем суммарное уравнение
Теперь разберём на примере NaCl:
1.NaCl(расплав)⇆Na++Cl–
2. ЗАПОМНИТЬ!!! К катоду притягиваются катионы, а к аноду притягиваются анионы.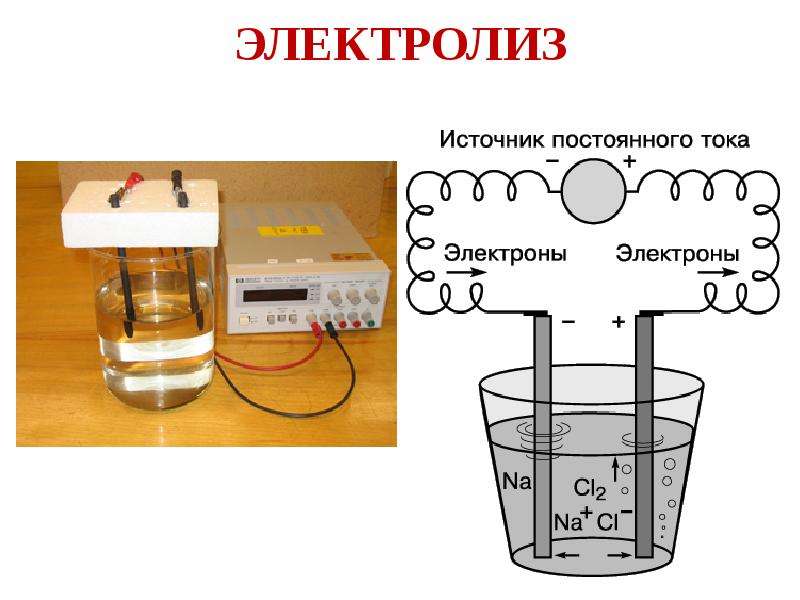
В нашем случае в электролизе участвует всего одно вещество – расплав NaCl, поэтому конкуренции на электродах не будет.
3.Катод (-): Na++1e→Na
Анод (+): 2Cl–-2e→Cl2↑
4. NaCl(расплав) → Na+Cl2↑
Далее речь пойдёт о электролизе растворов. Чтобы говорить о нём, нужно знать электролиз воды:
2H2O→2H2↑+O2↑
Катод (-): 2H++2e→H2↑
Анод (+): 2O-2-4e→O2↑
Заметим, что если проходит электролиз раствора, то участвовать в процессах будет растворённое вещество ивода!!! В водных растворах имеется как минимум (!!!) два вещества – вода и растворённое вещество.
Чтобы понять , какой из металлов выиграет в конкуренции за восстановление на катоде, следует обратиться к электрохимическому ряду напряжений металлов.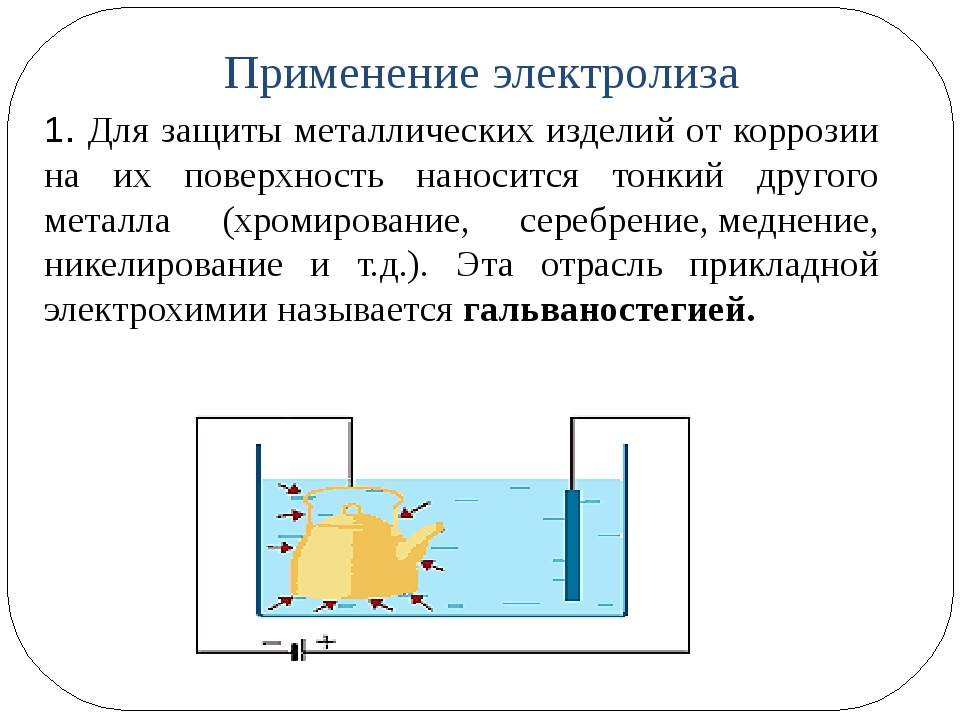
|
Катионы активных металлов |
Катионы металлов средней активности |
Катионы неактивных металлов |
|
Все металлы от Liи до Al(включительно) |
Все металлы от Mnи до Pb (включительно) |
Все металлы, стоящие после (H) в ЭХРП металлов |
|
Невозможно получить при электролизе растворов. На катоде подвергается электролизу вода с выделением водорода. |
При электролизе растворов данные металлы выделяются на катоде. |
Электролиз проходит легко, металлы выделяются на катоде. |
Конкуренция существует и при окислении на аноде, рассмотрим в таблице.
|
Анионы кислородсодержащих кислот, а так же фторид-ион |
Ионы бескислородных кислот (кроме фтороводородной) |
|
Не подвергаются окислению на аноде в водных растворах. Электролизу подвергается вода с выделением кислорода. |
Легко окисляются до свободных неметаллов. |
Разберём на практике несколько примеров:
1. Пишем уравнение диссоциации хлорида цинка :ZnCl2⇌Zn2++2Cl–
2. Катод (будут конкурировать ионы Zn2+ иH2O):
Zn2++2e→Zn↓
Анод (будут конкурировать ионы Cl–и H2O):
2Cl–-2e→Cl2↑
3. Суммарное уравнение:
Суммарное уравнение:
ZnCl2+H2O→ Zn↓+Cl2↑
Из данного примера видим, что тут вода не участвовала в электролизе.
Ещё пример.
1. Раствор сульфата меди (II)
CuSO4⇌Cu2++SO42-
2. Катод (Ионы Cu2+выигрывают конкуренцию у H2O):
Cu2++2e→Cu↓
Анод (будут конкурировать ионыSO42- и H2O):
2H2O+4e→O2↑+4H+
В растворе остались ещё H+ ионы, которые пойдут на образование молекулH2SO4.
3. Суммарное уравнение: 2CuSO4+2H2O→2Cu↓+O2↑+2H2 SO4
1.Раствор нитрата меди (II)
Cu(NO3 )2⇄Cu2++2NO3–
2. Катод (ионы Cu2+выигрывают конкуренцию у H2O)
Катод (ионы Cu2+выигрывают конкуренцию у H2O)
Cu2++2e→Cu↓
Анод (H2Oвыигрывает конкуренцию у NO3–)
2H2O-4e→O2↑+4H+
3. Суммарное уравнение:
2Cu(NO3 )2+2H2O→2Cu↓+O2↑+4HNO3
1. Раствор хлорида калия
KCl⇄K++Cl–
2. Катод (H2Oвыигрывает конкуренцию у ионов K+)
2H2O+2e→H2↑+2OH–
Анод (ионы Cl–выигрывают конкуренцию у H2O)
2Cl–-2e→Cl2↑
3. Суммарное уравнение:
Оставшиеся ионы K+и OH–образуют KOH
2KCl+2H2O→ H2↑+Cl2↑+2KOH
Решим несколько задач, где встречается электролиз:
1. При электролизе 1л раствора хлорида меди (II) на катоде выделилась медь массой 12,7г. Вычислите объем газа (н.у.), выделившегося на аноде, если плотность раствора близка к 1 г/мл
При электролизе 1л раствора хлорида меди (II) на катоде выделилась медь массой 12,7г. Вычислите объем газа (н.у.), выделившегося на аноде, если плотность раствора близка к 1 г/мл
Ответ: 4,44 л.
2.При электролизе водного раствора нитрата серебра (I) на аноде выделилось 13,44л кислорода (н.у.). Определите массу выделившегося на катоде серебра, если выход серебра составил 90% от теоретически возможного, а выход кислорода – количественный.
Ответ: 233,3г.
3.При электролизе водного раствора хлорида цинка на катоде выделился цинк массой 68,25г, а на аноде – хлор объемом 28,22л (н.у.). Определите выход цинка, если выход хлора составил 90% от теоретически возможного.
Ответ: 75%.
Автор статьи: Симкин Егор Андреевич
Редактор: Харламова Галина Николаевна
Ликвидация цеха ртутного электролиза в Усолье-Сибирском завершится в 2021 году
30. 12.2020
12.2020
Напомним, что в 2020 году в Иркутской области под руководством Губернатора Игоря Кобзева состоялся ряд совещаний, на которых приняты важные для региона решения. На федеральном уровне получена их поддержка.
С начала года проработаны механизмы реализации мероприятий по ликвидации накопленного экологического вреда окружающей среде от деятельности химических предприятий на территории г. Усолье-Сибирское, создана межведомственная комиссия под председательством заместителя Председателя Правительства РФ Виктории Абрамченко, работает единый оперативный штаб под председательством Губернатора Иркутской области Игоря Кобзева.
В соответствии с распоряжением Правительства РФ, в августе 2020 года единственным исполнителем работ, проводимых на промплощадке в Усолье-Сибирском, определен ФГУП «Федеральный экологический оператор» (ФЭО, предприятие Госкорпорации «Росатом»), в октябре утвержден план мероприятий («дорожная карта») по предупреждению и устранению загрязнения окружающей среды на территории г. Усолье-Сибирское.
В рамках исполнения мероприятий ФЭО проведены инженерно-геодезические изыскания, аэрофотосъемка, выполнены полевые работы по тахеометрической съемке и инвентаризации зданий, которые находятся на территории промплощадки.
На данный момент полностью и досрочно приведены в безопасное состояние и перезатарены емкости большого объема, содержащие токсичные вещества; демонтирована наземная часть цеха ртутного электролиза, проводится сортировка демонтированных конструкций и отбираются пробы для определения их заражения ртутью и последующей демеркуризации; ликвидированы две наиболее опасные скважины глубинного захоронения отходов; формируется противофильтрационная защита, предотвращающая попадание нефтяных продуктов в Ангару.
Все мероприятия на промлощадке проводятся максимально открыто. В городе создана общественная приемная. Проводятся заседания Экологического совета Иркутской области, созданного при Комиссии по экологии и охране окружающей среды Общественной палаты Российской Федерации. Организуются встречи с представителями общественности, технические туры на промышленную площадку.
В рамках экологического мониторинга ФГБУ «Центр лабораторного анализа и технических измерений по Сибирскому федеральному округу» осуществляет отбор и анализ проб атмосферного воздуха в 500 метрах от промплощадки ООО «Усольехимпром».
На заседании Госсовета РФ в декабре был рассмотрен вопрос, касающийся основных показателей достижения национальной цели «Комфортная и безопасная среда для жизни» по направлению «Экология». Один из показателей – ликвидация наиболее опасных объектов накопленного вреда окружающей среде и экологическое оздоровление водных объектов, включая Байкал. Об этом доложила заместитель Председателя Правительства Российской Федерации Виктория Абрамченко.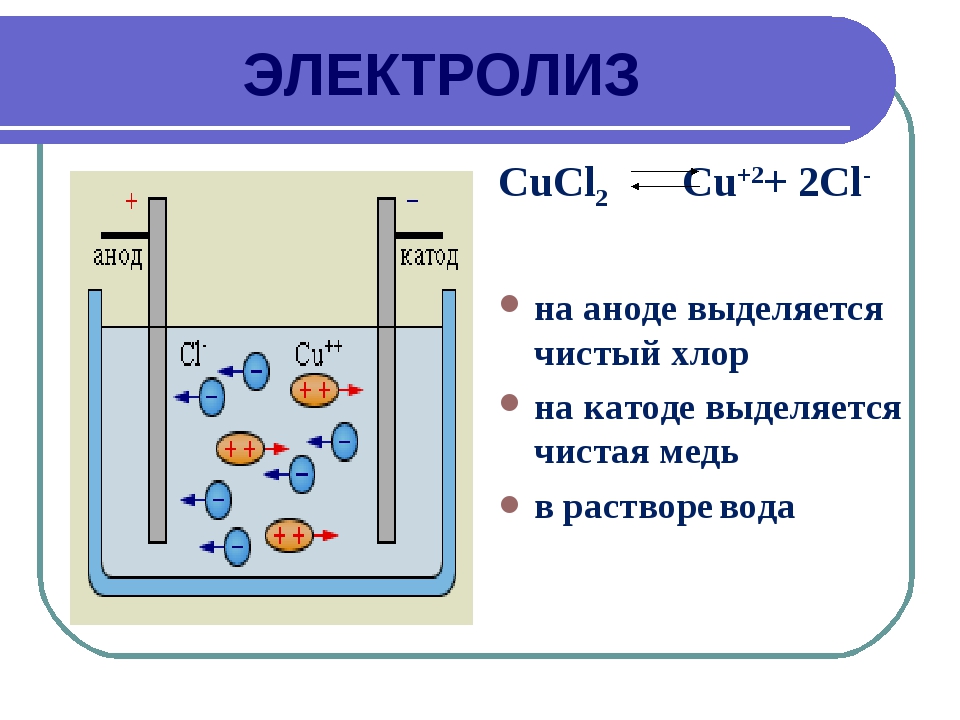
Зампред Правительства подчеркнула, что благодаря Указу Президента о национальных целях развития России на период до 2030 года вопросы экологии в стране выведены на другой, системный, уровень.
– В 2020 году региону при мощной поддержке федерального центра удалось сдвинуть с места решение острых проблем в сфере экологии. Работы, которые в очень короткие сроки развернулись на промплощадке в Усолье-Сибирском, тому пример. В соответствии с «дорожной картой», эти мероприятия будут продолжены. К концу 2024 года в Усолье-Сибирском будет создана новая среда для комфортного проживания граждан. По этому же пути мы пойдем и в решении экологических и социально-экономических проблем в Байкальске, – подчеркнул глава региона Игорь Кобзев.
Электролиз. Электролиз растворов. Электролиз расплавов
Электролиз – это окислительно-восстановительный процесс, который происходит на электродах во время прохождения электрического тока через расплав или раствор.
Электролиз – это ещё один способ получения чистых металлов и неметаллов. Кроме того, электролиз можно провести и в домашних условиях. Нужен источник тока, два электрода (какие электроды бывают и какой в каком случае брать – рассказано дальше) и, конечно, электролит. Электролит – это раствор, который проводит электрический ток.
Различают электролиз растворов и электролиз расплавов. Оба эти процесса существенно отличаются друг от друга. Отличие – в наличии растворителя. При электролизе растворов кроме ионов самого вещества в процессе участвуют ионы растворителя. При электролизе расплавов – только ионы самого вещества.
Для того, чтобы получить нужный продукт (газ, металл или неметалл), нужно правильно выбрать электрод и раствор электролита.
Электродами могут служить любые материалы, проводящие электрический ток.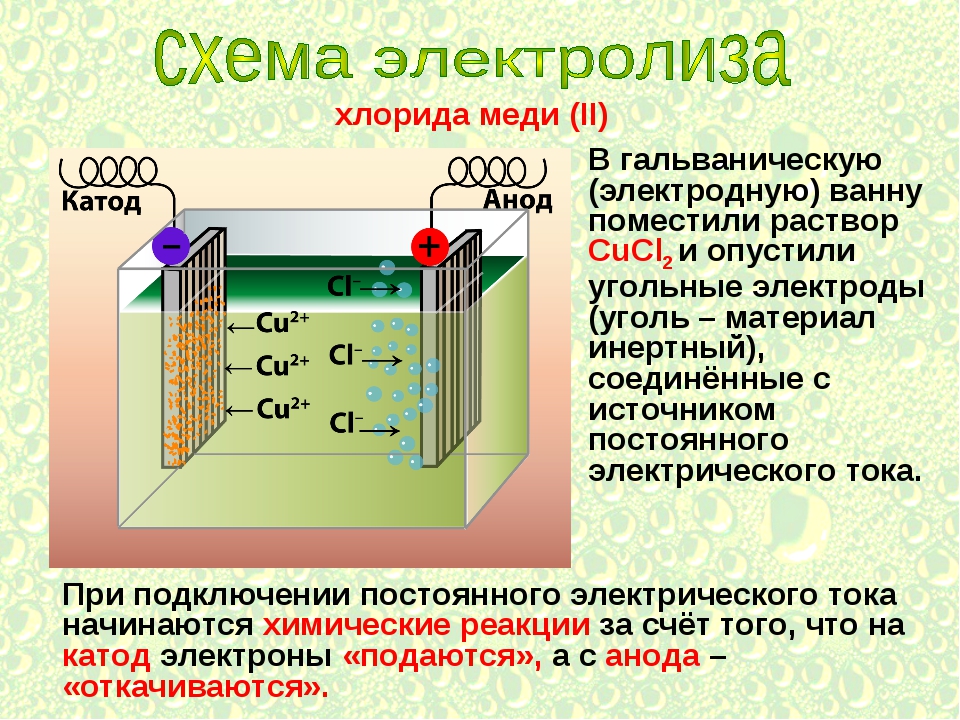 В основном применяют металлы и сплавы, из неметаллов электродами могут служить, например, графитовые стержни (или углерод). Реже в качестве электрода используют жидкости.
В основном применяют металлы и сплавы, из неметаллов электродами могут служить, например, графитовые стержни (или углерод). Реже в качестве электрода используют жидкости.
Электрод, заряженный положительно – анод. Электрод, заряженный отрицательно – катод. При электролизе происходит окисление анода (он растворяется) и восстановление катода. Именно поэтому анод следует брать таким, чтобы его растворение не повлияло на химический процесс, протекающий в растворе или расплаве. Такой анод называют инертным электродом. В качестве инертного анода можно взять графит (углерод) или платину.
В качестве катода можно взять металлическую пластину (она не будет растворяться). Подойдёт медь, латунь, углерод (или графит), цинк, железо, алюминий, нержавейка.
В домашних условиях, из тех веществ, что имеются практически у каждого, можно без труда получить, например, кислород, водород, хлор, медь, серу, а также слабую кислоту или щёлочь! Но будьте осторожны с хлором – этот газ ядовит!
Первый опыт проведём с целью получения водорода и кислорода.
Сделайте электролит из раствора пищевой соды (можно взять кальцинированную соду), опустите туда электроды и включите источник питания. Как только ток пойдёт через раствор, сразу станут заметны пузырьки газа, которые образуются у электродов: у “+” будет выделяться кислород, у “-” водород. Именно такое распределение газов происходит из-за того, что возле анода “+” происходит скопление отрицательных ионов OH–, и восстановление кислорода, а возле катода “-” скапливаются ионы щелочного металла, которые содержатся в кальцинированной соде (Na2CO3), имеющие положительный заряд (Na+) и одновременно происходит восстановление водорода. Восстановлении ионов натрия до чистого металла Na не происходит, так как металл натрий стоит в ряду напряжений металлов левее водорода
Li <K <Rb <Cs <Ba <Ca <Na <Mg <Al <Mn <Cr <Zn <Fe <Cd <Co <Ni <Sn <Pb <h3 <Cu <Ag <Hg <Pt <Au
В следующем опыте по электролизу будем получать чистую медь (Cu).
Для этого нам потребуется раствор медного купороса CuSO4, который содержит растворённую медь. Медь стоит в ряду напряжений металлов после водорода, поэтому она и будет выделятся на электроде. Приготовьте раствор медного купороса, опустите в него электроды и включите источник питания. Как и в предыдущем опыте с раствором кальцинированной соды, на адоде “+” будет восстанавливаться кислород. В то же время катод “-” будет покрываться тёмно-красным слоем меди, которая восстанавливается из раствора до чистого металла.
Мы провели 2 опыта по электролизу растворов и можем подвести результат:
При пропускании тока через раствор на положительном электроде – аноде – восстанавливаются отрицательно заряженные ионы (в нашем случае – кислород). Отрицательно заряженные ионы ещё называют анионами. На отрицательном электроде – катоде – восстанавливаются положительные ионы (в нашем случае это водород и медь). Положительные ионы называют катионами.
Катионами обычно выступают все металлы и водород. Но в некоторых химических соединениях катионами являются газы и неметаллы.
Это зависит от степени окисления элемента в химическом соединении.
Положительные ионы называют катионами.
Катионами обычно выступают все металлы и водород. Но в некоторых химических соединениях катионами являются газы и неметаллы.
Это зависит от степени окисления элемента в химическом соединении.
Проведём ещё один опыт по электролизу. На этот раз мы будем пропускать ток через раствор поваренной соли (NaCl).
Но должен заранее предупредить, этот электролиз нужно проводить в хорошо проветриваемой комнате, так как выделяемый из раствора чистый газ – хлор (Cl2) очень токсичен. Если хотите собрать этот газ (иди какой-нибудь другой), то можно воспользоваться предложенной ниже схемой:
Электролиз раствора поваренной соли. Схема сбора газа
Итак, начнём. Приготовьте раствор поваренной соли (NaCl). К положительному полюсу источника питания подключите инертный электрод (например – графитовый стержень), к отрицательному – подойдёт любой материал, проводящий ток. Опустите в него электроды и включите источник питания. Через несколько секунд уже можно почувствовать неприятный запах хлорки (это хлор!). Не переусердствуйте с запахом! Хлор выделяется в виде мелких пузырьков у анода (“+”). Чем дольше будет длиться процесс электролиза, тем больше концентрация хлора будет возле электролита. Если вы собираете хлор в пробирку или банку (хлор тяжелее воздуха, он будет находится на дне), не пробуйте “нюхать”его в банке – можно сильно отравится! (Статья о хлоре).
На аноде выделяется чистый газ хлор. При этом на катоде из раствора восстанавливается чистый водород (H2) и восстанавливаться натрий, который будет тут же вступать в реакцию с водой, образуя натриевую щёлочь.
Опустите в него электроды и включите источник питания. Через несколько секунд уже можно почувствовать неприятный запах хлорки (это хлор!). Не переусердствуйте с запахом! Хлор выделяется в виде мелких пузырьков у анода (“+”). Чем дольше будет длиться процесс электролиза, тем больше концентрация хлора будет возле электролита. Если вы собираете хлор в пробирку или банку (хлор тяжелее воздуха, он будет находится на дне), не пробуйте “нюхать”его в банке – можно сильно отравится! (Статья о хлоре).
На аноде выделяется чистый газ хлор. При этом на катоде из раствора восстанавливается чистый водород (H2) и восстанавливаться натрий, который будет тут же вступать в реакцию с водой, образуя натриевую щёлочь.
Электролиз расплавов
При электролизе расплавов в процессе участвуют только ионы вещества, которое подвергается электролизу. Например, если подвергнуть электролизу расплав поваренной соли (NaCl), то на аноде будет выделяться тот же газ – хлор, а вот на катоде вместо водорода будет восстанавливаться чистый металл – натрий (Na).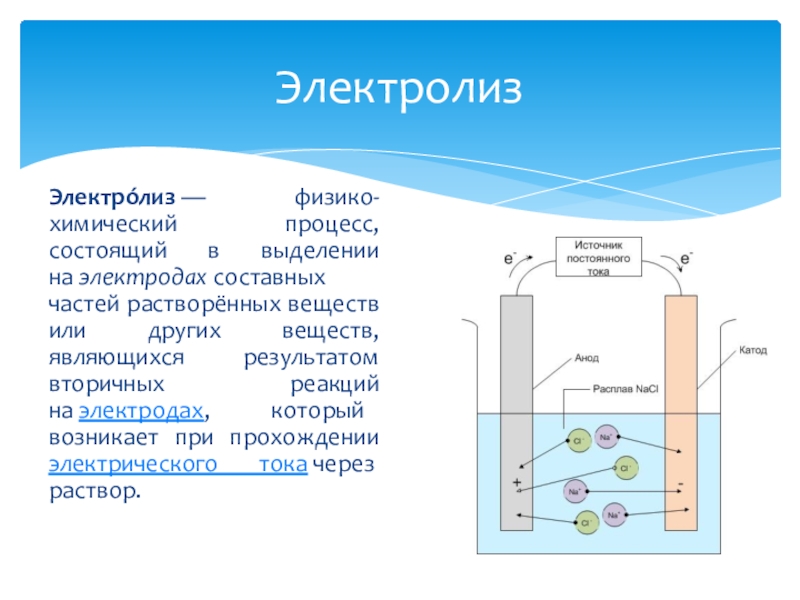 Именно таком способом в промышленности получают металлический натрий и другие щелочные и щелочноземельные металлы.
Таким же образом получают другие щелочные металлы (калий (K), литий (Li), кальций (Ca)), проводя ток через расплавы их солей.
Именно таком способом в промышленности получают металлический натрий и другие щелочные и щелочноземельные металлы.
Таким же образом получают другие щелочные металлы (калий (K), литий (Li), кальций (Ca)), проводя ток через расплавы их солей.
16.7: Электролиз: использование электричества для химии
До сих пор мы обсуждали, как можно производить электричество в результате химических реакций в батареях. Вместо этого некоторые реакции будут использовать электричество, чтобы вызвать реакцию. В этих реакциях реагентам передается электрическая энергия, заставляя их реагировать с образованием продуктов. Эти реакции имеют множество применений. Например, электролиз – это процесс, при котором электричество пропускается через жидкость или раствор, чтобы вызвать реакцию.Реакции электролиза не начнутся, если в систему не будет подана энергия извне. В случае реакций электролиза энергия вырабатывается аккумулятором. Думайте об электролизе и электролитических ячейках как о противоположности электрохимических ячеек:
Ячейки электрохимические | Ячейки электролитические | |
|---|---|---|
| Преобразование энергии | Химический → Электрический | Электрический → Химический |
| Самопроизвольная химическая реакция? | Есть | № |
| Значение E ° | Положительно | отрицательный |
В электрохимической ячейке спонтанная окислительно-восстановительная реакция используется для создания электрического тока; в электролитической ячейке произойдет обратное – потребуется электрический ток, чтобы вызвать несамопроизвольную химическую реакцию.Мы рассмотрим три примера электролитического процесса, сохраняя наше обсуждение на самом базовом уровне: электролиз расплавленного хлорида натрия, электролиз воды и гальваника.
Рисунок 16.7.1: Через воду проходит электрический ток, который расщепляет воду на водород и кислород.Если электроды, подключенные к клеммам батареи, поместить в жидкий хлорид натрия, ионы натрия будут перемещаться к отрицательному электроду и уменьшаться, в то время как ионы хлора перемещаются к положительному электроду и окисляются.-} \ rightarrow 2 \ ce {Na} + \ ce {Cl_2} \]
При соответствующей обработке аккумуляторной батареи можно добиться прочного прилипания восстанавливаемого в процессе электролиза металла к электроду. Использование электролиза для покрытия одного материала слоем металла называется гальваническим покрытием . Обычно гальваника используется для покрытия дешевого металла слоем более дорогого и привлекательного металла. Многие покупают украшения, покрытые золотом. Иногда гальваника используется для получения металла с поверхности, который лучше проводит электричество.Если вы хотите иметь поверхностные свойства золота (привлекательный, коррозионно-стойкий или хороший проводник), но не хотите, чтобы изготовление целого объекта из чистого золота обходилось слишком дорого, ответ может заключаться в использовании дешевого металла. чтобы сделать объект, а затем гальванизировать тонкий слой золота на поверхности.
Рисунок 16.7.2: Серебряное покрытие.Для серебряной пластины такой предмет, как ложка (посуда с покрытием дешевле, чем чистое серебро), ложку помещают на место катода в установке для электролиза с раствором нитрата серебра.При включении тока ионы серебра мигрируют через раствор, касаются катода (ложки) и прилипают к нему. При наличии достаточного количества времени и осторожности всю ложку можно покрыть слоем серебра. Анодом для этой операции часто будет большой кусок серебра, из которого ионы серебра будут окисляться, и эти ионы попадут в раствор. -} \]
Некоторый процент проданных золотых и серебряных украшений гальванизирован.Точки подключения в электрических переключателях часто покрываются золотом для улучшения электропроводности, а большинство хромированных деталей в автомобилях хромированы.
Электролиз расплавленного хлорида натрия
Если мы посмотрим на латинские корни слова «электролиз», мы узнаем, что оно означает, по сути, «разрушение» ( лизис, ) с помощью электричества. В нашем первом примере электролитической ячейки будет рассмотрено, как можно использовать электрический ток для разделения ионного соединения на его элементы.Следующее уравнение представляет собой распад NaCl (-1 ) :
2NaCl ( л ) → 2Na ( л ) + Cl 2 (г)
В этом процессе участвуют следующие полуреакции:
E ° | |||
| уменьшение | 2Na + (л) + 2e – → Na (с) | -2.71 В | |
| окисление | Класс – (л) → Класс 2 (г) + 2 e – | -1,36 В | |
Требуемое сетевое напряжение | – 4.07V | ||
Обратите внимание, что при сложении полуреакций получается отрицательное напряжение (-4,07 В). Это говорит нам о том, что общая реакция НЕ будет спонтанной, и для того, чтобы эта реакция произошла, потребуется минимум 4,07 вольт.
Как мы увидим, наша установка будет во многом похожа на наши электрохимические ячейки. Нам потребуются электроды и электролит для протекания электрического тока.
В нашем примере с NaCl электроды просто пропускают ток, но в противном случае они не будут напрямую участвовать в реакции.Электролитом будет фактический расплавленный (расплавленный) NaCl. Электроды и электролит должны пропускать электрический ток. Необходимо использовать расплавленный NaCl, поскольку твердые ионные соединения не несут электрический заряд.
Некоторые ключевые отличия от устройства электрохимической ячейки:
- Две половинные реакции не разделены солевым мостиком.
- Потребуется электрохимический элемент (или другой источник электрического тока).
Другое важное примечание:
- Анод электролитической ячейки является местом окисления, а катод – местом восстановления, как и в электрохимической ячейке.
- В электрохимической ячейке анод отрицательный, а катод положительный, но в электролитической ячейке все наоборот – анод положительный, а катод отрицательный.
Внимательно изучите схему нашей установки, уделяя особое внимание отслеживанию пути электронов. Пока электроны не совершат полный цикл, реакция не произойдет.
- Электроны «производятся» в батарее на аноде, в месте окисления.
- Электроны покидают электрохимическую ячейку через внешнюю цепь.
- Эти отрицательные электроны создают в электролитической ячейке отрицательный электрод, который притягивает положительные ионы Na + в электролите. Ионы Na + соединяются со свободными электронами и восстанавливаются (2Na + + 2e – → Na).
- Между тем, отрицательный Cl – притягивается к положительному электроду электролитической ячейки. На этом электроде хлор окисляется, высвобождая электроны (Cl – → Cl 2 + 2 e – ).
- Эти электроны проходят через внешнюю цепь, возвращаясь в электрохимическую ячейку.
Электролиз воды
Наш второй пример электролиза и электролитических ячеек включает разложение воды. Мы обнаружим ситуацию, очень похожую на электролиз расплавленного NaCl. Следующее уравнение представляет разделение H 2 O ( l ) :
2H 2 O ( л ) → 2H 2 ( г ) + O 2 (г)
Может быть труднее предсказать вовлеченные полуреакции, но они:
E ° | |||
| уменьшение | 2H 2 O ( л ) + 2e – → H 2 + 2 OH – | -0.83 В | |
| окисление | 2H 2 O ( л ) → O 2 + 4H + + 4e – | -1,23 В | |
| (см. Примечание ниже для уравнения сети) | |||
Требуемое сетевое напряжение | – 2.06V | ||
Настройка будет очень похожа на наш последний пример с некоторыми небольшими отличиями. Вода плохо переносит заряд, поэтому в воду добавляется электролит. Можно использовать уксус или слабую кислоту (уксусную кислоту). Для сбора образовавшихся газов водорода и кислорода часто добавляют перевернутые пробирки, как показано на схеме ниже.
Опять же, будьте особенно внимательны, чтобы проследить путь электронов. Пока электроны не совершат полный цикл, реакция не произойдет.
2H 2 O ( л ) + 2e – → H 2 ( г ) + 2 OH – (водн.)
2H 2 O ( л ) → O 2 (г) + 4H + (водн.) + 4e –
- Электроны «производятся» в батарее на аноде, в месте окисления.
- Электроны покидают электрохимическую ячейку через внешнюю цепь.
- Эти отрицательные электроны создают в электролитической ячейке отрицательный электрод, который вызывает уменьшение содержания воды.
Обратите внимание, что область вокруг этого электрода станет основной по мере образования ионов OH – .
- Тем временем вода в положительном электроде будет окисляться.
- Электроны, образующиеся в процессе окисления, возвращаются в электрохимическую ячейку.
Примечание к вычисленному уравнению электролиза воды:
Из полуреакций вы можете заметить, что сложение уравнений изначально не дает нам нашего чистого уравнения:
2H 2 O ( л ) → 2H 2 ( г ) + O 2 (г)
После того, как вы уравновесите количество электронов (умножьте уравнение редукции на 2), вы обнаружите, что на самом деле сумма уравнений составляет:
6H 2 O ( л ) → 2H 2 ( г ) + O 2 (г) + 4H + (водн.) + 4 OH – (водн. )
Ионы водорода и гидроксида объединятся с образованием 4 моль H 2 O ( l ) .Определение чистого количества H 2 O ( l ) дает нам окончательное уравнение:
2H 2 O ( л ) → 2H 2 ( г ) + O 2 (г)
Сводка
- Электрохимические ячейки состоят из анода и катода в двух отдельных решениях. Эти растворы соединены солевым мостиком и токопроводящим проводом.
- Электрический ток состоит из потока заряженных частиц.
- Электрод, на котором происходит окисление, называется анодом, а электрод, на котором происходит восстановление, называется катодом.
- В гальванике объект, который нужно покрыть, делают катодом.
Словарь
- Электрохимический элемент – Расположение электродов и ионных растворов, в котором окислительно-восстановительная реакция используется для производства электричества (также известного как батарея).
- Электролиз – Химическая реакция, вызванная электрическим током.
- Гальваника – Процесс, в котором электролиз используется как средство покрытия объекта слоем металла.
Материалы и авторство
Эта страница была создана на основе содержимого следующими участниками и отредактирована (тематически или всесторонне) командой разработчиков LibreTexts в соответствии со стилем, представлением и качеством платформы:
Фонд CK-12 Шэрон Бьюик, Ричард Парсонс, Тереза Форсайт, Шонна Робинсон и Жан Дюпон.
Электролиз | Химия для майоров
Результаты обучения
- Описать процесс электролиза
- Сравнить работу электролитических ячеек с работой гальванических элементов
- Выполнение стехиометрических расчетов электролитических процессов
Электрохимические ячейки, в которых происходят спонтанные окислительно-восстановительные реакции ( гальванических элементов ), до сих пор были темой обсуждения в этой главе.В этих ячейках электрическая работа выполняется окислительно-восстановительной системой в его окружении , поскольку электроны, образующиеся в результате окислительно-восстановительной реакции, передаются через внешнюю цепь. В этом последнем разделе главы будет рассмотрен альтернативный сценарий, в котором внешняя цепь действительно работает в окислительно-восстановительной системе , подавая напряжение, достаточное для запуска в противном случае несамопроизвольной реакции, процесса, известного как электролиз . Знакомый пример электролиза – это перезарядка батареи, которая включает использование внешнего источника питания для запуска спонтанной (разрядной) реакции ячейки в обратном направлении, восстанавливая до некоторой степени состав полуэлементов и напряжение батареи.Возможно, менее знакомо использование электролиза при очистке металлических руд, производстве товарных химикатов и нанесение гальванического покрытия металлических покрытий на различные продукты (например, ювелирные изделия, посуда, автозапчасти). Чтобы проиллюстрировать основные концепции электролиза, мы рассмотрим несколько конкретных процессов.
Электролиз расплавленного хлорида натрия
Металлический натрий, Na и газообразный хлор, Cl 2 , используются во многих областях, и их промышленное производство основано на крупномасштабном электролизе расплавленного хлорида натрия, NaCl (-1 ).- (l) \ longrightarrow 2 \ text {Na} (l) + \ text {Cl} _2 (g) [/ latex]
Потенциал ячейки для вышеуказанного процесса отрицательный, что указывает на то, что реакция, как написано (разложение жидкого NaCl), не является спонтанным. Чтобы вызвать эту реакцию, к ячейке должен быть приложен положительный потенциал , величина которого превышает отрицательный потенциал ячейки .
Рис. 1. Ячейки этого типа (ячейка для электролиза расплавленного хлорида натрия) используются в процессе Даунс для производства натрия и хлора, и в них обычно используются железные катоды и угольные аноды.{\ circ} _ \ text {cell} = -1,229 \ text {V} [/ latex]
Опять же, потенциал ячейки, как написано, отрицательный, что указывает на неспонтанную реакцию ячейки, которая должна быть вызвана приложением напряжения ячейки выше +1,229 В. Имейте в виду, что стандартные электродные потенциалы используются здесь для получения термодинамических прогнозов, хотя ячейка , а не , работающая в стандартных государственных условиях. Поэтому в лучшем случае рассчитанные потенциалы клеток следует рассматривать как приблизительные оценки.
Рисунок 2.Электролиз воды производит стехиометрические количества газообразного кислорода на аноде и водорода на аноде.
Электролиз водного хлорида натрия
Когда водные растворы ионных соединений подвергаются электролизу, анодные и катодные полуреакции могут включать электролиз либо компонентов воды (H 2 O, H + , OH –), либо растворенных веществ (катионы и анионы соединения). Например, электролиз водного хлорида натрия может включать любую из этих двух анодных реакций:
(i) [латекс] 2 \ text {Cl} ^ – (aq) \ longrightarrow \ text {Cl} _2 (g) + 2 \ text {e} ^ – \, \, \, \, \, \, \, \ text {E} ^ \ circ _ {\ text {анод}} = +1.\ circ _ {\ text {анод}} = +1.229 \ text {V} [/ latex]
Стандартные электродные потенциалы ( восстановления ) этих двух полуреакций показывают, что вода может быть окисленной на с менее отрицательным / более положительным потенциалом (–1,229 В), чем ион хлорида (–1,358 В). Таким образом, термодинамика предсказывает, что вода будет более легко окисляться, хотя на практике наблюдается, что и вода, и хлорид-ион окисляются в типичных условиях, образуя смесь кислорода и газообразного хлора.\ circ _ {\ text {cathode}} = −2,71 \ text {V} [/ latex]
Сравнение этих стандартных потенциалов полуреакции показывает, что восстановление иона водорода является термодинамически благоприятным. Однако в нейтральном водном растворе хлорида натрия концентрация иона водорода намного ниже стандартного значения состояния 1 M (приблизительно 10 -7 M ), и поэтому наблюдаемая катодная реакция на самом деле является восстановлением воды. \ circ _ {\ text {cell}} = – 2.186 \ text {V} [/ latex] Эта реакция электролиза является частью хлорно-щелочного процесса , используемого в промышленности для производства хлора и гидроксида натрия (щелока).
Гальваника
Важным применением электролитических ячеек является гальваника . Гальваника приводит к тонкому покрытию одного металла поверх проводящей поверхности. Причины нанесения гальванического покрытия включают повышение устойчивости объекта к коррозии, укрепление поверхности, получение более привлекательной отделки или очистку металла.Металлы, обычно используемые в гальванике, включают кадмий, хром, медь, золото, никель, серебро и олово. Обычные потребительские товары включают посеребренную или позолоченную посуду, хромированные автомобильные детали и ювелирные изделия. Мы можем получить представление о том, как это работает, исследуя, как производится посеребренная посуда (рис. 3).
Рис. 3. Ложка, сделанная из недорогого металла, подключена к отрицательной клемме источника напряжения и действует как катод. – \ longrightarrow \ text {Ag} (s) [/ latex]
Конечный результат – перенос металлического серебра с анода на катод.Для получения высококачественного серебряного покрытия необходимо тщательно контролировать несколько экспериментальных факторов, включая точный состав раствора электролита, приложенное напряжение ячейки и скорость реакции электролиза (электрический ток).
Количественные аспекты электролиза
Электрический ток определяется как скорость потока для любых заряженных частиц. Наиболее актуальным для этого обсуждения является поток электронов. Ток измеряется в сложной единице, называемой ампером, и определяется как один кулон в секунду (A = 1 Кл / с).- \ longrightarrow \ text {M} (s) [/ latex]
предполагает передачу n моль электронов. Таким образом, переданный сбор составляет
. [латекс] Q = нФ [/ латекс], где F – постоянная Фарадея, заряд в кулонах на один моль электронов. Если реакция происходит в электрохимической ячейке, ток удобно измерять, и его можно использовать для помощи в стехиометрических расчетах, связанных с реакцией ячейки.
Вы можете просмотреть стенограмму «Что такое электролиз | Реакции | Химия | FuseSchool »здесь (открывается в новом окне).
Пример 1: Преобразование тока в моли электронов
В одном процессе, используемом для гальваники серебра, ток силой 10,23 А пропускали через электролитическую ячейку в течение ровно 1 часа. Сколько молей электронов прошло через ячейку? Какая масса серебра была нанесена на катод из раствора нитрата серебра?
Показать решениеПостоянная Фарадея может использоваться для преобразования заряда ( Q ) в моль электронов ( n ). Заряд – это ток ( I ), умноженный на время
[латекс] \ displaystyle {n} = \ frac {Q} {F} = \ frac {\ frac {10.-} \ times \ dfrac {107.9 \ text {g Ag}} {1 \ text {mol Ag}} = 41.19 \ text {g Ag} [/ latex]
Проверьте свой ответ: исходя из стехиометрии, из 1 моля электронов получается 1 моль серебра. Было задействовано менее половины моля электронов и было произведено менее половины моля серебра.
Проверьте свои знания
Металлический алюминий может быть получен из ионов алюминия электролизом. Какая будет половинная реакция на катоде? Какая масса металлического алюминия будет восстановлена, если ток 25?- \ longrightarrow \ text {Al} (s) [/ latex]; 0,0777 моль Al = 2,10 г Al.
Пример 2: Время, необходимое для осаждения
В одном применении слой хрома толщиной 0,010 мм должен быть нанесен на деталь с общей площадью поверхности 3,3 м 2 из раствора, содержащего ионы хрома (III). Сколько времени нужно, чтобы нанести слой хрома, если ток равен 33,46 А? Плотность хрома (металла) 7,19 г / см 3 .
Показать решениеЭта проблема связана с рядом рассмотренных ранее тем.Схема того, что необходимо сделать:
- Если можно определить общий заряд, необходимое время – это просто заряд, деленный на текущий
- Общий заряд может быть получен из необходимого количества Cr и стехиометрии
- Количество Cr может быть получено с использованием требуемой плотности и объема Cr
- Требуемый объем Cr равен толщине, умноженной на площадь
Решая поэтапно и заботясь о единицах, требуемый объем Cr составляет
[латекс] \ text {volume} = \ left (\ text {0.4 \ text {s} = 11.0 \ text {hr} [/ latex]
Проверьте свой ответ: В такой длинной задаче одной проверки, вероятно, недостаточно. Каждый из шагов дает разумное число, так что все, вероятно, правильно. Обратите особое внимание на преобразование единиц измерения и стехиометрию.
Проверьте свои знания
Какая масса цинка требуется для цинкования верхней части листа железа размером 3,00 м × 5,50 м до толщины 0,100 мм цинка? Если цинк поступает из раствора Zn (NO 3 ) 2 и ток равен 25.5 А сколько времени займет гальванизация верха утюга? Плотность цинка 7,140 г / см 3 .
Показать решение11,8 кг Zn требуется 382 часа.
Основные понятия и краткое изложение
Непонтанные окислительно-восстановительные процессы могут быть вызваны в электрохимических ячейках приложением соответствующего потенциала с использованием внешнего источника энергии – процесс, известный как электролиз. Электролиз является основой некоторых процессов переработки руды, промышленного производства многих химических товаров и нанесения гальванических покрытий на различные продукты.Измерение силы тока во время электролиза позволяет проводить стехиометрические расчеты.
Ключевые уравнения
- [латекс] Q = I \ times {t} = n \ times {F} [/ латекс]
Попробуй
- Укажите реакцию на аноде, реакцию на катоде, общую реакцию и приблизительный потенциал, необходимый для электролиза следующих расплавов солей. Предположим, что стандартные состояния и стандартные восстановительные потенциалы в потенциалах стандартного электрода (полуэлемента) такие же, как и в каждой из точек плавления.Предположим, что КПД равен 100%.
- CaCl 2
- LiH
- AlCl 3
- CrBr 3
- Какая масса каждого продукта производится в каждой из электролитических ячеек предыдущей задачи, если через каждую ячейку проходит общий заряд 3,33 × 105 Кл? Предположим, что напряжения достаточно для уменьшения.
- Сколько времени нужно, чтобы восстановить 1 моль каждого из следующих ионов с помощью указанного тока? Предположим, что напряжения достаточно для уменьшения.
- Al 3+ , 1,234 A
- Ca 2+ , 22,2 А
- Cr 5+ , 37,45 A
- Au 3+ , 3,57 А
- Ток в 2,345 А проходит через элемент, показанный на рисунке, в течение 45 минут. Какой объем водорода собирается при комнатной температуре, если давление составляет ровно 1 атм? Предположим, что напряжения достаточно для уменьшения. (Подсказка: водород – единственный газ, присутствующий над водой?)
- Металлическая деталь неправильной формы, изготовленная из определенного сплава, была оцинкована цинком с использованием раствора Zn (NO 3 ) 2 .При использовании силы тока 2,599 А для нанесения на деталь слоя цинка толщиной 0,01123 мм требовалось ровно 1 час. Какова была общая площадь поверхности детали? Плотность цинка 7,140 г / см 3 . Предположим, что КПД равен 100%.
2. Массы следующие:
- масса Ca = 69,1 г; масса Cl 2 = 122 г
- масса Li = 23,9 г; масса H 2 = 3,48 г
- масса Al = 31,0 г; масса Cl 2 = 122 г
- масса Cr = 59.8 г; масса Br 2 = 276 г
4. 0,79 л
Глоссарий
электролиз: процесс, использующий электрическую энергию для возникновения несамопроизвольного процесса
электролитическая ячейка: электрохимическая ячейка, в которой используется электролиз; ячейка электрохимическая с отрицательным потенциалом ячейки
гальваника: нанесение тонкого слоя одного металла поверх проводящей поверхности
перенапряжение: разность между теоретическим потенциалом и фактическим потенциалом в электролитической ячейке; «дополнительное» напряжение, необходимое для возникновения некоторой несамопроизвольной электрохимической реакции
17.7 Электролиз – Химия 112 – Главы 12-17 OpenStax General Chemistry
Цели обучения
К концу этого раздела вы сможете:
- Описать электролитические ячейки и их связь с гальваническими элементами
- Выполнение различных расчетов, связанных с электролизом
В гальванических элементах химическая энергия преобразуется в электрическую. Обратное верно для электролитических ячеек. В электролитических ячейках электрическая энергия вызывает неспонтанные реакции в процессе, известном как электролиз .Зарядный электромобиль, изображенный в главе 18 «Введение» в начале этой главы, демонстрирует один из таких процессов. Электрическая энергия преобразуется в химическую энергию в аккумуляторе по мере его зарядки. После зарядки аккумулятор можно использовать для питания автомобиля.
В электролитических ячейках используются те же принципы, что и в гальванических элементах. Мы рассмотрим три электролитических ячейки и количественные аспекты электролиза.
В расплавленном хлориде натрия ионы могут свободно перемещаться к электродам электролитической ячейки.{\ circ} = -4.0 \; \ text {V} \ end {array} [/ latex]
Источник питания (аккумулятор) должен обеспечивать минимум 4 В, но на практике применяемые напряжения обычно выше из-за неэффективности самого процесса.
Рисунок 1. При пропускании электрического тока через расплавленный хлорид натрия материал разлагается на металлический натрий и газообразный хлор. Необходимо следить за тем, чтобы продукты были разделены, чтобы предотвратить самопроизвольное образование хлорида натрия.Электролизом можно разделить воду на водород и кислород.{\ circ} = -1,229 \; \ text {V} \ end {array} [/ latex]
Обратите внимание, что серная кислота не расходуется, и что объем произведенного газообразного водорода в два раза превышает объем произведенного газообразного кислорода. Минимальное подаваемое напряжение 1,229 В.
Рисунок 2. Вода разлагается на кислород и водород во время электролиза. Серная кислота была добавлена для увеличения концентрации ионов водорода и общего количества ионов в растворе, но не принимает участия в реакции. Объем собранного газообразного водорода в два раза больше объема собранного газообразного кислорода из-за стехиометрии реакции.{\ circ} = +1.229 \; \ text {V} \ end {array} [/ latex]Эти значения предполагают, что вода должна окисляться на аноде, потому что потребуется меньший потенциал – использование реакции (ii) для окисления даст менее отрицательный потенциал ячейки. Когда эксперимент проводится, выясняется, что на аноде образуется хлор, а не кислород. Неожиданный процесс настолько распространен в электрохимии, что получил название перенапряжения. Перенапряжение – это разница между теоретическим напряжением ячейки и фактическим напряжением, необходимым для электролиза.{\ circ} = -2,71 \; \ text {V} \ end {array} [/ latex]
Реакция (v) исключена, потому что она имеет такой отрицательный восстановительный потенциал. В стандартных условиях реакция (iii) была бы предпочтительнее реакции (iv). Однако pH раствора хлорида натрия равен 7, поэтому концентрация ионов водорода составляет всего 1 × 10 −7 M . При таких низких концентрациях реакция (iii) маловероятна и происходит реакция (iv). {\ circ} = -2.186 \; \ text {V} [/ латекс]
По мере протекания реакции ионы гидроксида замещают ионы хлора в растворе. Таким образом, гидроксид натрия можно получить путем испарения воды после завершения электролиза. Гидроксид натрия ценен сам по себе и используется для таких вещей, как очиститель для духовок, открывалка для слива, а также при производстве бумаги, тканей и мыла.
Гальваника
Важным применением электролитических ячеек является гальваника . Гальваника приводит к тонкому покрытию одного металла поверх проводящей поверхности.Причины нанесения гальванического покрытия включают повышение устойчивости объекта к коррозии, укрепление поверхности, получение более привлекательной отделки или очистку металла. Металлы, обычно используемые в гальванике, включают кадмий, хром, медь, золото, никель, серебро и олово. Обычные потребительские товары включают посеребренную или позолоченную посуду, хромированные автомобильные детали и ювелирные изделия. Мы можем получить представление о том, как это работает, исследуя, как производится посеребренная посуда (рис. 3).
Рисунок 3. Ложка, сделанная из недорогого металла, подключается к отрицательной клемме источника напряжения и действует как катод. Анод – серебряный электрод. Оба электрода погружены в раствор нитрата серебра. Когда через раствор пропускают постоянный ток, в конечном итоге металлическое серебро удаляется с анода и осаждается на катоде.На рисунке анод состоит из серебряного электрода, показанного слева. Катод расположен справа и представляет собой ложку, которая изготовлена из недорогого металла.{-} \; {\ longrightarrow} \; \ text {Ag} (s) [/ latex]
Конечный результат – перенос металлического серебра с анода на катод. Качество объекта обычно определяется толщиной наплавленного серебра и скоростью наплавки.
Величина тока, который может протекать в электролитической ячейке, зависит от количества молей электронов. Количество молей электронов может быть связано с реагентами и продуктами с использованием стехиометрии. Напомним, что единицей СИ для тока ( I ) является ампер (А), что эквивалентно 1 кулону в секунду (1 А = 1 [латекс] \ frac {\ text {C}} {\ text {s }}[/латекс]).Общий заряд ( Q в кулонах) равен
.[латекс] Q = I \; \ times \; t = n \; \ times \; F [/ латекс]
Где t – время в секундах, n – количество молей электронов, а F – постоянная Фарадея.
Моли электронов могут быть использованы в задачах стехиометрии. Также может быть запрошено время, необходимое для внесения определенного количества металла, как во втором из следующих примеров.
Пример 1
Преобразование тока в моль электронов
В одном процессе, используемом для гальваники серебра, ток равен 10.23 А пропускали через электролитическую ячейку ровно за 1 час. Сколько молей электронов прошло через ячейку? Какая масса серебра была нанесена на катод из раствора нитрата серебра?
Раствор
Константу Фарадея можно использовать для преобразования заряда ( Q ) в моли электронов ( n ). { -}} = 0.{-}} \; \ times \; \ frac {107.9 \; \ text {g \; Ag}} {1 \; \ text {mol \; Ag}} = 41.19 \; \ text {g \; Ag} [/ латекс]
Проверьте свой ответ: исходя из стехиометрии, из 1 моля электронов получается 1 моль серебра. Было задействовано менее половины моля электронов и было произведено менее половины моля серебра.
Проверьте свои знания
Металлический алюминий можно получить из ионов алюминия электролизом. Какая будет половинная реакция на катоде? Какая масса металлического алюминия будет восстановлена, если ток 2?{-} \; {\ longrightarrow} \; \ text {Al} (s) [/ latex]; 7,77 моль Al = 210,0 г Al.
Пример 2
Время, необходимое для осаждения
В одном случае слой хрома толщиной 0,010 мм должен быть нанесен на деталь с общей площадью поверхности 3,3 м 2 из раствора, содержащего ионы хрома (III). Сколько времени нужно, чтобы нанести слой хрома, если ток равен 33,46 А? Плотность хрома (металла) 7,19 г / см 3 .
Решение
Эта проблема связана с рядом рассмотренных ранее тем.Схема того, что необходимо сделать:
- Если можно определить общий заряд, необходимое время – это просто заряд, деленный на текущий
- Общий заряд может быть получен из необходимого количества Cr и стехиометрии
- Количество Cr может быть получено с использованием требуемой плотности и объема Cr
- Требуемый объем Cr равен толщине, умноженной на площадь
Решая поэтапно и заботясь о единицах, требуемый объем Cr составляет
[латекс] \ text {volume} = (0.4 \; \ text {s} = 11.0 \; \ text {hr} [/ latex]
Проверьте свой ответ: В такой длинной задаче одной проверки, вероятно, недостаточно. Каждый из шагов дает разумное число, так что все, вероятно, правильно. Обратите особое внимание на преобразование единиц измерения и стехиометрию.
Проверьте свои знания
Какая масса цинка требуется для гальванизации верхней части листа железа размером 3,00 м × 5,50 м до толщины 0,100 мм цинка? Если цинк поступает из раствора Zn (NO 3 ) 2 и ток равен 25.5 А сколько времени займет гальванизация верха утюга? Плотность цинка 7,140 г / см 3 .
Ответ:
231 г Zn потребовалось 446 минут.
Электролиз – это использование электричества для инициирования непредвиденного процесса. Электролитические ячейки – это электрохимические ячейки с отрицательными потенциалами ячейки (что означает положительную свободную энергию Гиббса), и поэтому они не являются спонтанными. Электролиз может происходить в электролитических ячейках при включении источника питания, который подает энергию, заставляющую электроны течь в неспонтанном направлении.Электролиз проводится в растворах, которые содержат достаточно ионов для протекания тока. Если раствор содержит только один материал, например, при электролизе расплавленного хлорида натрия, легко определить, что окисляется, а что восстанавливается. В более сложных системах, таких как электролиз водного хлорида натрия, более одного вида могут быть окислены или восстановлены, и стандартные восстановительные потенциалы используются для определения наиболее вероятного окисления (полуреакция с наибольшим [наиболее положительным] стандартным восстановительным потенциалом. ) и восстановления (полуреакция с наименьшим [наименее положительным] стандартным восстановительным потенциалом).Иногда из-за перенапряжения возникают неожиданные полуреакции. Перенапряжение – это разница между теоретическим потенциалом восстановления полуреакции и фактическим требуемым напряжением. Если он присутствует, приложенный потенциал должен быть увеличен, чтобы в электролитической ячейке могла произойти другая реакция. Полный заряд, Q , который проходит через электролитическую ячейку, может быть выражен как ток ( I ), умноженный на время ( Q = It ), или как моль электронов ( n ), умноженная на постоянную Фарадея. ( Q = нФ ).Эти отношения могут использоваться для определения таких вещей, как количество материала, используемого или образованного во время электролиза, как долго должна продолжаться реакция или какое значение тока требуется.
Химия: упражнения в конце главы
- Укажите реакцию на аноде, реакцию на катоде, общую реакцию и приблизительный потенциал, необходимый для электролиза следующих расплавов солей. Предположим, что стандартные состояния и стандартные восстановительные потенциалы в Приложении L такие же, как и при каждой из точек плавления.Предположим, что КПД равен 100%.
(а) CaCl 2
(б) LiH
(в) AlCl 3
(г) CrBr 3
- Какая масса каждого продукта образуется в каждой из электролитических ячеек предыдущей задачи, если через каждую ячейку проходит общий заряд 3,33 × 10 5 Кл? Предположим, что напряжения достаточно для уменьшения.
- Сколько времени нужно, чтобы восстановить 1 моль каждого из следующих ионов с помощью указанного тока? Предположим, что напряжения достаточно для уменьшения.
(а) Al 3+ , 1,234 A
(б) Ca 2+ , 22,2 A
(в) Cr 5+ , 37,45 A
(г) Au 3+ , 3,57 A
- Ток в 2,345 А проходит через элемент, показанный на рисунке 2, в течение 45 минут. Какой объем водорода собирается при комнатной температуре, если давление составляет ровно 1 атм? Предположим, что напряжения достаточно для уменьшения. (Подсказка: водород – единственный газ, присутствующий над водой?)
- Металлическая деталь неправильной формы, изготовленная из определенного сплава, была оцинкована цинком с использованием раствора Zn (NO 3 ) 2 .При использовании силы тока 2,599 А для нанесения на деталь слоя цинка толщиной 0,01123 мм требовалось ровно 1 час. Какова была общая площадь поверхности детали? Плотность цинка 7,140 г / см 3 . Предположим, что КПД равен 100%.
Глоссарий
- электролиз
- процесс, использующий электрическую энергию для возникновения несамопроизвольного процесса
- электролизер Электрохимическая ячейка
- , в которой используется электролиз; электрохимическая ячейка с отрицательными потенциалами ячейки
- гальваника
- нанесение тонкого слоя одного металла поверх проводящей поверхности
- перенапряжение
- разность между теоретическим потенциалом и фактическим потенциалом в электролитической ячейке; «дополнительное» напряжение, необходимое для возникновения некоторой несамопроизвольной электрохимической реакции
Решения
Ответы на упражнения в конце главы по химии
2.(a) [латекс] \ begin {array} {r @ {{} = {}} l} \ text {mass \; Ca} & 69.1 \; \ text {g} \\ [0.5em] \ text {mass \; Cl} _2 & 122 \; \ text {g} \ end {array} [/ latex]; (б) [латекс] \ begin {array} {r @ {{} = {}} l} \ text {mass \; Li} & 23.9 \; \ text {g} \\ [0.5em] \ text {mass \; H} _2 & 3.48 \; \ text {g} \ end {array} [/ latex]; (c) [латекс] \ begin {array} {r @ {{} = {}} l} \ text {mass \; Al} & 31.0 \; \ text {g} \\ [0.5em] \ text {mass \; Cl} _2 & 122 \; \ text {g} \ end {array} [/ latex]; (d) [латекс] \ begin {array} {r @ {{} = {}} l} \ text {mass \; Cr} & 59.8 \; \ text {g} \\ [0.5em] \ text {mass \; Br} _2 & 276 \; \ text {g} \ end {array} [/ latex]
4. 0,79 л
Электролиз: определение, типы и применение – научный класс [видео 2021]
Электролитические ячейки
Для проведения электролиза используются специально разработанные устройства, называемые электролитическими ячейками . Электролитическая ячейка содержит два электрода и раствор с растворенными ионами, называемый электролитами . Также вам понадобится источник электрической энергии, например, аккумулятор.
Электролиз не происходит спонтанно и всегда требует электричества. Когда электроды подключены к батарее (или другому источнику электроэнергии), один становится положительно заряженным, а другой – отрицательно заряженным. Эти заряженные электроды могут затем вступать в реакцию с ионами электролита.
Тип химической реакции, происходящей в электролитической ячейке, называется окислительно-восстановительной реакцией.Отрицательно заряженный электрод, известный как катод , уменьшает положительные ионы, добавляя к ним электроны, создавая нейтральные атомы. В то же время положительно заряженный электрод, известный как анод , окисляет отрицательные ионы, производя больше свободных электронов. Эти две полуреакции генерируют новые химические вещества, а также замыкают цепь с батареей, чтобы ток протекал через элемент.
- Окисление, половина реакции: X- → X + e-
- Восстановление половины реакции: Y + + e- → Y
Электролиз воды
Чтобы понять процесс электролиза, давайте сначала рассмотрим один из самых распространенных и простых электролитических процессов – электролиз воды.В этом процессе молекулы воды (h3 O) расщепляются с образованием как водорода (h3), так и кислорода (O2).
Для проведения электролиза воды вам понадобится электролитическая ячейка с двумя электродами внутри раствора воды с электролитами в ней. Хотя молекулы воды будут диссоциировать на ионы водорода (H +) и гидроксида (OH-), чистая вода не очень хорошо проводит электричество, поэтому вам нужно будет добавить несколько дополнительных ионов, чтобы электролиз стал возможным.
Как только вы подключите электроды к батарее, ионы H + будут восстанавливаться на катоде с образованием газообразного водорода, а молекулы воды будут окисляться на аноде.Результатом этой окислительно-восстановительной реакции является производство как кислорода, так и водорода.
- Реакция восстановления: 2H + + 2e- → h3
- Реакция окисления: 2 h3 O → O2 + 4 H + + 4 e-
- Общий результат реакции: 2 h3 O → 2 h3 + O2
Зачем вам проводить электролиз воды? Водород используется во многих промышленных приложениях, включая производство водородных топливных элементов, и это относительно простой способ его производства.Это также хороший способ получения кислорода, особенно в ситуациях, когда транспортировка большого количества газообразного кислорода не так уж и возможна, как на Международной космической станции. Кислород, которым дышат космонавты на космической станции, создается путем электролиза воды!
Электролиз также обычно используется для извлечения чистых металлов из металлических соединений. Например, металлический натрий можно получить из хлорида натрия (более известного как поваренная соль) с помощью электролиза. Чтобы извлечь металлический натрий, вы должны сначала расплавить хлорид натрия, а затем поместить два электрода в расплавленную соль.Его нужно расплавить, чтобы ионы могли свободно перемещаться. Ионы натрия (Na +) притягиваются к отрицательно заряженному катоду, где они объединяются с электронами с образованием металлического натрия, который осаждается на электроде. На аноде ионы хлора (Cl-) окисляются с образованием свободных электронов и газообразного хлора (Cl2).
Итак, мы имеем следующее:
2NaCl → 2Na + Cl2
Подобный процесс можно использовать для извлечения многих различных типов металлов из природных соединений.
Гальваника
Электролиз также можно использовать для покрытия металлических предметов тонким слоем другого металла. Этот процесс называется гальваника . Чтобы гальванизировать один металл с другим, вам понадобятся два металлических электрода. Металл анода будет окисляться, что приведет к его растворению в растворе на ионы металла. Затем эти ионы осаждаются на катодном металле тонким однородным слоем.
Гальваника используется при производстве пенни, которые в основном состоят из цинка с нанесенным сверху тонким слоем меди.Он также обычно используется для покрытия деталей автомобилей и приборов хромом для повышения их коррозионной стойкости, а также для покрытия недорогих ювелирных изделий золотом или серебром.
Резюме урока
Хорошо, теперь, когда мы завершаем этот урок, давайте уделим пару минут, чтобы просмотреть важную информацию, которую мы узнали.
Как мы видели здесь, электролиз – это процесс использования электричества для разделения химических соединений, вызывающий протекание химической реакции окисления-восстановления.Для проведения электролиза вам понадобится электролитическая ячейка с двумя электродами, известная как катод , или отрицательно заряженный электрод и анод , или положительно заряженный электрод, электролитический раствор растворенных ионов (называемый электролитами ). проводить электричество между ними и источником электрической энергии, например, батареей. Вам также необходимо расплавить хлорид натрия перед проведением электролиза, чтобы ионы натрия и хлора могли перемещаться и проводить электричество между электродами.
Электролиз можно использовать для производства водорода и кислорода из воды (именно так они производят кислород на Международной космической станции!), Для извлечения чистых металлов из металлических соединений и для гальваники гальванического соединения одного металла с другим, что является процесс, при котором электролиз также может использоваться для покрытия металлических предметов тонким слоем другого металла. Мы узнали, что гальваника используется во многих различных областях, от покрытия деталей автомобилей хромом до покрытия пенсов медью.
Изобилие электролиза в нашей жизни невозможно переоценить.
Что такое электролиз? | Мини-химия
Электролиз – это химическое осаждение соединения на составляющие его элементы под действием электрического тока.
- Через соединение пропускается постоянный ток (соединение может быть в расплавленном или водном состоянии).
- Электрическая энергия (от постоянного тока) преобразуется в химическую энергию (разложение соединения).
- Одним из распространенных примеров является электролиз воды, при котором вода разлагается на водород и кислород.
Видео электролиза воды:
Электролитическая ячейка
Основные компоненты электролитической ячейки: батарея, электролиты, электроды
Положительный вывод батареи соединен с положительным электродом (анодом), а отрицательный вывод батареи соединен с отрицательным электродом (катодом).
Электролиты обычно состоят из ионного соединения в растворе или расплавленном состоянии ИЛИ водных растворов кислот или щелочей.
- Электролиты проводят электричество с разложением на электродах.
- Электролиты можно разделить на три категории: неэлектролиты, слабые электролиты и сильные электролиты.
- Сильные электролиты = много ионов, переносящих заряды от одного электрода к другому. Примеры сильных электролитов: сильные кислоты или щелочи (серная кислота, водный гидроксид натрия), солевые растворы (водный хлорид натрия)
- Слабые электролиты = небольшое количество ионов, переносящих заряды от одного электрода к другому.Примеры слабых электролитов: слабые кислоты или основания (этановая кислота, водный аммиак)
- Неэлектролиты = нет ионов, переносящих заряды от одного электрода к другому. Примеры неэлектролитов: чистая вода, органические жидкости или растворители
Электроды – это проводники, через которые электроны входят в электролит и покидают его.
- Анод – это ПОЛОЖИТЕЛЬНЫЙ (+) электрод, с которого электроны покидают электролит (или электрический ток входит в электролит)
- Катод – ОТРИЦАТЕЛЬНЫЙ (-) электрод, с которого электроны входят в электролит (или электрический ток покидает электролит).
- Электроды обычно состоят из инертных материалов (которые не участвуют в окислительно-восстановительных реакциях), таких как углерод, платина, титан или нержавеющая сталь.(ПРИМЕЧАНИЕ: в некоторых случаях электроды подвергаются окислительно-восстановительным реакциям во время электролиза.)
Что происходит во время электролиза?
- Отрицательные ионы (анионы) притягиваются к аноду, а положительные ионы (катионы) притягиваются к катоду.
- Когда ионы достигают своих электродов, они разряжаются. (Они теряют или приобретают электроны и образуют нейтральные атомы)
- Следовательно, на аноде анионы разряжаются за счет потери электронов; в то время как на катоде катионы разряжаются за счет усиления электронов.
электролиз в предложении | Примеры предложений по Кембриджскому словарю
Эти примеры взяты из корпусов и из источников в Интернете. Любые мнения в примерах не отражают мнение редакторов Cambridge Dictionary, Cambridge University Press или его лицензиаров.
Он справедливо сказал, что один из способов получения водорода – это электролиз и электричества.
По своей природе электролиз алюминия имеет чрезвычайно ограниченные возможности для снижения выбросов диоксида углерода.
Что может произойти, если производство вторичного алюминия подлежит обложению налогом на изменение климата, а электролиз при выплавке первичного алюминия – нет?
В настоящее время местные власти имеют право регулировать любое место, где проводят пирсинг ушей, татуаж, иглоукалывание и электролиз .
Электролиз производит водород и кислород, а затем водород хранится в больших морских контейнерах и доставляется на берег.
Раньше электролиз , стоматология и ювелирные изделия не могли обойтись без него.
При электролизе и электролизе сегодня слишком дорого использовать, но это единственный доступный способ.
В свете представлений, полученных в отношении обработки , электролиз , мы предлагаем распространить это на электричество.
В частности, в области электролиза и заводов другие материалы часто могут быть использованы в качестве альтернативы асбесту.
Статья 14 дает советам право требовать надлежащих гигиенических условий для нанесения татуировок, прокалывания ушей или электролиза .
Очевидный способ сделать это, путем электролиза воды, по-прежнему потребовал бы электроэнергии и поэтому не выводит нас из нашей основной проблемы.
Я задал несколько конкретных вопросов, направленных на поощрение развития солнечной фотоэлектрической энергии, которая станет возобновляемым источником, используемым для электролиза как часть благотворного круга.
Если исключить потребность в паре, электричество для электролиза и хлора станет неэкономичным, и весь карточный домик развалится.
Сложность в том, что если мы используем электролиз для производства водорода, мы должны производить электричество чисто, чтобы жизненный цикл топлива был чистым.
Пробирка, наполненная водой и перевернутая в наполненный водой стакан, часто используется для улавливания газов, например в электролизе демонстраций.
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Значительная энергия по-прежнему требуется как для нагрева материалов, так и для электролиза , но это гораздо более энергоэффективно, чем плавление самих оксидов.
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Большинство современных военных подводных лодок генерируют кислород для дыхания путем электролиза воды.
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Анализируемое вещество осаждается просто путем адсорбции на поверхности электрода (т. Е. Без , электролиз ), а затем подвергается электролизу с получением аналитического сигнала.
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.В конце он превращается в сульфат таллия, и таллий экстрагируется электролизом на пластинах из платины или нержавеющей стали.
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Процесс восстановления осуществляется в ячейке для микробиологического электролиза .
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.При технической работе с медицинским электролизером требуются самые мельчайшие меры предосторожности.
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Способы включают водород, полученный посредством электролиза , хранение водорода в транспортном средстве в качестве второго топлива или преобразование обычного топлива в водород с помощью катализатора.
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Прикладывается электрический потенциал, и металлическое олово образуется на катоде посредством электролиза .
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Временные методы удаления включают бритье, стрижку, восковую эпиляцию, шугаринг и депиляцию, в то время как постоянное удаление волос может быть выполнено с помощью электролиза , или лазерной эпиляции.
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Производство водорода из воды с помощью электролиза будет потреблять больше энергии, чем доступно в водороде, потому что обработка всегда имеет ненулевые потери.
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Одним из главных его достижений был способ промышленного синтеза водорода и кислорода путем электролиза (1888).
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Открытие синтеза перекиси водорода путем электролиза с серной кислотой привело к появлению более эффективного электрохимического метода.
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Однако в электролизе электрический ток стимулирует поток электронов в противоположном направлении.
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.В настоящее время чистый газообразный водород невыгодно массово производить путем электролиза , или любыми другими способами.
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Электролиз или нагревание этих соединений может привести к образованию бериллия.
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Такие частицы получают путем электролиза раствора аммония с использованием ртутного катода.
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Серебро сначала модернизируется в кислородном конвертере, а затем очищается электролизом .
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.С помощью электролиза или высокотемпературного нагрева вода может быть разложена на водород и кислород, а затем водород используется в двигателях или топливных элементах.
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Его основные открытия включают в себя электромагнитную индукцию, диамагнетизм и электролиз .
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Водород может быть получен из воды с использованием процесса , электролиза , но этот процесс значительно дороже коммерчески, чем производство водорода из природного газа.
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.В настоящее время металл получают в основном путем электролиза солей магния, полученных из рассола.
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Пример можно найти в окислении воды до кислорода на положительном электроде , электролиз .
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.В настоящее время металл получают в основном путем электролиза и солей магния, полученных из рассола.
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Процесс электролиза плавленой соли проводят при температурах, достаточных для поддержания как электролита, так и производимого металла в расплавленном состоянии.
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Электролиз водного раствора хлорида натрия с медными электродами производит (среди прочего) сине-зеленую пену, которую можно собрать и превратить в гидрат.
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Некоторые промышленно важные активные металлы (которые сильно реагируют с водой) производятся в промышленных масштабах путем электролиза и их пирохимических расплавленных солей.
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Высокореактивный калий был получен путем электролиза его соединений, процесса, открытого 21 годом ранее.
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Позже в этом году он получает свободный металл путем электролиза его гидроксида и называет его.
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Около 4% газообразного водорода, производимого во всем мире, создается путем электролиза и обычно используется на месте.
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Из-за высокой стоимости электролиза этот процесс используется только тогда, когда требуется очень чистый свинец.
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Электролиз естественным образом притягивает кальций и другие минералы к пластинам.
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Алюминиевый завод состоит из большого количества электролизеров (электролизеров), в которых происходит электролиз .
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Электролиз – важная новая технология производства водорода, используемого в качестве энергоносителя.
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Водород производился из отечественных геотермальных и гидроэнергетических источников путем электролиза .
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Элементарный хлор промышленно получают из рассола путем электролиза .
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Чтобы заправить водородный автомобиль из воды, электричество используется для производства водорода путем электролиза .
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Основными типами процессов извлечения металлов являются электролиз , , газовое восстановление и осаждение.
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Во время электролиза вода расщепляется на водород и кислород.
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Ток, потребляемый электролизером , определяет массу водяного пара, попадающего в датчик.
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Процесс включает электролиз расплавленного алюминия с электролитом из фторида натрия, бария и алюминия.
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Он использовал переменный ток для предотвращения осаждения продуктов электролиза ; это позволило ему получить очень точные результаты.
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Аппарат состоит из набора для воды, который может расщеплять воду на молекулы водорода и кислорода в процессе электролиза воды .
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.При нормальном электролизе и они разделяются, по одному на каждый электрод.
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Электролиз «чистой» воды требует избыточной энергии в виде перенапряжения для преодоления различных барьеров активации.
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Большая часть этого водорода, полученного посредством электролиза , является побочным продуктом при производстве хлора.
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Во время электролиза в объеме аналит подвергается окислительно-восстановительному событию на рабочем электроде.
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Позже он объявил, что его группа разработала высокоэффективный анодный электрокатализатор (фосфат кобальта) для использования в электролизе воды с использованием недорогих материалов.
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Электролиз , который является страшилкой многих систем железных труб, совсем не влияет на деревянные трубы, поскольку дерево является гораздо лучшим электрическим изолятором.
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Подводные лодки и космические корабли используют либо электролитический механизм (вода или твердый оксид , электролиз ), либо химические генераторы кислорода как часть их оборудования жизнеобеспечения.
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Энергетическая эффективность воды , электролиз широко варьируется.
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Электролиз также используется для очистки и консервации старых артефактов.
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Есть разные способы его производства, такие как электролиз , и процесс парового риформинга метана.
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.В электролизере через воду пропускают электричество, чтобы отделить атомы водорода и кислорода.
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Электролиз расплавленного хлорида бериллия затем используют для получения металла.
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Электролиз воды – это химическое преобразование электричества, которое используется для разложения воды на водород и кислород.
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Устройства, которые используют магнетизм или электролиз в качестве метода умягчения воды, утверждают, что препятствуют образованию накипи без фактического удаления ионов жесткости из воды.
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.В настоящее время используются три метода; все используют электричество для разделения воды на водород и кислород посредством электролиза .
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Во время электролиза драгоценных металлов, таких как золото, серебро, платина, селен, палладий и т.д., оседают вместе с другими примесями на дне элементов.
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.В качестве альтернативы гидроксид меди легко получить путем электролиза и воды (содержащей небольшое количество электролита, такого как сульфат натрия).
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Скачки возникают при электролизе воды, что означает, что необходимое напряжение ячейки из-за кинетического торможения выше, чем равновесный потенциал.
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Электролиз в объеме часто используется для однозначного определения количества электронов, израсходованных в реакции, наблюдаемой с помощью вольтамперометрии.
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Побочным продуктом производства водорода посредством электролиза воды была тяжелая вода.
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Таким образом, угольные аноды расходуются во время электролиза , что приводит к высокому потреблению энергии и выбросам парниковых газов на плавильных заводах.
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Оба электрода, использованные в электролизе оксида алюминия, являются углеродными.
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Газообразный кислород можно также получить путем электролиза воды на молекулярный кислород и водород.
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Завод превращает импортный боксит в глинозем, а затем в алюминий с помощью электролиза .
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Он был пионером в использовании кабелей с неопреновой оболочкой для устранения паразитных токов и коррозии с помощью электролиза .
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Объемный электролиз также может быть использован для синтетических целей, если продукт электролиза может быть изолирован.
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Электролиз в объеме иногда упоминается в литературе как средство для изучения скоростей электрохимических реакций.
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.Очень чистый кремний (99,9%) может быть извлечен непосредственно из твердого диоксида кремния или других соединений кремния путем электролиза расплавленной соли .
ИзВикипедия
Этот пример взят из Википедии и может быть повторно использован по лицензии CC BY-SA.При электролизе тяжелая вода разделилась на кислород, который собирался на платиновом электроде, и дейтерий, который накапливался на палладиевом электроде.
Во время электролиза расплавов солей ионы металлов, которые всегда положительны (катионы), перемещаются к катоду и разряжаются.
В этом разделе мы узнаем, как природа электролита и концентрация водных электролитов влияет на продукты электролиза .
Электролиз рассола используется для производства хлора, водорода и гидроксида натрия, каждый из которых имеет важное применение.
В электролизе отрицательный электрод называется катодом; положительный электрод – анод.
Металлы, такие как натрий и магний, получают электролизом и их расплавленных хлоридов.
Однако продукты электролиза раствора соли могут отличаться от продуктов, полученных электролизом расплавленной соли.
Для электролиза рассола использовались несколько различных типов электролитических ячеек.
Электролиз расплавленного оксида алюминия производит алюминий на катоде.
Наиболее химически активные металлы должны быть извлечены из расплавленных руд с помощью электролиза .
Промышленность сосредоточена вокруг электролиза концентрированного раствора хлорида натрия (рассола).
Алюминий является основным примером металла, извлеченного из руды (боксита) путем электролиза .
Электролиз рассола производит исходные материалы для многих продуктов.
Чтобы провести электролиз , оксид алюминия должен быть расплавлен.
На теле почти нет волос – результат депиляции, бритья или электролиза , что делает мышцы еще более заметными.
Эти примеры взяты из корпусов и из источников в Интернете. Любые мнения в примерах не отражают мнение редакторов Cambridge Dictionary, Cambridge University Press или его лицензиаров.
Электролиз
14.4 Электролиз
Цели обучения
- Опишите электролиз с точки зрения окислительно-восстановительных реакций.
- Приведите примеры применения электролиза.
До сих пор мы рассматривали окислительно-восстановительные реакции для самопроизвольных процессов. При настройке в виде гальванического элемента или батареи такие реакции могут использоваться как источник электричества. Однако можно пойти и в другом направлении. Подавая электричество в клетку, мы можем вызвать окислительно-восстановительную реакцию, которая обычно не была бы спонтанной. В этих условиях ячейка называется электролитической ячейкой – ячейкой, в которой электричество заставляет произойти несамопроизвольную реакцию., и процесс, который происходит в ячейке, называется электролизом. Процесс создания неспонтанной окислительно-восстановительной реакции происходит за счет подачи электричества в ячейку. (Рисунок 14.5 «Электролиз»).
Рисунок 14.5 Электролиз
В электролитической ячейке электричество проходит через ячейку, вызывая неспонтанную окислительно-восстановительную реакцию. Здесь окислительно-восстановительная реакция 2H 2 O → 2H 2 + O 2 вызывается подачей электричества, которое вырабатывается батареей.
Электролиз имеет множество применений. Например, если NaCl расплавляется при температуре около 800 ° C в электролитической ячейке и через нее пропускается электрический ток, элементарный натрий появится на катоде, а элементарный хлор появится на аноде, поскольку протекают следующие две реакции:
Na + + e – → Na 2Cl – → Cl 2 + 2e –Обычно мы ожидаем, что элементарный натрий и хлор спонтанно реагируют с образованием NaCl.Однако, используя подачу электричества, мы можем вызвать противоположную реакцию и создать элементы. Литий, калий и магний также можно выделить из соединений электролизом.
Еще один элемент, выделяемый электролизом, – это алюминий. Раньше алюминий был трудным металлом для выделения в его элементарной форме; Фактически, на вершине монумента Вашингтона есть крышка из металлического алюминия весом 2,8 кг, которая в то время – 1884 год – была самым большим куском элементарного алюминия, когда-либо изолированным.Однако в 1886 году американец Чарльз Холл и француз Поль Эру почти одновременно разработали электролитический процесс для выделения алюминия из боксита, руды алюминия, химическая формула которой – AlO x (OH) 3 – 2 х . Основные реакции следующие:
Al 3+ + 3e – → Al 2O 2- → O 2 + 4e –С развитием процесса Холла-Эру цена на алюминий упала более чем в 200 раз, и металлический алюминий стал обычным явлением.Каждый год в Соединенных Штатах производится столько элементарного алюминия, что, по оценкам, на электролиз алюминия расходуется 5% всей электроэнергии в стране. (Переработка алюминия требует примерно 1/70 энергии, необходимой для очистки алюминия от руды, что демонстрирует огромную экономию энергии, которую обеспечивает переработка.)
Другим применением электролиза является гальваника. Нанесение тонкого слоя металла на объект в защитных или декоративных целях, то есть нанесение тонкого слоя металла на объект в защитных или декоративных целях (Рисунок 14.6). По сути, металлический объект соединяется с катодом электролитической ячейки и погружается в раствор определенного катиона металла. Когда электролитическая ячейка работает, тонкий слой катиона металла восстанавливается до элементарного металла на поверхности объекта; толщина покрытия может составлять всего несколько микрометров (10 -6 м). Драгоценности, столовые приборы, электрические контакты и автомобильные детали, такие как бамперы, являются обычными предметами, покрытыми гальваническим покрытием. Золото, серебро, никель, медь и хром – обычные металлы, используемые в гальванике.
Рисунок 14.6
Основные выводы
- Электролиз – это инициирование неспонтанной окислительно-восстановительной реакции путем подачи электричества в элемент от внешнего источника.
- Электролиз используется для изоляции элементов и гальванических предметов.
Упражнения
Определить электролитическая ячейка .
Чем работа электролитической ячейки отличается от работы гальванической ячейки?
Перечислите не менее трех элементов, производимых электролизом.
Напишите половинные реакции электролиза элементов, перечисленных в упражнении 3.
ответов
электрохимический элемент, в котором происходит зарядка и протекает несамопроизвольная реакция
любые три из следующих: Al, K, Li, Na, Cl 2 или Mg


 п.
п.
