Закон Фарадея для электролиза – формула и примеры
4.3
Средняя оценка: 4.3
Всего получено оценок: 225.
4.3
Средняя оценка: 4.3
Всего получено оценок: 225.
В 1836 году Майкл Фарадей опубликовал выведенные математически количественные характеристики электролиза. Обнаруженные взаимосвязи между количеством прошедшего через электролит электричества и количеством выделившегося при этом вещества впоследствии были названы законами Фарадея для электролиза.
Первый закон
Если пропускать через раствор медного купороса электрический ток в течение определённого количества времени, то на катоде выделяется небольшое количество меди. Однако если пустить ток большей силы, за такое же количество времени на катоде образуется большее количество меди. При увеличении времени и одинаковой силе тока также увеличивается количество меди.
Рис. 1. Майкл Фарадей.Фарадей установил взаимосвязь массы вещества, силы тока и времени. Математически эта взаимосвязь выражается следующим образом:
где:
- m – масса вещества;
- k – электрохимический эквивалент;
- I – сила тока;
- t – время.

Электрохимический эквивалент – это масса вещества, образованная при прохождении через электролит тока в 1 А за одну секунду. Выражается как соотношение массы вещества к количеству электричества или г/Кл.
Произведение силы тока и времени выражает количество электричества: q = It. Это электрический заряд, измеряемый в кулонах (один ампер к одной секунде). Электрический заряд отражает способность тела быть источником электромагнитного поля и принимать участие в электромагнитном взаимодействии.
Соответственно, уравнение Фарадея приобретает вид:
m = kq.
Рис. 2. Первый закон Фарадея.Первый закон электролиза Фарадея: масса вещества, выделившегося при электролизе, прямо пропорциональна количеству электрического тока, пропущенного через электролит.
Второй закон
Фарадей, пропуская электрический ток одинаковой силы через различные электролиты, заметил, что массы веществ на электродах неодинаковы. Взвесив выделившиеся вещества, Фарадей сделал вывод, что вес зависит от химической природы вещества.
На основе полученных данных Фарадей вывел второй закон электролиза: для определённого количества электричества масса химического элемента, образовавшегося на электроде, прямо пропорциональна эквивалентной массе элемента. Она равна массе одного эквивалента – количеству вещества, реагирующему или замещающему 1 моль атомов водорода в химических реакциях:
μeq = μ/z,
где:
- μ – молярная масса вещества;
- z – число электронов на один ион (валентное число ионов).
Для выделения одного моля эквивалента затрачивается одинаковое количество электричества – 96485 Кл/моль. Это число называется числом Фарадея и обозначается буквой F.
Согласно второму закону, электрохимический эквивалент прямо пропорционален эквивалентной массе вещества:
k = (1/F) μeq или k = (1/zF)μ.
Рис. 3. Второй закон Фарадея.Два закона Фарадея можно привести к общей формуле: m = (q / F) ∙ (μ/z).
Что мы узнали?
Фарадей, проводя реакцию электролиза разных веществ, вывел два закона. Согласно первому закону, масса вещества, осевшего на электрод, прямо пропорциональная количеству электричества, пропущенного через электролит: m = kq. Второй закон отражает взаимосвязь электрохимического эквивалента и эквивалентной массы вещества: k = (1/F) μeq. Электрохимический эквивалент – количество выделившегося вещества при прохождении единицы электричества. Эквивалентная масса – количество вещества, реагирующее с 1 молем водорода.
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
Лиза Шифр
4/5
Евгений Пшеничный
5/5
Татьяна Батарон
4/5
Оценка доклада
4.3
Средняя оценка: 4.3
Всего получено оценок: 225.
А какая ваша оценка?
Закон Фарадея для электролиза: формулы
Электрический ток, проходящий через растворы электролитов, способствует разложению веществ и дает возможность получать химически чистые материалы. Данный процесс получил наименование электролиза, нашедшего широкое применение в промышленном производстве. Физические преобразования проводников, находящихся в жидкости, объясняет закон Фарадея для электролиза, на основании которого анод выполняет функцию положительного электрода, а катод – отрицательного. С помощью него осуществляется очистка металлов от примесей и выполняется нанесение тонких покрытий, защищающих металлические поверхности.
Данный процесс получил наименование электролиза, нашедшего широкое применение в промышленном производстве. Физические преобразования проводников, находящихся в жидкости, объясняет закон Фарадея для электролиза, на основании которого анод выполняет функцию положительного электрода, а катод – отрицательного. С помощью него осуществляется очистка металлов от примесей и выполняется нанесение тонких покрытий, защищающих металлические поверхности.
Содержание
Суть процесса электролиза
Электролизом называются процессы окислительно-восстановительных реакций, протекающие под принудительным воздействием электрического тока. Для его выполнения используется специальная емкость с электролитическим раствором, куда погружаются металлические штыри, соединенные с наружным источником питания.
Электрод, соединенный с полюсом отрицательного значения источника тока, считается катодом. Именно в данном месте частицы электролита восстанавливаются. Другой электрод подключается к плюсовому полюсу и носит название анода. На этом участке вещество электрода или частицы электролита окисляются. Химические реакции на этом участке происходят по-разному, в зависимости от материала анода и состава электролитического раствора. Поэтому, как утверждает химия, электроды по отношению к электролиту могут быть инертными или растворимыми.
На этом участке вещество электрода или частицы электролита окисляются. Химические реакции на этом участке происходят по-разному, в зависимости от материала анода и состава электролитического раствора. Поэтому, как утверждает химия, электроды по отношению к электролиту могут быть инертными или растворимыми.
К категории инертных относятся аноды, изготовленные из материала, не окисляющегося во время электролиза. В качестве примера можно привести графитовые или платиновые электроды. Растворимыми являются практически все остальные виды металлических анодов, подверженных окислению в ходе электролитической реакции.
Электролитами чаще всего служат различные виды растворов или расплавов, внутри которых происходит хаотичное движение заряженных частиц – ионов. Когда на них воздействует электрический ток, они начинают двигаться в определенном направлении: катионы – к катоду, анионы – к аноду. Попадая на электроды, они теряют свои заряды и оседают на них.
Таким образом, на катоде и аноде происходит накопление так называемых суммарных продуктов, состоящих из электрически нейтральных веществ. Весь процесс электролиза выполняется под напряжением, подаваемым на электроды. Данное напряжение Uэл-за является типичным примером разности потенциалов, требующейся для обеспечения нормального течения электролитических реакций. Чисто теоретически это напряжение принимает вид формулы: Uэл-за = Еа – Ек, в которой Еа и Ек являются потенциалами химических реакций, происходящих на аноде и катоде.
Весь процесс электролиза выполняется под напряжением, подаваемым на электроды. Данное напряжение Uэл-за является типичным примером разности потенциалов, требующейся для обеспечения нормального течения электролитических реакций. Чисто теоретически это напряжение принимает вид формулы: Uэл-за = Еа – Ек, в которой Еа и Ек являются потенциалами химических реакций, происходящих на аноде и катоде.
Существует определенная связь между количеством электричества, протекавшего через раствор, и количеством вещества, выделенного в период электролитической реакции. Данное явление было описано английским физиком Фарадеем и оформлено в виде двух законов.
Первый закон Фарадея
Данный закон был выведен ученым экспериментальным путем. Он определяет пропорциональную зависимость между массой вещества, образующегося на электроде и зарядом, проходящим через электролитический раствор.
Эту пропорцию наглядно отображает формула m=k х Q=k х I х t, где k является коэффициентом пропорциональности или электрохимическим эквивалентом, Q – заряд, прошедший через электролит, t – время прохождения заряда, m – масса вещества, образовавшегося на электроде в результате реакции.
Первый закон Фарадея служит для определения количества первичных продуктов, образовавшихся в процессе электролиза на электродах. Масса этого вещества составляет суммарную массу всех ионов, попавших на электрод. Это подтверждается формулой m=m0 х N = m0 х Qq0 = m0q0 х I х t, в которой m0 и q0 соответственно являются массой и зарядом единичного иона. N=Qq0 – определяет количество ионов, попавших на электрод за время прохождения заряда Q через раствор электролита.
Следовательно, величина электрохимического эквивалента k представляет собой соотношение массы иона m0 используемого вещества и заряда q0 этого иона. Известно, что величина заряда иона составляет произведение валентности n этого вещества и элементарного заряда е, то есть, q0 = n х e. Исходя из этого, электрохимический эквивалент k будет выглядеть следующим образом: k = m0q0 = m0 х NAn х e х NA = 1F х μn. В этой формуле NA является постоянной Авогадро, μ – молярной массой данного вещества. F = e х NA является постоянной Фарадея и составляет 96485 Кл/моль.
Числовое значение данной величины равняется заряду, который должен быть пропущен через раствор электролита, для того чтобы на электроде выделился 1 моль вещества с одинаковой валентностью. Рассматриваемый закон Фарадея для электролиза примет вид еще одной формулы: m = 1F х μn х I х t.
Второй закон Фарадея
Следующий закон ученого Фарадея описывает, как электрохимический эквивалент будет зависеть от атомной массы вещества и его валентности. У этого коэффициента будет прямая пропорциональная зависимость с атомным весом и обратно пропорциональная – с валентностью вещества. С введением данной величины, второй закон Фарадея формулируется как пропорция электрохимических эквивалентов вещества и собственных химических эквивалентов этих веществ.
Если значения электрохимических эквивалентов взять за k1, k2, k3…kn, а химические эквиваленты принять за х1, х2, х3…xn, то k1/x1 = k2/x2 = k3/x3…kn/xn. Данное соотношение является постоянной величиной, одинаковой для любых используемых веществ: с = k/x и составляет 0,01036 мг-экв/к. Именно такое количество вещества в миллиграмм-эквивалентах выделяется на электродах за период прохождения в электролите электрического заряда, равного одному кулону.
Именно такое количество вещества в миллиграмм-эквивалентах выделяется на электродах за период прохождения в электролите электрического заряда, равного одному кулону.
Следовательно, второй закон Фарадея можно представить в виде формулы: k = cx. Если данной выражение использовать вместе с первым законом Фарадея, то в результате получится следующее выражение: m = kq = cxq = cxlt. Здесь категория с представляет собой универсальную постоянную, в размере 0,00001036 г-экв/к. Подобная формулировка дает возможность понять, что одни и те же токи, пропущенные через одинаковый промежуток времени в двух различных электролитах, выделят из них вещества с соблюдением рассмотренного химического эквивалента.
Поскольку x = A/n, то масса выделяемого вещества будет выглядеть как m = cA/nlt, с соблюдением прямой пропорции с атомным весом и обратной пропорции с валентностью.
Закон Фарадея – Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 24710
В каждом электрохимическом процессе, самопроизвольном или нет, определенное количество электрического заряда передается во время окисления и восстановления. Полуреакции, которые мы описали для электродных процессов, включают электроны, несущие этот заряд. Скорость переноса заряда можно измерить с помощью устройства, называемого амперметром.
Амперметр измеряет ток, протекающий по цепи. Единицами силы тока являются ампер (А) (для краткости амперы). В отличие от вольтметра, амперметры позволяют электронам проходить и, по сути, «отсчитывают» их по мере их прохождения. Количество электрического заряда, прошедшего через цепь, можно вычислить с помощью простого соотношения:
Единицами силы тока являются ампер (А) (для краткости амперы). В отличие от вольтметра, амперметры позволяют электронам проходить и, по сути, «отсчитывают» их по мере их прохождения. Количество электрического заряда, прошедшего через цепь, можно вычислить с помощью простого соотношения:
Заряд = ток x время ИЛИ Кулоны = амперы x секунды
Это позволяет нам связать стехиометрию реакции с электрическими измерениями. Принципы, лежащие в основе этих отношений, были выработаны в первой половине XIX в.XIX века английским ученым Майклом Фарадеем.
На диаграмме показано, как могут измеряться напряжение и ток для типичного гальванического элемента, но схема одинакова для любого гальванического элемента. Обратите внимание, что вольтметр расположен поперек электронного канала (т. е. провода), а амперметр является частью этого канала. Таким образом можно использовать вольтметр хорошего качества, даже если может показаться, что он «закорачивает» цепь. Поскольку электроны не могут пройти через вольтметр, они просто продолжают двигаться по проводу.
И вольтметр, и амперметр поляризованы. На них отмечены отрицательные и положительные клеммы. Электроны «ожидаются» только в одном направлении. Это важно при измерении постоянного тока (DC), например, выходящего (или входящего) в электрохимические ячейки.
Закон электролиза Фарадея можно сформулировать так: количество вещества, образующегося на каждом электроде, прямо пропорционально количеству заряда, протекающего через ячейку. Конечно, это некоторое упрощение. Вещества с различными окислительно-восстановительными изменениями с точки зрения электронов/атомов или ионов не будут производиться в одинаковых молярных количествах. Но если принять во внимание эти дополнительные отношения, то закон верен во всех случаях.
| Пример 1 |
|---|
|
| Пример 2 |
|---|
| Пример 3 |
|---|
| Пример 4 |
|---|
| Пример 5 |
|---|
Стивен Р.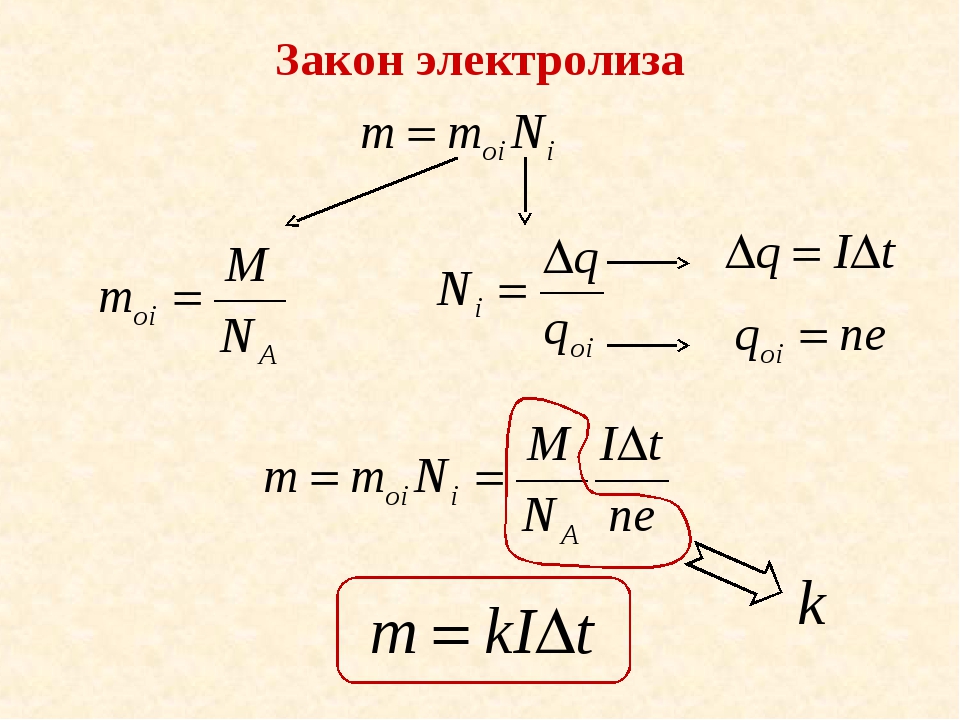 Марсден
Марсден
Закон Фарадея распространяется по незадекларированной лицензии и был создан, изменен и/или курирован LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Показать страницу TOC
- № на стр.
- Теги
Законы электролиза Фарадея – первый закон и второй закон
Электролиз – это использование электрического тока для стимуляции несамопроизвольной химической реакции. При электролизе электрический ток пропускают через раствор электролита, чтобы стимулировать поток ионов, вызывающий химическое изменение. Электролит — это жидкость (или, как правило, раствор соли металла), проводящая электричество.
При электролизе электрический ток пропускают через раствор электролита, чтобы стимулировать поток ионов, вызывающий химическое изменение. Электролит — это жидкость (или, как правило, раствор соли металла), проводящая электричество.
Что такое электрод?
Электрод можно определить как точку, в которой ток входит или выходит из электролита или цепи. Когда ток выходит из электрода, он известен как катод, а когда ток входит в электрод, он известен как анод.
Электроды являются основным компонентом электрохимических элементов. Необходимо, чтобы электрод был хорошим проводником электричества. Хотя существуют и инертные электроды, которые не участвуют в реакции. Электрод может быть из золота, платины, углерода, графита, металла и т. д. Электрод обеспечивает поверхность для протекания окислительно-восстановительных реакций в клетках.
Электроды в основном двух типов
Реактивные электроды – это те электроды, которые принимают участие в реакции, протекающей в ячейке, и могут растворяться в электролите.

Примеры реактивных электродов – медные электроды, серебряные электроды, цинковые электроды, медные электроды и т. д. Они в основном используются в потенциометрических работах.
Инертные электроды – это электроды, не принимающие участия в реакции.
Примеры инертных электродов – угольные электроды, платиновые электроды и т. д.
Что такое электролитическая ячейка?
Электролитические элементы представляют собой такие электрохимические элементы, которые преобразуют электрическую энергию в химическую потенциальную энергию. Поскольку мы обсуждали электролиз выше, вы можете сказать, что электролитические ячейки работают в процессе электролиза. Вторичные элементы или электролитические элементы являются перезаряжаемыми; это означает, что в этих клетках происходят обратимые химические реакции. В этих ячейках анод всегда положительный, а катод всегда отрицательный.
В этих ячейках анод всегда положительный, а катод всегда отрицательный.
Законы электролиза Фарадея
Получив четкое представление об электролизе, электродах и электролитических элементах, вы теперь в состоянии понять законы электролиза Фарадея. Законы электролиза Фарадея основаны на электрохимических исследованиях Майкла Фарадея, которые он опубликовал в 1833 году. Они показывают количественную зависимость между веществом, осажденным на электродах, и количеством прошедшего электрического заряда или электричества.
Первый закон электролиза Фарадея
Первый закон электролиза Фарадея гласит, что «масса вещества, осажденного на любом электроде, прямо пропорциональна количеству прошедшего заряда». Математически это можно выразить следующим образом –
м ∝ Q ———-(1)
Где:
При снятии пропорциональности в уравнении (1) –
910584
m=ZQ
Где Z — константа пропорциональности. Его единицей измерения являются граммы на кулон (г/Кл). Его также называют электрохимическим эквивалентом. Z — масса вещества, осевшего на электродах при электролизе в обход заряда 1 кулон.
Его единицей измерения являются граммы на кулон (г/Кл). Его также называют электрохимическим эквивалентом. Z — масса вещества, осевшего на электродах при электролизе в обход заряда 1 кулон.
Второй закон электролиза Фарадея
Второй закон электролиза Фарадея гласит, что «масса вещества, осажденного на любом электроде при прохождении определенного количества заряда, прямо пропорциональна его химическому эквивалентному весу». Или «когда одно и то же количество электричества проходит через несколько электролитов, масса осажденных веществ пропорциональна их соответствующему химическому эквиваленту или эквивалентному весу». Математически это можно представить так –
W ∝ E
, где w = масса вещества
E = эквивалентный вес вещества
. Это также может быть выражено o -W1/W2 = W2 = W2 = W2 = W2 = W2 = W2 = W2 = W2 = W2 = W2 = W2 = W2 = W2 = W2 = W2 = W2 = W2 = W2 = W2 = W2 = W1/W2 = W1/W2 = W2 = W1/W2 = W2 = W1/W2 = W2 = W1/W2 = W2 = W2 = W2 = W1/W2.
Эквивалентная масса или химический эквивалент вещества может быть определена как отношение его атомной массы к валентности.
Эквивалентный вес = атомный вес/валентность
Второй закон электролиза Фарадея можно дополнительно объяснить на следующем примере –
Рассмотрим три различные химические реакции, происходящие в трех отдельных электролитических ячейках, соединенных последовательно. Допустим, в 1-й электролизере ион натрия приобретает электроны и превращается в натрий.
NA + + E -→ NA
во 2 -й электролитической клетке после реакции
CU + 2 + 2E -→ CU
88888888 гг. Al3++ 3e- → Al
Если предположить, что y молей электронов проходят через три ячейки, масса выделяющихся натрия, алюминия и меди составляет 23y грамм, 9y грамм, 31,75y грамм соответственно.



