Арктур 006 Схема Электрическая Принципиальная
Для этого с функционального генератора на вход УК при отключённом конденсаторе С5 был подан синусоидальный сигнал частотой 20 кГц до наступления ограничения сигнала на выходе ОУ DA2. Хобби может и совсем опасть
Для удобства монтажа неиспользуемые выводы микросхем или панелек изгибают под углом либо отламывают.
Меняем электролиты на плате управления фотографий не сделал.
Арктур 006 привез-Покрасим ?
Проблемы особенно сильно проявляются со временем, когда механизм изнашивается и загрязняется.
Например, перегрузочную способность УК можно увеличить последовательным включением двух каскадов на ОУ.
Подстроечные резисторы, которых на этой плате несколько штук, трогать не рекомендуется, так как методика настройки утеряна где-то в прошлом веке и неизвестна современной науке.
Я собрал , но работает не важно,борьба с шумами и много раз подбирал партии микросхем.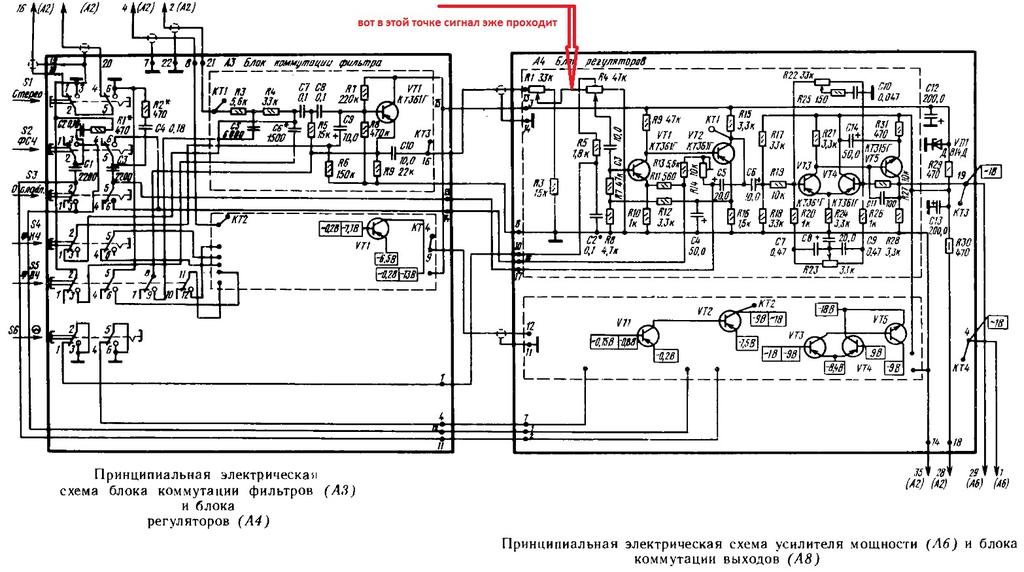
Хобби может и совсем опасть На плате расположены рядом два разъёма, один — выход непосредственно с иглы звукоснимателя и второй — усиленный и откорректированный.
АРКТУР 006
Инструкции и мануалы
Займемся пока встраиванием нового винил-корректора. Можно сдавать заказчику.
Плату УК целесообразно поместить в экран, защищающий от электромагнитных полей. Он собран на операционном усилителе с коррекцией в цепи обратной связи.
Для удобства монтажа неиспользуемые выводы микросхем или панелек изгибают под углом либо отламывают. Заключение Кроме всего прочего, будет очень полезно почистить кинематику ЭПУ, убрать старую, загустевшую смазку и смазать всё по новой.
В статьях даются оценки их качества либо по фактически достигнутым техническим характеристикам, либо по субъективным впечатлениям от звучания; при этом в сравнении разных УК предпочтение нередко отдают последним [1].
Затем снять металлический диск , он никак не фиксируется и сделать это не сложно. Нумерация и расположение деталей левого канала соответствуют аналогичным, отражённым на рис.
Дополнительно попросил встроить мой винил-корректор вместо штатного.
Устранить эти недостатки можно переделкой стробоскопа на светодиодный, частота работы которого будет стабилизирована кварцем. Порой из-за увеличения нагрузки на тонарм проигрывание канавки с малым радиусом становится вовсе невозможным.
Начало ремонта «Арктура-006»
Сообщение форума
Если это конечно не очередное обострение Займемся пока встраиванием нового винил-корректора.
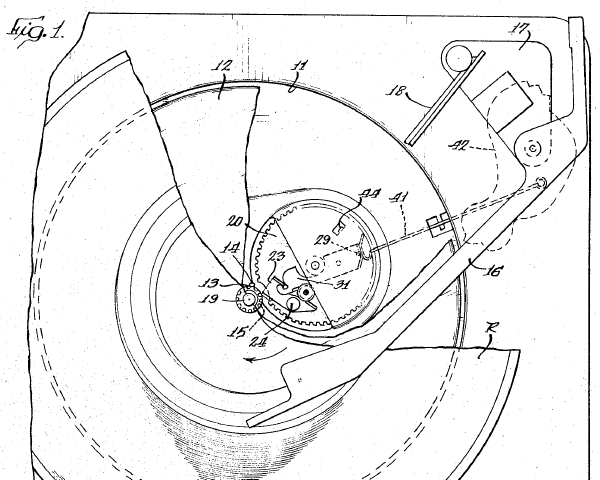
ЭПУ «Арк-турстерео» г. Принес товарищ мне на ремонт проигрыватель «Арктур » с жалобой на нестабильные обороты диска.
Такое решение позволяет снизить динамические искажения и устранить влияние шума второго усилителя, а рациональное применение цепей активной и пассивной коррекции — более точно сформировать АЧХ на высоких частотах [2].

Еще один недостаток проигрывателя — отсутствие подсветки пластинки Target Light тоже можно исправить доработкой тонарма. Затем вместо синусоидального был подан импульсный сигнал меандр чуть меньшей амплитуды. Попутно выясняется, что неисправна лампочка на индикацию 33 скорости.
После проведения всех описанных выше работ и манипуляций проигрыватель заработал вполне себе достойно и никаких нареканий больше не вызывает. Порой из-за увеличения нагрузки на тонарм проигрывание канавки с малым радиусом становится вовсе невозможным.
В стабилизаторе также следует проверить все ёмкости и, наверняка, заменить ВСЕ: В моём случае все напряжения с трансформатора были в порядке, но, например, на плату управления двигателем приходило всего лишь 14 вольт вместо ти и этого явно не хватало для нормальной работы платы и электромагнита, который удерживает рычаг опускания тонарма в рабочем положении. Подстраиваем корректор под ММ головку «Numark Groovetool» дали ее с проигрывателем. Плату УК целесообразно поместить в экран, защищающий от электромагнитных полей. И что это за подбор такой, зачем он нужен?
Плату УК целесообразно поместить в экран, защищающий от электромагнитных полей. И что это за подбор такой, зачем он нужен?
Например, перегрузочную способность УК можно увеличить последовательным включением двух каскадов на ОУ. Е48,Е96, Е скорей из этих рядов.
О перегрузочной способности корректирующего усилителя. Результат меня порадовал: при прослушивании классической музыки отметил чистоту звучания во всём звуковом спектре. Хобби может и совсем опасть
Похожие схемы
Питается УК от стабилизированного блока питания в авторском варианте на интегральных стабилизаторах напряжения и
Необходимо лишь, при наличии измерительной грампластинки, подобрать ёмкость конденсатора С1, добиваясь минимальной неравномерности АЧХ УК в полосе частот Питается УК от стабилизированного блока питания в авторском варианте на интегральных стабилизаторах напряжения и
Затем снять металлический диск , он никак не фиксируется и сделать это не сложно.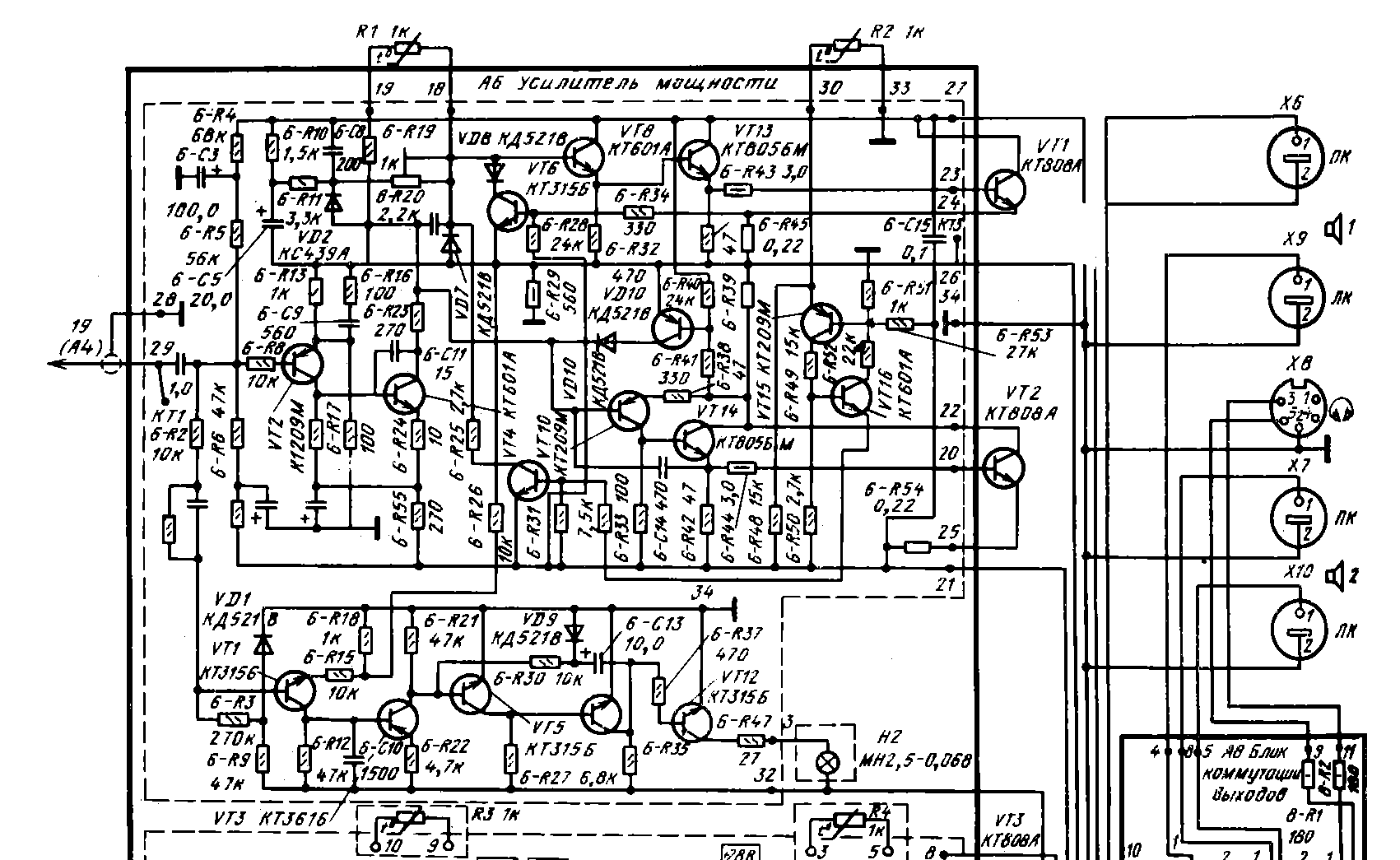
Устанавливаем в проигрыватель на штатное место. На плате управления двигателем все детали импортные, в стабилизаторе же и предусилителе-корректоре — наши, советские. Собираем все в кучу. Принципиальная схема одного канала для микросхемы DA1 номера выводов второго канала указаны в скобках разработанного УК приведена на рис.
Читайте дополнительно: Рд 34 45 51 300 97 скачать
Содержание / Contents
Хобби может и совсем опасть Это нормально. В [1 ] и [5] авторы указывают на субъективную оценку уровня шума УК по сравнению с уровнем шума немой канавки грампластинки. Для удобства монтажа неиспользуемые выводы микросхем или панелек изгибают под углом либо отламывают.
Муринов А. Подстраиваем корректор под ММ головку «Numark Groovetool» дали ее с проигрывателем. Автор: С.
Причём следует иметь ввиду, что при отключенном разъёме, то есть без нагрузки, это напряжение может быть несколько выше до 19 вольт. Алексенко А.
Вот некоторые из перечисленных факторов, принятых во внимание при разработке предлагаемого УК, характеристики которого по расчёту намного выше, чем встроенного штатного.
Арктур 006 проигрыватель. Кладовка. Выпуск №34
Простой винил-корректор для проигрывателя «Арктур-006-стерео» по схеме А. Бокарёва
Случайно в мои руки попал проигрыватель пластинок «Арктур-006-стерео». Поэтому появилась острая нужда в фонокорректоре. На просторах Интернета наткнулся на схему А. Бокарёва, по которой и решил сделать столь необходимый девайс.Сзади у проигрывателя есть два выходных разъёма (СГ-5/DIN): один со встроенного фонокорректора (500мВ), второй в обход, для подключения к внешнему (5мВ). При использовании встроенного фонокорректора во второй выход устанавливается перемычка.
Характеристики встроенного корректора мне не понравились, а при включении выяснилось, что он неисправен — я услышал в динамиках только гул 50 Гц. Желания его восстанавливать не возникло, отключил плату встроенного корректора совсем.
Буду слушать свой вариант.
Источник фото: vega-brz.ru
Электропроигрыватель высшей группы сложности «Арктур-006-стерео» с 1983 года выпускал Бердский радиозавод. Проигрыватель выполнен на базе двухскоростного ЭПУ G-2021, со сверхтихоходным электродвигателем и прямым приводом. Имеются регулятор прижимной и компенсатор скатывающей силы, подстройка частоты вращения диска по стробоскопу, автостоп, микролифт, переключатель скорости и автовозврат тонарма по окончании грампластинки.
Содержание / Contents
Рис. 1
Схема довольно проста, что очень хорошо для начинающего радиолюбителя, но при этом отлично справляется со своей задачей.
Важное примечание от автора схемы А. Бокарёва
В оригинале C5 = 4 µF и R6 = 2 кОм, постоянная Т4 = 8 миллисекунд, срез ниже 30 Герц. При указанных номиналах срез задран на уровне 100 Гц, басов нет.
 Выходной ОУ NE5532. Как вариант — TL082, но у него нагрузочная слабее, а сдвиг побольше.
Выходной ОУ NE5532. Как вариант — TL082, но у него нагрузочная слабее, а сдвиг побольше.Рис. 2. Оригинальная схема корректора «WEEKEND»
Питание схемы выполнено по предельно простой схеме: двуполярный однополупериодный выпрямитель с параметрической стабилизацией на стабилитронах 2C175А, их по два последовательно на плечо ставим. Шикарные стабы, разброс мизерный, неполярные.
В выпрямителе работают диоды Шоттки 1N5819 или 1N5822, неважно. задача получить Вольт 25-27 на входе стабилизатора.
Пробовал запитать схему в наглую, без стабилизаторов вовсе, подал 12 Вольт переменки, получил два по 16 Вольт, схема не заметила такого хамства и играла как и прежде.
Сразу совет: первичку сетевого трансформатора обязательно шунтируйте ёмкостью 1 мкф 600в, иначе при выключении иногда возникают жуткие щелчки.
Печатная плата корректора изготовлена на основе чертежа М. Васильева. Я добавил отверстия для конденсаторов разных размеров и скорректировал ПП под свои детали.
Плату блока питания разрабатывал я сам.
Рис. 3. Вид на ПП
Главной задачей для меня стало изготовление блока питания. Схеме необходимо двуполярное напряжение ±15 Вольт. В заначке нашёл только трансформатор с одной вторичкой на 15 Вольт в виде внешнего БП.
Рис. 4. Схема БП на чипах 78/79
Набросал в Sprint Layout плату, на которой двуполярное питание реализовал двумя однополупериодными выпрямителями со стабилизаторами 7815 и 7915 на выходе. Конденсаторы использовал от разобранного компьютерного ИИП, диоды 1n4007.
Рис. 5. Вид на ПП блока питания
Изготовление плат и запайка деталей заняли у меня около 3 часов. После чего не утерпел, припаял временные провода и подключил всё это дело к проигрывателю.
На моё удивление всё заработало с первого включения! Без «спецэффектов» и фона. Прослушивание музыки тоже порадовало: звук чистый, прозрачный и воздушный.Следующим этапом стало изготовление корпуса. Попросил знакомого на станке обрезать и выгнуть кусок кровельного железа
Боковины сделал из фанеры и покрыл их морилкой.
 Основание к боковинам прикрутил при помощи деревянного штапика.
Основание к боковинам прикрутил при помощи деревянного штапика.Отверстия для RCA гнезд и питания просверлил конусным сверлом (очень удобная вещь).
Вот что получилось в итоге.
Устройство до публикации статьи я отслушал ок. 2 месяцев, заметных недостатков я не выявил. Как уже писал выше: звук чистый, прозрачный и воздушный.
На мой вкус немного маловато низких частот. Но это из-за того, что я поставил конденсатор C5 на 1 мкФ вместо 2.2 мкФ. К сожалению, пока не нашёл хороших конденсаторов подходящей ёмкости.
В общем, если вам нужен неплохой бюджетный фонокорректор, который собирается за один вечер из доступных деталей, то этот проект вам отлично подходит!
Архив с печатными платами (номиналы деталей высвечиваются при наведении курсором).▼ korrektorblok-pitaniya.zip 40,91 Kb ⇣ 294
Принципиальная схема и руководство пользователя на «Арктур-006-стерео»
▼ arktur-006.7z 1,93 Mb ⇣ 184
Спасибо за внимание!
Камрад, рассмотри датагорские рекомендации
🌼 Полезные и проверенные железяки, можно брать
Опробовано в лаборатории редакции или читателями.
Усилитель-корректор для ЭПУ АРКТУР-006-СТЕРЕО – RadioRadar
Интерес к записям на виниловых пластинках по-прежнему не ослабевает, и публикуются статьи о новых схемах и конструкциях усилителей-корректоров (УК). В статьях даются оценки их качества либо по фактически достигнутым техническим характеристикам, либо по субъективным впечатлениям от звучания; при этом в сравнении разных УК предпочтение нередко отдают последним [1].
Рис. 1
При модернизации старой аппаратуры можно использовать готовую разработку, ориентируясь на радиодетали, которые можно реально приобрести, либо реализовать собственную, применив технические решения, которые заведомо обеспечат высокое качество воспроизведения. При этом совсем не обязательно решать проблему, применяя современные сверхмалошумящие и сверхбыстродействующие ОУ.
Например, перегрузочную способность УК можно увеличить последовательным включением двух каскадов на ОУ. Такое решение позволяет снизить динамические искажения и устранить влияние шума второго усилителя, а рациональное применение цепей активной и пассивной коррекции – более точно сформировать АЧХ на высоких частотах [2]. Вряд ли стоит стремиться к получению перегрузочной способности УК до 40 дБ, так как в имеющейся у меня коллекции из 400 грампластинок не найдётся и десяти, записанных по технологии DMM, обеспечивающей малый уровень шума и повышенный уровень высокочастотных составляющих сигнала.
Применяя широко распространённые ОУ с внешней коррекцией и компенсацию с опережением, можно увеличить скорость нарастания выходного напряжения до 10 В/мкс [3], что также способствует снижению динамических искажений. Кроме того, если нагрузить выходной каскад ОУ генератором тока, т. е. перевести его в режим усиления класса А, можно существенно снизить гармонические искажения, сузив их спектр, и увеличить запас устойчивости по фазе [4].
В [1 ] и [5] авторы указывают на субъективную оценку уровня шума УК по сравнению с уровнем шума немой канавки грампластинки. Какое же необходимо иметь отношение сигнал/шум, чтобы при прослушивании в реальной обстановке и при реальной мощности этот шум не раздражал? Согласно ГОСТ 5289-88/94, отношение сигнал/шум не-модулированной канавки грампластинки должно составлять не менее 60 дБ, а после 50 проигрываний должно уменьшиться не более чем на 2 дБ, следовательно, можно косвенно определить и этот параметр УК.
Какое же необходимо иметь отношение сигнал/шум, чтобы при прослушивании в реальной обстановке и при реальной мощности этот шум не раздражал? Согласно ГОСТ 5289-88/94, отношение сигнал/шум не-модулированной канавки грампластинки должно составлять не менее 60 дБ, а после 50 проигрываний должно уменьшиться не более чем на 2 дБ, следовательно, можно косвенно определить и этот параметр УК.
Встроенный в ЭПУ УК выполнен на ОУ К157УД2, для него указан уровень фона–63 дБ, уровень шума и коэффициент гармоник, к сожалению, не указаны, очевидно, уровень шума сопоставим с уровнем фона. ЭПУ “Арк-тур-006-стерео” 1984 г. выпуска используется в комплекте с музыкальным центром SONY FH-B1200 и АС “Радиотехника S-90B”.
Вот некоторые из перечисленных факторов, принятых во внимание при разработке предлагаемого УК, характеристики которого по расчёту намного выше, чем встроенного штатного.
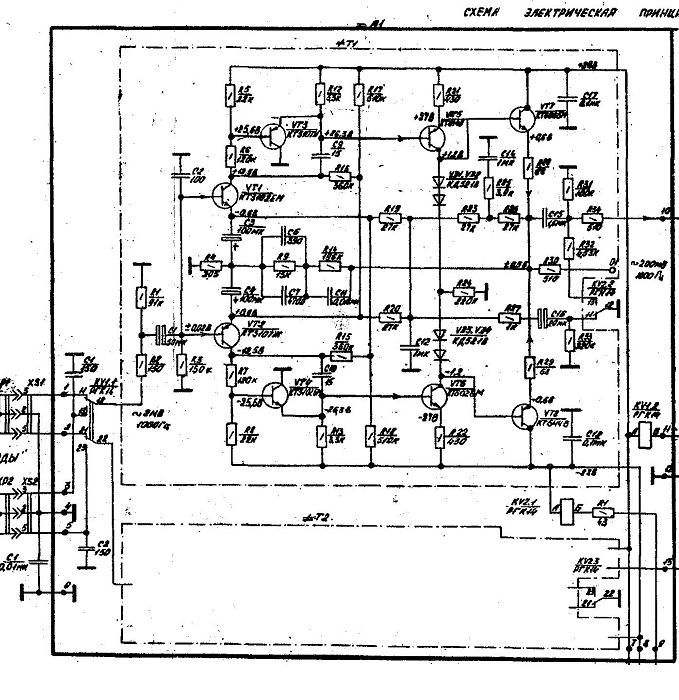
Принципиальная схема одного канала (для микросхемы DA1 номера выводов второго канала указаны в скобках) разработанного УК приведена на рис. 1. За основу взята схема предусилителя, описанного в [3], и она была переработана с учётом изложенного выше. Номиналы пассивных элементов рассчитаны с учётом следующих условий – минимум номиналов конденсаторов; достаточная перегрузочная способность и минимальные нелинейные искажения на частоте 20 кГц. Наличие высококачественных конденсаторов К71-7 (полистирольные, выпаяны из платы телевизора ЗУСЦТ) ёмкостью 4700 пФ ±1 % дало начало расчёту параметров остальных элементов частотной коррекции.
1. За основу взята схема предусилителя, описанного в [3], и она была переработана с учётом изложенного выше. Номиналы пассивных элементов рассчитаны с учётом следующих условий – минимум номиналов конденсаторов; достаточная перегрузочная способность и минимальные нелинейные искажения на частоте 20 кГц. Наличие высококачественных конденсаторов К71-7 (полистирольные, выпаяны из платы телевизора ЗУСЦТ) ёмкостью 4700 пФ ±1 % дало начало расчёту параметров остальных элементов частотной коррекции.
Усилитель-корректор содержит два каскада. Первый выполнен на малошу-мящем двухканальном ОУ КМ551УД2А, у которого уровень собственного шума, приведённый к входу, не превышает 1 мкВ в полосе частот 20 Гц…20 кГц. Собственно, он и был разработан для применения в УК (у ОУ К157УД2 этот показатель достигает 1,6 мкВ). Этот каскад имеет равномерную АЧХ и коэффициент усиления Ку=16. Цепи коррекции C2R4 и C3R5 обеспечивают коррекцию АЧХ ОУ DA1, необходимую для устойчивости и достаточной скорости нарастания выходного напряжения.
Выход ОУ DA1 нагружен генератором тока на транзисторе VT1, обеспечивающим работу выходного каскада ОУ в режиме А с током покоя около 4 мА (при этом корпус микросхемы нагревается до 40 °С). Цепь R7,C5,R9 формирует пассивную коррекцию с постоянной времени (R7IIR9)C5 = 75 мкс, где сопротивление параллельно соединённых резисторов R7IIR9 = R7-R9(R7+R9). Сопротивление нагрузки ОУ DA1 с учётом параллельно включённых цепей R3+R4 и R7C5 на частоте 20 кГц немногим превышает 600 Ом, что соответствует перегрузочной способности входного каскада 15 дБ на частоте 20 кГц при Кг=0,015 %.
Второй каскад УК выполнен на ОУ К553УД2 (DA2) в инвертирующем включении (Ку=10 на частоте 1 кГц), а благодаря применению коррекции по опережению через конденсатор 09 увеличена скорость нарастания выходного напряжения.
Основные постоянные времени (т = R C) корректирующих RC-цепей, включённых в цепь ОС, равны R11 С12 = = 318 мкс, R12 C12 = 3180 мкс. Ещё одна постоянная времени определяется номиналами элементов R7, R9, С7 и в соответствии с рекомендациями RIAA-78 равна (R7+R9)-C7 = 7950 мкс.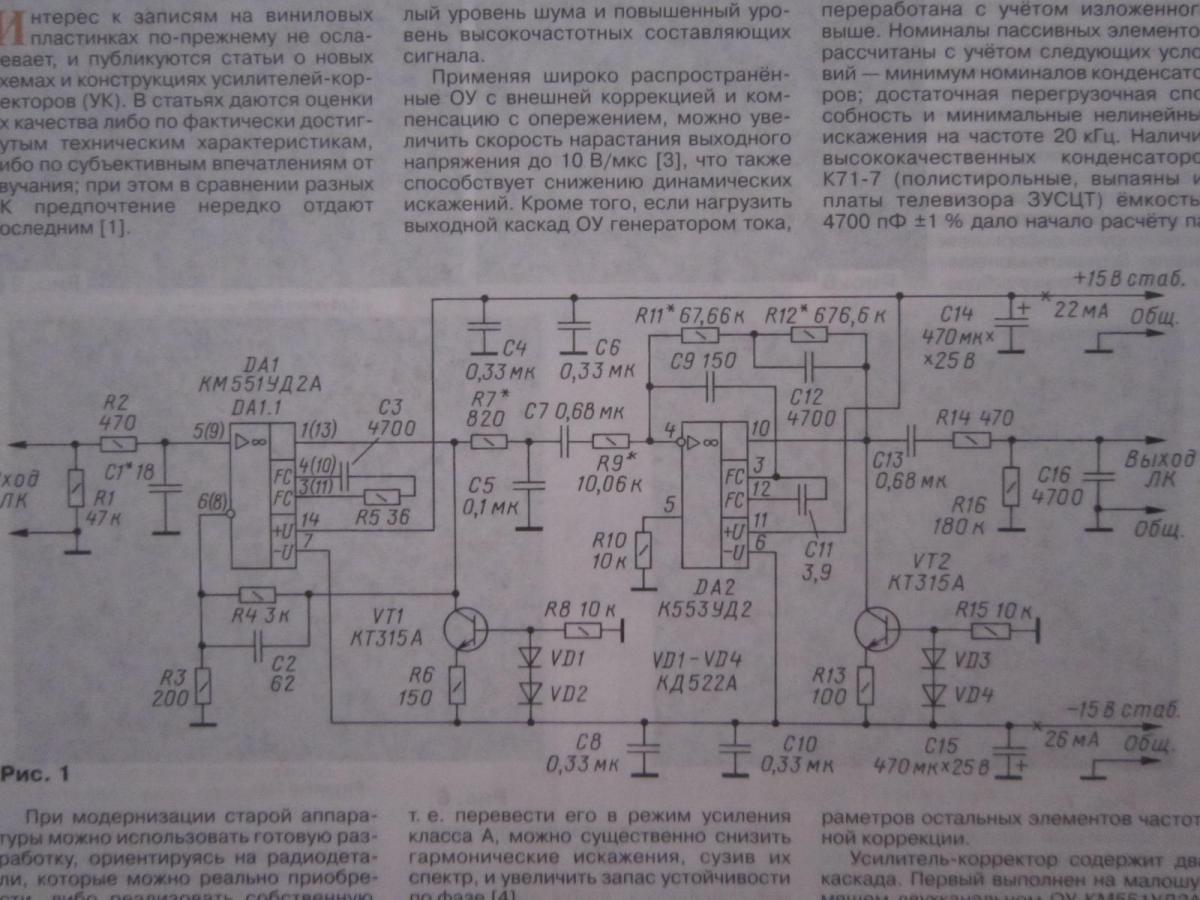
Выход ОУ DA2 также нагружен генератором тока на транзисторе VT2, который обеспечивает работу выходного каскада ОУ в режиме А с током покоя 6 мА.
Цепь C13R16 вместе с последующей нагрузкой сопротивлением 47 кОм образует ФВЧ с частотой среза 12,5 Гц для ослабления инфранизкочастотных помех от работы двигателя ЭПУ и при проигрывании покоробленных грампластинок, а ФНЧ R14C16 с частотой среза 72 кГц ослабляет шумы и высокочастотные помехи. Конденсаторы С4, С6, С8, СЮ, С14, С15 – фильтрующие по цепям питания, общие для обоих каналов УК. Коэффициент усиления в каналах УК на частоте 1 кГц равен 103.
В УК применены резисторы МЛТ-0,25 (можно МЛТ-0,125) с допуском ±5%, помеченные на схеме звёздочкой составляют из двух подобранных и соединённых последовательно; конденсатор С5 – К73-17 с допуском ±5 % (от ЗУСЦТ), конденсаторы С7, С13 – К10-47 (ТКЕ – ИЗО), но лучше импортные плёночные (например, малогабаритные HITANO из групп МЕТ, МЕВ на 100 В) с таким же допустимым отклонением. Эти конденсаторы подобраны с помощью мультиметра попарно для каждого из каналов, а затем по приведённым формулам рассчитаны сопротивления соответствующих резисторов. Остальные конденсаторы – К10-47, КМ-5, КМ-6, КТ, КД и импортные оксидные (Jamicon).
Остальные конденсаторы – К10-47, КМ-5, КМ-6, КТ, КД и импортные оксидные (Jamicon).
Транзисторы VT1, VT2 – КТ315, КТ3102 с любым буквенным индексом (при УСЛОВИИ Uкэ max > 25 В). Диоды VD1-VD4 – маломощные кремниевые серий КД521, КД522, КД503 и аналогичные. Вместо ОУ К553УД2 можно применить LM301.
Рис. 2
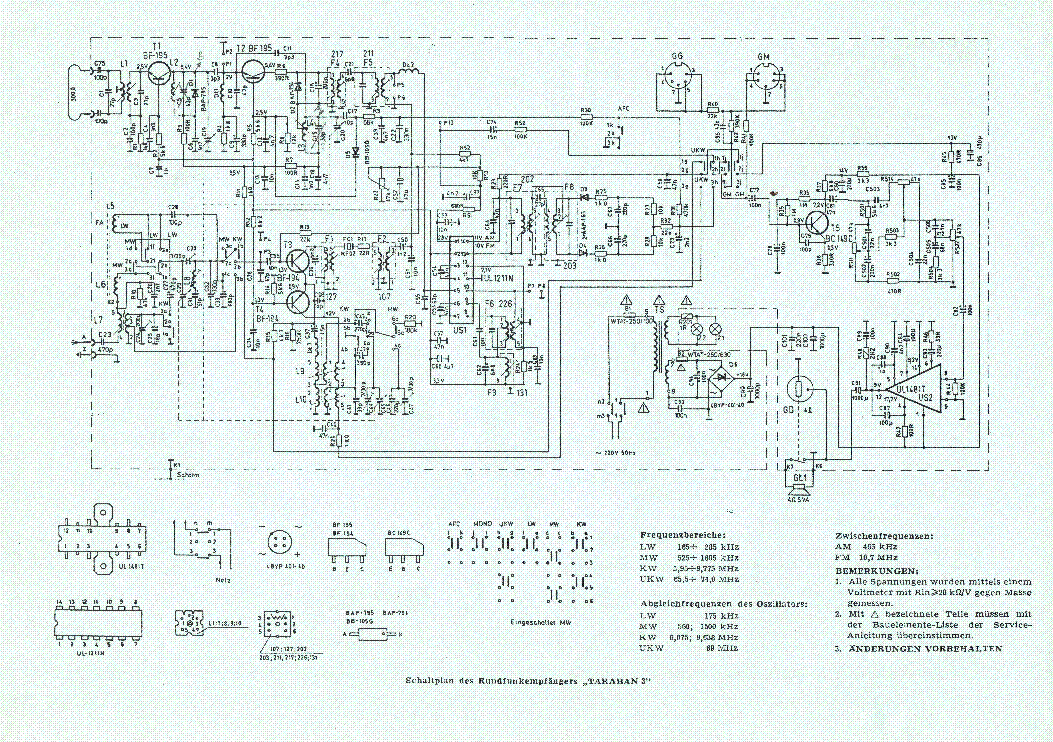
Все детали УК размещены на печатной плате размерами 115×77 мм из двусторонне фольгированного стеклотекстолита толщиной 2 мм. Чертёж печатной платы показан на рис. 2. Для удобства монтажа неиспользуемые выводы микросхем (или панелек) изгибают под углом либо отламывают. В первую очередь монтируют радиоэлементы, пайка которых осуществляется со стороны расположения элементов. Нумерация и расположение деталей левого канала соответствуют аналогичным, отражённым на рис. 2,б ниже средней линии платы деталям правого канала, за исключением общих для обоих каналов.
Правильно собранное устройство в налаживании не нуждается. Необходимо лишь, при наличии измерительной грампластинки, подобрать ёмкость конденсатора С1, добиваясь минимальной неравномерности АЧХ УК в полосе частот 10.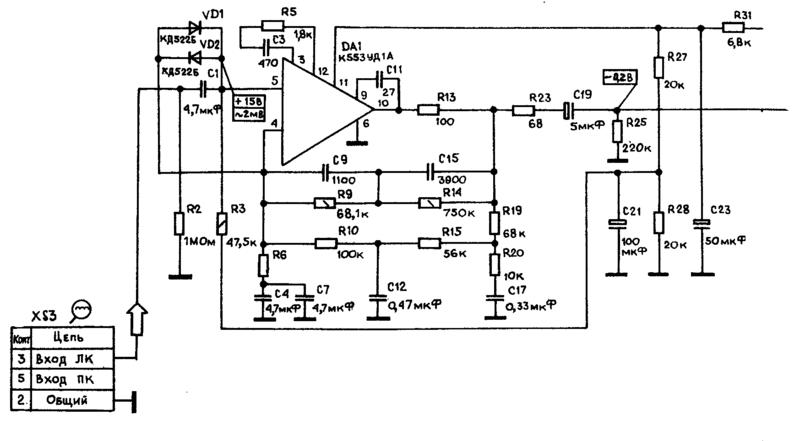 ..20 кГц (проигрывая зоны записи № 3-6).
..20 кГц (проигрывая зоны записи № 3-6).
В качестве входных экранированных проводников были использованы два отрезка коаксиального кабеля РК-75-2-13 м (погонная ёмкость 68 пФ/м) длиной по 88 см (С = 60 пФ), что вместе с конденсатором С1 и ёмкостью монтажа См = 4 пФ составляют рекомендуе-
мую для головки MF-104 ёмкость нагрузки 82 пФ. Впрочем, для нового корректора при желании можно подобрать головку и более высокого качества.
Питается УК от стабилизированного блока питания (в авторском варианте на интегральных стабилизаторах напряжения 7815 и 7915). Напряжение питания подаётся двумя короткими витыми парами.
Плату УК целесообразно поместить в экран, защищающий от электромагнитных полей. При налаживании и эксплуатации проявился эффект – уровень фона зависит от включения сетевой вилки проигрывателя: в одном положении фон есть, а в другом – нет; причина – в наличии ёмкостной связи между обмотками сетевого трансформатора при отсутствии реального заземления и третьего провода в сетевом шнуре.
С имеющейся в наличии измерительной аппаратурой объективно удалось оценить только скорость нарастания выходного напряжения УК. Для этого с функционального генератора на вход УК (при отключённом конденсаторе С5) был подан синусоидальный сигнал частотой 20 кГц до наступления ограничения сигнала на выходе ОУ DA2. Затем вместо синусоидального был подан импульсный сигнал (меандр) чуть меньшей амплитуды. Сигнал контролировался осциллографом на входе УК, выходе ОУ DA1 и выходе ОУ DA2. Форма сигнала на выходе ОУ DA1 практически соответствует форме входного, а на выходе ОУ DA2 сигнал имеет небольшой выброс. При уменьшении амплитуды входного сигнала в два раза выброс практически пропадает.
Субъективная оценка отношения сигнал/шум показала, что при заданном максимальном уровне громкости уровень шума едва заметен и намного ниже по сравнению с уровнем шума немой канавки грампластинки.
Субъективная оценка качества звуковоспроизведения проводилась без эталонного УК. Результат меня порадовал: при прослушивании классической музыки отметил чистоту звучания во всём звуковом спектре. Использованы следующие диски: Бах К. Ф. Э. Концерт для клавесина и струнного оркестра (С10-12417-8, Рижский завод грампластинок, 1978 г.), Рыбников А. “Юнона” и “Авось” (С60-18627-30, Ленинградский завод грампластинок, 1980 г.), Pink Floyd “Delicate Sound of Thunder” Live (F60-00543-007, цифровая, Апрелевский завод грампластинок, 1989 г.).
Литература:
1. Гурский А. Предусилители-корректоры на полевых транзисторах. – Радио, 2010, № 9, с. 16-19.
2. Лукьянов С. О перегрузочной способности корректирующего усилителя. – Радио, 1985, №10, с. 33-35.
3. Алексенко А., Коломбет Е., Старо-дуб Г. Применение прецизионных аналоговых микросхем. – М.: Радио и связь, 1985.
4. Снижение искажений интегральных ОУ. – Радио, 1985, № 6, с. 62.
5. Муринов А. Предусилитель-корректор. – Радио, 2008, № 2, с..14-16.
Автор: С. Семихатский, г. Ейск Краснодарского края
| Наименование | Тип | Размер, К | Файл |
| 0-ЭПУ-82СК | электропроигр. устр-во устр-во | 74 | el11.djvu |
| 1-ЭПУ-70С | электропроигр. устр-во | 22 | el10.djvu |
| 2-ЭПУ-65СМ | электропроигр. устр-во | 16 | el22.djvu |
| 3-ЭПУ-48 | электропроигр. устр-во | 29 | el52.djvu |
| Аккорд 101 стерео | электрофон | 84 | el43.djvu |
| Аккорд 201 стерео | электрофон | 38 | el49.djvu |
| Аккорд 202 стерео | электрофон | 26 | el44.djvu |
| Ария 102 стерео | заводская схема справочная схема | 208 | el31.djvu |
| Ария ЭФ5303С стерео | электрофон | 110 | el33.djvu |
| Арктур 003 стерео | электрофон | 79 | el21.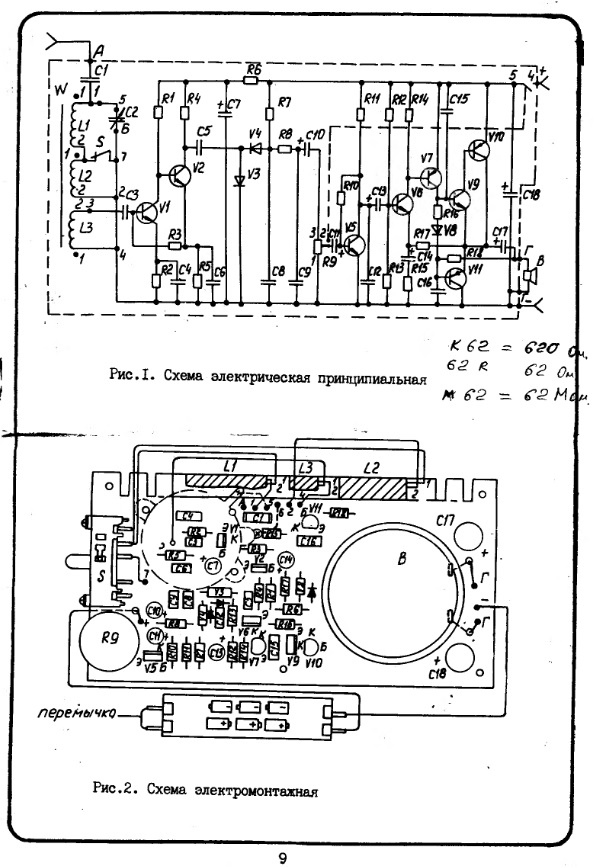 djvu djvu |
| Арктур 004(003) стерео | электрофон | 86 | el34.djvu |
| Арктур 006 стерео (ЭПУ G2021) | электропроигрыватель | 35 | el8.djvu |
| Вега 002 стерео | электрофон | 69 | el47.djvu |
| Вега 103 стерео | электрофон | 71 | el42.djvu |
| Вега 104 стерео | электрофон | 72 | el27.djvu |
| Вега 106 стерео | электропроигрыватель | 17 | el20.djvu |
| Вега 108 стерео | электрофон | 73 | el41.djvu |
| Вега 109 стерео | ЭПУ G602 электрофон | 55 | el9_1.djvu |
| Вега 110 стерео | электрофон | 69 | el48.djvu |
| Вега ЭП-110 стерео | электропроигрыватель | 48 | el1. djvu djvu |
| Вега 206 стерео | электропроигрыватель | 16 | el35.djvu |
| Вега 117 стерео | комплекс | 118 | el29.djvu |
| Корвет 038 стерео | электропроигрыватель | 36 | el7.djvu |
| Лидер 302 | электрофон | 15 | el46.djvu |
| Мелодия 103 стерео | электрофон | 65 | el36.djvu |
| Ноктюрн 211 | электрофон | 25 | el28.djvu |
| Ноктюрн 212 стерео | электрофон | 28 | el25.djvu |
| Радиотехника 001 стерео | электропроигрыватель | 20 | el30.djvu |
| Радиотехника ЭП101 стерео | электрофон | 24 | el12.djvu |
| Радиотехника 301 стерео | электрофон | 48 | el26.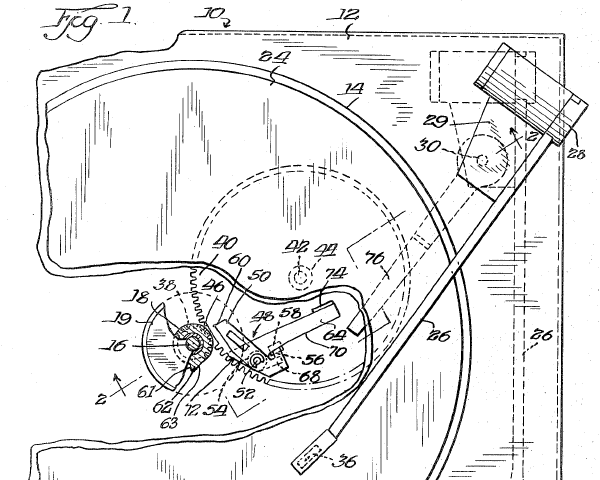 djvu djvu |
| Рондо 204(203) стерео | электрофон | 42 | el32.djvu |
| Рондо 206 стерео | электрофон | 69 | el39.djvu |
| Россия 105 стерео | электрофон | 156 | el51.djvu |
| Россия 105 стерео (1-ЭПУ-95СМ) | электропроигрыватель | 52 | el5.djvu |
| Электроника 012 | электропроигрыватель | 22 | el6.djvu |
| Электроника Б1-01 стерео | электроакустическое устр. электропроигрыватель | 133 | el2_1.djvu |
| Электроника Д1-012 стерео | электрофон | 110 | el24.djvu |
| Электроника ЭП-017 стерео | электропроигрыватель | 300 | el50.djvu |
| Электроника ЭП-060 стерео | электропроигрыватель | 67 | el4. |
| Эстония 010 стерео | электропроигрыватель | 171 | el3.djvu |
| Эстония ЛП-001С | СД проигрыватель | 215 | el40_1.djvu |
| Юность 301 | электрофон ламповый | 17 | el23.djvu |
Арктур 006 инструкция по ремонту – JSFiddle
Editor layout
Classic Columns Bottom results Right results Tabs (columns) Tabs (rows)
Console
Console in the editor (beta)
Clear console on run
General
Line numbers
Wrap lines
Indent with tabs
Code hinting (autocomplete) (beta)
Indent size:2 spaces3 spaces4 spaces
Key map:DefaultSublime TextEMACS
Font size:DefaultBigBiggerJabba
Behavior
Auto-run code
Only auto-run code that validates
Auto-save code (bumps the version)
Auto-close HTML tags
Auto-close brackets
Live code validation
Highlight matching tags
Boilerplates
Show boilerplates bar less often
Archive – RECEIVER.
 BY
BYa quick search in the archives of amateur publications
Recent searches
SIEMENS M50 LG Overwiew(Языковая таблица) [1], мп-407 [1], Panasonic TC21S1 [1], Cenmax V-200*. Схема подключения. [1], электронное реле [5], электроника Б6-403 [2], телефон [135], радиоприёмник [185], источник питания [159], блок питания [176], блок питания [238], Электроника Б1-01 стерео [4], ТЕС 7М – лабораторный блок питания [1], Схема подключения автосигнализации [7], Схема подключения [127], Схема М [127], Схема [813], Регулятор [137], Музыкальный звонок [14], Источник питания [145], Ореанда 204С (стереомагнитола) – 72Кб [1], яуза [28], Маяк 240С-1 [3], Ленинград 002 [2], Гетеродинный измеритель резонанса (ГИР) [1], Приципиальная схема субмодуля радиоканала СМРК-1-6 [1], Мегаомметр МЕГ-9 формуляр [1], 201 [148], е7-13 [2], Измеритель [108], синтезатор [68], Ч3-36 частотомер электронносчетный [1], Электронные часы [2], Весна 3 [5], аон [284], Перевод инструкции к музыкальному центру Panasonic [2], Осциллограф С8-37 [1], Осциллограф С1-107 [3], Осциллограф С1-101 Электрическая схема [1], Осциллограф С1-101 [2], Осциллограф С1-1 [30], Осциллограф ОМЛ-3М [4], Основная плата КВ-трансивера [2], Орленок 605 [4], Ореол 23ТБ-307 [1], Орель 101 [1], Ореанда 204с [7], Одиссей-002 стерео (транзисторный) – 85Кб [1], Одиссей-002 стерео [1], Одиссей-001 стерео (транзисторный) – 72Кб [1], Одиссей-001 стерео [3], Одиссей 100У-021 (некачеств. !) – 210Кб [1], Обыкновенный FM приёмник [1], Обзор по антеннам “Дельта”- 2 [1], ОР-1 осциллограф радиолюбителя [1], Нота 225 стерео (полупровод.) – 260Кб [1], Нота МП-220С (приставка (дека)) – 94Кб [1], Немного о ГПД. [1], Нейва 402 – переносной радиоприёмник [2], Нева 2 – Радиоприемник (СССР) транзисторный 22Kb [2], НАСТРОЙКА АНТЕНН С ПОМОЩЬЮ ИЗМЕРИТЕЛЯ АЧХ [1], Милливольтметр В3-33 [2], Меридиан 206 [3], Мезон 201 и 202 – радиоприёмник и радиола [2], Мезон 201 и 202 – радиоприёмник [2], Мегомметр Е6-4А [1], Мегаомметр МЕГ-9 [1], Маяк 240С-1 – Магнитофон [2], Маяк 232 стерео (приставка (дека)) – 175Кб [1], Маяк 205 [1], Маяк 203 [1], Маяк 1 – Радиоприемник (СССР) транзисторный 8Kb [2], Маяк 001 – стереофонический магнитофон [2], Зажигание лазерного светодиода [2], Маяк 001 стерео (приставка (дека)) – 80Кб [1], Магнитофон “Вега-МП-122-стерео” [1], Магазин сопротивления Р4831 [1], МОСТОВАЯ СХЕМА НА TDA2005 [4], МИКШЕРНЫЕ И РАЗВЕТВЛЯЮЩИЕ КАСКАДЫ [3], МИКРОСХЕМЫ КР142ЕН12 [1], МБУ-101 многоканальный блок управления [1], МАЧТОВОЕ УСТРОЙСТВО “ЧИНАРА” [2], МАЛОМОЩНЫЙ СВАРОЧНЫЙ АППАРАТ [3], Лира РП231 [2], Лира РП 241 (транзисторный) – 61Кб [1], Лира РП 231 (полупроводн.
!) – 210Кб [1], Обыкновенный FM приёмник [1], Обзор по антеннам “Дельта”- 2 [1], ОР-1 осциллограф радиолюбителя [1], Нота 225 стерео (полупровод.) – 260Кб [1], Нота МП-220С (приставка (дека)) – 94Кб [1], Немного о ГПД. [1], Нейва 402 – переносной радиоприёмник [2], Нева 2 – Радиоприемник (СССР) транзисторный 22Kb [2], НАСТРОЙКА АНТЕНН С ПОМОЩЬЮ ИЗМЕРИТЕЛЯ АЧХ [1], Милливольтметр В3-33 [2], Меридиан 206 [3], Мезон 201 и 202 – радиоприёмник и радиола [2], Мезон 201 и 202 – радиоприёмник [2], Мегомметр Е6-4А [1], Мегаомметр МЕГ-9 [1], Маяк 240С-1 – Магнитофон [2], Маяк 232 стерео (приставка (дека)) – 175Кб [1], Маяк 205 [1], Маяк 203 [1], Маяк 1 – Радиоприемник (СССР) транзисторный 8Kb [2], Маяк 001 – стереофонический магнитофон [2], Зажигание лазерного светодиода [2], Маяк 001 стерео (приставка (дека)) – 80Кб [1], Магнитофон “Вега-МП-122-стерео” [1], Магазин сопротивления Р4831 [1], МОСТОВАЯ СХЕМА НА TDA2005 [4], МИКШЕРНЫЕ И РАЗВЕТВЛЯЮЩИЕ КАСКАДЫ [3], МИКРОСХЕМЫ КР142ЕН12 [1], МБУ-101 многоканальный блок управления [1], МАЧТОВОЕ УСТРОЙСТВО “ЧИНАРА” [2], МАЛОМОЩНЫЙ СВАРОЧНЫЙ АППАРАТ [3], Лира РП231 [2], Лира РП 241 (транзисторный) – 61Кб [1], Лира РП 231 (полупроводн. ) – 80Кб [1], Линейный усилитель мощности [8], Линейный усилитель мощности [13], Линейная шкала квазианалового тахометра [2], Линейка AC/DC преобразователей фирмы ROHM [1], Ленинград 010 стерео (транзисторный) – [1], Легенда 404 (транзисторный) – 40Кб [1], Ласпи 005 стерео (транзисторный) – 133Кб [1], Ламповый SE усилитель на 6V6 [1], Ламповый SE усилитель на 50c5 [1], Ламповый PP усилитель 50 Ватт на ГУ50 [1], Ламповый усилитель OTL на 6С19П [1], Ламповый усилитель Genelex 35W [1], Конвертер [45], 144 мгц [70]
) – 80Кб [1], Линейный усилитель мощности [8], Линейный усилитель мощности [13], Линейная шкала квазианалового тахометра [2], Линейка AC/DC преобразователей фирмы ROHM [1], Ленинград 010 стерео (транзисторный) – [1], Легенда 404 (транзисторный) – 40Кб [1], Ласпи 005 стерео (транзисторный) – 133Кб [1], Ламповый SE усилитель на 6V6 [1], Ламповый SE усилитель на 50c5 [1], Ламповый PP усилитель 50 Ватт на ГУ50 [1], Ламповый усилитель OTL на 6С19П [1], Ламповый усилитель Genelex 35W [1], Конвертер [45], 144 мгц [70]Усовершенствованный адаптер к проигрывателю «Арктур-006» для MC-картриджа
Первая версия адаптера проработала у меня около 3-х лет. Потом, в связи с улучшением звукового тракта, появилось желание сравнить звучание этого адаптера с пермаллоевыми повышающими трансформаторами (1:10). Результат был ожидаемым — адаптер звучал не очень хорошо — всё познаётся в сравнении. Далее описана улучшенная конструкция устройства, обладающая лучшим звучанием. Она используется совместно с доработанным проигрывателем «Арктур-006» — внутри «встроен» один из вариантов усилителя-корректора «Lynx04», предприняты меры по демпфированию корпуса проигрывателя и введены другие улучшения. Описываемый адаптер включается с помощью штыревого разъёма СШ-5 (DIN-5) в гнездо для «заглушки» сзади проигрывателя с надписью “~5 мВ”. Конечно же, нет никакого смысла использовать MC-картридж и такой адаптер со штатным усилителем-корректором «Арктур-006»! Но можно изменить конструкцию адаптера так, чтобы его можно было подключить к внешнему усилителю-корректору.
Описываемый адаптер включается с помощью штыревого разъёма СШ-5 (DIN-5) в гнездо для «заглушки» сзади проигрывателя с надписью “~5 мВ”. Конечно же, нет никакого смысла использовать MC-картридж и такой адаптер со штатным усилителем-корректором «Арктур-006»! Но можно изменить конструкцию адаптера так, чтобы его можно было подключить к внешнему усилителю-корректору.
Адаптер собран в таком же алюминиевом корпусе BS31BK, как и раньше — размером 80x55x25 мм, а его питание осуществляется от внешнего силового трансформатора, размещённого в сетевой вилке (я использовал блок питания от модема «3Com U.S. Robotics 5630» с заявленным выходным напряжением ~9В и напряжением холостого хода — порядка ~11В). Немаловажное значение имеет размещение силового трансформатора вдали от входных чувствительных цепей. Следует также учитывать, что адаптер чувствителен к импульсным помехам от различных (и, как правило, многочисленных) окружающих устройств (например, таких, как светодиодные лампы с импульсным питанием).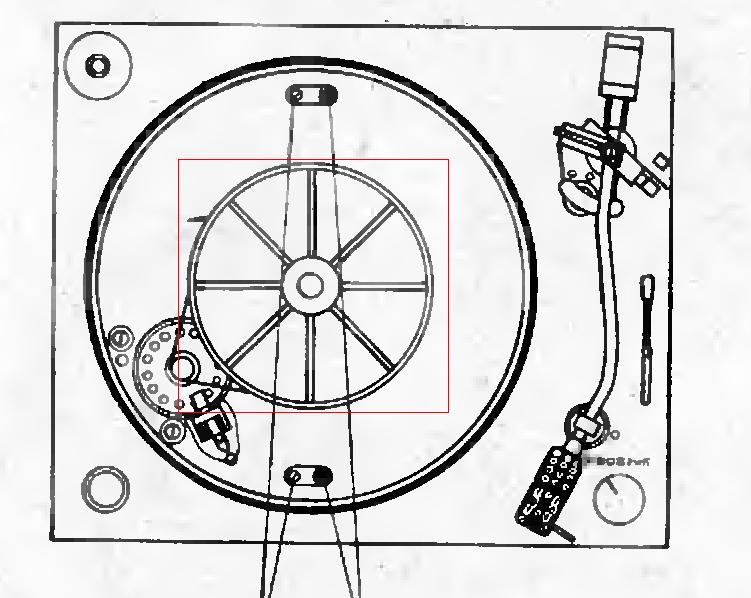 Часть этих помех может проникать через электрическую питающую сеть, а также воздействовать в виде электромагнитных наводок даже на кабель, по которому поступает входное переменное питающее напряжение через разъём X3. Для снижения воздействия помех через сеть необходимо использовать сетевой фильтр, а для снижения наводок желательно заэкранировать питающий кабель и/или по возможности подобрать экспериментально его оптимальное расположение. Уровень влияния наводок на кабель можно немного снизить, продев его в виде петли через ферритовое кольцо вблизи разъёма X3. Так как потребляемый адаптером ток очень мал, устройство может оставаться подключенным к питающей сети практически круглосуточно.
Часть этих помех может проникать через электрическую питающую сеть, а также воздействовать в виде электромагнитных наводок даже на кабель, по которому поступает входное переменное питающее напряжение через разъём X3. Для снижения воздействия помех через сеть необходимо использовать сетевой фильтр, а для снижения наводок желательно заэкранировать питающий кабель и/или по возможности подобрать экспериментально его оптимальное расположение. Уровень влияния наводок на кабель можно немного снизить, продев его в виде петли через ферритовое кольцо вблизи разъёма X3. Так как потребляемый адаптером ток очень мал, устройство может оставаться подключенным к питающей сети практически круглосуточно.
Рассмотрим принципиальную схему адаптера:
Основное изменение в схеме претерпел блок стабилизаторов — он практически целиком заимствован из узла питания референса ЦАПа AH-D7T на AK4497 (разработка Андрея), который построен на основе «стабилизаторов Назара» (VT1, VT2, VT4, VT5, VT7, VT8, VT10, VT11 на рассматриваемой схеме), подключённых к выходам стабилизаторов на ОУ (DA3, DA4, VT3, VT6, VT9, VT12).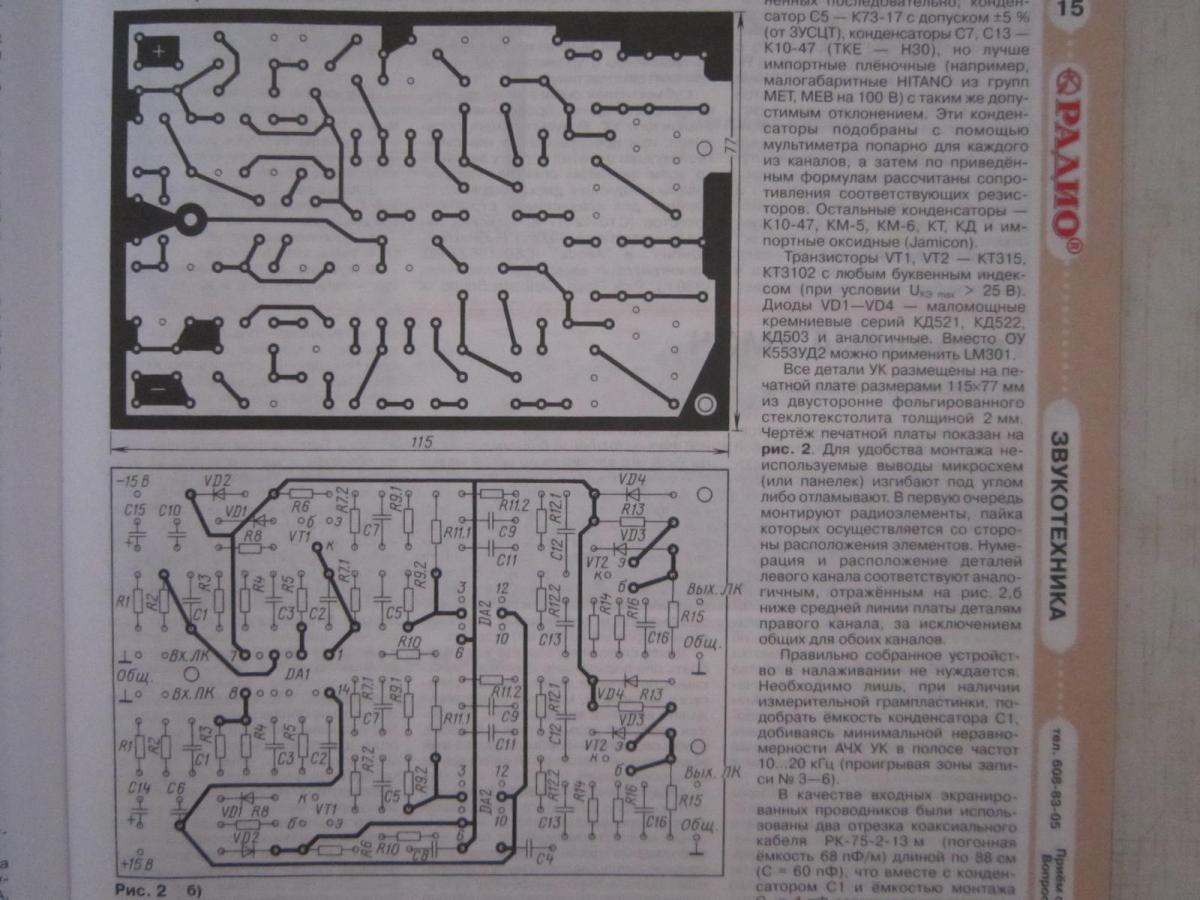 Для каждого канала усилителя и каждого плеча питания (+ / -) используются отдельные стабилизаторы (всего — четыре).
Для каждого канала усилителя и каждого плеча питания (+ / -) используются отдельные стабилизаторы (всего — четыре).
Сначала в качестве входных усилителей DA1, DA2 были применены те же ОУ AD797, что в первоначальной схеме, но оказалось, что они звучат хуже, чем более современные OPA1611 (биполярные малошумящие), которые и были взяты за основу. От цепей балансировки R6, R12 пришлось отказаться, но и без них постоянное напряжение на выходах ОУ не превышает величины ±0.3 мВ. Операционные усилители OPA1611 смонтированы на переходниках SOIC-8 — DIP-8:
Примечание: Впоследствии в самом усилителе корректоре «Lynx04» также были заменены операционные усилители AD743 на новейшие OPA828IDR — с ними звучание стало лучше.
В сигнальных цепях ОУ DA1, DA2 применены исключительно тонкоплёночные резисторы (типоразмера 0805). Электролитические конденсаторы в фильтрах питания по постоянному току — аудио «Nichicon KA» (C47, C49, C48, C50), «Nichicon KZ Muse» (C13, C23, C33, C40), остальные — «Nichicon FG». Использованы также плёночные конденсаторы PPS (C16, C26, C36, C43, C22, C32) и керамические NP0 (C1, C2, C3, C5, C7, C8, C9, C11, C14, C24, C34, C41, C19, C29, C39, C46). Хорошие результаты дала установка плёночных конденсаторов PPS (C4, C6, C10, C12) вместо керамики NP0 (C3, C5, C9, C11) такого же номинала. Можно увеличить ёмкость конденсаторов C3, C6, C10, C12 до 1 мкФ (PPS) и исключить при этом электролитические конденсаторы C13, C23, C33, C40.
Использованы также плёночные конденсаторы PPS (C16, C26, C36, C43, C22, C32) и керамические NP0 (C1, C2, C3, C5, C7, C8, C9, C11, C14, C24, C34, C41, C19, C29, C39, C46). Хорошие результаты дала установка плёночных конденсаторов PPS (C4, C6, C10, C12) вместо керамики NP0 (C3, C5, C9, C11) такого же номинала. Можно увеличить ёмкость конденсаторов C3, C6, C10, C12 до 1 мкФ (PPS) и исключить при этом электролитические конденсаторы C13, C23, C33, C40.
Конденсаторы C53, C54 (керамические X7R на напряжение не ниже 50 вольт) и резистор R73 выполняют роль RC-фильтра. Конденсаторы C51, C52 служат для получения напряжения отрицательной полярности от одной обмотки трансформатора (Двуполярное питание от одной обмотки. Журнал «Радио», 1982, №7, с.61). Стабилитроны ZD3, ZD4 выполняют защитную функцию — их ставить не обязательно. Излишки напряжения гасятся резисторами R69, R72 и реактивным сопротивлением конденсаторов C51, C52 (суммарно — порядка 30 Ом на частоте 50 Гц). Напряжение на выходе выпрямителей после резисторов R69, R72 под нагрузкой должно составлять 8. .10 вольт. Операционные усилители DA3 и DA4 («rail-to-rail» типа OPA1642 или OPA1652) могут быть в корпусах SOIC-8 (запаиваются снизу платы) или VSSOP-8 (запаиваются сверху платы — у меня как раз лежала пара таких «без дела»).
.10 вольт. Операционные усилители DA3 и DA4 («rail-to-rail» типа OPA1642 или OPA1652) могут быть в корпусах SOIC-8 (запаиваются снизу платы) или VSSOP-8 (запаиваются сверху платы — у меня как раз лежала пара таких «без дела»).
Вид на монтаж печатной платы сверху (с ОУ AD797):
И снизу:
Печатная плата заземляется на металлический корпус с помощью двух пружин — они же выполняют и роль её «держателей». Места соприкосновения пружин с внутренней стороной верхней крышки нужно зачистить, и хорошо бы смазать «Циатимом».
После монтажа нужно проверить корректность питающих напряжений (±8..10В на выходах выпрямителей после гасящих резисторов, ±2,5В на стабилитронах ZD1, ZD2 типа LM4040-2.5, ±6,2В на входах «стабилизаторов Назара» и ±5В на их выходах в каждом канале) — на плате предусмотрены соответствующие контактные площадки. У меня конструкция заработала сразу без дополнительных настроек.
Рисунок печатной платы приведён в архивном файле во вложении.
На мой слух, грампластинка с таким адаптером и картриджем «Denon» DL-103 звучит очень «достойно», не намного хуже, чем с повышающими трансформаторами, несколько уступая последним в детальности на высоких частотах. Если допустимо такое сравнение, то различие в звучании примерно такое же, как между ЦАП AH-D6/mk3 AK4493 и ЦАП AH-D7T AK4497 с трансформаторным выхлопом.
Если допустимо такое сравнение, то различие в звучании примерно такое же, как между ЦАП AH-D6/mk3 AK4493 и ЦАП AH-D7T AK4497 с трансформаторным выхлопом.
Одна доза вакцины SARS-CoV-2 на основе самотранскрибирующейся и реплицирующейся РНК вызывает защитный адаптивный иммунитет у мышей
РЕЗЮМЕ
Вакцина на основе самотранскрибирующейся и реплицирующейся РНК (STARR ™) (LUNAR ® -COV19) был разработан для предотвращения заражения SARS-CoV-2. Вакцина кодирует репликон на основе альфавируса и гликопротеин с полноразмерным шипом SARS-CoV-2. Трансляция репликона производит комплекс репликазы, который усиливает и продлевает экспрессию гликопротеина SARS-CoV-2.Однократная первичная вакцинация мышей приводила к устойчивым ответам антител, при этом титры нейтрализующих антител увеличивались до 60 дня. Активация клеточного иммунитета вызвала сильный вирусный антигенспецифический ответ Т-лимфоцитов CD8 + . Анализ на окрашивание внутриклеточных цитокинов на IFN-γ и IL-4 положительных CD4 + Т-хелперных лимфоцитов, а также на соотношение гликопротеинов IgG2a / IgG1 против спайков поддерживало сильный Th2-доминантный иммунный ответ. Наконец, однократная вакцинация LUNAR-COV19 в дозах 2 мкг и 10 мкг полностью защищала человеческих трансгенных мышей ACE2 как от смертности, так и от поддающейся измерению инфекции после заражения SARS-CoV-2 дикого типа.Наши результаты в совокупности предполагают потенциал Lunar-COV19 в качестве однократной вакцины.
Наконец, однократная вакцинация LUNAR-COV19 в дозах 2 мкг и 10 мкг полностью защищала человеческих трансгенных мышей ACE2 как от смертности, так и от поддающейся измерению инфекции после заражения SARS-CoV-2 дикого типа.Наши результаты в совокупности предполагают потенциал Lunar-COV19 в качестве однократной вакцины.
ВВЕДЕНИЕ
Пандемия коронавирусной болезни-2019 (COVID-19) поразила десятки миллионов людей, из которых сотни тысяч умерли от тяжелой респираторной дисфункции и других осложнений этого заболевания [1]. Этиологическим агентом COVID-19 является коронавирус 2 тяжелого острого респираторного синдрома (SARS-CoV-2), который, возможно, сначала возник из зоонозного источника, а затем передавался от человека к человеку до глобального распространения [1].Текущие меры контроля по сдерживанию пандемии, такие как блокировка по всей стране, закрытие рабочих мест и школ и сокращение международных поездок, угрожают втянуть мир в глобальную экономическую рецессию беспрецедентных масштабов [2]. Таким образом, срочно необходимы вакцины, обеспечивающие надежную защиту от инфекции SARS-CoV-2 [3]. Обнадеживает то, что в настоящее время ведутся разработки сотен различных вакцин, некоторые из которых даже вошли в фазу III клинических испытаний [4, 5].
Несмотря на то, что некоторые кандидаты достигают поздних стадий клинических испытаний, существует некоторая неуверенность в том, что производство может быть увеличено в достаточно сжатые сроки для производства миллиардов доз вакцины, необходимых для иммунизации населения мира [6].Более того, недавние результаты ранних испытаний вакцины против COVID-19 показали, что для достижения разумного уровня адаптивной иммунной памяти потребуется более одной дозы [7–9]. Прочная защита с помощью однократной дозы была достигнута с некоторыми вирусными живыми аттенуированными вакцинами (LAV), такими как вакцина против желтой лихорадки [10–12]. Однако, поскольку генетические детерминанты клинической пригодности SARS-CoV-2 четко не определены, разработка штамма LAV SARS-CoV-2, безопасного для использования на людях, является сложной задачей. Альтернативный подход заключался бы в имитации ключевых иммуногенных свойств живых вирусных вакцин, чтобы разработать альтернативную платформу вакцины, которая также могла бы быть эффективной для предотвращения COVID-19 с помощью однократной дозы. Однодозовая вакцина не только позволит избежать проблем с логистикой и соблюдением требований, связанных с многодозовыми вакцинами, но также позволит вакцинировать большее количество людей из каждой партии [6].
Альтернативный подход заключался бы в имитации ключевых иммуногенных свойств живых вирусных вакцин, чтобы разработать альтернативную платформу вакцины, которая также могла бы быть эффективной для предотвращения COVID-19 с помощью однократной дозы. Однодозовая вакцина не только позволит избежать проблем с логистикой и соблюдением требований, связанных с многодозовыми вакцинами, но также позволит вакцинировать большее количество людей из каждой партии [6].
РНК-вакцины предлагают быстрый подход к разработке вакцины против COVID-19 [13]. РНК-вакцины конструируются с использованием генетической последовательности вирусного антигена и быстро производятся с использованием бесклеточных, быстро масштабируемых методов [14].РНК инкапсулирована в липидную наночастицу (LNP), которая генерирует устойчивые иммунные ответы без необходимости применения адъювантов [15, 16]. Есть две основные категории РНК-вакцин; 1) вакцина с традиционной матричной РНК (обычная мРНК), в которой представляющий интерес иммуноген непосредственно транслируется из входного транскрипта вакцины, и 2) новые вакцины с самореплицирующейся РНК (репликон) [14].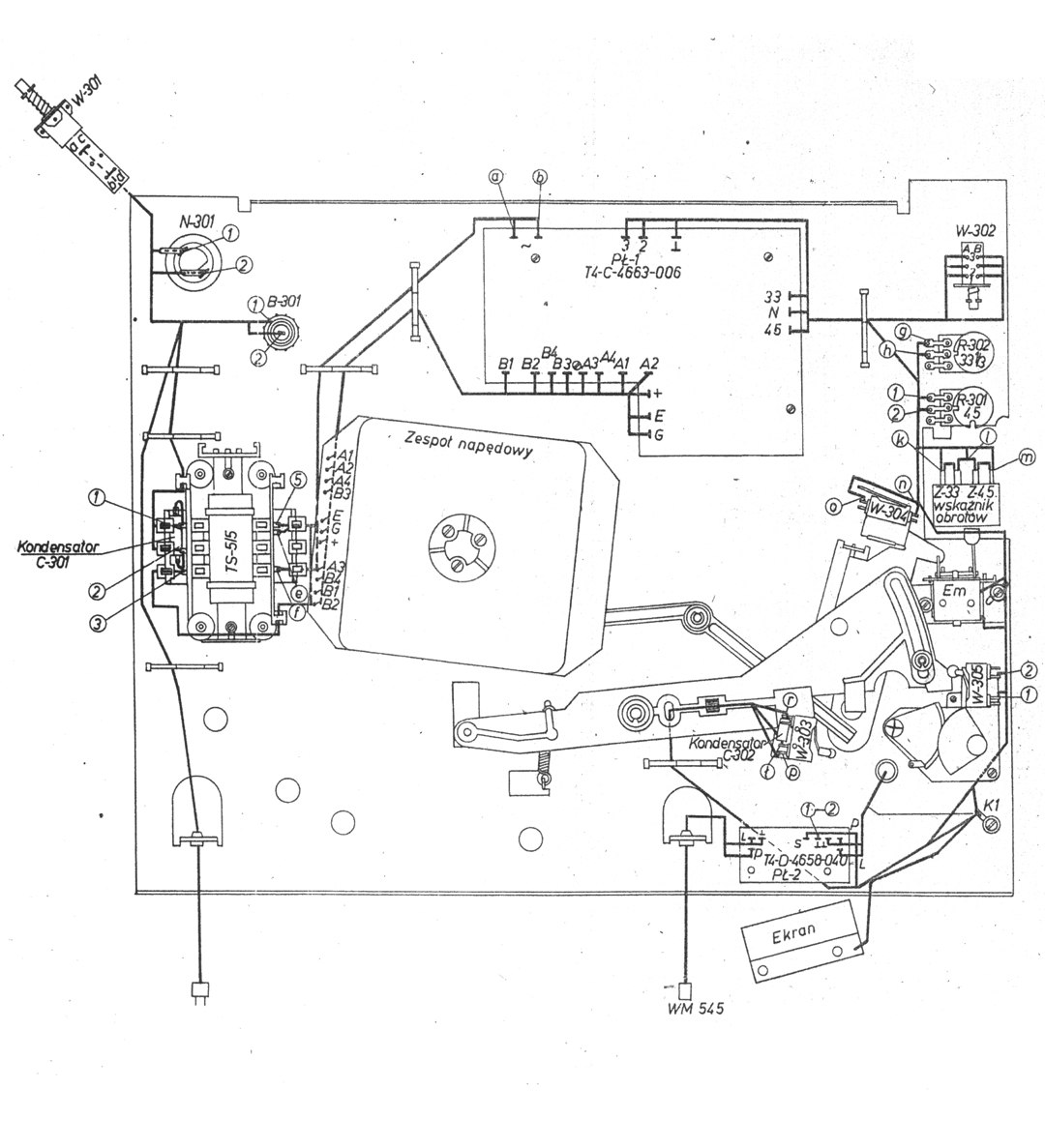 Репликонные вакцины кодируют механизм репликации, обычно комплекс репликации на основе альфавируса, который амплифицирует субгеномную РНК, несущую интересующий антиген, что приводит к амплификации транскриптов, несущих антиген, на несколько порядков по сравнению с начальной дозой [17].Длительная экспрессия антигена с помощью такой конструкции может не только вызывать очевидные эффекты экономии дозы [17], но потенциально также вызывать врожденные и адаптивные иммунные ответы, аналогичные тем, которые связаны с живыми вакцинами. Здесь мы демонстрируем прямое сравнение самовоспроизводящейся РНК-вакцины с использованием собственной самотранскрибирующейся и реплицирующейся РНК Arcturus (технология STARR ™ и обычной мРНК-вакцины против SARS-CoV-2 и предполагаем, что вакцина STARR, LUNAR-COV19 обеспечивает превосходный иммунный ответ, индуцированный вакциной, на обычную мРНК.
Репликонные вакцины кодируют механизм репликации, обычно комплекс репликации на основе альфавируса, который амплифицирует субгеномную РНК, несущую интересующий антиген, что приводит к амплификации транскриптов, несущих антиген, на несколько порядков по сравнению с начальной дозой [17].Длительная экспрессия антигена с помощью такой конструкции может не только вызывать очевидные эффекты экономии дозы [17], но потенциально также вызывать врожденные и адаптивные иммунные ответы, аналогичные тем, которые связаны с живыми вакцинами. Здесь мы демонстрируем прямое сравнение самовоспроизводящейся РНК-вакцины с использованием собственной самотранскрибирующейся и реплицирующейся РНК Arcturus (технология STARR ™ и обычной мРНК-вакцины против SARS-CoV-2 и предполагаем, что вакцина STARR, LUNAR-COV19 обеспечивает превосходный иммунный ответ, индуцированный вакциной, на обычную мРНК.
РЕЗУЛЬТАТЫ
Сравнение дизайна и экспрессии STARR и традиционных мРНК-платформ
Конструкции вакцины LUNAR-COV19 и обычные мРНК были разработаны для кодирования полноразмерного немодифицированного предварительно слитого S-белка SARS-CoV-2 (1273 aa), с LUNAR-COV19, дополнительно кодирующим гены репликазы вируса венесуэльского энцефалита лошадей (VEEV), необходимые для самоамплификации (, рис. 1A, ). Сначала мы определили характеристики этих различных конструкций, в состав которых входит один и тот же липидный состав LUNAR LNP.Несмотря на различия в длине РНК для LUNAR-COV19 и обычной мРНК, диаметр LNP, индекс полидисперсности и эффективность захвата РНК были одинаковыми (, рис. 1B, ). In vitro Экспрессия LUNAR-COV19 и стандартной мРНК вакцины была подтверждена в клеточном лизате через 24 часа после трансфекции посредством положительного вестерн-блоттинга S-белка (, фиг. 1C, ). Также было замечено, что обе вакцины экспрессировали смесь полноразмерного S-белка и расщепленного S-белка, т.е.е. в трансмембранные и цитоплазматические мембранные домены S1 и S2 (, рис. 1C, ). Затем мы сравнили in vivo экспрессию белка двух РНК-платформ у мышей BALB / c, используя STARR и обычные конструкции мРНК, которые экспрессировали репортер люциферазы (, фиг. 1D, ). Как и ожидалось, животные, которым вводили обычную конструкцию вакцины мРНК, демонстрировали высокую экспрессию люциферазы in vivo в день 1, хотя уровни экспрессии значительно снизились через три дня после инъекции.
1A, ). Сначала мы определили характеристики этих различных конструкций, в состав которых входит один и тот же липидный состав LUNAR LNP.Несмотря на различия в длине РНК для LUNAR-COV19 и обычной мРНК, диаметр LNP, индекс полидисперсности и эффективность захвата РНК были одинаковыми (, рис. 1B, ). In vitro Экспрессия LUNAR-COV19 и стандартной мРНК вакцины была подтверждена в клеточном лизате через 24 часа после трансфекции посредством положительного вестерн-блоттинга S-белка (, фиг. 1C, ). Также было замечено, что обе вакцины экспрессировали смесь полноразмерного S-белка и расщепленного S-белка, т.е.е. в трансмембранные и цитоплазматические мембранные домены S1 и S2 (, рис. 1C, ). Затем мы сравнили in vivo экспрессию белка двух РНК-платформ у мышей BALB / c, используя STARR и обычные конструкции мРНК, которые экспрессировали репортер люциферазы (, фиг. 1D, ). Как и ожидалось, животные, которым вводили обычную конструкцию вакцины мРНК, демонстрировали высокую экспрессию люциферазы in vivo в день 1, хотя уровни экспрессии значительно снизились через три дня после инъекции. Напротив, экспрессия люциферазы у мышей, которым инъецировали STARR, показала повышенный сигнал продукции белка по сравнению с обычной мРНК во все моменты времени после дня 1 – дня 7 после инокуляции (последняя измеренная временная точка) и при дозах ≥2,0 мкг экспрессия белка казалось, что на 7 день все еще растет (, рис. 1D, ). Эти данные показали, что доза за дозой конструкция люциферазы STARR давала более высокую и более продолжительную продолжительность экспрессии люциферазы по сравнению с мышами, которым вводили обычную конструкцию люциферазы мРНК.
Напротив, экспрессия люциферазы у мышей, которым инъецировали STARR, показала повышенный сигнал продукции белка по сравнению с обычной мРНК во все моменты времени после дня 1 – дня 7 после инокуляции (последняя измеренная временная точка) и при дозах ≥2,0 мкг экспрессия белка казалось, что на 7 день все еще растет (, рис. 1D, ). Эти данные показали, что доза за дозой конструкция люциферазы STARR давала более высокую и более продолжительную продолжительность экспрессии люциферазы по сравнению с мышами, которым вводили обычную конструкцию люциферазы мРНК.
A) Схематическая диаграмма самореплицирующейся РНК STARR SARS-CoV-2 (LUNAR ® -COV19) и обычных конструкций вакцины мРНК. Конструкция STARR кодирует четыре неструктурных белка, ns1-ns4, из вируса венесуэльского энцефалита лошадей (VEEV) и немодифицированный полноразмерный белок pre-fusion spike (S) SARS-CoV-2. Конструкция мРНК также кодирует тот же самый полноразмерный спайковый S-белок SARS-CoV-2. B) Физические характеристики и эффективность захвата РНК LNP, инкапсулирующего обычные вакцины с мРНК и LUNAR-COV19. C) Вестерн-блот-определение белка SARS-CoV-2 S после трансфекции клеток HEK293 LUNAR-COV19 и обычной мРНК. D) In vivo сравнение экспрессии белка после внутримышечного введения LNP, содержащего экспрессирующую люциферазу STARR РНК или обычную мРНК.Мышам Balb / c ( n = 3 / группа) внутримышечно вводили 0,2 мкг, 2,0 мкг и 10,0 мкг РНК STARR или обычной мРНК, приготовленной с той же липидной наночастицей. Экспрессию люциферазы измеряли по биолюминесценции in vivo и на 1, 3 и 7 дни после внутримышечного введения. S домен 1 = S1, S домен 2 = S2, трансмембранный домен = TM, цитоплазматический домен = CP; aka = также известен как.
Экспрессия иммунного гена после вакцинации LUNAR-COV19 и общепринятой мРНК
Мышей C57BL / 6J вакцинировали LUNAR-COV19 или общепринятыми мРНК-вакцинами при 0.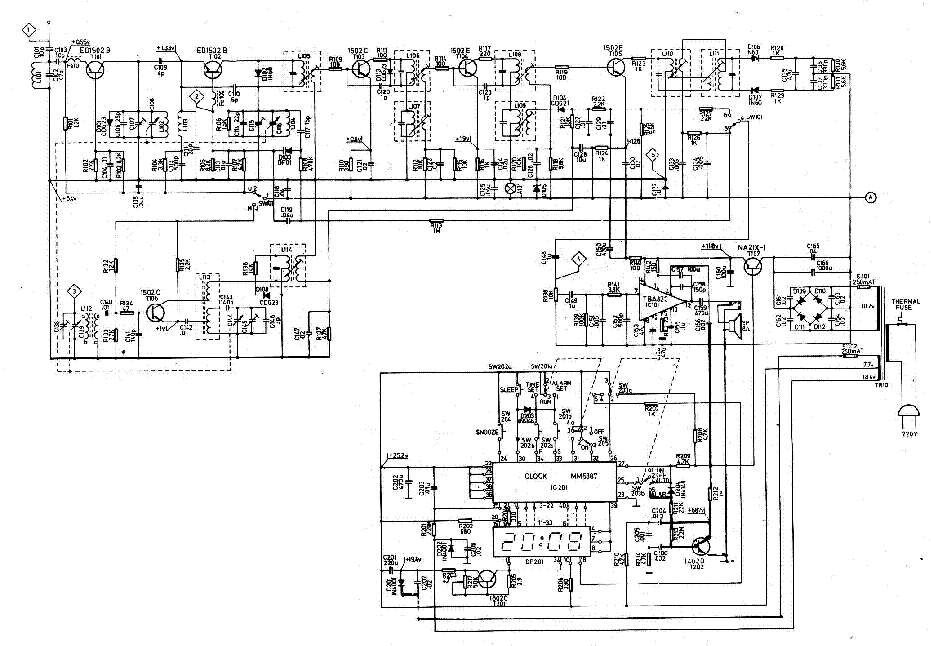 Дозы 2 мкг, 2 мкг и 10 мкг или контроль PBS. В течение первых 4 дней не наблюдалось значительной средней потери веса животных, за исключением тех, которые получили 10 мкг LUNAR-COV19 (, рис. 2A) . Однако, помимо потери веса, было немного других клинических признаков, о чем свидетельствуют минимальные различия в клинических показателях. Как вес, так и клинические показатели улучшились без происшествий после 3-го дня после вакцинации.
Дозы 2 мкг, 2 мкг и 10 мкг или контроль PBS. В течение первых 4 дней не наблюдалось значительной средней потери веса животных, за исключением тех, которые получили 10 мкг LUNAR-COV19 (, рис. 2A) . Однако, помимо потери веса, было немного других клинических признаков, о чем свидетельствуют минимальные различия в клинических показателях. Как вес, так и клинические показатели улучшились без происшествий после 3-го дня после вакцинации.
A) мышей C57BL / 6 ( n = 5 / группа) были иммунизированы PBS, мРНК или LUNAR-COV19 (дозы 0,2 мкг, 2 мкг или 10 мкг), вес и клинические показатели оценивались каждый день, брали кровь на 1 день после иммунизации, умерщвляют через 7 дней после вакцинации и собирают лимфатические узлы. Экспрессию генов воспалительных генов и иммунных генов измеряли в цельной крови (на 1 день) и лимфатических узлах (на 7 день), соответственно. B ) Экспрессия IFN и генов воспалительного ответа в цельной крови представлена в виде тепловой карты z-значений. C) Вес лимфатических узлов через 7 дней после вакцинации. Анализ главных компонентов (PCA) экспрессии иммунного гена после вакцинации обычной мРНК или LUNAR-COV19 в дозах D) 0,2 мкг, E) 2 мкг и F) 10 мкг. Графики вулканов кратного изменения LUNAR-COV19 по сравнению с обычной мРНК (ось x) и Log 10 P -значение LUNAR-COV19 по сравнению с обычной мРНК (ось y) для доз G) 0,2 мкг, H ) 2 мкг и I) 10 мкг.Схема проекта исследования создана с помощью BioRender.com. Вес лимфатических узлов сравнивали между группами с использованием двустороннего теста Манна-Уитни U , где * означает 0,05 < P <0,01.
Ранее было показано, что врожденный иммунный ответ, в частности ответ интерферона I типа (IFN), связан с иммуногенностью вакцины после вакцинации против желтой лихорадки [11, 12, 18]. Кроме того, мы также обнаружили, что провоспалительные реакции, вызванные активными формами кислорода, лежат в основе системных нежелательных явлений при вакцинации против желтой лихорадки [19, 20].Поэтому мы измерили экспрессию генов врожденного иммунитета и провоспалительных генов в цельной крови мышей C57BL / 6, инокулированных PBS, стандартной мРНК-вакциной или LUNAR-COV19. Гены пути ИФН типа I были наиболее высоко экспрессированы у животных, инокулированных LUNAR-COV19, по сравнению с обычной мРНК-вакциной или PBS ( фиг. 2B, и , дополнительная фиг. 1, ). Напротив, количество генов, связанных с провоспалительными реакциями, было в основном снижено после вакцинации LUNAR-COV19 по сравнению с обычной мРНК-вакциной или PBS ( Рисунок 2B и Дополнительный Рисунок 1 ).
Дополнительный рисунок 1.Транскриптомные данные цельной крови через 1 день после первичной вакцинации, показывающие количество нанострингов на 50 нг РНК отобранных IFN и воспалительных генов.
Дополнительная фигура 2. Анализ корреляции нейтрализации живого SARS-CoV-2 против связывающих подклассов IgG и IgG в линиях мышей BALB / c и C57BL / 6J.A ) Корреляционный анализ Спирмена нейтрализации SARS-CoV-2 (PRNT50) против общего IgG, специфичного к нескольким антигенам SARS-CoV2, включая рекомбинантные белки S, S1 и RBD. B ) Корреляционный анализ Спирмена нейтрализации SARS-CoV-2 (PRNT50) против SARS-CoV2 S-специфичных подклассов IgG (IgG1 и IgG2a или IgG2c).
Поскольку адаптивные иммунные ответы развиваются в зародышевых центрах дренирующих лимфатических узлов, мы вскрыли дренирующие лимфатические узлы на 7 день после инокуляции (схема исследования на , рис. 2А, ). Паховые лимфатические узлы мышей, инокулированных LUNAR-COV19, показали дозозависимое увеличение веса, в отличие от мышей, инокулированных либо традиционной мРНК-вакциной, либо PBS; средний вес лимфатических узлов мышей, которым вводили 10 мкг LUNAR-COV19, был значительно выше, чем у мышей, которым вводили эквивалентную обычную мРНК вакцину (, рис. 2С, ).Анализ основных компонентов (PCA) экспрессии иммунного гена показал кластеризацию ответов на каждую из 3 доз LUNAR-COV19 вдали от контроля PBS (обозначены красными и оранжевыми сферами на фигуре , рис. 2D-F ), что указывает на четкие различия в иммунной системе. экспрессия гена в группах вакцинированных LUNAR-COV19 и плацебо. Эти тенденции также отличались от тенденций, наблюдаемых у мышей, которым вводили обычную мРНК-вакцину, где при всех испытанных дозах PCA существенно перекрывался с контролем PBS (показаны синими и оранжевыми сферами на , фиг. 2D-F ).
Затем мы оценили дифференциально экспрессируемые гены в лимфатических узлах мышей, которым вводили LUNAR-COV19, по сравнению с мышами, инокулированными мРНК-вакциной. Анализ графика вулкана выявил значительную активацию нескольких врожденных генов B- и T-клеток у животных, иммунизированных LUNAR-COV19 (, рис. 2G-I, ). Некоторые из наиболее дифференцированно экспрессируемых генов включали GZMB (необходимый для уничтожения клеток-мишеней цитотоксическими иммунными клетками) [21], S100A8 и S100A9 (факторы, регулирующие иммунные ответы через TLR4) [22], TNFRSF17 (также известный как BCMA и регулирующий гуморальный иммунитет) [23], CXCR3 (хемокиновый рецептор, участвующий в перемещении и функционировании Т-клеток) [24] и AICDA (опосредует переключение классов антител и соматическую гипермутацию в В-клетках) [25].Эти данные в совокупности указывают на то, что адаптивные иммунные ответы в дренирующих лимфатических узлах мышей, инокулированных LUNAR-COV19, могут отличаться от таковых, которым вводили нереплицирующуюся мРНК-вакцину.
LUNAR-COV19 индуцировал устойчивые Т-клеточные ответы
Затем мы исследовали клеточный иммунный ответ после вакцинации мышей C57BL / 6 ( n = 5 на группу) LUNAR-COV19 или обычной мРНК. На 7 день после вакцинации селезенки собирали и оценивали на CD8 и CD4 Т-клетки с помощью проточной цитометрии.Подмножество CD8 + T-клеток CD44 + CD62L-эффектор / память было значительно увеличено у мышей, вакцинированных LUNAR-COV19, по сравнению с мышами, которым вводили PBS или обычную мРНК вакцину (, фиг. 3A-B, ). Не было статистически значимой разницы в доле эффекторных клеток CD4 + T у этих животных (, фиг. 3C, ). IFNγ + CD8 + Т-клетки (в дозах 2 мкг и 10 мкг) и IFNγ + CD4 + Т-клетки (в 0,2 мкг и 10 мкг) были пропорционально выше, как было обнаружено с использованием внутриклеточного окрашивания (ICS) с проточной цитометрией, в LUNAR-COV19 по сравнению с к обычным вакцинированным мРНК животным ( фиг. 3D-F ).
Рисунок 3. Клеточные иммунные ответы после вакцинации LUNAR-COV19 и обычной мРНК.мышей C57BL / 6 ( n = 5 на группу) были иммунизированы 0,2 мкг, 2,0 мкг или 10,0 мкг LUNAR-COV19 или обычной мРНК через IM, умерщвлены на 7 день после вакцинации и селезенки проанализированы на клеточные Т-клетки. ответы с помощью проточной цитометрии и ELISPOT. A-B ) CD8 + и C ) CD4 + эффекторные Т-клетки оценивали у вакцинированных животных, используя поверхностное окрашивание на маркеры Т-клеток и проточную цитометрию. DE ) IFNγ + CD8 + Т-клеток и F 900 26) Соотношение IFNγ + / IL4 + CD4 + Т-клеток в селезенке иммунизированных мышей оценивали после ex vivo стимуляции с PMA / IO и внутриклеточное окрашивание. G-I ). Специфические для белка SARS-CoV-2 S ответы на объединенные пептиды белка S оценивали с помощью анализов IFNγ ELISPOT после вакцинации мРНК ( H ) или LUNAR-COV19 ( I ).Процент CD8 + клеток, CD4 + клеток, IFNγ и IL4-продуцирующих Т-клеток сравнивали между группами с использованием двустороннего теста Манна-Уитни U , где * означает 0,05 < P <0,01 и ** 0,01 < P <0,001 .
Специфические клеточные ответы SARS-CoV-2 оценивали у вакцинированных животных с помощью ELISPOT. Набор из 15-мерных пептидов, покрывающих полноразмерный белок SARS-CoV-2 S, был разделен на 4 пула и протестирован на ответы IFNγ + в спленоцитах вакцинированных и невакцинированных животных.SARS-CoV-2-специфические клеточные ответы (отображаемые как IFNγ + SFU / 10 6 клеток) были обнаружены с помощью ELISPOT как у животных, иммунизированных LUNAR-COV19, так и у животных, иммунизированных стандартной мРНК, по сравнению с контролем PBS (, рисунок 3G-I, ). Эти ответы были значительно выше для всех доз в LUNAR-COV19 по сравнению с группами, вакцинированными традиционной мРНК (, рисунок 3G-I, ). Даже самая высокая испытанная доза (10 мкг) стандартной мРНК-вакцины вызвала ответы IFNγ + ELISPOT, которые были значительно ниже, чем ответы на самую низкую дозу (0.2 мкг) LUNAR-COV19.
LUNAR-COV19 индуцировал превосходные гуморальные иммунные ответы.
Гуморальные ответы, специфичные для SARS-CoV-2, после вакцинации однократной инъекцией были охарактеризованы на двух разных моделях мышей, BALB / c и C57BL / 6. Самок мышей ( n = 5 на группу) вакцинировали в день 0 и брали кровь каждые 10 дней, до 60 дня для BALB / c и до 30 дня для C57BL / 6 (, фиг. 4A, ). SARS-CoV-2 S-специфические IgM-ответы были протестированы при разведении сыворотки 1: 2000 с использованием собственного иммуноанализа Luminex.Все испытанные дозы стандартной мРНК-вакцины и LUNAR-COV19 вызывали детектируемые S-специфические ответы IgM в обеих моделях мышей (, фиг. 4B-C, ). При сравнении LUNAR-COV19 с обычными вакцинированными мРНК мышами BALB / c не наблюдалось различий в ответах IgM; Уровни IgM у мышей C57BL / 6 были выше у мышей C57BL / 6, вакцинированных LUNAR-COV19, на 10 день после вакцинации. Напротив, уровни SARS-CoV-2 S-специфического IgG (при разведении сыворотки 1: 2000) были повсеместно выше, начиная с 20-го дня у животных, инокулированных LUNAR-COV19, по сравнению с традиционной мРНК-вакциной (, рис. 4D-E ).Возможно, еще более примечательно то, что у BALB / c, вакцинированных LUNAR-COV19, уровни IgG продолжали увеличиваться до 50-го дня после вакцинации; Мышей C57BL / 6 наблюдали только до 30 дня после вакцинации. Эта тенденция резко контрастировала с мышами, которые получали обычную мРНК-вакцину, где у мышей BALB / c уровни антител выходили на плато на 10-й день после вакцинации; хотя у обычных мышей C57BL / 6, вакцинированных мРНК, наблюдалось повышение уровня S-специфического IgG, оно всегда было ниже, чем у мышей, которым вводили LUNAR-COV19.
Рисунок 4: LUNAR-COV19 вызывает более качественный гуморальный ответ, чем обычная мРНК-платформа.A) Мышей BALB / c и C57BL / 6J иммунизировали с помощью IM 0,2 мкг, 2 мкг или 10 мкг LUNAR-COV19 или стандартной мРНК ( n = 5 / группа). Забор крови проводился на исходном уровне и на 10, 19, 30, 40, 50 и 60 дни после вакцинации для BALB / c и на 10, 20 и 30 дни для C57BL / 6J. B – C ) IgM и D – E ) IgG против белка SARS-CoV-2 S с течением времени, оцениваемое с использованием цельного белка S, полученного из клеток насекомых, в иммуноанализе Luminex (измеряется как MFI ).Конечные титры IgG к целому белку S, полученному из млекопитающих, белкам S1, S2 и RBD, к целому белку S, полученному из млекопитающих, на 30 день после вакцинации оценивали в F) BALB / c и G) C57BL / 6J. H ) Авидность IgG, специфичного к белку SARS-CoV-2 S, на 30-й день после иммунизации измеряли с использованием промывок 8M мочевиной. I ) Нейтрализующее антитело (PRNT 50 титры ) на 30 день после вакцинации против клинически изолированного живого вируса SARS-CoV-2, измеренного как в BALB / c, так и в C57BL / 6J.Серые пунктирные линии отображают диапазон разведений сыворотки (т.е. от 1:20 до 1: 320), проверенный с помощью PRNT. J ) PRNT50 и K ) PRNT70 нейтрализации SARS-CoV-2 на 30-й и 60-й день после вакцинации в BALB / c и сыворотках выздоравливающих пациентов с COVID-19. L ) Корреляционный анализ спайк-специфических титров конечных точек IgG против нейтрализации SARS-CoV-2 (PRNT50). Данные по антителам сравнивали между группами с использованием двустороннего теста Манна-Уитни U , где * означает 0.05 < P <0,01 и ** 0,01 < P <0,001.
Углубленная характеристика специфического для SARS-CoV-2 ответа IgG у вакцинированных животных была проведена на 30-й день после иммунизации, чтобы оценить, какие области S-белка являются мишенями. Конечные титры IgG оценивали для всех областей белка S1, S2 и рецепторсвязывающего домена (RBD) полного эктодомена S-белка. Как и ожидалось для обеих вакцин-кандидатов, большинство специфичных для SARS-CoV-2 IgG распознавало S1, который содержит эритроциты, хотя высокие конечные титры IgG были также обнаружены для белка S2 (, фиг. 4F-G, ).Однако конечные титры IgG, вызванные LUNAR-COV19, были повсеместно и значительно выше по сравнению с титрами, полученными с помощью традиционной вакцинации мРНК (, фиг. 4F-G, ). Примечательно, что IgG, которые связывают RBD белка S, который является иммунодоминантным сайтом нейтрализующих антител [26, 27], также были выше у LUNAR-COV19 по сравнению с животными, вакцинированными традиционной мРНК. Также следует отметить, что при более низких дозах обычная мРНК-вакцина, но не LUNAR-COV19, изо всех сил пыталась вызвать высокие титры SARS-CoV-2 специфических IgG у более Th2-доминантного штамма мышей C57BL / 6 (, рисунок 4G, ).Взятые вместе, разовая доза LUNAR-COV19 вызвала значительные различия в экспрессии иммунных генов и улучшенные клеточные иммунные ответы в дренирующих лимфатических узлах по сравнению с традиционной вакциной мРНК и, как следствие, более сильные и продолжительные гуморальные иммунные ответы.
Мы оценили как силу связывания (авидность), так и нейтрализующую способность ответа антител, вызванного этими конструкциями вакцины. Авидность сывороточного IgG измеряли на 30 день после вакцинации с использованием модифицированного иммуноанализа Luminex с промывками 8M мочевины.LUNAR-COV19 вызывал более высокую авидность S-белок-специфических IgG в обеих моделях мышей при всех испытанных дозах (, фиг. 4H, ). Эти различия наблюдались, за исключением 0,2 мкг в BALB / c, для всех доз (, рисунок 4H, ), что указывает на то, что LUNAR-COV19 вызывал антитела более высокого качества, что свидетельствует о более высоком созревании аффинности с вакциной LUNAR-COV19.
Нейтрализация живого SARS-CoV-2 сывороткой вакцинированных животных оценивалась с помощью теста нейтрализации уменьшения бляшек (PRNT).На 30-й день вакцинированные LUNAR-COV19 мыши BALB / c показали явное дозозависимое повышение титров PRNT 50 ; 4 из 5 (80%) мышей в группе 10 мкг LUNAR-COV19 показали титры PRNT 50 более 320, что было верхним пределом нашего разведения (, рис. 4I, ). Сходные дозозависимые тенденции в титрах PRNT 50 также были обнаружены у мышей C57BL / 6, хотя у этих животных титры PRNT 50 у нескольких животных превышали 320 даже при самом низком значении 0.Вакцинация дозой 2 мкг (, рис. 4I, ). Напротив, титры PRNT 50 у животных, инокулированных стандартной конструкцией мРНК вакцины, были, за исключением одной мыши C57BL / 6J, которая получила дозу 10 мкг, все <20 ( Рисунок 4I ). Неожиданно, но обнадеживающе, титры PRNT 50 и PRNT 70 мышей BALB / c, вакцинированных LUNAR-COV19, продолжали расти между 30-м и 60-м днями после однократной вакцинации ( Рисунок 4J-K ) и в оба момента времени для дозы ≥2.0 мкг. Эти титры были сопоставимы с титрами PRNT 70 для сывороток выздоравливающих пациентов с COVID-19 (, рисунок 4K ).
Мы также обнаружили, что титры S-белка IgG положительно коррелировали с титрами PRNT 50 у мышей, вакцинированных LUNAR-COV19, в обеих моделях мышей ( Рисунок 4L ). Сходные положительные корреляции наблюдались также с IgG против S1 и RBD (дополнительный рисунок , ). Напротив, мы не обнаружили корреляции между титрами IgG и PRNT 50 у обычных мышей, вакцинированных мРНК ( Рисунок 4L ).Взятые вместе, наши анализы ответа антител показывают, что более высокие титры PRNT 50 после вакцинации LUNAR-COV19 не только сильно связаны с количеством продуцируемого IgG, но также являются фактором превосходного качества анти-SARS-CoV- 2 антитела, полученные после вакцинации LUNAR-COV19.
Вакцинация LUNAR-COV19 показала доминантный ответ Th2
Проблемой безопасности вакцины против коронавируса является риск вакцино-ассоциированного иммунного усиления респираторного заболевания (VAERD) [28].Действительно, разработка вакцин против SARS-CoV и MERS-CoV подчеркнула важность искаженных Th2-ответов в снижении риска индуцированного вакциной усиления иммунитета [29, 30]. Поэтому мы исследовали баланс Th2 / Th3, вызванный вакцинацией как обычной мРНК, так и LUNAR-COV19. На судьбу подкласса IgG плазматических клеток сильно влияют Т-хелперные (Th) клетки [31]. На 30 день после вакцинации и обычная мРНК, и LUNAR-COV19 индуцировали сопоставимые количества SARS-CoV-2 S-специфического IgG1, Th3-ассоциированного подкласса IgG у мышей, за исключением 0.Доза 2 мкг у мышей C56BL / 6J (, рис. 5A-B, ). Напротив, Th2-ассоциированные подклассы IgG – IgG2a в BALB / c и IgG2c в C56BL / 6J – были значительно больше у животных, вакцинированных LUNAR-COV19. Соотношение S-протеин-специфических IgG2a / IgG1 (Balb / c) и IgG2c / IgG1 (C57BL / 6) было больше 1 у животных, вакцинированных LUNAR-COV19 ( Рисунок 5A-B) . За исключением дозы 0,2 мкг, все эти соотношения были значительно выше для LUNAR-COV19 по сравнению с животными, вакцинированными традиционной мРНК.
Рисунок 5. LUNAR-COV19 вызывает иммунные ответы, предвзятые Th2.SARS-CoV-2 спайк-специфичных подклассов IgG и соотношение IgG2a / c / IgG1 через 30 дней после вакцинации LUNAR-COV19 и обычной мРНК у мышей A ) BALB / c и B ) C57BL / 6J . Цитокин Th3 и перекос Th2 / Th3 в Т-лимфоцитах CD4 на 7-й день после вакцинации у мышей C57BL / 6J, измеренный с помощью ICS как C ) процентное содержание Т-клеток IL4 + CD4 и D ) соотношение IFNγ + / IL4 + CD4 + Т-клеток.Титры антител и данные Т-лимфоцитов сравнивали между группами с использованием двустороннего теста Манна-Уитни U , где * означает 0,05 < P <0,01 и ** 0,01 < P <0,001.
Кроме того, мы использовали ICS для исследования продукции IFNγ (цитокин Th2) и IL4 (цитокин Th3) CD4 + Т-клетками в селезенке на 7 день после вакцинации мышей C56BL / 6J. Как было описано выше, по сравнению с обычной вакцинацией мРНК уровни IFNγ были значительно выше у животных, вакцинированных LUNAR-COV19 (рис. 3F).Экспрессия IL4 в CD4 T-клетках была немного выше при использовании обычной мРНК по сравнению с LUNAR-COV19 при дозах 0,2 и 2,0 мкг (, фиг. 5C, ). Сравнивая уровни IFNγ и IL4 у отдельных мышей, мы обнаружили, что отношения IFNγ / IL4 в CD4 + Т-клетках как для мышей, вакцинированных LUNAR-COV19, так и для обычных мышей, вакцинированных мРНК, всегда были выше 1 ( Рисунок 5D ). Отношение IFNγ / IL4 в CD4 + Т-клетках у мышей, которым вводили дозы 0,2 и 2,0 мкг, было значительно выше при LUNAR-COV19, чем при традиционной вакцинации мРНК (, фиг. 5F, ).Однако повышенные соотношения при этих дозах были связаны со снижением экспрессии IL4 на уровнях ниже фонового (то есть у контрольных мышей PBS), а не со снижением IFNγ и, следовательно, активности Th2. Взятые вместе, наши данные показывают, что LUNAR-COV19 вызывал адаптивный иммунный ответ, связанный с Th2.
Однократная доза LUNAR-COV19 защищает от летальной инфекции SARS-CoV-2
Наконец, мы проверили эффективность LUNAR-COV19 в защите от инфекции и смертности на модели смертельного заражения SARS-CoV-2.Трансгенных мышей hACE2, иммунизированных либо PBS, либо 2 мкг или 10 мкг вакцины LUNAR-COV19, интраназально заражали живым вирусом SARS-CoV-2 (5 × 10 4 TCID 50 ) на 30 день после вакцинации. Это был тот же изолят, который использовался в наших анализах PRNT. Затем мышей разделили на две группы: в одной группе отслеживали вес, клинические показатели и выживаемость; вторую группу мышей умерщвляли через 5 дней после инъекции (dpi) и оценивали вирусную нагрузку в дыхательных путях (от трахеи до легких) и головном мозге (, фиг. 6A, ).Измерение титров PRNT 70 подтвердило образование нейтрализующих антител у мышей hACE2, вакцинированных LUNAR-COV19 (, фиг. 6B, ). Независимо от испытанных доз, мыши, получившие вакцину LUNAR-COV19, показали неизменный вес и отсутствие клинических признаков, в то время как мыши PBS показали значительное снижение веса и повышение клинических показателей после заражения SARS-CoV-2 дикого типа ( Рисунок 6C- D ). Вакцинация LUNAR-COV19 как в дозах 2 мкг, так и в дозах 10 мкг полностью защищала мышей hACE2 от 100% смертности на 7 день после заражения (, фиг. 6E, ).Оценка вирусной нагрузки ткани на 5-й день после заражения показала, что РНК SARS-CoV-2 минимальна или отсутствует (, рис. 6F, ), в отличие от контрольных невакцинированных животных. Хотя вирусная РНК была обнаружена на очень низких уровнях у некоторых животных, это не было связано с каким-либо присутствием инфекционных вирусных частиц, поэтому большинство подобных представляет собой фрагменты вирусной РНК, а не интактные вирусные геномы РНК. Никаких обнаруживаемых инфекционных вирусов не было обнаружено ни в дыхательных путях, ни в головном мозге вакцинированных LUNAR-COV19 животных (, рис. 6G, ).Напротив, невакцинированные животные показали 4 и 8 логарифмов инфекционного SARS-CoV-2 в дыхательных путях и головном мозге, соответственно (, рис. 6G, ). В совокупности эти данные показывают, что однократная доза вакцины LUNAR-COV19 вызвала устойчивые гуморальные и клеточные иммунные ответы, которые привели к полной защите мышей hACE2 от летального заражения SARS-CoV-2.
Рисунок 6. Однократная доза LUNAR-COV19 защищает мышей hACE2 от летального заражения вирусом SARS-CoV-2.A ) трансгенных мышей hACE2 иммунизировали однократной дозой PBS или 2 мкг или 10 мкг LUNAR-COV19 ( n = 5 на группу), затем заражали живым SARS-CoV-2 через 30 дней после -вакцинацию и оценивали либо на выживаемость (с ежедневным весом и клиническими показателями), либо на умерщвление на 5 день после заражения, и измеряли вирусную нагрузку в легочной и мозговой ткани.5 TCID 50 ) живого вируса SARS-CoV-2. F ) Вирусная РНК и G ) инфекционный вирус в легких и мозге зараженных мышей измеряли с помощью qRT-PCR или анализа бляшек, соответственно. PRNT 70 и титры вирусов (титры РНК и бляшек) сравнивали между группами с использованием непараметрического теста Манна-Уитни U . Вес и клинические показатели в разные моменты времени сравнивали между мышами, иммунизированными PBS и 10 мкг LUNAR-CoV19, с использованием нескольких тестов t . P -значения обозначены * для 0,05 < P <0,01, ** для 0,01 < P <0,001, *** для 0,001 < P <0,0001, **** P <0,00001 .
ОБСУЖДЕНИЕ
Пандемия COVID-19 потребовала быстрой разработки вакцин. Обнадеживает то, что несколько вакцин-кандидатов против COVID-19 в настоящее время проходят клинические испытания, и еще большее количество вакцины проходят первые испытания на людях. Однако для большинства разрабатываемых вакцин-кандидатов требуется две или более доз для достаточных адаптивных иммунных ответов.Потребность во второй прививке может усложнить соблюдение режима массовых кампаний вакцинации и привести к тому, что за одну партию будет вакцинировано меньшее количество субъектов, что снизит эффективность вакцинации. Следовательно, однократная доза вакцины, которая генерирует устойчивый и устойчивый клеточный и гуморальный иммунитет, без повышения риска опосредованного вакциной усиления иммунитета, остается неудовлетворенной потребностью.
Среди лицензированных вакцин от других болезней живые аттенуированные вакцины могут предложить наиболее надежную защиту от вирусных заболеваний.Живые вакцины инфицируют и размножаются в местах инокуляции, а некоторые даже в дренирующих лимфатических узлах. Репликация обеспечивает эндогенную и устойчивую экспрессию вирусных антигенов, что позволяет презентации антигена стимулировать цитотоксические CD8 + Т-клетки. Экспрессированные антигены, захваченные антигенпрезентирующими клетками, также запускают помощь Т-лимфоцитов CD4 +, которая стимулирует созревание аффинности в В-клетках. Исследования живой ослабленной вакцины против желтой лихорадки показали, что более длительный период стимуляции адаптивного иммунного ответа приводит к превосходным адаптивным иммунным ответам [32].Хотя работа по определению того, какие из этих коррелятов живых вакцин являются механистическими детерминантами адаптивного иммунитета, все еще продолжаются, способность самовоспроизводящихся РНК-вакцин имитировать устойчивые характеристики презентации антигена живой вакцинации может обеспечить устойчивый иммунитет против COVID-19.
Многочисленные исследования показали иммуногенность РНК-вакцины. В этом исследовании мы провели параллельное сравнение иммуногенности, вызванной двумя кандидатами РНК-вакцины SARS-CoV-2, стандартной конструкцией мРНК и конструкцией STARR, LUNAR-COV19.Мы обнаружили, что по сравнению с обычной мРНК, LUNAR-COV19 вызывал более высокую и длительную экспрессию белка in vivo , повышал экспрессию нескольких врожденных генов B- и T-клеточного ответа в крови и дренирующих лимфатических узлах. Эти свойства были связаны со значительно более сильными нейтрализующими антителами и специфическими для SARS-CoV-2 ответами IgG, CD8 + Т-клеточными ответами, IFNγ + ELISPOT ответами и искаженными ответами Th2 (которые, как было показано, связаны с защитой от VAERD), чем обычные мРНК.Интересно, что несмотря на самую высокую протестированную дозу стандартной мРНК, вызывающей сопоставимые S-протеин-специфические антитела, как и самая низкая протестированная доза LUNAR-COV19, обычные мРНК-индуцированные IgG не показали такой сильной авидности или нейтрализующей активности, как при вакцинации LUNAR-COV19. Эти данные предполагают качественно лучший гуморальный иммунный ответ с превосходным созреванием аффинности В-клеток с вакциной LUNAR-COV19. Таким образом, наши результаты подчеркивают иммунологические преимущества самовоспроизводящейся РНК по сравнению с традиционными платформами мРНК.
Превосходное качество иммунных ответов, вызванных LUNAR-COV19 по сравнению с традиционной конструкцией мРНК вакцины, может быть связано с множеством факторов. Более высокая и более длительная экспрессия иммуногенов вызывает лучший иммунитет [32], вероятно, за счет лучшего взаимодействия Т-фолликулярных хелперных клеток и, таким образом, приводит к более разнообразным мишеням антител и более устойчивым нейтрализующим ответам антител [33, 34]. Репликация LUNAR-COV19 приводит к формированию матрицы с отрицательной цепью для производства большего количества мРНК с положительной цепью и субгеномной мРНК, экспрессирующих S-трансген.Взаимодействие между отрицательной и положительной цепями образует промежуточную двухцепочечную РНК (дцРНК), которая будет взаимодействовать с TLR3 и RIG-I-подобными рецепторами, чтобы стимулировать ответы интерферона 1 типа [35–37], что мы и другие ранее показали. чтобы коррелировать с превосходными адаптивными иммунными ответами [11, 12, 18]. Продукция IFNγ также может стимулировать развитие цитотоксических CD8 + Т-клеток [36]. Важно отметить, что белок S действительно содержит эпитопы CD8 + Т-клеток человека. Согласно недавним открытиям Т-клеточного ответа на SARS-CoV-2 и другие коронавирусные инфекции [38-40], развитие Т-клеточной памяти может иметь важное значение для долгосрочного иммунитета.
Неясно, обладает ли VEEV nsP1-4, образующий репликационный комплекс, какими-либо иммуногенными свойствами, хотя было показано, что мутации в белках nsP влияют на индукцию IFN типа I [41]. Хотя репликоны VEEV не исследованы в нашем текущем исследовании, также было показано, что они вызывают адъювантный иммунный ответ на участках слизистой оболочки [42], что еще раз оправдывает использование платформы STARR для разработки вакцины COVID-19.
В заключение, платформа вакцины STARR на примере LUNAR-COV19 предлагает подход к моделированию ключевых иммуногенных свойств вакцинации живым вирусом и предлагает потенциал для эффективной однократной вакцинации против COVID-19.
МЕТОДЫ (Приложение 1)
Конструкции и конструкция вакцинной плазмиды
Ген гликопротеина SARS-CoV-2 с оптимизированными кодонами (S) гликопротеина SARS-CoV-2 (доступ в GenBank: YP_009724390) клонировали в плазмиды pARM2922 и pARMS2379 для создания плазмид pARM2922 и pARMS2379 -CoV-2 Spike, экспрессирующий STARR и обычную мРНК, соответственно. Плазмида STARR также кодирует неструктурные белки вируса венесуэльского энцефалита лошадей (VEEV) nsP1, nsP2, nsP3 и nsp4, которые вместе образуют комплекс репликазы, который связывается с субгеномным промотором, расположенным непосредственно перед последовательностью белка S.Клонированные части всех плазмидных конструкций проверяли секвенированием ДНК. Плазмиды были линеаризованы сразу после растяжения поли (A) и использованы в качестве матрицы для реакции транскрипции in vitro с РНК-полимеразой Т7. Для вакцины LUNAR-CoV19 реакцию на РНК проводили, как описано ранее [43], с запатентованными модификациями, чтобы обеспечить высокоэффективное котранскрипционное включение запатентованного аналога Cap1 и получить высококачественную молекулу РНК длиной более 11000 нуклеотидов мРНК STARR. .Затем РНК очищали через колонку с диоксидом кремния (Macherey Nagel) и количественно определяли по УФ-поглощению. Для обычной мРНК-вакцины РНК синтезировали аналогично, но со 100% заменой УТФ на N1-метил-псевдоУТФ. Для вакцин LUNAR-CoV19 и обычных мРНК качество и целостность РНК проверяли электрофорезом в 0,8-1,2% неденатурирующем агарозном геле, а также анализатором фрагментов (Advanced Analytical). Очищенные РНК хранили в воде, свободной от РНКазы, при -80 ° C до дальнейшего использования.
Вакцинные липидные наночастицы (LNP)
Наночастицы LUNAR®, инкапсулирующие STARR ™, получали смешиванием спиртового раствора липидов с водным раствором STARR ™ РНК. Липидные наполнители (запатентованный ионизируемый липид Arcturus Therapeutics, DSPC, холестерин и PEG2000-DMG) растворяют в этаноле при мольном соотношении 50:10: 38,5: 1,5 или 50: 13: 35,5: 1,5. Водный раствор вакцинной РНК готовят в цитратном буфере pH 4,0. Затем липидную смесь объединяют с раствором вакцинной РНК при соотношении потоков 1: 3 (об. / Об.) Через специальный модуль смешивания.Образованные таким образом наночастицы стабилизируют разбавлением фосфатным буфером, а затем буфером HEPES, pH 8,0. Затем проводят ультрафильтрацию и диафильтрацию (UF / DF) состава наночастиц путем фильтрации с тангенциальным потоком (TFF) с использованием модифицированных мембран из полых волокон PES (MWCO 100 кДа) и буфера HEPES pH 8,0. После UF / DF состав фильтруют через фильтр PES 0,2 мкм. Затем выполняется анализ концентрации РНК в процессе. Концентрацию препарата доводят до конечной концентрации целевой РНК с последующей фильтрацией через 0.Стерилизующий фильтр из PES 2 мкм. После стерильной фильтрации нерасфасованный состав асептически разливают в стеклянные флаконы, закрывают пробками и замораживают при -70 ± 10 ° C. Аналитическая характеристика включала измерение размера частиц и полидисперсности с использованием динамического рассеяния света (ZEN3600, Malvern Instruments), pH, осмоляльности, содержания РНК и эффективности инкапсуляции с помощью флуорометрического анализа с использованием реагента Ribogreen RNA, чистоты РНК с помощью капиллярного электрофореза с использованием анализатора фрагментов (Advanced Analytical) , содержание липидов с помощью ВЭЖХ.
Трансфекция in vitro и обнаружение иммуноблотом спайкового белка
Клетки Hep3b (высеянные в 6-луночные планшеты с плотностью 7 × 10 5 клеток / лунку за день до этого) трансфицировали очищенными IVT (2,5 мкг стандартной мРНК и 2,5 мкг STARR) реагентом для трансфекции Lipofectamine MessengerMax (Thermo Fisher Scientific) в соответствии с инструкциями производителя. Клетки собирали на следующий день с гипотоническим буфером (10 мМ Трис-HCl, 10 мМ NaCl с добавлением коктейля из ингибиторов протеаз (Roche)) с последующей обработкой ультразвуком.Образцы дегликозилировали с последующей обработкой PNGase F (New England Biolabs) в соответствии с инструкциями производителя.
Белковый лизат (10 мкг) разделяли на 7,5% -ном трис-ацетатном геле NuPAGE (Thermo Fisher Scientific), и экспрессию спайкового белка анализировали с помощью системы количественного вестерн-блоттинга LI-COR с использованием кроличьих антител, определяющих S1 (40150- T62-COV2, Sino Biologic) и мышиное антитело к области S2 (GTX632604, GeneTex) вместе с соответствующими вторичными антителами (козлиное антитело против кролика 800 и козье антитело против мышиное 680).
Исследования на животных
Исследования BALB / c
Все исследования на мышах BALB / c были одобрены Explora Biolabs IACUC и проводились в соответствии с Протоколом по уходу и использованию животных номер EB-17-004-003. Прямое сравнение экспрессии белков стандартной мРНК и платформ вакцины STARR было проведено с использованием обычных конструкций мРНК и STARR, экспрессирующих репортерный ген люциферазы. Мышам BALB / c (лаборатория Джексона) вводили внутримышечно (IM) в rectus femoris с помощью стандартной мРНК или STARR в дозах 0.2, 2 и 10 мкг ( n = 3 мыши / группа). Экспрессию обычных мРНК и конструкций STARR измеряли на 1, 3 и 7 дни после инокуляции посредством экспрессии люциферазы путем визуализации мышей на предмет биолюминесценции.
Гуморальные ответы на вакцину-кандидаты от SARS-CoV-2 Spike были протестированы на самках мышей BALB / c (лаборатория Джексона) в возрасте 8-10 недель путем внутримышечной иммунизации rectus femoris либо обычной мРНК, либо LUNAR-COV19 в дозах. 0,2 мкг, 2 мкг или 10 мкг ( n = 5 мышей / группа).У мышей брали кровь в начале и через 10, 19, 30, 40, 50 и 60 дней после вакцинации для оценки гуморальных иммунных ответов, специфичных для SARS-CoV-2.
C57BL / 6
Все исследования на мышах C57BL / 6 были выполнены в соответствии с протоколами, утвержденными Комитетом по уходу за животными и их использованию в Службе здравоохранения Сингапура (исх. №: 2020 / SHS / 1554). Мышей C57BL / 6, приобретенных у inVivos, содержали в помещении для животных BSL-2 в Медицинской школе Duke-NUS. Группы самок мышей C57BL / 6 дикого типа в возрасте 6-8 недель вакцинировали внутримышечно либо обычной мРНК, либо LUNAR-COV19 в дозах 0.2 мкг, 2 мкг или 10 мкг. Для транскриптомных исследований и исследований Т-клеток проводили поднижнечелюстные кровотечения для цельной крови через 24 часа после вакцинации. На 7-й день после иммунизации мышей забивали в паховые лимфатические узлы и собирали селезенку для исследования экспрессии иммунного гена и ответов Т-клеток, соответственно. Суспензии спленоцитов для измерения ответов Т-клеток получали путем измельчения селезенки через фильтр для клеток 70 мкм (Corning). Эритроциты удаляли лизисом с использованием реагента BD PharmLyse.Для исследований антител у другой группы вакцинированных мышей в возрасте 6-8 недель брали кровь в начале и через 10, 20 и 30 дней после вакцинации.
Эксперименты с заражением SARS-CoV-2 были проведены на самках мышей B6; SJL-Tg (K18-hACE2) 2Prlmn / J, приобретенных в лаборатории Джексона. Группы самок мышей C57BL / 6 дикого типа в возрасте 6-8 недель вакцинировали внутримышечно 100 мкл LUNAR-COV19 в дозах 2 мкг или 10 мкг. Поднижнечелюстные кровотечения выполняли для выделения сыворотки для определения титров антител с помощью PRNT через 28 дней после вакцинации.Животных инфицировали 5 × 10 4 TCID50 в 50 мкл интраназальным путем. Были получены ежедневные измерения веса и клинические оценки. Мышей умерщвляли при потере веса более 20% или клинической оценке 10. Для оценки вирусной нагрузки на органы мышей умерщвляли через 5 дней после инфицирования и собранные органы замораживали при -80 ° C. Целые легкие и мозг гомогенизировали с лизирующей матрицей А и F MP в соответствии с инструкциями производителя в 1 мл PBS. Гомогенат использовали для оценки титров бляшек и экстракции РНК с использованием TRIzol LS (Invitrogen).В исследованиях на животных не проводилось ослепления.
Экспрессия генов иммунных и воспалительных генов
Цельную кровь, собранную через 1 день после вакцинации, лизировали с использованием реагента BD PharmLyse и экстрагировали РНК с помощью набора Qiagen RNAeasy. Лимфатические узлы мыши, собранные через 7 дней после вакцинации, гомогенизировали и экстрагировали РНК с использованием тризола LS. РНК (50 нг) из клеток цельной крови и лимфатических узлов гибридизовали с панелями NanoString nCounter для мышиных воспалений и иммунологии v2 (Nanostring Technologies), соответственно.Как описано ранее [20, 44], РНК гибридизовали с восстановленными CodeSet и ProbeSet. Реакции инкубировали в течение 24 часов при 65 ° C и постепенно снижали до 4 ° C. Затем гибридизированные образцы иммобилизовали на картридже nCounter и отображали на nCounter SPRINT (NanoString Technologies). Данные анализировали с помощью программного обеспечения nSolver Analysis (Nanostring Technologies) и Partek Genomics Suite. Для нормализации образцы были исключены, когда процент регистрации поля зрения <75, плотность связывания выходит за пределы диапазона 0.1–1,8, положительный контроль R 2 значение <0,95 и 0,5 фМ положительный контроль ≤2 s.d. выше среднего отрицательного контроля. Вычитание фона выполняли путем вычитания оцененного фона из геометрических средних необработанных подсчетов зондов отрицательного контроля. Число зондов меньше, чем фон, было доведено до значения 1. Среднее геометрическое положительных контролей использовали для вычисления параметров нормализации положительного контроля. Выборки с коэффициентами нормализации за пределами 0,3–3.0 были исключены. Среднее геометрическое значение генов домашнего хозяйства использовалось для вычисления эталонного коэффициента нормализации. Также были исключены образцы с эталонными коэффициентами за пределами диапазона 0,10–10,0. Иерархическая кластеризация была выполнена с помощью Partek Genomics Suite v6 на наборах генов, значения zScore по евклидову несходству и среднему сцеплению.
Для идентификации DEG между группами использовалось программное обеспечение Partek Genomics Suite Analysis v7 для анализа дисперсии (ANOVA) с пороговым значением P <0.05. Log 2 Сгенерированные кратные изменения были использованы для графиков вулканов, построенных с использованием программного обеспечения Prism v8.1.0. ДЭГ были идентифицированы по отсечке кратных изменений, равной 2. Неконтролируемый анализ основных компонентов выполняли для визуализации вариабельности между вакцинированными и невакцинированными животными с помощью программного обеспечения Partek genomics suite analysis v7. Эллипсоиды PCA были нарисованы с максимальной плотностью и 3-мя делениями.
Проточная цитометрия
Окрашивание поверхности проводили на свежевыделенных спленоцитах с использованием следующей панели антител и реагентов: B220 (RA3-6B2), CD3 (17A2), CD4 (RM4-5), CD8α (53-6.7), CD44 (IM7), CD62L (MEL-14) и DAPI. Окрашивание внутриклеточных цитокинов проводили путем стимуляции свежевыделенных спленоцитов 50 нг / мл PMA и 500 нг / мл иономицина в присутствии GolgiPlug (BD) в течение 6 часов. После стимуляции проводили окрашивание поверхности на CD3, CD4 и CD8a с последующим внутриклеточным окрашиванием IFN-γ (XMG1.2) и IL-4 (11B11). Сбор данных выполнялся на BD LSRFortessa и анализировался с помощью FlowJo. ELISPOT
ELISPOT выполняли с использованием набора IFN-γ ELISpot BASIC (Mabtech).Аналогичный протокол был использован для образцов SARS-CoV-2 человека [40]. Вкратце, 4 × 10 5 свежевыделенных спленоцитов помещали в покрытые PVDF 96-луночные планшеты, содержащие захватывающее антитело IFN-γ (AN18). Клетки стимулировали библиотекой 15-мерных пептидов, покрывающей часть S-белка. Всего 143 пептида были разделены на четыре пула и использованы при конечной концентрации 1 мкг / мл на пептид. Лунки отрицательного контроля не содержали пептида. После стимуляции в течение ночи планшеты промывали и последовательно инкубировали с биотинилированным антителом для определения IFN-γ (R4-6A2), стрептавидин-ALP и, наконец, BCIP / NBT.Планшеты визуализировали с помощью анализатора ImmunoSpot и количественно оценивали с помощью программного обеспечения ImmunoSpot.
Luminex Immuno-assay
Продольная оценка связывающего антитела
Продольные IgM- и IgG-ответы в BALB / c и C57BL / 6 измеряли с помощью собственного иммунного анализа Luminex. Подобные иммуноанализы Luminex были ранее описаны для обнаружения антител против антигенов SARS-CoV-2 [45, 46]. Вкратце, гранулы Magpix Luminex были ковалентно конъюгированы с полученным из насекомых HIS-меченным целым белком Spike SARS-CoV-2 (SinoBiologicals) с использованием набора для связывания ABC (Thermo) в соответствии с инструкциями производителя.Затем шарики блокировали 1% BSA с последующей инкубацией с сывороткой (разведенной 1: 2000 в блоке) в течение 1 часа при 37 ° C. Затем шарики промывают, и мышиные антитела, специфичные для шипов SARS-CoV-2, детектируют с использованием соответствующего биотинилированного вторичного антитела (т.е. антимышиного IgM-биотина и антимышиного IgG-биотина (Southern Biotech) для оценки IgM и IgG, соответственно). со стрептавидином-PE (Southern Biotech). Связывание антител со Spike затем измеряли на приборе Magpix как среднюю интенсивность флуоресценции (MFI).Количество спайкового антигена на шариках также исследовали с помощью антител против 6xHIS-PE, и все значения MFI затем корректировали на количество спайкового антигена, чтобы учесть экспериментальные вариации.
Конечные титры подклассов IgG и IgG
Конечные титры IgG к спайку SARS-CoV-2, полученному от млекопитающих, спайковому домену 1 (S1), спайковому домену 2 (S2) и рецепторсвязывающему домену (RBD) на 30-е сутки сыворотки после иммунизацию измеряли с помощью Luminex ImmunoAssay. Анализ проводили, как описано выше, с модификацией последовательного 10-кратного разведения сыворотки с 200 до 2 × 10 8 .Аналогичным образом, титры конечных точек подкласса IgG (т.е. IgG1 и IgG2a в BALB / c и IgG1 и IgG2c в C57BL / 6) были измерены против белка SARS-CoV-2 Spike, полученного из млекопитающих, с использованием серийно разведенных сывороток мыши (в 5 раз от 200 до 3,1). × 10 6 ) и вторичные антитела против IgG1-биотина, анти-IgG2a-биотина или анти-IgG2b-биотина (Southern Biotech). Четырехпараметрические логистические кривые (4PL) были подогнаны к измеренным данным MFI для серийно разведенных сывороток, и трехкратный фон (т.е. 3x MFI без сыворотки) был использован в качестве порогового значения для оценки конечных титров.
Авидность IgG
Индекс авидности IgG к белку SARS-CoV-2 Spike на 30 день сыворотки после иммунизации оценивали с помощью Luminex ImmunoAssay. Анализ проводили, как описано выше, с незначительной модификацией следующей инкубации шариков с сывороткой (разведенной до 1: 2000) либо с 10-минутной промывкой PBS, либо с 8М мочевиной. Индекс авидности оценивали путем вычитания фонового MFI из всех значений образца, а затем деления MFI с промывкой 8M мочевиной на MFI с промывкой PBS.
Анализ нейтрализации
Анализ титра нейтрализации вируса (VNT)
Сероконверсию нейтрализации оценивали на 10-й и 20-й день после иммунизации в BALB / c с использованием анализа нейтрализации вируса, как описано ранее [47].Вкратце, сыворотки разводили до 1:20 в культуральной среде, смешивали в соотношении 1: 1 с сингапурским клиническим изолятом живого вируса SARS-CoV-2, изолятом BetaCoV / Singapore / 2/2020 (код доступа GISAID EPI_ISL_406973) и инкубировали. в течение 1 часа при 37 ° C. Затем иммунные комплексы вирус-антитело добавляли к клеткам Vero-E6 (ATCC) в 96-луночных планшетах и инкубировали при 37 ° C. Через пять дней планшеты оценивали под микроскопом на цитопатический эффект (ЦПД) клеток.
Титр нейтрализации уменьшения бляшек (PRNT)
Нейтрализацию живого SARS-CoV-2 измеряли с помощью PRNT на 30 день после вакцинации у мышей BALB / c и C57BL / 6.Подобные протоколы были опубликованы ранее для SARS-CoV-2 [48]. Вкратце, мышиные сыворотки серийно разводили от 1:20 до 1: 320 в культуральной среде и инкубировали с сингапурским изолятом вируса SARS-CoV-2 в течение 1 часа при 37 ° C. Затем смеси вирус-антитело добавляли к клеткам Vero-E6 в 24-луночных планшетах, инкубировали в течение 1-2 часов, затем покрывали карбоксиметилцеллюлозой (CMC) и инкубировали при 37 ° C в атмосфере 5% CO 2 . Через 5 дней клетки промывают, окрашивают кристаллическим фиолетовым и подсчитывают количество бляшек.Было оценено разведение сыворотки, приводящее к нейтрализации 50% вируса, то есть PRNT 50 .
ВКЛАД АВТОРА
Рукланти де Альвис отвечал за гуморальную характеристику иммунного ответа на вакцину LUNAR COV19. Эстер С. Ган отвечала за исследования заражения трансгенных мышей huACE2 и анализ профилей экспрессии вакцины LUNAR COV19.
ЗАЯВЛЕНИЕ ОБ ИНТЕРЕСАХ
D.M., E.A., P.H., J.P., M.A., H.B., A.D., B.B., B.C., J.V., S.R, J.A.G., M.S., R.Y., W.T., K.T., S.P., P.K., J.D., S.S., S.H. и P.C. являются сотрудниками Arcturus Therapeutics, Inc.
БЛАГОДАРНОСТИ
Мы благодарим Совет по экономическому развитию Сингапура за начало этого сотрудничества и за финансирование разработки LUNAR-COV19. ARdA получило зарплату от премии молодых исследователей Национального совета медицинских исследований (NMRC). EEO получил зарплату от премии NMRC Clinician-Scientist Award (старший исследователь).
Внутренняя базовая станция для непрерывного измерения атмосферных парниковых газов
Отчет об установке для Arcturus
Law, R.M., Rayner, P.J. and Wang, Y.P. (2004) Инверсия суточного изменения синтетического CO2:
Оптимизация сети для австралийского тестового примера, Global Biogeochem. Циклы, 18, GB1044,
DOI: 10.1029 / 2003GB002136.
Law, R.M., Peters, W., Rödenbeck, C., Aulagnier, C., Baker, I., Bergmann, D.J., Bousquet, P.,
Brandt, J., Bruhwiler, L., Cameron-Smith, PJ, Christensen, JH, Delage, F., Denning AS, Fan, S.,
Geels, C., Houweling, S., Imasu R ., Карстенс, У., Кава, С.Р., Клейст Дж., Крол, М.К., Лин, С.-Дж.,
Локупития, Р., Маки, Т., Максютов, С., Нива, Ю., Ониши , R., Parazoo, N., Patra, PK, Pieterse, G.,
Rivier, L., Satoh, M., Serrar, S., Taguchi, S., Takigawa M., Vautard R., Vermeulen AT , Zhu Z.
(2008) Моделирование модели TransCom почасового атмосферного CO2: экспериментальный обзор и результаты суточного цикла
за 2002 г., Global Biogeochem.Циклы., 22, GB3009,
DOI: 10.1029 / 2007GB003050.
Леунинг, Р., Этеридж, Д., Лухар, А., Дунс, Б. (2008) Мониторинг и проверка атмосферы.
Технологии геосеквестрации СО2. Международный журнал по контролю за парниковыми газами 79, 14.
Loh, Z., Leuning. Р., Зегелин. С., Этеридж, Д., Бай, М., Нейлорд, Т., Гриффит, Д. (2009) Тестирование моделирования атмосферной дисперсии
Лагранжа для мониторинга утечки CO2 и Ch5 из геосеквестра
, Атмосферная среда, 43, 16, 2602–2611
Лухар, А., Этеридж, Д., Леунинг, Р., Стил, Л., Спенсер, Д. Херли, П., Эллисон, К., Ло, З.,
Зегелин, С. Мейер, М. (2009) Моделирование углерода потоки и концентрации диоксида вокруг геологического хранилища
CO2CRC Otway. Материалы 19-й Международной конференции по чистому воздуху и
по окружающей среде, 6–9 сентября 2009 г., Общество чистого воздуха Австралии и Новой Зеландии.
Munger, J.W. и Loescher, H.W. (2004) Руководство по измерениям вихревых ковариационных потоков
.Национальная сеть экологических обсерваторий, Североамериканская углеродная программа,
http://public.ornl.gov/ameriflux/measurement_standards_4.doc [по состоянию на октябрь 2009 г.]
Olivier, J.G.J., and Berdowski, J.J.M. (2001) Глобальные источники и поглотители выбросов, в The Climate
System, под редакцией Дж. Бердовски, Р. Гишерита и Б. Дж. Хейджа, стр. 33–78, AA Balkema
Publishers / Swets and Zeitlinger Publishers, Lisse, The Нидерланды
RET (2009) Информация о площадях для улавливания и хранения углерода, Министерство ресурсов, энергетики и
Туризм,
www.ret.gov.au/resources/carbon_dioxide_capture_and_geological_storage/carbon_capture_and_sto
rage_acreage_release / Pages / default.aspx [по состоянию на сентябрь 2009 г.]
Santos. (2009) «Проект хранения углерода в Мумбе».
www.santos.com/library/Santos_Moomba_Carbon_Storage.pdf. [доступ осуществлен в сентябре 2009 г.]
Schuepp, P.H. et al. (1990) Прогнозирование следа скалярных потоков на основе аналитических решений уравнения диффузии
. Метеорология пограничного слоя 50: 355–373.
Tarr, A. (2009) ZeroGen: низкая мощность выбросов. Австралия Япония Семинар по угольной технологии. 26 июня
2009, Брисбен.
Wandoan Power (2009) «Wandoan Power: углеродное решение – расположение»
www.wandoanpower.com.au/index.php?pageid=12 [по состоянию на октябрь 2009 г.]
47
| fs-24 | 1 промышленные стойки с глубокой оцинковкой | |
| SD013 | 3-КОЛЕСНАЯ ДОЛЛАЯ ПЛИТА | |
| 54286X-360PT | 360 PT от 12 дюймов до 20 дюймов | |
| SDS003 | Тележка для перекрытия 4-х колес Abaco | |
| SD0x | Опоры для перекрытий Abaco 8 и 11 дюймов | |
| ACC40 | Зажимы для переноски Abaco | |
| ADE089- | Дегидратор Abaco | |
| CDX | Мусорные контейнеры Abaco | |
| AFJ-25 | Стрела для вилочного погрузчика Abaco | |
| SRK010X | Стойки для гранитных и мраморных плит Abaco | |
| TAF60H- | Тяжелый грузовик Abaco с А-образной рамой! | |
| ABS22 | Abaco Lifter – дужка | |
| Abaco_Little_Giant_50 | Подъемник Abaco – Little Giant 50 | |
| ALG50-W- | Подъемник Abaco – Little Giant 50 (белый) | |
| ALG75-B | Подъемник Abaco – Little Giant 75 | |
| ALG75-W | Подъемник Abaco – Little Giant 75 (белый) | |
| SWS03 | Подъемник Abaco – стальная шарнирная скоба | |
| ASL017 | Кабельная соединительная стропа подъемника Abaco | |
| OSA72X | Универсальные тележки с А-образной рамой Abaco | |
| ALG-026 | Запасная часть для ремонта Abaco, набор фиксирующих защелок для Little Giant | |
| ALGExtensionSpringsKit75 | Набор запасных пружин Abaco для Little Giant (75) | |
| ALGExtensionSpringsKit50 | Комплект запасных пружин Abaco для Little Giant 50 | |
| RSR0X | Стеллаж для перекрытий Abaco Rhino | |
| SC100 | Зажим ножничный Abaco | |
| SC150 | Зажим ножничный Abaco 150 | |
| SLT13MX | Самоблокирующаяся тележка для гранита и мрамора Abaco | |
| SBG800- | Багги Abaco Slab | |
| AFJS-25 | Стрела для вилочного погрузчика с поворотной стрелой Abaco | |
| AWT7523X | Рабочий стол Abaco | |
| ARL100 | Подъемник Arcturus | |
| ALG75-012 | Задняя пластина ALG75-012 | |
| ALG50-012 | Задняя пластина и резиновая подкладка для подъемника Abaco Little Giant 50 | |
| ALG50-013 | Нижний штифт ALG50-013 | |
| ALG75-013 | Нижний штифт ALG75-013 | |
| ALG-002 | Шайба латунная ALG-002 | |
| BSR010 | Стойка для пакетов | |
| SRK-01A | Заглушки для опоры стойки перекрытия – без резины | |
| SRK-02A | Заглушки для опоры стойки перекрытия – с резиной | |
| ALG75-014 | Центральная пластина ALG75-014 | |
| ALG50-14 | Центральная пластина и резиновая подкладка для подъемника Abaco Little Giant 50 | |
| 54286802 Чашка X-Cyclone-Resin-Cup | Циклонные заполненные смолой колесные диски | |
| 5428623-Fury-Curved-Blade | DB Fury сегментированная кривая 4.5 дюймов и 5 дюймов | |
| DSBG1320- | Двухсторонний багги | |
| D-FORK-10-SL | Вилка с двойным шарниром, 10 000 фунтов. Подъемный крюк для подъема | |
| 542861-DX-Turbo-10PK | DX – Turbo – 10 Pack от 4,5 до 7 дюймов | |
| ECOBACKER | Адаптеры для подкладки экономичных подкладок на липучке. | |
| EHC3541- | Подъемная тележка | |
| ALG-001 | Внешнее стопорное кольцо ALG-001 | |
| 54286744X-Fast-Fury-Core-Bit | Биты для сухого керна Fast FuryTM от 1-1 / 4 “до 1-1 / 2” | |
| 450,1 | Алмазные диски на липучке Flex 4 “Dia-Jet – 100 = красный (# 450.100) | |
| 450,15 | Алмазные диски на липучке Flex 4 “Dia-Jet – 1500 = оранжевый (# 450.150) | |
| 450,2 | Алмазные диски на липучке Flex 4 “Dia-Jet – 200 = желтый (# 450.200) | |
| 450,3 | Алмазные диски на липучке Flex 4 “Dia-Jet – 3000 = розовый (# 450.300) | |
| 450,4 | Алмазные диски на липучке Flex 4 дюйма Dia-Jet – 400 = синий (# 450.400) | |
| 450,05 | Алмазные диски на липучке Flex 4 дюйма Dia-Jet – 50 = зеленый (# 450.050) | |
| 450,8 | Алмазные диски на липучке Flex 4 “Dia-Jet – 800 = темно-зеленый (# 450.800) | |
| 450,9 | Алмазные диски на липучке Flex 4 дюйма Dia-Jet – Buff Pad White (# 450.900) | |
| 550,1 | Алмазные диски на липучке Flex 5 дюймов Dia-Jet – 100 = красный (# 550.100) | |
| 550,15 | Алмазные диски на липучке Flex 5 дюймов Dia-Jet – 1500 = оранжевый (# 550.150) | |
| 550,2 | Алмазные диски на липучке Flex 5 дюймов Dia-Jet – 200 = желтый (# 550.200) | |
| 550,3 | Алмазные диски на липучке Flex 5 дюймов Dia-Jet – 3000 = розовый (# 550.300) | |
| 550,4 | Алмазные диски на липучке Flex 5 дюймов Dia-Jet – 400 = синий (# 550.400) | |
| 550,05 | Алмазные диски на липучке Flex 5 дюймов Dia-Jet – 50 = зеленый (# 550.050) | |
| 550,8 | Алмазные диски на липучке Flex 5 дюймов Dia-Jet – 800 = темно-зеленый (# 550.800) | |
| 451,43 | Flex Brand Backer Pad Adapters – # 451.430 = 4 “Мягкая подкладка | |
| 451.45 | Flex Brand Backer Pad Адаптеры – # 451.450 = 4 “Ridgid Backer Pad | |
| 451,5 | Flex Brand Backer Pad Adapters – # 451.500 = 5 “Мягкая подкладка | |
| 451,55 | Flex Brand Backer Pad Адаптеры – # 451.550 = 5 “Ridgid Backer Pad | |
| 451.6 | Flex Brand Backer Pad Adapters – # 451.600 = 3 “Ogee Aluminium Back Up Pad | |
| 354,33 | Полировальная машина с 3 головками с планетарным приводом FLEX LCP | |
| 355,05 | FLEX LW 1503 5 “Мокрая полировальная машина (электрическая) | |
| 253,69 | FLEX LW 603 Мокрая полировальная машина с регулируемой скоростью (электрическая) | |
| 355.9 | FLEX PLW Air Stone Sander / Polisher Wet (AIR) | Пневматическая шлифовальная машина для камня|
| 378,66 | FLEX Односкоростной 5-дюймовый полировальный станок для влажной уборки (электрический) | |
| 375,24 | Полировальная машина для влажной уборки FLEX с регулируемой скоростью 5 дюймов (электрическая) | |
| 54286x-Fury-Turbo | Fury -Turbo Гранитные лезвия от 4 до 8 дюймов | |
| AGL-28 | СТЕКЛЯННЫЙ ПОДЪЕМНИК | |
| LM-HighRiser-Boom-4-24 | Гранит 4000 фунтов.5 футов (60 дюймов) нетелескопическая или телескопическая стрела вилочного погрузчика с высоким подъемом стрелы | |
| LM-Rise-4 | Гранит 4000 фунтов. Нетелескопическая или телескопическая стрела вилочного погрузчика с подъемным подъемником 24 дюйма, стрела | |
| LM-4000-Стрела | Гранит 4000 фунтов. Стрела вилочного погрузчика с телескопической стрелой | |
| LM-Tilting-4-Boom | Гранит 4000 фунтов.Наклоняемая нетелескопическая или телескопическая стрела вилочного погрузчика | |
| LM-HIGHRISER-BOOM-6-24 | Гранит 6000 фунтов. 5 футов (60 дюймов) нетелескопическая или телескопическая стрела вилочного погрузчика с высоким подъемом стрелы | |
| LM-Rise-6 | Гранит 6000 фунтов. Нетелескопическая или телескопическая стрела вилочного погрузчика с подъемным подъемником 24 дюйма, стрела | |
| LM-6000-СТРЕЛА | Гранит 6000 фунтов.Стрела вилочного погрузчика с телескопической или нетелескопической стрелой | |
| LM-Tilting-6-Boom | Гранит 6000 фунтов. Наклоняемая нетелескопическая или телескопическая стрела вилочного погрузчика | |
| LM-1T-8-24 | Гранит 8000 фунтов. Телескопическая стрела для вилочного погрузчика с подъемным подъемником 24 дюйма, стрела | |
| LM-8000-СТРЕЛА | Гранит 8000 фунтов.Стрела вилочного погрузчика с телескопической стрелой | |
| LM-TILTING-8-BOOM | Гранит 8000 фунтов. Откидная стрела вилочного погрузчика с телескопической стрелой | |
| 54286-Rodding-Blade | Лезвия для гранитных стержней. | |
| зеленый x | Зеленый X Упаковка 100 шт. | |
| Groves-Part-AFTL | Замок Groves Footlock для столов TT3272 | |
| GrovesFootlockforTT3272table | Замок Groves Footlock для столов TT3272 | |
| HDSC48 | Тележка для тяжелых условий эксплуатации Groves | |
| SSSC-4036 | Тележка для одностороннего гранита Groves | |
| TT3272 | Гранитная тележка Groves Tilt Table | |
| 54286801X-Hurricane-cup-wheel | Колеса для урагана | |
| 5428622X-3 дюйма | Индивидуальные прокладки 3 “Magnum Flex Pad | |
| Magnum-CP-3 дюйма | Индивидуальные прокладки Flex 3 “Magnum ™ CP Flex. | |
| 5428622X-4 дюйма | Индивидуальные колодки Magnum Flex 4 дюйма | |
| Magnum-CP-4 дюйма | Индивидуальные 4-дюймовые подушечки Magnum ™ CP Flex. | |
| Magnum-CP-5 дюймов | Индивидуальные прокладки Flex 5 “Magnum ™ CP. | |
| ALG50-027 | Колесо внутреннего прижима ALG50-027 | |
| ALG75-027 | Колесо внутреннего прижима ALG75-027 | |
| LM-FP | Большие карманы для вил | |
| ALG50-004 | Подъемный палец ALG50-004 | |
| ALG75-004 | Подъемный палец ALG75-004 | |
| ALG50-006 | Линкер ALG50-006 | |
| ALG75-006 | Линкер ALG75-006 | |
| H-25-MD | Низкопрофильный стальной саморазгружающийся бункер под 90 ° | |
| ALG-021 | Винт с головкой под раковину M12 ALG-021 | |
| ALG-020 | Винт с головкой под раковину M16 ALG-020 | |
| ALG-023 | Гайка M6 ALG-023 | |
| ALG015 | Винт под раковину M8 x 20 ALG015 | |
| ALG-019 | Винт под раковину M8 x 40 ALG-019 | |
| 542865 Буровая коронка X-Magnum | Биты для сухого керна Magnum GB от 1 до 2 дюймов | |
| 54286339X-Magnum-Supreme-Twin | Колесо с двумя чашками Magnum Supreme | |
| ALG75-022 | Главный корпус ALG75-022 | |
| ALG50-022 | Главный корпус и резиновая защита для подъемника Abaco Little Giant 50 | |
| маркер | Набор маркеров из 100 штук | |
| ALG-010 | Винт по металлу ALG-010 | |
| Двигатель R2 | Двигатель | |
| мульти | Мультипакет Включает по 100 символов каждого из 9 | |
| 12-FS-24 | Одна дюжина (12) стендов для изготовления оцинкованной стали | |
| OSAXPRO | Универсальная А-образная рама Pro | |
| OSA7267-2T | Двухуровневая рама One Stop 7267 | |
| SSA7247- | Универсальная односторонняя А-образная рама | |
| ALG50-003 | Колесо внешнего давления ALG50-003 | |
| ALG75-003 | Колесо внешнего давления ALG75-003 | |
| AbacoFilterBags | Упаковка из 10 сменных пакетов для дегидратора Abaco | |
| A90C-M3 | Пара ABACO 90�ЗАЖИМОВ | |
| ALR200 | Пара выравнивателей Abaco | |
| SAF060 | Пара стандартных А-образных рам Abaco для гранитных и мраморных плит | |
| FE-4 | Пара удлинителей вилочного погрузчика для (шириной 4 дюйма) 72 дюймов до 108 дюймов длиной | |
| FE-5 | Пара удлинителей вилочного погрузчика для (шириной 5 дюймов) 72 дюймов до 108 дюймов длиной | |
| FE-6 | Пара удлинителей вилочного погрузчика для (6 дюймов в ширину) от 72 дюймов до 108 дюймов в длину | |
| радиус | Радиус в упаковке 100 шт. | |
| 5428670X-Рэмбо | Рэмбо от 12 дюймов до 18 дюймов | |
| 5428674X-Rambo-Core-Bit | Биты для сухого керна RamboTM PT от 1-1 / 4 “до 2” | |
| красный x | Красный X Упаковка 100 шт. | |
| ALG-024 | Отпускная струна ALG-024 | |
| RES27- | Стойка для остатков | |
| ALG50-013B | Резиновые вставки ALG50-013B | |
| ALG75-013B | Резиновые вставки ALG75-013B | |
| шов | Набор из 100 шт. По кромке шва | |
| ALG50-016 | Вал ALG50-016 | |
| ALG75-016 | Вал ALG75-016 | |
| СТОИМОСТЬ ДОСТАВКИ | Стоимость доставки | |
| SHIP-COST-176.35 | Стоимость доставки – совокупная $ 176,35 | |
| ДОСТАВКА-216 | Стоимость доставки – совокупная $ 216 | |
| ДОСТАВКА-345.75 | Стоимость доставки – совокупная $ 345,75 | |
| SHIP-COST-160 | Стоимость доставки – Грузовик 160 $.00 | |
| ДОСТАВКА-219.15 | Стоимость доставки – грузовик $ 219,15 | |
| ДОСТАВКА-102 | Стоимость доставки – Грузовик – 102 | |
| ДОСТАВКА-225.60 | Стоимость доставки – Грузовик – 225,60 | |
| SHIP-COST-101 | Стоимость доставки – Грузовик 101 | |
| SHIP-COST-112 | Стоимость доставки – Грузовик 112 | |
| SHIP-COST-114.17 | Стоимость доставки – Грузовик 114,17 | |
| СТОИМОСТЬ-120,25 | Стоимость доставки – Грузовик 120,25 | |
| ДОСТАВКА-120.48 | Стоимость доставки – грузовик 120,48 | |
| SHIP-COST-130 | Стоимость доставки – Грузовик 130 | |
| SHIP-COST-136 | Стоимость доставки – Грузовик 136 | |
| SHIP-COST-145.42 | Стоимость доставки – грузовик 145,42 | |
| ДОСТАВКА-163 | Стоимость доставки – Грузовик 163 | |
| ДОСТАВКА-170,88 | Стоимость доставки – Грузовик 170,88 | |
| ДОСТАВКА-194 | Стоимость доставки – Грузовик 194 | |
| SHIP-COST-202.46 | Стоимость доставки – Грузовик 202,46 | |
| ДОСТАВКА-СТОИМОСТЬ-334 | Стоимость доставки – Грузовик 334 | |
| ДОСТАВКА-989.63 | Стоимость доставки – UPS на следующий день – 989,63 долл. США | |
| СТОИМОСТЬ-135.00 | Стоимость доставки Грузовик- 135.00 | |
| MOD-S1 | Строительная пила MOD-S1 | |
| MOD-S2 | Строительная пила MOD-S2 | |
| плита дефект | Упаковка с дефектами плиты из 100 штук | |
| RSR-полюс | Опора стойки для перекрытий | |
| RSR-Pole-Rubber | Опора стойки для перекрытий с резиновым покрытием | |
| ALG-005 | Распорка ALG-005 | |
| ASB056M1- | Распорка балки (M1) | |
| стальная вата 0000 | Стальная шерсть – # 0000 Super Fine – 8 шт. В упаковке | |
| упор | Stop Polishing Here Набор из 100 штук | |
| PLSC-2-2436 | Тележка для полировки конструкционного пластика | |
| AWT7523-только на роликах | Поворотный ролик для рабочего стола Abaco | |
| вверх | Пакет This Edge Up из 100 штук | |
| TSL-4 | Подъемник плитки | |
| ТС-1 | Пила для плитки TS-1 | |
| ALG50-011 | Верхний палец ALG50-011 | |
| ALG75-011 | Верхний палец ALG75-011 | |
| SLT128 | Тройной всасывающий подъемник | |
| Пара | Набор инструментов для установки под раковину | |
| ALG-007 | Шайба (нижняя) ALG-007 | |
| ALG-009 | Шайба (верхняя) ALG-009 | |
| желтый x | Желтый X Упаковка 100 шт. |
Наночастицы на основе липидов | Энциклопедия
3.Наночастицы на липидной основе для доставки лекарств
Уже почти 30 лет липосомы процветают в клинических применениях. Был одобрен 21 липосомальный продукт, инкапсулирующий различные низкомолекулярные препараты. Клинический успех Doxil ® привел к одобрению FDA многих новых нанопрепаратов, таких как Abelcet ® , AmBisome ® , DaunoXome ® , Depocyt ® , Inflexal V ® , Myocet ® , Visudyne ® , DepoDur ® , DepoCyt ® , Marqibo ® , Mepact ® , Exparel ® , Lipodox ® 000 ®, Onivyt ®, Onivyt ® , Vyxeos ® , Shingrix ® , Lipoplatin TM и Arikayce ® [1] [2] [6] [71] .Эти составы используются не только в онкологии, но также при грибковых инфекциях и обезболивании. Каждый липосомный состав описан более подробно в таблице 2, а соответствующие структурные липиды показаны на рисунке 4. Существует четыре различных липосомальных продукта с доксорубицином (Doxil ® , Myocet ® , Lipodox ® и липосомальный доксорубицин). которые показаны при новообразованиях груди. Из этих продуктов Myocet ® является традиционным препаратом, тогда как Doxil ® , Lipodox ® и Doxorubicin представляют собой скрытые пегилированные липосомы.Помимо этих трех скрытых липосом, существует только один продукт, Onivyde ® , который обладает скрытными свойствами за счет ПЭГилирования. Для анестезии одобрены две разные липосомы, инкапсулирующие бупивакаин. Для лечения угрожающих жизни грибковых инфекций на рынке также есть два липосомальных препарата, которые инкапсулируют амфотерицин B. Marqibo ® , обычная липосома, содержащая винкристин, была одобрена в 2009 году для лечения острого лимфобластного лейкоза и в 2012 году для лечения гематологических злокачественных новообразований. и лечение солидной опухоли.Кроме того, в липосомы были включены другие препараты, включая даунорубицин, цитарабин, вертепорфин, морфин, мифамуртид, иринотекан, цитарабин и амикацин. Среди них только Curosurf ® инкапсулировал поверхностно-активные белки B и C (SP-B и SP-C) в обычных липосомах для лечения респираторного дистресс-синдрома (RDS) у недоношенных детей. Атипичным препаратом является Vyxeos ® , который содержит два препарата, включенных в липосомы, тем самым используя синергетический эффект даунорубицина и цитарабина для более эффективного лечения острого миелоидного лейкоза.Таким образом, за этот период было успешно коммерциализировано 13 химиотерапевтических препаратов и один белок, приготовленный в виде обычных и скрытых липосом.
Таблица 2. Обзор одобренных липосом в ЕС и США.
| Время первоначального утверждения | Коммерческое наименование | Наркотик | Липосомные компоненты | Лечение |
|---|---|---|---|---|
| 1995 | Доксил ® | Доксорубицин | HSPC: холестерин: DSPE-PEG [6] | Новообразования груди; множественная миелома; новообразования яичников; Саркома Капоши |
| 1995 | Abelcet ® | Амфотерицин B | DMPC: DMPG [6] | Опасные для жизни грибковые инфекции. |
| 1996 | DaunoXome ® | Даунорубицин | DSPC: холестерин [6] | Рак на поздней стадии ВИЧ-ассоциированная саркома Капоши |
| 1997 | AmBisome ® | Амфотерицин B | HSPC: DSPG, холестерин [6] | Висцеральный лейшманиоз |
| 1999 | DepoCyt ® | Цитарабин | DOPC: DPPG [6] | Неопластический менингит |
| 1999 | Curosurf ® | SP-B и SP-C | Натуральное поверхностно-активное вещество легких свиней [6] | РДС у недоношенных детей |
| 2000 | AmBisome ® | Амфотерицин B | HSPC: DSPG, холестерин [6] | Криптококковый менингит у больных СПИДом |
| 2000 | Myocet ® | Доксорубицин | EPC: Холестерин | Новообразования груди |
| 2000 | Visudyne ® | Вертепорфин | EPG: DMPC [6] | Неоваскуляризация субфовеальной хориоидеи |
| 2004 | DepoDur ® | Морфин | DOPC: DPPG [6] | Обезболивающее |
| 2009 | Маркибо ® | Винкристин | SPH: холестерин [6] | Острый лимфобластный лейкоз, отрицательный по хромосомам, Филадельфия [6] |
| 2009 | Повязка Mepact ® | Мифамуртид | DOPC: DOPS [6] | Остеосаркома |
| 2011 | Exparel ® | Бупивакаин | DEPC: DPPG: Холестерин: Трикаприлин [6] | Анестетик |
| 2012 | Маркибо ® | Винкристин | SPH: холестерин [6] | Гематологические злокачественные новообразования и солидные опухоли [7] [71] |
| 2013 | Lipodox ® | Доксорубицин | HSPC: Холестерин: DSPE-PEG [6] | Новообразования груди |
| 2015 | Оливайд ® | Иринотекан | DSPC: Холестерин: DSPE-PEG [6] | Метастатический рак поджелудочной железы |
| 2017 | Липосомальный доксорубицин | Доксорубицин | HSPC: Холестерин: DSPE-PEG [6] | Новообразования груди |
| 2017 | Nocita ® | Бупивакаин | DEPC: DPPG: Холестерин: Трикаприлин [6] | Анестетик |
| 2017 | Vyxeos ® (CPX-351) | Даунорубицин Цитарабин | DSPC: DSPG: Холестерин [6] | Острый миелоидный лейкоз |
| 2018 | ArikayceTM | Амикацин | DPPC: холестерин [6] | Комплексное заболевание легких Mycobacterium avium |
| 2018 | ЛипоплатинTM НаноплатинTM | Цисплатин | DPPG: соевый ПК: MPEG-DSPE: холестерин [72] | Рак поджелудочной железы Рак легкого |
Помимо этих составов, есть много других липосом, показанных для химиотерапии, которые в настоящее время проходят клинические испытания (Таблица 3).MBP-426 ® от Mebiopharm Co., Ltd. (Токио, Япония) представляет собой инкапсулированную оксалиплатином липосому с трансферином, конъюгированную с трансферином, и показан при аденокарциноме желудка, пищевода и пищевода. Клиническое испытание фазы I (NCT00355888) MBP-426 ® было завершено [7] , с началом фазы IIa / b (NCT00964080) для характеристики профиля безопасности в комбинации с лейковорином и фторурацилом. Mebiopharm Co., Ltd. также разработала другие продукты, включая MBP-Y003, MBP-Y004 и MBP-Y005 на доклинических стадиях, которые представляют собой конъюгированные с трансферрином липосомы, содержащие метотрексат, доцетаксел и гемцитабин, соответственно [73] .Эти четыре продукта разработаны с лигандом трансферрина для нацеливания на рецепторы, которые сверхэкспрессируются в раковых тканях.
Таблица 3. Липосомальные препараты в клинических испытаниях.
| Лекарство и спонсор | Лекарство / цель | Клиническое исследование | Индикация | Арт. |
|---|---|---|---|---|
| Митоксантрон в липосомах (LEM) INSYS Therapeutics Inc (Феникс, Аризона, США) | Митоксантрон | Фаза 1 NCT00024492 Завершено | Опухоли | [72] |
| S-CKD602 Питтсбургский университет ALZA | CKD-602 | Фаза 1 NCT00177281 Завершено | Злокачественные новообразования на поздней стадии | [74] |
| Топотекан для инъекций липосом (TLI) Spectrum Pharmaceuticals, Inc (Хендерсон, Невада, США) | Топотекан | Фаза 1 NCT00765973 Завершено | Мелкоклеточный рак легкого Рак яичника Солидные опухоли | [75] |
| INX-0076 Inex Pharmaceuticals | Топотекан | Фаза 1 | Солидные опухоли поздней стадии | [74] |
| TLD-1 Швейцарская группа клинических исследований рака | Доксорубицин | Фаза 1 Набор персонала NCT03387917 | Расширенные солидные опухоли | [76] |
| LEP-ETU INSYS Therapeutics Inc (Феникс, Аризона, США) | Паклитаксел | Фаза 1 NCT00080418 Завершена Фаза 2 NCT011 | Распространенный рак (новообразование) Метастатический рак молочной железы | [72] [74] |
| MBP-426 ® Mebiopharm Co., ООО | Оксалиплатин / Трансферрин | Фаза 1/2 NCT00964080 | Солидные опухоли | [77] |
| MM-302 Merrimack | Доксорубицин / фрагмент антитела | Фаза 1/2 Обрыв | Рак груди | [78] |
| LiPlaCis Онкологическое предприятие | Цисплатин | Фаза 1/2 NCT01861496 | Фаза 1: распространенные или рефрактерные солидные опухоли Фаза 2: метастатический рак груди, рак простаты и рак кожи | [74] |
| SPI-77 NYU Langone Health | Цисплатин | Фаза 2 NCT00004083 Завершено | Рак яичников | [72] |
| OSI-211 Astellas Pharma Inc, OSI Pharmaceuticals (Фармингдейл, Нью-Йорк, США) | Луртотекан | Фаза 2 NCT00046787 Завершено | Рецидивирующий мелкоклеточный рак легкого | [72] [74] |
| ThermoDox ® Celsion | Доксорубицин / Таргетная термотерапия | Фаза 3 NCT02112656 завершена | Гепатоцеллюлярная карцинома | [79] |
| MBP-Y003 Mebiopharm Co., ООО | Метотрексат / трансферрин | Еще нет | Лимфома | [73] |
| MBP-Y004 Mebiopharm Co., Ltd. | Доцетаксел / Трансферрин | Еще нет | Лимфома | [73] |
| MBP-Y005 Mebiopharm Co., Ltd. | Гемцитабин / Трансферрин | Еще нет | Лимфома | [73] |
ThermoDox ® от Celsion – это термочувствительные липосомы, содержащие доксорубицин, для лечения гепатоцеллюлярной карциномы.Термочувствительный липид способен изменять структуру при 40–45 ° C, чтобы быстро высвобождать доксорубицин в опухоли за счет радиочастотной абляции. Хотя четыре коммерческие липосомы, загружающие доксорубицин, уже были успешно выпущены на рынок, ThermoDox ® – это новый продукт с расширенными характеристиками, который показал 5-кратное высвобождение доксорубицина в месте опухоли по сравнению с Doxil ® [80 ] . Фаза III клинических испытаний ThermoDox ® в сочетании со стандартизированной радиочастотной абляцией (NCT02112656) завершена [7] [80] .
MM-302 от Merrimack Pharmaceuticals, представляет собой скрытую липосому, модифицированную антителами, нацеленными на рецептор 2 эпидермального фактора роста человека (HER2) и содержащую доксорубицин [78] , которая подала заявку на проведение фазы 1 клинических испытаний в 2011 году. MM-302 направлена на преодоление ограничений доксорубицина, связанных с сердечной токсичностью и неэффективным воздействием на раковые клетки. MM-302 оценивался в сочетании с трастузумабом или трастузумабом плюс циклофосфамид для лечения распространенного HER2-положительного рака молочной железы.Многообещающие данные клинических испытаний фазы 1 вдохновили MM-302 перейти к фазе 2. Однако результаты эффективности не показали значительного преимущества по сравнению с препаратами сравнения, что привело к тому, что Merrimack прекратил дальнейшие испытания MM-302 в 2016 г. [81] .
SPI-77, разработанный Sequus Pharmaceuticals (Johnson & Johnson), представляет собой инкапсулированную цисплатином скрытую липосому, разработанную для лечения рецидивирующего рака яичников [82] и немелкоклеточного рака легкого IV стадии (НМРЛ) [83] .Предполагается, что SPI-77 снижает системную токсичность цисплатина и обеспечивает высокую способность доставки. Однако из-за отсутствия значимых данных в клинических испытаниях фазы 1 и фазы 2 производитель решил прекратить дальнейшие испытания [82] [83] [84] .
Инкапсулированный в липосомы митоксантрон (LEM) от INSYS Therapeutics Inc состоит из лиофилизированных липидов, смешанных с солью митоксантрона (под коммерческим названием Novantrone). Этот состав был создан для повышения безопасности и эффективности свободного новантрона.LEM вошел в фазу 1 клинических испытаний в 2001 году с идентификатором NCT00024492. Пациенты с запущенными солидными опухолями (40 участников) были набраны для внутривенной инъекции LEM. Результаты фармакокинетики крови и наблюдения опухолей были завершены в 2004 году, но никаких результатов опубликовано не было.
OSI-211, липосомы, инкапсулирующие луртотекан, был разработан для лечения рецидивирующего мелкоклеточного рака легкого. OSI-211 был клинически протестирован (NCT00046787) компанией Astellas Pharma Inc. (Тюо, Токио, Япония). Университет Питтсбурга и компания ALZA разработали S-CKD602 и завершили клиническое испытание фазы 1 (NCT00177281) для определения максимально переносимой дозы. как безопасность у пациентов с запущенными опухолями.S-CKD602 представляет собой ПЭГилированную липосому, инкапсулирующую CKD-602, аналог камптотецина, ингибирующий топоизомеразу I, с липосомальным составом, состоящим из N- (карбонил-метоксиполиэтиленгликоль 2000) -DSPE и DSPC [85] . Другая липосома, названная LEP-ETU, также вошла в фазу 1 клинических испытаний (NCT00080418). LEP-ETU – это липосома, образованная DOPC, холестерином и кардиолипином, которая инкапсулирует паклитаксел для лечения рака яичников, груди и легких [86] . Топотекан для инъекций липосом (TLI) также вошел в фазу 1 клинических испытаний (NCT00765973) для проверки его безопасности и эффективности.К настоящему времени эти четыре продукта завершили фазу клинических испытаний, но обновленной информации не было.
Три продукта, включая LiPlaCis, INX-0076 и TLD-1, проходят клинические испытания. INX-0076 был приготовлен в виде липосом с топотеканом для лечения запущенных солидных опухолей. LiPlaCis, разработанный для лечения запущенных солидных опухолей, представляет собой липосомный препарат, включающий цисплатин, который состоит из липидов со свойствами разложения, контролируемыми ферментом sPLA2 для механизма высвобождения, запускаемого опухолью [74] .TLD-1 – это новые липосомы, инкапсулирующие доксорубицин, рекомендованные для лечения запущенных солидных опухолей [76] .
4. Наночастицы на основе липидов для генной терапии
В последнее время большое распространение получили терапевтические нуклеиновые кислоты, такие как малые интерферирующие РНК (миРНК), малые активирующие РНК (саРНК) и информационные РНК (мРНК), которые находятся на переднем крае медицины благодаря своему потенциалу в эффективности доставки и лечения. широкого спектра болезней [87] [88] .Однако эти генетические препараты склонны к быстрой деградации эндонуклеазами сыворотки. Для их защиты липосомы или липидные наночастицы (LNP, включая SLN и / или NLC) все чаще используются в качестве системы доставки, которая обладает достаточной инкапсулирующей способностью и способна воздействовать на ткани и клетки [89] . Для доставки генов был разработан ряд ионизируемых липидов, каждый со своим собственным pKa и структурными свойствами, таких как 1,2-диолеоил-3-диметиламинопропан (DODAP, pKa, равное 6.6), 1,2-дилинолеил-3-диметиламинопропан, 1,2-дилинолеилокси-3-диметиламинопропан (DLin-DMA, pKa 6,8), 2,2-дилинолеил-4-диметиламинометил- [1] [3 ] -диоксолан (DLin-K-DMA, pKa 5,94), 2,2-дилинолеил-4- (2-диметиламиноэтил) – [1] [3] -диоксолан (DLin-KC2-DMA, pKa 6,68) (фиг. 5) [18] и (6Z, 9Z, 28Z, 31Z) -гептатриаконта-6,9,28,31-тетраен-19-ил-4- (диметиламино) бутаноат (Dlin- MC3-DMA, pKa 6,44) (рисунок 1). Помимо значения pKa, линкер между головной группой и алкильными цепями также является определяющим фактором эффективности доставки.Было продемонстрировано, что кетальный линкер является лучшим кандидатом по сравнению с сложноэфирными и алкоксильными линкерами [18] . Dlin-K-DMA со значительным подавлением фактора VII in vivo сравнивали с другими липидами без кетальных линкеров [18] . Серия оптимизации линкера привела к созданию DLin-MC3-DMA, который теперь рассматривается как многообещающий кандидат для генетической доставки лекарств и может быть запущен в клинике. Dlin-MC3-DMA проявлял в 10 раз более высокую эффективность, чем Dlin-KC2-DMA, в отношении подавления генов печени in vivo [21] .Иллюстрацией эффективности этого липида является Onpattro ® (рис. 1). Вторым терапевтическим средством siRNA, получившим одобрение FDA, был GIVLAARI TM (гивосиран, ALN-AS1) в ноябре 2019 г. [90] и разрешение на рынок от Европейского комитета – синтетическая siRNA, нацеленная на ген ALAS1 в гепатоцитах. Эта терапия назначается взрослым пациентам с острой печеночной порфирией, генетическим заболеванием, приводящим к накоплению токсичных молекул порфирина, которые образуются во время образования гема.Однако эта РНК-терапия состоит из голой модифицированной нуклеотидами миРНК без носителя, но в присутствии нацеливающего лиганда, который направляет лекарство в печень.
Рис. 5. Химические структуры наиболее распространенных ионизируемых катионных липидов: 1,2-диолеоил-3-диметиламинопропан (DODAP), 1,2-дилинолеил-3-диметиламинопропан, 1,2-дилинолейлокси-3-диметиламинопропан (DLin -DMA), 2,2-дилинолеил-4-диметиламинометил- [1] [3] -диоксолан (DLin-K-DMA) и 2,2-дилинолеил-4- (2-диметиламиноэтил) – [ 1] [3] -диоксолан (DLin-KC2-DMA).
Платформа LNP, разработанная Arcturus Therapeutics, Inc. (Сан-Диего, Калифорния, США) для доставки РНК, была названа РНК, модифицированной с помощью липидов и разблокированной нуклеомономерным агентом (LUNAR ® ). LUNAR состоит из запатентованных ионизируемых аминокислотных липидов (58 молярных%, ATX, рис. 4), фосфолипида 1,2-дистеароил-sn-глицеро-3-фосфохолина (7 молярных%, DSPC), холестерина (33,5 молярных%) и DMG-PEG 2000 (1,5 мол.%) [91] . Липиды ATX похожи на семейство липидов, разработанное Alnylam / Acuitas, которое можно модифицировать для нацеливания на определенный тип клеток или тканей по различным показаниям.В отличие от обычных катионных липидов, липиды ATX разлагаются в физиологических условиях за счет разрыва сложноэфирных связей, тем самым способствуя быстрой деградации для более быстрого метаболизма и лучшего профиля безопасности [92] . Было показано, что LUNAR использовался для инкапсуляции мРНК человеческого FIX (hFIX) для лечения гемофилии B в доклинических условиях [93] . Эффективность LUNAR в доставке мРНК была в 5 раз выше, чем у других липидных носителей с DLin-MC3-DMA или гептатриаконта-6,9,28,31-тетраен-19-ил-4- (диметиламино) бутаноатом) (MC3).Кроме того, состав LUNAR не вызывал неблагоприятного иммунного ответа, такого как увеличение ферментов печени, которые являются маркерами острой токсичности для печени [93] .
Помимо Onpattro в качестве первого коммерческого продукта РНК, GIVLAARI TM и мРНК-LUNAR в доклинических исследованиях, в настоящее время в клинические испытания прошли различные РНК-LNP (Таблица 4). TKM-080301 был изучен и произведен Arbutus Biopharma Corporation для лечения солидных опухолей, таких как нейроэндокринные опухоли желудочно-кишечного тракта или карцинома коры надпочечников (ACC) [94] .TKM-080301 состоит из миРНК, инкапсулированной в LNP, которые могут нацеливаться на поло-подобную киназу 1 (PLK1), которая регулирует критические аспекты прогрессирования опухоли. Было проведено клиническое исследование фазы I / II (NCT01262235) с многообещающими данными по безопасности и противоопухолевой эффективности [94] [95] . После тестирования на 16 пациентах при 0,6 или 0,75 мг / кг / неделю в течение 18 циклов было подтверждено, что TKM-080301 может увеличивать экспрессию PLK1 и инактивировать мишень в ACC. Позже, в 2018 году, TKM-080301 прошел клиническую оценку безопасности, фармакокинетики и предварительной противоопухолевой активности у пациентов с запущенной гепатоцеллюлярной карциномой (NCT021) [96] [97] .В этом раннем исследовании с 43 пациентами противоопухолевый эффект TKM-080301 был ограничен. Следовательно, TKM-080301 не использовался для дальнейшей оценки в качестве единственного агента для лечения HCC, и клинические исследования были прекращены [97] .
Таблица 4. Список РНК-инкапсулированных липидных наночастиц (LNP) с показаниями и информацией о клинических испытаниях.
| Препарат и его спонсор | Цель | Клиническое исследование | Индикация | Арт. | |
|---|---|---|---|---|---|
| DCR-MYC Dicerna Pharmaceuticals, Inc. | Онкоген MYC | Прекращено, фаза I, II NCT02314052, NCT02110563 | Солидные опухоли, Гепатоцеллюлярная карцинома | [26] [98] | |
| TKM-080301 Arbutus Biopharma Corporation (Варминстер, Пенсильвания, США) | PLK1 (поло-подобная киназа-1) | Завершено, Фаза I, II NCT01262235, NCT021 | Нейроэндокринные опухоли желудочно-кишечного тракта, опухоли надпочечников, гепатоцеллюлярная стадия поздней стадии карцинома | [26] [94] [95] [96] | |
| миРНК EphA2 M.Онкологический центр Д. Андерсона Национальный институт рака (NCI) | EphA2 | Набор персонала, Фаза 1 NCT015 | Злокачественное солидное новообразование на поздней стадии | [26] [99] [100] | |
| ARB-001467 Arbutus Biopharma Corporation | HBsAg | Завершено, Фаза II NCT02631096 | Гепатит В, хронический | [26] | |
| PRO-040201 Arbutus Biopharma Corporation | ApoB | Прекращено, фаза I (Возможность иммунной стимуляции препятствовать дальнейшему увеличению дозы.) NCT00 9 | Гиперхолестеринемия | [26] | |
| ALN-PCS02 Alnylam Pharmaceuticals | PCSK9 | Завершено, Фаза I NCT01437059 | Повышенный уровень холестерина ЛПНП | [26] | |
| ND-L02-s0201 Bristol-Myers Sqyubb Pharmaceuticals | HSP47 | Завершено, Фаза I NCT02227459 | Фиброз печени | [26] | |
| ARC-520 Arrowhead Pharmaceuticals и ICON Clinical Research | HBsAg | Прервано, Фаза 2 NCT02065336 | Вирус хронического гепатита B | [23] | |
| DCR HBVS Dicerna Pharmaceuticals, Inc. | HBsAg | Набор персонала, Фаза 1 NCT03772249 | Гепатит В, хронический | [23] [101] | |
| ALN-VSP02 Липидные наночастицы | миРНК-KSP | Завершено, Этап 1, NCT01158079 | Рак – солидные опухоли | [102] [103] [104] | |
| мРНК-2752 Липидная наночастица Moderna Tx.Inc. (Кембридж, Массачусетс, США) и AstraZeneca (Кембридж, Великобритания) | OX40L Т-клетка | Набор персонала, Фаза 1 NCT03739931 | Рак различный | [105] [106] | |
| мРНК-2416 Липидная наночастица ModernaTX, Inc. | OX40L Т-клетка | Рекрутинг, Этап 1-2, NCT03323398 | Рак – солидная опухоль, лимфома, яичник | [107] | |
| Липосомный лосьон T4N5 Национальный институт рака (NCI) | прокариотический фермент репарации ДНК | Завершено Этап 2 NCT00089180 | Рецидив немеланомного рака кожи | [108] |
Dicerna Pharmaceuticals (Лексингтон, Массачусетс, Массачусетс, США), компания, специализирующаяся на РНК-препаратах, подавляющих гены, разработала DCR-MYC, липидную частицу, которая включает синтетическую двухцепочечную РНК для нацеливания на онкоген MYC и подавления прогрессирования рака [26] [109] .Эта терапия была оценена в исследовании повышения дозы у пациентов с множественной миеломой, лимфомой или солидными опухолями (NCT02110563). Кроме того, DCR-MYC также оценивался в клинических испытаниях на гепатоцеллюлярную карциному (NCT02314052) [98] . Однако все клинические исследования, связанные с DCR-MYC, были остановлены Dicerna, поскольку первые результаты эффективности не оправдали ожиданий компании и не потребовали дальнейшего развития. [98] [110] .
В области использования генетических методов лечения рака Wagner et al.разработали нанолипосомный препарат, нацеленный на EphA2 (миРНК EphA2), который имеет нейтральный заряд и направлен на снижение токсичности для органов, связанной с заряженными частицами [99] . EphA2 принадлежит к подсемейству рецепторов тирозинкиназ и сверхэкспрессируется при раке груди, легких, простаты, яичников, поджелудочной железы и эндометрия [99] . Таким образом, инкапсулированная миРНК нарушает пролиферацию раковых клеток и замедляет рост опухоли. В доклинических исследованиях этот состав продемонстрировал значительный противораковый эффект с умеренными ответами гемолитической реакции, воспаления и инфильтрации мононуклеарных клеток в желудочно-кишечном тракте, сердце и почках [111] .Эти многообещающие результаты привели к тому, что миРНК EphA2 вошла в фазу 1 клинических испытаний (NCT015
ModernaTX, Inc. и AstraZeneca разработали инкапсулированный мРНК-2752 LNP и подали заявку на проведение фазы 1 клинического исследования (NCT03739931). Эта мРНК кодирует OX40L, костимулятор Т-клеток, провоспалительные цитокины IL-23 и IL-36γ. Пациенты с солидными опухолями получали мРНК-2752 индивидуально или в комбинации с дурвалумабом.Уменьшение опухоли при монотерапии или двойной терапии дурвалумабом наблюдалось в доклинических исследованиях у пациентов с запущенной солидной злокачественной опухолью или лимфомой, что подтверждает переход мРНК-2752 к исследованиям фазы 1. Используя аналогичную технологию, ModernaTX, Inc. изучила другого кандидата LNP (мРНК 2416) для лечения пациентов с запущенными злокачественными новообразованиями [107] . мРНК-2416 доставляется непосредственно в опухоли, которые сверхэкспрессируют OX40, которые затем активируют сильные Т-клеточные ответы, убивающие опухоль.В настоящее время этот кандидат набирается для участия в клинических испытаниях 1-2 фазы с идентификатором NCT03323398 [107] .
Alnylam Pharmaceuticals также завершила Фазу 1 клинических испытаний (NCT01158079) ALN-VSP02 в 2012 г. [104] , который представляет собой LNP с миРНК, нацеленную на экспрессию фактора роста эндотелия сосудов (VEGF) и белка веретена кинезина (KSP). [103] . Эти факторы чрезмерно экспрессируются во многих опухолях и способствуют пролиферации и выживанию опухолей.Следовательно, ALN-VSP02 подавляет эти две мРНК и предотвращает трансляцию белков KSP и VEGF, что ингибирует рост опухоли у этих пациентов.
Система LNP-RNA оказалась универсальной платформой, которая не ограничивается лечением рака. С 2009 по 2019 год было одобрено для клинических испытаний 6 аналогичных продуктов (таблица 4). Arbutus Biopharma Corporation завершила фазу 2 клинических испытаний (NCT02631096) для ARB-001467 [17] . Эта формула содержала миРНК против четырех транскриптов вируса гепатита B и была показана пациентам с гепатитом B.Bristol-Myers Squibb и Nitto Denko Corporation завершили клиническое испытание фазы 1b / 2 ND-L02-s0201, которое было показано пациентам с умеренным и обширным фиброзом печени (NCT02227459). ND-L02-s0201, белок теплового шока 47 siRNA, замедляет синтез и секрецию коллагена для предотвращения фиброза. Это клиническое исследование было начато в Японии после того, как оно было начато в Европе и США. Arrowhead Research также разработала ARC-520 для лечения вируса гепатита B и применила клинические испытания фазы 2 (NCT02065336).ARC-520, созданный на основе интерференционной РНК, которая может восстанавливать все транскрипты РНК, полученные из ковалентно замкнутой кольцевой ДНК, что приводит к снижению вирусных антигенов и ДНК вируса гепатита B. Однако ARC-520 был прекращен из-за токсичности, связанной с доставкой [112] . В настоящее время Dicerna Pharmaceuticals, Inc. разработала LNP с siRNA (названная DCR-HBVS), нацеленная на мРНК поверхностного антигена гепатита B (HbsAg), для лечения хронического гепатита B. Запрошена фаза 1 клинических испытаний DCR-HBVS ( NCT03772249), когда были получены многообещающие доклинические данные, в которых мышиная модель гепатита B, обработанная DCR-HBVS, была значительно снижена.
Alnylam Pharmaceuticals также завершила фазу 1 клинического испытания (NCT01437059) ALN-PCS02 для лечения пациентов с гиперхолестеринемией. ALN-PCS02 составлен из миРНК, инкапсулированной в липидные LNP, в которых миРНК снижает фермент пропротеин конвертазы субтилизин / кексин типа 9 (PCSK9) метаболизма холестерина в плазме, что приводит к снижению уровня липопротеина низкой плотности [111] .
Tekmira зарегистрировала в 2009 году клиническое испытание фазы 1 с идентификатором NCT00
9 для PRO-040201, которое содержит siRNA, загруженную в стабильную нуклеиновую кислоту LNP.PRO-040201 может нацеливаться на ApoB, продуцируемый гепатоцитами, для контроля уровня холестерина в крови. Хотя предварительное клиническое испытание продемонстрировало, что PRO-040201 эффективно доставляет миРНК в печень и значительно снижает уровень липопротеинов низкой плотности, при самой высокой дозе [111] наблюдались гриппоподобные симптомы. Таким образом, Текмира решила прекратить исследование в 2010 году.
5. Наночастицы на основе липидов для вакцин
В конце 2019 года в городе Ухань китайской провинции Хубэй появились больные пневмонией.После этого, в январе 2020 года, новый коронавирус, вызывающий пневмонию, был подтвержден китайцами под названием 2019 nCoV. Всемирная организация здравоохранения (ВОЗ), китайские власти и другие партнеры работали над пониманием свойств, источников, предотвращения распространения вируса и методов лечения [113] . Однако пандемия COVID-19 беспрецедентно распространяется по всему миру, что серьезно влияет на здоровье людей и общества в глобальной экономике. В результате остро стоит потребность не только в спасении пациентов с COVID-19, но и в разработке вакцин.
Вакцины на основе нуклеиновых кислот привлекли большое внимание, и первые кандидаты вошли в клинические испытания [114] . Вакцины на основе нуклеиновых кислот обладают многими преимуществами по сравнению с обычными вакцинами на основе белков, такими как простота синтеза, безопасность, эффективное манипулирование антигенами, стоимость и возможность масштабирования [115] [116] . Однако нуклеиновые кислоты обладают некоторыми присущими им недостатками [114] [116] . ДНК имеет низкую иммуногенность и может интегрироваться с геномом человека [116] .РНК быстро разлагается в физиологической среде и эффективно выводится за счет клубочковой фильтрации менее чем за 10 минут [14] . Несмотря на это, РНК по-прежнему считается лучшей платформенной технологией для разработки вакцин против различных заболеваний, как неинфекционных, так и инфекционных [117] . Вакцины с транскрибированной РНК in vitro демонстрируют эффективную экспрессию антигена и самоадъювантность [118] . Адъюванты часто добавляют к вакцинам для усиления и продления иммунного ответа [119] , но они также могут вызывать побочные воспалительные эффекты [120] .Таким образом, РНК-вакцины становятся многообещающими кандидатами в качестве самоадъювантных вакцин с минимальными воспалительными побочными эффектами [121] . Частицы для доставки вакцины должны обеспечивать высокую загрузочную способность, устойчивое высвобождение, отсутствие утечек и простоту производства [122] . Чтобы максимизировать эффективность этих вакцин-кандидатов, а также достичь благоприятного индекса для применения на людях, каркасы, несущие эти агенты, играют важную роль в эффективности вакцины. Тщательное рассмотрение подходящих каркасов для конкретной вакцины играет ключевую роль в производстве вакцины.Связанные с липосомными каркасами, четыре других одобренных липосомы Inflexal V, Epaxal, Mosquirix и Shingrix были успешно коммерциализированы как вакцины [6] [7] [71] . Эти липосомы включают вакцину против виросомного гриппа, инактивированный вирус гепатита A, RTS, вакцину на основе S-антигена и вакцину на основе гликопротеина E [6] [7] . LNP стали идеальными кандидатами для разработки вакцины, они похожи на вирусные структуры с вирусоподобными размерами и способны нести антигены и адъюванты [123] .
Наряду с историей разработки вакцины, адъюванты не менее важны и привели к значительному прогрессу в составах вакцин и их эффективности. В частности, квасцы (нерастворимые соли алюминия) включены во многие детские вакцины, такие как вакцины DTaP (дифтерия, столбняк, коклюш), пневмококковая конъюгированная вакцина и вакцины против гепатита B [124] [125] . Из других вакцин, одобренных в 2015 году, было много составов, содержащих адъюванты.Например, AS01 (MPL (лиганд TLR4 природного происхождения) и сапонин QS21), MF59 и иммуностимулирующие олигонуклеотиды представлены в Shingrix, Fluad и Heplisav, соответственно [124] . Кроме того, в лицензированные продукты [124] [125] были включены различные другие адъюванты вакцин, включая AS04, RC-529, CpG ODN, агонист TLR9, агонист TLR4 и виросомы. Эти вакцины подтверждают, что включение адъювантов может способствовать более быстрому и успешному внедрению вакцины в клинику.Также сообщалось, что широкий спектр липидов обладает сильной адъювантной активностью. В частности, катионный липид диметилдиоктадециламмония бромид (DDA) показал отложение антигена в месте инъекции, усиление интернализации клеточного антигена и ассоциацию антигена [126] . В результате прогнозировалось, что LNP, изготовленные из DDA, обладают самоадъювантной активностью. Действительно, Андерлуцци и др. сообщили, что эмульсия полимерных наночастиц, липосом и твердых липидных наночастиц, структурированных DDA, обладает высокой эффективностью адсорбции антигена, переносом антигена in vitro, распределением in vivo и высоким ответом антител [126] .Однако уровень иммуногенности сильно зависел от типа препарата. Система наночастиц показала высокое поглощение клетками и процессинг антигена, в то время как эмульсия показала высокие ответы антител [126] .
В другом случае LNP использовали в качестве системы-носителя для адъювантов и мРНК для достижения их синергетических эффектов при иммунной стимуляции. Ли и др. изготовили LNP с адъювантом Pam3 (три-пальмитоил-S-глицерил цистеин, связанный с пентапептидом) для переноса мРНК для иммунотерапии рака.Их результаты показали, что этот состав запускал различные TLR для увеличения популяции CD8 + Т-клеток, тем самым предотвращая рост опухоли. Таким образом, комбинация адъюванта и мРНК в носителе LNP может быть многообещающим направлением в лечении рака на основе мРНК [118] .
5.1. Наночастицы на основе липидов для терапевтических вакцин
LNP и липосомы показали свою лучшую пригодность для вакцин на основе РНК по защитной способности, фармакокинетике, тканевому распределению и целевой доставке (дендритные клетки и макрофаги) [12] [114] [122] [127] [128] .Оптимизировав более 1000 кандидатов, был сделан вывод, что LNP являются подходящими носителями для доставки мРНК-кодирующих антигенов для противораковых вакцин [13] . Такие РНК-LNP были разработаны для обращения вспять M2-подобных макрофагов или других иммуносупрессивных фенотипов, для активации врожденного иммунитета, для ингибирования других растворимых иммунодепрессивных факторов и для индукции инфильтрирующих опухоль лимфоцитов для стратегий иммуномодуляции для лечения злокачественных опухолей (Рисунок 6). . Фактически, существует множество исследований, связанных с этой темой, которые были обобщены в избранных обзорах [12] [13] [14] .Здесь мы сосредоточимся на клинических испытаниях разработанных вакцин, которые кратко представлены в Таблице 5.
Рисунок 6. Стратегии иммуномодуляции для улучшения иммунотерапии рака в наномедицинских препаратах: Наномедицин был разработан для индукции гибели иммуногенных клеток, для усиления противоопухолевого иммунитета (вакцинация от рака), для модуляции иммунных клеток, для активации врожденного иммунитета, для подавления растворимых иммунодепрессивных факторов, для альтернативный матрикс опухоли для конструирования лимфоцитов и нормализации сосудов [129] .
Таблица 5. Информация о клинических испытаниях LNP для противораковых вакцин.
| Вакцина | Разработчик | Индикация |
|---|---|---|
| Липо-МЕРИТ | BioNTech RNA Pharmaceuticals GmbH Фаза 1: NCT02410733 (*) [130] | Рак (меланома) |
| мРНК-4157 | ModernaTX, Inc. и Merck Sharp & Dohme Corp. Фаза 1: NCT03313778 (*) [131] Этап 2: NCT03897881 (*) [132] | Рак (рак мочевого пузыря, меланома и немелкоклеточная карцинома легкого (НМРЛ)) |
| Stimuvax (L-BLP-25) | EMD Serono & Merck KGaA, Дармштадт, Германия. Фаза 3: NCT00409188 (*) Завершено [72] | Немелкоклеточный рак легкого |
Lipo-MERIT – противораковая вакцина [133] , состоящая из четырех мРНК, кодирующих NY-ESO-1, MAGE-A3, тирозиназу и TPTE, которые инкапсулированы в липосомы без какой-либо модификации с помощью молекулярных лигандов [134] .Lipo-MERIT перемещается в селезенку и поглощается дендритными клетками селезенки и макрофагами для активации NK, B, CD4 + и CD8 + Т-клеток. В настоящее время липо-МЕРИТ находится на стадии 1 клинических испытаний [130] , что касается развития коммерческого препарата.
Другой противораковой вакциной, находящейся в клинических испытаниях, является персонализированная вакцина против рака мРНК-LNP, мРНК-4157, разработанная ModernaTX, Inc. и Merck Sharp & Dohme Corp. Эта вакцина показана пациентам с удаленными солидными опухолями, включая карциному мочевого пузыря, меланому и другие. -мелкоклеточная карцинома легкого (НМРЛ).Кроме того, мРНК-4157 также используется в комбинации с пембролизумабом для пациентов с запущенным или метастатическим раком. После введения этот LNP захватывается и транслируется антигенпрезентирующими клетками, тем самым вызывая как цитотоксические Т-лимфоциты, так и зависимые от Т-клеток памяти иммунные ответы для разрушения раковых клеток. В настоящее время мРНК-4157 проходит клиническую оценку безопасности и эффективности в фазе 1 (NCT03313778) [131] и фазе 2 (NCT03897881) [132] .
Stimuvax (L-BLP-25, липосома BLP25) от EMD Serono & Merck KgaA, Дармштадт, Германия также вошел в фазу 3 клинических испытаний (NCT00409188).Эта терапевтическая вакцина обеспечивает иммунитет к уничтожению раковых клеток, экспрессирующих гликопротеиновый антиген Муцин 1 (MUC-1). Испытание для пациентов с распространенным немелкоклеточным раком легкого (НМРЛ), но результаты были неутешительными и не соответствовали первичной конечной точке [135] . В результате L-BLP-25 был прекращен.
5.2. Липидные наночастицы для профилактических вакцин – быстрый ответ на COVID19:
В марте 2020 года Всемирная организация здравоохранения (ВОЗ) объявила коронавирусное инфекционное заболевание (COVID-19) глобальной пандемией.В марте 2021 года во всем мире было зарегистрировано более 129,4 миллиона случаев заболевания и 2,8 миллиона случаев смерти [123] . В то же время COVID-19 имеет высокую вероятность стать сезонным заболеванием с высокими показателями инфицирования и длительным инкубационным периодом [123] . Следовательно, разработка вакцин против COVID-19 была необходимостью для населения [136] мира, для которого были исследованы многочисленные платформы. Есть 12 вакцин, одобренных FDA. Другие находятся в клинических испытаниях, 93 вакцины перечислены с 257 испытаниями [127] [137] , из которых 29 вакцин находятся в фазе 1, 39 вакцин в фазе 2 и 25 вакцин в фазе 3 [137] .Активирующие механизмы в большинстве этих вакцин-кандидатов основаны на индукции нейтрализующих антител против белка spike (S) для предотвращения поглощения человеческими клетками через человеческий рецептор ангиотензинпревращающего фермента-2 (ACE2) [127] . К настоящему времени для мРНК-LNP были успешно разработаны только мРНК-1273 и BNT162, а другие находятся в стадии клинических испытаний (Таблица 6) [12] [128] [138] [139] [ 140] .
Таблица 6. Список вакцин против COVID-19 с использованием LNP.
| Вакцина | Разработчик | Список литературы |
|---|---|---|
| Утверждено FDA | ||
| мРНК-1273 | ModernaTX, Inc. Этап 1: NCT04283461 (*) Этап 2: NCT04405076 (*) Этап 3: NCT04470427 (*) | [127] [128] [141] [142] |
| BNT162b2 | BioNTech SE и Pfizer Фаза 1/2: NCT04380701 (*) Фаза 2/3: NCT04368728 (*) | [143] |
| На стадии клинической оценки | ||
| BNT162a1 | BioNTech SE и Pfizer Фаза 1/2: NCT04380701 (*) Фаза 2/3: NCT04368728 (*) | [138] [144] |
| BNT162b1 | ||
| BNT162c2 | ||
| ARCT-021 (мРНК Lunar-Cov19) | Arcturus Therapeutics and Duke-NUS Фаза 1/2: NCT04480957 | [145] |
| COVAC1 (LNP-nCoVsaRNA) | Имперский колледж Лондона Фаза 1: ISRCTN17072692 (*) | [140] [146] [147] |
| Вакцина мРНК ChulaCov19 | Центр исследований вакцин в Чуле / Пенсильванский университет Фаза 1: NCT04566276 (*) | [140] |
| Вакцина мРНК SARS-VoV-2 | Госпиталь Шулан (Ханчжоу); Центр по контролю и профилактике заболеваний Гуанси-Чжуанского автономного района Фаза 1: ChiCTR2000034112 (*) | [148] |
| D614G вариант LNP-инкапсулированная мРНК | Globe Biotech Ltd. | [140] |
| В доклинической стадии | ||
| мРНК, инкапсулированная в LNP, кодирующая S | Институт коллоидов и интерфейсов Макса Планка | [140] |
| LNP-мРНК | Перевести Био / Санофи Пастер | [140] |
| LNP-мРНК | CanSino Biologics / Precision NanoSystems | [140] |
| мРНК, инкапсулированная в LNP | Токийский университет / Дайити-Санкё | [140] |
| Пептидные антигены, содержащиеся в LNP | IMV Inc | [140] |
| инкапсулированная в LNP мРНК, кодирующая RBD | Университет Фудань / Шанхайский университет Цзяотун / RNACure Biopharma | [140] [149] |
| инкапсулированная в LNP мРНК, кодирующая полноразмерную S | дикого типа (WT)[150] | |
| LNP-инкапсулированный коктейль мРНК, кодирующий VLP | [140] [150] | |
LNP, инкапсулирующих мРНК, разработанных BioNTech SE и Pfizer для вакцины против SARS-CoV-2, было четыре кандидата (BNT162a1, BNT162b1, BNT162b2 и BNT162c2).Они были сконструированы из двух типов мРНК, модифицированной нуклеозидами, мРНК, содержащей уридин, и самоамплифицирующейся РНК [138] [144] . Они были протестированы в фазе 2 клинических испытаний (NCT04380701) на здоровых добровольцах в возрасте от 18 до 85 лет [151] и в фазе 3 (NCT04368728) [152] . Кандидат BNT162b2 завершил 3-ю фазу клинических испытаний с многообещающими результатами безопасной и эффективной вакцины. В связи с острой потребностью в вакцине Covid-19 компании Pfizer и BioNTech направили свой BNT162b2 в FDA для запроса разрешения на использование в экстренных случаях.11 декабря 2020 года FDA одобрило вакцину Pfizer-BioNTech COVID-19, распространяемую в США, [143] .
Используя аналогичную стратегию, мРНК-1273 COVID-19 производится из синтетической мРНК внутри LNPs [128] [153] . Эта синтетическая мРНК кодирует спайковый белок S вирусов SARS-CoV-2 [12] [138] [139] , который является ключевым фактором связывания вирусных поверхностей с клеткой-хозяином через рецептор ACE2. Белок S вирусов SARS-CoV-2 опосредует прикрепление клеток, распознавание рецепторов и слияние для проникновения вируса и инфицирования [154] .Эта формула была разработана Moderna TX, Inc и находится в процессе утверждения FDA (фаза 1) под номером NCT04283461 [127] [128] [141] . Он также перешел в фазу 2 (NCT04405076) для оценки реактогенности, иммуногенности и безопасности у здоровых мужчин и небеременных женщин в возрасте от 18 лет [140] [155] . Этот кандидат вступил в фазу 3 (NCT04470427) для оценки безопасности, эффективности и иммуногенности для предотвращения COVID-19 на срок до двух лет [140] [156] .17 декабря 2020 года Moderna TX, Inc получила разрешение FDA на экстренное использование мРНК-1273 [142] .
McKay et al. изучили LNP, инкапсулированные с самоусиливающейся РНК (saRNA), в качестве новой вакцины против SARS-CoV-2, названной LNP-nCoVsaRNA или COVAC1 [136] [146] . Эти самоамплифицирующиеся конструкции РНК были предложены, потому что любой интересующий антиген может быть закодирован и сформулирован в более низкой дозе, чем обычная мРНК. Для экспериментов in vitro и in vivo вакцина LNP-nCoVsaRNA против SARS-CoV2 показывала устойчивые антитела и клеточные ответы.Эти выдающиеся результаты породили твердую уверенность в том, что вакцина LNP-nCoVsaRNA будет способствовать иммуногенности у людей. В настоящее время Имперский колледж Лондона применил вакцину LNP-nCoVsaRNA для клинического испытания, которое в настоящее время находится в фазе 1 (ISRCTN17072692) [140] [147] .
Duke-NUS Medical School и Arcturus Therapeutics Inc. сотрудничали в разработке вакцины против COVID-19 под названием ARCT-021. Они использовали липид-опосредованную систему доставки LUNAR для инкапсуляции РНК (STARR TM ).На доклинической стадии ARCT-021 продемонстрировал, что является безопасной и эффективной вакциной против COVID-19 в низких дозах. Он был способен индуцировать CD8 + Т-клеточные и Т-хелперные клеточные иммунные ответы без адъювантов и вирусного вектора. Переходя к фазе 1/2 клинических исследований (NCT4480957), ARCT-021 был оценен с точки зрения безопасности, переносимости и иммуногенности при нескольких уровнях доз от 1 до 10 мкг. Возрастные группы для этого исследования – здоровые люди от 18 до 80 лет, за исключением беременных и кормящих женщин.Предварительные данные для ARCT-021 показали благоприятный профиль безопасности при относительно низкой дозе [145] . Кроме того, другие аналогичные платформы вакцин, включая вакцину мРНК ChulaCov19 (Университет Чулалонгкорна) и вакцину мРНК SARS-CoV-2 (Шулан, Госпиталь Ханчжоу), подали заявки на клинические испытания. Вакцина на основе мРНК ChulaCov19 была зарегистрирована для клинических испытаний фазы 1 (NCT04566276), в исследование пока не набирали [146] . Вакцина с мРНК SARS-CoV-2 была внесена в регистр клинических испытаний Китая для фазы 1 клинических испытаний (ChiCTR2000034112).Это испытание будет оценивать безопасность, переносимость и иммуногенность многократных доз у лиц старше 18 лет [146] .
LNP, разрабатываемые для вакцин COVID-19, не только включают вышеупомянутые одобренные продукты или продукты, которые все еще проходят клинические испытания, но также включают множество других, которые постоянно разрабатываются на доклинической стадии (Таблица 6) [157] . Многие компании, научно-исследовательские институты и университеты по всему миру были внесены в список ВОЗ с РНК-инкапсулированными вакцинами LNP.Globe Biotech Ltd. имела мРНК, инкапсулированную LNP в варианте SARS-CoV-2 D614G. В Институте коллоидов и интерфейсов Макса Планка были LNP, инкапсулирующие мРНК, нацеленную на клетку Лангерганса. Санофи Пастер и Translate Bio изучали вакцину MRT5500 на основе мРНК и собираются подать заявку на клинические испытания в конце 2020 г. [158] . Теперь MRT5500 начал клинические испытания фазы 1/2. Ожидается, что промежуточные результаты будут получены в третьем квартале 2021 года [159] . CanSino Biologics и Precision NanoSystems совместно разработали РНК-вакцину против COVID-19, состоящую из мРНК и липидного носителя наночастиц [160] .Компания Daiichi-Sankyo Co. разработала вакцину против COVID-19 на основе мРНК, названную DS-5670. Для следующих клинических исследований Daiichi-Sankyo Co. собирается сотрудничать с Токийским университетом [140] . Компания IMV Inc (Дартмут, Канада) разработала кандидатную вакцину против DPX-COVID-19. DPX представляет собой систему доставки на основе липидов, в которой пептидные антигены растворены в липидах, а конечный состав хранится в сухой форме [161] . После растворения вакцина вводится внутримышечно. В месте инъекции отсутствует механизм высвобождения, но пептидные антигены действуют как адъювант, и сформулированный DPX может затем рекрутировать антигенпрезентирующие клетки, которые вызывают иммунный ответ из лимфатических узлов [161] .Na-Na Zhang et al. изучили термостабильную мРНК-вакцину-кандидат для предотвращения инфекции COVID-19 [149] . Они использовали LNP для инкапсуляции мРНК, нацеленной на рецептор-связывающий домен (RBD) тяжелого острого респираторного синдрома коронавируса 2 (SARS-CoV-2). В модели мышей, которую они использовали, этот LNP индуцировал нейтрализующие антитела и ответы Т-клеток с высоким защитным иммунитетом против SARS-CoV-2. Кроме того, эту вакцину-кандидат можно хранить при комнатной температуре не менее одной недели.Обладая этими преимуществами, этот кандидат на LNP-мРНК (RQ3011-RBD) переходит в фазу 1 оценки клинических испытаний, проводимых Университетом Фудань, Шанхайским университетом ЦзяоТун и RNACure Biopharma [140] [149] . Более того, они разработали две другие вакцины-кандидаты, RQ3013-VLP и RQ3012-Spike, которые включают смесь конструкций мРНК. Кандидат RQ3013-VLP содержит коктейль мРНК, кодирующих 3 вирусных структурных белка: S (шип), M (мембрана) и E (оболочка). Вакцина RQ3012-Spike несет мРНК, кодирующую полноразмерный S.В модели на мышах RQ3013-VLP продемонстрировал лучший иммунный ответ для трех этих кандидатов, в то время как RQ3011-RBD вызывал недостаточный иммунитет при низкой концентрации 2 мкг РНК на дозу. В зависимости от этих предварительных тестов можно сделать вывод, что мРНК-вакцины могут действовать как гибкая платформа для разработки эффективных кандидатов [149] .
Кроме того, стратегия разработки вакцин все еще изучается для других болезней. Shirai et al. продемонстрировали, что LNP могут действовать как адъювант для вакцин против гриппа [162] .Это было подтверждено результатами об иммуностимулирующем действии на дендритные клетки у мышей и защитной способности LNP, инкапсулирующих обычную сезонную сплит-вакцину (SV), по сравнению с чистыми SV и SV, объединенными квасцами. LNP был изготовлен из 1,2-диолеоил-3-триметиламмоний-пропана, 1,2-дипальмитоил-sn-глицеро-3-фосфохолина, N- (карбонил-метоксиполиэтиленгликоль 2000) -1,2-дистеароил-sn-глицеро- 3-фосфоэтаноламин и холестерин. Было обнаружено, что LNP с SV достигают той же эффективности, что и SV с квасцами.Квасцы вызывали сильный воспалительный ответ, что считается ограничением традиционных адъювантов. Напротив, LNP были способны индуцировать SV-специфические иммунные ответы без воспаления [162] . Swaminathan et al. также оценивали адъювантную активность одних LNP и LNP, включающих синтетический агонист TLR9, адъювант IMO-2125, на мышиной модели [163] . Этот состав LNP состоял из DSPC, холестерина, DMG-PEG2000 и асимметричного ионизируемого аминокислотного липида. Удивительно, но LNP без адъюванта был способен индуцировать B-клеточные ответы против HbsAg (поверхностный антиген вируса гепатита B) и субъединичных антигенов овальбумина на сравнимом уровне, чем в присутствии других адъювантов, включая IMO-2125, 3-O-деактилированный. монофосфориллипид и адъюванты на основе алюминия.LNP не только вызывал значительное усиление иммунных ответов, но также вызывал более высокий ответ типа Th2 по сравнению с одним IMO-2125. Таким образом, комбинация LNP и иммуномодулирующих олигонуклеотидных адъювантов привела к синергетическому эффекту для иммунных ответов и к манипулированию теми иммунными качествами, которые сильно отличаются от неорганических адъювантов.
6. Выводы и дальнейшие направления
Клиническая разработка липидных технологий наночастиц с химиотерапией и терапией нуклеиновыми кислотами продемонстрировала потенциал липидных носителей в лечении ряда заболеваний.Однако количество успешных продуктов, появившихся на рынке, не точно отражает количество составов в (доклинических испытаниях), что указывает на то, что разработка этих наночастиц по-прежнему сопряжена с трудностями и проблемами при переходе от животных к человеку. Недавно было разработано несколько стратегий для преодоления этих ограничений. Чтобы улучшить стабильность наночастиц и предотвратить утечку лекарств, были разработаны липидные структуры, которые эффективно образуют комплекс за счет ионного притяжения с инкапсулированным терапевтическим средством.Было показано, что ионизируемые липиды, такие как DOP-DEDA, подходят для инкапсуляции генов. С другой стороны, холестерин необходим для обеспечения стабильности липосомных структур, что приводит к плотной упаковке лекарств. Стабильность LNP в физиологической среде и системном кровотоке достигается путем модификации поверхности частицы с помощью PEG-липида, тем самым снижая распознавание ретикулоэндотелиальной системой. Однако сообщалось, что продукция анти-ПЭГ-антител после введения первой дозы снижает терапевтическую эффективность и / или вызывает побочные реакции при применении следующих доз.Поэтому поиск альтернатив ПЭГ стал необходим, чтобы сделать возможными повторные инъекции. Помимо длительного кровообращения, LNP должны нацеливаться на определенные ткани / клетки / органы, а затем интернализироваться через клеточные мембраны для высвобождения лекарств в месте действия. Чтобы выполнить это требование, LNP были разработаны как интеллектуальные материалы с селективными лигандами, разложение которых запускается изменениями pH, температуры или окислением / восстановлением.
Селективная ассоциация LNP с клетками-мишенями остается проблемой.Например, вакцины на основе нуклеиновых кислот нельзя вводить непосредственно в наши лимфатические узлы или селезенку, которые представляют собой ткани, в которых находятся иммунные клетки, ответственные за выработку антител и уничтожение раковых клеток. Таким образом, нацеленная доставка нуклеиновых кислот из мест инъекции к иммунным клеткам в лимфатических узлах или селезенке имеет решающее значение для максимизации продукции антител или долгоживущих антиген-специфичных цитотоксических Т-клеток. Такие системы доставки нуждаются в способности нацеливаться на лимфатические узлы, а также преодолевать барьерные клетки в лимфатических узлах для взаимодействия с иммунными клетками.Кроме того, после интернализации необходимо эффективно инициировать контролируемое высвобождение терапевтических средств в аберрантные клетки. Эти механизмы, которые способствуют захвату клеток, интернализации и высвобождению полезной нагрузки, еще не достигли ожидаемых результатов. Успех LNP с селективными лигандами на рынке еще не завершен. Таким образом, ожидается, что исследования, связанные с эффективностью модифицированных LNP при различных заболеваниях, с различными лигандами и стимулирующими агентами, специфичными для различных типов клеток, вскоре войдут в клинические испытания.Совместная доставка или совместное инкапсулирование лекарственного средства с адъювантами представляет интерес в этой области для повышения эффективности и иммунной модуляции. Кроме того, процесс производства и увеличения масштабов LNP был непростым. Новые методики приготовления LNP, основанные на микрофлюидике, на сегодняшний день считаются наиболее надежными, но они демонстрируют ограничения при разработке многофункциональных LNP.
Одновременно с этим для борьбы с пандемией COVID-19 быстрое развитие вакцин на основе РНК и LNP получило экстренное одобрение FDA, что демонстрирует быстрый и эффективный ответ этого подхода против сложных заболеваний.Эти вакцины не ограничиваются инфекционными заболеваниями, но также были разработаны для других типов заболеваний, таких как рак и гиперлипидемия. Некоторые клинические испытания почти на завершающей стадии. Многочисленные исследования находятся на ранней стадии и будут увеличиваться в будущем, что позволяет прогнозировать появление на рынке ряда продуктов.
В заключение, мы считаем, что успех вакцин мРНК-LNP открывает захватывающую главу для технологии LNP. Долгий путь к оптимизации составов LNP для низкомолекулярных лекарств и доставки нуклеиновых кислот окупился, и LNP снова стали лидером в системе доставки наночастиц.В этом обзоре выделены ключевые уроки, извлеченные из этого долгого пути, и он служит справочным материалом при проектировании LNP. Дальнейшая разработка LNP по-прежнему остро необходима для решения текущих проблем глобального здравоохранения, что требует совместных усилий ученых в различных областях.
мРНК-липидных наночастиц вакцины COVID-19: структура и стабильность
Основные моменты
- •
Текущие вакцины против COVID-19 с мРНК-LNP должны храниться при (сверх) низких температурах.
- •
Ядро LNPs содержит мРНК, ионизируемый катионный липид, нейтральный липид и воду.
- •
гидролиз мРНК является определяющим фактором нестабильности мРНК-LNP.
- •
Повышение стабильности за счет оптимизации молекул мРНК должно стать приоритетом.
- •
Другие варианты стабилизации: оптимизация LNP и разработка сухой рецептуры.
Реферат
Недостатком современных вакцин против COVID-19 с мРНК-липидными наночастицами (LNP) является то, что они должны храниться при (сверх) низких температурах.Понимание первопричины нестабильности этих вакцин может помочь рационально улучшить стабильность продукта мРНК-LNP и тем самым облегчить температурные условия для хранения. В этом обзоре мы обсуждаем предлагаемые структуры мРНК-LNP, факторы, влияющие на стабильность мРНК-LNP, и стратегии оптимизации стабильности продукта мРНК-LNP. Анализ структур мРНК-LNP показывает, что мРНК, ионизируемый катионный липид и вода присутствуют в ядре LNP. Нейтральные вспомогательные липиды в основном расположены на внешней, инкапсулирующей стенке.Гидролиз мРНК является определяющим фактором нестабильности мРНК-LNP. В настоящее время неясно, как вода в ядре LNP взаимодействует с мРНК и в какой степени подверженные деградации участки мРНК защищены слоем ионизируемых катионных липидов. Для повышения стабильности вакцин мРНК-LNP приоритетом должна быть оптимизация нуклеотидного состава мРНК. Во-вторых, лучшее понимание среды, в которой находится мРНК в ядре LNP, может помочь рационализировать корректировки структуры LNP для сохранения целостности мРНК.Более того, методы сушки, такие как лиофилизация, являются многообещающими вариантами, которые еще предстоит изучить.
Ключевые слова
COVID-19
Липидные наночастицы (LNP)
Лиофилизация
мРНК
Срок годности
Стабильность при хранении
Структура
Вакцина
Рекомендуемые статьи Цитирующие статьи (0) 20 9000 Автор с). Опубликовано Elsevier B.V.
Рекомендуемые статьи
Цитирующие статьи
Сигналы витамина А, присущие эпителию, координируют клиренс патогенов в кишечнике через IL-18
Abstract
Эпителиальные клетки кишечника (IEC) находятся в авангарде взаимодействий “хозяин-патоген”, координируя каскад иммунных ответов для защиты от патогенов.Здесь мы показываем, что внутренняя передача сигналов витамина A IEC ограничивает инвазию патогенов на ранних стадиях инфекции и впоследствии активирует иммунные клетки, способствуя очищению от патогенов. Мыши, избирательно заблокированные для передачи сигналов рецептора ретиноевой кислоты (RAR) в IEC (остановка ΔIEC ), показали более высокую нагрузку Salmonella в тканях толстой кишки на ранней стадии инфекции, что связано с более высокой просветной и системной нагрузкой патогена на более поздних стадиях. Более высокая нагрузка патогенов у мышей Stop ΔIEC коррелировала с ослабленным продуцированием интерферона гамма (IFNγ) слизистой оболочкой нижележащими иммунными клетками.Мы обнаружили, что при гомеостазе кишечный эпителий мышей stop ΔIEC продуцировал значительно меньшие количества интерлейкина 18 (IL-18), мощного индуктора IFNγ. Регулирование IL-18 витамином A также наблюдалось в модели питания с добавлением витамина A. Восстановление IL-18 у мышей stop ΔIEC восстановило устойчивость к Salmonella , способствуя отщеплению эпителиальных клеток для устранения инфицированных клеток и ограничения инвазии патогенов на ранних стадиях инфекции. Кроме того, IL-18 увеличивал продукцию IFNγ нижележащими иммунными клетками, чтобы ограничить бремя патогенов и системное распространение.Наша работа раскрывает критическую роль витамина А в координации двухфазного иммунного ответа на инфекцию Salmonella путем регулирования выработки IL-18 с помощью IEC.
Информация об авторе
Эпителиальные клетки выстилают просвет кишечника, образуя барьер между телом и пищевым и микробным содержимым в просвете. Помимо поглощения питательных веществ из рациона, эти эпителиальные клетки помогают поддерживать стабильные симбиотические отношения между комменсальными бактериями и иммунными клетками.Во время инфекции они помогают координировать иммунный ответ, чтобы противостоять инфекции. Как диетические микронутриенты, такие как витамин А, влияют на функцию эпителиальных клеток во время инфекции, плохо изучено. Используя модель, в которой эпителиальные клетки кишечника не могут реагировать на сигналы витамина А, мы обнаружили, что передача сигналов витамина А в эпителии способствует устойчивости к инфекции Salmonella . Мы показываем, что витамин А увеличивает выработку ключевого цитокина, интерлейкина 18, эпителиальными клетками. IL-18 способствует выделению инфицированных эпителиальных клеток, чтобы уменьшить инвазию патогенов, а также индуцировать продукцию гамма-интерферона иммунными клетками, чтобы опосредовать клиренс патогенов.Таким образом, эпителиальные клетки динамически реагируют на диетический витамин А, регулируя выработку интерлейкина 18 и усиливая устойчивость к инфекции.
Образец цитирования: Iyer N, Grizotte-Lake M, Duncan K, Gordon SR, Palmer ACS, Calvin C, et al. (2020) Внутренняя передача сигналов витамина А в эпителии координирует клиренс патогенов в кишечнике через IL-18. PLoS Pathog 16 (4): e1008360. https://doi.org/10.1371/journal.ppat.1008360
Редактор: Игорь Эрик Бродский, Пенсильванский университет, США
Поступила: 4 июня 2019 г .; Принята к печати: 27 января 2020 г .; Опубликовано: 24 апреля 2020 г.
Авторские права: © 2020 Iyer et al.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все соответствующие данные находятся в рукописи и ее файлах с вспомогательной информацией.
Финансирование: Эта работа была поддержана премией исследовательского фонда OVPR Университета Брауна (GR300113) для N.I., награда NIH (P20GM10903 и 1R01DK113265) для S.V. и награда CCFA за развитие карьеры С.В. Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Введение
Устойчивость к инвазивному патогену включает координацию между ранней и поздней фазами иммунного ответа для достижения клиренса патогена без чрезмерного побочного повреждения хозяина.Кишечный эпителий находится в авангарде взаимодействий между хозяином и микробом и имеет решающее значение для организации этих иммунных ответов во время инфекции. Хемокины, секретируемые эпителием, ответственны за рекрутирование и активацию иммунных клеток [1]. Т-клетки, NK-клетки, а также нейтрофилы попадают в толстую кишку во время инфекции. Они секретируют провоспалительные цитокины, такие как интерферон гамма (IFNγ), чтобы способствовать бактериальному клиренсу и остановить системное распространение инфекции [2, 3]. Более того, сам эпителий подвергается отслаиванию клеток на ранних стадиях инфекции как врожденный защитный механизм для устранения внутриклеточных патогенов [4, 5].Механизмы, которые управляют такими разнообразными функциями эпителиальных клеток кишечника (IEC) во время инфекции, остаются малоизученными.
Витамин А – важное диетическое питательное вещество. Он абсорбируется в форме каротиноидов и эфиров ретинила эпителиальными клетками кишечника и метаболизируется в активную форму ретиноевой кислоты (RA). Рецептор ретиноевой кислоты (RAR) и рецептор ретиноида X (RXR) образуют ядерный комплекс, который активируется связыванием RA для индукции экспрессии целевого гена [6]. Передача сигналов ретиноевой кислоты влияет как на набор, так и на активность дендритных клеток [7], Т-клеток [8], В-клеток [9] и врожденных лимфоидных клеток (ВЛК) [10] в кишечнике.Ретиноевая кислота, синтезируемая эпителиальными клетками, хотя и доступна для основных иммунных клеток, также способна инициировать сигнальный ответ внутри самих IEC. Передача сигналов ретиноевой кислоты в эпителиальных клетках кишечника регулирует спецификацию эпителиальных клонов и способствует ответам Т-хелперов 17 (Th27) тонкого кишечника [11, 12]. Дефицит витамина А в пище заметно увеличивает восприимчивость к кишечным патогенам [13], однако относительно мало известно о вкладе IEC-внутренней передачи сигналов ретиноевой кислоты в контекст инфекции.
В этом исследовании мы используем модель мышей, экспрессирующих доминантно-отрицательный рецептор ретиноевой кислоты (стоп ΔIEC ) в IEC, чтобы исследовать роль передачи сигналов ретиноевой кислоты во время инфекции. stop Мыши ΔIEC более восприимчивы к просветной и системной колонизации Salmonella . Это связано с прекращением выделения инфицированных эпителиальных клеток, а также с ослабленным ответом на гамма-интерферон (IFNγ). Мы обнаружили, что экспрессия интерлейкина-18, известного индуктора IFNγ, зависит от передачи сигналов ретиноевой кислоты в эпителиальных клетках кишечника.IL-18, зависимый от передачи сигналов RAR, способствует отщеплению эпителиальных клеток, а также продукции IFNγ слизистой оболочки, что обеспечивает устойчивость к инфекции. Таким образом, наши результаты выявляют новую регуляторную ось в кишечнике, где внутренняя эпителиальная передача сигналов в ответ на витамин А последовательно запускает зависимые от IL-18 механизмы, чтобы сначала ограничить тканевую инвазию, а затем запустить ответ IFNγ, способствуя очищению от патогенов.
Результаты
Внутренняя эпителиально-внутренняя передача сигналов RAR защищает от
Salmonella колонизации Дефицитвитамина А приводит к повышенной восприимчивости к инфекции, вызываемой Salmonella и другими кишечными патогенами [13, 14].Дефицит витамина А вызывает нарушение иммунной регуляции в кишечнике, включая неправильное рекрутирование лимфоидов, созревание и функциональный потенциал [15, 16]. Эти радикальные изменения скрывают мельчайшие детали того, как витамин А регулирует исход инфекции. Пищевой витамин А последовательно всасывается, метаболизируется и распределяется эпителиальными клетками кишечника [17]. Ретиноевая кислота, синтезируемая эпителиальными клетками кишечника, регулирует рекрутирование иммунных клеток и продукцию цитокинов [18, 19]. Мы предположили, что передача сигналов витамина А в IEC регулирует иммунный ответ слизистых оболочек, опосредуя восприимчивость к инфекции.Чтобы ответить на этот вопрос, мы выбрали модель на мышах, в которой передача сигналов витамина A была специфически отменена в эпителиальных клетках кишечника после метаболизма витамина A. Было обнаружено, что альфа-рецептор ретиноевой кислоты является наиболее доминирующей изоформой RAR, экспрессируемой в эпителиальных клетках кишечника (рис. 1A). . В нашей мышиной модели использовалась виллин-Cre-зависимая сверхэкспрессия доминантно-негативной формы рецептора ретиноевой кислоты альфа (рис. 1B) [20, 21]. Кишечные эпителиальные клетки у этих мышей (стоп ΔIEC ) были дефектными по экспрессии RA-чувствительного гена isx по сравнению с их однопометниками дикого типа (стоп flox ) (рис. 1С) [22].Чтобы оценить, влияет ли нарушение передачи сигналов RA в IEC на метаболизм ретиноидов, мы провели количественную оценку общего количества ретиноидов в тканях толстой кишки мышей stop flox и stop ΔIEC . Прекращение передачи сигналов RAR в эпителии не влияло на достаточность витамина А в кишечнике. stop Мыши ΔIEC демонстрировали повышенные уровни ретиноевой кислоты и ретиниловых эфиров в тканях, что указывает на компенсаторные механизмы для поддержания достаточности витамина A в тканях (S1A фиг.).Передача сигналов RA, как известно, участвует в пролиферации и дифференцировке IEC. Мы видели, что при гомеостазе мышей stop ΔIEC демонстрировали увеличение дифференцировки бокаловидных клеток, а также общую толщину слизистого барьера (S1B и S1C, рис.), Подтверждая результаты предыдущего исследования с использованием мышей RARα ΔIEC [11] . Однако стоп- ΔIEC мышей не показали значимых различий в эпителиальном обновлении (S1D и S1E фиг.).
Рис. 1. Внутренняя эпителиальная передача сигналов RAR защищает от колонизации Salmonella .
(A) Абсолютное количество изоформ RAR и RXR (α, β и γ) в микродиссектированных с помощью лазерного излучения эпителиальных клетках из гомеостатической остановки flox мышей подвздошной ткани (B) Схематическое изображение создания остановки flox (дикий тип) и остановили ΔIEC (нокдаун передачи сигнала RAR), используя Villin-Cre зависимую экспрессию кассеты dnRAR. (C) Относительная экспрессия гена, отвечающего за витамин A, isx , в стоп flox и стоп ΔIEC в тканях подвздошной кишки. (D) Схематическое изображение временной шкалы заражения Salmonella с оценкой патогенной нагрузки через 18 и 72 часа после заражения (hpi). (E) Бактериальная нагрузка в фекальных тканях и проксимальных отделах толстой кишки на 18 hpi при остановке flox и остановке ΔIEC мышей. (F) Бактериальная нагрузка в образцах фекалий, дистальных отделов ободочной кишки и брыжеечных лимфатических узлов при 72 hpi при остановке flox и остановке ΔIEC мышей. Репрезентативные данные из 3 независимых экспериментов.n = 3–4 мыши на группу. Для статистического анализа использовался критерий Стьюдента. * P <0,05; ** P <0,01.
https://doi.org/10.1371/journal.ppat.1008360.g001
Роль внутренней эпителиальной передачи сигналов витамина А во время инфекции оценивалась с использованием модели гастроэнтерита нетифоидной Salmonella Typhimurium (рис. 1D) [ 23]. Бактериальную нагрузку определяли в ранние (18 часов после инфицирования; hpi) и поздние (72 hpi) моменты времени, чтобы оценить, модулирует ли передача сигналов витамина A кинетику колонизации патогенов.В ранние моменты времени остановите мышей ΔIEC и остановите flox. Контрольные группы из однопометников имели аналогичную люминальную нагрузку патогена. Однако мыши stop ΔIEC показали значительно более высокие нагрузки бактерий в тканях толстой кишки (рис. 1E). Это преимущество в начальной инвазии тканей увеличивало бремя патогенов в более поздние моменты времени, с более высокими нагрузками, обнаруженными в кале, толстой кишке, а также в мезентериальных лимфатических узлах мышей stop ΔIEC (рис. 1F). Сама экспрессия рецептора ретиноевой кислоты оставалась неизменной во время инфекции (S1F фиг.).Кроме того, исход инфекции не зависел от микробиома, поскольку состав гомеостатического фекального микробиома мышей stop ΔIEC был аналогичен таковому у мышей stop flox (S2A – S2C фиг.). Эти результаты показывают, что потеря передачи сигналов RAR в кишечном эпителии фенокопирует диетический дефицит витамина А в контексте кишечной инфекции. Кроме того, изменения кинетики инфекции позволяют предположить, что внутренняя эпителиальная передача сигналов витамина А координирует ранние и поздние иммунные механизмы, способствуя устойчивости к инфекции.
Внутренняя эпителиально-внутренняя передача сигналов RAR способствует ответу IFNγ слизистой оболочки во время инфекции
Метаболизм витамина А и передача сигналов в эпителии являются ключевыми детерминантами иммунной системы кишечника. В кишечнике ретиноевая кислота влияет на баланс между клетками Th2 и Th27, которые важны для борьбы с инфекцией [8, 24, 25]. Собственный IEC метаболизм витамина А способствует выработке слизистыми оболочками IL-22, что, в свою очередь, вызывает дисбактериоз и способствует колонизации патогенов [18].Поэтому мы проанализировали популяции собственной пластинки толстой кишки на нашей модели мышей, чтобы проверить, является ли повышенная чувствительность мышей stop ΔIEC следствием нарушения регуляции иммунного ответа. Мыши stop ΔIEC и stop flox показали сходный иммунный состав толстой кишки при гомеостазе (S3A – S3D, фиг.). Однако на 3-й день заражения Salmonella , стоп-мышей ΔIEC обнаружил дефект в продукции интерферона гамма (рис. 2А). CD4 и CD8 Т-клетки, а также нейтрофилы были рекрутированы в толстую кишку в одинаковой степени у мышей stop ΔIEC и stop flox (S4A и S4B фиг.), Но активация этих клеток для продуцирования IFNγ была дефектной при остановке ΔIEC . мышей (рис. 2B – 2D).Никаких значительных различий в продукции IL-17 и IL-22 слизистой не наблюдалось у мышей stop ΔIEC и stop flox во время инфекции (S4C и S4D фиг.).
Рис. 2. Внутренняя эпителиальная передача сигналов RAR способствует ответу IFNγ слизистой оболочки во время инфекции.
(A-D) Анализ проточной цитометрии лимфоцитов собственной пластинки толстой кишки от стоп flox и стоп ΔIEC мышей 72 hpi с Salmonella . Графики типичной плотности и количественный анализ относительных частот (A) общих живых CD45 + IFNγ + клеток (B) CD4 + IFNγ + клеток (C) CD8 + IFNγ + клеток и (D) Gr-1 + IFNγ + клетки в остановке flox и остановке ΔIEC мышей.Репрезентативные данные из 2 независимых экспериментов. n = 3–4 мыши на группу. Для статистического анализа использовался критерий Стьюдента. * P <0,05; ** P <0,01.
https://doi.org/10.1371/journal.ppat.1008360.g002
Чтобы оценить, был ли дефект продукции IFNγ ответственным за повышенную чувствительность мышей stop ΔIEC , мы провели эксперименты с обратной связью IFNγ (рис. 3A). Восстановление IFNγ у мышей stop ΔIEC привело к снижению восприимчивости, при этом бактериальная нагрузка вернулась к уровням дикого типа (рис. 3B и 3C).Предыдущие исследования, in vitro и in vivo , показали, что гамма-интерферон может регулироваться витамином А, а ретиноевая кислота способствует выработке IFNγ в кишечных Т-клетках [26, 27]. Гамма-интерферон стимулирует механизмы устойчивости, такие как фагоцитоз, чтобы помочь ограничить кишечную и системную инфекцию Salmonella [28, 29]. Наши результаты показывают, что внутренняя эпителиальная передача сигналов RAR запускает выработку IFNγ слизистой оболочки, чтобы ограничить инфекцию Salmonella .
Рис. 3. Эпителиальная передача сигналов RAR способствует ответу IFNγ, опосредуя клиренс патогена.
(A) Схематическое изображение обратной связи IFNγ у мышей ΔIEC во время инфицирования Salmonella . Мышам внутрибрюшинно вводили 10 мкг IFNγ при 0 hpi и 48 hpi. Бактериальная нагрузка в (B) фекальных и (C) мезентериальных лимфатических узлах через 72 часа после заражения Salmonella при остановке flox , остановке ΔIEC и остановке ΔIEC + IFNγ мышей.Для статистического анализа использовали односторонний дисперсионный анализ. ** P <0,01, *** P <0,005.
https://doi.org/10.1371/journal.ppat.1008360.g003
Внутренний эпителий кишечника – внутренняя передача сигналов RAR регулирует интерлейкин-18
Интерлейкин-18 был впервые обнаружен как молекула, индуцирующая гамма-интерферон [30, 31]. Этот цитокин семейства IL-1 конститутивно экспрессируется широким спектром типов клеток в организме. В кишечнике эпителиальные клетки кишечника являются основным источником IL-18 [32, 33].Мы предположили, что интерлейкин-18 может быть механистической связью между внутренней передачей сигналов IEC RAR и ответом IFNγ слизистой оболочки. Предыдущее исследование клеток нейробластомы человека выявило индукцию IL-18 всей транс-ретиноевой кислотой in vitro [34]. Кроме того, было показано, что уровни сывороточного IL-18 повышаются во время приема витамина А у мышей с ожирением [35]. Однако о регуляции гомеостатических уровней IL-18 в кишечнике витамином А ранее не сообщалось.
Мы оценивали уровни IL-18 при гомеостазе между остановкой ΔIEC и остановкой flox мышей.Цельная ткань толстой кишки (фиг. 4A), а также колоноциты (фиг. 4B) мышей stop ΔIEC показали пониженные уровни белка формы-предшественника IL-18. Чтобы подтвердить, что это явление не ограничивается нашей моделью мыши stop ΔIEC , мы использовали модель питания, в которой мышей дикого типа кормили диетой с добавлением ретинилацетата в течение 2 недель. По сравнению с мышами, получавшими контрольный носитель, мыши, получавшие избыток ретинилацетата, имели повышенные уровни IL-18 в колоноцитах (фиг. 4C). Эти результаты предполагают, что диетический витамин А может динамически модулировать уровни IL-18 в толстой кишке.
Рис. 4. Внутренняя передача сигналов RAR кишечному эпителию регулирует интерлейкин-18.
Репрезентативные вестерн-блоты и результаты количественного анализа изображений, сравнивающие гомеостатические уровни IL-18 в цельной ткани толстой кишки (A) и лизатах колоноцитов (B) от остановки flox и остановки ΔIEC мышей. Репрезентативные данные из 2 независимых экспериментов. (C) Репрезентативный вестерн-блоттинг и количественный анализ изображений, сравнивающий уровни IL-18 в колоноцитах мышей stop flox , получавших обычную пищу для мышей с добавлением носителя (кукурузное масло) или ретинилацетата (500 МЕ / г) в течение 2 недель.Репрезентативные данные из 2 независимых экспериментов. Все количественные анализы проводились на уровни про-IL18 во всех экспериментах. ImageJ использовался для денситометрического анализа изображения. Уровни β-актина использовали для нормализации. Для статистического анализа использовался критерий Стьюдента. * P <0,05; ** P <0,01.
https://doi.org/10.1371/journal.ppat.1008360.g004
Исследования по выявлению транскрипционных мишеней передачи сигналов RAR с помощью in silico и методов ChIP-seq не выявили IL-18 в качестве кандидата, что предполагает наличие ретиноевой кислоты. рецептор не связывает непосредственно промотор il18 [36, 37].Чтобы идентифицировать механистическую связь между передачей сигналов RAR и IL-18, мы выполнили анализ RNAseq на эпителиальных клетках кишечника от стоп ΔIEC и стоп flox мышей. Анализ RNAseq подтвердил, что передача сигналов RAR регулирует транскрипцию il-18 и (S5A и S5B фиг.). В нашем наборе данных ни один из известных регуляторов транскрипции IL-18, таких как NF-κB, PU.1, Stat1, AP-1 и Bcl6, не экспрессировался по-разному у мышей stop ΔIEC [38-40]. Одним из наиболее активированных генов у мышей stop ΔIEC был металлотионеин-1 ( mt1 ) (S5B и S5C фиг.).Металлотионеины представляют собой внутриклеточные цинк-связывающие белки, которые динамически регулируют цинк, доступный для других цинк-связывающих факторов транскрипции [41–43]. Повышение экспрессии mt1 в стоп- ΔIEC IEC коррелировало с сопутствующим снижением лабильных уровней цинка, количественно определяемых с использованием репортера цинка Zinpyr-1 (S5D и S5E Fig) [44]. Известно, что цинк модулирует активность нескольких факторов транскрипции, включая AP1 и NF-κB, и может быть связующим звеном между передачей сигналов RAR и IL-18 [45].
Зависимый от передачи сигналов RAR IL-18 управляет ранней устойчивостью к вторжению
SalmonellaНаши результаты по остановке мышей ΔIEC продемонстрировали прямую корреляцию между уровнями IL-18 в кишечнике, передачей сигналов RAR, продукцией IFNγ и устойчивостью к инфекции Salmonella . Чтобы выяснить причинно-следственную связь между IL-18, IFNγ и исходом инфекции, мы воссоздали IL-18 и IFNγ у мышей stop ΔIEC и сравнили их восприимчивость в ранние моменты времени (18 hpi) заражения Salmonella .Мы обнаружили, что хотя колонизация просвета не изменилась, обратная связь с IFNγ не спасла раннюю тканевую инвазию у мышей stop ΔIEC (рис. 5A – 5C). С другой стороны, обратная связь IL-18 у мышей stop ΔIEC спасла тканевую нагрузку патогена до уровней, сравнимых с уровнем мышей stop flox (рис. 5D – 5F). Это было дополнительно подтверждено с помощью конфокальной микроскопии, где окрашивание на Salmonella выявило больше бактерий в тканях толстой кишки стоп ΔIEC по сравнению с мышами стоп flox и IL-18 с обратной связью (рис. 5G – 5I; фильмы S1 – S3).Анализ проточной цитометрии при 18 hpi не показал значительных изменений в продукции IFNγ, подтверждая результаты, полученные с обратной связью IFNγ в этот момент времени (S6A и S6B Fig; Fig 5A-5C). Эти результаты показывают, что передача сигналов эпителиального RAR способствует ранней устойчивости к бактериальной инвазии зависимым от IL-18, но независимым от IFNγ образом.
Рис. 5. IL-18, зависящий от передачи сигналов RAR, управляет ранней устойчивостью к инвазии Salmonella .
(A) Схематическое изображение режима обратной связи по IFNγ для 18-часовой временной точки при заражении Salmonella . (B) Фекальные и (C) Бактериальные нагрузки проксимального отдела толстой кишки при 18hpi при остановке flox , остановке ΔIEC и остановке ΔIEC + IFNγ мышей. (D) Схематическое изображение режима обратной связи IL-18 для 18-часовой временной точки при инфекции Salmonella . (E) Фекальные и (F) Бактериальные нагрузки проксимального отдела толстой кишки при 18hpi при остановке flox , остановке ΔIEC и остановке ΔIEC + IL-18 мышей. (G, H и I) Репрезентативные изображения конфокальной микроскопии, на которых изображены скопления Salmonella (красный) в ткани толстой кишки через 18 часов после инфицирования, окрашенные EpCAM (эпителиальные клетки; зеленый) и DAPI (ядра; серый). (J, K и L) Репрезентативные изображения и (M) количественный анализ гибели эпителиальных клеток (расщепленные клетки, положительные по каспазе-3; красный) в тканях слепой кишки stop flox , stop ΔIEC и stop ΔIEC + IL-18 мышей через 18 часов после заражения. Образцы контрастировали с Epcam (эпителиальные клетки; зеленый) и DAPI (ядра; серый). Стрелки указывают на активно выделяющиеся Csp3-положительные эпителиальные клетки. Объединенные данные из 2 независимых экспериментов. Количественное сравнение проводили путем подсчета общего количества клеток Csp3 + ve на изображение.Данные представляют собой в среднем 6–10 изображений на мышь с 3–4 мышами на группу за эксперимент. Для статистического анализа использовали односторонний дисперсионный анализ. * P <0,05; ** P <0,01, *** P <0,005.
https://doi.org/10.1371/journal.ppat.1008360.g005
На ранней стадии заражения, Salmonella использует эпителиальную инвазию как стратегию, чтобы вызвать воспаление тканей и получить избирательное преимущество перед кишечными комменсалами [46, 47] . Недавно смерть эпителиальных клеток была идентифицирована как стратегия устранения инфицированных клеток в кишечнике и ограничения колонизации тканей [48, 49].В контексте инфекции пути клеточной смерти, опосредованные инфламмасомами, и секреция IL-18 участвуют в этом внутреннем эпителиальном ответе [4, 48, 50]. Мы предположили, что передача сигналов RAR в IECs модулирует ответ клеточной смерти во время инфекции Salmonella через IL-18. Сообщается, что смерть клеток происходит как ранний ответ на инфекцию, особенно в слепой кишке, которая более восприимчива к бактериальной инвазии [4]. Мы оценили степень отхождения эпителиальных клеток слепой кишки у мышей stop ΔIEC при 18 hpi, используя окрашивание расщепленной каспазой-3 в качестве маркера гибели эпителиальных клеток.Мы наблюдали большее количество умирающих клеток у мышей stop flox по сравнению с мышами stop ΔIEC . Этот дефект был устранен после восстановления IL-18 (рис. 5J-5M). Чтобы подтвердить связь между IL-18 и эпителиальным отщеплением, мы провели эксперименты по нейтрализации. Обработка мышей нейтрализующими IL-18 антителами приводила к сопутствующему снижению отхождения слепой кишки во время инфекции Salmonella (S7A – S7C, рис.). Это предполагает, что продукция IL-18, опосредованная передачей сигналов RAR, способствует реакции выделения эпителиальных клеток, которая связана с ограничением тканевой инвазии Salmonella .
Внутренняя передача сигналов RAR кишечному эпителию регулирует колонизацию патогенов через интерлейкин-18
Наши результаты с обратной связью IFNγ показали, что на 3-й день инфекции IFNγ успешно спасает колонизацию патогенов у мышей stop ΔIEC (рис. 3A – 3C). IL-18, но не IFNγ, обратная связь была необходима для восстановления чувствительности к ранней тканевой инвазии у мышей stop ΔIEC (рис. 5C и 5F). Таким образом, мы предположили, что уровни IL-18 в кишечнике способствуют ранней врожденной защите от инфекции, в то же время стимулируя IFNγ слизистой оболочки, чтобы опосредовать выведение патогенов на более поздних стадиях.Мы проанализировали эффект восстановления IL-18 у мышей stop ΔIEC на 3-й день инфицирования (фиг. 6A). Обратной связи по IL-18 было достаточно, чтобы вернуть бактериальную нагрузку в образцах фекалий и MLN стоп-мышей ΔIEC к уровням дикого типа (фиг. 6B и 6C). Оценка собственной пластинки толстой кишки показала, что обратная связь IL-18 спасала продукцию IFNγ Т-клетками слизистой оболочки (фиг. 6D). Эти результаты предполагают, что передача сигналов эпителиального RAR модулирует ответ IFNγ слизистой оболочки через IL-18, опосредуя устойчивость к патогену.Наши результаты согласуются с предыдущим исследованием, в котором эпителиальная экспрессия IL-18, регулируемая активностью гистондеацетилазы 3, запускает IFNγ-ответ в интраэпителиальных лимфоцитах, чтобы ограничить колонизацию Citrobacter [51]. Индукция IL-18 путем колонизации простейшими в кишечнике защищает от Salmonella , стимулируя ответ Th2 и Th27 слизистой оболочки [52]. Наши результаты подтверждают важность ИЛ-18 как детерминанты восприимчивости к инфекции и показывают ранее недооцененный путь регуляции ИЛ-18 посредством передачи сигналов витамина А и пищевого витамина А.
Рис. 6. Внутренняя передача сигналов RAR кишечному эпителию регулирует колонизацию патогенов через интерлейкин-18.
(A) Схематическое изображение режима обратной связи IL-18 у мышей stop ΔIEC во время инфицирования Salmonella при 72 hpi. Бактериальная нагрузка в фекальных (B) и мезентериальных лимфатических узлах (C) при 72 hpi в стопе flox , остановке ΔIEC и остановке ΔIEC + IL-18. Объединенные данные из 2 независимых экспериментов. (D) Анализ проточной цитометрии лимфоцитов собственной пластинки толстой кишки от стоп flox , стоп ΔIEC и стоп ΔIEC + IL-18 мышей с графиками плотности и количественным анализом относительных частот CD3 + IFNγ + клеток. Репрезентативные данные из 2 независимых экспериментов. n = 3–4 мыши на группу. Для статистического анализа использовали односторонний дисперсионный анализ. * P <0,05; ** P <0,01.
https://doi.org/10.1371/journal.ppat.1008360.g006
Обсуждение
Витамин А – мощный диетический микронутриент, а его дефицит вызывает восприимчивость к целому ряду инфекционных заболеваний.Большой объем работ способствовал нашему пониманию иммуномодулирующего потенциала витамина А и его метаболита ретиноевой кислоты. Однако сложные метаболические пути и пути распределения, а также функциональные эффекты, зависящие от источника и концентрации, затрудняют интерпретацию диетических моделей витамина А [53]. В этом исследовании мы используем тканеспецифичную модель отмены передачи сигналов, чтобы выяснить роль сигнального пути витамина А в эпителии кишечника во время инфекции. Эта модель не имеет прямого вмешательства в метаболизм витамина А, что позволяет избежать различий в торговле кишечным иммунитетом.В частности, это исследование расширяет наши представления о гомеостатических функциях передачи сигналов витамина А в кишечнике и показывает ранее недооцененную регуляторную роль этого пути во время инфекции Salmonella . Мы описываем динамическую регуляцию гомеостатических уровней IL-18 в кишечнике с помощью витамина A. Мы выясняем функциональную роль оси витамина A-IL18 в ограничении ранней тканевой инвазии с помощью Salmonella и праймировании продукции IFNγ слизистой оболочки, чтобы опосредовать клиренс патогенов (рис. 7).
Рис. 7. Модель, изображающая роль внутренней эпителиальной передачи сигналов во время инфекции Salmonella .
Диетический витамин A активирует передачу сигналов ретиноевой кислоты в эпителиальных клетках толстой кишки, чтобы вызвать выработку IL-18 в гомеостазе. На ранних стадиях заражения Salmonella (18 часов) IL-18 способствует отщеплению эпителиальных клеток, устраняя инфицированные клетки и ограничивая инвазию патогенов. IL-18 также стимулирует продукцию IFNγ иммунными клетками слизистой оболочки, которые способствуют удалению патогенов на более поздних стадиях инфекции (72 часа).
https://doi.org/10.1371/journal.ppat.1008360.g007
Цитокины, секретируемые эпителиальными клетками, важны для иммунной координации в кишечнике. Известно, что витамин А индуцирует передачу сигналов важных цитокинов, таких как IL-22, в кишечнике [26]. Предыдущее исследование нашей группы показало, что собственный эпителиальный синтез ретиноевой кислоты способствует экспрессии IL-22 в иммунных клетках, что, в свою очередь, способствует дисбиозу, индуцированному Salmonella , и колонизации кишечника [18].Напротив, текущее исследование показывает, что внутренняя эпителиальная передача сигналов RA регулирует экспрессию IL-18, которая защищает от колонизации патогенами и системного распространения. Это подчеркивает, что ретиноевая кислота, синтезируемая эпителиальными клетками, имеет различные аутокринные и паракринные функции, каждая из которых оказывает различное влияние на исход инфекции.
Интерлейкин-18 отличается от других членов семейства IL-1 тем, что конститутивно экспрессируется широким спектром типов клеток по всему телу [54].Лиганды TLR (LPS, поли (I: C), pam3CSK4) и интерфероны типа I индуцируют экспрессию IL-18, который затем протеолитически процессируется через путь воспаления в массе [39]. Хотя индукция IL-18 во время воспалительных состояний хорошо известна, относительно мало известно о гомеостатических регуляторах IL-18. Исследования показали, что на поздних сроках беременности неактивный ИЛ-18 начинает накапливаться в кишечнике, а активный ИЛ-18 обнаруживается постнатально [55]. Микробная колонизация кишечника вызывает усиление экспрессии IL-18 [56], а микробный метаболит бутират участвует в регуляции транскрипции IL-18 [57].Это исследование является первым, демонстрирующим, что гомеостатические уровни IL-18 в кишечнике регулируются внутренним сигналом витамина A IEC. Кроме того, мы показываем, что добавка витамина А в рацион также способна индуцировать IL-18 в кишечнике, что предполагает динамическое регулирование уровней эпителиального IL-18 с помощью пищевого витамина A.
В отличие от всасывания и метаболизма питательных веществ, которые хорошо изучены, мы относительно мало знаем о роли восприятия питательных веществ в эпителии. В частности, наши результаты подчеркивают, как уровни витамина А в гомеостазе усиливают раннюю эпителиально-внутреннюю и внешнюю коммуникацию во время инфекции для создания эффективной защиты.
Наши результаты демонстрируют, что уровни IL-18 в кишечнике транскрипционно регулируются витамином А, однако точный механизм этой регуляции остается нерешенным. Мы предполагаем, что регуляция IL-18 витамином А происходит посредством косвенного механизма, включающего взаимодействие между одной или несколькими прямыми мишенями передачи сигналов RAR. Количественный анализ экспрессии генов выявил ранее неизвестное взаимодействие между передачей сигналов RAR, металлотионеинами и внутриклеточными уровнями лабильного цинка.Связь между цинком и витамином А давно постулировалась, при этом корреляция уровней обоих питательных веществ в сыворотке крови наблюдалась во время болезненных состояний [58]. Метаболический фермент витамина А, ретинолдегидрогеназа, а также рецептор ретиноевой кислоты требуют цинка для своей активности [59–61]. Наши результаты предполагают, что эта регуляция может быть двунаправленной, с сигналом витамина А, модулирующим гомеостаз цинка в эпителии. Понимание того, как эпителий интегрирует различные пищевые сигналы, влияющие на метаболизм и иммунитет, имеет решающее значение для понимания реакции хозяина во время инфекции.
Материалы и методы
Мыши
Все мыши были выращены в барьерном учреждении SPF в Университете Брауна. RAR403 – это доминантно-отрицательная форма альфа-рецептора ретиноевой кислоты. RAR403 лишен карбоксиконцевых 59 аминокислот RARα, что приводит к усеченному белку из 403 аминокислот, неспособному реагировать на ретиноевую кислоту [62]. Конструкция, содержащая RAR403 ниже по ходу потока от кассеты неомицина, фланкированной loxP, была клонирована в локусе Rosa26, давая остановку мышей flox [20].Мыши stop flox дикого типа были любезным подарком от доктора С. Соканатана (Медицинский факультет Университета Джона Хопкинса). Мышей Villin-Cre с фоном C56BL / 6J приобретали в Jackson Laboratories. Мышей stop flox скрещивали с мышами Villin-Cre для получения stop flox (Cre-отрицательный) или стоп ΔIEC (Cre-положительный) мышей. Все мыши, использованные в исследовании, были в возрасте 6–10 недель и были одинакового пола в разных группах. Однопометники или мышей, проживающих в одном доме, использовали для минимизации микробиомного воздействия на исследование.
Штаммы бактерий и уход за ними
Все эксперименты по заражению были проведены с использованием штамма Salmonella Typhimurium SL1344 GFP (любезный подарок доктора Ванессы Сперандио, Юго-Западный Юта). Штамм обычно поддерживали на чашках с агаром Luria Bertani, содержащими 100 мкг / мл ампициллина.
Мышиные инфекции
Для модели гастроэнтерита инфекции Salmonella протокол, изложенный Barthel et al. было выполнено [23]. Вкратце, мышей лишали пищи и воды в течение 4 часов, а затем перорально вводили через зонд 20 мг стрептомицина.Через 20 часов мышей снова лишали пищи и воды на 4 часа. Ночную культуру Salmonella субкультивировали в течение 4 часов, после чего мышей инфицировали 10 8 бактерий через желудочный зонд. Через 72 часа после инфицирования мышей умерщвляли для извлечения органов и оценки бактериальной нагрузки. Для определения бактериальной нагрузки в дистальном отделе толстой кишки ткани собирали, обрабатывали и дважды промывали фосфатно-солевым буфером (PBS). Затем ткани инкубировали в PBS, содержащем 400 мкг / мл гентамицина, в течение 30 мин при комнатной температуре при встряхивании.Затем ткани промывали PBS, взвешивали, гомогенизировали и высевали на чашки для определения бактериальной нагрузки.
Чтобы оценить инфекцию на ранних этапах, соблюдали протокол, изложенный Sellin et al [4]. Обработку стрептомицином и субкультуру Salmonella проводили, как описано выше, и мышей инфицировали 5 × 10 7 бактерий через желудочный зонд. Оценка гибели клеток, а также тканевой нагрузки проводилась в слепой кишке и проксимальном отделе толстой кишки, соответственно, которые являются первичными участками инфицирования в этот ранний момент времени.Для оценки гибели клеток ткани слепой кишки собирали и фиксировали в 4% параформальдегиде / 4% сахарозе в течение ночи. Затем фиксированные ткани насыщали PBS, содержащим 20% сахарозы, помещали в среду с оптимальной температурой резки (OCT), замораживали на сухом льду и хранили при -80 ° C. Ткани проксимального отдела толстой кишки промывали и обрабатывали гентамицином для оценки бактериальной нагрузки.
Для экспериментов по восстановлению рекомбинантный IFNγ мыши (Sino Biological; № по каталогу 50709-MNAH) и рекомбинантный IL-18 мыши (Sino Biological; Cat.# 50073-MNCE). Поскольку дефект продукции IFNγ у мышей stop ΔIEC наблюдался только после инфицирования, восстановление проводили через 0 и 48 часов после инфицирования 10 мкг рекомбинантного IFNγ внутрибрюшинно. Поскольку мыши Stop ΔIEC имели гомеостатический дефицит продукции IL-18, их восстанавливали 2,5 мкг рекомбинантного IL-18 внутрибрюшинно за 24 часа до и через 24 часа после заражения. Для экспериментов с ранними временными точками мыши stop ΔIEC получали однократную дозу 5 мкг рекомбинантного IL-18 внутрибрюшинно за 24 часа до инфицирования или однократную дозу 15 мкг рекомбинантного IFNγ внутрибрюшинно через 0 часов после инфицирования.Для нейтрализации IL-18 мышам stop flox вводили 200 мкг нейтрализующего антитела IL-18 (YIGIF74-1G7, Bioxcell) ежедневно в течение 3 дней до заражения Salmonella [52].
Выделение и анализ лимфоцитов собственной пластинки толстой кишки
Лимфоцитов собственной пластинки толстой кишки выделяли, как описано Kim et al [63]. Вкратце, толстую кишку промывали для удаления содержимого просвета, распиливали, разрезали на три части и хранили в ледяном PBS. Ткани промывали энергичным встряхиванием с последующим 10-минутным перевариванием при 37 ° C в HBSS, содержащем 3% FCS, 1 мМ дитиотреитол и 30 мМ этилендиаминтетрауксусной кислоты (EDTA), и HBSS, содержащем 3% FCS и 30 мМ EDTA.Между обработками ткани энергично встряхивали, чтобы удалить эпителиальные клетки. Лимфоциты высвобождались из собственной пластинки путем переваривания тканей в полной RPMI, содержащей 40 мкл / мл коллагеназы (Sigma-Aldrich, исходный раствор 5 мг / мл) и 5 мкл / мл ДНКазы (Sigma-Aldrich, исходный раствор 0,5 мг / мл) для один час при 37 ° C с последующим сильным встряхиванием. Клетки фильтровали через фильтр 70 мкм и разделяли в прерывистом градиенте 40% / 80% Percoll (GE Healthcare). Клетки на границе раздела собирали и обрабатывали для анализа проточной цитометрии.
Анализ проточной цитометрии
Клетки стимулировали в течение 4 часов при 37 ° C в RPMI complete, содержащем 1X коктейль для стимуляции клеток (eBioscience) и коктейль ингибиторов транспорта белка (eBioscience). Стимулированные клетки собирали и окрашивали на маркеры поверхности и жизнеспособность в течение 30 мин при комнатной температуре. Образцы окрашивали красителем жизнеспособности APCef780 (ThermoFisher), CD45 evolve655 (ThermoFisher), CD4 BV785 (BioLegend), CD3 eF450 (ThermoFisher), CD8a BV605 (BioLegend), CD335 BV510 (BioLegend) и Gr-1.После фиксации в течение ночи с использованием раствора для фиксации / пермеабилизации (набор буферов для окрашивания eBioscience Foxp3) клетки пермеабилизировали и окрашивали на цитокины IL-17A AF488 (eBioscience), IL-22 PE (eBioscience) и IFNγ PE (eBioscience). Клетки анализировали с помощью цитометра Aria IIIu, а данные анализировали с помощью программного обеспечения FlowJo.
Лазерный захват микродиссекции
Ткани кишечника промывали PBS и OCT, заливали в OCT, замораживали на сухом льду и хранили при -80 ° C.Криосрезы (толщиной 10 мкм) окрашивали метиловым зеленым и эозином. Клетки кишечного эпителия были выборочно захвачены с использованием системы микродиссекции Arcturus Laser Capture Microdissection. РНК выделяли из IEC с использованием набора RNA Water-Micro Total RNA (Ambion).
Количественная ПЦР в реальном времени.
Изолированная РНК LCM была преобразована в кДНК с использованием набора для синтеза кДНК iScript (BioRad). Образцы цельной ткани гомогенизировали, РНК экстрагировали с помощью набора для выделения РНК PureLink (Life Technologies) и преобразовывали в кДНК с использованием обратной транскриптазы MMLV.Количественную ПЦР в реальном времени проводили с использованием мастер-микса SYBR green (Maxima). Экспрессию нормализовали с использованием gapdh в качестве гена домашнего хозяйства. Подробная информация о праймерах представлена в таблице 1.
Анализ последовательности РНК
Микродиссекцию с лазерным захватомиспользовали для выделения РНК из эпителиальных клеток тонкого кишечника гомеостатических стоп flox и стоп ΔIEC мышей. Качество выделенной РНК проверяли с помощью набора Picochip на 2100 Agilent Bioanalyser. РНК обрабатывали с использованием системы Ovation Mouse RNA-seq (NuGen) для получения библиотеки кДНК.РНК была секвенирована на платформе Illumina (чтения 1×50 пар оснований), и данные были проанализированы с использованием платформы Galaxy [64]. Вкратце, считывания последовательности РНК анализировали с помощью FastQC и выравнивали с геномом мыши с помощью Bowtie2. Выровненные считывания подвергали анализу дифференциальной экспрессии генов с использованием CuffDiff. Первые 50 генов с повышенной и пониженной регуляцией (значение p <0,05) были визуализированы с помощью GraphPad Prism. Исходные данные хранятся в репозитории NCBI GEO (GSE140518). Полный список дифференциально регулируемых генов можно найти в таблице S1.
Анализ барьерной функции
Анализ включенияBrdU использовали для оценки оборота барьера. Мышам внутрибрюшинно вводили 1 мг бромдезоксиуридина. Мышей умерщвляли через 2 часа и 24 часа после инъекции, ткани дистального отдела толстой кишки фиксировали в фиксаторе метакарна и заключали в парафиновые блоки. Срезы тканей (толщиной 7 мкм) окрашивали антителом против BrdU (Novus Biologicals; # NBP2-14890) и визуализировали. Для окрашивания слизи образцы тканей толстой кишки фиксировали в метакарне и заключали в парафиновые блоки.Срезы тканей (толщиной 7 мкм) окрашивали реактивом Шиффа альциановой синей и периодической кислотой для анализа толщины слизи и количества бокаловидных клеток в крипте.
Количественное определение ретиноидов.
Гомеостатические, однопометные, совпадающие по полу, 6–10 недель stop flox и stop Мышей ΔIEC использовали для анализа ретиноидов. Мышей умерщвляли и собирали всю толстую кишку в темноте. Ткань толстой кишки промывали PBS, заполняли, замораживали на сухом льду и хранили при -80 ° C. Ткани обрабатывали для количественного определения ретиноидов, как описано ранее [18].
Иммунофлуоресцентное окрашивание и конфокальная микроскопия
Для визуализации выделения клеток и внутриклеточной бактериальной нагрузки образцы слепой кишки и проксимального отдела толстой кишки, фиксированные PFA, залитые с помощью ОКТ, делали криосрезы до толщины 10 мкм. Срезы сушили на воздухе, пропитывали 0,5% Triton X-100 и блокировали 10% донорской козьей сывороткой. Срезы окрашивали анти-Salmonella LPS (Difco; # DF2659-47-5), анти-расщепленной каспазой-3 (Cell Signaling; # 9661S) и антителом против Epcam (BioLegend; # 118201).DAPI использовался для контрастирования ядер. Ткани визуализировали с помощью микроскопа Olympus FV3000.
Вестерн-блот
Для анализа уровней белка, особенно в эпителиальных клетках кишечника, толстую кишку собирали и промывали PBS. Эпителиальные клетки толстой кишки лизировали in situ реагентом для экстракции тканевого белка (TPER, Thermo Fisher), содержащим смесь ингибиторов протеазы. После 5-минутной инкубации лизат извлекали, центрифугировали при 10000 g в течение 3 минут для удаления остатков и хранили при -80 ° C [65].Лизаты цельной ткани получали путем гомогенизации образцов ткани в 500 мкл TPER, содержащего ингибиторы протеаз, и инкубирования на льду в течение 20 мин. Лизаты центрифугировали, как указано выше, и хранили при -80 ° C. Белок в образцах количественно определяли с использованием анализа белка DC (BioRad), и приблизительно 50 мкг белка загружали для SDS-PAGE. Предварительно окрашенный белок (BioRad) загружали в качестве эталона. Белки переносили на мембраны из PVDF и блокировали 4% бычьим сывороточным альбумином в буфере TBST в течение одного часа.Блоты окрашивали в течение ночи при 4 ° C с использованием первичных антител против IL-18 (Abcam; # ab71495) с последующей инкубацией с соответствующими вторичными антителами, конъюгированными с HRP. Уровни бета-актина (Santa Cruz; # sc-47778-HRP) в образце использовали для нормализации. Блоты анализировали с использованием программного обеспечения ImageJ для расчета относительных уровней белка.
Диетическое вмешательство
Stop flox мышей в возрасте 6–8 недель кормили обычным кормом для мышей, покрытым ретинилацетатом (500 МЕ / г) или эквивалентным количеством контрольного носителя (кукурузное масло) в течение 2 недель.Потребление корма контролировали, чтобы убедиться, что обе группы мышей потребляли одинаковое количество корма. Мышей умерщвляли и готовили лизаты толстой кишки для анализа уровней IL-18 с помощью вестерн-блоттинга.
Анализ внутриклеточного лабильного цинка
Homeostatic stop flox и stop Мышей ΔIEC умерщвляли и собирали ткани толстой кишки. Толстую кишку промыли холодным PBS и запилили. Ткани толстой кишки промывали холодным PBS 3 раза и дважды dPBS (каждый раз встряхивая в течение 1 мин).Ткани переваривали в HBSS, содержащем 1 мМ EDTA и 1 мМ DTT, в течение 30 минут при 30 ° C при встряхивании. Ткани встряхивали в течение 1 мин и фильтровали через фильтр 40 мкм для получения фракции эпителиальных клеток. Эпителиальные клетки промывали HBSS (3 раза) и ресуспендировали в dPBS. Клетки окрашивали CD326 APC (EpCAM; ThermoFisher), CD45 evolve655 (ThermoFisher) и Zinpry-1 FITC (Cayman Chemical company) и анализировали проточной цитометрией.
Получение изображения с микроскопа
Получение изображения производилось на конфокальном микроскопе Olympus FV3000.Изображения были получены с использованием иммерсионного объектива 60X. Для внутриклеточных бактериальных данных изображения были получены в виде Z-стека. Вся обработка изображений производилась с помощью программного обеспечения Fiji с плагином Olympus. Цвет канала для DAPI был изменен на постобработку в оттенках серого. Исходные 16-битные стеки были преобразованы в формат RGB перед экспортом как видео.
Секвенирование 16S рРНК и анализ микробиома
Подготовка библиотеки и секвенирование.
ПЦР-амплификацию выполняли с использованием ДНК-полимеразы Phusion High-Fidelity с праймерами, разработанными для фланкирования области V4 / V5 гена 16S рРНК.Образцы были отправлены в Центр геномики и секвенирования Университета Род-Айленда для подготовки библиотеки PrepX NGS. Ампликоны были секвенированы с использованием платформы Illumina MiSeq, давая считывание парных концов, 250 пар оснований.
Обработка секвенированных данных.
Конвейер DADA2 [66] использовался в R (версия 3.3.4) и усеченных чтениях, где средний балл Phred <30. Алгоритм классификатора RDP с обучающим набором RDP 14 использовался для выполнения таксономического задания [67].Таблица ASV была импортирована в R с помощью пакета phyloseq [68]. Гистограммы были построены путем преобразования количества образцов в проценты для учета вариаций глубины отбора образцов и экспортированы в программное обеспечение Prism (GraphPad). Графики главных координат анализа (PCoA) были построены с использованием функции phyloseq и нормализованы путем преобразования подсчетов в относительную численность. Матрицы расстояний были созданы с использованием как взвешенных, так и невзвешенных показателей расстояния UniFrac [69].
Статистический анализ
Представленные данные представляют собой средние значения ± SEM.Данные были нанесены на график и проанализированы с использованием программного обеспечения GraphPad Prism. Для сравнения двух групп использовался t-критерий Стьюдента с двусторонним анализом. Сравнение двух или более групп проводили с использованием однофакторного дисперсионного анализа. Двусторонний дисперсионный анализ ANOVA использовался для сравнения экспрессии генов в нескольких группах.
Заявление об этике
Все эксперименты были одобрены и проведены в соответствии с руководящими принципами Институционального комитета по уходу за животными и их использованию в Университете Брауна (протокол № 1803000345).
Дополнительная информация
S1 Рис. Гомеостатический ретиноид толстой кишки и анализ барьера.
На этом рисунке сравниваются (A) общий RA (ретиноевая кислота), ROL (ретинол) и RE (ретиниловый эфир), нормализованные на грамм ткани толстой кишки, (B) толщина слизи, (C) бокаловидные клетки / крипта, (D и E) обновление эпителия посредством включения BrdU через 2 часа (D) и 25 часов (E) после инъекции в гомеостатическую толстую кишку мышей stop flox и stop ΔIEC . (F) Экспрессия гена рецептора ретиноевой кислоты альфа в цельной ткани толстой кишки в ранние и поздние моменты времени инфицирования.
https://doi.org/10.1371/journal.ppat.1008360.s001
(TIF)
S2 Рис. Анализ гомеостатического микробиома.
На этом рисунке анализируются фекальные микробные сообщества в гомеостатической остановке flox и ΔIEC мышей с использованием (A) невзвешенного Unifrac, (B) взвешенного Unifrac и отображает (C) относительную численность микробных сообществ на уровне класса.
https://doi.org/10.1371/journal.ppat.1008360.s002
(TIF)
S3 Фиг.Гомеостатическая характеристика лимфоцитов собственной пластинки толстой кишки.
Этот рисунок описывает относительные частоты (A) CD45 + CD3 + клеток, (B) CD45 + CD3 + IFNγ + клеток, (C) CD45 + CD3 + IL17 + клеток и (D) IL22 + клеток в толстой кишке стоп flox и остановить гомеостаз мышей ΔIEC .
https://doi.org/10.1371/journal.ppat.1008360.s003
(TIF)
S4 Рис. Характеристика лимфоцитов собственной пластинки толстой кишки во время инфекции.
Этот рисунок описывает относительные частоты (A) клеток CD4 и CD8, (B) клеток Gr-1 +, (C) CD3 + IL17 + и (D) CD45 + IL22 + клеток в собственной пластинке толстой кишки остановки flox и остановки ΔIEC мышей через 72 часа после заражения Salmonella .
https://doi.org/10.1371/journal.ppat.1008360.s004
(TIF)
S5 Рис. Анализ RNAseq.
На этом рисунке сравнивается экспрессия генов в микродиссектированных с помощью лазерного излучения эпителиальных клетках из тканей подвздошной кишки гомеостатических стоп flox и стоп ΔIEC мышей. (A) График вулкана, отображающий глобальные изменения в экспрессии генов. (B) Тепловая карта с подробным описанием топ-50 генов с пониженной и повышенной регуляцией. (C) Относительная экспрессия гена mt1 в эпителиальных клетках подвздошной кишки (D и E) Анализ проточной цитометрии EpCAM + эпителиальных клеток толстой кишки от гомеостатической остановки flox и стоп ΔIEC мышей и количественный анализ клеточной флуоресценции Zinpyr-1.
https://doi.org/10.1371/journal.ppat.1008360.s005
(TIF)
S6 Рис. Характеристика лимфоцитов собственной пластинки толстой кишки через 18 часов после инфицирования.
Этот рисунок описывает относительные частоты IFNγ + клеток в собственной пластинке толстой кишки у мышей stop flox и ΔIEC через 18 часов после заражения Salmonella .
https://doi.org/10.1371/journal.ppat.1008360.s006
(TIF)
Благодарности
Мы благодарим Кевина Карлсона за помощь в проточной цитометрии и Джеффа Уильямса за поддержку центра Leduc Bioimaging.Мы благодарим Кристофа Шорла и ядро Brown Genomics за помощь в секвенировании РНК.
Ссылки
- 1. Аллер Дж. М., Кроули С. М., Ло Х. Т., Чанг С. Ю., Ко Х. Дж., Валланс Б. А. Кишечный эпителий: центральный координатор иммунитета слизистой оболочки. Trends Immunol. 2018; 39 (9): 677–96. pmid: 29716793.
- 2. Thiemann S, Smit N, Roy U, Lesker TR, Galvez EJC, Helmecke J, et al. Повышение выработки IFN-гамма с помощью отдельных комменсалов улучшает заболевание, вызванное сальмонеллой.Клеточный микроб-хозяин. 2017; 21 (6): 682–94 e5. pmid: 28618267.
- 3.
Мюллер А.А., Доловщак Т., Селлин М.Э., Фелми Б., Вербри С., Гадиент С. и др. Реакция на перфорин NK-клеток, вызванная IL-18, контролирует кинетику воспаления слизистой оболочки во время инфекции кишечника сальмонеллой. PLoS Pathog. 2016; 12 (6): e1005723. pmid: 27341123; PubMed Central PMCID: PMC4
9. - 4. Селлин М.Э., Мюллер А.А., Фелми Б., Доловщак Т., Диард М., Тардивел А. и др. Внутренняя инфламмасома NAIP / NLRC4, присущая эпителию, вызывает изгнание инфицированных энтероцитов, ограничивая репликацию сальмонелл в слизистой оболочке кишечника.Клеточный микроб-хозяин. 2014. 16 (2): 237–48. pmid: 25121751.
- 5. Лю Дж., Болик Д.Т., Коллинг Г.Л., Фу З., Геррант Р.Л. Белковая недостаточность ухудшает оборот эпителиальных клеток кишечника, потенциальный механизм усиления криптоспоридиоза на мышиной модели. Заражение иммунной. 2016; 84 (12): 3542–9. pmid: 27736783; PubMed Central PMCID: PMC5116730.
- 6. Харрисон Э. Механизмы, участвующие в кишечной абсорбции витамина А и каротиноидов провитамина А. Biochim Biophys Acta.2012; 1821 (1): 70–7. pmid: 21718801; PubMed Central PMCID: PMC3525326.
- 7. Coombes JL, Siddiqui KR, Arancibia-Carcamo CV, Hall J, Sun CM, Belkaid Y, et al. Функционально специализированная популяция CD103 + DC слизистой оболочки индуцирует Foxp3 + регуляторные Т-клетки посредством TGF-бета и механизма, зависимого от ретиноевой кислоты. J Exp Med. 2007. 204 (8): 1757–64. pmid: 17620361; PubMed Central PMCID: PMC2118683.
- 8. Холл Дж. А., Кэннонс Дж. Л., Грейнджер Дж. Р., Дос Сантос Л. М., Хэнд Т. В., Наик С. и др.Важная роль ретиноевой кислоты в стимулировании эффекторных ответов CD4 (+) Т-клеток через рецептор ретиноевой кислоты альфа. Иммунитет. 2011. 34 (3): 435–47. pmid: 21419664; PubMed Central PMCID: PMC3415227.
- 9. Мора-младший, фон Андриан UH. Роль ретиноевой кислоты в импринтинге секретирующих IgA клеток кишечника. Semin Immunol. 2009. 21 (1): 28–35. pmid: 18804386; PubMed Central PMCID: PMC2663412.
- 10. Goverse G, Labao-Almeida C, Ferreira M, Molenaar R, Wahlen S, Konijn T. и др.Витамин А контролирует присутствие RORgamma + врожденных лимфоидных клеток и лимфоидной ткани в тонком кишечнике. J Immunol. 2016; 196 (12): 5148–55. pmid: 27183576.
- 11. Хихон Х. Б., Суарес-Лопес Л., Диас О. Е., Дас С., Де Калисто Дж., Парада-Куш М. и др. Коррекция: Специфическое для кишечных эпителиальных клеток истощение RAR-альфа приводит к аберрантному гомеостазу эпителиальных клеток и слаборазвитой иммунной системе. Mucosal Immunol. 2019; 12 (2): 580. pmid: 30514887.
- 12. Гатту С., Банг Й.Дж., Пендсе М., Денде С., Чара А.Л., Харрис Т.А. и др.Бета-рецептор эпителиальной ретиноевой кислоты регулирует сывороточную экспрессию амилоида А и витамин А-зависимый кишечный иммунитет. Proc Natl Acad Sci U S A. 2019. pmid: 31097581.
- 13. Макклунг Л., Уинтерс Дж. Влияние диеты без витамина А на устойчивость к инфекции, вызываемой Salmonella enteritidis. Журнал инфекционных болезней. 1932; 51 (3): 469–74
- 14. Имдад А., Майо-Уилсон Э, Херцер К., Бхутта З.А. Добавка витамина А для предотвращения заболеваемости и смертности у детей от шести месяцев до пяти лет.Кокрановская база данных Syst Rev.2017; 3: CD008524. pmid: 28282701; Идентификатор PubMed Central PMCID: PMC6464706.
- 15. Хуан Цзы, Лю И, Ци Г, Бренд Д, Чжэн С.Г. Роль витамина А в иммунной системе. J Clin Med. 2018; 7 (9). pmid: 30200565; PubMed Central PMCID: PMC6162863.
- 16. Вилламор Э, Фавзи WW. Влияние добавок витамина А на иммунные ответы и корреляцию с клиническими исходами. Clin Microbiol Rev.2005; 18 (3): 446–64. pmid: 16020684; PubMed Central PMCID: PMC1195969.
- 17. Дас BC, Тхапа П., Карки Р., Дас С., Махапатра С., Лю Т.С. и др. Пути передачи сигналов ретиноевой кислоты в развитии и заболеваниях. Bioorg Med Chem. 2014. 22 (2): 673–83. pmid: 243
; PubMed Central PMCID: PMC4447240.
- 18. Гризотт-Лейк М, Жонг Дж., Дункан К., Кирквуд Дж., Айер Н., Смоленски И. и др. Комменсалы подавляют синтез ретиноевой кислоты в эпителиальных клетках кишечника, чтобы регулировать активность интерлейкина-22 и предотвращать микробный дисбактериоз. Иммунитет. 2018; 49 (6): 1103–15 e6.pmid: 30566883; PubMed Central PMCID: PMC6319961.
- 19. Илиев И.Д., Милети Э., Маттеоли Г., Чиппа М., Ресциньо М. Эпителиальные клетки кишечника способствуют дифференцировке регулирующих Т-клеток, защищающих от колита, посредством кондиционирования дендритных клеток. Mucosal Immunol. 2009. 2 (4): 340–50. pmid: 1
33.
- 20. Rajaii F, Bitzer ZT, Xu Q, Sockanathan S. Экспрессия доминантно-отрицательного ретиноидного рецептора, RAR403, изменяет пролиферацию телэнцефальных предшественников, выживаемость и спецификацию судьбы клеток.Dev Biol. 2008. 316 (2): 371–82. pmid: 18329011.
- 21. Цай С., Бартельмез С., Хейман Р., Дамм К., Эванс Р., Коллинз С.Дж. Мутировавший рецептор-альфа ретиноевой кислоты, проявляющий доминантно-отрицательную активность, изменяет клональное развитие мультипотентной линии гемопоэтических клеток. Genes Dev. 1992. 6 (12A): 2258–69. pmid: 1334022.
- 22. Лобо Г.П., Хессель С., Эйхингер А., Ной Н., Моис А.Р., Висс А. и др. ISX – это чувствительный к ретиноевой кислоте привратник, который контролирует кишечные бета-, бета-каротиновые абсорбции и выработку витамина А.FASEB J. 2010; 24 (6): 1656–66. pmid: 20061533; PubMed Central PMCID: PMC2874479.
- 23. Бартель М., Хапфельмайер С., Кинтанилья-Мартинес Л., Кремер М., Роде М., Хогардт М. и др. Предварительная обработка мышей стрептомицином дает модель колита серовара Typhimurium Salmonella enterica, которая позволяет анализировать как патоген, так и хозяина. Заражение иммунной. 2003. 71 (5): 2839–58. pmid: 12704158; PubMed Central PMCID: PMC153285.
- 24. Ивата М., Эшима Ю., Кагечика Х. Ретиноевая кислота оказывает прямое влияние на Т-клетки, подавляя развитие Th2 и усиливая развитие Th3 через рецепторы ретиноевой кислоты.Int Immunol. 2003. 15 (8): 1017–25. pmid: 12882839.
- 25. Brown CC, Esterhazy D, Sarde A, London M, Pullabhatla V, Osma-Garcia I, et al. Ретиноевая кислота необходима для стабильности клонов клеток Th2 и предотвращает переход к программе клеток Th27. Иммунитет. 2015; 42 (3): 499–511. pmid: 25769610; PubMed Central PMCID: PMC4372260.
- 26. Мильке Л.А., Джонс С.А., Равердо М., Хиггс Р., Стефанская А., Грум Дж. Р. и др. Экспрессия ретиноевой кислоты связана с усилением продукции IL-22 гаммадельта-Т-клетками и врожденными лимфоидными клетками и ослаблением воспаления кишечника.J Exp Med. 2013. 210 (6): 1117–24. pmid: 236; PubMed Central PMCID: PMC3674702.
- 27. Рампал Р., Авасти А., Ахуджа В. Дендритные клетки человека, примированные ретиноевой кислотой, ингибируют клетки Th9 и индуцируют дифференцировку клеток Th2 / Th27. J Leukoc Biol. 2016; 100 (1): 111–20. pmid: 26980802.
- 28. Бао С., Бигли К.В., член парламента Франции, Шен Дж., Муж А.Дж. Гамма-интерферон играет решающую роль в иммунитете кишечника против инфекции Salmonella typhimurium. Иммунология. 2000. 99 (3): 464–72.pmid: 10712678; PubMed Central PMCID: PMC2327174.
- 29. Гордон М.А., Джек Д.Л., Докрелл Д.Х., Ли М.Э., Рид Р.С. Гамма-интерферон усиливает интернализацию и раннее неокислительное уничтожение серовара Typhimurium Salmonella enterica человеческими макрофагами и изменяет цитокиновые ответы. Заражение иммунной. 2005. 73 (6): 3445–52. pmid: 153; PubMed Central PMCID: PMC1111838.
- 30. Динарелло С.А., Новик Д., Ким С., Каплански Г. Интерлейкин-18 и белок, связывающий ИЛ-18. Фронт Иммунол.2013; 4: 289. pmid: 24115947; PubMed Central PMCID: PMC37
.- 31. Ёсимото Т., Такеда К., Танака Т., Окусу К., Кашивамура С., Окамура Н. и др. IL-12 усиливает экспрессию рецептора IL-18 на T-клетках, Th2-клетках и B-клетках: синергизм с IL-18 для продукции IFN-гамма. J Immunol. 1998. 161 (7): 3400–7. pmid: 9759857.
- 32. Колинская Дж., Лиза В., Кларк Дж. А., Козакова Н., Закостелецкая М., Хайлова Л. и др. Конститутивная экспрессия IL-18 и IL-18R в дифференцированных клетках IEC-6: эффект лечения TNF-альфа и IFN-гамма.J Interferon Cytokine Res. 2008. 28 (5): 287–96. pmid: 18547159.
- 33. Писарро Т.Т., Мичи М.Х., Бенц М., Вораратанадхарм Дж., Смит М.Ф.-младший, Фоли Э. и др. IL-18, новый иммунорегуляторный цитокин, активируется при болезни Крона: экспрессия и локализация в клетках слизистой оболочки кишечника. J Immunol. 1999. 162 (11): 6829–35. pmid: 10352304.
- 34. Sallmon H, Hoene V, Weber SC, Dame C. Дифференциация человеческих клеток нейробластомы SH-SY5Y полностью транс-ретиноевой кислотой активирует систему интерлейкина-18.J Interferon Cytokine Res. 2010. 30 (2): 55–8. pmid: 20028206.
- 35. Гущина Л.В., Ясмин Р., Зиузенкова О. Умеренные добавки витамина А у мышей с ожирением регулируют тканевой фактор и продукцию цитокинов в зависимости от пола. Arch Biochem Biophys. 2013. 539 (2): 239–47. pmid: 23850584; PubMed Central PMCID: PMC3818464.
- 36. Lalevee S, Anno YN, Chatagnon A, Samarut E, Poch O, Laudet V и др. Идентификация in silico по всему геному новых консервативных и функциональных элементов ответа рецептора ретиноевой кислоты (прямые повторы, разделенные 5 п.н.).J Biol Chem. 2011. 286 (38): 33322–34. pmid: 21803772; PubMed Central PMCID: PMC31
. 7.- 37. Delacroix L, Moutier E, Altobelli G, Legras S, Poch O, Choukrallah MA, et al. Клеточно-специфическое взаимодействие рецепторов ретиноевой кислоты с генами-мишенями в эмбриональных фибробластах мыши и эмбриональных стволовых клетках. Mol Cell Biol. 2010. 30 (1): 231–44. pmid: 19884340; PubMed Central PMCID: PMC2798310.
- 38. Ясуда К., Наканиши К., Цуцуи Х. Интерлейкин-18 в здоровье и болезнях.Int J Mol Sci. 2019; 20 (3). pmid: 30717382; PubMed Central PMCID: PMC6387150.
- 39. Чжу Кью, Каннеганти Т.Д. Передний край: различные механизмы регуляции контролируют провоспалительные цитокины IL-18 и IL-1beta. J Immunol. 2017; 198 (11): 4210–5. pmid: 28468974; PubMed Central PMCID: PMC5544497.
- 40. Такеда Н., Арима М., Цуруока Н., Окада С., Хатано М., Сакамото А. и др. Bcl6 является репрессором транскрипции для гена IL-18. J Immunol. 2003. 171 (1): 426–31. pmid: 12817026.
- 41. Крезель А., Марет В. Функции метаморфических металлотионеинов в метаболизме цинка и меди. Int J Mol Sci. 2017; 18 (6). pmid: 28598392; PubMed Central PMCID: PMC5486060.
- 42. Рутткай-Недецки Б., Нейдл Л., Гумулек Дж., Зитка О., Масарик М., Экшлагер Т. и др. Роль металлотионеина в окислительном стрессе. Int J Mol Sci. 2013. 14 (3): 6044–66. pmid: 23502468; PubMed Central PMCID: PMC3634463.
- 43. Kagi JH. Обзор металлотионеина.Методы Энзимол. 1991; 205: 613–26. pmid: 1779825.
- 44. Woodroofe CC, Masalha R, Barnes KR, Frederickson CJ, Lippard SJ. Мембранные и непроницаемые датчики семейства Zinpyr и их применение для визуализации цинка в гиппокампе in vivo. Chem Biol. 2004. 11 (12): 1659–66. pmid: 15610850.
- 45. Уззо Р.Г., Криспен П.Л., Головин К., Махов П., Хорвиц Е.М., Коленко В.М. Разнообразные эффекты цинка на факторы транскрипции NF-kappaB и AP-1: последствия для прогрессирования рака простаты.Канцерогенез. 2006. 27 (10): 1980–90. pmid: 16606632.
- 46. Thiennimitr P, Winter SE, Winter MG, Xavier MN, Tolstikov V, Huseby DL, et al. Воспаление кишечника позволяет сальмонелле использовать этаноламин для борьбы с микробиотой. Proc Natl Acad Sci U S. A. 2011; 108 (42): 17480–5. pmid: 21969563; PubMed Central PMCID: PMC3198331.
- 47. Winter SE, Thiennimitr P, Winter MG, Butler BP, Huseby DL, Crawford RW и др. Воспаление кишечника является акцептором респираторных электронов для сальмонелл.Природа. 2010. 467 (7314): 426–9. pmid: 20864996; PubMed Central PMCID: PMC2
- 4.
- 48. Rauch I, Deets KA, Ji DX, von Moltke J, Tenthorey JL, Lee AY и др. Инфламмасомы NAIP-NLRC4 координируют изгнание эпителиальных клеток кишечника с высвобождением эйкозаноида и IL-18 посредством активации каспазы-1 и -8. Иммунитет. 2017; 46 (4): 649–59. pmid: 28410991; PubMed Central PMCID: PMC5476318.
- 49. Уильямс Дж. М., Дакворт, Калифорния, Беркитт, доктор медицины, Уотсон, А. Дж., Кэмпбелл, Б. Дж., Притчард, DM.Отшелушивание эпителиальных клеток и барьерная функция: вопрос жизни и смерти кончика ворсинок тонкого кишечника. Vet Pathol. 2015; 52 (3): 445–55. pmid: 25428410; PubMed Central PMCID: PMC4441880.
- 50. Knodler LA, Crowley SM, Sham HP, Yang H, Wrande M, Ma C. и др. Активация неканонических инфламмасом каспазы-4 / каспазы-11 опосредует эпителиальную защиту против кишечных бактериальных патогенов. Клеточный микроб-хозяин. 2014. 16 (2): 249–56. pmid: 25121752; PubMed Central PMCID: PMC4157630.
- 51.Navabi N, Whitt J, Wu SE, Woo V, Moncivaiz J, Jordan MB и др. Эпителиальная гистоновая деацетилаза 3 управляет кишечным иммунитетом, координируя локальную активацию лимфоцитов. Cell Rep. 2017; 19 (6): 1165–75. pmid: 28494866; PubMed Central PMCID: PMC5499685.
- 52. Чудновский А., Морта А., Кана В., Кеннард А., Рамирес Дж. Д., Рахман А. и др. Взаимодействия между хозяином и простейшими защищают от инфекций слизистых оболочек за счет активации инфламмасомы. Клетка. 2016; 167 (2): 444–56 e14. pmid: 27716507; PubMed Central PMCID: PMC5129837.
- 53. Боно М.Р., Теджон Дж., Флорес-Сантибанес Ф., Фернандес Д., Роземблатт М., Саума Д. Ретиноевая кислота как модулятор Т-клеточного иммунитета. Питательные вещества. 2016; 8 (6). pmid: 27304965; PubMed Central PMCID: PMC4
0. ; PubMed Central PMCID: PMC6030816.- 54. Tone M, Thompson SA, Tone Y, Fairchild PJ, Waldmann H. Регулирование экспрессии гена IL-18 (фактор, индуцирующий гамма-интерферон). J Immunol. 1997. 159 (12): 6156–63. pmid: 9550417.
- 55. Kempster SL, Belteki G, Forhead AJ, Fowden AL, Catalano RD, Lam BY и др.Контроль развития инфламмасомы Nlrp6 и субстрата, IL-18, в кишечнике млекопитающих. Am J Physiol Gastrointest Liver Physiol. 2011; 300 (2): G253–63. pmid: 21088234; PubMed Central PMCID: PMC3043648.
- 56. Леви М., Таисс К.А., Зееви Д., Дохналова Л., Зильберман-Шапира Г., Махди Дж. А. и др. Метаболиты, модулируемые микробиотой, формируют кишечную микросреду, регулируя передачу сигналов инфламмасомы NLRP6. Клетка. 2015; 163 (6): 1428–43. pmid: 26638072.
- 57. Калина У., Кояма Н., Хосода Т., Нюрнбергер Х., Сато К., Хельцер Д. и др.Повышенная продукция IL-18 в эпителии кишечника, обработанном бутиратом, путем стимуляции проксимальной области промотора. Eur J Immunol. 2002. 32 (9): 2635–43. pmid: 12207348.
- 58. Смит Дж. С. младший, МакДэниел Э. Г., Фан ФФ, Холстед Дж. А. Цинк: микроэлемент, необходимый для метаболизма витамина А. Наука. 1973, 181 (4103): 954–5. pmid: 4730448.
- 59. Моррис Д.Р., Левенсон CW. Цинковая регуляция транскрипционной активности во время дифференцировки нейронов, индуцированной ретиноевой кислотой.J Nutr Biochem. 2013; 24 (11): 1940–4. pmid: 24029070; PubMed Central PMCID: PMC3832953.
- 60. Касадевалл М., Саркар Б. Влияние окислительно-восстановительных условий на эффективность связывания ДНК цинкового пальца рецептора ретиноевой кислоты. J Inorg Biochem. 1998. 71 (3–4): 147–52. pmid: 9833319.
- 61. Кристиан П., Вест КП мл. Взаимодействие между цинком и витамином А: обновленная информация. Am J Clin Nutr. 1998; 68 (2 доп.): 435С – 41С. pmid: 9701158.
- 62. Дамм К., Хейман Р.А., Умесоно К., Эванс Р.М.Функциональное ингибирование реакции ретиноевой кислоты доминантно-отрицательными мутантами рецептора ретиноевой кислоты. Proc Natl Acad Sci U S. A. 1993; 90 (7): 2989–93. pmid: 8096643; PubMed Central PMCID: PMC46222.
- 63. Ким М., Галан С., Хилл А.А., Ву В.Дж., Фелнер-Пич Х., Сонг Х.В. и др. Критическая роль микробиоты в регуляции CX3CR1 (+) мононуклеарными фагоцитами кишечных ответов Т-лимфоцитов. Иммунитет. 2018; 49 (1): 151–63 e5. pmid: 29980437; PubMed Central PMCID: PMC6051886.
- 64.Афган Э., Бейкер Д., Батут Б., ван ден Бик М., Бувье Д., Чех М. и др. Платформа Galaxy для доступных, воспроизводимых и совместных биомедицинских анализов: обновление 2018 г. Nucleic Acids Res. 2018; 46 (W1): W537 – W44. pmid: 297
- 65. Бенджамин Дж. Л., Самптер Р. Мл., Левин Б., Хупер Л. В.. Кишечная эпителиальная аутофагия необходима для защиты хозяина от инвазивных бактерий. Клеточный микроб-хозяин. 2013. 13 (6): 723–34. pmid: 23768496; PubMed Central PMCID: PMC3755484.
- 66. Каллахан Б.Дж., Макмерди П.Дж., Розен М.Дж., Хан А.В., Джонсон А.Дж., Холмс С.П. DADA2: вывод образца с высоким разрешением из данных ампликона Illumina. Нат методы. 2016; 13 (7): 581–3. Epub 2016/05/24. pmid: 27214047; PubMed Central PMCID: PMC4
- 67. Ван Кью, Гроссмейстер Гаррити, Тидже Дж. М., Коул Дж. Р. Наивный байесовский классификатор для быстрого отнесения последовательностей рРНК к новой бактериальной таксономии. Прикладная и экологическая микробиология. 2007. 73 (16): 5261–7. Epub 2007/06/22.pmid: 17586664.
- 68. McMurdie PJ, Holmes S. phyloseq: пакет R для воспроизводимого интерактивного анализа и графики данных переписи микробиома. PLoS One. 2013; 8 (4): e61217. Epub 2013/05/01. pmid: 23630581; PubMed Central PMCID: PMC3632530.
- 69. Lozupone C, Knight R. UniFrac: новый филогенетический метод сравнения микробных сообществ. Appl Environ Microbiol. 2005. 71 (12): 8228–35. Epub 2005/12/08. pmid: 16332807; PubMed Central PMCID: PMC1317376.
вакцин | Бесплатный полнотекстовый | Системы доставки наноматериалов для мРНК-вакцин
1. Введение Пандемия COVID-19 выдвинула
мРНК-вакцины на центральное место в биотехнологической и фармацевтической промышленности. В настоящее время проводится восемь испытаний мРНК вакцин на людях под руководством BioNTech / Pfizer, Moderna, CureVac, Sanofi / TranslateBio, Медицинской школы Arcturus / Duke-NUS в Сингапуре, Имперского колледжа Лондона, Университета Чулалонгкорн в Таиланде и Providence Therapeutics [1].Примечательно, что в двух из этих испытаний были объявлены результаты промежуточных испытаний фазы 3, в которых сообщается об эффективности, обеспечивающей снижение более чем на 94% инфекции SARS-CoV-2 после 2 доз 30 мкг или 100 мкг последовательности мРНК, кодирующей иммуноген спайкового белка. доставляется в липидной наночастице [2,3]. Скорость разработки вакцины также превзошла ожидания: эти результаты были получены всего через 10 месяцев после того, как последовательность SARS-CoV-2 стала общедоступной. Этот успех является свидетельством не только способности биотехнологической и фармацевтической промышленности реагировать на неотложные и неудовлетворенные глобальные потребности, но и неотъемлемых возможностей мРНК как фармацевтического средства, в данном случае профилактической вакцины.Цель этого обзора – сделать обзор разработки систем доставки для мРНК, а затем обобщить доклинические и клинические данные о мРНК-вакцинах SARS-CoV-2 и связать их с характеристиками системы доставки, которые способствуют их успеху. Недавно было опубликовано несколько превосходных обзоров систем доставки мРНК для вакцин и терапевтических средств, предшествующих COVID-19 [4,5,6,7,8,9,10,11,12,13,14,15,16]. терапевтические средства имеют много преимуществ и несколько проблем по сравнению с другими фармацевтическими методами, включая небольшие молекулы, ДНК, олигонуклеотиды, вирусные системы и белки, включая антитела.Способность опосредовать как стимулирующие, так и ингибирующие способы действия по сравнению с олигонуклеотидами и большинством мишеней низкомолекулярных лекарственных средств, а также экспрессировать или заменять дефектные белки, расширяет круг потенциальных показаний для их использования. По сравнению с ДНК, мРНК нуждается только в доступе к аппарату цитоплазматической рибосомной трансляции, а не к ядру, и не подвергается риску геномной интеграции. По сравнению как с белками, так и с вирусными системами, производство мРНК бесклеточное, более быстрое, а белковый продукт обладает природными гликозилированными и конформационными свойствами.В сочетании с системой доставки липидных наночастиц (LNP) наноструктурные свойства мРНК LNP также имеют сходство с вирусными системами и циркулирующими эндогенными липидсодержащими хиломикронами с точки зрения их размера, липидной оболочки и, для вирусных систем, внутреннего геномный материал, который способствует их применению в качестве носителей для доставки вакцин и других терапевтических средств [17]. Проблемы, присущие платформе мРНК, заключаются в ее внутренней иммуногенности, предрасположенности к ферментативной деградации и почти ничтожном уровне поглощения клетками голой мРНК.Врожденная иммуногенность мРНК обусловлена клеточной детекцией одно- и двухцепочечной РНК толл-подобными рецепторами (TLR)), рецепторами геликазы, включая рецепторы, индуцируемые ретиноевой кислотой, ген I (RIG-I) -подобные (RLR), и др. [18,19], которые затем передают сигнал через регуляторные факторы NF-κB и интерферона (IFN) IRF3 и IRF7, которые перемещаются в ядро для связывания с промотором гена IFN типа I, вызывая экспрессию IFN типа I (IFN- α и IFN-β), сопровождаемые провоспалительными цитокинами, такими как фактор некроза опухоли-a (TNF-α), IL-6 и IL-12 [20].Секретируемые интерфероны передают сигнал через свои рецепторы и путь JAK / STAT в той же клетке и соседних клетках, чтобы активировать более 300 IFN-стимулированных генов, включая протеинкиназу PKR, в качестве общего механизма защиты от вирусов. Хотя эта активация может быть полезной для усиления иммунного ответа на мРНК-вакцины, одним из непосредственных эффектов является подавление трансляции посредством фосфорилирования PKR eIF2a, что снижает активность eIF2, ингибируя трансляцию мРНК и, таким образом, синтез белка иммуногена [21].Основным средством отмены этого врожденного иммунного ответа является замена встречающихся в природе нуклеозидов, таких как 1-метилпсевдоуридин [22] и других нуклеозидов, присутствующих в переносимой и рибосомной РНК (но обычно не в мРНК), в последовательность мРНК, что затем делает ее необнаружимой через эти сенсоры врожденного иммунитета [23,24]. Эта модифицированная нуклеозидами платформа иммуносиленцирования мРНК является основой технологий мРНК, которые недавно показали эффективность> 94% в испытаниях вакцин BioNTech / Pfizer и Moderna SARS-CoV-2, основанных на предыдущих испытаниях других патогенов, которые подробно описаны ниже.Второй подход, применяемый CureVac, – это инженерия последовательности, включающая оптимизацию кодонов и истощение уридина [25], поскольку TLR7 и TLR8 в первую очередь распознают богатые GU одноцепочечные последовательности РНК [26]. Второй проблемой для терапевтических средств мРНК является ее чувствительность к нуклеазам, примером которой является период полужизни в сыворотке 27]. Хотя химические модификации siRNA очень успешны в повышении стабильности и снижении иммуногенности [28], на сегодняшний день они не были успешными для мРНК из-за чувствительности аппарата трансляции к этим модификациям [29].Третьей проблемой для мРНК является отсутствие клеточного поглощения голой мРНК в большинстве типов клеток [30], за исключением незрелых дендритных клеток [31]. Эти две последние проблемы решаются путем включения мРНК, модифицированной нуклеозидами или созданной последовательностью, в систему доставки, которая одновременно защищает мРНК от ферментативной атаки и облегчает клеточное поглощение. Например, включение в липидные наночастицы защищает мРНК от ферментативной атаки и увеличивает поглощение и экспрессию клетками до 1000 раз по сравнению с голой мРНК при введении на животных моделях [32,33].Терапевтическая мРНК продуцируется транскрипцией in vitro (IVT) из остова плазмидной ДНК для получения полноразмерного сообщения, содержащего 5′-колпачок, 5′-нетранслируемую последовательность (UTR), открытую рамку считывания, кодирующую интересующий белок, 3 ′ UTR и полиА-хвост [4]. Природный эукариотический 5′-кэп (cap0) представляет собой инвертированный 7-метилгуанозин (m7G), связанный с первым нуклеотидом мРНК с помощью 5′-5′-трифосфата. Cap0 защищает эндогенную мРНК от нуклеазной атаки, участвует в ядерном экспорте и связывается с фактором инициации трансляции 4, чтобы начать трансляцию белка.Были идентифицированы два дополнительных 5′-кэпа (cap1 и cap2), которые содержат дополнительные метильные группы на втором или третьем рибонуклеотиде и менее иммуногенны, чем cap0 (и поэтому предпочтительны) [34]. Обычно используемый в настоящее время метод кэппинга включает процесс ко-транскрипции кэппинга, приводящий к cap1, который обладает высокой трансляцией и низкой иммуногенностью [35]. 5’UTR участвует в инициации трансляции и может содержать последовательность Козака, а также внутренний сайт входа в рибосомы для кэп-независимой трансляции [36].За открытой рамкой считывания следует 3’UTR, которая влияет на стабильность мРНК и продолжительность экспрессии белка. Хвост полиА кодируется примерно 100 остатками и помогает инициировать трансляцию и задерживать деградацию. Производство мРНК IVT должно сопровождаться тщательной очисткой для удаления ДНК и загрязнителей двухцепочечной РНК, которые являются иммуногенными [37,38]. Описанные выше мРНК могут быть модифицированы нуклеозидами или созданы без модификации нуклеозидов, но не способны к саморепликации.Самоамплифицирующаяся мРНК (самРНК), способная к репликации, также тестируется в клинических испытаниях на SARS-CoV-2 и имеет более длинные последовательности ~ 10 т.п.н., поскольку они содержат четыре дополнительно кодируемых неструктурных гена, включая РНК-зависимую РНК-полимеразу, что приводит к саморепликация внутри клеток, но не приводит к образованию инфекционных частиц, поскольку в них отсутствуют структурные гены [39]. самРНК не могут быть модифицированы нуклеозидами, поскольку эти модификации препятствуют самоамплификации. Из-за процесса амплификации для самРНК обычно используются более низкие дозы (1–10 мкг) в текущих клинических испытаниях COVID-19 по сравнению с 30–100 мкг для неамплифицирующей мРНК.Интересно, что все вышеперечисленные категории мРНК-вакцин в настоящее время проходят клинические испытания на людях на SARS-CoV-2 и суммированы в таблице 1. Все системы доставки мРНК в этих клинических испытаниях представляют собой липидные наночастицы. Точный состав Pfizer-BioNTech LNP [40] и Moderna LNP [41] был публично раскрыт, а некоторые другие – нет. Все остальные, скорее всего, подобны продукту Alnylam Onpattro ™ (описанному далее ниже), но с запатентованным ионизируемым липидом, как в случае тех, которые раскрыты.Хотя конкретный используемый ионизируемый липид может быть известен не во всех случаях, его общий класс можно понять из журналов и патентных публикаций и указан в таблице 1. До COVID-19 мРНК-вакцины использовались в доклинических и клинических исследованиях инфекционных заболеваний. в том числе грипп, зика, ВИЧ, лихорадка Эбола, бешенство, чикунгунья, малярия, генитальный герпес, toxoplasma gondii и другие. Эти исследования обобщены в ряде прекрасных недавних обзоров [4,6,16,39].2. Системы ранней доставки для мРНК-вакцин
Протамин, смесь небольших катионных белков, богатых аргинином, был использован для образования комплексов с мРНК, которые улучшили трансфекцию по сравнению с голой мРНК [62].Позже была введена смесь свободной мРНК с мРНК в комплексе с протамином [63], поскольку мРНК в комплексе с протамином частично ингибировала экспрессию белка [64]. Динамическое рассеяние света показало, что свободная мРНК имеет размер около 50 нм, в то время как комплексы протамин / мРНК находятся в диапазоне 250–350 нм [63]. Этот подход был использован CureVac для кандидата в вакцину против бешенства, CV7201, лиофилизированной, термостабильной немодифицированной мРНК, состоящей из свободной и связанной с протамином мРНК, кодирующей гликопротеин вируса бешенства (RABV-G) [65].У мышей Balb / c две дозы 10 мкг и выше индуцировали нейтрализующие титры, превышающие порог защиты ВОЗ, и введение дозы 80 мкг дважды оказывало защиту от летального внутримозгового заражения [66]. В фазе 1 испытания на людях с использованием доз 80–640 мкг, вводимых внутрикожно и внутримышечно, только подгруппа участников, получивших три дозы 80–400 мкг с использованием конкретного инъектора, достигла порогового значения титра нейтрализации ВОЗ [67]. Серьезное нежелательное явление (паралич Белла) произошло у одного участника из 101 при максимальной дозе, и 5% всех участников испытали запрошенное серьезное нежелательное явление.Общая частота всех нежелательных явлений была высокой: 97% испытывали реакции в месте инъекции, а 78% – системные нежелательные явления. Учитывая эту субоптимальную доставку мРНК в комплексе с протамином, CureVac заимствовал систему доставки липидных наночастиц от Acuitas [47,68] и продемонстрировал значительно улучшенные нейтрализующие титры при 20-кратной дозе 0,5 мкг (по сравнению с 10 мкг для мРНК в комплексе с протамином) в Balb / c мышей и в дозе 10 мкг для приматов, кроме человека [69]. Активация Т-клеточных ответов и присутствие IL-6 и TNF в дренирующих лимфатических узлах и местах инъекций указывает на роль LNP в опосредовании положительного иммунного ответа.Начато клиническое испытание (NCT03713086), промежуточные результаты которого, как ожидается, будут представлены в 2021 г. Катионная наноэмульсия (CNE) была разработана для доставки мРНК путем комбинирования катионного липида DOTAP с коммерческим адъювантом (MF59), содержащим сквален, триолеат сорбитана, и полисорбат 80 в цитратном буфере с pH 6,5 [70]. Совместное использование самоусиливающейся мРНК, кодирующей гликопротеин респираторно-синцитиального вируса (RSV-f), с соотношением NP амина (из DOTAP) к фосфату (мРНК), равным 7, привело к получению наночастиц среднего размера 129 нм.Одним из преимуществ этого подхода является возможность хранить CNE и мРНК отдельно и комбинировать их только во время использования. Доза 15 мкг, введенная дважды мышам Balb / c, вызвала нейтрализующие титры выше титров адъювантной субъединичной вакцины. Детектируемые титры нейтрализации и Т-клеточные ответы у нечеловеческих приматов были достигнуты с двумя дозами по 75 мкг. Основываясь на этой концепции, отдельная группа создала наноструктурированный липидный носитель (НЖК), который представляет собой гибрид CNE и липидной наночастицы, состоящий из жидкой масляной фазы, такой как сквален, с твердофазным липидом, состоящим из насыщенного триглицерид [71].НЖК, содержащие самоусиливающуюся мРНК, кодирующую иммуноген sika, имели размер частиц 40 нм и соотношение NP 15 и были способны генерировать защитные нейтрализующие титры у мышей C57BL / 6 после однократной инъекции такой низкой дозы, как 0,1 мкг. или 0,01 мкг.3. Полимеры для доставки мРНК
Катионные полимеры широко используются для доставки нуклеиновых кислот в течение нескольких десятилетий, включая, например, поли (L-лизин), полиэтиленимин (PEI), DEAE-декстран, поли (β-аминоэфиры) (PBAE). ) и хитозан.В их простейшем формате катионные полимеры в избытке смешиваются с нуклеиновой кислотой с образованием электростатически связанных катионных полиплексов. Хотя было разработано много полимеров, они не так развиты, как липидные наночастицы для доставки нуклеиновых кислот, и количество исследований на животных, успешно применяющих их к вакцинам, ограничено. PBAE были объединены с липидами полиэтиленгликоля (PEG) для образования наночастиц мРНК / PBAE / PEG-липидов, которые были способны к функциональной доставке мРНК в легкие после внутривенного введения мышам [72].Биоразлагаемый полимер, терполимер поли (сополимер со сложным эфиром амина) (PACE), был исследован на предмет доставки мРНК с использованием эритропоэтина в качестве репортера после внутривенного введения для доставки генов [73]. Контролируя молекулярную массу и химию концевых групп, член семейства PACE 10 кДа достиг той же эффективности трансфекции in vitro, что и TransIT, мощный, но токсичный коллоидно нестабильный коммерческий эталон большого размера. Экспрессия ЭПО in vivo при внутривенном введении 20 мкг была в пять раз сильнее, чем TransIT. Сверхразветвленные поли (бета-аминоэфиры) (hPBAE) были синтезированы для доставки мРНК в легкие путем ингаляции.Полиплексы мРНК hPBAE имели размер 137 нм и были способны трансфицировать 25% эндотелия легких при распылении и вдыхании у мышей без явной токсичности и с уровнями экспрессии в 10 раз выше, чем у разветвленного PEI [74]. Поли (амидоамин) с дисульфидной связью, pABOL, был синтезирован с молекулярной массой от 8 до 167 кДа и способен образовывать полидисперсные нанокомплексы размером около 100 нм [75]. Экспрессия люциферазы этих полиплексов in vivo с использованием репортера самоамплифицирующейся мРНК была аналогична экспрессии PEI после внутримышечного введения.При доставке мышам с иммуногеном гемагглютинина (HA) против гриппа в схеме «прайм-буст» нейтрализующие титры были самыми высокими для низкомолекулярного pABOL 8 кДа и превышали таковые для PEI. 8 кДа pABOL, доставляющий 1 мкг HA самоамплифицирующейся мРНК, также частично защищал от смертельного заражения гриппом, предотвращая смерть, но не предотвращая значительную потерю веса. Эта система pABOL была рассмотрена группой из Имперского колледжа Лондона для доставки самоусиливающегося иммуногена мРНК для SARS-CoV-2; однако доставка иммуногена SARS-CoV-2 с pABOL была в 1000 раз менее эффективна, чем доставка того же иммуногена с оптимизированной липидной наночастицей от Acuitas [59].В целом, 1 мкг самоамплифицирующейся РНК в pABOL генерировал такие же связывающие антитела и титры нейтрализации, как 0,001 мкг в оптимизированной липидной наночастице (д-р Анна Блэкни, личное сообщение). Многие другие полимерные системы способны доставлять мРНК in vitro или in vivo, но еще предстоит протестировать в контексте вакцины [76,77,78,79,80,81,82,83,84].4. Разработка липидных наночастиц для текущих клинических испытаний SARS-CoV-2
Самым ранним реагентом для трансфекции мРНК был кватернизованный катионный DOTAP в сочетании с ионизируемым и фузогенным DOPE, заимствованный из трансфекции ДНК [85] для трансфекции мРНК во множестве типы клеток [86].Несмотря на свою эффективность in vitro, постоянно катионная кватернизованная группа аммония делает эти липоплексы большого размера быстро выводимыми из кровотока и, как правило, нацеленные на легкие, а также проявляют токсичность. Предшественником сегодняшнего LNP была стабилизированная плазмидно-липидная частица (SPLP), которая была образована путем объединения фузогенного ионизируемого DOPE с кватернизованным катионным липидом DODAC, который электростатически связывал и инкапсулировал плазмидную ДНК, которую затем покрывали гидрофильным PEG для стабилизации. в водной среде и ограничивают взаимодействие белков и клеток при введении in vivo [87].ДОФЭ может быть протонирован в эндосоме после поглощения клеткой и, поскольку он имеет форму конуса, он может образовывать эндосомолитическую ионную пару с эндосомными фосфолипидами для облегчения эндосомального высвобождения, что является критическим событием для успешной доставки [17]. Затем SPLP был разработан в виде стабилизированной липидной частицы нуклеиновой кислоты (SNALP), содержащей siRNA, которая включала четыре липида: ионизируемый, а не кватернизованный катионный липид, насыщенный бислой, образующий кватернизованный цвиттерионный липид, DSPC, холестерин и PEG-липид [88] .В дополнение к электростатическому связыванию с нуклеиновой кислотой ионизируемый липид в SNALP играет роль фузогенного липида и становится протонированным в эндосоме с образованием дестабилизирующей мембрану ионной пары с эндосомным фосфолипидом. Теперь известно, что DSPC помогает формировать стабильный бислой под поверхностью PEG [89]. Холестерин играет несколько ролей, в том числе заполняет пробелы в частице, ограничивает взаимодействия LNP-белок и, возможно, способствует слиянию мембран [90]. Ионизируемый липид играет центральную роль, будучи нейтральным при физиологическом pH, таким образом устраняя любой катионный заряд в циркуляции, но становясь протонированным в эндосоме при pH ~ 6.5 для облегчения эндосомального высвобождения. Разработка первого продукта siRNA, который был клинически одобрен в 2018 году, в первую очередь был направлен на оптимизацию ионизируемого липида и, во вторую очередь, PEG-липида и соотношений четырех липидов, используемых в LNP, а также процедуры сборки и производства LNP. Было обнаружено, что оптимальное количество ненасыщенных связей в хвосте C18 обеспечивает хвост дилинолевой кислоты, связанный простыми эфирами с головной группой диметиламина [88], в соответствии с гипотезой формы молекулы [12,91].Однако введение одного линкера в хвост дилинолевой кислоты, который имел оптимизированное количество атомов углерода от головной группы диметиламина до линкера, привело к тому, что pKa ионизируемого липида в LNP была близка к 6,4 для ионизируемого липида DLin- MC3-DMA [92,93]. Последним шагом в оптимизации было регулирование мольных соотношений этих липидов до 50/10 / 38,5 / 1,5 для MC3 / DSPC / холестерина / PEG – липида. В целом, этот процесс оптимизации от DLin-DMA до DLin-MC3-DMA потребовал более 300 ионизируемых липидов для скрининга в тысячах составов и привел к 200-кратному увеличению активности и соответствующему снижению эффективной дозы для достижения стойкое подавление целевого гена> 80% и терапевтическое окно, которое позволило клиническое одобрение Onpattro ™ в 2018 году [94,95].Этот состав MC3, разработанный для siRNA, является основой для последующей разработки LNP, описанных ниже (Рисунок 1), которые теперь используются в экстренных случаях после утверждения для доставки мРНК-вакцин SARS-CoV-2. Moderna провела несколько доклинических исследований [97 , 98,99] и клинические исследования [97,100] с использованием MC3 в составе Onpattro, описанном выше, для доставки нуклеозид-модифицированных иммуногенов, кодируемых мРНК. MC3 позже был идентифицирован [42,101] как ионизируемый липид в этих исследованиях, сравнивающих новый класс ионизируемых липидов с MC3.Этот новый класс включает липид H [42], который представляет собой ионизируемый липид SM-102 [41] в мРНК-1273 продукта SARS-CoV-2 компании Moderna (таблица 2). Используя модифицированный нуклеозидами мРНК-кодируемый иммуноген для вируса Зика, MC3 LNP был способен защищать мышей с ослабленным иммунитетом, лишенных передачи сигналов интерферона типа I и II (IFN), от летального заражения одной дозой 10 мкг или двумя дозами 2 мкг в первичном -буст-дизайн [99]. Аналогичные результаты были получены на иммунокомпетентных мышах, которым предварительно вводили блокирующее антитело против ifnar1 для создания летальной модели.В серии исследований гриппа с доставкой иммуногенов гемагглютинина (НА), кодирующих нуклеозид-модифицированную мРНК, внутрикожный ввод LNP MC3 был способен полностью защищать мышей от летального заражения при однократном введении всего лишь 0,4 мкг, хотя после заражения происходила потеря веса. даже при введении до 10 мкг разовой дозы [97]. Однократная доза 50 или 100 мкг вызвала высокие титры HAI (анализ ингибирования гемагглютинации) у хорьков, как и две дозы 200 или 400 мкг у нечеловеческих приматов.У небольшого числа (23) людей, получивших дозы 100 мкг, у всех титры HAI> 40 (коррелят защиты ВОЗ) были более чем в четыре раза выше исходного уровня в начале исследования. В более крупном исследовании фазы 1 с использованием тех же самых LNP MC3, доставляющих два различных нуклеозид-модифицированных мРНК-кодируемых иммуногена НА, внутримышечная инъекция 100 мкг иммуногена h20N8 привела к тому, что 100% из 23 субъектов имели титры HAI> 40 [100]. Хотя опасных для жизни нежелательных явлений не произошло, у 3 из этих 23 субъектов возникли тяжелые нежелательные явления 3 степени.Запланированная доза 400 мкг была отменена после того, как у двух из трех субъектов возникли побочные эффекты 3 степени, что соответствовало правилам паузы в исследовании. При более низких дозах частота и тяжесть нежелательных явлений уменьшались, хотя почти каждый субъект испытал по крайней мере одно нежелательное явление. Эти исследования были многообещающими, но также подчеркнули относительно узкое терапевтическое окно для получения защитных иммунизаций в дозах, которые не вызывают проблемного числа нежелательных явлений. Это напоминает узкое терапевтическое окно предшественника MC3, DLin-DMA, которому требовалась улучшенная эффективность, чтобы снизить дозу и при этом добиться эффективного нокдауна гена.Поскольку продукты siRNA требуют повторного дозирования при хронических заболеваниях, существует опасение, что медленная деградация дилинолевого алкильного хвоста в MC3 может вызвать накопление и потенциальную токсичность при повторном дозировании. Биоразлагаемая версия MC3, Lipid 319 (Таблица 2), была получена путем замены одной из двух двойных связей в каждой алкильной цепи на первичный сложный эфир, который может легко разлагаться эстеразами in vivo [68]. Для липида 319 был отмечен период полураспада менее часа в печени, в то время как он поддерживал эффективность подавления гена в печени, аналогичную MC3.Продукты разложения были подтверждены in vivo, а также их секреция и нетоксичная природа липида 319. Это исследование липида 319 цитируется в доклинических и клинических исследованиях SARS-CoV-2 как представителя класса LNP Acuitas, используемого в BioNTech. [49] и CureVac [53,69], хотя LNP Acuitas, доставляющий самоусиливающуюся РНК в исследовании Imperial College London [60], упоминается как содержащийся в более поздней патентной заявке [59], представленной здесь Липид A9 от Acuitas (Таблица 2).Недавно идентичность ионизируемого липида Acuitas в одобренном BioNTech BNT162b2 была раскрыта [40] как ALC-0315 (таблица 2). Важным аспектом этих LNP является то, что они были разработаны путем скрининга экспрессии мРНК в печени после внутривенного введения и, возможно, еще не полностью оптимизированы для внутримышечного введения вакцин на основе мРНК. Moderna недавно разработала новый класс ионизируемых липидов для замены MC3. в первую очередь из-за вышеупомянутых проблем, связанных с медленной разлагаемостью MC3, но также с усилиями по увеличению их активности за счет обеспечения большего разветвления, чем у дилинолевого алкильного хвоста MC3 [42,101].Этот новый класс липидов имеет головную группу, ионизируемую этаноламином, связанную как с одним насыщенным хвостом, содержащим первичный разлагаемый сложный эфир, как у Maier 2013, так и со вторым насыщенным хвостом, который разветвляется после семи атомов углерода на два насыщенных хвоста C8 с использованием менее разлагаемого вторичный эфир, такой как липид 5 [101] (таблица 2), оптимизированный для внутривенного введения в печень, и аналогичный липид H [42] или SM-102, который оказался оптимальным для внутримышечного (IM) введения вакцин. Повышенное разветвление – общая черта, преследуемая Acuitas, поскольку липид A9 имеет в общей сложности пять разветвленных цепей [59] (таблица 2) vs.три для ЛНП «Модерна». Считается, что усиленное разветвление создает ионизируемый липид с более конической структурой, так что – при соединении с анионным фосфолипидом в эндосоме – проявляется большая способность разрушать мембрану в соответствии с гипотезой о форме молекулы, изложенной несколько десятилетий назад [12]. , 91]. При внутривенном введении липид 5 не обнаруживался в печени через 24 часа, в то время как MC3 присутствовал в печени в 71% от его начальной дозы, что подтверждает способность липида 5 к разложению. Липид 5 был в три раза сильнее, чем MC3 у мышей. для экспрессии люциферазы и в пять раз более эффективен у нечеловеческих приматов для hEPO после внутривенного введения.Это повышение активности соответствовало и, возможно, было вызвано увеличением эндосомального высвобождения, при этом до 15% мРНК в клетке высвобождались из эндосомы для липида 5 по сравнению с 2,5% для MC3, причем последнее было аналогично тому, что было измерено ранее. для MC3 с использованием siRNA [106]. Однако поглощение клетками в этих экспериментах по высвобождению эндосом было в четыре раза выше для MC3 по сравнению с липидом 5, так что абсолютные количества высвобожденной мРНК в цитоплазме были одинаковыми для этих двух LNP. Та же самая ионизируемая липидная библиотека была исследована при внутримышечном введении вакцин, и было обнаружено, что она разлагается и быстро удаляется из-за первичного эфира и, как правило, имеет 3-6-кратное увеличение активности с точки зрения экспрессии белка или иммуногенности по сравнению с MC3 для модифицированная нуклеозидами гриппа мРНК, кодирующая иммуноген у мышей, хотя иммуногенность у нечеловеческих приматов была идентична MC3 при первичной буст-дозе 5 мкг [42].Липид Н или SM-102 (таблица 2) был идентифицирован как оптимальный кандидат и структурно отличается от липида 5, определенного как оптимальный для внутривенного введения, только двухуглеродным замещением первичного эфира. PKa липида 5 LNP составляла 6,56, тогда как pKa липида H LNP составляла 6,68, что позволяет предположить, что небольшое увеличение pKa может быть полезным для внутримышечного введения по сравнению с внутривенным введением, хотя эта разница находится в пределах вариабельности анализа. Гистологическое исследование участков мышечной инъекции у крыс показало, что липидные H LNP привлекали меньше воспалительного инфильтрата, обогащенного нейтрофилами и макрофагами, по сравнению с MC3, что может снизить реактогенность места инъекции в испытаниях на людях [42].6. Липидоидные наночастицы
Ряд липидоподобных образований, названных липидоидами, были первоначально разработаны для доставки миРНК и впоследствии использованы для доставки мРНК. Одним из примеров является C12-200 (таблица 2), который был выбран из большого семейства липидоидов из-за его высокой эффективности в подавлении генов гепатоцитов посредством внутривенного введения [123]. Для эффективного подавления подавления генов, направляемого печенью, C12-200 объединяли с теми же липидами, что и прототип MC3 Onpattro, а именно с 50% ионизируемым липидом, 10% DSPC, 38.5% холестерина и 1,5% ПЭГ-липидов. Более позднее исследование показало, что эффективность доставки мРНК C12-200 к той же мишени печени может быть увеличена в семь раз за счет снижения процентного содержания ионизируемого липида до 35%, но увеличения массового отношения ионизируемого липида к нуклеиновой кислоте с 5 до 10 и замены ДСПК с фузогенным ненасыщенным ДОФЭ [103]. Интересно, что этот оптимизированный препарат увеличил экспрессию мРНК в семь раз, но не изменил эффективность подавления siRNA. C12-200 в этом составе также изучался для мРНК-опосредованной белковой заместительной терапии у мышей и нечеловеческих приматов [124], но при подкожном введении было обнаружено сильное воспалительное действие при гистологическом исследовании [109].C12-200 представляет собой небольшой дендример с пятью алкильными цепями и пятью атомами азота, три из которых, по-видимому, могут протонироваться, согласно анализу ионизации, который может быть выполнен с помощью коммерческого программного обеспечения, такого как ACDLabs Percepta (Таблица 2). Другой липидоид-дендример, 5A2-SC8, был идентифицирован на предмет высокой эффективности доставки siRNA в печень в отдельном процессе скрининга, а также имеет пять атомов азота и пять коротких алкильных цепей [125] (Таблица 2). Липидоид 5A2-SC8 имел низкую эффективность для доставки мРНК, если параметры его состава не были аналогичным образом изменены путем снижения мольной доли ионизируемого липида до 24%, использования DOPE вместо DSPC и увеличения других пропорций липидов, но, в то же время, увеличения весовое отношение 5A2-SC8 к мРНК – 20 [104].Эти изменения состава, по-видимому, необходимы для того, чтобы эти липидоиды дендримерного типа были эффективными носителями для доставки мРНК, возможно, потому, что они имеют многопротонные головные группы и структуру дендримеров. Другой модифицированный дендример с очень высокой молекулярной массой был использован для доставки самоусиливающейся мРНК, кодирующей иммуногены против гриппа, лихорадки Эбола и toxoplasma gondii, и было показано, что он защищает мышей от всех трех патогенов после однократной очень высокой дозы 40 мкг или первичной иммунизации. Инъекции 4 мкг, что также является высокой дозой для репликации РНК [126].Интересным недавним открытием для ряда липидоидов было то, что дополнительная одноуглеродная ветвь на конце каждой из четырех алкильных цепей этого небольшого трехазотного дендримера увеличивала эффективность экспрессии в печени более чем в 10 раз по сравнению с другими липидоидами в организме. этот класс [105]. Не было корреляции этой повышенной активности с LNP pKa, но была корреляция с абсолютной флуоресценцией красителя TNS при pH 5, что указывает на то, что амплитуда протонирования в эндосоме коррелирует с экспрессией мРНК, предположительно за счет облегчения высвобождения эндосом. .Можно также ожидать, что дополнительная углеродная ветвь создаст более конусообразную структуру и, следовательно, большее разрушение мембраны в соответствии с гипотезой формы молекулы [12,91].7. Интраназальная доставка мРНК липидных наночастиц
Для мРНК-вакцин в подавляющем большинстве исследований и всех текущих клинических испытаний использовалось внутримышечное введение, в то время как внутрикожное введение также изучается, обычно параллельно с внутримышечным путем. Несмотря на то, что на сегодняшний день не очень развито, интраназальное введение вакцин дает такие преимущества, как активация иммунитета слизистой оболочки, что очень важно для респираторных патогенов, и меньшая зависимость от иммунизации с помощью иглы.MC3 LNP был использован для доставки модифицированной нуклеозидом последовательности размером 4,5 т.п.н., кодирующей трансмембранный регулятор проводимости при муковисцидозе (CFTR) [127]. Репортер люциферазы был успешно экспрессирован в легких путем внесения в ноздри дозы 12 мкг для спонтанной ингаляции. Затем у трансгенных мышей с нокаутом CFTR применение LNP мРНК CFTR восстанавливает опосредованную CFTR секрецию хлоридов в проводящем эпителии дыхательных путей в течение по меньшей мере 14 дней. LNP MC3 были снова использованы в последующем исследовании доставки в носовой эпителий с использованием репортера люциферазы.Здесь было исследовано использование распылителя для создания аэрозоля с использованием LNP; однако аэрозолизация приводила к агрегации LNP, увеличивая их размер вдвое до 170 нм и приводя к потере трансфекционной активности in vitro [128]. В результате исследователи решили внедрить LNP в ноздри и обнаружили, что репортер люциферазы в основном экспрессируется в назальном эпителии с некоторой дополнительной трансфекцией в эпителии легких. Это исследование выявило проблемы доставки, связанные с получением однородных и высоких уровней трансфекции мРНК в носовом и легком эпителии.Интраназальная доставка мРНК LNP была также достигнута с использованием более старой системы DOTAP / холестерин / ПЭГ-липид в сочетании с протамином для инкапсуляции немодифицированного мРНК-экспрессирующего цитокератина 19, чтобы спровоцировать клеточный иммунный ответ и замедлить рост опухоли в ксенотрансплантате рака легкого Льюиса. модель на мышах [129]. Эти LNP были большими, размером 170 нм, катионными, с дзета-потенциалом 10 мВ и способностью трансфицировать 30% дендритных клеток DC2.4 in vitro. После того, как опухоль ксенотрансплантата была установлена, 10 мкг LNP мРНК, кодирующей цитокератин 14, вводили интраназально в 100 мкл PBS один раз в неделю в течение 3 недель, что приводило к очень значительному снижению роста объема опухоли по сравнению с контролем PBS.Модифицированная нуклеозидами мРНК, кодирующая антиген гриппа h4N2-HA, была доставлена в другом исследовании с использованием DOTAP / DOPE / PEG – липидных LNP, а также той же LNP-несущей маннозы в качестве лиганда для облегчения захвата макрофагами и дендритными клетками [130]. ]. Эти LNP также были большими, при 200 нм, положительно заряженными, с дзета-потенциалом 15 мВ и способны экспрессировать люциферазу в легких после интраназальной инстилляции дозы 12 мкг. Две 12 мкг дозы LNP h4N2-HA вводили интраназально на 0 и 3 неделях мышам C57BL / 6, которым впоследствии вводили летальную дозу h2N1.Оба LNP, содержащие кодируемый мРНК иммуноген, были способны к полной защите, в то время как LNP, покрытые маннозой, оказались более способными также блокировать потерю веса. Кажется возможным интраназальное введение LNP, хотя дозы были выше, чем сообщалось для внутримышечного введения, и метод введения или аэрозолизации все еще требует доработки.8. Доставка мРНК LNP, кодирующих антитела
В настоящее время на рынке присутствует более 70 моноклональных антител (mAb), глобальные продажи которых составляют 125 миллиардов долларов США.Возможность использования антител, кодируемых мРНК, может принести некоторые преимущества, в том числе эндогенный синтез белка с использованием нативных посттрансляционных модификаций и упрощенный метод производства, который не требует культивирования клеток и обширной очистки и характеристики белкового продукта [8]. Возможность доставки mAb, кодируемых мРНК, для пассивной иммунизации была показана путем инкапсуляции очищенных модифицированных нуклеозидами мРНК, кодирующих легкую и тяжелую цепи VRC01, широко нейтрализующего антитела против ВИЧ-1, в LNP Acuitas [131].Мыши Balb / c, получавшие внутривенную дозу 30 мкг, которая будет нацелена на гепатоциты, экспрессировали mAb в течение более чем недели, при этом уровни в сыворотке достигли 150 мкг / мл, что было выше, чем при прямой инъекции 600 мкг mAb с еженедельным введением. инъекции, способные поддерживать постоянный уровень в сыворотке крови выше 40 мкг / мл. Как 30 мкг, так и 15 мкг инъекции мРНК LNP могут защитить гуманизированных мышей CD34-NSG от заражения ВИЧ-1 через 24 часа, как показали анализы сыворотки на вирусные копии РНК через 2 недели после заражения.Возможность терапевтических немодифицированных антител, кодируемых мРНК, была подтверждена в исследовании CureVac, также с использованием LNP Acuitas [25], где были выбраны mAb IgG с широкой нейтрализующей способностью для различных штаммов бешенства, а также тяжелая цепь. – нейтрализующий агент против ботулотоксина только на основе VH-домена (VHH) [132]. Также был получен ритуксимаб, кодируемый мРНК, нацеленный на CD20, золотой стандарт для лечения неходжкинской лимфомы. Здесь в исследованиях на животных использовался LNP Acuitas, нацеленный на гепатоциты путем внутривенного введения.Однократное введение 40 мкг мышам вызывало уровень IgG в сыворотке чуть выше 10 мкг / мл, который постепенно снижался до 1 мкг / мл через 1 месяц. Та же доза однодоменного нейтрализующего агента VHH давала в 10 раз более высокие уровни, но с гораздо более коротким периодом полураспада, составляющим несколько дней, из-за отсутствия области Fc. Однократное внутривенное введение 40 мкг мышам также могло полностью защитить мышей при введении либо за 1 день до, либо через 2 часа после смертельного заражения вирусом бешенства. Точно так же доза 40 мкг через 6 часов после заражения летальным ботулиническим токсином полностью защитила животных.Третья модель заражения, в которой клетки В-клеточной лимфомы Raji-luc2 прививали внутривенно и позволяли расти в течение 4 дней, а затем вводили 10 или 50 мкг ритуксимаба, кодируемого мРНК, в LNP Acuitas пять раз в течение 18 дней, в результате все животных, переживших эту смертельную опухолевую инфекцию, и доза 50 мкг была способна полностью остановить рост опухоли. Биспецифические антитела, которые привлекают Т-клетки к опухолевым клеткам, также кодировались в модифицированных конструкциях мРНК и доставлялись in vivo с использованием коммерческого реагента для трансфекции TransIT, который не является столь же эффективны, как и существующие LNP для доставки в печень [133].Конструкция мРНК могла поддерживать циркулирующие и биоактивные биспецифические антитела в течение более 6 дней, в то время как та же самая доза белков-биспецифических антител в 5 мкг была снижена до уровня, близкого к исходному, через один день. Второе исследование также было проведено с использованием биспецифических антител в формате VHH, где один VHH, который связывает консервативный эктодомен 2 матричного белка гриппа A (M2e), был генетически связан со вторым VHH, который специфически связывается с рецептором Fcγ мыши IV (FcγRIV). для привлечения клеток врожденного иммунитета, экспрессирующих FcγRIV, к инфицированным гриппом клеткам, экспрессирующим M2e [134].Эти модифицированные нуклеозидами конструкции мРНК доставляли с использованием LNP DOTAP / холестерин путем интратрахеальной инстилляции в легкие мыши и через 4 часа заражали летальной дозой вируса гриппа. Большинство мышей (80%) были защищены от смертельной дозы, хотя они действительно испытали значительную потерю веса, а наночастицы мРНК DOTAP / холестерина привели к временному притоку гранулоцитов в легкие в сочетании с увеличением сывороточного цитокина IL-6. уровни. Наконец, мощное нейтрализующее антитело, идентифицированное в В-клетках пережившего инфекцию чикунгуньи, было закодировано в модифицированной нуклеозидом конструкции мРНК, доставленной в LNP, возможно, содержащую MC3 или липид 5 [135].Защита от вирусного заражения, введенного за 24 ч до инфузии мышам, была достигнута при 0,5 мг / кг (10 мкг) внутривенно для мРНК-кодируемого mAb, в то время как требовалось 2 мг / кг белкового mAb. Терапевтическая защита путем инфузии через 4 часа после инфицирования была получена у мышей при очень высоких дозах 10 мг / кг (200 мкг). Исследования на приматах, не относящихся к человеку, показали, что очень высокие дозы до 3 мг / кг (9 мг) вызывают минимальную временную токсичность, включая увеличение селезенки и повышение уровня CCL2 в сыворотке крови, а антитело можно было обнаружить в течение нескольких месяцев после инфузии.Основываясь на этих результатах, Moderna инициировала фазу 1 испытания на людях и объявила о положительных результатах, когда инфузии 0,1 и 0,3 мг / кг хорошо переносились и привели к уровням mAb в сыворотке в диапазоне 1–14 мкг / мл, которые, как ожидается, будут защищает от вируса чикунгунья до 16 недель после однократного приема [136].9. Сборка и структура липидных наночастиц
Современные методы производства липидных наночастиц мРНК используют микрожидкостное смешение или смешение Т-образного соединения для быстрого объединения фазы этанола, содержащей гидрофобные липиды, и водной фазы, которая содержит мРНК в буфере, таком как уксусный кислоты, при pH 4 (рис. 2).Известные методы, такие как гидратация тонкой пленки и инъекция этанола, обычно не используются, поскольку они приводят к получению гетерогенных наночастиц большего размера с более низкой эффективностью инкапсуляции мРНК, которые трудно масштабировать [95]. Преимущество микрожидкостного смешения заключается в возможности смешивать очень небольшие объемы липидов в этаноле с мРНК в водных растворах (десятки мкл), так что возможен скрининг многих компонентов и параметров рецептуры. Т-смешивание, с другой стороны, является общим методом выбора для коммерческого производства больших партий мРНК LNP, например, в текущих клинических испытаниях.Недавняя публикация продемонстрировала, что оба метода приводят к LNPs схожего размера и морфологии [96]. Быстрое смешивание двух растворов является ключевым для ограничения размера получаемых частиц до 137]. Сборка и формирование LNPs из этих растворов происходит под действием как гидрофобных, так и электростатических сил, как показано на рисунке 2. Четыре липида (ионизируемый липид, DSPC, холестерин, ПЭГ-липид) изначально растворимы в этаноле без каких-либо противоионов, поэтому что ионизируемый липид непротонирован и электрически нейтрален (рис. 2А).Один объем липидсодержащего раствора этанола обычно смешивают с тремя объемами мРНК в водно-ацетатном буфере с pH = 4, так что, когда липиды контактируют с водным буфером, они становятся нерастворимыми в растворителе 3: 1 вода / этанол и ионизируемом липиде. становится протонированным и положительно заряженным, что затем заставляет его электростатически связываться с отрицательно заряженным фосфатным остовом мРНК (рис. 2В), в то время как липиды становятся нерастворимыми, образуя липидную частицу, инкапсулирующую мРНК в основном в водной суспензии.Ключевым компонентом в этом процессе является ПЭГ-липид, поскольку цепь ПЭГ является гидрофильной и, таким образом, покрывает частицу, а также определяет ее конечный термодинамически стабильный размер. Изменяя мольную долю PEG, размер LNP можно предсказуемо контролировать, например, от 100 нм при мольной доле 0,5% до 43 нм при 3% мольной доле PEG – липид [89]. Недавнее критически важное наблюдение состояло в том, что структура и размер LNP продолжают развиваться после смешивания, когда суспензия мРНК LNP либо разбавляется в водном буфере, либо диализуется против водного буфера для повышения pH и удаления этанола [96].Первоначальное смешивание водной и липидной фаз дает pH около 5,5, протонируя ионизируемый липид, который имеет рКа LNP около 6,5 и обеспечивает связывание и инкапсуляцию мРНК (рис. 2B, C). Последующее повышение pH путем разбавления, диализа или фильтрации в тангенциальном потоке нейтрализует ионизируемый липид до тех пор, пока он не станет в основном разряженным при pH 7,4 (рис. 2D). Когда ионизируемый липид становится нейтральным, он также становится менее растворимым, что приводит к образованию более крупных гидрофобных липидных доменов, которые управляют процессом слияния LNP, так что их размер увеличивается, и ядро LNP становится аморфной электронно-плотной фазой, в основном содержащий ионизируемый липид, связанный с мРНК.Было подсчитано, что до 36 пузырьков могут сливаться с образованием только одного конечного LNP во время этого процесса (Figure 2C, D). Слияние было продемонстрировано с использованием пар FRET, и в дальнейшем было замечено, что роль ПЭГ-липид проявляется во время этого процесса, поскольку добавление ПЭГ-липида после смешивания контролировало конечный размер LNP так же, как добавление ПЭГ-липида перед смешиванием [138 ]. Это и другое исследование с использованием методов рассеяния нейтронов также показало, что DSPC образует бислой прямо под периферическим слоем PEG в LNP, центральным ядром которого является в первую очередь ионизируемый липид, связанный с мРНК (рис.


