Алюминий гальванических пар – Энциклопедия по машиностроению XXL
Алюминий нельзя применять в случае прямого контакта с водопроводной водой (рН=5-ь9) без ее и-мической обработки и добавления ингибитора коррозии. Он может применяться при прямом контакте с дистиллированной или деионизированной водой, содержащей ингибитор коррозии при условии отсутствия контакта с железом или медью, которые, обладая менее положительным электродным потенциалом, образуют с алюминием гальванические пары. Кроме того, алюминий может работать с безводными органическими жидкостями. Скорость воды и водных растворов в трубопроводах не должна превышать 1,25 м/с. [c.157]По отношению к большинству металлов алюминий имеет отрицательный электрохимический потенциал и, находясь в контакте с ними, образует гальванические пары, что в присутствии влаги способствует развитию электрохимической коррозии.
Гальванические эффекты. При наличии электрического контакта титана с такими обычными металлами, как сталь или алюминий, может происходить локальная коррозия анодного элемента этой гальванической пары. Разрушение наблюдается непосредственно в месте соединения или около него и протекает в периоды, когда на поверхности металла присутствует влажная солевая пленка. Соединение титана с медью несколько усиливает коррозию меди. В гальванической паре с нержавеющей сталью влияние титана минимально. Данные о коррозии гальванопар представлены в табл. 46. [c.117]
Гальванические эффекты. Опыт применения титановых сплавов в морских условиях показывает, что их следует использовать только в тех случаях, когда могут быть оправданы затраты, связанные с более высокой по сравнению со сталью и алюминием стоимостью. Морских конструкций, выполненных целиком из титановых сплавов, пока не существует, поэтому титан всегда соседствует в конструкциях с другими металлами.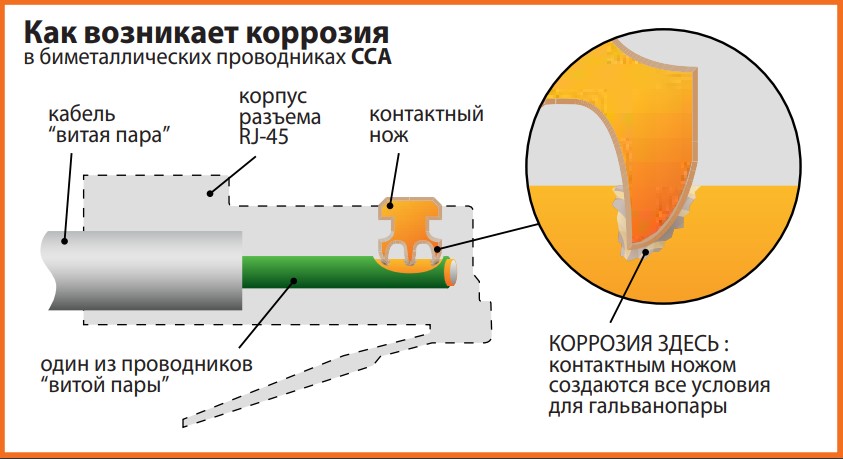
Магний является наиболее анодным металлом в электрохимическом ряду напряжений, поэтому в гальванической паре с другим металлом подвергается ускоренной коррозии. При этом может разрушаться и второй элемент пары. Например, при испытаниях на стенде, расположенном в 25 м от океана в Кюр-Бич, магний, соединенный с алюминием, подвергался анодному разрушению. На алюминии происходила щелочная коррозия, являющаяся результатом катодной реакции.
Обзор более 70 публикаций, посвященных либо коррозионным испытаниям алюминия в морской воде, либо практическому опыту использования алюминия в опреснительных установках, дан в работе Тейлора [247]. Имеющиеся данные показывают, что наиболее высокой стойкостью в морской воде обладают алюминиевые сплавы, содержащие 1—3% Mg (например, сплав 5052). Важно избегать образования гальванических пар алюминия со сталью или сплавами на основе меди. Описаны методы уменьшения питтинговой коррозии с помощью входных фильтров и ловушек, задерживающих ионы тяжелых металлов. Прекрасная коррозионная стойкость, низкая стоимость и хорошая обрабатываемость делают алюминиевые сплавы наиболее удобным материалом для изготовления оборудования опреснительных установок. [c.203]
Контактный способ осаждения цинка представляет собой цинкование без внешнего источника тока за счет работы гальванической пары, образующейся при погружении стальных деталей в контакте с алюминием в раствор цинковой соли.
 Цинк при этом вытесняется алюминием. Покрытия, полученные данным способом, отличаются незначительной толщиной, низкими защитными свойствами и используются только для обработки неответственных деталей.
[c.67]
Цинк при этом вытесняется алюминием. Покрытия, полученные данным способом, отличаются незначительной толщиной, низкими защитными свойствами и используются только для обработки неответственных деталей.
[c.67]По второму методу — защита электрохимическая полной изоляции стали от внешней среды при этом не требуется. Сущность его заключается в нанесении на поверхность стали металла, обладающего более отрицательным электродным потенциалом в данной среде, чем сталь (например, цинк, алюминий, сплав или смесь цинка с алюминием). Такое покрытие, изолируя сталь от внешней среды, одновременно защищает ее электрохимически, т. е. в случае повреждения защитного слоя (наличие пор, трещин и т. п.) или влажной пленки образуется гальваническая пара, в которой эти покрытия являются анодом, а оголенная сталь служит катодом. При работе такой гальванической пары анод подвергается постепенному растворению, а сталь остается в сохранности.
Большое практическое значение имеет вопрос о возможности гальванической коррозии в местах контакта алюминия и меди. Если область контакта может быть увлажнена, возникает местная гальваническая пара с довольно высоким значением э. д. с., причем полярность этой пары такова, что на внешней поверхности контакта ток идет от алюминия к меди, и алюминиевый проводник может быть сильно разрушен коррозией. Поэтому места соединения медных
[c.207]
Если область контакта может быть увлажнена, возникает местная гальваническая пара с довольно высоким значением э. д. с., причем полярность этой пары такова, что на внешней поверхности контакта ток идет от алюминия к меди, и алюминиевый проводник может быть сильно разрушен коррозией. Поэтому места соединения медных
[c.207]
Кроме того, алюминий легко разъедается большинством электролитов, особенно в тех случаях, когда он образует в контакте с более положительным металлом (например, металлом покрытия) гальваническую пару. [c.291]
Однако наличие прочной оксидной пленки значительно затрудняет пайку и создает большое переходное сопротивление в контактах. При действии влаги в местах контакта алюминия с медью образуется гальваническая пара с высоким значением э. д. с. и ток идет от алюминия к меди. При этом алюминиевый проводник сильно разрушается коррозией. [c.261]
При монтаже свинцовой соединительной муфты на кабеле с алюминиевой оболочкой также образуется контактная гальваническая пара свинец—алюминий, в которой алюминий является анодом, что может вызвать разрушение алюминиевой оболочки через несколько месяцев после монтажа на кабеле свинцовой соединительной муфты.
Как было указано, растворимость кремния в алюминии при комнатной температуре незначительна и при охлаждении кремний выделяется в свободном виде. Силумины обладают высокими антикоррозионными свойствами не только по причине небольшой э. д. с., возникающей в гальванической паре Л1—51, но, главным образом, вследствие склонности кремния в присутствии кислорода покрываться, так же как и алюминий, защитной пленкой. [c.152]
Области применения цинковых покрытий обширны. Ими пользуются для защиты резервуаров от действия бензина керосина, воды и других агрессивных жидкостей, для защиты труб, арматуры, крепежных деталей. С помощью цинковых покрытий предотвращают контакты между сталью, медью и другими металлами, способными образовывать гальванические пары, приводящие к разрушению металла.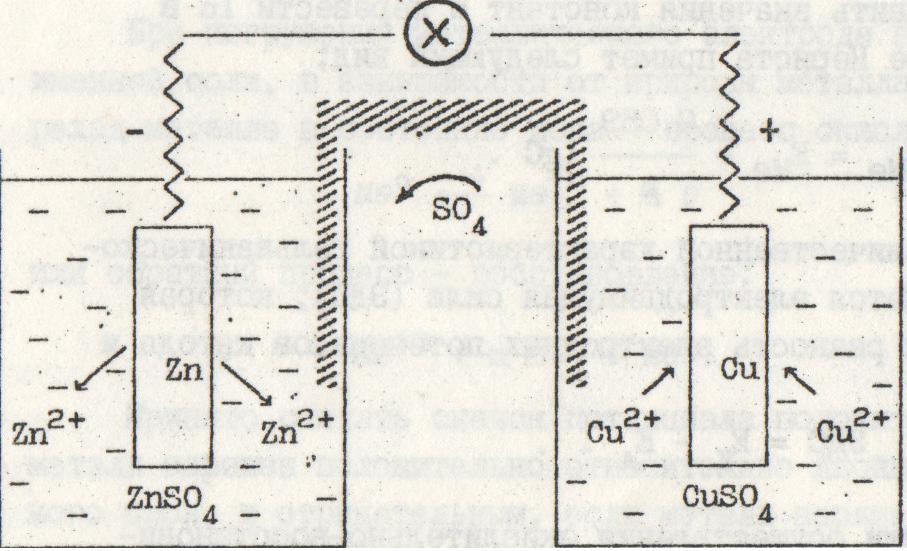
Важное практическое значение имеет вопрос о возможности гальванической коррозии в местах контакта алюминия и меди. Если область контакта подвергается действию влаги, то возникает местная гальваническая пара с довольно высоким значением э. д. с., причем полярность этой пары такова, что на внешней поверхности контакта ток идет от алюминия к меди, вследствие чего алюминиевый проводник может быть сильно разрушен коррозией. Поэтому места соединения медных проводников с алюминиевыми всегда должны тщательно защищаться от увлажнения (покрытием лаками и тому подобными способами).
Алюминий имеет отрицательный потенциал от —0,6 до —1,6 в (величина потенциала зависит от характера и агрессивности среды). При нахождении в агрессивной среде металла с более высоким потенциалом образуется гальваническая пара, в которой алюминий и другой металл являются электродами, а среда — электролитом. При прохождении тока разрушается металл с более отрицательным потенциалом (анодный).
[c.25]
При прохождении тока разрушается металл с более отрицательным потенциалом (анодный).
[c.25]
При увлажнении мест соединения алюминиевых проводов с проводами из других металлов могут образоваться гальванические пары. При этом алюминиевый провод будет разрушаться возникающими местными гальваническими токами. Чтобы избежать образования гальванических пар, места соединений тщательно защищают от влаги (например, лакированием). Чем выше химическая чистота алюминия, тем лучше он сопротивляется коррозии. [c.103]
Большое практическое значение имеет вопрос о возможности гальванической коррозии в местах контакта алюминия и меди. Если область контакта может быть увлажнена, возникает местная гальваническая пара с довольно высоким значением э. д. с., причем полярность этой пары такова, что [c.222]
Кроме этого, для алюминиевых покрытий характерен эффект само-залечивания, имеющий электрохимическую природу. Сущность его в следующем. Если покрытие не сплошное, т. е. имеются незащищенные участки основного металла, или же имело место механическое отслоение основного металла, то в результате образования гальванической Пары активизируется анодное растворение алюминия. Электрохимический процесс сопровождается отложением продуктов коррозии именно на участках несплошности, где формируется достаточно плотная защитная пленка. Таким образом, композиция основной металл – покрытие самопроизвольно залечивает дефектные участки.
Сущность его в следующем. Если покрытие не сплошное, т. е. имеются незащищенные участки основного металла, или же имело место механическое отслоение основного металла, то в результате образования гальванической Пары активизируется анодное растворение алюминия. Электрохимический процесс сопровождается отложением продуктов коррозии именно на участках несплошности, где формируется достаточно плотная защитная пленка. Таким образом, композиция основной металл – покрытие самопроизвольно залечивает дефектные участки.
В кислых растворах поведение гальванической пары из двух разнородных металлов, один из которых титан, может отличаться от описанного выше. Титан иногда может становиться анодным элементом по отношению к нержавеющей стали и даже к алюминию [24]. По этой причине в средах, с которыми приходится сталкиваться на химических предприятиях, обычно принимают меры для изоляции титана от соседних деталей, изготовленных из других металлов. [c.193]
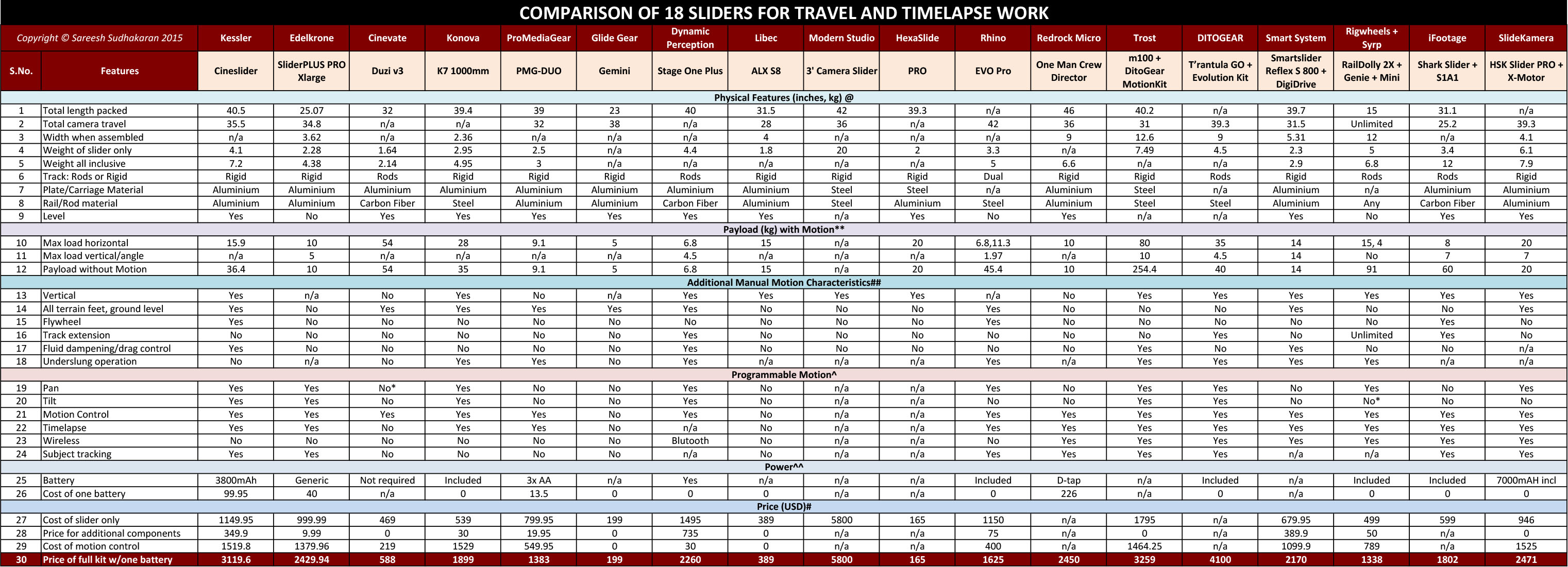
Железо и алюминий. Гальваническая пара алюминий— железо в рассоле хлористого кальция успешно защищается введением 2,4 г/л Na rOj [21]. Без замедлителя алюминий гальванически защищает железо. Но в технической водопроводной воде добавка Naj rO переносит коррозию с алюминия на сталь, находящуюся с ним в контакте [24]. В рассоле хлористого кальция при низких температурах Nag rjOy хорошо предохраняет от коррозии как сталь, так и алюминий.
[c.298]
Гальваническая пара алюминий— железо в рассоле хлористого кальция успешно защищается введением 2,4 г/л Na rOj [21]. Без замедлителя алюминий гальванически защищает железо. Но в технической водопроводной воде добавка Naj rO переносит коррозию с алюминия на сталь, находящуюся с ним в контакте [24]. В рассоле хлористого кальция при низких температурах Nag rjOy хорошо предохраняет от коррозии как сталь, так и алюминий.
[c.298]
Следовательно, железо, имеющее в морской воде коррозионный потенциал около —0,4 В, непригодно для использования в качестве протектора для катодно защищаемого алюминия, в отличие от цинка, который имеет более подходящий коррозионный потенциал, близкий —0,8 В. Для нержавеющей стали 18-8 критический потенциал в 3 % растворе Na l равен 0,21 В, для никеля — около 0,23 В. Следовательно, контакт этих металлов с имеющими соответствующую площадь электродами из железа или цинка может обеспечить им в морской воде эффективную катодную защиту, предупреждающую питтинговую коррозию. Элементы создаваемых конструкций (например, кораблей и шельфовых нефтедобывающих платформ) иногда специально проектируют таким образом, чтобы можно было успешно использовать гальванические пары такого рода.
[c.227]
Элементы создаваемых конструкций (например, кораблей и шельфовых нефтедобывающих платформ) иногда специально проектируют таким образом, чтобы можно было успешно использовать гальванические пары такого рода.
[c.227]
Создание гальванической пары из мартенситной нержавеющей стали и электроотрица[тельного металла также может приводить к разрушениям в результате выделения водорода на катодной поверхности стали. Подобные явления наблюдали при лабораторных испытаниях [52]. Как указывалось в разд. 7.4, на практике отмечали случаи разрушения судовых винтов из мартенситной нержавеющей стали. Эти винты самопроизвольно растрескивались вскоре после того, как их приводили в контакт с алюминием в условиях прибрежной атмосферы. Аналогичным образом вели себя винты из упрочненной мартенситной нержавеющей стали, находившиеся в контакте со стальным корпусом корабля они разрушались вскоре после начала эксплуатации. Некоторые марки аустенитных нержавеющих сталей 18-8, подвергнутые
[c.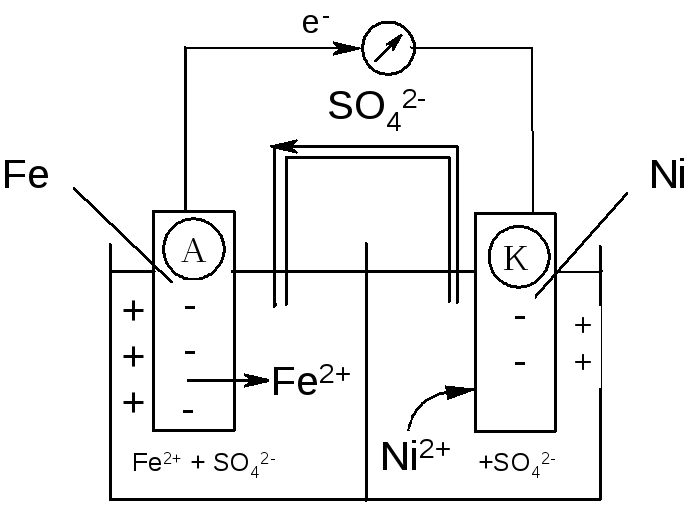 319]
319]
Влияние легирующих добавок в этих средах зачастую иное, чем в водных растворах- возникающие гальванические пары и внешняя поляризация не влияют на скорость коррозии скорости коррозии одинаковы в паровой фазе и в кипящей жидкости. Все эти факты являются сильными аргументами в пользу того, что коррозия протекает не по электрохимическому механизму . Механизм процесса с участием свободных радикалов подтверждается также данными по аналитическому обнаружению радикалов -СС1з, появление которых, видимо, приводит к красному окрашиванию I4 при взаимодействии его с алюминием. Об этом же свидетельствует легкость, G которой добавки многих органических веществ подавляют реакцию (свободные радикалы очень реакционноспособны). [c.349]
Протекторная эащита. Принцип защиты катодной поляризацией с помощью протекторов состоит в образовании гальванической пары, катодом в которой служит защищаемое сооружение, а анодом — протектор (рис. 32). Металл протектора должен иметь электродный потенциал, более отрицательный, чем электродный потенциал загцищаемого металла.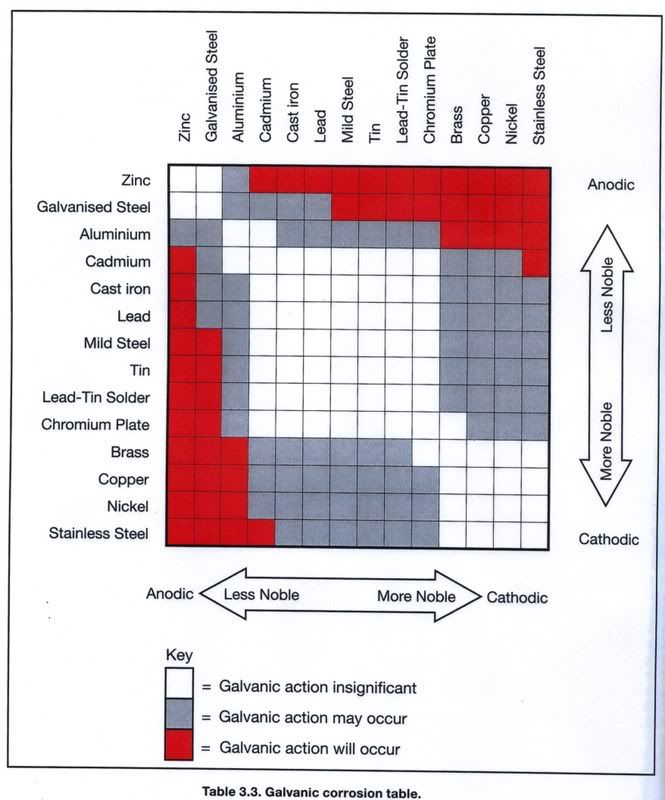 Так, по отношению к железу или его сплавам, имеющим электродный потенциал около минус 0,44 В по водородному электроду, в качестве протекторов можно использовать магний, обладающий электродным потенциалом минус 2,37 В, алюминий — минус 1,66 В, цинк — ми- ус 0,76 В. При протекторной защите разрушается протектор.
[c.77]
Так, по отношению к железу или его сплавам, имеющим электродный потенциал около минус 0,44 В по водородному электроду, в качестве протекторов можно использовать магний, обладающий электродным потенциалом минус 2,37 В, алюминий — минус 1,66 В, цинк — ми- ус 0,76 В. При протекторной защите разрушается протектор.
[c.77]
Алюминий весьма активно окисляется и покрывается тонкой оксидной пленкой с большим электрическим сопротивлением (см. 6-20). Эта пленка предохраняет алюминий от дальнейшей коррозии, но создает большое переходное сопротивление в местах контакта алюминиевых проводов и делает невозможной пайку алюминия обычными методами. Для пайки алюмнния применяются специальные пасты-припои или используются ультразвуковые паяльники. В местах контакта алюминия и меди возможна гальваническая коррозия. Если область контакта подвергается действию влаги, то возникает местная гальваническая пара с довольно высоким значением ЭДС, причем полярность этой пары такова, что на внешней поверхности контакта ток идет от алюминия к меди и алюминиевый проводник может быть сильно разрушен коррозией. Поэтому места соединения медных проводников с алюминиевыми должны тщательно защищаться от увлажнения (покрытием лаками и тому подобными способами).
[c.202]
Поэтому места соединения медных проводников с алюминиевыми должны тщательно защищаться от увлажнения (покрытием лаками и тому подобными способами).
[c.202]
Легирование матрицы в углеалюминиевых композициях с целью повышения коррозионной стойкости материала пока не дало положительных результатов. Вероятно, наличие в таких материалах гальванической пары алюминий—углерод является превалирующим фактором, определяющим поведение материала. В связи с этим в настоящее время ведутся поиски покрытий и технологии нанесения их на углеродные волокна. Такие покрытия, наносимые равномерно сплошным тонким слоем (из газовой фазы или химическим методом), имеют целью предотвратить непосредственный контакт между алюминием и углеродным волокном. В качестве таких покрытий рассматриваются, например, карбид титана, диборид титана, карбид кремния и др. (патент Швейцарии № 528596, 1970 г.). [c.227]
В некоторых случаях образование гальванических пар дает положительный эффект. Например, питтииговая и общая коррозия алюмн-нпевых сплавов уменьшается при их соединении с алюминиевыми пли цинковыми анодами. В испытаниях, проведенных ВМС США, использование алюминиевого (или цинкового) растворимого аиода приводило к уменьшению средней глубины 5 наибольших питтингов на некоторых сплавах при 12-мес экспозиции в морской воде от 1,0 до 0,08 мм (табл. 57). Аноды из магния применять не следует, так как более высокий потенциал приведет к перезащите и повышению pH среды около катода. В более щелочной среде амфотерный алюминий будет корродировать.
[c.142]
Например, питтииговая и общая коррозия алюмн-нпевых сплавов уменьшается при их соединении с алюминиевыми пли цинковыми анодами. В испытаниях, проведенных ВМС США, использование алюминиевого (или цинкового) растворимого аиода приводило к уменьшению средней глубины 5 наибольших питтингов на некоторых сплавах при 12-мес экспозиции в морской воде от 1,0 до 0,08 мм (табл. 57). Аноды из магния применять не следует, так как более высокий потенциал приведет к перезащите и повышению pH среды около катода. В более щелочной среде амфотерный алюминий будет корродировать.
[c.142]
При наличии электрического контакта с такими конструкционными металлами, как сталь или алюминий, на катодной поверхности тантала может выделяться водород. В кислых растворах это вызывает охрупчивание тантала [112], но в щелочной морской воде опасность такого разрушения, по-видимому, гораздо меньше. В гальванических парах с распространенными конструкционными металлами тантал подчиняется таким же закономерностям, как и титаГн. [c.161]
[c.161]
Специалисты из лаборатории Баттел-Колумбус Университета штата Пенсильвания и Управления охраны окружающей среды исследовали в замкнутых контурах с морской водой коррозию сплавов на основе алюминия в контакте со сплавом Монель 400, латунью, титаном и нержавеющей сталью [229]. В аэрированной морской воде наиболее сильная коррозия алюминия наблюдалась в гальванической паре со сплавом Монель 400, менее сильная — в контакте с твердым анодированным алюминием, самая слабая — в контакте с титаном или нержавеющей сталью. Наиболее эффективным методом предотвращения коррозии было удаление из воды растворенного кислорода. Обескислороживание значительно уменьшало степень коррозионного разрушения, хотя и не исключало его полностью. С помощью обычных ингибиторов не удавалось полностью подавить коррозию алюминия в гальванической паре со сплавом Монель 400. [c.198]
Ионизирующее излучение, воздействуя на окисную пленку, образующуюся на поверхности металла, может изменять ее электропроводность, защитные свойства и в соответствии с этим коррозионную стойкость металла. И. Л. Розенфельд и Е. К. Оше [1,29] показали, что ток пар цирконий — алюминий, цирконий — железо в движущемся растворе трехпроцентного хлористого натрия значительно возрастает при облучении катода (цирконий) потоком электронов большой энергии (0,8 Меё) с интенсивностью 15 мка/см . После начала облучения сила тока возрастала в 15—20 раз, а затем в течение всего опыта (1 час) оставалась постоянной. По окончании облучения величина тока уменьшалась почти до исходного значения. При облучении анода исследуемых гальванических пар сила тока не увеличивалась. Изменение электрохимической активности циркониевого электрода под действием облучения связано с изменением физических свойств окисной пленки на циркониевом катоде. Окисная пленка на катоде (2гОг) рассматривается как полупроводник. Электрические свойства полупроводников могут существенно изменяться под влиянием облучения, которое в большинстве случаев вызывает резкое увеличение электропроводности полупроводников. Величина тока исследуемых пар определяется скоростью катодной реакции восстановления кислорода.
И. Л. Розенфельд и Е. К. Оше [1,29] показали, что ток пар цирконий — алюминий, цирконий — железо в движущемся растворе трехпроцентного хлористого натрия значительно возрастает при облучении катода (цирконий) потоком электронов большой энергии (0,8 Меё) с интенсивностью 15 мка/см . После начала облучения сила тока возрастала в 15—20 раз, а затем в течение всего опыта (1 час) оставалась постоянной. По окончании облучения величина тока уменьшалась почти до исходного значения. При облучении анода исследуемых гальванических пар сила тока не увеличивалась. Изменение электрохимической активности циркониевого электрода под действием облучения связано с изменением физических свойств окисной пленки на циркониевом катоде. Окисная пленка на катоде (2гОг) рассматривается как полупроводник. Электрические свойства полупроводников могут существенно изменяться под влиянием облучения, которое в большинстве случаев вызывает резкое увеличение электропроводности полупроводников. Величина тока исследуемых пар определяется скоростью катодной реакции восстановления кислорода. Если допустить, что скорость этой реакции лимитируется высоким сопротивлением пленки-полупроводника на катоде, облучение, уменьшая сопротивление пленки окиси циркония, должно ускорить катодную реакцию и привести к резкому увеличению тока коррозионной пары.
[c.37]
Если допустить, что скорость этой реакции лимитируется высоким сопротивлением пленки-полупроводника на катоде, облучение, уменьшая сопротивление пленки окиси циркония, должно ускорить катодную реакцию и привести к резкому увеличению тока коррозионной пары.
[c.37]
При соприкосновении с медью и другими металлами алюминий образует гальваническую пару, в результате действия которой происходит разрушение алюминия электрохимической коррозией. Это обстоятельство ока13ывает немаловажное влияние на ухудшение контактов в соединениях и оконцева-няях алюминиевых жил. [c.5]
О.хлаждающие рассолы довольно агрессивны, и стоимость замены холодильников, ремонта трубопроводов и насосов очень велика. Если не соблюдать должной предосторожности, то стоимость применения рассола в других промышленных охлалхлорида натрия и хлорида кальция. Чаще всего требуется защищать железные изделия, однако может также возникнуть необходимость в защите латуни, меди, бронзы, олова, алюминия, цинка и свинца. В системе могут быть щели, застойные участки, старые накопления ржавчины, гальванические пары разнородных металлов. Так, например, алюминий в контакте с железом в неннгибированном рассоле быстро покрывается инееобразным осадком н питтингами.
[c.174]
В системе могут быть щели, застойные участки, старые накопления ржавчины, гальванические пары разнородных металлов. Так, например, алюминий в контакте с железом в неннгибированном рассоле быстро покрывается инееобразным осадком н питтингами.
[c.174]
По сравнению с цинком алюминий имеет отрицательный нормальный электродный потенциал (—1,67 В против 0,76 В у цинка) и в гальванической паре с железом должен был бы разрушаться быстрее. Однако испытания показали, что алюминиевое покрытие при прочих равных условиях имеет в несколько раз более высокую коррозионную стойкость, чем цинковое. Это может быть объяснено склонностью алюминия к самопроизвольной пассивации в присутствии атмосферного или растворенного кислорода и других пассиваторов, что облагораживает стационарный потенциал первоначально активного алюминия [Л. 7]. Поэтому алитиро-ванная сталь более стойка против атмосферной коррозии и коррозии в растворах солей, чем оцинкованная (при атмосферных испытаниях длительность составляет соответственно 19 и 7 лет), а также устойчива в условиях тропиков. В [Л. 8] показано, что при скручивании алитированной проволоки диаметром 3,66 мм алюминиевое покрытие не повреждается оно устойчиво в воде, тогда как на оцинкованной проволоке появляется ржавчина. Прочность паяных и непаяных соединений проволоки с алюминиевым покрытием выше, чем прочность аналогичных соединений оцинкованной проволоки. Полевые испытания в условиях сильной коррозии показали, что срок службы алитированной проволоки вЗ раза больше оцинкованной.
[c.13]
В [Л. 8] показано, что при скручивании алитированной проволоки диаметром 3,66 мм алюминиевое покрытие не повреждается оно устойчиво в воде, тогда как на оцинкованной проволоке появляется ржавчина. Прочность паяных и непаяных соединений проволоки с алюминиевым покрытием выше, чем прочность аналогичных соединений оцинкованной проволоки. Полевые испытания в условиях сильной коррозии показали, что срок службы алитированной проволоки вЗ раза больше оцинкованной.
[c.13]
Из алюминиевых сплавов высокой коррозионной стойкостью обладают силумины. Алюминий и кре.мний в гальванической паре. дают чрезвычайно малую э. д. с., а в присутствии кислорода покрываются ПЛОТНО защитно пленкой окислов Л1 0,3 + 51 Оо. [c.115]
Таким образом, такая комбинированная конструкция по весу оказывается примерно ра Вной решетчатой ко 1-струкции, сплошь выполненной из алюминия, но в которой собственно алюминия расходуется на 15—18% меньше. При изготовлении комбинированных стоек не следует забывать, что стальные плаики должны быть оцинкованы (иначе создается гальваническая пара), а в качестве соединительных болтов должны быть использованы либо алюминиевые лок-болты, либо высокопрочные предварительно напряженные стальные болты, не допускающие сдвиговых деформаций. [c.302]
Большую роль в растворении цинкового покрытия играют открытые поровые каналы (проникающая пористость). Покрытие в этом случае несет функции протекторной защиты. Возникновение гальванической пары цинковое покрытие — стальная основа в электролите -агрессивной среде ускоряет разрушение цинка. Вместе с тем основной металл не растворяется. Цинк является анодом в системе покрытие -сталь – кислая среда , и, переходя в раствор, интенсивно корродируя, он защищает основной металл. Все это, разумеется, сопровождается уменьшением массы и лишних размеров. Однако однозначно считать, что цинковое покрытие не выполняет защитных функций, неправомерно. Активно растворяясь сам, цинк тем самым защищает поверхность изделия. В алюмоцинковом покрытии с 20 % цинка, вероятно, в первую очередь весьма активно растворялись микрообъемы, занятые частицами цинка. Отрицательную роль сыграло возникновение гальванической пары, что ускорило коррозию. Продукты коррозии цинка не являются столь плотными, как продукты коррозии алюминия. Они не осаждаются в виде пленки на поверхности, не закупоривают откры- [c.222]
Как уже отмечалось, электрохимические процессы в гальванических парах, в которых тантал является катодом, могут оказывать на него разрушающее воздействие путем охрупчивания. В то же время если тантал оказывается анодом то разрушения не происходит, так как очень быстрая пассивация понижает гальванический ток до очень малой величины. Гальванические пары тантала с платиной, серебром, медью, висмутом, сурьмой, молибденом, никелем, свинцом, оловом, цинком и алюминием в 0,1 н. серной кислоте были исследованы в работе Хайсински [37]. Во всех случаях, за исключением цинка и алюминия, тантал оказывался отрицательным элементом (анодом) пары. В плавиковой кислоте тантал также был более положительным по отношению к пинку и алюминию, но более отрицательным по отношению к платине, серебру, меди, сурьме, никелю и свинцу. Перечисленные шесть пар характеризовались большими стационарными токами, так как в растворах ионов фтора тантал, как правило, не пассивируется, а корродирует. Очевидное аномальное поведение, наблюдавшееся в гальванических парах тантала с висмутом или железом в плавиковой кислоте, Хайсински объяснил образованием нерастворимых фторидов на поверхностях висмутовых и железных электродов. [c.208]
Допустимые и недопустимые контакты металлов. Популярные метрические и дюймовые резьбы
Электронику часто называют наукой о контактах. Многие знают, что нельзя скручивать между собой медный и алюминиевый провода. Медная шина заземления или латунная стойка для платы плохо сочетаются с оцинкованными винтиками, купленными в ближайшем строительном супермаркете. Почему? Коррозия может уничтожить электрический контакт, и прибор перестанет работать. Если это защитное заземление корпуса, то прибор продолжит работу, но будет небезопасен. Голая алюминиевая деталь вообще может постепенно превратиться в прах, если к ней приложить даже низковольтное напряжение.
Доступные нам металлы не ограничиваются только медью и алюминием, существуют различные стали, олово, цинк, никель, хром, а также их сплавы. И далеко не все они сочетаются между собой даже в комнатных условиях, не говоря уже о жёстких атмосферных или морской воде.
В советских ГОСТах было написано почти всё о допустимых контактах металлов, но если изучение чёрно-белых таблиц из 1000 ячеек мелким шрифтом утомляет, то правильный ответ на «медный» вопрос — нержавейка, либо никелированная сталь, из которой, кстати, и сделан почти весь «компьютерный» крепёж. В эпоху чёрно-белого телевидения были другие понятия об удобстве интерфейса, поэтому для уважаемых читателей (и для себя заодно) автор приготовил цветную шпаргалку.
И, раз уж зашла речь о металлообработке, заодно автор привёл таблицу с популярными в электронике резьбами и соответствующими свёрлами, отобрав из объёмных источников наиболее релевантное по тематике портала. Не все же здесь слесари и металлурги, экономьте своё время.
Преамбула
Да, в век 3D-печати популярность напильника с лобзиком несколько потускнела. Но
клетка Фарадеядля
РЭАпо-прежнему является преимуществом, не забываем и про защитное заземление. Да, для печати корпусов РЭА уже доступен
электропроводный (conductive) ABS-пластик, но судя по
источнику, его удельное сопротивление примерно в миллион раз больше меди. Дескать, пыль уже не липнет, но для заземления всё равно многовато. Напечатать же стальные детали корпуса ПК в домашних условиях пока никак невозможно, да мы и алюминий-то с оловом никак не освоим…
Что же делать? Нашему брату приходится действовать методом Микеланджело, используя для творчества вместо каменной глыбы купленные в DIY-магазине заготовки, либо вообще старые корпуса ПК. Работая как-то с корпусом от старого сервера IBM из шикарной миллиметровой стали, автор впал в ступор, потому что имеющаяся резьба была крупнее М3, но мельче #6-32 (позже выяснилось, что это М3,5). Зачем вообще понадобилось в 2003-м году использовать метизы М3,5, останется загадкой, но о существовании дробной метрической резьбы автор даже не подозревал.
UPD
Для моддеров, кстати, рынок предлагает новые, удобные инструменты арсенала домашней мастерской, и про один из них (осциллорез) я рассказываю в отдельной публикации. Арсенал принадлежностей прекрасно дополнит более привычные циркулярные мини-пилы (aka «дремели»), а отсутствие эффекта «запрессовки зубьев» упростит обработку вязких металлов типа меди и алюминия. Инструмент лёгкий, не такой неуклюжий и опасный, как «болгарка». Можно пилить металл практически на уровне носа и без риска получить рубящий удар от заклинившего или осколок от «взорвавшегося» диска. А так бывает в красочно описанных уважаемыми читателями случаях с УШМ: 300-граммовый блин «болгарки» делает 200 оборотов в секунду, потребляя до 2кВт электричества, и требует чуть ли не костюм сапёра. Работающий же осциллорез травматологи упирают себе пильной стороной прямо в ладонь, чтобы успокоить пришедшего на снятие гипсовой повязки пациента… Впрочем, вернёмся к нашим металлам.
Допустимые и недопустимые контакты металлов по ГОСТ 9.005-72
DISCLAIMER:
Предоставляется «как есть». Если уважаемый читатель занимается моделизмом, автомобилизмом или робототехникой, в ГОСТе также приведены: Таблица №2 для
жестких и очень жесткихатмосферных условий, Таблица №3 для контактов, находящихся
в морской воде. Ниже я предлагаю выдержку из Таблицы №1 для
средних атмосферных(т.е. комнатных) условий. Буква «А» означает «ограниченно допустимый в атмосферных условиях», подробности в самом ГОСТе.
Кликабельно (спасибо, НЛО):
UPD:
Ещё цветные шпаргалки (благодарю greatvovan):
для средних атмосферных условий
для жестких и очень жестких атмосферных условий
Пара слов о металлах
Металлурги, поправляйте, если что не так. Коррозия очень объёмная и сложная тема, и я не претендую на полноту её освещения. Я лишь даю выборочные зарисовки, чтобы сформировать у читателя нужные ассоциативные ряды.
ОцинковкаОцинкованная сталь — основная рабочая лошадка народного хозяйства. В виде различных метизов «оцинковка» встречается в магазинах стройматериалов гораздо больше, чем, например, «премиумная» нержавейка. Фабричные корпуса ПК, технологические ящички и шкафчики для оборудования чаще всего выполнены из оцинкованной холоднокатанной стали толщиной порядка 1мм (чем дешевле корпус, тем тоньше лист). «Оцинковка» достаточно прочна и хорошо проводит ток, в промышленности требуется заземление. Если разрезать корпус, то под слоем краски какого-нибудь унылого RAL7035 будет тончайшее цинковое покрытие, а под ним, скорее всего, та самая углеродистая холоднокатанная сталь. Лично у меня нет причин не доверять ГОСТ 9.005-72, поэтому после колхозинга фабричных изделий вообще не рекомендую делать электрический контакт на месте среза стали, лучше постарайтесь сберечь цинковое покрытие. А порезы и шрамы можно закрасить из балончика того же унылого RAL7035 (только заплати €10 и попробуй его найти ещё). Я пользовался автомобильной эмалью нейтрального белого или чёрного цвета (флакончик с кисточной, €2 в любом автомагазине).
Алюминий
Алюминий и его сплавы бывают анодированные (с защитным слоем) и обычные (неанодированные). Алюминий легко обрабатывать в домашних условиях, но помните о коррозии. Не используйте голый алюминий в качестве проводника даже с низковольтным напряжением, иначе ток медленно обратит деталь в прах. Обработанным в мастерской алюминиевым и дюралюминиевым деталям показана полная
эквипотенциальность(наведённые полями токи вроде бы по фиг, заземлять тоже можно). Алюминий совместим с цинковым покрытием, но для контакта с медью, «голой» или никелированной сталью требуется оловянная «прокладка». Ограниченно допустим контакт алюминия с нержавейкой в атмосферных условиях. Для простоты можно принять, что при контакте с другими металлами и покрытиями алюминий будет корродировать сам по себе, без помощи внешнего электричества.
Витая пара из омедненного алюминия (Copper Clad/Coated Aluminium, CCA) — это отдельная история, в домашних условиях кабель всё равно не производится.
Медь
Медь мягкая и довольно неаппетитно окисляется на воздухе, поэтому изделия из меди заключают в герметичную оболочку или лакируют. Латунные бляхи солдатских ремней и стойки для электронных печатных плат лучше сопротивляются окислению и выглядят аппетитнее позеленевшей меди, особенно если их периодически полировать (я про бляхи, конечно). При этом ни медь, ни её сплав с цинком (латунь) «не дружат» с чистым цинком и его покрытиями. Зато медь совмещается с хромом, никелем и нержавейкой. А если вы держите в руках какую-нибудь клемму, то она наверняка из лужёной (покрытой оловом) меди.
Олово
Олово мягкое, но зато стойкое к коррозии (в комнатных условиях) и электрически совместимое почти со всеми, кроме чугуна, низколегированных и углеродистых сталей, магния. Не стоит паять оловом и бериллий, будьте внимательны при сборке домашнего ядерного реактора. Олово используют, чтобы из недопустимого электрического контакта получить допустимый, т.е. в качестве «прокладки». Клеммы из лужёной меди — отличный пример.
UPD:
На холод изделие выносить нельзя, а при минусовых температурах лучше не эксплуатировать вообще.
Никель
Никелем покрыты блестящие «компьютерные» винтики. Такое покрытие совместимо с медью и бронзой, латунью, оловом, хромом и нержавеющей сталью. Никель несовместим с цинком и алюминием (для алюминия лучше контакт с нержавеющей сталью, см. ниже).
Нержавейка
Нержавеющая сталь — королева металлов сталей: прочная, пластичная, стойкая к коррозии, электропроводная, круто выглядит. Слишком тугая, чтобы резать и гнуть её дома в промышленных масштабах. Хромистые и хромисто-никелевые нержавейки электрически плохо совместимы с цинком и «голой» сталью, зато дают надёжный контакт с медью без помощи олова. Алюминий, а также азотированная, оксидированная и фосфатированная низколегированная сталь ограниченно совместимы при стандартных атмосферных условиях. Нержавейка марки А2 не «магнитится», но существуют и нержавеющие стали с магнитными свойствами. Магнитные свойства не влияют на коррозионную стойкость нержавеющей стали.
Пара слов про case modding
Если вы занимались сборкой ПК, то наверняка знаете, что болтики для монтажа приводов CD/DVD, «ноутбучных» дисков 2.5″ и флоппи-дисководов (ха-ха) используют метрическую резьбу M3. В корпусах ПК и жёстких дисках 3.5″ используется более грубая дюймовая резьба #6-32 UNC. Почему? Мягкий металл любит более грубую резьбу, к тому же адепты дюймовой системы пока лидируют на рынке технологий. Стойка 19″ использует (вы не поверите) дюймы в качестве основной меры, однако для монтажа оборудования я встречал только оцинкованные клетевые шайбы и винты с метрической резьбой М6. Дюймово-метрический дуализм в технологиях…
Обустройство своей инженерной кухни я начал с того, что купил защитные очки, набор качественных свёрл по металлу, небольшой вороток и метчики на резьбы M3 и #6-32 UNC, а заодно M4 и M6. Плашки не понадобились.
Популярые виды резьбы, используемой в компьютерной технике
ГОСТ 19257-73 рекомендует использовать следующие диаметры свёрл для металлов. Наверное, стоит учитывать и количество метчиков в наборе: чем твёрже материал, тем больше необходимость в «предварительных» метчиках. У меня их по три штуки, два «грубых» и один «финишный». А как правильно, кстати?
UPD
А как правильно — читайте комментарии, на публикацию-таки зашли мастера слесарного дела, только я не успел отсортировать всю информацию. Пользователь golf2109 любезно принёс сюда прямо из мастерской два правых столбца таблицы для обозначения того, как мягкость (вязкость) металла влияет на диаметр отверстия под резьбу, благодарю за поддержку.
| Диаметр резьбы | Стандартный шаг, мм | Диаметр сверла, мм | ||
| ГОСТ | Fe | Al | ||
| M2 | 0.4 | 1,6 | 1.5* (-0.1) | |
| M2,5 | 0.45 | 2.0 | 1.8* (-0.2) | |
| M3 | 0.5 | 2.5 | 2.3 (-0.2) | |
| M3.5 | 0.6 | 2.9 | 2.7* (-0.2) | |
| M4 | 0.7 | 3.3 | 3.2 | 3.0 (-0.3) |
| M5 | 0.8 | 4.2 | 3.9 (-0.3) | |
| M6 | 1.0 | 5.0 | 4.9 | 4.6 (-0.4) |
| M8 | 1.25 | 6.8 | 6.7 | 6.3 (-0.5) |
| M10 | 1.5 | 8.5 | 8.0 (-0.5) | |
| #6-32 UNC | 0.794 | 2.85 | 2.7* | 2.5* (-0.35) |
* Я рискнул прикинуть калибры двух дополнительных свёрл для стали и алюминия там, где по ним у меня нет данных в источниках. Обратите внимание, резьба #6-32 UNC по наружному диаметру находится между M3 и M4, а по шагу резьбы вообще ближе к M5.
UPD
Если сверлите что-то толще миллиметрового листа, читайте спойлер про СОЖ.
Довольно большое значение и при сверлении, и при нарезании резьб имеет смазка и охлаждение обрабатываемых деталей и инструмента. Настоятельно рекомендую при подаче сверла не спешить и пользоваться техническими жидкостями. Режущая кромка сверла легко перегревается от сухой детали, и получается металлический отпуск. Поверьте, такой отпуск не нужен: он вызывает необратимые изменения в структуре металла и деградацию его прочностных свойств (сверло тупится гораздо быстрее, чем должно). Что делать? Вот несколько советов, которые автор встречал в разных местах.
Не сверлите большим сверлом сразу, разбейте операции примерно по 3мм: т.е. отверстие 10мм сперва проходим 3мм, потом 6мм.
Хорошенько отметьте отверстие керном. Одолжите у ребёнка пластилин, сделайте бортик вокруг планируемого отверстия так, чтобы получился мини-бассейн размером с монету. Если под рукой нет *вообще ничего*, хорошенько смешайте ложку подсолнечного масла с ложкой жидкого мыла и налейте в этот мини-бассейн, хуже не будет. Но если нужно просверлить насквозь, скажем, гирю 16кг, погуглите книгу народных рецептов «сож своими руками». Желаю всем начинающим удачной пенетрации: как говорится, берегите ваши свёрла-метчики смолоду, ведь их ждут новые идеи и интересные изобретения!
На известной китайской площадке можно приобрести «пальцевые» винтики (thumb screw), причём и на #6-32, и на M3. Материал и цвет разный.
Источники
» ГОСТ 9.005-72. Единая система защиты от коррозии и старения. Машины, приборы и другие технические изделия. Допустимые и недопустимые контакты металлов. Общие требования.
» ГОСТ 19257-73. Отверстия под нарезание метрической резьбы. Диаметры.
» Unified Coarse Thread ANSI B1.1 (резьбы UNC ANSI B1.1).
Гальваническая коррозия
МЕТАЛЛЫ В МОРСКОЙ СРЕДЕ
Крепеж
Когда речь заходит про крепеж, в дело вступают дополнительные факторы. Он должен, естественно, обладать прочностью и желательно при этом иметь разумную стоимость, поскольку количество его даже для самой миниатюрной лодки исчисляется сотнями. Но, пожалуй, самым важным для него является то, что, будучи установлен, он не должен ни корродировать сам, ни вызывать коррозию того, что он крепит – по крайней мере в течение достаточно длительного времени. В данном контексте имеются два вида коррозии, о которых следует помнить: гальваническая и химическая.
Гальваническая коррозия
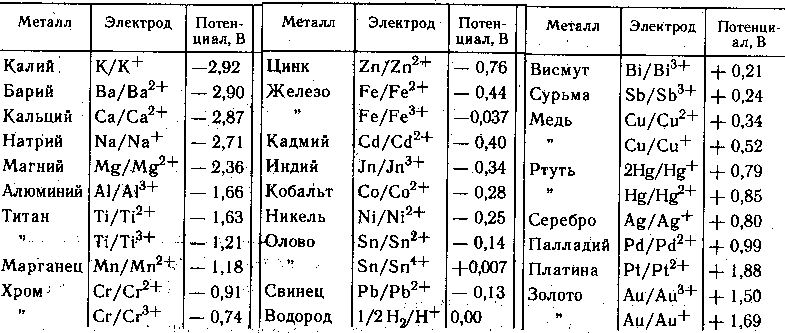
Первый ее вид – гальваническая коррозия, которая возникает в тех случаях, когда два разных металла находятся в контакте друг с другом в присутствии электролита. Морская вода является (увы!) отличным электролитом и проникает на лодке повсюду. Гальваническая шкала ниже демонстрирует электрические потенциалы металлов, обычно применяемых в малом судостроении. Постараемся не слишком не углубляться в химические дебри, а заострим ваше внимание на трех основных моментах, чтобы понять ее практический смысл:
- Когда два металла находятся в контакте, находящийся левее будет корродировать.
- Разность потенциалов в 0.1 В является безопасной, 0.2 – приемлемой в зависимости от следующего условия.
- Темпы коррозии зависят помимо всего прочего от площадей поверхностей открытых металлов. Если крепеж менее инертен, чем деталь, он корродирует довольно скоро. Если же он из более благородного металла, срок его службы будет достаточен.
Каков практический смысл этой диаграммы?
- Из диаграммы понятно, почему элементы крепежа обычно делаются из материалов правой ее части. С алюминием у вас будут проблемы, поэтому позаботьтесь, чтобы вытяжные заклепки были из монеля (алюминиевые широко используются в автомобильной промышленности).
(Монель – сплав Ni с 23-27% Cu, 2-3% Fe, 1-2% Mn) - Вы сами можете решить, какой крепеж использовать для каких деталей (см. таблицу далее). Оцинкованного крепежа следует, естественно, избегать на нержавейке и алюминии. Менее явно то, что латунные винты представляют собой неудовлетворительный, а скорее даже опасный выбор для крепления бронзовых деталей.
- Существуют сплавы, сами по себе способные являться гальваническими парами. Самым ярким примером является латунь, у которой в присутствии электролита одна из “фаз” начинает корродировать. Явление именуется “децинкификация”. Латунный элемент, подверженный этому явлению, представляет собой неприятное зрелище и теряет свою прочность.
|
Крепеж |
||
|
Материал детали |
Допустимо |
Недопустимо |
|
Оцинкованная сталь |
Оцинкованный или нерж. |
Латунь и бронза |
|
Алюминий |
Нержавеющий |
Оцинкованный, латунь |
|
Латунь |
Латунь или бронза |
Нержавеющий |
|
Бронза |
Бронза или нерж. |
Латунь |
|
Нерж. сталь |
Нерж. или монель |
Оцинк. или латунь |
Химическая коррозия
Второй вид коррозии, о котором не стоит забывать, является следствием воздействия различных химических веществ. Как правило, металлы защищают сами себя оксидной пленкой на поверхности и главное тут, является ли она самовосстанавливающейся, как в случае нержавеющей стали, алюминия и цветных металлов или же отваливается хлопьями, как у стали. Последствия этого могут быть разными – от чисто косметических в случае коррозии бронзового или оцинкованного палубного оборудования, до весьма серьезных – в случае коррозии гвоздей обшивки. Последнее в основном вызывается образованием в древесине кислот по мере ее пропитывания, дуб в этой ситуации является наихудшим вариантом. Всем хорошо известно, что может ожидать стальной крепеж, а стало быть килевые болты и гвозди. Гораздо чаще забывают, что нержавеющая сталь тоже уязвима.
Нержавеющая сталь
Поскольку существует огромное количество ложных представлений о нержавеющей стали (впрочем, само это название вводит в заблуждение), стоит провести небольшой ликбез по этой части. Помимо железа и углерода, нержавеющая сталь содержит ряд легирующих добавок. Из них самой важной является хром (Cr). Если сталь содержит его более 12%, вся поверхность покрывается пленкой из оксида хрома. Эта пленка “пассивна”, стойка к большинству воздействий и самовосстанавливается в присутствии кислорода. Нержавеющая сталь, содержащая один только хром, довольно хрупкая и поэтому в нее добавляют в два раза меньшее хрома количество никеля (Ni). 304-я нержавейка (она же A2), одна из самых распространенных, содержит 18% Cr и 10% Ni. Мойка или выхлопная труба скорее всего сделаны именно из 304-й и если вы пробовали чистить раковину мойки или релинг, то могли обратить внимание, что они в некоторой степени подвержены воздействию органических кислот, образующихся в пищевых продуктах, отпечатков пальцев и прочих загрязнений.
Химическая и пищевая промышленность снижают остроту этой проблемы путем добавления в сталь небольшого количества молибдена (Mo). Таким образом 316-я нержавейка (она же А4) обычно содержит 17% Cr, 11% Ni, 2 % Mo и широко используется для хранения и транспортировки агрессивных жидкостей. Из этого напрашивается вывод, что она представляет собой идеальный материал для крепежа древесины (или к ней) и с точки зрения воздействия одних только химических веществ вы скорее всего будете правы. Но надо еще принимать во внимание и ту среду, в которой предстоит работать крепежному элементу. Представим себе болт, гвоздь или шуруп, крепящий доску обшивки к шпангоуту ниже ватерлинии. Его шляпка, находящаяся на поверхности или вблизи нее будет иметь достаточный приток кислорода для поддержания оксидной пленки. Само же тело, находящееся внутри конструкции, скорее всего будет испытывать его недостаток, при этом находясь в окружении разных кислот и хлоридов. При подобных обстоятельствах пассивная пленка может разрушиться, сделав таким образом нержавейку “активной”. Последствий у этого может быть два. Во-первых, взгляните на гальваническую диаграмму, и вы увидите, что разность активных и пассивных потенциалов у 304-й нержавейки (у 316-й в меньшей степени) вполне достаточна, чтобы вызвать гальваническую коррозию. Подобно латуни, она способна сама собой образовывать гальваническую пару. Во-вторых, лишенная защитной пленки, нержавейка корродирует такими же темпами, как и самая обычная сталь. В результате этого нержавеющий крепеж ниже ватерлинии, независимо от его марки, может не иметь никаких преимуществ по сравнению с простой низкоуглеродистой сталью. Выше ватерлинии (где больше кислорода и меньше электролита) такой крепеж ведет себя превосходно.
В заключение хотелось бы еще указать на неразумность пескоструйной обработки оборудования из нержавеющей стали с целью придания ему вида оцинкованного. Способность пассивной пленки к самовосстановлению выше, если поверхность отполирована. При образовании на поверхности миллионов маленьких “пиков” вы значительно снижаете такую способность, в результате чего деталь покрывается ржавчиной. Если вам надо, чтобы деталь выглядела как оцинкованная, лучше такую и взять.
Сталь и оцинковка
Низкоуглеродистой стали без защитного покрытия нет места на борту лодки по причине ее склонности к коррозии, но при наличии покрытия — это вполне пригодный материал. Обычно этого достигают, нанося на нее слой цинка, получая при этом два плюса. Во-первых, цинк хорошо сопротивляется химической коррозии, а во-вторых, в присутствии электролита он корродирует прежде стали. Существует ряд способов нанесения слоя цинка, основная разница между ними заключается в толщине формируемого слоя. Чтобы получить приемлемый срок службы в морской среде, слой должен иметь толщину порядка 100 мкм. Этого можно достичь лужением (до 125 мкм при горячем погружении), окраской (около 40 мкм на слой), но только не электрогальваникой, где толщина обычно ограничивается 20 мкм. Поэтому тот блестящий оцинкованный крепеж, что продается в магазинах хозтоваров, годится для строительства теплицы, на лодке же жизнь его будет недолгой. “Морской” крепеж должен быть луженый.
Медь
Медные гвозди с шайбами широко применяется в классической деревянной конструкции. Для такого рода сравнительно гибких конструкций медные гвозди представляют идеальный материал: легко крепятся, коррозионно-устойчивы, достаточно эластичны, чтобы позволить подвижку элементов. С выходом на сцену клееных конструкций и тем более стеклопластиковых корпусов, довольно удивительно, что медные корабельные гвозди до сих пор имеются в продаже. Однако их выбор постепенно сужается. К примеру, 5-6 мм шайбы более не выпускаются, поэтому строителям каноэ приходится теперь расклепывать гвозди. Также исчезают и нестандартные размеры, полезные при ремонте обшивки, когда выбор гвоздей на размер выше поможет решить проблему течи.
Латунь
Латунь чаще всего выступает в роли шурупов. Помня о проблемах децинкификации, латунный крепеж следует использовать только в защищенных местах – во внутренней обстройке или в тех местах, где от него не зависит ваша жизнь.
Бронза
Стандартным материалом для крепежа является кремниевая бронза. Помимо использования ее в виде болтов и гвоздей, она является одним из немногих материалов, из которого делают гигантского размера шурупы (вплоть до №30). Она достаточно коррозионно-устойчива и служит очень долго – от тридцати до пятидесяти лет. Поэтому, несмотря на свою стоимость, бронзовый крепеж конкурентоспособен.
|
Виды медных сплавов и химический состав |
||||
|
Наименование |
Обозначение |
Состав |
Применение |
|
|
Латуни |
Обычная латунь |
CZ108 |
Zn 37% |
Внутреннее оборудование |
|
Морская латунь |
CZ112 |
Zn 37% Sn1% |
Оборудование довоенных лодок |
|
|
Высокопрочная латунь |
CZ114 |
Zn 37% Mn 2% Al 1.5% Fe 1% Pb 1.5% Sn 0.8% |
Такелажные скобы, гребные винты, лебедки |
|
|
Коррозионностойкая латунь |
CZ132 |
Zn 36% Pb 2.8% As 0.1% |
Водозапорная и трубная арматура |
|
|
Бронзы |
Алюминиевая бронза |
CA104 |
Al 10% Ni5% Fe5% |
Высокопрочное оборудование |
|
Фосфористая бронза |
PB102 |
Sn 5% P 0.2% |
Сборное и кованое оборудование |
|
|
Кремнистая бронза |
CS101 |
Si 3% Mn1% |
Крепеж |
|
|
Оружейная бронза |
LG2 |
Sn 5% Pb5% Zn5% |
Литье |
|
|
Алюминиевая бронза для литья |
AB2 |
Al 10% Ni5% Fe3% |
Леерное и мачтовое оборудование |
|
|
Al – алюминий, As – мышьяк, Fe – железо, Mn – марганец, Ni – никель |
||||
Титан контакт с другими металлами
Гальванические эффекты. Опыт применения титановых сплавов в морских условиях показывает, что их следует использовать только в тех случаях, когда могут быть оправданы затраты, связанные с более высокой по сравнению со сталью и алюминием стоимостью. Морских конструкций, выполненных целиком из титановых сплавов, пока не существует, поэтому титан всегда соседствует в конструкциях с другими металлами. При наличии электрического контакта между титаном и каким-либо металлом происходит увеличение площади поверхности катода, связанного с локальными анодами на этом втором металле. Коррозия таких металлов, как сталь и алюминий, контролируется катодными процессами, поэтому возрастание площади катодной поверхности при образовании гальванической пары с титаном способствует усилению коррозии более анодного элемента пары. Как видно из приведенного электрохимического ряда напряжений, пассивный титан является более катодным металлом по отношению практически ко всем распространенным конструкционным материалам. [c.120]Титан и его сплавы в нейтральных водных растворах хлоридов являются катодом по отношению к большинству конструкционных материалов коррозионностойким сталям, медноникелевым сплавам, алюминию и его сплавам. В этом случае контакт с другим металлом не приводит к сколь-нибудь заметной коррозии титана и его сплавов, но, как правило, является опасным для контактирующего металла. [c.193]
Скорость движения морской воды увеличивает коррозию малоуглеродистой стали и алюминия, находящихся в контакте с другими металлами. При небольших скоростях движения воды (0,15 м/с) в паре со всеми металлами увеличение скорости коррозии стали и алюминия практически одинаковое, т. е. скорость коррозии определяется величиной диффузионного тока по кислороду. При увеличении скорости движения воды, и, следовательно, значительного возрастания предельного тока по кислороду наибольшая коррозия наблюдается при контакте с медью, никелем, монелем. В этих условиях величина тока пары будет в значительной степени определяться скоростью электрохимической реакции восстановления кислорода, которая зависит от природы металла (на нержавеющей стали и титане эта реакция затруднена), что вызывает различные скорости коррозии стали и алюминия при контактировании с различными металлами. И. Л. Розенфельдом, О. И. Вашковым [50, с. 64] было установлено количественное соответствие между скоростью вращения электрода и линейной скоростью судна, что позволяет моделировать эффект контактной коррозии для движущихся судов в лабораторных условиях. [c.81]
Изучалось поведение титана в контакте с другими металлами. В солянокислых средах, содержащих сероводород, следует избегать контакта титана с углеродистой сталью и латунью в сопряжении с титаном коррозия этих металлов усиливается. Контакт титана с нержавеющими сталями не опасен. Коррозионное поведение самого титана в контакте с вышеперечисленными материалами не меняется. [c.76]
Титан и его сплавы обладают хорошей коррозионной стойкостью и не нуждаются в защите. Однако, как отмечалось, следует иметь в виду, что в контакте с другими металлами и сплавами титан и его сплавы вызывают усиление коррозии сопряженных металлов. [c.11]
Разность потенциалов между титаном и другими стойкими в морской воде металлами очень незначительна, что предопределяет малую вероятность контактной коррозии между этими металлами. На рис. 5.1 приведены данные, характеризующие коррозионное поведение различных металлов в контакте с титаном в морской воде. [c.178]
Известно, что в атмосферных условиях контакт титана с другими металлами не влияет на его коррозию. В водопроводной воде коррозия магния в контакте с титаном увеличивается в [c.181]
Условия электролиза. Материал электродов. В качестве анодов в электролизерах с мембраной обычно используют титан часто в виде просечной сетки, покрытой -смесью оксидов рутения и других металлов (например, титана). Катодом служит стальная сетка. Обычно электроды биполярные. Электрический контакт между стальным катодом и титановым анодам осуществляется с помощью металлических шпилек, которые проходят сквозь пластмассовую перегородку. В некоторых случаях в качестве биполярного электрода используют биметалл из титана и стали, полученный из листов этих металлов с помощью взрывной технологии. [c.172]
В гальванотехнике используют, в основном, сопротивление титана коррозии. Поверхность титана постоянно. покрыта пассивным слоем самовосстанавливающихся оксидов. Этот слой обладает изоляционными свойствами и предупреждает осаждение покрытия. Этим титан схож с алюминием. Слой оксидов на титане столь тонок, что при упругом контакте этого металла с другим он может стать токопроводящим. С учетом этого титан можно использовать для изготовления гальванических подвесок. [c.188]
Для предотвращения усиления коррозии при контакте анодированного алюминия и его сплавов с нержавеющими сталями, титаном и его сплавами, медными сплавами их кадмируют, грунтуют и окрашивают после сборки. В жестких условиях эксплуатации, например морских, при контакте алюминиевых сплавов с другими металлами для предупреждения усиления или развития коррозии поступают следующим образом стальные детали кадмируют, окрашивают и устанавливают на герметике У-30-МЭС-5. Стальные кадмированные болты в неразъемных соединениях устанавливают на сырой грунтовке ФЛ-086 [c.243]
В табл. 31 приведен гальваническим ряд металлов, рас 10,1о-женных по возрастающе величине стационарного электродного потенциала в морской воде, текущей со скоростью 649 м/мин. Как видно из таблицы, разность электродных потенциалов между титаном и углеродистой сталью, алюминием, сплавами на медной основе довольно велика, поэтому контактная коррозия между ними может быть значительной. Разность потенциалов между титаном и другими устойчивыми в морской воде металлами очень незначительна, что предопределяет малую вероятность контактной коррозии между этими. металлами. Эти выводы подтверждаются данными диаграммы (фиг. 29), где приведены результаты испытаний титана в контакте с другими металлами, применяемыми в морских конденсаторах. В морской воде [c.61]
Была установлена не только высокая общая стойкость титана к коррозии в спокойной и движущейся морской воде, но также коррозионной кавитации и усталости, а также к коррозии под напряжением, устойчивость в отношении коррозии в щелях и к питтингообразованию Вследствие положительного стационарного потенциала титан не склонен к коррозии в контакте, но сам несколько увеличивает коррозию других металлов (даже меди), находящихся с ним в контакте. По своему контактному действию он аналогичен нержавеющей стали в пассивном состоянии, т. е. представляет собой не очень активно действующий катод. [c.570]
Большинство цветных металлов (медь, бронза, латунь и другие сплавы) подвергаются значительной коррозии при воздействии аммиака. Относительно стойки сталь, чугун, алюминий, никель и титан. Углеродистая сталь практически не корродирует при контакте со сжиженным аммиаком, поэтому из нее изготавливают трубопроводы и резервуары для перекачивания и хранения аммиака. Длительные испытания на двигателе FR показали, что при работе на аммиаке повышенный износ наблюдается лишь у деталей, изготовленных из цветных металлов, особенно из меди и ее сплавов. Из прокладочных материалов стойкими к аммиаку являются фторопласты и некоторые сорта резины. Большинство нефтяных и синтетических масел практически не изменяют свои свойства при работе двигателя на аммиаке. При этом отмечены лишь незначительные колебания вязкости и некоторое снижение эффективности антиокислительных присадок. [c.190]
Серная кислота высокой концентрации (практически безводная) не взаимодействует с железом в результате пассивации металла. Явление пассивации связано с образованием на поверхности металла прочной сплошной пленки, состоящей из оксидов или других соединений, которая препятствует контакту металла с кислотой. Благодаря пассивации можно хранить и перевозить концентрированную серную кислоту в стальной таре. Концентрированная серная кислота пассивирует также алюминий, никель, хром, титан. [c.137]
Титан как сильно электроотрицательный металл, является активным катодом в гальванической паре с железом, медью, алюминием, цинком. Контакт с титаном ускоряет коррозию углеродистой стали, латуни, алюминиево-магниевых и медно-никелевых сплавов. В паре с платиной титан пассивируется, что позволяет использовать его как основу под покрытие платиной и другими благородными металлами [36]. [c.112]
Находясь в электрическом контакте с большинством других конструкционных материалов титан и его сплавы в спокойной морской воде являются катодами. Такой контакт может ускорить коррозию сопряженного металла на большую или меньшую величину в соответствии с соотношениями площадей и поляризационными характеристиками контактирующих материалов (рис. 4.17). Из-за более низкого перенапряжения катодной реакции на медном электроде по сравнению с титановым электродом, потери массы углеродистой стали, находящейся в контакте с медью в несколько раз больше, чем в случае контакте с титаном (рис. 4.18). [c.199]
Безусловные достоинства титановьгх сплавов — высокая стойкость к общей коррозии, локальным видам коррозионного разрушения в морской воде в сочетании с высокой механической прочностью, малой по сравнению со сталью плотностью, и др. делают титан и его сплавы весьма перспективным конструкционным материалом для ответственных морских сооружений. Титан не лишен некоторых недостатков, к которым относится его низкая стойкость к биологическим формам коррозии, а также его способность интенсифицировать коррозию других металлов, находящихся с ним в контакте. [c.26]
В первой группе сред на коррозию титана не влияет контакт с другими металлами и сплавами, но скорость коррозии контак-тируемого с титаном металла может значительно зшеличиваться. Во второй группе сред контакт с другими металлами может рка-зьшать сильное влияние на скорость коррозии обоих материалов. Исходя из этого рабочие колеса дымососов не следует изготов- [c.118]
На скорость растворения титана в азотной кислоте не влияет контакт с другими металлами. Так, в 4%-ной HNO3 при 95 °С титан растворялся со скоростью 0,01 мм/год при потенциале [c.179]
В средах, в которых титан может находиться как в активном, так и в пассивном состоянии, результаты контакта его с другими металлами можно предвидеть и даже рассчитать, исходя из поляризационных кривых титана и контактирующего металла. Контактная коррозия титана в 40%-ной h3SO4 исследована именно с таких электрохимических позиций [463]. [c.181]
На рис. 5.10 приведены результаты изучения наводороживания титана в контакте с другими металлами и 6%-ном растворе Na l. В свободном состоянии и в контакте с латунью образцы титана наводороживанию ие подвергались во всем исследованном интервале температур. Наводороживание титана в контакте с углеродистой сталью отмечается при температуре выше 100 °С, и уже при 120 °С содержание водорода в титане достигает 105-10 %- Особенно сильному наводороживанию титан подвергается при контакте с цинком. Наводороживание происходит даже при 70°С и экспоненциально увеличивается с ростом температуры [504]. [c.195]
На скорость растворения титана в азотной кислоте не влияет контакт с другими металлами. Так, в 4%-ной НМОз при 95°С титан растворялся со скоростью 0,01 мм/год при потенциале 0,60 В. При контакте со свинцом (соотношение площадей поверхности РЬ и Т1 составляло 1 I) в этих же условиях скорость коррозии титана не изменялась, хотя потенциал сместился до —0,07 В, тогда как нержавеющие стали при контакте со свинцом депассиБируются и скорость коррозии их возрастает на 4 порядка [360]. [c.114]
Контакт с другими металлами. В большинстве сред потенциалы титана, сплава Монель и нержавеющей стали в пассивном состоянии примерно одинаковы, и поэтому при соединении этих металлов электрохимические эффекты не возникают. Если титан и находящийся с ним в контакте материал являются разнородными металлами, то титан обычно играет роль эффективного катода, и хотя к значительной коррозии титана такой контакт скорее всего не приведет, отрицательное воздействие на второй металл окажет. Размеры и степень такого электрохимического коррозионного разрушения будут зависеть от соотношения площади титана и другого металла. Если площадь последнего мала по сравнению с площадью титана, то этот другой металл подвергнется сильной коррозии, а в случае обратного соотношения площадей коррозия будет меньше [17]. Такие металл1>1, как нержавеющая сталь, которые, подобно титану, легко поляризуются, подвергаются в этих условиях значительно меньшему воздействию, чем сплавы на основе меди и малоуглеродистая сталь. [c.193]
Поведение титана,в контактах с другими металлами,естественно,вызывает большой интерес. Обычно титан по своему электрохимическому поведению похож на нержавеющую сталь. Инглис утверждает, что сам титан не подвергается коррозии в контакте с другими металлами, но что коррозия других металлов, находящихся в контакте с титаном, может значительно возрасти — особенно мягкой стали и оружейной стали. Это хорошо совпадает с обычным эксплуатационным опытом, хотя из некоторых других источников известны противоположные данные. [c.191]
Было высказано мнение, что коррозионное поведение титановых сплавов эквивалентно коррозионному поведению чистого титана. Поскольку титан в чистом виде является очень активным металлом, который становится пассивным за счет пленки, находящейся в сильно сжатом состоянии, уже незначительные изменения в составе или состоянии поверхности могут вызывать изменение коррозионного поведения, хотя сплавление с другими металлами не обязательно вызывает увеличение его катодной эффективности. Данные Пейжа и Кетгама показывают, что в нормальном растворе хлористого натрия контактирование других металлов с титановым сплавом, содержащим 1,8 % хрома и 0,9% железа, вызывает меньшее ускорение коррозии отрицательных металлов, чем контактирование тех же металлов с чистым титаном или нержавеющей сталью. Контакт с любым из этих трех металлов увеличивает скорость коррозии кадмия в 9 раз на эти данные следует обратить внимание в связи с надеждами, возлагаемыми на кадмиевые покрытия для защиты от коррозии в авиации. [c.191]
Ряд процессов, например водное хлорирование, а также процессы со средами, в которых содержатся кислородные соединения хлора, не могут быть осуществлены без аппаратов или их отдельных деталей, изготовленных из титана. В этих средах скорость коррозии титана не превышает 0,01 мм1год. В значительно большей степени применяют технически чистый титан мap ки ВТ1-1 и мало-легированный титановый сплав марки 0Т4, из которых изготовляют теплообменники, колонные аппараты, резервуары, подогреватели и другие аппараты. ВТГ-1 в контакте со многими сплавами и металлами в большинстве агрессивных сред (за исключением азотной и серной кислот) является катодам и спосо1бствует убыстрению коррозии металла, контактирующего с ним. Коррозионная стойкость сплава марки ОТ-4 в некоторых средах ниже, чем титана мap ки ВТ1-1. [c.24]
Контакт со сталью, хотя и менее опасен, чем контакт с медью или свинцом, также может ускорять коррозию алюминия. Вместе с гем в некоторых естественных водных средах и в ряде других случаев алюминий может быть защищен за счет черных металлов. Нержавеющие стали способны усиливать разрушение алюминия, особенно в морской воде и в морской атмосфере, в то же время высокое. электрическое сопротивление поверхностных окис-ных пленок обоих материалов заметно ослабляет контактные явления в менее агрессивных средах. Титан ведет себя в эгом от юшении аналогично стали. Сплавы алюминий- цннк, используемые в качестве расходуемых анодов для защиты стальных конструкции, содержат также небольшие добавки олова, индия или ртути, улучшающие характеристики растворения и смещающие потенциал к более отрицательным значениям. [c.83]
Перенос массы титана в отсутствие солей может происходить за счет испарения титана. Несомненно, испарение титана в условиях глубокого вакуума имеет место. Однако перенос массы титана хорошо осуществляется и при нормальном давлении в атмосфере инертного газа. Эти данные можно объяснить высокими термоэмиссионными свойствами титана, свойствами излучать ионы и атомы металла [ ]. Внутренние напряжения, вызванные наличием примесей или другими причинами, способствуют термо-эдшссии. Однако ни испарение, пи эмиссия титана не могут полностью объяснить все наблюдаемые при образовании покрытий факты. В частности, наблюдалось следующее интересное явление. Металлический титан, со-прикасающи11ся с поверхностью покрываемого материала (особенно заметно на керамике), как бы расползается по поверхности последнего. Непосредственно в месте контакта металлического титана с подложкой на последней образуется наплав металла, постепенно утончающийся по мере удаления от места контакта. Силы взаимодействия между атомами титана [c.238]
|
« НазадКоррозия и гальваническая пара 08.11.2011 06:55
Металлы в виду своего разнородного характера не всегда подходят для непосредственного контакта друг с другом тем более, если они находятся в агрессивных средах. Нередко они образуют весьма сильную гальваническую пару, что приводит к быстрому образованию коррозии в местах их непосредственного соприкосновения. Слово «коррозия» заимствованно от латинского слова «corrodere», что означает – пожирать, изгладывать. Наиболее известная форма коррозии, это физико-химической реакция окружающей среды со сталью, которая приводит к появлению ржавчины. Аналогичные процессы проистекают и с другими материалами. Коррозия может быть химической и электрохимической в зависимости от вида процесса разрушения. Химическая коррозия, как правило, вызвана воздействием на сталь сухих газов и жидкостей без электролитных свойств и не сопровождается возникновениями электрических токов. При таком виде коррозии происходит равномерное воздействие на всю поверхность металла, в результате чего появляются окислы в виде рыхлых образований. Химическая коррозия представляет менее опасный вид разрушающих воздействий, в отличие от электрохимической коррозии. Коррозия, при которой происходит возникновение электрического тока, в среде жидкого электролита называется – электрохимическая коррозия. Все металлы и сплавы обладают электрическим потенциалом, из-за наличия в составе сплавов тех или иных веществ их потенциал не однороден. Если взять два материала с разными потенциалами и соединить их между собой, то они образовывают гальваническую пару. Поместив такую связку в электролит, между ними начинается активный электрообмен, что приводит к ускоренному разрушению более активного материала. Электролит, это вещество в среде которого, возможно протекание электрического тока. В качестве электролита может быть не только морская вода, но и обычная водопроводная вода, так как в ней присутствуют минеральные вещества. Коррозионное разрушение алюминиевых частей водной техники, приобретает ускоренный характер, если применять детали из нержавеющей стали в качестве дополнительных элементов. В состав сплава этой легированной стали входят такие вещества как никель и хром, которые не совместимы с алюминием. Какие материалы можно применять для совместного использования без образования гальванической пары можно посмотреть в таблице совместимости металлов и сплавов. К примеру, если металлические детали будет контактировать с деталями на медной основе, процесс разрушения металлических изделий в таком случае резко ускорится. Иногда для защиты стали от коррозии применяют покрытие из слоя олова, но оно будет выполнять свои защитные функции до тех пор, пока не нарушится их целостность. В результате механического воздействия оголяется поверхность материала находившегося под защищающим его слоем, что приводит к образованию гальванической пары олово-железо. Сталь в данном месте будет разрушаться очень быстро. При проведении ремонтных работ нужно учитывать особенности материалов закрепляя их на основное изделие. Замена деталей, не предусмотренных конструкцией, может привести к их преждевременному разрушению и выходу из строя, а в некоторых случаях может повлечь возникновение аварийных ситуаций опасных для жизни. Вот некоторые комбинации несовместимых материалов и сплавов, которые создают гальваническую пару: Алюминий, а так же его сплавы не совместимы с такими материалами как, – медь, сплавы меди, серебро, золото, платина, палладий, родий, олово, никель, хром. Магниево-алюминиевые сплавы при их соединении создают отрицательное взаимодействие с веществами такими как, – никель, хром, олово, медь, свинец, палладий, родий, серебро, золото, платина. Цинк и сплавы на его основе по своей природе не совместимы с медью, славами на основе меди, а так же с некоторыми веществами, например: серебро, золото, платина, палладий, родий. Нелегированная сталь, олово, свинец, кадмий, не совместимы с веществами перечисленными далее: медь, серебро, золото, платина, палладий, родий. Никель и хром, если соединить их с серебром, золотом, платиной, палладием, родием, могут привести к не желательному взаимодействию. |
В каких средах окисляется алюминий. Основные виды коррозии алюминия. Коррозионная стойкость алюминия
С чего обычно начинаются работы по добавлению функционала наших машин? Правильно – с посещения сайтов и форумов, чтобы посмотреть, как другие реализовали подобные идеи, подчерпнуть что-то интересное и не совершать чужих ошибок. Но всегда ли стоит верить тому, что написано на форумах? Чужой опыт не всегда является истиной и редко описывается человеком, достигшим Дзен в данном вопросе. Вспоминаю свои первые посты – такую ерунду писал, да еще и отстаивал свою правоту, да так убедительно. А ведь кто-то может этим воспользоваться. Так же помню читал раньше, где уже не помню, о том, что ни в коем случае нельзя выполнять отделку кузова алюминием. Звучало это приблизительно так: «Ребята, да Вы что, совсем физику не учили?! При контакте алюминия и железа Вы создаете гальваническую пару и у Вас кузов за полгода сгниет весь, растворится! Головой-то надо думать хоть иногда!». Гальваническая пара создается, да, но будет ли таким плачевным результат? Об этом далее.
По моей новой профессии отправили меня учится на повышение квалификации в Уфимский Государственный Нефтяной Технический Университет, где в течении двух недель кандидаты технических наук рассказывали мне о коррозии металла и как с ней бороться. Эта статья не будет научно-публицистической, дабы не забивать Вам голову, постараюсь все рассказать на примере яблок, образно.
Итак, по механизму протекания коррозия делится на химическую и электрохимическую. Химическая коррозия протекает в неэлектролитической среде при высокой температуре. Так как мы рассматриваем кузов автомобиля, то данный тип коррозии не применим. Нас интересует электрохимическая коррозия, электролитом в которой выступает влага. Из курса физики и химии мы все помним, что все металлы имеют кристаллическую решетку, в которой электроны свободно двигаются и называется такая решетка металлосвязью. Эта связь атомов не очень крепкая и ее свойства позволяют активно использовать данные материалы в нашей жизни.
Но тот факт, что она не крепкая доставляет нам проблемы. Например, диполи воды (а вода, в силу своего строения, является довольно агрессивной средой) разбивают металлосвязь и наиболее активно это происходит в местах, где количество электронов недостаточно, вытягивая молекулы металла и создавая с ними более стабильное соединение. Эти места являются очагами коррозии. Как же возникают участки металла с малым количеством электронов? Связано это как раз со способностью электронов свободно перемещаться в кристаллической решетке металла. Все металлы имеют естественный потенциал (электростатический), отличный от нуля. Железо в естественных условиях имеет потенциал, равный приблизительно -0,44 Вольта, цинк -0, 76 В, алюминий -1, 67 В, магний -2,3 В. Но даже металл одной природы, например, лист железа, в разных своих частях имеет отличающиеся потенциалы. Незначительно, но отличаются. Это связано с различными причинами, в том числе с механическими напряжениями в структуре металла, различными вкраплениями, острыми краями, заусенцами, царапинами, наклёпами, сварочными швами и т.д. Такие места имеют более отрицательный потенциал по отношению к другим частям и они являются анодными зонами, т.е. анодами (остальные части соответственно являются катодами).
При протекании электрохимической коррозии в электролите анод насыщает электронами через проводник катод, тем самым теряя силу молекулярной связи и разрушается под действием агрессивной среды.
Вспомните места, где наиболее часто гниет кузов – это сгибы кузова, швы, соединения различных частей и т.д., т.е. в местах, где присутствует влага и есть дополнительные факторы, создающие анодные зоны. Те же полики на наших машинах не гниют равномерно по всей площади. Очаги начинают развиваться в углах и на сгибах. Каждый из Вас может в качестве подтверждения провести один небольшой и не сложный опыт: Возьмите два одинаковых гвоздя. Один из них согните на 90 градусов. Затем обезжирьте оба и не касаясь пальцами (можно брать их бумажкой) положите в раствор поваренной соли (NaCl). Коррозия будет протекать наиболее интенсивно на согнутом гвозде в месте изгиба. На прямом гвозде она будет протекать более равномерно по всей площади и менее интенсивно. Кому доводилось разбирать деревянные постройки, в которых ржавые гвозди, могут вспомнить, что согнутые гвозди в местах сгибов очень легко ломаются и практически все место слома ржавое насквозь.
От действия коррозии кузов защищает изоляция, в роли которой выступают краска и грунтовка. Но тут есть один момент – в местах нарушения изоляции коррозия будет развиваться более интенсивно, нежели бы весь металл был голым, без изоляции.
Так какое же все-таки влияние оказывает алюминий на железо в местах контакта? Металлы с более отрицательным естественным потенциалом при соприкосновении с железом выступают в роли анода, т.е. защищают металл от коррозии. К таким металлам относятся цинк, алюминий и магний. Т.е. при отделке кузова алюминием при наличии электролита между ними в качестве анода будет выступать алюминий и именно он будет разрушаться. Процесс этот длительный, а при условии, что алюминий редко несет серьезные механические нагрузки – еще и безболезненный. На данном принципе построена протекторная защита металлоконструкций от коррозии, например, нефтепроводов.
Конечно, никто Вам гарантий того, что уложив лист алюминия на полик Вы полностью защите кузов от коррозии, здесь не дает. На этот процесс влияет много факторов, в том числе токи, протекающие по кузову от электроприемников, различные агрессивные среды, разлитые масла, химические жидкости и т.д. Но хуже алюминием Вы не сделаете, даже наоборот.
Здесь еще стоит отметить, что в местах контакта кузова с металлами, имеющими меньший естественный потенциал по отношению к железу, железо уже не будет катодом, а станет анодом, как следствие процесс коррозии будет протекать более интенсивно. К таким металлам относятся никель, олово, свинец, медь. Серебро и золото тоже, но они думаю у вас в машинах не валяются.
Существует несколько типов металлов, используемых для изготовления компонентов распылительной упаковки. Существует также распространенный миф коррозии о том, что алюминий обладает большей коррозионной стойкостью, чем сталь. Давайте вкратце рассмотрим типы металлов, используемых для изготовления распылительных упаковок и аэрозольных клапанов, а затем обсудим, почему концепция превосходной коррозионной стойкости алюминия является мифом коррозии.
Основы коррозии: металлы, используемые для изготовления распылительных упаковок. Двумя металлами, используемыми для изготовления распылительных упаковок, являются алюминий и сталь. Алюминий, сталь и нержавеющая сталь используются при изготовлении и строительстве аэрозольных клапанов. Алюминий, используемый для распылительных упаковок, представляет собой коммерчески чистую чистоту алюминия от около 99% до 7% алюминия. Алюминиевые аэрозольные контейнеры изготавливаются путем экструзии алюминиевой шайбы в форму окончательного контейнера.
Вот собственно и все о коррозии и с чем ее едят, не сильно кратко, но и не очень заумно) Надеюсь, что статья оказалась для Вас полезной!
Алюминий – широко распространенный в промышленности и быту металл. Окисление алюминия на воздухе не происходит. Его инертность обусловлена тонкой оксидной пленкой, защищающей его. Однако под влиянием определенных факторов из окружающей среды этот метал все же подвергается разрушительным процессам, и коррозия алюминия — не такое уж и редкое явление.
Сумки, вставленные в аэрозольные контейнеры, образованы алюминиевой фольгой, которая имеет один или несколько слоев полимерной пленки, ламинированной по обеим сторонам фольги. Сумки формируются сварочными секциями вместе и сваривают клапан до верхней части мешка.
Качество архитектурного материала зависит от
Сталь является общим обозначением для сплавов железа. Сталь, используемая для распылительных упаковок, может быть одним из трех сплавов железа. Стальные сплавы обычно покрыты либо металлическим оловом, покрытым тонким слоем хрома, либо тонким слоем хромового металла, чтобы предотвратить атмосферную ржавчину. Во многих случаях сплав, используемый для корпуса контейнера, отличается от сплава, используемого для изготовления вершин и днищ контейнера.
Виды коррозии
Окисляется алюминий в атмосфере быстро, но на небольшую глубину. Этому препятствует защитная окисная пленка. Окисление ускоряется выше температуры плавления алюминия. Если нарушается целостность оксидной пленки, алюминий начинает корродировать. Причинами истончения его защитного слоя могут стать различные факторы, начиная с воздействия кислот, щелочей и заканчивая механическим повреждением.
Стальные аэрозольные контейнеры формируются одним из двух способов. Тело, вершины и днища формируются из отдельных листов, затем скрепляются друг с другом. Тело и верх, или тело, и днище выкопаны в форму контейнера – без нижней или верхней части соответственно. Верх или нижний слой затем скрепляют сверху или снизу – в зависимости от того, какая часть не подделана с телом. Аэрозольные клапаны штампованы из алюминия или стального листового металла на нескольких ступенях штамповки. Шарниры и пружины из аэрозольного клапана изготавливаются из различных сплавов из нержавеющей стали.
Коррозия алюминия – саморазрушение металла под воздействием окружающей среды. По механизму протекания выделяют:
- Химическую коррозию – происходит в газовой среде без участия воды.
- Электрохимическую коррозию – протекает во влажных средах.
Являются ли алюминиевые контейнеры более устойчивыми к коррозии, чем стальные контейнеры? Алюминий является более химически реактивным металлом, чем железо, и поэтому он должен быть менее коррозионно-стойким, чем сталь. Тем не менее, фактический ответ на вышеупомянутый вопрос, по которому металл более устойчив к коррозии, зависит от вашей химии формулы.
Сталь обычно корродирует очень быстро, когда рН раствора ниже примерно пяти. И наоборот, коррозия стали может быть значительно медленнее, когда рН раствора примерно выше. Как правило, скорость коррозии алюминия является самой низкой, когда рН раствора находится где-то между четырьмя и семью. Однако алюминий также быстро корродирует, когда рН раствора ниже примерно четырех, и алюминий растворяется в растворах с очень высоким рН.
- Газовое разрушение – но сопровождает нагрев и горячую обработку алюминия. В результате взаимодействия кислорода с металлами возникает плотная окисная пленка. Вот почему алюминий не ржавеет, как и все цветные металлы.
На видео: электрохимическая коррозия металлов и способы защиты.
Два примера помогут проиллюстрировать совместимость алюминиевых и тинтированных стальных емкостей с различными типами формул. Формула для мышиного мусса с рН 4 обычно совместима с алюминиевыми контейнерами, но обычно не совместима со стальными контейнерами.
Существует также множество формул, таких как аэрозоль для волос, освежители воздуха и инсектициды, которые могут быть упакованы в алюминиевые контейнеры или стальные контейнеры в зависимости от химического состава формулы. Алюминиевые контейнеры с внутренними покрытиями, скорее всего, более устойчивы к коррозии с низкими значениями рН. Однако другие ингредиенты формулы могут привести к недействительности этих правил рН. Например, органические галогены могут сильно реагировать с алюминием.
Причины коррозии алюминия
Коррозионная стойкость алюминия зависит от нескольких факторов:
- чистоты – наличия примесей в металле;
- воздействующей среды – алюминий может одинаково подвергаться разрушению и на чистом сельском воздухе и в промышленно загрязненных районах;
- температуры.
Во многих случаях малоконцентрированные кислоты могут растворить алюминий. От возникновения коррозии не защищает естественная окисная пленка.
В конечном итоге для обоих типов металлов с распылительной насадкой необходимы коррозионные испытания, чтобы определить, совместимы ли они с данным типом формулы. Кроме того, правильно оптимизированная система ингибиторов коррозии значительно повысит коррозионную стойкость алюминия или стали. Тем не менее, различные типы ингибиторов коррозии обычно необходимы для алюминия и стали.
Алюминий и нержавеющая сталь могут выглядеть похожими, но на самом деле они совершенно разные. Помните эти 10 различий, когда решаете, какой тип металла использовать в следующем проекте. Хром добавляют в качестве агента для обеспечения коррозионной стойкости. Кроме того, поскольку он непористый, сопротивление коррозии увеличивается. Алюминий обладает высокой стойкостью к окислению и коррозии, главным образом, благодаря пассивирующему слою. Когда алюминий окисляется, его поверхность станет белой и иногда будет ямой. В некоторых экстремальных кислотных или щелочных средах алюминий может быстро корродировать с катастрофическими результатами. Теплопроводность. Алюминий имеет гораздо лучшую теплопроводность, чем нержавеющая сталь. Одна из основных причин, по которой он используется для автомобильных радиаторов и кондиционеров. Стоимость. Алюминий обычно дешевле, чем нержавеющая сталь. Технологичность. Алюминий довольно мягкий и легче режется и образуется. Из-за его износостойкости и износа, из нержавеющей стали трудно работать. Нержавеющие стали сложнее и особенно сложнее, чем алюминий. Сварка. Нержавеющая сталь относительно легко сваривается, в то время как алюминий может быть затруднен. Тепловые свойства. Нержавеющая сталь может использоваться при гораздо более высоких температурах, чем алюминий, который может стать очень мягким, примерно на 400 градусов. Электрическая проводимость. Нержавеющая сталь – действительно плохой проводник по сравнению с большинством металлов. Алюминий – очень хороший проводник электричества. Из-за высокой проводимости, малой массы и коррозионной стойкости высоковольтные воздушные линии электропередачи обычно изготавливаются из алюминия. Прочность. Нержавеющая сталь прочнее алюминия. Влияние на продукты питания. Нержавеющая сталь менее реактивна с продуктами. Алюминий может реагировать на продукты, которые могут влиять на цвет и аромат.
- Соотношение прочности и веса.
- Алюминий обычно не такой сильный, как сталь, но это также почти одна треть веса.
- Это основная причина, почему самолеты сделаны из алюминия.
- Коррозия.
- Нержавеющая сталь состоит из железа, хрома, никеля, марганца и меди.
Мощные разрушители – фтор, калий, натрий. Алюминий и его сплавы корродируют при воздействии химических соединений брома и хлора, растворов извести и цемента.
Коррозия алюминия и его сплавов происходит в воде, воздухе, оксидах углерода и серы, растворах солей. Морская вода приводит к ускоренному разрушению. Алюминий считается активным металлом, но при этом отличается хорошими коррозионными свойствами.
Телефон, электронная почта или посетите один из наших экспертов по металлическим металлам. Наши представители обслуживания клиентов помогут вам сделать правильный выбор! Посетите, позвоните или отправьте письмо по электронной почте для получения дополнительной информации.
Коррозия представляет собой химическую реакцию металла, в данном случае алюминия, с окружающей его средой, что приводит к ухудшению свойств металлов, алюминия в этом случае. Алюминий – очень реактивный металл, но он также является пассивным металлом. Этот противоречивый характер объясняется тем, что зарождающийся алюминий реагирует с кислородом или водой и образует когерентный поверхностный оксид, который препятствует дальнейшей реакции алюминия с окружающей средой.
Выделяют два основных фактора, которые влияют на интенсивность коррозийного процесса:
- степень агрессивности воздействующей окружающей среды – влажность, загрязненность, задымленность;
- химическая структура.
Алюминий не подвергается коррозии в чистой воде. Не влияют на защитную оксидную пленку нагревание и пар.
Алюминий химически очень реактивен. Например, порошкообразный алюминий используется в качестве ракетного топлива для движения ракет твердого топлива космического челнока. Кроме того, реакция алюминия с водой выделяет огромное количество энергии. Коррозия представляет собой реакцию алюминия с водой и последующее ухудшение его свойств. Коррозия, по определению, является медленным процессом, требующим значительных дней или лет, в отличие от аналогичных электрохимических реакций, таких как травление, осветление или анодирование, которые происходят в течение нескольких минут или меньше.
Проявление коррозии алюминия
Выделяют следующие виды коррозии алюминия и его сплавов:
- Поверхностная – наиболее распространенная, приносит наименьший вред, легко заметна и быстро поддается устранению.
- Локальная – разрушения наблюдаются в виде углублений и пятен. Опасный вид коррозии в силу своей незаметности. Встречается в труднодоступных частях и узлах металлических конструкций.
- Нитеподобная, филигрань – наблюдается под покрытиями из органики, на ослабленных местах поверхности.
Любой из видов коррозии конструкций из алюминия является причиной разрушения.
Алюминиевые сплавы могут корродировать по нескольким различным путям. Признание пути или форм коррозии алюминия является важным шагом для определения подходящего средства для каждого зонда. Атмосферная коррозия определяется как коррозия или разрушение материала, подверженного воздействию воздуха и его загрязняющих веществ, а не погружения в жидкость. Многие авторы классифицируют атмосферную коррозию под категориями сухого, влажного и влажного, тем самым подчеркивая различные механизмы атаки при повышении влажности или влажности.
Коррозионность атмосферы к металлам сильно варьируется от одного географического положения к другому, в зависимости от таких погодных факторов, как направление ветра, осадки и изменения температуры, количество и тип городских и промышленных загрязнителей и близость к естественным водоемам. Конструкция конструкции также может зависеть от срока службы, если погодные условия вызывают повторную конденсацию влаги в незапечатанных щелях или в каналах, не предусматривающих дренаж.
Это сокращает срок эксплуатации изделий. В гальванической паре алюминий может корродировать, при этом он защищает другой металл.
Естественных антикоррозийных свойств алюминия и его сплавов недостаточно. Поэтому механизмы, агрегаты, конструкции и изделия из металла нуждаются в дополнительной защите.
Общая коррозия или равномерная коррозия происходит в растворах, где рН либо очень высокий, либо очень низкий, либо при высоких потенциалах в электролитах с высокими концентрациями хлоридов. В кислотных или щелочных растворах оксид алюминия нестабилен и, следовательно, не защищен.
В экономическом отношении гальваническая коррозия создает наибольшее количество проблем коррозии для алюминиевых сплавов. Гальваническая коррозия, также известная как разнородная коррозия металлов, возникает, когда алюминий электрически соединен с более благородным металлом и оба находятся в контакте с одним и тем же электролитом.
Способы борьбы с коррозией
Защита от коррозии производится несколькими способами:
- Механическое лакокрасочное защитное покрытие.
- Электрохимическая защита – покрытие более активными металлами;
- Покрытие алюминия порошковыми составами, так называемый процесс аллюминирования;
- Высоковольтное анодирование;
- Химическое оксидирование;
- Применение ингибиторов коррозии.
Гальваническая коррозия алюминия
Кривизная коррозия требует наличия щели, соленой воды, кислорода. Расщелина может быть результатом перекрытия двух частей или зазора между болтом и конструкцией. Когда алюминий смачивается соленой водой, а вода поступает в щель, изначально мало что происходит. Со временем внутри щели кислород потребляется из-за растворения и осаждения алюминия.
Рисунок 1: Кристаллическая коррозия может возникать в условиях соленой воды, если щель становится деаэрированной, а реакция восстановления кислорода происходит вне устья щели. В этих условиях щель становится более кислым, и коррозия протекает с увеличением скорости.
Механическое покрытие
Как защитить алюминий от коррозии? Чаще всего применяют механический способ – нанесение слоя краски.
Покройте краской изделие и вы убедитесь в действенности этого способа. Окрашивание бывает мокрым и сухим, или порошковым. Эти технологии усовершенствуются. При мокром окрашивании лакокрасочные слои наносят после защиты алюминия составом, содержащим соединения цинка и стронция. Металлическую основу тщательно подготавливают: защищают, шлифуют, сушат. Грунт наносят поэтапно.
Когда растворитель из грунтовочной смеси полностью исчезнет, поверхность можно покрывать изолирующим составом: масляным или глифталиевым лаком.
Специальные составы помогают остановить коррозию и защищают алюминиевые конструкции от химикатов, бензина, различного вида масел. Выбор покрытия зависит от условий последующей эксплуатации металлического изделия:
- молотковые – применяют для получения конструкций различных цветовых оттенков, используемых в декоре;
- бакелитовые – наносят под высоким давлением, заполняя микротрещины и поры.
Порошковое окрашивание требует тщательной очистки поверхности от жира и различных отложений. Это достигается погружением в щелочные или кислотные растворы с добавлением смачивателей. Далее на алюминиевые конструкции наносится слой хроматных, фосфатных, циркониевых или титановых соединений. После этого он не будет окисляться.
После просушки материала на окислившийся участок наносят защитный полимер. Чаще всего используются полиэфиры, стойкие к механическому, химическому и термическому воздействию. Применяют полимеризованный уретан, эпоксидные и акриловые порошки.
Оксидирование алюминия
Оксидирование алюминия протекает при постоянном токе под напряжением 250 В. Наращивание защитной пленки происходит при комнатной температуре с водяным охлаждением. Не требуется импульсного источника. Пленки получаются плотными и прочными в течение 45-60 минут.
На плотность и цвет оксидного покрытия влияет температура электролита:
- пониженная температура образует плотную пленку яркого цвета;
- повышенная – формирует рыхлую пленку, требующую дальнейшей окраски.
Образовать защиту алюминия от коррозии можно электрохимической реакцией. Процесс разделен на несколько этапов:
1. На стадии подготовки алюминиевое изделие обезжиривают, погружая его в раствор щавелевой кислоты.
2. После промывания водой опускают в щелочной раствор, чтобы удалить неравномерно образовавшийся оксидный слой.
3. Для дополнительной окраски алюминиевые изделия погружают в соответствующие растворы солей. Чтобы заполнить образовавшиеся поры, металлический материал обрабатывают паром.
4. Затем изделие подвергают сушке. Анодное оксидирование может проводиться с применением переменного тока.
Для защиты от коррозии применяют химическое оксидирование – менее затратное, не требующее специального электрического оборудования и квалификации исполнителей. Используется несложный химический состав.
В процессе алюминирования полученная оксидная пленка толщиной в 3 мкм имеет салатный цвет, обладает высокими электроизоляционными свойствами, не пориста, не окрашивается.
Коррозия алюминия возникает вследствие находящихся рядом металлов, которые окислились. Предотвращению этот процесса способствует изоляция. Это могут быть прокладки из резины, битума, паронита. При покрытии ржавчиной применяются лак и другие изолирующие материалы. Других способов избавиться от этой проблемы пока нет.
Три способа удалить окисную плёнку с поверхности алюминия (1 видео)
Коррозия Джон Коттерил рассказывает о причинах коррозии и методах борьбы с ней С проблемой коррозии металлов на яхте встречается каждый из нас. Несмотря на героические попытки остановит ее, коррозия молчаливо съедает металлические детали вашей лодки, пока не остается другой альтернативы, как заменить их. Понимание процесса, однако, является первым шагом к предотвращению его. Фотография вверху показывает деталь, принесенную в нашу мастерскую – и это не самый «тяжелый» случай жестокости моря по отношению к металлу, что мне приходилось видеть. Морской воздух также может быть беспощаден. Каждый металл занимает определенное место в таблице электрических потенциалов (Рис.1)
Самые верхние позиции в таблице принадлежат графиту и платине, которые будут электрически положительными по отношению ко всем остальным металлам. Опускаясь вниз по таблице, где металлы становятся все более электрически отрицательными, нам встречаются: титан, серебро, никель, бронзы, медь, олово, латунь, алюминий, мягкая сталь, цинк, и, наконец, магний. Металлы наверху таблицы называются «катоды», а те, что внизу – «аноды». Скрытые ресурсы гальванической коррозии Что такое электролитическая коррозия?
Как то мне показали сифонный клапан, помещенный в деревянную коробку рядом с отключателем положительной клеммы аккумулятора. Протекающая из дефектного клапана соленая вода проложила путь из мокрого дерева коробки к положительной клемме 12 V аккумулятора. Отсюда, с « +», по этому пути, через корпус клапана и по системе охлаждения и теплообменник, ток пошел на корпус двигателя и к «-« батареи. Латунный патрубок скорродировал очень быстро, но теплообменник не пострадал. Болезнь двигателя Проблемы гребного вала
Нержавеющая сталь может также страдать от процесса, называемого « коррозия сварного шва». Вы неоднократно могли видеть полированные нержавеющие детали на яхтах, покрытые ржавчиной в районе сварного шва. В момент сварки, под воздействием высокой температуры, легирующий металл хром удаляется из расплавленного сварного шва, оставляя там железо, которое и ржавеет.
Из “Boat Owner” by John Cotterill |
контактирующих разнородных металлов | Американская ассоциация гальванизаторов
Дом ” Дизайн и изготовление » Рекомендации по дизайну » Контакт разнородных металлов
Сталь, оцинкованная горячим способом, хорошо подходит для использования в различных средах и в различных конструкциях, и иногда она контактирует с различными металлами, включая, среди прочего, нержавеющую сталь, алюминий, медь и сталь, устойчивую к атмосферным воздействиям.
Когда два разных металла контактируют в коррозионной среде, один из металлов подвергается ускоренной гальванической коррозии, в то время как другой металл остается гальванически защищенным.
Металлы, расположенные рядом друг с другом в гальванической серии, мало влияют друг на друга. Как правило, по мере того, как расстояние между металлами в серии увеличивается, коррозионное воздействие на металл, находящийся выше в серии, также увеличивается.
Относительные площади поверхности контакта разнородных металлов также важны для определения того, какой металл проявляет ускоренную коррозию.Нежелательно иметь большую поверхность катода в контакте с относительно небольшой поверхностью анода.
Гальваническая коррозия возникает, когда два разных металла контактируют в коррозионной среде: один из металлов испытывает повышенную скорость коррозии. Контактирующие металлы образуют биметаллическую пару из-за их различного сродства (или притяжения) к электронам. Это различное сродство создает электрический потенциал между двумя металлами, позволяя течь току.
Металл более высокого уровня в гальваническом ряду металлов, анод, обеспечивает защиту металла нижнего ряда, катода.
Как видно из гальванической серии, цинк защищает низкую сталь.
Что касается соприкасающихся поверхностей двух металлов, хотя ток коррозии, протекающий между катодом и анодом, не зависит от площади, скорость проникновения на аноде зависит от плотности тока. Таким образом, большая площадь анода в контакте с относительно небольшой площадью катода обычно не является проблемой. Несмотря на это, условия окружающей среды остаются решающими факторами скорости коррозии.
Таблица 1: Влияние биметалла на оцинкованную сталь в различных областях примененияНержавеющая сталь и алюминий: почему не следует использовать их вместе и соответствующие меры предосторожности, если вы используете
Гальваническая коррозия
Комбинация алюминия и нержавеющей стали вызывает гальваническую коррозию.Чтобы понять, почему не следует использовать вместе нержавеющую сталь и алюминий, нам сначала нужно понять, как работает гальваническая коррозия. Гальваническая коррозия – это перенос электронов от одного материала (анода) к другому (катоду). Помимо знания того, что такое гальваническая коррозия, нам также необходимо понимать связанные с ней технические термины.
Вот все технические термины, которые мы будем использовать в этой публикации:
- Анод – материал, который заряжен положительно, электроны покидают этот материал
- Катод – материал, который заряжен отрицательно, в этот материал входят электроны
- Электролит – жидкость, помогающая в процессе переноса электронов
- Коррозия / коррозия – постепенное разрушение или ослабление металла
Как это работает
Гальваническая коррозия возникает, когда два материала (анод и катод) контактируют друг с другом и с электролитом.Электролиты могут быть факторами окружающей среды, такими как влажность или дождевая вода. Когда эти факторы вступят в силу, начнется перенос электронов. В зависимости от уровня сопротивления электролита этот перенос может происходить намного быстрее. Вот почему соленая вода, электролит с очень низким сопротивлением, является общим фактором при выборе продукта. В связи с этим невероятно важно продумать, какой материал вы собираетесь использовать в окружающей среде. При работе с морской или соленой водой вам даже нужно учитывать тип используемой нержавеющей стали.
Существует несколько видов ржавчины, которые могут возникнуть в процессе окисления. Чтобы узнать о них больше, прочтите это сообщение в блоге о трех часто встречающихся типах ржавчины.
Наш пример
В оставшейся части нашего поста, вместо того, чтобы ссылаться на анод и катод, мы будем использовать пример алюминия (анод) и нержавеющей стали (катод). Когда алюминий и нержавеющая сталь используются в сборке вместе, электроны из алюминия начнут переходить в нержавеющую сталь.Это приводит к ослаблению алюминия. Этот ослабленный алюминий заставляет его ухудшаться гораздо быстрее. Это может продлить срок службы нержавеющей стали. Примечание. Алюминий, если оставить его вместе с электролитом, в конечном итоге все равно потеряет свои электроны, но наличие нержавеющей стали значительно ускорит этот процесс.
Практика гальванической коррозии обычно используется при нанесении покрытия для создания временного слоя поверх другого материала. Обычно используются оцинкованная сталь и черный оксид.
Исключения
Каждая сборка ситуативна. Поскольку металл подвержен коррозии за счет факторов окружающей среды, могут быть места, где вы можете использовать некоторые металлы вместе, не заметив этих эффектов. Если окружающая среда очень сухая, защищенная от непогоды и грязи, вы можете попробовать использовать металлы вместе. Однако в большинстве случаев окружающая среда не контролируется температурой и влажностью, возникает ржавчина. В связи с этим компания Albany County Fasteners рекомендует никогда не использовать вместе алюминий и нержавеющую сталь.Мы также рекомендуем использовать исключительно металлы для максимального срока службы. Нержавеющая сталь с нержавеющей, алюминий с алюминием, латунь с латунью. Смешивание металлов может повлиять на прочность покрытия, срок службы крепежа, коррозию материалов и т. Д.
Другая ситуация, в которой эти материалы могут использоваться вместе с незначительным воздействием на предотвращение ржавчины, – это если площадь катода очень мала по сравнению с площадью анода. Например, если основным материалом является большой лист алюминия, то использование очень маленьких винтов из нержавеющей стали не приведет к значительному сокращению срока службы.И наоборот, если вы используете алюминий для крепления большого листа нержавеющей стали, срок службы алюминия значительно сократится.
Albany County Fasteners рекомендует использовать неопрен EPDM или связующие шайбы между нержавеющими крепежными деталями и алюминиевыми материалами, неопрен образует барьер между металлами, предотвращая коррозию.
Факторы окружающей среды для определения
При выборе материала для установки необходимо учитывать множество факторов.
| Коэффициент | Почему это важно |
| Продолжительность контакта с электролитом | Чем дольше электролит контактирует с алюминием и нержавеющей сталью, тем выше вероятность переноса электронов. |
| Электролитное сопротивление | Чем ниже сопротивление электролита, тем легче происходит перенос электронов. Пример: соленая вода имеет очень низкое сопротивление электролиту. |
| Стоячая вода | Вода, которая сидит и рассеивается очень долго, может привести к длительному контакту с электролитами. |
| Грязь | Грязь (особенно не под прямыми солнечными лучами) может абсорбировать электролит и удерживать его в течение очень долгого времени. Это может привести к увеличению воздействия на сборку, если ее не содержать в чистоте. |
| Влажность / туман | Оба фактора окружающей среды приводят к увеличению содержания воды в воздухе.Если окружающая среда подвержена этим факторам, воздействие электролитов считается увеличенным |
| Щели | Щели служат для улавливания влаги (электролита), которая может удерживать ее на материалах в течение длительного периода времени. |
Благородные металлы
Если вы решите, что вам нужно использовать вместе два разных материала, мы рекомендуем использовать анод в качестве основного материала и убедиться, что он значительно больше катодов.Катоды также можно назвать благородными металлами или металлами, обладающими высокой стойкостью к окислению (ржавчине). Ниже мы составили список благородных металлов:
- Золото
- Иридий
- Меркурий
- Осмий
- Палладий
- Платина
- Родий
- Рутений
- Серебро
От анода к катоду
Чтобы еще больше снизить влияние гальванической коррозии, рекомендуется использовать материалы, которые с меньшей вероятностью вызывают перенос электронов при контакте друг с другом и электролитом.Следующий список представляет собой список материалов. * Примечание: чем ближе два металла в этом списке, тем меньше вероятность того, что они пострадают от отрицательного воздействия гальванической коррозии.
- Магний
- Магниевые сплавы
- Цинк
- Бериллий
- Алюминиевые сплавы
- Кадмий
- Мягкая и углеродистая сталь, чугун
- Хромистая сталь (с содержанием хрома менее или равным 6%)
- Активная нержавеющая сталь (302, 310, 316, 410, 430)
- Алюминиевая бронза
- Свинцово-оловянный припой
- Олово
- Активный никель
- Активный инконель
- Латунь
- бронза
- Медь
- Марганцевая бронза
- Силиконовая бронза
- Медно-никелевые сплавы
- Свинец
- Монель
- Серебряный припой
- Пассивный никель
- Пассивный инконель
- Пассивная нержавеющая сталь (302, 310, 316, 410, 430)
- Серебро
- Титан
- Цирконий
- Золото
- Платина
Как остановить гальваническую коррозию?
Есть несколько шагов, которые вы можете предпринять, если ДОЛЖНЫ использовать эти материалы вместе.
- Добавьте изолятор между двумя материалами, чтобы они больше не соединялись. Без этой связи передача электронов невозможна. Гайки для колодцев – это обычно используемый крепеж, помогающий отделить материалы, которые могут пострадать от гальванической коррозии.
- Используйте материалы с одинаковым потенциалом. Металлы с одинаковой коррозионной стойкостью обычно можно использовать вместе.
- Если вы находитесь в ситуации, когда только один из материалов будет контактировать с электролитом, перенос электронов не произойдет.
- Если на катоде есть покрытие, оно может предотвратить перенос из-за повышенного сопротивления.
- Примите во внимание вашу среду перед установкой. Выберите материалы, которые подходят для вашей среды.
- Покройте или покрасьте сборку (полностью), чтобы электролит не контактировал с материалами
- Используйте неопрен EPDM или клеящие шайбы в качестве барьера между металлами.
Если вам интересны типы материалов, которые мы предлагаем, и дополнительная информация о них, ознакомьтесь с нашим Справочным руководством по материалам.
Можно ли использовать вместе нержавеющую сталь и алюминий?
Последнее обновление: 21 сентября 2020 г., Marsh Fasteners
Коррозия возникает, когда два разнородных материала объединяются в коррозионный электролит. Это может произойти, когда определенные материалы (например, алюминий) контактируют с нержавеющей сталью.
Наиболее распространенным решением для предотвращения гальванической коррозии является выбор металлов, которые находятся близко друг к другу в гальванической серии. Разделение несовместимых металлов снижает риск разрушения этих клеток.В соответствии с уровнями гальванической коррозии нержавеющая сталь, контактирующая с такими материалами, как медь, представляет меньший риск, чем когда она контактирует с алюминием.
Хотя алюминий отрицательно реагирует на нержавеющую сталь, большие площади поверхности алюминия и нержавеющей стали могут быть приемлемы в зависимости от местных условий окружающей среды. В морской среде может иметь место сильная коррозия. Однако есть методы, которые можно использовать для уменьшения этого эффекта.Хороший способ уменьшить коррозию – использовать изолирующее покрытие или краску на алюминии и стали, чтобы изолировать их электрически. Изолирующие шайбы также эффективны для изоляции двух разнородных материалов и создания относительно безопасной площади поверхности.
Наряду с коррозией может произойти обесцвечивание нержавеющей стали в сочетании с алюминием. Это также называется «окрашиванием чая». Обесцвечивание можно предотвратить, если использовать изоляцию и регулярно проводить техническое обслуживание. Пассивация также может использоваться для создания пассивной пленки на крепежном элементе, обеспечивающей лучшую коррозионную стойкость.
Как ведущий специалист по крепежу из нержавеющей стали; и установила партнерские отношения с производителями и поставщиками всего спектра нержавеющей стали и алюминия во всех отраслях промышленности; Marsh Fasteners может помочь вам использовать лучшие продукты с высочайшими антикоррозийными качествами.
Клиенты часто спрашивают, можно ли или целесообразно ли использовать крепеж из нержавеющей стали с алюминием. Хорошо известно, что соприкосновение двух металлов может вызвать коррозию. Коррозия возникает, когда два разнородных материала объединяются в коррозионный электролит.Это может произойти, когда определенные материалы (например, алюминий) контактируют с нержавеющей сталью. Однако есть способы использовать вместе нержавеющую сталь и алюминий, предотвращая коррозию.
Наиболее распространенным решением для предотвращения гальванической коррозии является выбор металлов, которые находятся близко друг к другу в гальванической серии. Разделение несовместимых металлов снижает риск разрушения этих клеток. В соответствии с уровнями гальванической коррозии нержавеющая сталь, контактирующая с такими материалами, как медь, представляет меньший риск, чем когда она контактирует с алюминием.
Реакция стали и алюминия
Хотя алюминий отрицательно реагирует на нержавеющую сталь, большие площади поверхности алюминия и нержавеющей стали могут быть приемлемыми в зависимости от местных условий окружающей среды. Примером безопасного использования крепежных элементов из нержавеющей стали с алюминием может быть использование болтов из нержавеющей стали для крепления алюминиевых ограждений парапетов проезжей части. В этом случае площадь поверхности алюминия настолько велика по сравнению с площадью поверхности болтов из нержавеющей стали, что риск возникновения сильной коррозии очень низок.
Сильная коррозия может иметь место в морской среде. Однако есть методы, которые можно использовать для уменьшения этого эффекта. Хороший способ уменьшить коррозию – использовать изолирующее покрытие или краску на алюминии и стали, чтобы изолировать их электрически. Изолирующие шайбы также эффективны для изоляции двух разнородных материалов и создания относительно безопасной площади поверхности.
Как отличить алюминий от нержавеющей стали
Не знаете, с какими материалами вы имеете дело? Обычно можно увидеть разницу между алюминием и нержавеющей сталью, поскольку первый имеет более тусклый вид.Алюминий также намного легче и мягче стали. Однако это не всегда так очевидно; это зависит от рассматриваемых сплавов. Различные производственные процессы могут создавать различный внешний вид и отделку.
Один из способов убедиться в этом – использовать ключевой тест. Возьмите ключ и перетащите его по плоской поверхности. Если поверхность алюминиевая, без чрезмерного давления она поцарапает довольно глубоко, так как алюминий намного мягче стали. Сталь не будет царапаться совсем или царапаться только на поверхности.
Что ставить между сталью и алюминием
При использовании крепежа из нержавеющей стали с алюминиевыми поверхностями можно предотвратить коррозию, поместив что-нибудь между двумя металлами.Подойдут пластиковые или резиновые шайбы или прокладки.
Наряду с коррозией может произойти обесцвечивание нержавеющей стали в сочетании с алюминием. Это также называется «окрашиванием чая». Обесцвечивание можно предотвратить, если использовать изоляцию и регулярно проводить техническое обслуживание. Пассивация также может использоваться для создания пассивной пленки на крепежном элементе, обеспечивающей лучшую коррозионную стойкость.
Как прикрепить алюминий к стали
Хотя использование крепежа из нержавеющей стали на больших алюминиевых поверхностях относительно безопасно, обратное неверно.Если вы используете алюминиевые заклепки или другие крепежные детали для соединения больших стальных деталей, возникнет коррозия и разрушит крепеж, что в конечном итоге приведет к расшатыванию деталей.
Когда соединяемые детали являются конструктивными, используйте самые прочные крепежи, какие только сможете найти. Например, при соединении алюминия и стали выбирайте болты из углеродистой стали.
При соприкосновении алюминия и стали вы также можете использовать тонкий слой невпитывающего изоляционного материала между ними. В зависимости от области применения можно использовать резину или пластик.Также можно использовать полипропиленовую ленту или загрунтовать детали защитным покрытием. Даже после того, как такая обработка была проведена, вы должны использовать какой-либо антикоррозийный материал – например, пасты, шайбы и т. Д. – под головками болтов и винтов в качестве дополнительной превентивной меры.
Как ведущий специалист по крепежу из нержавеющей стали; и установила партнерские отношения с производителями и поставщиками всего спектра нержавеющей стали и алюминия во всех отраслях промышленности; Marsh Fasteners может помочь вам использовать лучшие продукты с высочайшими антикоррозийными качествами.
FAQ 1: Гальваническая коррозия / коррозия разнородных металлов
Контакт между разнородными металлами происходит часто, но часто не является проблемой. Алюминиевая головка на чугунном блоке, припой на медной трубе, цинкование на стальной прогоне и стальной крепеж в алюминиевом листе являются типичными примерами.
Скачать FAQ по ASSDA 1 (PDF)
ЧТО ВЫЗЫВАЕТ ГАЛЬВАНИЧЕСКУЮ КОРРОЗИЮ?
Для возникновения гальванической, разнородной или электролитической коррозии необходимо выполнение трех условий:
- Металлическое соединение должно быть смочено проводящей жидкостью
- Должен быть контакт металла с металлом
- Металлы должны иметь достаточно разные потенциалы
Смачивание стыка
Проводящей жидкостью (или электролитом) может быть дождевая вода или вода, абсорбированная поверхностными отложениями, если относительная влажность (RH) достаточно высока, или даже простая конденсация.Если отложения представляют собой морскую соль, они начнут растворяться, если относительная влажность превысит 34% из-за хлорида магния. Чем выше проводимость, тем сильнее гальванические эффекты. Соляные или промышленные загрязнения значительно увеличивают проводимость воды, поэтому гальванические эффекты обычно более сильны у побережья или в тяжелых промышленных зонах. Чистая дождевая вода с низкой проводимостью вызывает лишь незначительные гальванические эффекты. Одна из проблем заключается в том, что во время испарения водяные пленки становятся более проводящими, поэтому изначально чистая вода может вызывать довольно активные гальванические эффекты, поскольку жидкость в щели под болтом или зажимом становится более концентрированной.Вода может быть исключена за счет конструкции или использования адгезивных герметиков или окраски благородного металла на 30–50 мм за стыком, чтобы предотвратить перенос заряженных атомов (ионов) в любой тонкой водной пленке. Покраска активного металла (углеродистой стали, алюминия или цинка) может вызвать глубокие отверстия на дефектах покрытия.
Контакт металл-металл
Гальваническая коррозия может возникнуть только в том случае, если разнородные металлы находятся в электрическом контакте. Контакт может быть прямым или посредством внешней трубы, провода или болта.Если разнородные металлы изолированы друг от друга подходящими пластиковыми полосами, шайбами или втулками, то гальваническая коррозия не может возникнуть. Краска не является надежным электрическим изолятором, особенно под головками болтов, гайками, шайбами или вблизи краев металлических листов. Краска обычно повреждается при укладке или последующем перемещении. Обратите внимание, что слой пленки оксида хрома на нержавеющей стали очень тонкий и не является электрическим изолятором. Поэтому пленка оксида хрома не предотвращает гальваническую коррозию.
Различия потенциалов
Все металлы в некоторой степени растворяются при смачивании токопроводящей жидкостью. Степень растворения наиболее высока для активных или жертвенных металлов, таких как магний и цинк, и они имеют наиболее отрицательный потенциал. Напротив, благородные или пассивные металлы, такие как золото или графит, относительно инертны и имеют более положительный потенциал. Посередине находится нержавеющая сталь, хотя она более благородна, чем углеродистая сталь. Потенциал можно измерить с помощью электрода сравнения и использовать для построения гальванической серии, как показано ниже (стандарт ASTM G82).
Когда два металла соединяются и контактируют с проводящей жидкостью, более активный металл вызывает коррозию и защищает благородный металл. Цинк более негативен, чем сталь, поэтому цинковое покрытие оцинкованной стали подвержено коррозии, чтобы защитить сталь от царапин или порезов. Нержавеющие стали, в том числе 304 и 316, обладают более высокими характеристиками, чем цинк и сталь, поэтому, когда нержавеющая сталь контактирует с оцинкованной сталью и является влажной, сначала коррозирует цинк, затем сталь, а нержавеющая сталь будет защищена эта гальваническая активность и не вызывает коррозии.Скорость гальванической атаки определяется величиной разности потенциалов.
График показывает, что нержавеющая сталь имеет два диапазона потенциала. Обычное пассивное поведение показано светлой штриховкой. Однако, если пассивная пленка разрушается, нержавеющая сталь подвергается коррозии, и ее потенциал находится в диапазоне темных полос.
Как показывает опыт, если разность потенциалов меньше 0,1 В, гальваническая коррозия маловероятна.
Если все три условия соблюдены, то вероятна гальваническая коррозия, и на скорость коррозии будут влиять относительная площадь и плотность тока, передаваемого благородным металлом.
ОТНОСИТЕЛЬНАЯ ПОВЕРХНОСТЬ, СМАЧИВАЕМАЯ СМАЗКОЙ
Если благородный металл, такой как нержавеющая сталь, имеет большую площадь поверхности, контактирующую с электролитом, а жертвенный металл (например, алюминий) имеет очень маленькую площадь поверхности, контактирующую с электролитом, то нержавеющая сталь будет генерировать большой ток коррозии, который будет сосредоточено на небольшой площади жертвенного металла. Алюминий быстро подвергается коррозии, поэтому алюминиевые крепежи из нержавеющей стали неприемлемы.Однако часто используется нержавеющий винт из алюминия, хотя коррозия алюминия непосредственно вокруг нержавеющей стали вполне возможна. Это связано с тем, что соотношение смоченной благородной застежки A в активном металле может измениться с 1:50 до 1: 1 во время высыхания после ливня. Если загрязняющие вещества значительны, это означает, что избегание пар разнородных металлов может быть предпочтительным вариантом для предотвращения гальванической атаки.
Оцинкованные крепежные детали из нержавеющей стали также теряют цинк быстрее, чем при самостоятельном открытии.Дополнительным недостатком является то, что продукт коррозии изменит цвет с белого на оранжевый, когда коррозия достигнет сплава цинк-железо около нижней части гальванизированного слоя. После этого начинается коррозия крепежа из углеродистой стали – снова более быстрыми темпами, чем при автономном воздействии.
Как показывает практика, если смачиваемая площадь корродирующего металла в 10 раз больше смачиваемой площади благородного металла, то гальванические эффекты не являются серьезными, хотя чем больше это соотношение, тем меньше эффект.
ДОСТУПНАЯ ПЛОТНОСТЬ ТОКА Нержавеющая сталь
имеет эффективную пассивную пленку, поэтому доступный ток коррозии, переносимый заряженными атомами (ионами), довольно низок.Если сравнивать поведение пары медь / сталь и пары нержавеющая сталь / сталь, муфта медь / сталь представляет собой более серьезную гальваническую проблему, несмотря на аналогичное разделение потенциалов в 0,35 В.
Примеры приемлемых гальванических пар:
- Потенциал медного сплава более активен, чем у нержавеющей стали, и он обеспечивает ток катодной защиты для ограничения точечной коррозии вала из нержавеющей стали или трещин на втулке подшипника. Глубина потери медного сплава невелика, поскольку он имеет очень большую площадь по сравнению с обнаженным валом.
- Подвески для труб из оцинкованной стали используются для внешней подвески труб из нержавеющей стали вокруг химических заводов. Отношение площади поверхности плохое при большой площади нержавеющей стали и небольшой площади активного цинка / стали, но дождевая вода обычно имеет довольно низкую проводимость, и 20-летний срок службы является нормальным.
- В водной промышленности заедание между резьбой и гайками из нержавеющей стали удалось избежать за счет использования гайки из алюминиевой бронзы на шпильках или болтах из нержавеющей стали. Хотя алюминиевая бронза более активна, чем нержавеющая сталь, проводимость воды и, следовательно, скорость коррозии, как правило, довольно низкая.Гайки потребуют замены, но только во время капитального ремонта.
- Разность потенциалов между пассивным элементом 304 и пассивным элементом 316 мала, поэтому гальванической коррозии 304 не ожидается даже при больших соотношениях площадей.
Неприемлемые пары материалов включают резиновое уплотнение с настолько высоким содержанием технического углерода (для устойчивости к ультрафиолетовому излучению), что оно является проводящим и вызывает гальваническое воздействие на винт или штифт из нержавеющей стали. Прокладки, содержащие графит, вызывают аналогичные проблемы для фланцев из нержавеющей стали и не должны использоваться для морской воды независимо от сплава нержавеющей стали.Неизолированные крепления из нержавеющей стали не допускаются для настенного или кровельного покрытия Colorbond®, так как гальванический ток от корродирующего Zincalume® вызывает вздутие краски.
GALVANIC СЕРИИ
ВАЖНЫЙ ОТКАЗ ОТ ОТВЕТСТВЕННОСТИ: Технические рекомендации, содержащиеся в этой публикации, обязательно носят общий характер, и на них нельзя полагаться для конкретных приложений без предварительного получения компетентного совета. Несмотря на то, что ASSDA предприняла все разумные шаги для обеспечения точности и актуальности информации, содержащейся в данном документе, ASSDA не гарантирует точность или полноту информации и не несет ответственности за ошибки или упущения.
Гальваническая коррозия – PennEngineering
Потенциал гальванической коррозии – это мера того, как разнородные металлы будут корродировать при размещении друг напротив друга в сборке. Металлы, расположенные рядом друг с другом на графике, обычно не оказывают сильного влияния друг на друга, но чем дальше друг от друга разделены любые два металла, тем сильнее коррозионное воздействие на один из них, находящийся выше в списке. Этот список представляет потенциальную возможность вызвать коррозионную реакцию, однако фактическую коррозию в каждом случае трудно предсказать.Обычно присутствие электролита (например, воды) необходимо для ускорения гальванической коррозии. См. Таблицу ниже.
| Электрический ток течет от плюс до минус | Анодное (наименее благородное) Корродированное Направление атаки Катодное (наиболее благородное) Защищенное | Магний Магниевые сплавы Цинк Бериллий Алюминий 1100, 3003, 3004, 5052, 6053 Кадмий Алюминий 2017, 2024, 2117 Мягкая сталь 1018, Кованое железо Сталь HSLA, Чугун Хромовое железо (активное) 430 Нержавеющая сталь (активный) 302, 303, 321, 347, 410, 416 Нержавеющая сталь (активный) Ni-Resist 316, 317 Нержавеющий (активный) Carpenter 20Cb-3 Нержавеющий (активный) Алюминиевая бронза (CA687) Hastelloy C (активный) Инконель 625 (активный) Титан (активный) Свинец / оловянный припой Свинец Олово Инконель 600 (активный) Никель (активный) 60% Ni 15% Cr (активный) 80% Ni 20% Cr ( активный) Хастеллой B (активный) Морская латунь (CA464), Желтая латунь (CA268) Красная латунь (CA230), Адмиралтейская латунь (CA443) Медь (CA102) Марганцевая бронза (CA675), оловянная бронза (CA903, 905) ) 410, 416 Нержавеющая (пассивная) фосфористая бронза (CA521, 524) Кремниевая бронза (CA651, 655) Нейзильбер (CA 732, 735, 745, 75 2, 754, 757, 765, 770, 794 Купро-никель 90-10 Купро-никель 80-20 430 Нержавеющая сталь (пассивная) Купро-никель 70-30 Никель-алюминиевая бронза (CA630, 632) Монель 400, K500 Серебряный припой Никель (пассивный) 60% Ni 15% Cr (пассивный) Iconel 600 (пассивный) 80% Ni 20% Cr (пассивный) Хром Железо (пассивный) 302, 303, 304, 321, 347 Нержавеющая сталь (пассивный) 316, 317 Нержавеющий (пассивный) Carpenter 20Cb-3 Нержавеющий (пассивный), Incoloy 825 (пассивный) Серебро Титан (пассивный), Hastelloy C и C276 (пассивный) Графит Цирконий Золото Платина |
Вводное руководство по разнородным металлам
Вы когда-нибудь задумывались, почему стальная вата ржавеет, когда ее оставляют на мойке из нержавеющей стали? Вы когда-нибудь замечали, как алюминиевая фольга, покрывающая лазанью, разъедается, если ее обернуть вокруг стальной сковороды?
Оба являются примерами того, что может произойти, если соединить разнородные металлы вместе.Но когда вы выходите на рабочую площадку, работа с разнородными металлами превращается в совершенно нового монстра с ужасными потенциальными последствиями.
Понимание разнородных металлов может помочь вам защититься от опасных комбинаций, которые приводят к коррозии, разрушению проектов и потенциальным катастрофам на объекте.
Мы здесь, чтобы предоставить ноу-хау, чтобы этого не произошло. Прочтите простое руководство по разнородным металлам.
Что такое разнородные металлы?Чтобы понять разнородные металлы, вам нужно углубиться – на субатомный уровень.
Разные металлы обладают разными свойствами, и важным отличием является их благородство. Благородство – это устойчивость металла к коррозии. Благородные металлы более скупы со своими электронами, тогда как неблагородные металлы легче отдают свои электроны.
То, насколько легко металл отдает свои электроны, определяет его место на гальванической шкале. Таким образом, в той же среде такой металл, как алюминий, будет отдавать свои электроны легче, чем такой металл, как нержавеющая сталь. Эта способность удерживать электроны делает нержавеющую сталь более устойчивой к коррозии.
Однако, чтобы понять благородство и разнородные металлы, лучше всего иметь представление о процессе коррозии.
Безупречный контакт с коррозиейГальваническая коррозия является наиболее важным видом коррозии для понимания разнородных металлов. Гальваническая коррозия возникает, когда разнородные металлы трутся друг о друга во влажной или грязной среде.
Вот как это работает:
Допустим, вы работаете с нержавеющей сталью и алюминием.Нержавеющая сталь благороднее алюминия. Помимо того, что нержавеющая сталь лучше удерживает свои электроны, она естественным образом забирает электроны из алюминия всякий раз, когда это возможно. Электролит облегчает кражу электронов нержавеющей стали. Когда трио объединяется, получается ржавый кусок алюминия.
Какие металлы встречаются? Какие металлы не используются?Во избежание гальванической коррозии следует избегать металлических поверхностей на противоположных концах гальванической шкалы. Если в благородстве двух металлов есть большой разрыв, они, вероятно, не уживутся друг с другом.
Вот общий список некоторых распространенных металлов, от более благородных (вверху) к более простым (внизу):
- Золото
- Серебро
- Титан
- Нержавеющая сталь
- Медь
- Латунь
- Олово
- Свинец
- Углеродистая сталь
- Алюминий
- Цинк
Поскольку нержавеющая сталь и алюминий имеют большой разрыв в благородстве, они не похожи. Это означает, что их объединение в пары с большей вероятностью приведет к гальванической коррозии.
С другой стороны, такие металлы, как медь и нержавеющая сталь, похожи. Вот почему стальные трубы и медные трубы хорошо сочетаются друг с другом.
То же самое касается меди, свинца или олова. Они достаточно похожи, поэтому их обычно не нужно изолировать друг от друга.
Среды, влияющие на разнородные металлыКоррозия между разнородными металлами может усиливаться окружающей средой. Например, обычный электролит, вода, может запустить процесс коррозии между двумя металлами.
Вот почему гальваническая коррозия особенно остро проявляется во влажной или влажной среде. Бактерии и прочая грязь также могут выступать в роли разжигателя между металлами.
Минимизация отрицательного воздействия пар разнородных металловОднако иногда имеет смысл работать с разнородными металлами. Это часто бывает с разнородными металлами, такими как нержавеющая сталь и углеродистая сталь. Углеродистая сталь прочная, но коррозионная. Таким образом, имеет смысл добавить гладкую нержавеющую сталь к внешней отделке.
К счастью, есть способы остановить гальваническую коррозию.
Один из способов – добавить буфер или изолятор между металлами. В трубопроводе это может быть коньки для труб. На гайках или балках это можно сделать с помощью шайб.
Цинкование также может защитить от гальванической коррозии. В этом процессе на наружную поверхность основного металла наносится слой цинка. Поскольку цинк является более основным, чем большинство металлов, он в первую очередь отдает свои электроны, сохраняя основной металл под ним.
Избавьтесь от коррозии при следующей работеПонимание разнородных металлов и других причин коррозии может помочь вам защититься от бедствий. Есть вопросы по материалам для вашей следующей работы? Отправьте нам сообщение с подробностями, и мы поможем вам в правильном направлении.
Гальваническая коррозия
Несколько человек затронули тему разнородных металлов или гальванической коррозии. Предмет может быть чрезвычайно сложным, но есть несколько хороших общих черт, которые можно использовать в качестве руководства при выборе совместимых металлов.Во-первых – вам понадобится диаграмма или таблица гальванического ряда. Вам действительно нужен тот, в котором перечислены сплавы, которые вы собираетесь использовать. Просто сказать, что алюминий или нержавеющая сталь недостаточно, если вы действительно хотите добиться хороших результатов. Разные сплавы ведут себя по-разному. Поймите, как работают таблицы (см. Ниже). Две лучшие таблицы, которые я нашел, перечислены ниже.
Вторая – выбирайте совместимые металлы в зависимости от того, насколько они близки к гальванической серии. Чем ближе гальванические потенциалы, тем меньше коррозии.В-третьих, степень коррозии пропорциональна отношению площади катода к площади анода. Это приводит к ряду методов минимизации коррозии. Сделайте анодную металлическую деталь намного больше, чем катодную. Коррозия будет распространяться по большему куску металла, и, таким образом, потеря некоторых атомов с поверхности, скорее всего, не приведет к значительному ослаблению. Если вам нужно использовать другой металл в качестве застежки, используйте на один катод больше, чем металл, в котором он будет использоваться. В-четвертых, помните, что иногда вышеуказанные правила должны быть немного отклонены по другим причинам, и что коррозия может быть намного сложнее, чем просто гальваническая коррозия.Взгляните, например, на нержавеющую сталь. Большинство из них сами по себе могут быть как катодными, так и анодными! Коррозия при погружении в морскую воду может сильно отличаться от коррозии от воздействия загрязняющих веществ в атмосфере.
Итак, прежде чем представить таблицу, давайте рассмотрим исходный вопрос – нержавеющие крепежи на алюминии. Для начала нам нужно знать, о каком сплаве алюминия и нержавеющей стали идет речь. Не имея другой информации, все, что мы можем сделать, это отметить, что алюминий обычно более анодный, чем любая из нержавеющих сталей.Это хорошо с точки зрения наличия небольшой застежки. Но учтите, что цинковое или кадмиевое покрытие, вероятно, лучше, поскольку они ближе к алюминию в гальванической серии. Я бы, вероятно, выбрал горячеоцинкованный винт вместо винта с кадмиевым покрытием из-за более толстого покрытия, но я бы выбрал винт с кадмиевым покрытием вместо простого оцинкованного (который, вероятно, будет довольно тонким). Но я бы точно не стал выбирать латунь, медь или бронзу.
Это поднимает вопрос, почему я привел две таблицы.Более короткий дает лучшее представление о том, как далеко друг от друга находятся металлы в серии. В более длинном списке приводится много сплавов, но если вы посмотрите
с их электродвижущими потенциалами (не показаны), вы обнаружите, что многие серии сплавов мало отличаются по их фактическому размещению в серии. Таким образом, с алюминием вы можете заметить небольшую разницу между коррозией нержавеющей стали 304 или 17-7PH.
Коррозия может быть почти точной наукой, если все, с чем вы работаете, исключительно чисто.Но в реальном мире это не так, и опытный металлург – отличный друг. Я впервые узнал об этом на уроках коррозии, но после того, как я узнал это на собственном опыте, я действительно понял, что это не так.
[И один или два раза я видел, как мой друг-металлург тоже в замешательстве почесал затылок!]
Когда ваш выбор материалов ограничен, иногда приходится соглашаться с тем, что некоторая коррозия неизбежна, и проектировать соответственно.


